¶ CERO 3D细胞培养系统操作说明
¶ CERO操作手册
¶ 一、接通CERO
1.打开仪器侧面的电源开关。
2.几分钟后出现主菜单屏幕。
二、设置温度
1.在“主菜单”中,进入“温度控制”界面。
2.按下温度圆键。
3.温度按钮的背景改变颜色,并显示调整范围。
4.旋转点击轮以设置所需的目标温度。
5.按下点击轮或按下温度按钮进入新的设置。
6.按下开始按钮开始温度调节。
三、设置CO2
1.从主菜单中进入CO2控制窗口。
2.按CO2圆形按钮。
3.CO2按钮的背景改变颜色,并显示调整范围。
4.旋转点击轮以设置所需的CO2目标水平。
5.按下点击轮或按CO2按钮进入新的设置。
6.按下开始按钮开始CO2调节。
四、设置好温度和CO2浓度后,进行样品准备,具体如下表所示:
将准备好的样品放入CERO中:
1.按下CERO前面的开盖按钮来打开滑动顶盖。
2.将CEROtube放入到所需的位置上。
3.再次按下开盖按钮,关闭滑动顶盖。
五、运行已有模板的实验
1.在主菜单中选择CEROtube的位置,CERO中对应位置的CEROtube将会运行该实验。如果需要在同一实验中运行多个CEROtube,可以通过“选择多个”按钮选择所需的管数。
2.运行菜单将出现。
3.按开始键。
4.在列表中选择需要运行的实验,按“Ok”。
5.在开始窗口中,您可以在字段“remark”中输入注释,该字段将出现在Output文件的名称中。
6.必要时禁用不需要的程序和步骤,取消选择它们并按下Start。
六、实验运行数据追踪
1.打开想要查看的CEROtube运行菜单。
2.运行菜单总结了运行实验的关键信息,包括:
(1)试管位置
(2)程序名称
(3)培养实验状态
(4)经过的时间
(5)可选的pH测量
3.培养参数(例如T, CO2)可以在屏幕左侧的图形面板上查看。
4.单击图形面板放大它。
¶ CERO 3D细胞培养系统操作

|
强调 - 减少成本、时间和差异 |
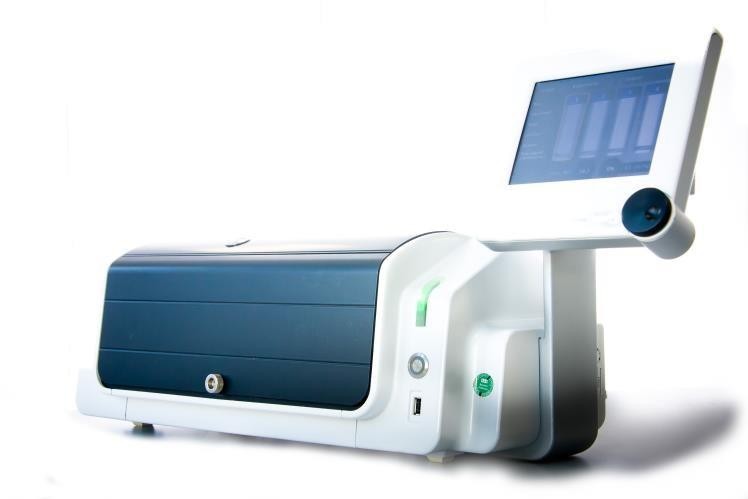
CERO 3D 系统概述 CERO 3D系统克服了静态培养的已知局限性。其优势包括: |
 |
 |
¶ 一、多能干细胞扩增 – iPSC & ESC
- 自由悬浮,单分散的3D细胞聚团
- 无自分化
- 保持多能性
- 灵活的接种密度
- 最高的细胞产量
- 无需基质胶
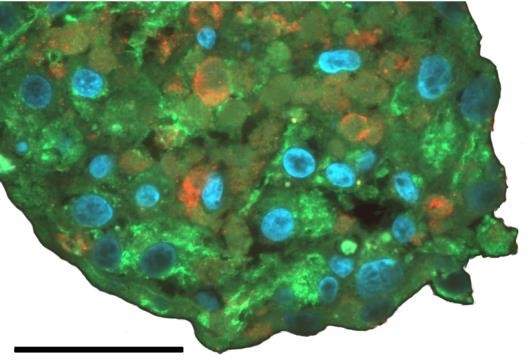
高产量的均质多能干细胞,用于生物库,基于细胞的药物开发,毒性测试,再生医学等许多应用。均质的iPSC和ESC聚集物可以很容易地用于2D下游应用或分化为类器官。
¶ I. 转移到CERO之前的2D多能干细胞(iPSC)的培养
- 在iPSC培养基中培养(添加所需营养物质)。
- 每四天传代1次;比例1:6。
注意:
- 确保iPSC质量良好。
- 确保细胞的均质性(无分化亚群)和增殖率。
- 确保培养液已定期更换(颜色不变)。
¶ II. 接种 – 3D聚集体的形成
- 消化分离iPSC。
- 计数。
- 将细胞接种到10ml培养液的CEROtube中(培养液中含有10 µM Y-27632(Rho-激酶抑制剂))。
推荐的接种浓度及CERO设置如下:
| 种属(细胞浓度/ml) | Tube 1 | Tube 2 | Tube 3 | Tube 4 |
|---|---|---|---|---|
| 非人源 | 15,000 | 30,000 | 45,000 | 60,000 |
| 人源 | 30,000 | 45,000 | 60,000 | 80,000 |
| 旋转设置 | 搅拌(混匀)设置 | 总程序 | |||
| speed (rpm) | time(sec) | pause (sec) | period(min) | pause(min) | duration(h) |
| 80 | 5 | 2 | 0 | 0 | 6 |
4. 在接种结束后(>12h),根据细胞聚集物的均匀性和大小选择初始细胞浓度。
注意: 收集后,细胞可以冷冻储存或用于化验。为了 进一步扩增,请继续执行第II步的第3步.
¶ III. iPSC聚集体的培养
| 旋转设置 | 搅拌(混匀)设置 | 总程序 | |||
| speed (rpm) | time(sec) | pause (sec) | period(min) | pause(min) | duration(h) |
| 80 | 1 | 2 | 0 | 0 | ∞ |
- 每24小时加入5ml iPSC培养液(调节作用)。
- 3至7天后继续进行收集步骤或进行类器官分化和培养流程。
¶ IV. 聚集体收集
- 停止旋转5-10分钟,让聚集体沉降下来。
- 小心去除上清。
- 用15ml不含Ca2+、Mg2+的PBS清洗1次。
- 小心去除清洗用的PBS。
- 加入约10ml的细胞消化液,并在下述条件下孵育15分钟。
| 旋转设置 | 搅拌(混匀)设置 | 总程序 | |||
| speed (rpm) | time(sec) | pause (sec) | period(min) | pause(min) | duration(h) |
| 80 | 1 | 2 | 0 | 0 | 15 |
6.将iPSC细胞悬液转移到Falcon管中,离心使细胞沉降(500g, 3分钟)。
7.小心去除上清。
8.小心分散,重新悬浮在含有10 µM Y-27632 (Rho激酶抑制剂)的iPSC培养基中。
9.用40µm细胞过滤器过滤细胞悬液。
¶ 故障处理
- 为了防止在接种时发生自体黏附,请:
- 检查细胞的数量和质量
- 确保使用正确数量的活细胞,特别是从冻存细胞开始
- 解离方法直接影响聚集体的性能。尽可能选择温和的解离方法:
- 酶解EDTA(温和酶解)
- 细胞消化液(温和酶解)
- 非酶解,比如温和的细胞解离试剂(StemCell Technologies,#07174)
- 可以增加起始细胞数量到100/120/140/160k,首选良好细胞数量来增加细胞产量
- 加入0.04%的聚乙烯醇
- 选择新鲜批次的细胞
¶ 用于下游分化的较大iPSC聚集体优化设置
- 在接种过程中,接种细胞浓度越高,起始聚集体越大(200-500k细胞/ml)
- 例如:
- 接种密度为300,000/ml
| 培养天数 | 聚集体的估计大小 |
|---|---|
| 1 | 100µm |
| 3 | 250µm |
| 5 | 500µm |
¶ 二、类器官的分化和培养
- 类器官类型:大脑、心脏、肝脏、上皮细胞等
- 特点:
- 自由悬浮的类器官和更高的剪切力
- 改善分化和效率
- 高收率 – 低成本
- 无剪切力
- 最好的均质性
CERO系统为实验室规模的类器官生产提供了一种独特的方法,适用于从诱导多能干细胞(iPSC)和胚胎干细胞(ESC)生成类器官。CERO提供高效、标准化的类器官生产方法,能生产大量高质量的同质类器官,并允许长期分化和存活(1年以上)。
¶ I. 类器官 – 诱导
注意:建议使用在CERO中生成的多能干细胞(iPSC)聚集体进行类器官诱导(详见多能干细胞扩增iPSC & ESC部分)。CERO也可以用于其他来源的类器官培养。
- 停止旋转5-10分钟,使iPSC聚集体沉降。
- 小心去除上清液。
- 使用15 ml无Ca2+和Mg2+的PBS清洗一次。
- 去除清洗用的PBS。
- 加入15 ml诱导培养基进行孵育。
CERO系统的iPSC诱导和培养参数如下:
| 旋转设置 | 搅拌(混匀)设置 | 总程序 | |||
| speed (rpm) | time(sec) | pause (sec) | period(min) | pause(min) | duration(h) |
| 80 | 1 | 2 | 0 | 0 | ∞ |
6. 每周更换培养液2次,或根据需要更换。相比2D培养,CERO系统中的培养频率更高。建议每周更换一次CEROtube,持续诱导7-12天。
注意:当聚集体直径超过300微米时,请按1:30的比例在培养基中加入CEROsolution1。
¶ II. 培养
1.停止旋转5-10分钟,使类器官沉降。
2.小心去除上清液。
3.使用15 ml无Ca2+和Mg2+的PBS清洗1次。
4.去除清洗用的PBS。
5.根据下表加入分化培养基:
| 聚集体大小 (微米) | 每轮替换的培养基量 (ml) | 每周添加的培养基量 (ml) |
|---|
| <5-200 | 7-10 | 12-15 |
| 200-500 | 10 | 20-30 |
| >500 | 10 | 20-30 |
6.按照下表调整培养基更换频率,或根据初始pH值变化的颜色作为指示:
| 更换条件 | 每周更换频率 |
|---|
| 100% | 1次 |
| 80% | 2次 |
| 50% | 3次 |
| 30% | 3-4x |
7.停止旋转5-10分钟,让类器官沉降。
8.小心去除上清液,并按上表继续添加新的培养液。
注意:
▪ 类器官培养很容易延续至一年或更长时间。
▪ 为了自动检测pH值,每个CEROtube至少需要30ml的培养基。
▪ 根据类器官的大小,增加培养基的粘度可以支持长期培养。最少的期限应该在7到12天之间。
▪ 建议一周更换一次CEROtube。
¶ 三、从2D到CERO的类器官和肿瘤的转移和培养
- 优化实验操作
- 短周期、高收率
- 更均质和更高的基因表达水平
- 无其他长空间限制
- 易于标准化操作
CERO可以显著改善类器官或类肿瘤的培养方式。描述了一种快速、可靠和有效的方法将类器官从基质/静态培养转移到CERO中培养的操作流程。
¶ I. 类器官/类肿瘤传代
注意: 为了使在基质胶中的类器官和类肿瘤传代,需要去除残留的基质胶。我们推荐使用IBD Biosciences及其专属的机械化解胶液。
- 选择合适的试剂盒去除基质胶。
- 用15ml Falcon试管中收集24孔板上的类器官。
- 离心(300g,6分钟)。
- 小心去除上清。
- 类器官重悬在约5ml TrypLE Express(Gibco)或类似解离培养液中。体积可根据类器官数量增加至10ml。
- 移液枪轻轻混合(最多50次)。
- 37°C孵育5分钟。
- 离心(300g,6分钟)。
- 小心去除上清。
- 将类器官重悬在约1ml培养基中。体积可根据需要进行调整。
注意: 我们不建议CERO培养使用基质胶。 如果需要,也可以尝试2%的基质胶。但在这种情况下,我们建议改用溶解基质胶的酶进行处理。
¶ II. 类器官/类肿瘤扩增
- 将类器官细胞悬液均匀转移到4个管中,并加入12ml扩增培养液。
- 设置以下参数,持续扩增3-4天:
| 旋转设置 | 搅拌(混匀)设置 | 总程序 | |||
| speed (rpm) | time(sec) | pause (sec) | period(min) | pause(min) | duration(h) |
| 80 | 1 | 2 | 0 | 0 | ∞ |
3. 扩增后,从CERO管中收集类器官,并分配到适当量的15ml Falcon管中。
4. 离心(300g,6分钟)。
5. 小心去除上清。
6. 类器官重悬在约5ml TrypLE Express(Gibco)或类似培养液中。体积可根据类器官数量增加至10ml。
7. 移液枪轻轻混合(最多50次)。
8. 37°C孵育5分钟。
9. 离心(300g,6分钟)。
10. 小心去除上清。
11. 将类器官重悬在培养基中,比例为1:3(即12ml培养液扩增每管),如有需要再用36ml的扩增培养基扩增。
12. 继续扩增,用于下游应用或储存起来以便将来使用。
¶ 四、MSC, 祖细胞 & 成体干细胞及细胞系的扩增
- 自由悬浮、单分散的3D细胞聚团
- 高细胞产量
- 灵活的接种密度
- 无需基质胶
MSC、祖细胞及成体干细胞和细胞系提供了高的细胞产量,使许多下游应用成为可能,包括从生成的3D聚集物中分化成成体、用于疾病建模和药物发现。
¶ I. 接种 – 形成3D聚集体
- 细胞消化
- 测定细胞数量、活力和质量
- 离心(300g,6分钟)
- 小心去除上清
- 将细胞接种到10ml培养液的CEROtube中(培养液中含有10 µM Y-27632(Rho激酶抑制剂))
推荐的接种浓度及CERO设置如下:
| 浓度类型 | Tube 1 | Tube 2 | Tube 3 | Tube 4 |
|---|---|---|---|---|
| 高 | 30,000 | 40,000 | 70,000 | 90,000 |
| 低 | 60,000 | 80,000 | 100,000 | 120,000 |
| 旋转设置 | 搅拌(混匀)设置 | 总程序 | |||
| speed (rpm) | time(sec) | pause (sec) | period(min) | pause(min) | duration(h) |
| 80 | 1 | 0 | 0 | 0 | 6 |
注意: 选用高、低增殖细胞配适包括祖细胞和细胞(如神经细胞),而同类基质细胞(MSC)在低增殖时使用。
6. 在接种结束(>6小时),根据细胞聚集体的均匀性和大小选择初始细胞浓度。
¶ II. 3D聚集体培养
| 旋转设置 | 搅拌(混匀)设置 | 总程序 | |||
| speed (rpm) | time(sec) | pause (sec) | period(min) | pause(min) | duration(h) |
| 80 | 1 | 2 | 0 | 0 | ∞ |
1.每24小时加入分化培养基5ml(培养液替换)。
- 注意:如果细胞培养液变浑浊、pH值变化较快,更换的培养体积应增加至目标管体积的50%。
2.继续培养,直到达到预期的细胞产量(最多3到5天后)。
3.根据细胞类型,继续使用下列可选项之一:
- 收集细胞群
- 按照CERO表实验流程进行分化、成就或维持增殖
¶ III. 聚集体分离 – 收集
- 停止旋转5-10分钟,让聚集体沉降下来。
- 小心去除上清。
- 用15ml不含Ca2+、Mg2+的PBS清洗1次。
- 小心去除清洗用的PBS。
- 加入约10ml的细胞消化液,并在以下条件下孵育15分钟:
| 旋转设置 | 搅拌(混匀)设置 | 总程序 | |||
| speed (rpm) | time(sec) | pause (sec) | period(min) | pause(min) | duration(min) |
| 80 | 1 | 0 | 0 | 0 | 15 |
6.将后面的细胞悬液转移到Falcon管中,离心(500g, 3分钟)。
7.小心去除上清。
8.小心地将聚集体重新悬浮至含有10 µM Y-27632(Rho激酶抑制剂)的培养基中。
¶ 故障处理
▪ 为了防止在接种时发生自体黏附,请
▪ 检查细胞的数量和质量
▪ 确保使用正确数量的活细胞,特别是从冻存细胞开始
▪ 解离方法直接影响聚集体的性能.尽可能选择温和的解离方法:
▪ 胰酶/EDTA (激烈酶解)
▪ 细胞消化液(温和酶解)
▪ 非酶解,比如温和的细胞解离试剂(StemCell Technologies,#07174)
▪ 可以增加起始细胞数量到100/120/140/160k,富集良好细胞数量来增加细胞产量
▪ 加入0.04%的聚乙烯醇
▪ 选择新鲜批次的细胞
¶ 五、球状体培养和成熟
- 适用于大多数细胞系和预分化细胞
- 改善分化和极性
- 稳定的长期分化和存活(多周和数月)
- 每个球状体聚团的细胞数量均匀质化
- 高产量 – 低成本
- 无剪切力
CERO提供了在很长一段时间内进行实验的自由,即使2D球体已经坏死了很长一段时间。为实验提供了一种生产中等均匀球体的方法。
注意:建议仅使用微孔产生绝对均匀的球体。如果需要均匀的球体,请考虑细胞聚体。
¶ I. 球状体的产生和接种到CERO中
- 用膜酶/EDTA消化细胞。
- 经过细胞质量,暂时的培养基中再悬浮细胞,添加10µM Y-27632(Rho激酶抑制剂)。
- 根据每20,000或更大孔板中转移15,000个细胞/球体(不同于48孔每个培养孔/液),按球状培养细胞进行处理,然后在微孔中收集细胞。
- 连续5天,每24小时更换一次介质(不含Y-27632)。接种5天后,可以看到改变的球状细胞。
- 将最多2孔(约1500个)的球状体重悬在45mL培养液CEROtube中(CEROsolution1按1:30)。
| 旋转设置 | 搅拌(混匀)设置 | 总程序 | |||
| speed (rpm) | time(sec) | pause (sec) | period(min) | pause(min) | duration(min) |
| 80 | 1 | 0 | 2 | 0 | ∞ |
¶ II. 球状体培养
注意:如下所述,每2-3天更换一次培养液。也可以参考pH值颜色变化作为指示。所述过程可以有效地监测细胞生长质量,细胞形态和生长小球体从球状观察的结晶。
CEROsolution1 (1:30)的使用对于球体的尺寸,致密性和观察/变变化有积极的影响。
1.将球状体与CEROtube中的培养基一起转移到10cm的细胞培养皿中
2.使用真空泵通过70或100μm的细胞过滤器除去约30ml的培养基(根据聚合体的大小),并添加30毫升新鲜培养基
3.重复步骤2
4.添加新鲜培养基至45mL,转移至新的CEROtube
¶ III. 球状体成熟
注意:CERO可以维持很长时间(80天或更长)球状体的活力和功能。它是使特定亚种群成熟的完美工具。
- 停止旋转5-10分钟,使球状体自然沉降下来。
- 小心去除上清。
- 用15ml的PBS清洗液(不含Ca2+和Mg2+)。
- 小心去除PBS。
- 按下表添加分化培养基:
| 每管替换量(大小) | 每周培养添加 |
|---|
| <200 | 7-10ml |
| 201-500 | 20-30ml |
| 500以上 | 30-50ml |
注意:
▪ 体可以长期保持。在成熟过程中,每3天交换30%的培养基,或每7天交换50%的培养基(如III所述。1.-5)。
▪ 在成熟过程中,由于各种原因(如qPCR,IF或下游实验),可以从试管中取到球状体,并保持到后期阶段
¶ 六、组织块培养
- 适用于肝脏、大脑、胰腺和更多的组织
- 与2D/静态方法相比,延长了使用寿命
- 易于标准化操作
- 无基质胶Free floating组
- 组织块群育
- 无剪切力
CERO为组织的长期培养提供了一种简单、可重复和非常有效的方法。组织块保持健康更长时间,理想的下游应用。
¶ I. 准备
1.将组织切成块,尺寸不应超过直径约1.5至1.8mm。
2.选择合适的培养基。
3.如有可能,收集供体血清。另外,也可以使用人白蛋白输血液(或HII)。
4.设置温度37°C和CO₂ 5.0%。
5.其它参数设置:
| 旋转设置 | 搅拌(混匀)设置 | 总程序 | |||
| speed (rpm) | time(sec) | pause (sec) | period(min) | pause(min) | duration(min) |
| 80 | 5 | 2 | 0 | 0 | ∞ |
¶ II. 组织培养
- 用10% - 20%的供者血清或人白蛋白输血液补充培养基(Takeda)。
- 混合培养液与CEROsolution1(稀释比1:30)。
- 每30ml培养基培养约400个组织块。
- 每3天更换一次培养液。
- 停止旋转5-10分钟,使组织块沉降下来。
- 小心地吸除20ml上清,并加入20ml新鲜补充的含上CEROsolution1的培养基。
注意:
▪ 如果需要,CEROSolution1也可以以1:10的比例加入,以增加粘度
▪ 定期控制组织切片的质量
▪ 流式细胞仪
▪ PCR定量
▪ 切片免疫染色(包埋)
▪ 其它方法等