¶ iPSC及其衍生物在多种谱系中的可扩展扩增
郭志强1,伊莎贝尔·塞巴斯蒂安1,克里蒂卡·哈里哈兰,伊娜·迈瑟,珍妮特·维汉,萨斯基娅·阿尔特迈尔 c, 伊莎贝尔·卡纳茨 b, 多米尼克·鲍尔 b, 本杰明·费舍尔 b, 亚历山大·费勒 b, 阿尔弗雷多·卡布雷拉-索科罗 d, 米克尔·拉斯穆森 e, 比约恩·霍尔斯特 e, 朱莉娅·C·诺伊鲍尔 b,c, 克里斯蒂安·克劳森e, 凯瑟琳·维尔法耶 f, 安德烈亚斯·埃布内特 d, 马蒂亚斯·汉森 a, 瑞秋·斯蒂格 g, 海科·齐默尔曼b, c, h, i, *
a Cell Therapy R&D, Novo Nordisk A/S, Novo Nordisk Park 1, 2760 Måløv, Denmark
b Fraunhofer Project Center for Stem Cell Process Engineering, Fraunhofer Institute for Biomedical Engineering IBMT, Neunerplatz 2, 97082 Würzburg, Germany
c Fraunhofer Institute for Biomedical Engineering IBMT, Joseph-von-Fraunhofer-Weg 1, 66820 Sulzbach, Germ ea ny
d Neuroscience Therapeutic Area, Janssen Research & Development, Turnhoutseweg 30, 2340 Beerse, Belgium
e BioneerA/S,KogleAlle2,2970Horsholm,Denmark
f Department of Development and Regeneration, Stem Cell Institute, UZ Gasthuisberg, Herestraat 49, 3000 Leuven, Belgium g
g Fraunhofer UK Research Ltd, Technology and Innovation Centre, 99 George Street, G1 1RD Glasgow, Uni ti ed Kingdom
h Department of Molecular and Cellular Biotechnology, Saarland University, 66123 Saarbrücken, Germany
i Facultad de Ciencias del Mar, Universidad Católica del Norte, Coquimbo
¶ 文章信息
¶ 摘 要
Keywords:诱导多能干细胞 细胞库 EBiSC分化 扩大规模 生物加工 细胞处理 悬浮式生物反应器
诱导多能干细胞(iPSC)技术使得从已知遗传背景的体细胞中生产多能干细胞系成为可能。它们分化和生成多种细胞类型的能力使其被用于各种生物医学应用,包括毒性测试。许多这些iPSC细胞系现在已在数据库中注册,并存储在生物库中,如欧洲诱导多能干细胞库(EBiSC),这可以简化这些单个细胞系的质量控制和分发。为了生成用于储存和高通量毒性筛选等应用所需的细胞数量,需要开发可扩展且稳健的方法,以实现iPSC的大规模生产。由于在较小的占地面积上具有更高的细胞产量,以及通过增加培养体积来简化扩展,3D悬浮培养平台正越来越多地被干细胞研究人员使用。在此,我们描述了使用台式生物反应器和孵化器进行3D悬浮培养的成功可扩展iPSC生产策略,同时保持高质量iPSC系所期望的质量属性。此外,为了满足对“即用型”细胞类型日益增长的需求,我们报告了最近建立稳健、可扩展的分化协议以实现心脏、神经和肝脏命运的工作,从而使EBiSC能够增加可用的研究工具。
¶ 1. 介绍
人类诱导多能干细胞(iPSC)技术的发现和发展[1,2]对生物医学科学来说是革命性的。iPSC可以从各种遗传背景的体细胞中衍生出来,并分化为所有三个胚层的细胞。与胚胎干细胞相似,iPSC可以在实验室中轻松培养,因为它们具有自我更新和无限增殖能力,可以作为生物医学应用的起始材料,包括毒性研究、药物筛选、疾病建模以及再生医学[3]。自从这一发现以来,世界各地的研究小组已经生成了许多iPSC系,包括对照、疾病相关以及基因编辑的细胞系。然而,生成和验证iPSC系的高成本是开发新iPSC系的一个重大障碍。因此,迫切需要高质量、经过验证的iPSC细胞库,作为存储库以满足研究和临床社区的各种需求。确实,国家/地区和国际细胞库计划(例如,欧洲诱导多能干细胞银行(EBiSC)、国际干细胞银行倡议、hPSCreg、全球iPSC疗法联盟)[4–10] 已为这些目的建立。此外,大量分化细胞(例如心肌细胞、肝细胞)可能需要用于高通量毒性筛选测定[11–13]。而且,即使iPSCs来自相同或不同的供体,即使它们的多能性已被很好地表征并通过相同的方法重编程,它们的行为可能也不相同。细胞系对生长因子和抑制剂的敏感性在实践中常常被发现不同,这需要对每个用于任何已发表协议的新细胞系进行因子的滴定。这要求有稳健可靠的协议来扩大未分化iPSCs的培养,以及随后将其分化为更终末分化的细胞类型。
为实现这一目标,文献中报道了各种方法。常见的小规模培养iPSCs的方法是在涂有基质(如Matrigel™、Geltrex™、玻连蛋白、层粘连蛋白或合成基质如Synthemax™)的塑料器皿(如细胞培养皿、多孔板、T型瓶)上进行二维贴壁培养(参见[14])。已经开发并商业化的多层塑料器皿,如Corning CellSTACK™和Nunc Cell Factory™ [15],这些器皿可以增加二维贴壁培养过程的表面积,以获得更高数量的iPSCs。然而,使用多层塑料器皿劳动强度大,并产生大量塑料废物。或者,自动化的二维贴壁培养系统,如CompacT SelecT™平台[16],也被证明是大规模生产多能干细胞的可行方法。这种方法的缺点是设备的初始资本投资大,需要培训合格的人员,以及空间要求。此外,这些二维平台依赖于扩展(即增加并行培养的容器数量)来生产所需的细胞数量。另一种贴壁培养系统是中空纤维生物反应器[17-19],其中许多毛细管涂有基质,然后装载iPSCs。这为细胞附着提供了非常大的表面积,同时保持了较小的物理占地。然而,在这个系统中,细胞生长在扩展阶段难以监测,评估只能在收获时进行。此外,由于毛细管的狭窄内腔,这些系统容易堵塞,导致难以确保培养基能够有效分布在整个生物反应器中,从而导致营养/废物梯度的产生,可能影响iPSC的生长。
3D悬浮培养平台已越来越多地用于iPSCs的扩增,特别是在需要大量细胞时,因为这些平台可以通过增加培养体积而保持相同的细胞密度,从而更容易扩展。先前的研究报告了在生物反应器中悬浮的涂层微载体上扩增胚胎干细胞[20–23]。这些微载体可以由多种材料制成,如聚苯乙烯、玻璃、纤维素或海藻酸盐[24,25],并涂有用于2D贴壁培养的相同基质。当在生物反应器中保持悬浮状态时,这些微载体可以增加细胞附着的可用表面积数倍[20,26]。经过一段时间的培养后,可以通过化学或酶处理将细胞从微载体上解离。最近,已开发出可溶解的微载体,其中收获溶液由几种成分组成,这些成分可以将细胞从微载体上解离并同时溶解微载体,而不对细胞活力产生负面影响[27]。在发现ROCK抑制可以促进解离的胚胎干细胞存活后[28],更多的研究表明,胚胎干细胞和iPSCs在不需要附着表面的情况下,也可以在悬浮状态下作为细胞聚集体进行培养和扩增,当在培养的前24–48小时内用ROCK抑制剂(例如Y-27632)处理时[29–36]。已经有几种3D悬浮平台在有或没有微载体的情况下与iPSCs一起进行了测试。这些包括搅拌罐式生物反应器 [33,35,36],垂直轮式生物反应器 [37,38],以及摇摆式生物反应器 [39]。
此外,根据细胞的应用,可能需要几种方法来扩展和冷冻保存细胞。虽然将细胞传代为单个细胞可能在细胞附着方面提供更多的均一性和可重复性,并且在某些应用中甚至可能是关键的(例如,用于基因组编辑应用的单细胞克隆),但以ROCK抑制剂传代为单个细胞已与基因组稳定性问题相关联[40]。一些团体甚至可能更喜欢使用非酶法将细胞解离为团块而不是单个细胞。ROCK通路调节也被认为会影响下游分化效率[40,41],因此需要开发能够在未分化细胞扩增过程中省略ROCK抑制的方案。此外,对细胞数量的需求可能差异很大;虽然106 个细胞可能足以满足实验室规模的活动,但工业规模的制造可能需要比这高几个数量级的细胞数量。因此,这些细胞的生产需要根据具体情况灵活和可扩展。EBiSC还旨在不仅提供未分化的iPSCs,还提供从各种iPSC来源衍生的分化细胞类型。在这里,为了满足研究界的需求,EBiSC处于独特的位置,可以将未分化细胞的扩大生产与其后续分化为更终末分化的细胞类型结合起来。
在这项工作中,3D实验是在细胞聚集体格式或Matrigel™涂层的海藻酸盐微载体上进行的,并在神经分化的情况下与标准2D培养条件(平面培养,见图1)进行比较。扩增、分化和冷冻保存过程在多个细胞系和不同谱系中进行。在所有方法中,使用了悬浮生物反应器系统CERO 3D,作为一种优化和灵活的实验室规模设备。不同的工作流程变体如图2所示。
¶ 2. 材料和方法
¶ 2.1. Cell lines
使用了五种不同的EBiSC iPSC细胞系(IMI项目,www.ebisc.org),这些细胞系也在hpscreg.eu上注册(表1)。EBiSC细胞系完全同意用于研究用途并经过质量控制。在与EBiSC进行细胞库化时,常规进行无菌性(无支原体、微生物生长)、基于短串联重复序列分析的细胞系身份验证以及核型分析;这些数据和随附的分析证书可根据要求提供。此外,定期进行支原体检测。对于放大实验,使用了对照细胞系UKBi005-A和BIONi010-C [42],而选择BIONi010-C-13 [43]作为基因编辑细胞系,其具有NGN2转基因表达用于神经元分化。在心脏分化的情况下,使用了对照细胞系UKBi005-A和疾病细胞系UKKi018-A,而对于肝脏分化,使用了来自BIONi010-C-64的基因编辑子细胞系(使用CYP3A4-T2A-Nluc报告基因编辑,并通过基因组测序验证)。细胞在Matrigel™涂层的细胞培养皿(MTG;Corning,美国)中使用mTeSR™1培养基(Stemcell Technologies,加拿大)培养,并在60-80%汇合时用0.5 mM乙二胺四乙酸(EDTA)溶液(Invitrogen,美国)进行传代。细胞计数和活力在NucleoCounter®NC-200™设备(ChemoMetec,丹麦)上测定。
¶ 2.2. 3D 培养方法
¶ 2.2.1. 成团培养
对于3D中的种子团块(CL),细胞先前通过改良EDTA(iEDTA;基于EDTA的专有配方,由Fraunhofer IBMT开发)从2D培养中分离出来,经过两次DPBS(-/-)洗涤步骤。作为培养表面,使用Matrigel™涂层的海藻酸盐微载体。(MC; Alginatec, Germany) 直径约为 350 µm 的微载体被过滤并与细胞一起以每 cm2 60,000 个细胞的比例转移到 CEROtube 容器中(以前称为 LeviTube;OLS,德国),该容器专为生物反应器系统 CERO 3D(以前称为BioLevitator;OLS,德国)设计。培养条件为 37 ◦C 和 5% CO2。通过 CEROtube 的双向旋转使细胞和微载体的混合物保持悬浮状态(有关方案 1的详细信息,请参见表 3)。在微载体上达到汇合后,细胞在 CERO 3D生物反应器中以 60 rpm(方案 2)与 iEDTA 孵育约 20 分钟。然后用 mTeSR™1 停止解离反应,并通过使用 200 µm 细胞过滤器(pluriSelect Life S
cience,德国)过滤掉微载体,从细胞悬液中去除微载体。细胞在 250 g离心 3 分钟后用于进一步使用(重新播种、质量控制或储存)。
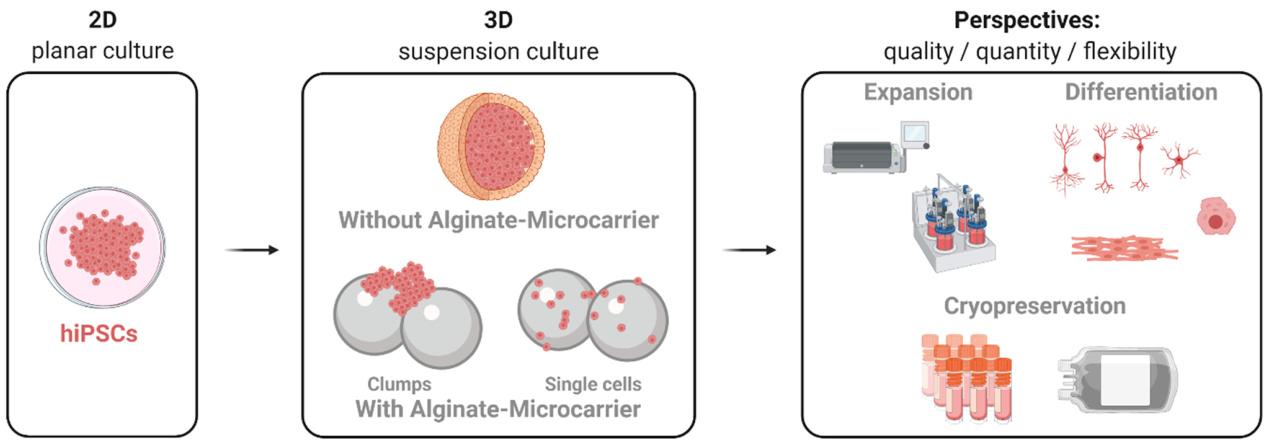
图1. iPSCs可扩展扩增和分化的不同方法,描述了所用的培养格式和结果应用领域。
¶ 2.2.2. 单细胞培养
与团块协议类似,在微载体上培养为单细胞(SC)的iPSCs以60,000个细胞每cm2 的比例接种于CERO管中,并用iEDTA分离。通过移液进行的重悬更加密集,以达到均匀的单细胞悬浮液。mTeSR™1培养基中加入ROCK抑制剂Y-27632(Abcam,英国),最终浓度为10 µM。使用CERO设备的程序3(表3)。
使用聚合协议,iPSCs用DPBS (-/-)清洗,然后使用TrypLE™ Select或Accutase® (Gibco, USA)解离,重悬于含有10 µM Y-27632的mTeSR™1中以停止解离,以300 g 离心5分钟,然后重悬于含有10 µM Y-27632的mTeSR™1中。之后,将细胞接种到CEROtubes中。对于iPSC作为聚合物的扩增,选择80 rpm的旋转速度,接种密度为2 × 105 cells/ml(程序4,见表3)。聚合物解离也在80 rpm下进行。
¶ 2.3. 冷冻保存程序
心脏和神经元分化后的细胞在250 g 离心3分钟,沉淀重悬于Cryo-Stor® CS10(Stemcell Technologies,加拿大),用于神经元分化(采用3D聚集体条件)的密度为8.5 × 106 个细胞每毫升每个冷冻管(Greiner,奥地利),用于心脏分化的密度为4–5 × 106 个细胞每毫升每个冷冻管。然后将小瓶在− 80 ◦C的冷冻容器(Mr. Frosty™)中过夜储存,容器中装有足够的异丙醇以进行逐步冷冻(Thermo Fisher Scientific,德国),并在接下来的几天内转移到− 150 ◦C液氮蒸汽相的低温储罐中。
简而言之,5000–7000个肝类器官在第8天和第21天以1 ◦C/分钟的速度在1 ml CryoStor® CS10中缓慢冷冻至− 80 ◦C,并使用VIA Freeze(Cytiva)控制速率冷冻器进行操作。随后,将小瓶储存在液氮罐中低于− 140 ◦C的温度下,解冻于37 ◦C水浴中,并在CERO 3D生物反应器中进一步培养。有关详细信息,请参阅肝类器官的冷冻保存结果如本文所述,可在本期的Altmaier等人[44]中找到。
¶ 2.4. 神经元分化
对于由NGN2过表达引发的神经元分化,使用了细胞系BIONi010-C-13[43]。细胞用TrypLE™ Select解离,并作为单细胞接种用于标准2D、聚集体或Matrigel™涂层的藻酸盐微载体(MC)。根据iPSC培养协议,使用MC的生长表面比率为每cm2 60,000个细胞,聚集体方法的接种密度为每毫升7.5 × 105 个细胞,分别在CEROtubes中以40和60 rpm的旋转速度进行(程序3和5)。在这两种情况下,前24小时需要使用含10 µM Y-27632的mTeSR™1,并在第二天更换为单独的mTeSR™1。在实验的第2天,使用补充有2 µg/ml多西环素(DOX;Merck,美国)的N2B27培养基(Shih等人发表的成分[45])进行额外的两到五天以诱导神经元分化。在不同的收获时间点(第0天、第2天和第5天),用DPBS (-/-)洗涤细胞,并在CERO3D系统中以60 rpm用Accutase®解离10分钟(表3的程序2)。进行了细胞计数、免疫细胞化学和qPCR。
¶ 2.5. 心脏分化
根据Zhang等人[46]的程序,将iPSC培养物分化为早期心肌细胞。根据Fischer等人[47]的研究,该方案被调整为在悬浮培养的三维条件下使用CERO 3D生物反应器。为了从培养皿中收获iPSCs,吸取培养基,用10 ml DPBS (-/-)洗涤两次,然后用6 ml TrypLE™ Select处理。在37 ◦C孵育5-7分钟后,用6 ml mTeSR™1和10 µM Y-27632稀释酶促反应,并转移到50 ml离心管(Greiner,奥地利)。经研磨后,使用NucleoCounter® NC-200™确定细胞计数。随后,将细胞以300 g 离心3分钟,并在CEROtubes中以60rpm的旋转速度(程序5,表3)播种于心脏分化培养基中。心脏分化培养基由基础培养基组成,含有KnockOut™ DMEM(Thermo Fisher Scientific,美国),转铁蛋白-硒(Sigma-Aldrich,美国),谷氨酰胺(Thermo Fisher Scientific,美国)和青霉素链霉素(Thermo Fisher Scientific,美国)。每24小时更换培养基,并在第0天、第2天和第3天添加心脏特异性生长因子和抑制剂,如表2所列。在第1天、第4天和第7天使用不含额外生长因子的基础培养基。标准和优化方案在生长因子和抑制剂浓度上有所不同,如表2所列。通过使用木瓜蛋白酶(40 U/ml)(Worthington Biochemical,美国)与2 mM L-半胱氨酸混合在DPBS (-/-)中进行酶解消化球形聚集体。
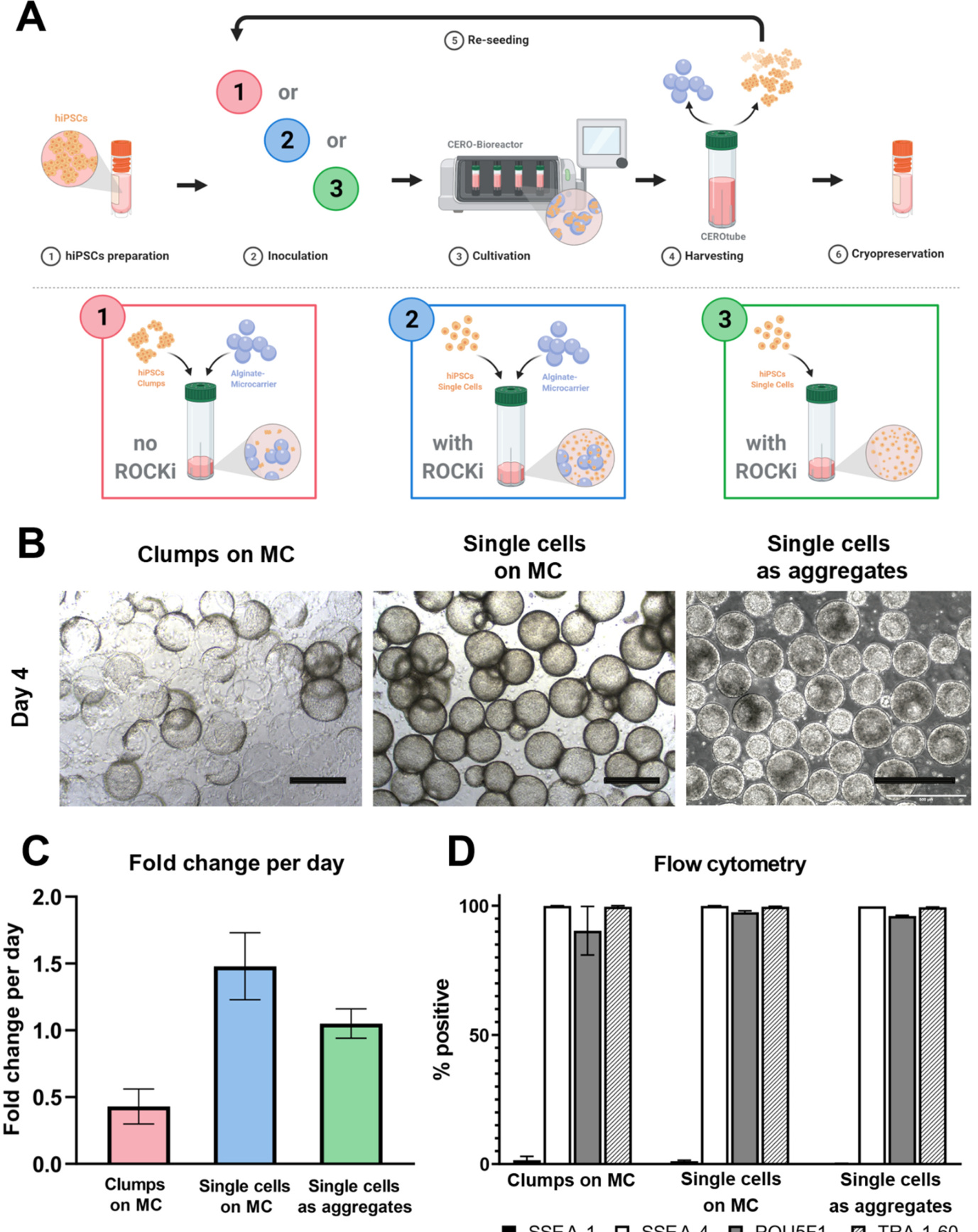
图2. iPSCs在3D培养条件下的培养和扩增。A: 3D悬浮培养的工作流程选项。A1: iPSC团块接种在Matrigel™涂层的海藻酸盐微载体上。A2: iPSC单细胞接种在Matrigel™涂层的海藻酸盐微载体上,培养基中补充10 µM Y-27632。A3: iPSC单细胞悬浮液在ROCK抑制剂Y-27632的支持下形成聚集体。B: 在Matrigel™涂层的海藻酸盐微载体(MC)上培养的团块和单细胞以及聚集体的细胞形态。UKBi005-A细胞系用于微载体方法,BIONi010-C细胞系用于聚集体方法。比例尺= 500 µm。C: 图表表示三种方法的细胞输出潜力,以每天细胞倍增变化为参数(n = 3)。D: 流式细胞术分析收获后多能性相关标记SSEA-4、TRA-1–60和POU5F1的维持情况,SSEA-1作为分化标记。绘制了这四种标记的阳性细胞百分比(n = 3)。
表 1 用于扩增和分化实验的 EBiSC2 iPSC 细胞系。
| EBiSC cell line identifier | Descriptor | Reprogramming method | Donor Sex | BioSampleID |
|
UKBi005-A BIONi010-C BIONi010- C-13 UKKi018-A BIONi010- C-64 |
Healthy | Retrovirus | Female | SAMEA4584351 |
| Healthy | Episomal | Male | SAMEA3158050 | |
| NGN2 | Episomal | Male | SAMEA103988285 | |
| induction Familial | Sendai | Female | SAMEA17622418 | |
| LongQT Syndrome CYP3A4- T2A-Nluc | Episomal | Male | SAMEA10534760 |
表 2 用于心脏分化的因子浓度。
| Growthfactor/ Inhibitor | Source | Standard Protocol | Optimised Protocol | Applied on |
| ActivinA | ThermoFisher Scientific,USA | 10 ng/ml | 20 ng/ml | Day 0 |
| BMP4 | Peprotech,USA | 1 ng/ml | 2 ng/ml | Day 0 |
| FGF2 | Peprotech,USA | 10 ng/ml | 10 ng/ml | Day 0 |
| CHIR99021 | AxonMedchem, Netherlands | 1 μM | 3 μM | Day 0 |
| WntInhibitor C59 | TocrisBioscience, UK | 1 μM | 2 μM | Day 2 |
在悬浮培养的第8天,至少在37 ◦C下孵育20分钟。随后,将球体在基础培养基、KnockOut™ 血清替代品(KO-SR)(Thermo Fisher Scientific,美国)、10 µM Y-27632和10 µM DNase(Sigma-Aldrich,美国)的溶液中孵育。通过在含有KO-SR的基础培养基中用木瓜蛋白酶抑制剂E64洗涤来阻止酶的作用。酶解后,分离出的第8天心肌细胞按照之前描述的方法进行冷冻保存。或者,从球体解离获得的第8天单细胞被接种在涂有重组层粘连蛋白或纤连蛋白(在2D中)的组织培养瓶中,并培养1-2周以增强成熟度。在第16天,心肌细胞准备好接种在支架和其他材料上进行测试,到第25天,它们表现出理想的电生理特性,并用于药理学测试。
心肌细胞使用尼康-Eclipse Ts2显微镜进行相差成像。在分化结束前的第7天和第8天,解离前检查了大约70-100个球体。每个样本的搏动比率通过以下公式计算:
计算了由 UKBi005-A 和 UKKi018-A 生成的心肌细胞的搏动球体数量,作为心脏分化效率的读数。解离的心肌细胞也通过流式细胞术和 qPCR进行分析。
¶ 2.6. Hepatic differentiation
肝脏分化方案最初是在2D中建立的,基于Rezania等人[48]开发的向最终内胚层(DE)分化的方案,由Carpentier等人[49]开发的向肝前体细胞分化的方案,最后由Pettinato等人[50]开发的向肝细胞分化的方案。然后,该过程被转化为基于悬浮的生物反应器CERO 3D。在试点研究中,优化了工艺参数,以最大化3D中的均匀性、生物量和肝细胞标志物表达。简而言之,旋转速度设定为60 rpm,没有接种阶段,并通过添加0.3%甲基纤维素来增加培养基的粘度,以减缓沉降并防止形成的类器官聚集。为了启动分化方案,iPSCs在70-80%汇合度时使用Accutase®(Gibco,美国)作为单细胞收获:一旦菌落开始从表面脱离并在相差显微镜下呈现白色,细胞在存在10 µM Y-27632(Cayman Chemical Company,美国)的情况下用mTeSR™1冲洗。随后,4 × 105 细胞/ml,在总量为20 ml中接种。三种分化培养基的组成简述如下:阶段1培养基(S1)到DE,由KODMEM、1% Pen/Strep/Glutamine和胰岛素-转铁蛋白-硒(均为Fisher Scientific)组成。额外的因素包括10 μM Y-27632(Caymanchem)、1 μM CHIR99021(Selleckchem)、10 ng/ml Activin A(Cell Guidance systems)、10 ng/ml成纤维细胞生长因子-基础(Peprotech)、1 ng/ml骨形态发生蛋白4(R&D)和0.3%甲基纤维素(R&D)。对于第二阶段到肝前体细胞,培养基由DMEM/F12、10% KOSR、1% Glutamax、1%非必需氨基酸(NEAA)、1% Pen/Strep(均为Fisher Scientific)、1% DMSO和0.3%甲基纤维素(R&D)组成。培养基每两天更换一次。在第3天,培养基切换为无酚红的William’s E培养基(Fisher Scientific),配有初级肝细胞维护试剂盒(Fisher Scientific)和0.5 μM地塞米松。此外,添加了50 ng/ml重组人肝细胞生长因子(Peprotech)和30 ng/ml重组人肿瘤抑制素M(Peprotech)。从第17天到第24天,添加了10 μM氢化可的松(Selleckchem)和1x胆固醇脂质浓缩物(Gibco, 12531018)。进行了类器官大小和计数、功能性肝细胞标志物CYP3A4表达的代谢分析、冷冻保存、流式细胞术、免疫细胞化学和qPCR,并在Altmaier等人[44]中报告;关键量化结果在本文中呈现(图5)。关于2D和3D肝分化以及冷冻保存方法的更多细节可以在本期Altmaier等人[44]的报告中找到。
¶ 2.7. 质控方法
¶ 2.7.1. 流式细胞术 (FC)
用于流式细胞术分析的细胞样本用DPBS (-/-)洗涤两次,用4%甲醛(Cytofix™;BD,美国)固定,并在用染色缓冲液(BD,美国)或DPBS (-/-)洗涤两次后储存在4 ◦C。染色前,细胞样本用Perm/Wash Buffer(BD,美国)洗涤两次,并在室温下孵育10-15分钟。心脏样本另外在室温下用含1% FBS(Gibco,美国)的DPBS (+/+)孵育5分钟。
表3 CERO 方案用于 iPSCs 的 3D 培养和分化。CL= 团块;MC = Matrigel™ 涂层海藻酸盐微载体;SC = 单细胞。
| Programme | Sub-programme | Rotation period[s] | Rotation speed [rpm] | Agitationperiod[min] | Agitation pause[min] | Duration[h] | |
| CLonMCculture | Inoculation | 4 | 40 | 2 | 15 | 5 | |
| Cultivation | 4 | 40 | 8 | ||||
| 2 | CL/SConMCharvest | Harvesting | 5 | 60 | 一 一 | 一 | 8 |
| 3 | SConMCculture | Inoculation | 4 | 40 | 2 | 5 | 12 |
| Cultivation | 4 | 40 | 8 | ||||
| 4 | SCculture+harvest | Cultivation | 4 | 80 | 8 | ||
| 5 | SCdifferentiation | Cultivation | 2 | 60 | 8 |
人和小鼠多能干细胞分析试剂盒(BD,美国)按照制造商的说明使用,另外添加了抗体用于未分化扩增方法中的iPSC细胞系染色(详见表4)。心脏样本用针对心脏肌钙蛋白和Ki-67的初级抗体在4 ◦C过夜染色,随后在室温下用次级抗体孵育一小时。所用抗体列于表4。
流式细胞术分析已在初步研究中进行,以比较测试的分化方法对DE(FOXA2和SOX17,数据未显示)的肝分化。有关这些的详细信息包含在Altmaier等人的补充材料中[44]。
¶ 2.7.2. 免疫细胞化学 (ICC)
神经分化的2D ICC样品用DPBS(+/+)洗涤两次,用4%甲醛(Cytofix™,BD,美国)固定,并在用DPBS(+/+)洗涤两次后储存在4 ◦C。用0.2% Triton™ X-100(Merck,美国)和1% BSA(Thermo Fisher Scientific,美国)在DPBS(+/+)中进行透化和封闭后,加入一抗,在4 ◦C过夜。用含1% BSA的DPBS(+/+)洗涤三次后,细胞在室温下与二抗孵育一小时,并再次用相同溶液洗涤三次。在第三次洗涤步骤中,加入DAPI(NucBlue™ Fixed Cell ReadyProbes™ Reagent,Invitrogen,美国),10分钟后用DPBS(+/+)替换。
¶ 2.7.3. 实时定量聚合酶链式反应 (qPCR)
qPCR样品在RLT缓冲液(QIAGEN,德国)中裂解,并使用RNeasy Plus Micro Kit(QIAGEN,德国)提取RNA。使用High-capacity cDNA Reverse Transcription Kit(Applied Biosystems,美国)转录为cDNA后,qPCR分析对神经样品进行重复测定,对心脏样品进行三次测定(TaqMan测定列表见表5;Thermo Fisher Scientific,美国)。数据使用Delta Delta Ct方法分析,并以iPSCs作为参考样品(RQ = 1)绘制基因表达的相对定量(RQ)或倍数变化。GAPDH 被用作内源性对照(表6)。
肝类器官的qPCR使用标记HNF4A、AFP、TTR,
表 4 用于流式细胞术染色的 hiPSC 和心脏细胞抗体 (Ab) 列表。
| Cells | Antibodies list | Dilution | Catalogue number |
| hiPSC | AlexaFluor?647Ratanti-SSEA- 4 PerCP-CyTM5.5Mouse anti-Oct3/ 4 PE Rat anti-SSEA-1 Alexa Fluor? 647 Mouse IgG3, K | 20 μul per million cells | 560477 (BD) |
| Isotype Control PerCP-CyTM5.5 Mouse IgG1, K Isotype Control PE Mouse IgM, k Isotype Control Alexa Fluor? 488-conjugated | 5 μl per | BLD-330614 | |
| anti-human TRA-1-60-R Alexa Fluor? 488 Mouse IgM,K | million cells 1.5 μl per million cells | (Biozol) BLD-401617 (Biozol) | |
| Isotype Control Anti- cardiac troponin T (mouse monoclonal) | 1:400 | ab8295 (Abcam) | |
| Alexa Fluor? 488 goat anti- | 1:1000 | A11001 (Thermo | |
| Cardiac | mouse Anti - Ki-67 (rabbit polyclonal) | 1:400 | Fisher) ab15580 |
| Alexa Fluor? 647goat anti- | 1:1000 | (Abcam) A21236 | |
| rabbit Isotype mouse IgG1 | 1:200 | (Thermo Fisher) M5284 | |
| Isotype rabbit IgG | 1:200 | (Sigma Aldrich) ab125938 (Abcam) |
表5 用于神经细胞 ICC 染色的抗体 (Ab) 列表。
| Antibodieslist | Dilution | Catalogue number |
| PrimaryAbl:Nestin | 1:200 | PA5-11887 |
| SecondaryAbl:GoatantiRabbitAlexaFluor? 555 | 1:1000 | A21429 |
| PrimaryAb2:Tubb3 | 1:1000 | Ab7751 |
| SecondaryAb2:GoatantiRatAlexaFluor? 488 | 1:1000 | A11034 |
| DAPI | 2 dropsper ml | R37606 |
ALB、CYP2C9 和 CYP3A4 未在此处显示,但在 Altmaier 等人 [44] 中显示。
¶ 3. 结果
¶ 3.1. iPSC 扩增方法的实施
对于3D iPSC扩增方法的比较,细胞以团块形式在Matrigel™涂层的海藻酸盐微载体(MC)上培养,作为从接种的单细胞悬浮液中形成的聚集体,以及在MC上的单细胞(SC)悬浮液,至少传代一次,最多传代四次(MC上的团块和作为聚集体的SC)。在数量方面,观察到不同的细胞附着行为和细胞增殖,如图2B的形态图片所示。使用“MC上的团块”方案(图2 A.1),以团块形式接种的UKBi005-A细胞在MC上的细胞附着性较低,生长更为异质,但不需要Y-27632补充。在这种条件下,每天的倍增变化达到0.33 ± 0.19(图2 C)。使用“MC上的SC”方案(图2 A.2),来自相同细胞系的单细胞接种在Matrigel™涂层的海藻酸盐微载体上,观察到最高的生长率,每天的倍增变化达到1.48 ± 0.25(在培养3-4天后已达到汇合)。微载体几乎完全被增殖的细胞覆盖,与“MC上的团块”方案相比,细胞附着更为均匀。在第三种方案“作为聚集体的SC”(图2 A.3)的情况下,经过7天的培养,获得了直径约220 µm的光滑、边界清晰的球形聚集体,每天的倍增变化达到1.07 ± 0.13,使用细胞系BIONi010-C,代表最终收获的细胞密度为1.52 ± 0.19 × 106 个细胞/ml。
为了评估细胞质量,对三种方法(MC上的团块,MC上的单细胞,作为聚集体的单细胞)进行流式细胞术,以通过量化SSEA-4、TRA-1-60、POU5F1等多能性相关标记物的存在,以及用于分化的SSEA-1,观察在3D培养中最终传代时未分化状态的维持。在所有三种扩展条件下,细胞对多能性相关标记物的阳性率通常超过90%,而对分化标记物SSEA-1的阳性率低于5%(图2D)。
表6 用于 qPCR 分析的 TaqMan 测试列表:.
| Target | TaqMan Assay ID |
| ACTN2 | Hs00153809_m1 |
| EOMES | Hs00172872_m1 |
| GAPDH | Hs99999905_m1 |
| ISL1 | Hs00158126_m1 |
| MAP2 | Hs00258900_m1 |
| MAPT | Hs00902194_m1 |
| MESP1 | Hs01001283_gl |
| MYH7 | Hs01110632_m1 |
| POU5F1 | Hs00742896_s1 |
| TNNT2 | Hs00943911_m1 |
| TUBB3 | Hs00801390_s1 |
¶ 3.2. iPSC 在(早期)NGN2 诱导的神经元中快速且可重复地分化
使用NGN2基因编辑的细胞系BIONi010-C-13,通过在N2B27中短期诱导多西环素,将iPSCs分化为早期神经元。在mTeSR™1中预培养两天后,对BIONi010-C-13细胞在分化2天和5天后进行了表征。它们在三种不同的单细胞培养格式中培养:在6孔板上(2D)、在微载体上(3D微载体)和作为聚集体(3D聚集体),如图3A所示。关于细胞输出潜力,2D条件在第5天达到最高产量,达到9.9 ± 2.9,其次是3D微载体第2天条件(图3B)。然而,第2天的产量在三种培养技术中相当相似,并且没有显著差异(2D:7.0 ± 2.4,3D聚集体:8.1 ± 4.0,3D微载体:9.5 ± 5.1)。在显微镜检查下,第5天3D聚集体和3D微载体方法表现良好(图片未显示),但收获的细胞数量仅允许产量为2.1和1.5,如后文所述。用N2B27和多西环素培养的未基因编辑的BIONi010-C亲本系仅显示出非常早期的分化迹象,而没有看到BIONi010-C-13的明显谱系特异性(数据未显示)。
在不同的培养时间点,进行qPCR以表征BIONi010-C-13细胞在分化过程中的成熟度。四个标记的表达谱显示三种培养方法之间有明显的相似性。在所有条件下,与iPSC相比,细胞表现出显著的多能性相关标记POU5F1 的下调,倍数变化值高达在第5天,微载体条件下的次数为900次(图3 C)。相反,神经标记物TUBB3 和MAP2 从第2天开始逐渐表达,而作为晚期标记物的MAPT从第5天开始上升,其相对于iPSC的倍数变化值分别为2D、3D聚集体和3D微载体的128、204和81。
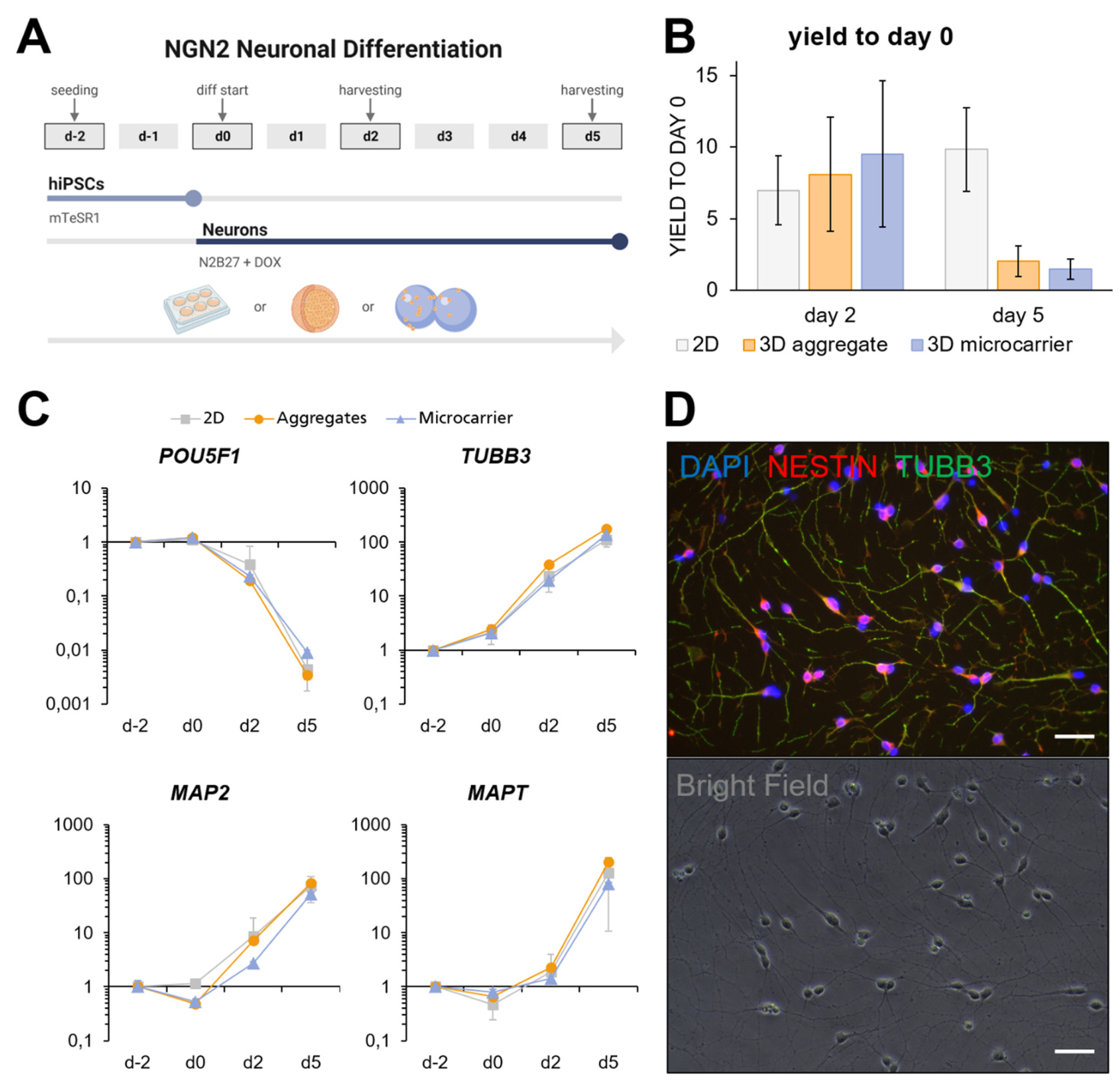
图3. iPSC在2D、3D聚集体和3D Matrigel™涂层藻酸盐微载体上的神经元分化。A: 分化方案的工作流程,详细说明所用培养基(mTeSR™1和N2B27 +DOX)和分析时间点(第−天2、第0天、第2天和第5天)。B: 分化的生长潜力,绘制了所有三种培养条件的两个收获日的第0天产量(2D: n = 5; 3D聚集体: n = 5; 3D微载体: n = 3)。C: 三种条件下四个标记物(POU5F1、TUBB3、MAP2、MAPT)的qPCR分析,基因表达相对于第2天的相对定量随时间观察(2D: n = 5; 3D: n = 3)。D: 在聚-L-鸟氨酸(PLO)-层粘连蛋白涂层板上解冻三天后的第2天分化细胞的ICC和明场视图。DAPI、Nestin和Tubb3用作染色标记。荧光图片已使用ImageJ合并和排列。比例尺= 100µm。
基于这些结果,分化的第2天被选为冷冻保存方法的最佳时间点,解冻后直接恢复和存活率为> 85%。可以证明,冷冻保存的细胞恢复良好并保持其神经元特性,如图3D所示,解冻后三天在聚-L-鸟氨酸(PLO)-层粘连蛋白涂层的孔板上确认了Tubb3和Nestin的蛋白表达。
¶ 3.3. 优化的心肌细胞分化方案显著提升了不同来源iPSC系生成心脏细胞的可靠性、稳健性和效率
心肌细胞是通过使用Zhang等人[46]的修改协议从iPSCs生成的,在CERO 3D中培养八天内完成。该协议先前已被修改,以提高健康iPSC系UK
Bi005-A以及患病iPSC系UKKi018-A(长QT综合征,2型相关iPSC系)中搏动心脏球体的产量。iPSCs在Activin A、BMP4和FGF2存在下,经过WNT激活(通过添加CHIR99021)24小时,然后通过添加WNT抑制剂(Wnt-C59)进行48小时的WNT关闭阶段,这对于iPSC的心脏特异性至关重要(图4A,生长因子浓度列于表2中)。在第0天播种的聚集体在心脏诱导的一周内逐渐发展成球体,在UKBi005-A的情况下形成搏动的心脏球体(图4B)。在CERO 3D中使用标准协议(SP)对患病的UKKi018-A系进行分化的初步试验(图4B)导致非搏动球体,需对协议进行优化。在优化过程中,研究了几个方面,包括小分子抑制剂的浓度以及心脏谱系发展中重要的关键通路激动剂/抑制剂的时间应用。优化后的协议(OP;生长因子浓度列于表2中)在不同的iPSC系中更为稳健;例如,UKKi018-A在标准分化协议下未能生成搏动球体(n = 3),但在优化协议下在分化第7天稳健地形成86.2%的搏动球体(n = 2)。有趣的是,这一优化协议将UKBi005-A生成的搏动球体的百分比从63.5%提高到98.5%(n = 6和n= 3,分别)(图4C)。如此详细且稳健的优化对于允许从许多不同的iPSC系中高效分化心肌细胞至关重要,而无需进行细胞系特定的协议更改,这既费时又费钱。优化后的协议还大大减少了生成的搏动球体数量的变异性(表现为标准差条减少)。另一个关键因素是以成本效益高的方式生成大量心肌细胞。在此,产量(即生成的心肌细胞数量与播种的iPSCs数量之比)始终保持在> 150%。通过流式细胞术评估这些心肌细胞,显示约98%的心肌肌钙蛋白(cTNT)表达(图4E)。高水平的增殖标志物Ki-67共表达(图4E)表明这些第8天心肌细胞的不成熟。成熟的心肌细胞逐渐失去增殖潜力,并显示出低水平的Ki-67。基因表达也始终显示出典型的早期心肌细胞特征,没有中胚层标志物的升高表达(EOMES 和MESP-1)。ISL-1,一种早期心肌细胞标志物,在第7天表达,变异性低,表明在生物反应器中的稳健分化(图4F)。高度表达的是肌节蛋白(ACTN2, MYH7 和TNNT2)),它们对于细胞骨架的组织和心脏功能至关重要。
¶ 3.4. iPSC 向肝细胞样细胞的分化
从iPSCs通过定向内胚层和肝前体细胞到类肝细胞的分化协议在二维中成功地转化为悬浮生物反应器(见图5A)以形成肝类器官。如图5B所示,在分化过程的第3天到第4天之间,形成的聚集体变得更加紧凑和密集。从第4天开始,它们的大小缓慢增加,直到最终分化日(第21天),同时类器官的数量在同一时间范围内减少(图5C)。图5D显示了在21天培养期间形成的类器官形态变化的代表性图像。
¶ 3.5. 扩增和分化能力总结
为了总结iPSC在神经和心脏谱系中的不同增殖潜力和分化能力,我们列出了每百万个播种的iPSC所收获的细胞数量,涵盖所有方法和格式。结果可以在表7中找到。我们观察到在神经分化过程中,产出最高,在仅仅2天内变化约10倍,其次是在2D和MC上单细胞的iPSC扩增,历时7天。虽然在CERO 3D中完成了肝脏分化,但目的是生成完整的肝类器官。因此,这些类器官没有被解离成单个细胞进行细胞计数。2D和3D肝脏分化方法的比较见Altmaier等人[44]。
¶ 4. 讨论
¶ 4.1. 3D expansion of undifferentiated iPSCs
在这里,我们展示了可以通过三种不同的3D方法实现iPSCs的规模化扩增。方法的选择理想情况下应根据研究者的目标来决定。在没有ROCK抑制的情况下,iPSC对MCs的附着可能较低,特别是当生成的细胞团块过小或搅拌速率过高时,会导致生长和附着受限的剪切应力。即使在附着允许的搅拌速率下将最佳大小的细胞团块接种到MCs上,细胞团块也倾向于不均匀地附着在MCs上。这并不影响在MCs上未分化细胞扩增的可能性。然而,这种方法确实需要经过培训和经验丰富的操作员进行仔细的显微镜检查,以确定传代的最佳时间点,以防止在MCs上过度生长,这可能导致自发分化或降低细胞活力。异质细胞附着的另一个缺点可能是下游分化应用的可重复性或效率。因此,当ROCK抑制严重影响下游应用(如细胞分化)时,可以考虑这种方法。该方法的未来发展可以研究使用替代的化学解离试剂,以产生更均匀大小的细胞团块,这些团块足够大,可以快速有效地附着在MCs上。
通过应用单细胞悬液和ROCK抑制,细胞对MCs的附着更加均匀,细胞产量相比于团块( >3倍)可以大幅增加。此外,MCs的涂层可以根据个体需求进行变化和调整,培养格式可以最佳地模拟in vivo 环境。海藻酸盐微载体还可以用于添加进一步的功能以优化工作流程,例如控制释放生长因子或通过可切换表面平滑分离细胞。这种方法的一个缺点是增加了操作步骤的数量,以确保细胞能够充分附着或从MCs上分离。这可以通过不使用MCs培养细胞为聚集体来克服。这些聚集体可以很容易地形成,并且尺寸相对均匀,聚集体的大小可以通过改变培养参数来调节,例如细胞播种密度和搅拌速率。在这种方法中,高重复性和易于操作是其突出特点。当使用涉及ROCK抑制的此类方法时,大量存活的细胞导致培养周期更快,直到它们准备好收获。然而,由于细胞即使在压力大的单细胞状态下也被迫存活,因此存在积累基因组畸变的风险。因此,应注意确保细胞不会过度生长MCs,或细胞聚集体不会超过某一尺寸,从而营养和气体扩散限制可能会对细胞聚集体的生长和活力产生不利影响。一旦确定了这些限制,就可以用来定义培养周期的终点,然后细胞可以应用于其他下游过程,如分化或解离用于冷冻保存和储存。此处展示的 iPSC 扩增的可扩展工作流程可产生足够的细胞,例如用于毒理学筛选(参见表 7 中的输出容量)。
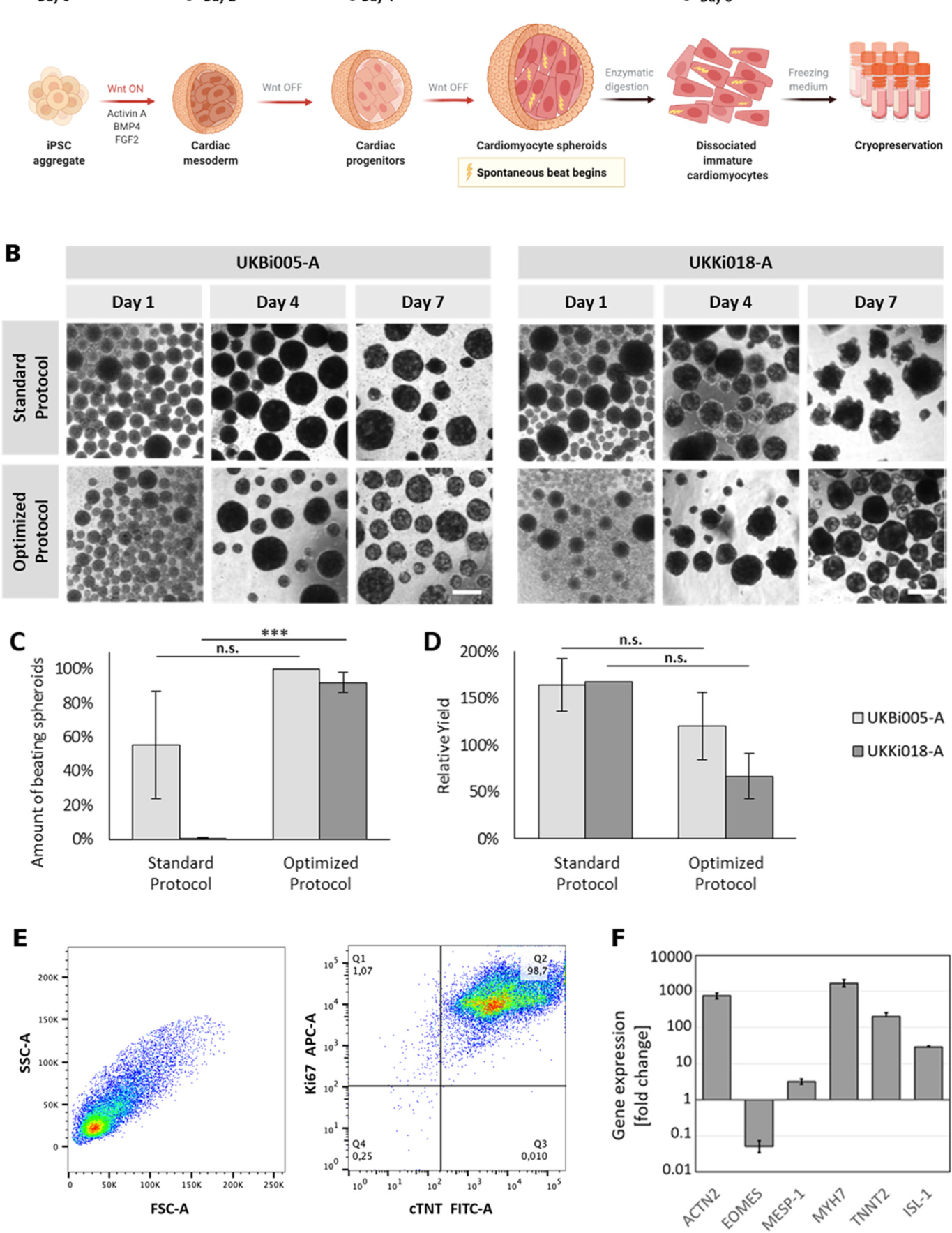
图4. iPSCs作为3D球体的心脏分化。A:从iPSCs到8天早期心肌细胞冷冻保存的心脏分化工作流程。B:通过相差显微镜成像的两个细胞系UKBi005-A和UKKi018-A在7天内的球体形态,参考(标准)和优化方案(比例尺:500 µm)。C:两种细胞系和方案的跳动球体百分比(每个重复中70-100个聚集体,进行三次重复,n = 3批次)(误差条表示标准差)。D:两种细胞系分化的细胞产出作为相对产量的百分比(SP:n = 6(UKBi005-A),n = 1(UKKi018-A);OP:每个n = 3)。E:第8天细胞的cTNT/TNNT2(心脏标记)和Ki-67(增殖标记)的心脏细胞流式细胞术分析(n = 3)。F:第7天UKBi005-A系典型早期心肌细胞基因表达的qPCR分析,针对五个特定标记(ACTN2, EOMES, MESP-A, MYH7, TNNT2, ISL- 1)(n = 3)数据以相对于d0的iPSCs的倍数变化给出;误差条表示95%置信区间)。
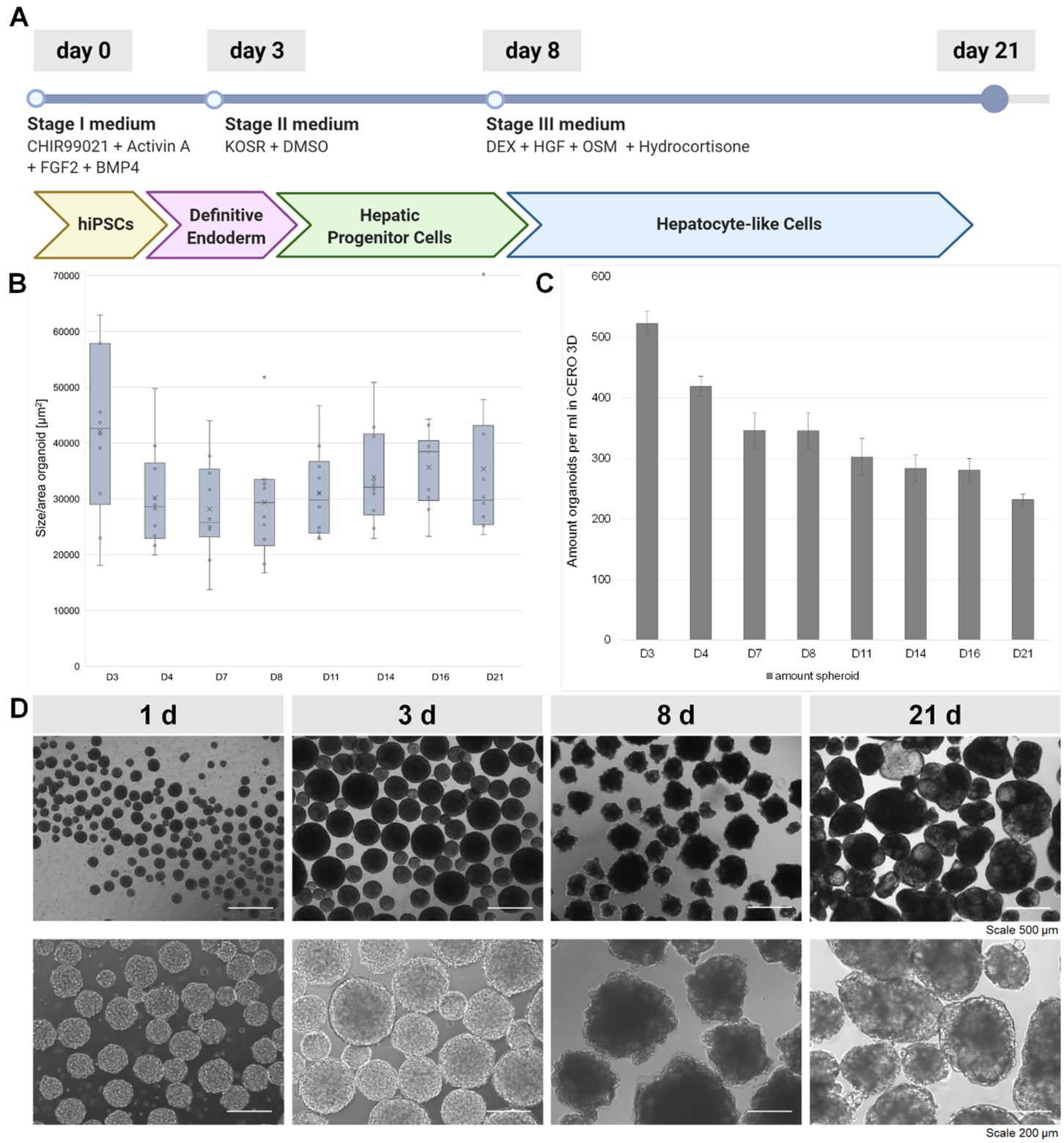
图5。 A: 从iPSCs到类肝细胞的分化方案概述。B: 在分化过程中类器官大小的发展 (n = 3 ). C: 在 20 ml 中产生的类器官数量 (n = 3)。D: 肝类器官发育过程中的代表性显微图像。
¶ 4.2. 神经元分化
除了iPSC扩增之外,我们还评估了NGN2编辑的iPSC系通过多西环素诱导进行神经元分化的放大能力(图3B)。与传统的基于生长因子的分化方法(例如双SMAD抑制[51–53])相比,谱系决定性转录因子NGN2的过表达可以加速分化并产生更均一的在2D条件下以及在3D条件下(有和没有MC)仅经过两天分化后[45]的可重复性群体。在2D培养中,增殖持续到第5天,尽管程度较低,因为细胞开始进入后有丝分裂状态。在3D条件下,细胞数量也有类似的增加。在这里,我们观察到聚集体直径的增长以及微载体上的细胞汇合度增加。然而,细胞无法从MCs上脱离或从聚集体中正确解离以达到单细胞悬浮液,导致细胞计数被低估。尽管尚未研究,我们推测3D方法中细胞间接触的强度超过了平面2D培养中的物理相互作用。更强的机械脱离细胞或使用试剂如EB解离试剂盒(Miltenyi Biotec,德国)可能是合适的替代方案,但苛刻的解离条件可能会影响细胞的活力、完整性和再附着能力。尽管在所有条件下观察到细胞计数的高标准偏差,但在第2天和第5天的qPCR分析以及解冻后三天的ICC染色证实了iPSC向表达经典谱系特异性标记如TUBB3、MAP2和MAPT的神经元的可重复分化(图3C和D)。总体而言,3D方法的分化效率与2D培养无异,突显了我们3D协议在大规模生产神经元方面的潜力。除了更好的培养基/体积比和模拟in vivo 环境外,MCs上的3D培养还利用了细胞-基质相互作用的优势,并在生长表面如何涂层方面具有灵活性。
表 7 从 个细胞接种开始的 iPSC 扩增和分化期间的输出能力:.
| Cell type | Seeded cells | 2D | 3D onMC | 3Das aggregates |
| iPSC | Clumps | 5.9 x | 2.3 ×106 | |
| expansion (7days later) | Single | 106 1.0 x | 1.0 × 107 | 7.6 × 106 |
| iPSC-derived | Cells Single | 10? 7.0 x | 8.1 × 106 | 9.5 × 106 |
| neurons (2 days later) | Cells | 106 | ||
| iPSC-derived cardiomyocytes (7 days later) | Single Cells | UKBi005-A: 1.5 × 106 UKKi018-A: |
随着二维神经分化协议在实验室规模的三维培养格式中的转化,我们可以在生产大量高质量的iPSC衍生神经细胞方面达到一个重要的里程碑,用于毒性、功能性和更复杂的模型测试。
¶ 4.3. 心脏分化
将iPSCs分化为心肌细胞已被多个实验室实现。然而,使用单一方案处理多条iPSC系(包括健康和病变的)仍然面临挑战,需要对每个新细胞系进行因素滴定以适应任何已发表的方案。本研究比较了从Fischer等人[47]改编的标准方案与优化方案,后者能够在不响应的疾病相关细胞系中触发分化。优化方案不仅能够从“ 难以分化” 的iPSC系生成心肌细胞,还能增加在对标准方案反应良好的细胞系中生成跳动的球体。这增强了该优化方案的应用,以快速且经济高效的方式开发和分发来自多个供体的心肌细胞产品,支持可持续发展的目标。iPSCs直接扩增为心肌细胞仅在健康细胞系(UKBi005-A)中观察到,细胞数量至少增加了1.5倍(表7),与输入的iPSCs数量相比。使用标准方案,健康和疾病相关的细胞系(UKKi018-A)都产生了相似的总量。
细胞数量,但在搏动类球体的比例上有明显差异;有趣的是,使用优化的方案时,虽然两种细胞系的细胞产量相比标准方案有所减少,但搏动类球体的比例在两种细胞系中都显著增加。进一步的细胞系正在测试其在优化方案下的表现。第8天获得的心肌细胞具有几个理想的特征,包括高cTNT表达、特定心脏细胞骨架标志物的早期mRNA检测、自发搏动和高增殖能力。这使得它们不够成熟,但其快速增殖促进了心肌细胞水平的扩增,推动了大规模生产更成熟心肌细胞群体的努力。第8天的早期心肌细胞在解冻后迅速恢复,并可以在涂有层粘连蛋白或纤维连接蛋白的组织培养表面上生长(补充图1)。在第8天,心肌细胞不能作为类球体测试电生理特性,因此需要进一步培养。为了将来对这些心肌细胞进行进一步的功能特征化,可以在微电极阵列上培养一周后测量其场电位持续时间。在2D培养一到两周后,可以获得适合功能测定和毒性测试的成熟心肌细胞。在第25天,成熟且电生理稳定的心肌细胞也可以接受CiPA研究[54]中的化合物,以评估所需功能的所有离子通道的存在。
¶ 4.4. 肝细胞分化
iPSC来源的类肝细胞有可能作为人类原代肝细胞(PHH)的替代来源。PHH已成功应用于in vitro 模型,例如用于肝毒性评估,但其数量有限,并且由于在实验室条件下表现不佳,应用窗口狭窄。相比之下,iPSC来源的肝细胞在三维多细胞聚集体中分化和培养,在培养中表现良好,并且由于模拟了生理环境,通常显示出改善的肝表型[55]。我们在此展示了在可扩展的基于悬浮的生物反应器中,从iPSC通过最终内胚层到类肝细胞的肝类器官生成在21天分化后是可能的。正如发育中的肝类器官的显微图像所示(图5D),它们的紧凑程度在整个培养过程中发生变化。这解决了分化第8天后类器官大小略微增加(图5B)与生成的类器官数量减少(图5C)之间的差异。很可能,这种形态变化是由从阶段2到阶段3培养基的过渡引起的,此时细胞进一步成熟并从肝前体状态转变为类肝状态。由于类器官中细胞内接触的强度随着肝成熟迅速增加,它们的解离以及单细胞基础上的产量评估是不适用的。类器官数量在分化和成熟过程中的减少很可能是由两个或多个类器官的聚集引起的。为了避免这种聚集并更紧密地控制类器官的大小,建议随着大小的进展增加旋转速度。需要在进一步的研究中评估由此产生的剪切力增加对肝类器官功能的影响。生产的类器官的功能性已通过代谢活性、免疫细胞化学染色和相关肝标志物的qPCR分析进行评估。数据可以在本期杂志的Altmaier等人[44]的文章中看到。所报道的肝类器官生产的优势在于更具生理性的三维特性,以促进细胞功能(例如CYP3A4表达)和通过并行化满足生物医学研究中不断增加的需求的培养技术的可扩展性。
¶ 5. 结论
在本文中,我们展示了从几种不同的iPSC系开始建立和优化不同扩展和分化协议。这些iPSC系通过欧洲诱导多能干细胞库(EBiSC)进行了分类并提供。所有方法均在相同的生物反应器系统中进行,显示了该设备对个体需求的灵活性和适应性,同时也提供了关于在这种3D培养格式中扩大未分化和分化细胞生产的方法的见解。在这些3D培养格式中可以收获和成熟大量的iPSC和iPSC衍生的后代(高达10倍变化),从而证明了使用这些稳健协议可重复生成多种细胞类型用于毒性筛查和化合物测试的可行性。
¶ 附录A. 支持信息
与本文相关的补充数据可在在线版本中找到,网址为 doi:10.1016/j.reprotox.2022.05.007。
¶ 参考文献
[1] K. Takahashi, K. Tanabe, M. Ohnuki, M. Narita, T. Ichisaka, K. Tomoda, S. Yamanaka, 通 过定义的因子从成人人体成纤维细胞诱导多能干细胞, Cell 131 (2007) 861– 872, https://doi. org/10.1016/j.cell.2007.11.019。
[2] J. Yu, M.A. Vodyanik, K. Smuga-Otto, J. Antosiewicz-Bo urget, J.L. Frane, S. Tian, J. Nie, G.A. Jonsdottir, V. Ruotti, R. Stewart, I.I. Slukvin, J.A. Thoms on, 从人体体细胞衍生的诱导多能干细胞系, Science 318 (2007) 1917– 1920, https://doi.org/ 10.1126/science.1151526。
[3] Y. Shi, H. Inoue, J.C. Wu, S. Yamanaka, 诱导多能干细胞技术 :十年的进展, Nat. Rev. Drug Discov. 16 (2016) 115, https://doi.org/10.1038/nrd.2016.245。
[4] M. Turner, S. Leslie, N.G. Martin, M. Peschanski, M. Rao, C.J. Taylor, A. Trounson, D. Turn er, S. Yamanaka, I. Wilmut, 朝着开发全球诱导 多能干细胞库, Cell Stem Cell 13 (2013) 382– 384, https://doi.org/10.1016/j.stem.2013.08 .003。
[5] G.N. Stacey, L. Healy, 国际干细胞银行倡议 (ISCBI), Stem Cell Res. 53 (2021), 1022 65, https://doi.org/10.1016/J.SCR.2021.102265。
[6] S. Sullivan, P. Ginty, S. McMahon, M. May , S.L. Solomon, A. Kurtz, G.N. Stacey, A. Bennaceur Griscelli, R.A. Li, J. Barry, J. Song, M.L. T urner, 全球iPSC疗法联盟 (GAiT), Stem Cell Res. 49 (2020), 102036, https://doi.org/10.1016/J.S CR.2020.102036。
[7] A. Kurtz, G. Stacey, L. Kidane, A. Seriola, H. Stachelscheid, A. Veiga, 欧 洲人类多能干细胞注册的监管见解, Stem Cells Dev. 23 (2014) 51– 55, https://doi.org/10.1089/ scd.2014.0319。
[8] N. Mah, S. Seltmann, B. Aran, R. Steeg, J. Dewender, N. Bultjer, A. Veiga, G. N. Stacey, A. Kurtz, 获取干细胞数据和多能细胞系注册: 人类多能干细胞注册 (hPSCreg), Stem Cell Res. 47 (2020), 101887, https://doi.org/10.1016/j.scr.2020.101887。
[9] R. Steeg, J.C. Neubauer, S.C. Müller, A. Ebneth, H. Zimmermann, 用于疾病研究的EBiSC iPSC银行, Stem Ce ll Res. 49 (2020), 102034, https://doi.org/10.1016/j.scr.2020.102034。
[10] T. Hanatani, N. Takas u, CiRA iPSC种子库 (CiRA的iPSC库存项目), Stem Cell Res. 50 (2021), 102033, https://doi.org /10.1016/j.scr.2020.102033。
[11] F.A. Grimm, Y. Iwata, O. Sirenko, M. Bittner, I. Rusyn, 用于 诱导多能干细胞衍生心肌细胞和肝细胞毒性筛选的高内涵检测多重化, ASSAY Drug Dev. T echnol. 13 (2015) 529– 546, https://doi.org/10.1089/adt.2015.659。
[12] G. Witt, O. Keminer, J. Leu, R. Tandon, I. Meiser, A. Willing, I. Winschel, J.-C. Abt, B. Brandl, I. Sebastien, M.A. Friese , F.-J. Müller, J.C. Neubauer, C. Claussen, H. Zimmermann, P. Gribbon, O. Pless, 一种自动化和 高通量筛选兼容的多能干细胞测试平台,用于小分子化合物的发育和生殖毒性评估, Cell Bi ol. Toxicol. 2 (37) (2020) 229– 243, https://doi.org/10.1007/S10565-020-09538- 。
[13] J.C. del Alamo,D.Lemons, R. Serrano, A.Savchenko,F. Cerignoli, R.Bodmer, M. Mercola, 用于药物 开发的iPSC衍生心肌细胞的高通量生理筛选, Biochim. Et Biophys. Acta (BBA) - Mol. Cell Re s. 1863 (2016) 1717– 1727, https://doi.org/10.1016/J.BBAMCR.2016.03.003。
[14] L.G. VillaDiaz, A.M. Ross, J. Lahann, P.H. Krebsbach, 简要回顾: 人类多能干细胞培养的演变: 从饲养细 胞到合成涂层, Stem Cells 31 (2013) 1– 7, https://doi.org/10.1002/stem.1260。
[15] S. Tohyama , J. Fujita, C. Fujita, M. Yamaguchi, S. Kanaami, R. Ohno, K. Sakamoto, M. Kodama, J. Kurokaw a, H. Kanazawa, T. Seki, Y. Kishino, M. Okada, K. Nakajima, S. Tanosaki, S. Someya, A. Hirano , S. Kawaguchi, E. Kobayashi, K. Fukuda, 高效大规模2D培养系统用于人类诱导多能干细胞和 分化心肌细胞, Stem Cell Rep. 9 (2017) 1406– 1414, https://doi.org/10.1016/J.STEMCR.2017.0 8.025。
[16] R.J. Thomas, D. Anderson, A. Chandra, N.M. Smith, L.E. Young, D. Williams, C. D enning, 在无饲养层条件下自动化、可扩展的人类胚胎干细胞培养, Biotechnol. Bioeng. 102 ( 2008) 1636– 1644, https://doi.org/10.1002/bit.22187。
[17] C. Gerlach, E. Schmelzer, 基于多腔 空心纤维的生物反应器用于动态三维灌流培养, Methods Mol. Biol. (2016), https://doi.org/10. 1007/7651。
[18] F.C. Paccola Mesquita, C. Hochman-Mendez, J. Morrissey, L.C. Sampaio, D. A. Taylor, 层粘连蛋白作为大规模扩展人类诱导多能干细胞的有效基质,在封闭细胞扩展系 统中, Stem Cells Int. (2019), https://doi.org/10.1155/2019/9704945。
[19] K. Ikeda, S. Nagata, T . Okitsu, S. Takeuchi, 基于细胞纤维的三维培养系统用于高效扩展人类诱导多能干细胞, Sci. Rep. 7 (2017) 1– 10, https://doi.org/10.1038/s41598-017-03246-2。
[20] A.K. Chen, X. Chen, A. B.H. Choo, S. Reuveny, S.K.W. Oh, 在纤维素微载体上扩展人类胚胎干细胞, 见: Current Proto cols in Stem Cell Biology, John Wiley & Sons, Ltd, 2010: pp. 1C.11.1– 1C.11.14. https://doi.org/ 10.1002/9780470151808.sc01c11s14。
[21] B.W. Phillips, R. Horne, T.S. Lay, W.L. Rust, T.T. T eck, J.M. Crook, 人类胚胎干细胞在微载体上的附着和生长, J. Biotechnol. 138 (2008) 24– 32, https://doi.org/10.1016/j.jbiotec.2008.07.1997。
[22] S.K.W. Oh, A.K. Chen, Y. Mok, X. Chen, U.M. Lim, A. Chin, A.B.H. Choo, S. Reuveny, 人类胚胎干细胞的长期微载体悬浮培养, Stem Cell Res. 2 (2009) 219– 230, https://doi.org/10.1016/j.scr.2009.02.005。
[23] L.T. Lock, E.S. Tz anakakis, 在微载体搅拌悬浮培养中扩展和分化人类胚胎干细胞为内胚层后代, Tissue Eng. P art A 15 (2009) 2051– 2063, https://doi.org/10.1089/ten.tea.2008.0455。
[24] M.M. Gepp, B. Fis cher,A. Schulz, J. Dobringer, L. Gentile, J.A. Vasquez, J. C. Neubauer, H. Zimmermann, 从海藻 衍生的海藻酸盐制成的生物活性表面用于人类干细胞的培养, J. Appl. Phycol 5 (29) (2017) 2 451– 2461, https://doi.org/10.1007/S10811-017-1130-6。
[25] A.K.-L. Chen, S. Reuveny, S.K. W. Oh, 人类间充质和多能干细胞微载体培养在细胞治疗中的应用, Biotechnol. Adv. 31 (2013 ) 1032– 1046, https://doi.org/10.1016/j.biotechadv.2013.03.006。
[26] D.E. Kehoe, D. Jing, L.T. Lock, E.S. Tzanakakis, 可扩展的搅拌悬浮生物反应器培养人类多能干细胞, Tissue Eng. Part A 16 (2010) 405– 421, https://doi.org/10.1089/ten.tea.2009.0454。
[27] A.L. Rodrigues, C.A.V. Rodrigues, A.R. Gomes, S.F. Vieira, S.M. Badenes, M. M. Diogo, J.M.S. Cabral, 可溶解微载体 允许在无异种条件下可扩展扩展和收获人类诱导多能干细胞, Biotechnol. J. (2018) 1800461, https://doi.org/10.1002/biot.201800461。
[28] K. Watanabe, M. Ueno, D. Kamiya, A. Nishiyama, M. Matsumura, T. Wataya, J. B. Takahas hi, S. Nishikawa, S. Nishikawa, K. Muguruma, Y. Sasai, ROCK抑制剂允许解离的人类胚胎干 细胞存活,Nat. Biotechnol. 25 (2007) 681– 686, https://doi.org/10.1038/nbt1310.
[29] R. Z weigerdt, 大规模生产干细胞及其衍生物,见:U. Martin(编),干细胞工程,Springer, Ber lin, Heidelberg, Germany, 2009: pp. 201– 235. https://doi.org/10.1007/10_2008_27.
[30] R. Zweigerdt, R. Olmer, H. Singh, A. Haverich, U. Martin, 在悬浮培养中可扩展的人类多能干细 胞扩增,Nat. Protoc. 6 (2011) 689– 700, https://doi.org/10.1038/nprot.2011.318.
[31] H. Si ngh, P. Mok, T. Balakrishnan, S.N.B. Rahmat, R. Zweigerdt, 单细胞接种的人类胚胎干细胞悬 浮培养的放大,Stem Cell Res. 4 (2010) 165– 179, https://doi.org/10.1016/J.SCR.2010.03.001.
[32] R. Olmer, A. Lange, S. Selzer, C. Kasper, A. Haverich, U. Martin, R. Zweigerdt, 在受 控搅拌生物反应器中悬浮培养人类多能干细胞,Tissue Eng. Part C: Methods 18 (2012) 772– 784, https://doi.org/10.1089/ten.tec.2011.0717.
[33] C. Kropp, H. Kempf, C. Halloin, D. Rob les-Diaz, A. Franke, T. Scheper, K. Kinast, T. Knorpp, T.O. Joos, A. Haverich, U. Martin, R. Zwe igerdt, R. Olmer, 饲养策略对一次性搅拌罐生物反应器中人类多能干细胞可扩展扩增的影响 ,Stem Cells Transl. Med. 5 (2016) 1289– 1301, https://doi.org/10.5966/sctm.2015-0253.
[34] A. Elanzew, A. Sommer, A. Pusch-Klein, O. Brüstle, S. Haupt, 一种可重复和多功能的系统 ,用于悬浮中人类多能干细胞的动态扩增,Biotechnol. J. 10 (2015) 1589– 1599, https://doi.o rg/10.1002/biot.201400757.
[35] C.K. Kwok, Y. Ueda, A. Kadari, K. Günther, S. Ergün, A. Heron, A.C. Schnitzler, M. Rook, F. Edenhofer, 使用一次性生物反应器生成数十亿人类诱导 多能干细胞的可扩展搅拌悬浮培养,J. Tissue Eng. Regen. Med. 12 (2018) e1076– e1087, http s://doi.org/10.1002/term.2435.
[36] F. Manstein, K. Ullmann, C. Kropp, C. Halloin, W. Trieb ert, A. Franke, C.M. Farr, A. Sahabian, A. Haase, Y. Breitkreuz, M. Peitz, O. Brüstle, S. Kalies, U . Martin, R. Olmer, R. Zweigerdt, 通过代谢控制和计算机建模进行人类多能干细胞的高密度 生物加工,Stem Cells Transl. Med. (2021) 1063– 1080, https://doi.org/10.1002/sctm.20-0453.
[37] B.S. Borys, T. Dang, T. So, L. Rohani, T. Revay, T. Walsh, M. Thompson, B. Argiropo ulos, D.E. Rancourt, S. Jung, Y. Hashimura, B. Lee, M.S. Kallos, 克服垂直轮搅拌悬浮生物反应 器中高质量hiPSC聚集体大规模扩增的生物加工瓶颈,Stem Cell Res. Ther. 2021 12 1 (12) (2 021) 1– 19, https://doi.org/10.1186/S13287-020-02109-4.
[38] C.A. Rodrigues, T.P. Silva, D .E. Nogueira, T.G. Fernandes, Y. Hashimura, R. Wesselschmidt, M.M. Diogo, B. Lee, J.M. Cabra l, 在无异种条件下使用一次性垂直轮TM生物反应器进行人类诱导多能细胞的可扩展微载体 培养,J. Chem. Technol. Biotechnol. 93 (2018) 3597– 3606, https://doi.org/10.1002/JCTB.5738.
[39] B.M. Davis, E.R. Loghin, K.R. Conway, X. Zhang, 在摇动生物反应器中自动化封闭 系统扩增多能干细胞聚集体,Slas Technol.: Transl. Life Sci. Innov. 23 (2018) 364– 373, https: //doi.org/10.1177/2472630318760745.
[40] Z. Li, S. Han, X. Wang, F. Han, X. Zhu, Z. Zhen g, H. Wang, Q. Zhou, Y. Wang, L. Su, J. Shi, C. Tang, D. Hu, Rho激酶抑制剂Y-27632在无异种 条件培养基中促进人骨髓间充质干细胞向角质形成细胞样细胞分化,Stem Cell Res. Ther. 6 (2015) 1– 13, https://doi.org/10.1186/s13287-015-0008-2.
[41] M. Maldonado, R.J. Luu, M. E.P. Ramos, J. Nam, ROCK抑制剂使人类诱导多能干细胞选择性分化为中胚层谱系,通过上 皮-间质转化样调节,Stem Cell Res. 17 (2016) 222– 227, https://doi.org/10.1016/j.scr.2016.07. 009.
[42] M.A. Rasmussen, B. Holst, Z. Tümer, M.G. Johnsen, S. Zhou, T.C. Stummann, P. Hyttel, C. Clausen, 短暂的p53抑制增加了人类成纤维细胞的重编程,而不影响凋亡和DNA 损伤,Stem Cell Rep. 3 (2014) 404– 413, https://doi.org/10.1016/j.stemcr.2014.07.006.
[43] B. Schmid, B. Holst, U. Poulsen, I. Jørring, C. Clausen, M. Rasmussen, U.A. Mau-Holzmann , R. Steeg, H. Nuthall, A. Ebneth, A. Cabrera-Socorro, 在AAVS1位点生成携带DOX诱导的NG N2表达盒的两条基因编辑iPSC系,带有和不带有GFP,干细胞研究. 52 (2021), https://doi.or g/10.1016/j.scr.2021.102240.
[44] S. Altmaier, I. Meiser, E. Lemesre, B. Chanrion, R. Steeg, L.E. Leonte, B. Holst, B.S. Nielsen, C. Clausen, K. Schmidt, A.M. Vinggaard, H. Zimmermann, J. C. Neubauer, M.A. Rasmussen, 用于冷冻保存和体外毒性研究的2D和3D悬浮培养的人iPSC衍 生肝细胞,生殖毒理学 (2022), https://doi.org/10.1016/j.reprotox.2022.05.005.
[45] P.Y. Sh ih, M. Kreir, D. Kumar, F. Seibt, F. Pestana, B. Schmid, B. Holst, C. Clausen, R. Steeg, B. Fischer , J. Pita-Almenar, A. Ebneth, A. Cabrera-Socorro, 开发一种完全人源化的检测方法,结合NGN 2诱导的神经元与iPSC衍生的星形胶质细胞共培养,适用于电生理研究,干细胞研究. 54 (2 021), https://doi.org/10.1016/j.scr.2021.102386.
[46] M. Zhang, J.S. Schulte, A. Heinick, I. Pi ccini, J.Rao,R. Quaranta,D. Zeuschner,D. Malan, K.P.Kim,A.Ropke,P. Sasse,M.Arauzo-Br avo,G.Seebohm, H. Scholer, L.Fabritz,P. Kirchhof,F.U. Muller, B.Greber,在二维和三维格 式中普遍诱导人多能干细胞的心脏分化:对体外成熟的影响,干细胞 33 (2015) 1456– 1469 , https://doi.org/10.1002/stem.1964.
[47] B. Fischer, A. Meier, A. Dehne, A. Salhotra, T.A. Tr an, S. Neumann, K. Schmidt, I. Meiser, J.C. Neubauer, H. Zimmermann, L. Gentile, 完整的工作 流程用于分化和解离hiPSC衍生的心球,干细胞研究. 32 (2018) 65– 72, https://doi.org/10.101 6/j.scr.2018.08.015.
[48] A. Rezania, J.E. Bruin, P. Arora, A. Rubin, I. Batushansky, A. Asadi , S. O’ Dwyer, N. Quiskamp, M. Mojibian, T. Albrecht, Y.H.C. Yang, J.D. Johnson, T.J. Kieffer, 通过体外衍生的人多能干细胞产生的胰岛素细胞逆转糖尿病,自然生物技术. 32 (2014) 112 1– 1133, https://doi.org/10.1038/nbt.3033.
[49] A. Carpentier, I. Nimgaonkar, V. Chu, Y. Xi a, Z. Hu, T.J. Liang, 在适合高通量筛选的微型化格式中人多能干细胞的肝分化,干细胞研究 . 16 (2016) 640– 650, https://doi.org/10.1016/j.scr.2016.03.009.
[50] G. Pettinato, S. Lehoux, R. Ramanathan, M.M. Salem, L.X. He, O. Muse, R. Flaumenhaft, M.T. Thompson, E.A. Rouse, R .D. Cummings, X. Wen, R.A. Fisher, 从人诱导多能干细胞与内皮细胞混合生成完全功能的肝 细胞样类器官,科学报告. 9 (2019) 1– 21, https://doi.org/10.1038/s41598-019-45514-3.
[51] Y. Shi, P. Kirwan, F.J. Livesey, 定向分化人多能干细胞为大脑皮层神经元和神经网络,自 然协议. 7 (2012) 1836– 1846, https://doi.org/10.1038/nprot.2012.116.
[52] P. Reinhardt, M. Glatza, K. Hemmer, Y. Tsytsyura, C.S. Thiel, S. Hoing, S. Moritz, J.A. Parga, L. Wagner, J.M. Br uder, G. Wu, B. Schmid, A. Ropke, J. Klingauf, J.C. Schwamborn, T. Gasser, H.R. Scholer, J. Ste rneckert, 仅使用小分子衍生和扩展人神经祖细胞用于神经退行性疾病建模,PLoS One 8 (20 13), e59252, https://doi.org/10.1371/journal.pone.0059252.
[53] S.M. Chambers, C.A. Fasano , E.P. Papapetrou, M. Tomishima, M. Sadelain, L. Studer, 通过双重抑制SMAD信号高效神经转 化人ES和iPS细胞,自然生物技术. 27 (2009) 275– 280, https://doi.org/10.1038/nbt.1529.
[54] K. Blinova, J. Stohlman, J. Vicente, D. Chan, L. Johannesen, M.P. Hortigon-Vinagre, V. Zam ora, G. Smith, W.J. Crumb, L. Pang, B. Lyn-Cook, J. Ross, M. Brock, S. Chvatal, D. Millard, L. Galeotti, N. Stockbridge, D.G. Strauss, 全面翻译评估人诱导多能干细胞衍生心肌细胞用于评 估药物诱导的心律失常,毒理学科学. 155 (2017) 234– 247, https://doi.org/10.1093/TOXSCI/ KFW200.
[55] S.P. Harrison, S.F. Baumgarten, R. Verma, O. Lunov, A. Dejneka, G.J. Sulliv an, 肝类器官:最近的发展、局限性和潜力,前沿医学. 8 (2021) 534, https://doi.org/10.3389/ FMED.2021.574047.