¶ 人源iPSC衍生肝细胞的2D和3D悬浮培养—一用于冷冻保存与体外毒性研究
萨斯基亚·阿尔特迈尔ä、伊娜·迈泽尔‘、埃米莉·勒梅尔、本杰明·尚里昂b、雷切尔·斯蒂格‘、莉迪亚·埃琳娜·莱昂特d,e、比约恩·霍尔斯特d、博耶·施纳克·尼尔森d、克里斯蒂安·克劳森d、卡特琳娜·施密特a、安妮·玛丽·温加德、海科·齐默尔曼a,f,、茱莉亚·克里斯蒂安·诺伊鲍尔a*、米克尔·奥贝赫·拉斯穆森d
a 德国弗劳恩霍夫生物医学工程研究所(IBMT),约瑟夫-冯-弗劳恩霍夫路1号,66820苏尔茨巴赫,德国
b 法国赛诺菲研究学院,环形路125号,78290克鲁瓦西-塞纳河畔,法国
c 弗劳恩霍夫英国研究有限公司,技术与创新中心,乔治街99号,G1 1RD格拉斯哥,英国
d 生物先锋股份有限公司,科格勒巷2号,2970霍尔斯霍尔姆,丹麦
e 丹麦技术大学国家食品研究所,凯米托维特202号楼,2800克斯林比,丹麦
f 德国萨尔布吕肯市66123,萨尔大学分子与细胞生物技术/纳米技术系智利科金博市,北天主教大学海洋科学学院
¶ 文章信息
Keywords: 人诱导多能干细胞、肝细胞、体外毒理学、纳米荧光素酶报告基因、微型化肝类器官、冷冻保存、规模化扩增
¶ 摘要
肝细胞在疾病建模、药物筛选和体外毒理学领域的生物医学研究中具有特殊价值。人诱导多能干细胞(hiPSC)分化的肝细胞因其大规模扩增能力,可作为原代人肝细胞的补充。本研究提出了一种优化方案,通过单层(2D)和悬浮培养(3D)从hiPSC生成类肝细胞(HLCs)以制备类器官。我们首先利用基因编辑的CYP3A4纳米荧光素酶报告hiPSC系在2D培养中优化方案,用于监测HLCs成熟度及明确内胚层(DE)细胞的冷冻保存。该方案针对微孔培养进行高通量筛选优化,可实现快速灵敏的药物毒性检测。为满足生物医学研究对肝细胞日益增长的需求,分化过程进一步转化为可扩展的悬浮生物反应器以建立肝类器官。在初步研究中,通过调整初始接种密度、转速、接种时间和培养基粘度等技术参数,成功制备出均质性肝类器官并最大化生物量产量(230个类器官/毫升)。为加速生产流程,我们系统分析了类器官程序化冷冻的保存方法对其细胞复苏率和标志物表达的影响。结果显示,仅在第8天肝祖细胞(HPs)阶段衍生的冷冻类器官能保持表型,更成熟阶段则无法维持。这种稳定的大批量肝细胞与肝类器官生产方案的建立,将显著推动其在生物医学和毒理学研究中的应用。
¶ 1.引言
¶ 1.1 肝细胞在高通量筛选和体外毒理学中的应用
药物候选化合物从药物开发第一阶段和第二阶段的主要问题是临床安全性问题[1],而肝毒性被列为药物开发过程中止的主要原因之一[2]。因此,科研人员正不断探索新的体外模型,以促进创新药物向临床转化。目前,原代人肝细胞(PHH)是评估肝毒性最广泛使用的体外模型,然而,由于原代人肝细胞(PHH)需从接受肝移植的患者体内分离获取,其可用性较低。因此,科学家们对人类诱导多能干细胞(hiPSCs)分化的肝样细胞(HLCs)作为PHH替代品用于毒性测试和药物筛选抱有极大兴趣,这主要得益于其自我更新能力[3]。由于hiPSCs衍生的HLCs具有遗传和环境多样性[4],能够建立来自健康与患病个体的稳定细胞系,并具备基因编辑潜力,这些特性使其成为PHH极具吸引力的替代方案,有望为药理学和毒理学研究开辟新视角。
已有多项研究致力于开发在单层培养中从人诱导多能干细胞生成功能性肝样细胞的方案。2013年,Hannan及其同事提出了一种将人多能干细胞定向分化为均质肝样细胞群体的方案[5];2016年,Carpentier等人描述了在微孔板中进行hiPSC肝向分化的微型化方案[6]。近期,Du团队报道了使用小分子鸡尾酒法仅需数周即可将hiPSC分化为肝样细胞[7]。此外,也有多项关于hiPSC来源肝细胞类器官培养的尝试。Pettinato团队提出基于多细胞球体的hiPSC肝向分化方案,可实现肝样细胞的大规模稳定生产[8];随后该团队又报道了hiPSC与内皮细胞混合培养生成全功能肝样类器官的方法[9]。然而,尽管该领域取得重大进展,针对肝组细胞和肝样细胞冷冻保存潜力及其在下游体外毒理学研究中应用的研究仍相对有限。
¶ 1.2. 从2D转换到3D的差异化
由于生物医学研究对稳健肝细胞模型的需求日益增长,hiPSCs向HLCs的2D分化过程已被转化为可扩展的悬浮式无叶轮生物反应器系统。这种3D培养体系可独立调节,能提供标准化且可重复的培养条件,从而实现比2D培养更高的生物量产量。多细胞人iPSCs来源的3D模型可真实反映人类器官的生理学和功能,因此为药物筛选或人类疾病研究提供了重要价值[10]。hiPSCs形成类器官的过程基于自组织机制,通过模拟人类体外发育实现[11]。这凸显了其在人类发育生物学或组织工程基础研究领域的附加潜力。尽管存在这些优势,现有的类器官生成方案及其质量评估方法(尤其在3D体系中)尚未实现标准化[10,12,13]。为获得生物量产量高、重复性强的均质肝类器官,我们基于无叶轮设计的CERO3D悬浮生物反应器建立了3D分化流程,其低剪切力特性可减少细胞损伤。通过优化初始接种密度、转速、接种时间及培养基成分与粘度等参数,我们确定了最佳技术方案。具体扩增流程详见KeongKwok等人的研究报告[14]。
¶ 1.3. 肝脏器官组织的冷冻保存
根据所描述的肝细胞样细胞分化流程,从人诱导多能干细胞生成成熟肝类器官的过程耗时约一个月。此外,成熟类器官的保质期有限,目前尚无法长期保存这类即用型3D细胞系统。在此背景下,研究目标在于实现肝类器官的库存管理并确保其稳定供应,以消除批次间差异[15,16]。迄今为止,冷冻保存是存储活性生物材料的唯一选择,但该技术目前仅能较好地保存悬浮状态下的单细胞。针对类器官的标准化冷冻保存方案仍存在空缺。由于3D系统中冷冻保护剂的不均匀冷冻分布和有限扩散[15-18],不均匀的冷却和升温速率导致细胞系统从表面到内部产生大的温度梯度,从而引起有害的渗透压应激和不受控制的细胞内及细胞外冰晶形成。此外,细胞系统内部冷冻保护剂的供给有限。这些因素导致冷冻和解冻过程中细胞活力丧失和细胞外基质损伤,从而危及类器官的结构完整性一一这种完整性对维持其形态和功能至关重要[19]。不过,目前已有初步方法能改善原代大鼠肝细胞聚集体解冻后的存活率,特别是通过玻璃化冷冻技术[22-27]。但玻璃化冷冻法的缺陷在于有限的可扩展性,且尚未研究该技术从原代细胞聚集体向iPSCs来源肝类器官的转移适用性。
本文阐述了一种将患者来源的hiPSCs进行分化的实验方案,旨在获得能够模拟体内肝细胞生理状态及疾病特征的类肝细胞无限来源。为此,我们构建了CYP3A4纳米荧光素酶iPSC报告系统,用于监测药物对肝细胞成熟度的影响,从而便捷读取体外毒性数据。此外,我们优化了微型化分化平台,以促进功能性类肝细胞作为药物发现高通量模型的开发。
最后,我们深入研究了使用预定义冷却速率、冷冻培养基和标准化冻存管的控制性慢速冷冻技术,对肝祖细胞和肝类器官的冷冻保存与复苏潜能的影响。为分析分化成功率及冷冻损伤效应,我们在冷冻保存前后对3D细胞模型实施了质量控制,包括类器官形态学观察、基因与蛋白表达检测以及CYP3A4代谢特性评估。
¶ 2.材料与方法
¶ 2.1.hiPSC 培养
在BIONi010-C野生型hiPSC细胞系中,我们建立了一个报告基因系,该基因系在CYP3A4基因终止密码子紧邻上游插入了T2A-纳米荧光素酶基因,并用于后续肝细胞分化研究。该hiPSC细胞系培养于经hESC认证基质胶(康宁,356234)预包被的组织培养皿中,使用mTeSR1或mTeSR Plus培养基(STEMCELL Technologies),并在37◦℃、5% CO2的培养箱中维持培养。每日更换培养基,每5-6天通过0.05% EDTA室温消化5-7分钟进行细胞团块传代。
¶ 2.2.肝细胞分化
人诱导多能干细胞系BIONi010-C-CYP3A4-2TA-Nluc ((https://pscreg.eu/cell-line/BIONi010-C-64)通过采用基于多个已发表方案优化的分化方案成功分化为肝细胞(图1)。
在第1天,hiPSCs(培养至最多80%汇合度)用DPBS洗涤一次,并在37 ◦C下用AccuMax(Fisher Scientific,50–927–1)处理10分钟。使用1ml移液器解离成单细胞悬液后,将hiPSCs以1:5的比例进一步转移到mTeSR1中并进行计数。随后,将hiPSCs以120 g离心5分钟,并以0.5 × 105 细胞/cm2 的密度接种在涂有hESC合格Matrigel的组织培养板上,并在mTeSR1 + 1:100 Revitacell中培养一天。
向定型内胚层(DE)分化的第一阶段根据Rezania等人[28]的方法进行了改良(附图1)。简言之,在第0天更换为阶段1培养基(S1),其成分为:MCDB131基础培养基(Fisher Scientific,10372019)、0.5% BSA、1.5 g/L碳酸氢钠(Fisher Scientific,25080060)、10 mM葡萄糖、1% Glutamax(Fisher Scientific,35050079)、0.1%青霉素-链霉素(Fisher Scientific,15070063),以及100 ng/ml的Activin A(Cell Guidance systems,GFH6–100)。此外,仅在0-1天期间添加了3 µM的CHIR99021(Selleckchem,S2924120–14)。
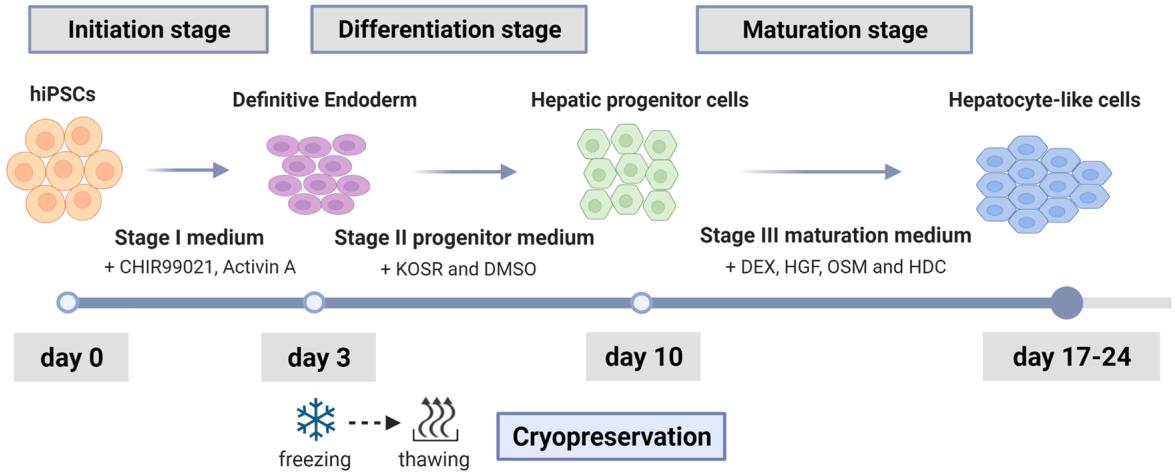
图1.人iPSCs在单层培养(2D)中分化为肝细胞的工作流程概览。在起始阶段,hiPSCs被诱导分化为定形内胚层细胞,并在分化和成熟阶段持续分化至第17-24天。第3天时将定形内胚层细胞作为中间产物冻存。本图使用biorender软件绘制。
向肝祖细胞分化的第二阶段根据Carpentier等人2016年的研究[6]进行了改良。简言之,在第4天,将定形内胚层细胞用TrypLE Express(Fisher Scientific,12563011)于37◦℃处理5-10分钟,重悬于含1:1000 Rock Inhibitor(Selleckchem,S1049)的20% KnockOut血清(KOSR)/DPBS溶液中并进行计数。此阶段的定形内胚层细胞可冻存于10% DMSO/KOSR冻存液,或直接以5××105 个细胞/平方厘米的密度接种于经LN521(Biolamina,LN521-05)包被的培养板中,使用第二阶段培养基(S2)进行培养。该培养基成分为:DMEM/F12基础培养基(Fisher Scientific,12634010)、10% KOSR(Fisher Scientific,10828028)、1% Glutamax(Fisher Scientific,35050061)、1%非必需氨基酸(Fisher Scientific,11140050)、1%青霉素-链霉素(Fisher Scientific,15070063)及1% DMSO。从本阶段起,培养基每两天更换一次。
肝细胞成熟的第三阶段根据Petti- nato等人2016年的研究[8]进行了改进。简言之,在第10天将培养基更换为hESC专用基质胶(10 mg/ml储存液)与冰浴(5–15 ◦C)第三阶段培养基(S3)按1:40比例混合的溶液,最终浓度为0.25 mg/ml。S3培养基由无酚红的William’s E培养基(Fisher Scientific, A1217601)搭配原代肝细胞维持试剂盒(Fisher Scientific, CM4000)及0.5 µM地塞米松组成,均按制造商说明配制。此外添加了50 ng/ml重组人肝细胞生长因子(Peprotech, 100–39 H)和30 ng/ml重组人制瘤素M(Peprotech, 300–10 H)。在最后一周(第17-24天),额外补充10 µM氢化可的松(Selleckchem, S1696)和1×胆固醇脂质浓缩液(Gibco, 12531018)。
¶ 2.3.分化过程中的读数
在分化过程的第0天(hiPSC)、第3天(DE)、第10天(HP)、第17天(未成熟HLC)和第24天(成熟HLC),分别通过显微镜观察细胞形态,收集细胞用于RNA提取,固定细胞进行免疫细胞化学(ICC)分析,并同步检测荧光素酶活性与细胞存活率。
在基因表达分析中,分别于第0天(iPSC)、第3天(DE)和第17天(HLC)收集单层培养细胞,并采集悬浮培养细胞(参见第2.11节)。按照制造商说明培养1天的人原代肝细胞(PHH,Sekisui,098HPCH10+)作为参照。简言之,使用RLT缓冲液裂解细胞,并依据制造商说明通过RNeasy Mini Kit(Qiagen,74106)离心柱纯化RNA。采用RNA-to-CT1-StepTaqManKit(Fisher Scientific,4392938)按照制造商说明进行qRT-PCR。TaqMan用于qRT-PCR的引物列于表1。
在免疫细胞化学分析中,分别于第0、3、10、17和24天用 多聚甲醛固定细胞。固定过程在室温下进行15分钟,随后将细胞置于磷酸盐缓冲液中待处理。分化阶段结束后,对第10、17和24天固定的细胞进行免疫细胞化学检测。固定细胞用含 Triton X-100和 牛血清白蛋白的PBS溶液在室温摇床上封闭30分钟。随后与相应一抗(1:500稀释)在4℃下孵育过夜。次日用PBS洗涤细胞三次(每次5分钟),并与AlexaFluor标记的二抗在室温下孵育1小时。抗体详细信息参见表2。最后用Hoechst(赛默飞世尔科技)以1:10000比例稀释于PBS进行细胞核染色。每个步骤间均用新鲜PBS洗涤细胞。使用共聚焦显微镜(Molecular Devices,ImageXpress Micro Confocal)完成图像采集与处理。
采用PromegaNano-Glo?荧光素酶系统(Promega,N1110)检测分化后CYP3A4纳米荧光素酶报告基因细胞系的荧光素酶表达,操作流程遵循Promega官网提供的制造商说明书。该检测体系能在高表达功能性肝脏标志物CYP3A4的肝细胞中,通过分泌的纳米荧光素酶产生生物发光反应。发光信号使用PerkinElmerEnspire2300化学发光仪进行检测。细胞活性通过CellTiter 96?AQueous One Solution细胞增殖检测试剂盒 (Promega,G3582)测定,并据此将CYP3A4活性标准化为活细胞数量。该检测严格遵循Promega官网发布的制造商操作规程,吸光度数值通过PerkinElmer Enspire 2300化学发光仪记录。
表1用于qRT-PCR的Taqman引物概述
| Target gene | Primer ID | |
| Hepatocyte progenitors | Hepatocyte nuclear factor 4 α (HNF4A) | Hs00230853_m1 |
| α-fetoprotein (AFP) Transthyretin (TTR) | Hs01040598_m1 Hs00174914_m1 | |
| Hepatocytes | Albumin (ALB) | Hs00609411_m1 |
|
Asialoglycoprotein Receptor 1 (ASGR1) |
Hs01005019_ml | |
| CYP enzymes | Cytochrome P450 2C9 (CYP2C9) | Hs00426397_m1 |
| Cytochrome P450 3A4 (CYP3A4) | Hs00604506_m1 |
表2免疫细胞化学所用抗体概述
| Antibody | Company, cat. no. | Fluorophore | Dilution |
| Mouse anti-human Hepatocyte | Santa Cruz, | Alexa Fluor 488 | 1:500 |
| nuclear factor 4α (HNF4A) Rabbit anti-human | SC374229 Dako,A0008 | Alexa Fluor 594 | 1:500 |
| α-fetoprotein (AFP) Mouse anti-human Cytochrome P450 3A4 (CYP3A4) | Thermo Fisher,MA517064 | Alexa Fluor488 | 1:500 |
| Rabbit anti-human Albumin (ALB) | Dako,A0001 | Alexa Fluor 594 | 1:500 |
| Mouse anti-human Cytokeratin 18 (CK18) | Dako,M7010 | Alexa Fluor 488 | 1:500 |
| Rabbit anti-human alpha 1 anti- Trypsin (A1AT) | Dako,A0012 | Alexa Fluor 594 | 1:500 |
¶ 2.4. 体外毒理学研究
在第21天,将细胞暴露于多种药物下以测试其对细胞的肝毒性作用。本研究从Bell等人论文中选取了三种药物[29],包括最常见的肝毒性药物扑热息痛和双氯芬酸,以及非肝毒性药物吡格列酮。所用化合物浓度见表3.储备溶液在甲醇中制备。肝细胞在分化期的第21至28天暴露于药物中,持续七天,每三天更换一次培养基。药物暴露后,在第28天,根据制造商的说明,使用Nano-Glo评估荧光素酶活性,使用CellTiter-Glo评估细胞活力。
¶ 2.5.HTS 微型化
通过定量检测第15天细胞中白蛋白(ALB)、α-甲胎蛋白(AFP)和肝细胞核因子4α(HNF4A)的表达水平(附图2),评估了384孔板每孔
中的最佳细胞浓度。当细胞密度达到约73000个/平方厘米2时获得最佳肝向分化效果。将内胚层阶段第3天冻存的细胞解冻后,以每孔8000个细胞的密度接种于含10 μM Rock抑制剂Y-27632(默克密理博,688002)的S2培养基中。分化过程按照2.2节方案进行,通过ALB、AFP和HNF4A抗体的免疫细胞化学染色(表2)评估肝向分化程度。在分化终点,分别对第10、17和24天固定的细胞进行免疫细胞化学检测。使用共聚焦显微镜(珀金埃尔默,Opera phenix共聚焦显微镜)进行图像采集,并通过Harmony HCS软件处理图像。
¶ 2.6. 细胞对吲哚菁绿的吸收和释放
为测试成熟肝细胞的功能,分析了临床使用的花青染料吲哚菁绿(ICG;默克公司,1340009)的摄取与释放情况。将ICG母液用二甲基亚砜
配制为5 mg/ml的浓度。实验时向培养基新鲜添加1 mg/ml的ICG。在培养第10、17、24天(hiPSC)或第2天(PH),将细胞置于37◦C的ICG溶液中孵育。经30分钟孵育及PBS清洗三次后,通过光学显微镜观察细胞对ICG的摄取情况。为监测ICG的细胞释放过程,随后将细胞置于37◦C的新鲜培养基中继续培养并进行检测。
| 化合物 | 最终浓度(uM) |
| 扑热息痛 | 10000,5000,2000,1000,0 |
| 双氯芬酸 | 500,250,100,50,0 |
| 吡格列酮 | 40,20,10,5,0 |
6小时后通过光学显微镜观察。
¶ 2.7.糖原的周期性酸-希夫染色法
为检测细胞内糖原储存情况,通常采用高碘酸-雪夫染色法(PAS;Sigma Aldrich,395B)。在培养第10、17、24天(iPSC)或第2天(PH)时,使用PAS染色试剂盒于室温下对细胞进行染色。简要步骤包括:使用1%高碘酸溶液氧化固定细胞5分钟,雪夫试剂孵育15分钟,梅耶苏木精染色2分钟,最后通过光学显微镜成像。每个步骤间隔均采用新鲜PBS冲洗细胞三次。
¶ 2.8. AdipoRedrM 检测
AdipoRed™检测试剂盒(Lonza,PT-7009)用于量化细胞内脂质积聚。在第10、17和24天(hiPSC)或第2天(PH),将细胞与2 µM的CellTracker™ Green CMFDA(Thermofisher scientific,C2925)在37◦C下孵育30分钟。随后用PBS清洗细胞三次,室温静置5分钟冷却。接着将AdipoRed™试剂以1/40比例用PBS稀释,室温孵育10分钟,PBS清洗三次后使用共聚焦显微镜(PerkinElmer,Opera phenix共聚焦显微镜)进行成像。
¶ 2.9. 统计分析
所有数据均来自三次独立实验,以均值± SEM表示,并使用统计软件GraphPad Prism 8.4(GraphPad Software,美国加利福尼亚州拉霍亚)进行分析。采用Student t检验比较两组间差异。P<0.05视为具有统计学意义(*p<0.05,**p<0.01,***p<0.001)。
¶ 2.10.在悬浮式生物反应器中生成肝脏器质性组织
为生成3D肝细胞样类器官,我们将涉及培养基组成与培养时间的2D分化流程转化为可规模化的悬浮无叶轮生物反应器系统——OLS公司生产的CERO 3D生物反应器(图2)。进行3D分化诱导时,CERO 3D培养管以8×106 个人源诱导多能干细胞/20ml培养基的初始接种密度进行接种。将含有细胞悬液的培养管置于CERO 3D生物反应器中,在调节温度(37◦℃)、CO2 浓度(5%)及培养程序(旋转周期:2秒,暂停间隔:0秒,转速:60转/分钟)条件下进行培养。类器官需完全沉降1-2分钟后方可更换分化培养基。培养基配方基于2D培养体系调整:前三天使用KO-DMEM(Fisher Scientific,10829018)、1%青霉素/链霉素/谷氨酰胺(FisherScientific,1037816)及胰岛素-转铁蛋白-硒(Fisher Scientific,354351)诱导hiPSCs分化为定形内胚层细胞。另添加10μM Y27632(Caymanchem,10005583)、1μM CHIR99021(Selleckchem,S2924120–14)、10ng/ml激活素A(Cell Guidance systems,GFH6–100)、10ng碱性成纤维细胞生长因子(Peprotech,100–18B)、1ng/ml骨形态发生蛋白4(R&D,314BP010)和0.3%甲基纤维素(R&D,HSC001)。第2-3天培养基中不含Y27632与CHIR99021。后续分化过程参照2D培养方法使用S2和S3培养基,但仅添加0.3%甲基纤维素(参见第2.2节)。关于规模化培养的更多细节可参阅本期Keong Kwok等人发表的报告[14]。
¶ 2.11. 肝脏器官组织的冷冻和解冻
肝脏类器官在分化第8天(HPs)和最终分化第21天(HLCs)采用控制性慢速冷冻方案进行冻存。单个CERO 3D培养管中可获得约5000至7000个类器官。转移至一个冻存管(Greiner,2 ml)中。静置沉降1-2分钟后弃去上清液,将类器官重悬于1.5 ml CryoStor® CS10冷冻保护剂中。随后立即使用程序降温仪VIA Freeze(Cytiva)进行冷冻保存。经过4◦℃条件下5分钟平衡后,以1◦℃/分钟的降温速率冷冻至−80◦℃,随后储存于液氮2罐中(低于−140◦℃)。6天后,将类器官置于37◦℃水浴中解冻,转移至装有20 ml预热S3成熟培养基的CERO 3D管中。类器官继续在CERO 3D生物反应器中培养,每两天更换一次培养基。分别于解冻后0小时(第8天D8–01/第21天D21–01)、24小时(第9天D8–02/第22天D21–02)、3天(第11天D8–03/第24天D21–03)、7天(第15天D8–04/第28天D21–04)和14天(第21天D8–05)收集质量分析样本(参见第2.3节)。未冷冻对照组在相应时间点取样。约20个类器官使用BD Cytofix™固定缓冲液固定用于免疫化学染色,并储存于4◦℃。基因表达分析则固定约200个类器官于RLT缓冲液中,储存于−20◦℃。免疫化学染色与基因表达分析的材料方法详见第2.3节。
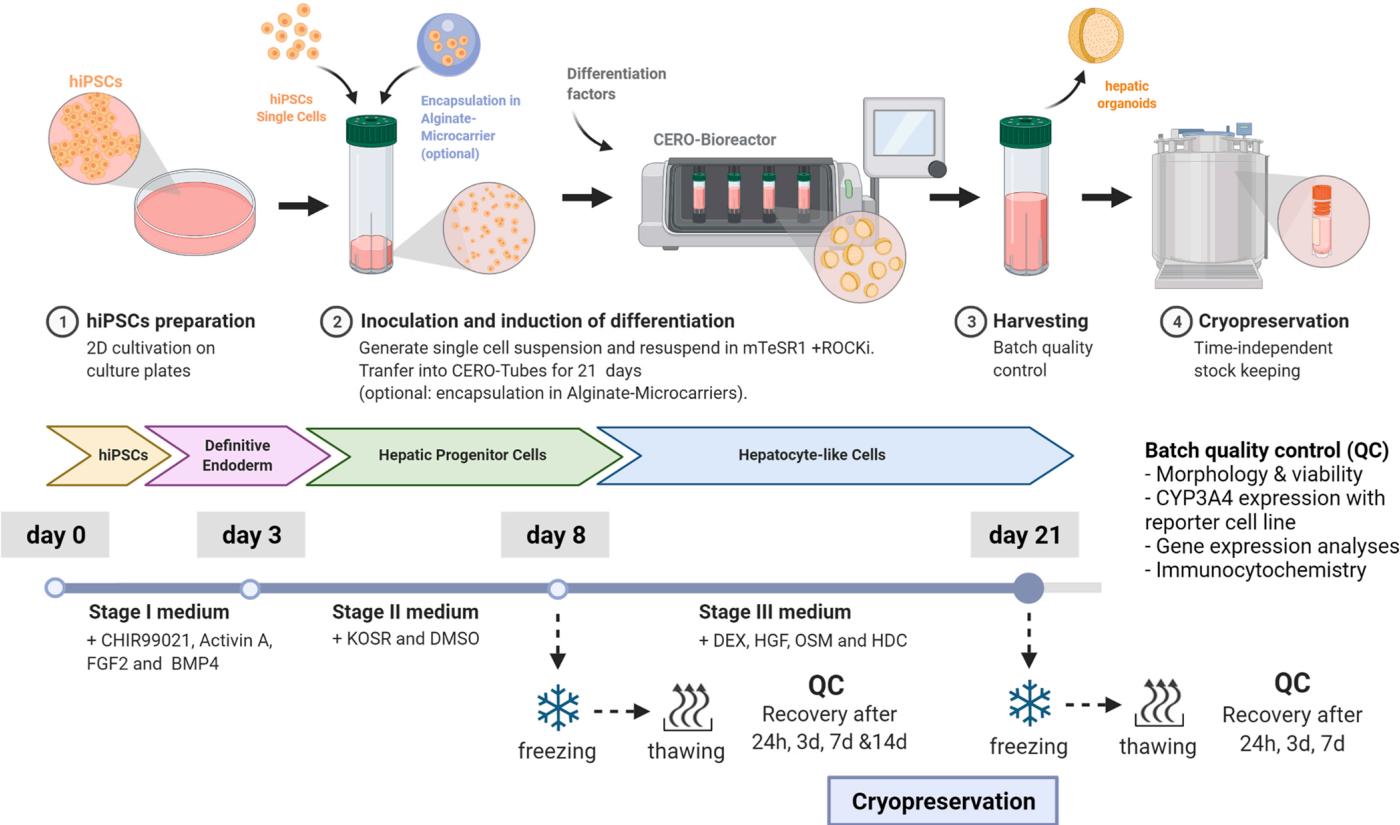
图2.人iPSCs来源肝细胞在悬浮培养(3D)中的分化流程概览。第一步是建立从起始阶段到成熟阶段的稳健2D HLCs分化体系。第二步将该方案转化为基于悬浮生物反应器CERO3D(OLS)的3D培养模式。最后在分化过程的两个时间点(第8天和21天)对肝类器官进行冷冻保存,以评估其冻存效率。分化过程中的各项质控指标以及复苏后的状态验证了肝类器官的质量。本图使用Biorender软件绘制。
¶ 2.12.3D体系中报告基因活性的评估
为了评估肝脏类器官的代谢活性,采用基因修饰的人诱导多能干细胞报告细胞系BIONi010-C-CYP3A4–2TA-Nluc进行类器官构建与3D分化。如第2.3节所述,分别采用Nano-Glo®荧光素酶检测系统(Promega, N1110)和CellTiter-Glo®发光法细胞活力检测试剂盒(Promega, G7570)。在冷冻前与解冻后各时间点分别取样约20个类器官用于质量分析。对照组和处理组分别接种于预先包被hESC级别基质胶的白色透明底板96孔板中。每个实验条件分析8个 孔板。由于Nano-Glo?荧光素酶检测系统与CelITiter-Glo检测方法不兼容3D样本,将类器官在包被板上培养24小时使其贴壁延展形成单层样结构。首先按照制造商说明对每个96孔板进行Nano-Glo?荧光素酶检测,随后进行CellTiter-Glo?发光法细胞活力检测。使用Tecan Infinite F200酶标仪测量发光信号。
¶ 3.结果
¶ 3.1.在单层中建立基于 iPSC 的分化方案
利用CRISPR-Cas9技术建立了肝细胞特异性报告基因人诱导多能干细胞系。该报告系统在CYP3A4基因下游插入NanoLuc荧光素酶基因,可通
过酶标仪便捷读取细胞成熟度指标。基于该细胞系,我们比较了已发表的不同hiPSC肝向分化方案在单层(2D)与悬浮(3D)培养体系中的效
果。这些方案均遵循从hiPSC向定型内胚层分化,经肝祖细胞阶段最终获得成熟肝细胞样细胞的分化路径。研究团队首先建立了优化的定型内胚层诱导方案[28],在分化启动第3天可获得超过90%的SOX17/FOXA2双阳性细胞(图3A及附图1)。随后相继开发出优化的肝祖细胞[6]与肝细胞样细胞[9]诱导方案(图3A)。最终获得的肝细胞样细胞呈现典型肝细胞形态:大多角形结构、具有单/双显著核仁的清晰圆形细胞核以及明亮连接的细胞间隙。这些细胞已通过免疫细胞化学显示成熟肝细胞标志物的染色,包括HNF4A、AFP、ALB、CK18、A1AT和CYP3A4(图3 B)。此外通过肝细胞特异性引物(包括HNF4A、AFP(肝祖细胞特异性)、ALB及CYP3A4(肝样细胞特异性))进行qRT-PCR对肝样细胞进行进一步表征。在为期四周的分化过程中,观察到未成熟与较成熟肝样细胞标志物的表达增加(图4 A)。此外,CYP3A4报告细胞系在分化过程中的检测结果显示通过Nano-Glo 检测(报告基因检测)并经CellTiter-Glo 读数(基于ATP水平的细胞存活率)标准化后,结果显示CYP3A4在分化过程中持续增加,验证了其作为衡量肝细胞成熟度有效工具的价值(图4B)。
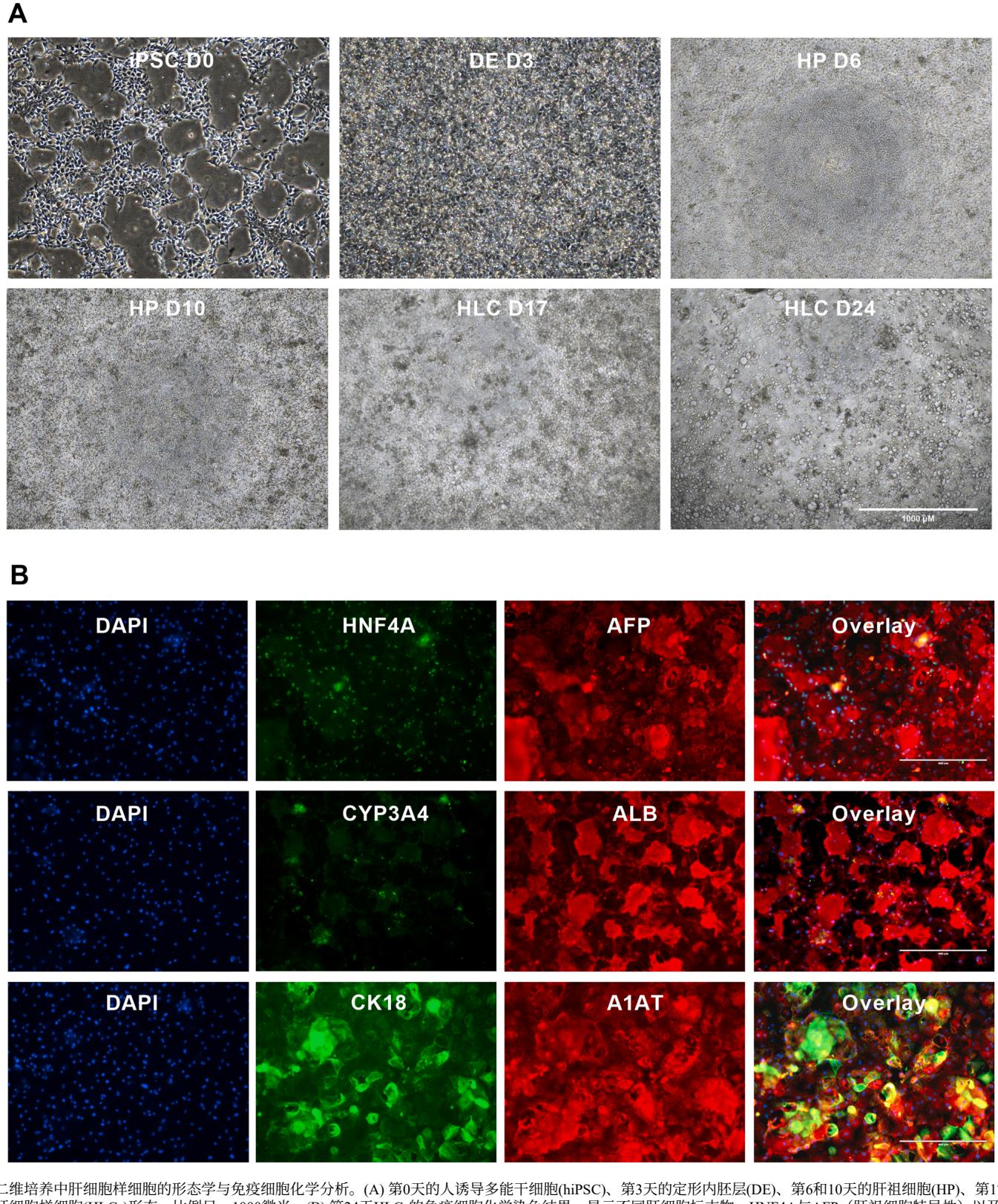
图3. 2D培养中肝细胞样细胞的形态学与免疫细胞化学分析。(A) 第0天的人诱导多能干细胞(hiPSC)、第3天的定形内胚层(DE)、第6和10天的肝祖细胞(HP)、第17和24天的肝细胞样细胞(HLCs)形态。比例尺= 1000微米。(B) 第24天HLCs的免疫细胞化学染色结果,显示不同肝细胞标志物:HNF4A与AFP(肝祖细胞特异性)以及CYP3 A4、ALB、CK18和A1AT(肝细胞样细胞特异性)。比例尺= 400微米。
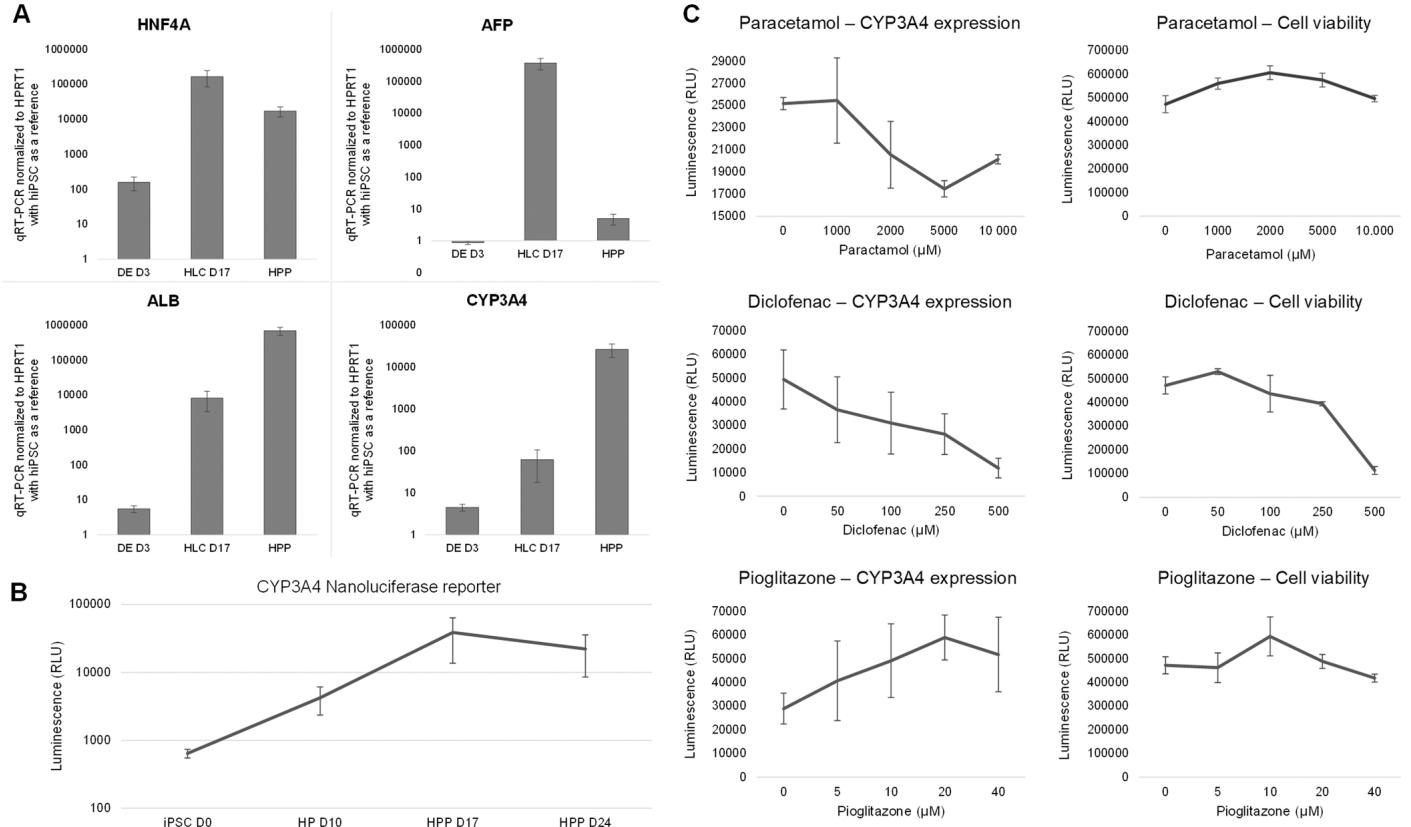
图4. 验证和使用 CYP3A4 纳米荧光素酶报告基因的药物测试。(A) 使用相关肝标志物(HNF4A、AFP、ALB、CYP3A4)的 qRT-PCR。(B) 在2D肝细胞分化过程中,来自 CYP3A4 报告基因系的 HLCs 使用 Nano-Glo 测定法(CYP3A4 报告基因)的荧光素酶读数。(C) 在来自 CYP3A4 报告基因的 HLCs 上测试不同参考药物,随后使用 Nano-Glo 测定法(CYP3A4 表达)或 CellTiter-Glo ATP 为基础的活力测定法(细胞活力)进行发光读数,平均值 ± 标准差,n = 3。
¶ 3.2. iPSC 衍生肝细胞的体外毒性研究
采用我们2D方案从CYP3A4报告基因衍生的HLCs,进一步用于为期7天的已知参考药物处理,包括对乙酰氨基酚、双氯芬酸以及非肝毒性药
物吡格列酮[29],随后进行经典的CellTiter-Glo或Nano-Glo检测。通过该方法,我们验证了CYP3A4报告基因系的功能性和分化结果,这些结果将揭示所得肝细胞类器官能否用于有意义的毒理学检测。数据显示,仅在使用最高浓度双氯芬酸时,CellTiter-Glo检测才显示细胞存活率下降,而Nano-Glo检测在较低浓度下也呈现阶梯式下降(图4C)。例如,研究结果表明使用经典毒性测试仅能在最高浓度(500 µM)检测到双氯芬酸的肝毒性,但通过CYP3A4报告基因在≥ 50 µM浓度即可检测。正如预期,在所选测试浓度下,非肝毒性药物吡格列酮的处理在两种检测中均未导致细胞死亡。最终我们建立了一种易于使用的非裂解性检测方法,该方法在较低浓度下具有更高灵敏度,能获得更优化的浓度-反应曲线。
¶ 3.3.在 384孔板中分化 HLCs
在优化hiPSC向HLCs分化过程中,我们开发了DE细胞冷冻保存方案。该中间DE阶段随后被用于微孔板格式的微型化实验,这些实验与高内涵筛选兼容,可在高通量平台上进行临床前研究中的药物毒性评估。
首先,通过测量特异性分化标志物的水平,确定了384孔板中的最佳细胞浓度。第15天时(补充图2)。对ALB、CYP3A4和HNF4A的定量分析显示,在约每立方厘米73000个细胞(相当于每孔8000个细胞)的密度下肝成熟度更高(补充图2)。采用该细胞密度时,我们获得了覆盖整个孔底、具有紧密连接的多边形细胞均质单层(图6B顶行),其形态与96孔板中获得的结果相当(图6A顶行)。通过肝祖细胞和肝样细胞分化标志物的ICC染色后,我们分别在96孔板(图5A)和384孔板(图5B)中对肝样细胞特异性标志物(ALB与CYP3A4)及肝祖细胞特异性标志物(AFP与HNF4A)的表达水平进行了定量。两种规格孔板中,成熟后肝祖细胞标志物水平如预期下降,而肝样细胞特异性标志物水平均有所上升(图5A、B)。但除CYP3A4外,第10天时96孔板中肝祖细胞与肝样细胞特异性标志物水平始终更高。此外,微型化孔板中培养的细胞在培养2周后易出现死亡(数据未显示)。我们还检测了96孔板(图6A)与384孔板(图6B)中肝样细胞的功能状态。糖原(PAS检测)与甘油三酯(AdipoRedTM检测)储存是功能性肝细胞的重要特征[30]。结果显示,分化早期(第10天)iPSC来源的肝细胞可分别储存被染成紫色(图6A、B第4行)的糖原和被染成红色(图6A、B第5行)的甘油三酯。我们还进行了吲哚菁绿摄取实验以表征肝细胞摄取功能——这是由成熟肝细胞特异性表达的阴离子转运蛋白LSAT1介导的过程[6]。与染料孵育30分钟后,96孔板和384孔板中的细胞在分化第10天即具备储存和释放吲哚菁绿的能力(图6A、B第2行(摄取)与第3行(释放))。
这些结果证实了在384孔板中培养的人诱导多能干细胞(hiPSCs)具有表型和功能上的肝细胞分化能力,使其适用于高通量检测——即使这些细胞在培养中的存活时间无法达到96孔板培养模式的水平。
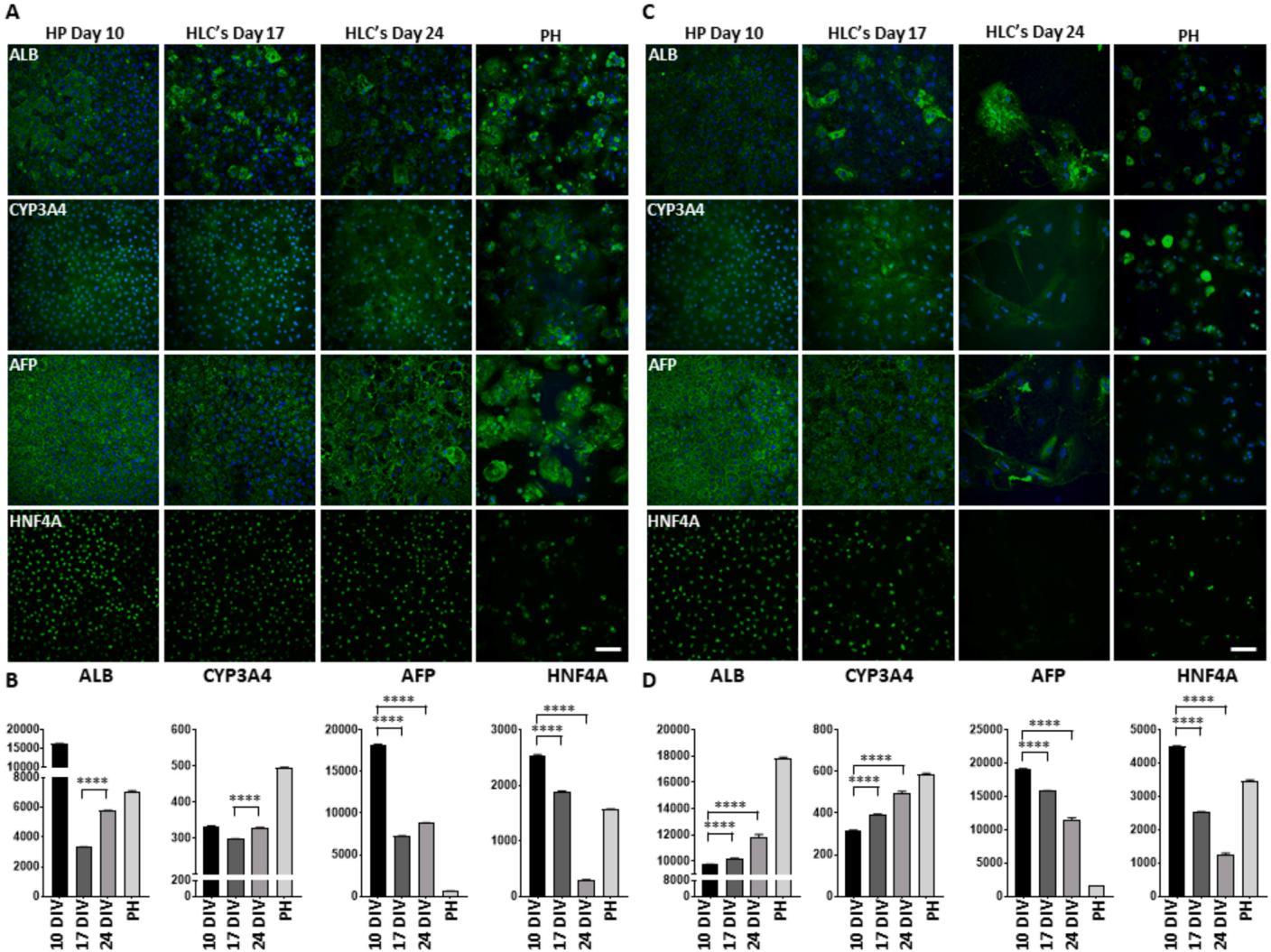
图5. 在96孔板和384孔板中iPSC衍生HLCs的形态学特征评估。(A) 免疫荧光染色代表性图像,显示96孔板中培养10、17和24天后PHH、HP及HLC的ALB、CYP3A4、AFP和HNF4A抗体表达。(B) 96孔板中培养10、17和24天后PHH、HP及HLC单位细胞免疫荧光信号量化分析。(C) 免疫荧光染色代表性图像,显示384孔板中培养10和17天后PHH、HP及HLC的ALB、CYP3A4、AFP和HNF4A抗体表达。(D) 384孔板中培养10和17天后PHH、HP及HLC单位细胞免疫荧光信号量化分析。标尺= 100微米。(****p值< 0.0001)。
¶ 3.4.对冷冻保存后的肝脏器官组织进行评估
在分化过程中的两个时间点研究了冷冻保存方法。图2提供了从2D到3D分化转化的概念验证,以及3D细胞系统的冷冻保存和相应的质量控制。为了分析冷冻保存后不同成熟状态类器官的恢复情况,分别在早期3D分化的第8天和3D分化结束时的第21天进行了冷冻。
分别在解冻后0小时、24小时、3天和7天的时间点,对非冷冻对照组进行形态学检测。图7A展示了肝类器官在冷冻前、解冻后24小时及7天的代表性相差图像。第8天冷冻前的类器官呈现均匀形态,直径约为200微米;而第21天的类器官形态则更具异质性。解冻一天后,两种条件下类器官的外部轮廓均变得更不规则,直径缩小且细胞碎片增多(如白色箭头所示)。解冻七天后,两种冷冻方案的类器官均再次呈现更均匀的形态,无细胞碎片且直径增大。
图7B中的图表描绘了第8天或第21天冷冻类器官在解冻后不同时间点的CYP3A4表达量及其对应的未冷冻对照组。在冷冻前即刻和解冻后即刻,第8天冷冻的类器官显示出与活细胞数标准化后相似的CYP3A4表达水平。解冻后第一天(第9天),CYP3A4表达量降至未冷冻对照组的约17 ,同时检测到活细胞比例为 在后续时间点(第11、15和21天),该功能性肝细胞标志物水平再次上升。解冻3天后样本显示出相似表达量,但冷冻样本的标准偏差较大。此外,解冻7天后细胞活性相较于冷冻前回升至
在第21天冷冻的类器官在解冻前后也表现出相似的CYP3A4表达水平(图7B)。同样,冷冻样本在解冻24小时后标志物表达量下降约25%。与第8天冷冻样本不同,最终状态冷冻类器官(第21天)在解冻后第3天和第7天显示出CYP3A4表达量下降。针对快速可用产品的潜在需求,第21天冷冻类器官在解冻后培养至第28天(即解冻后第7天)进行恢复与分析。相比之下,第8天冷冻类器官在解冻后培养14天直至分化终点(第21天),此时它们已充分成熟可用于下游实验。
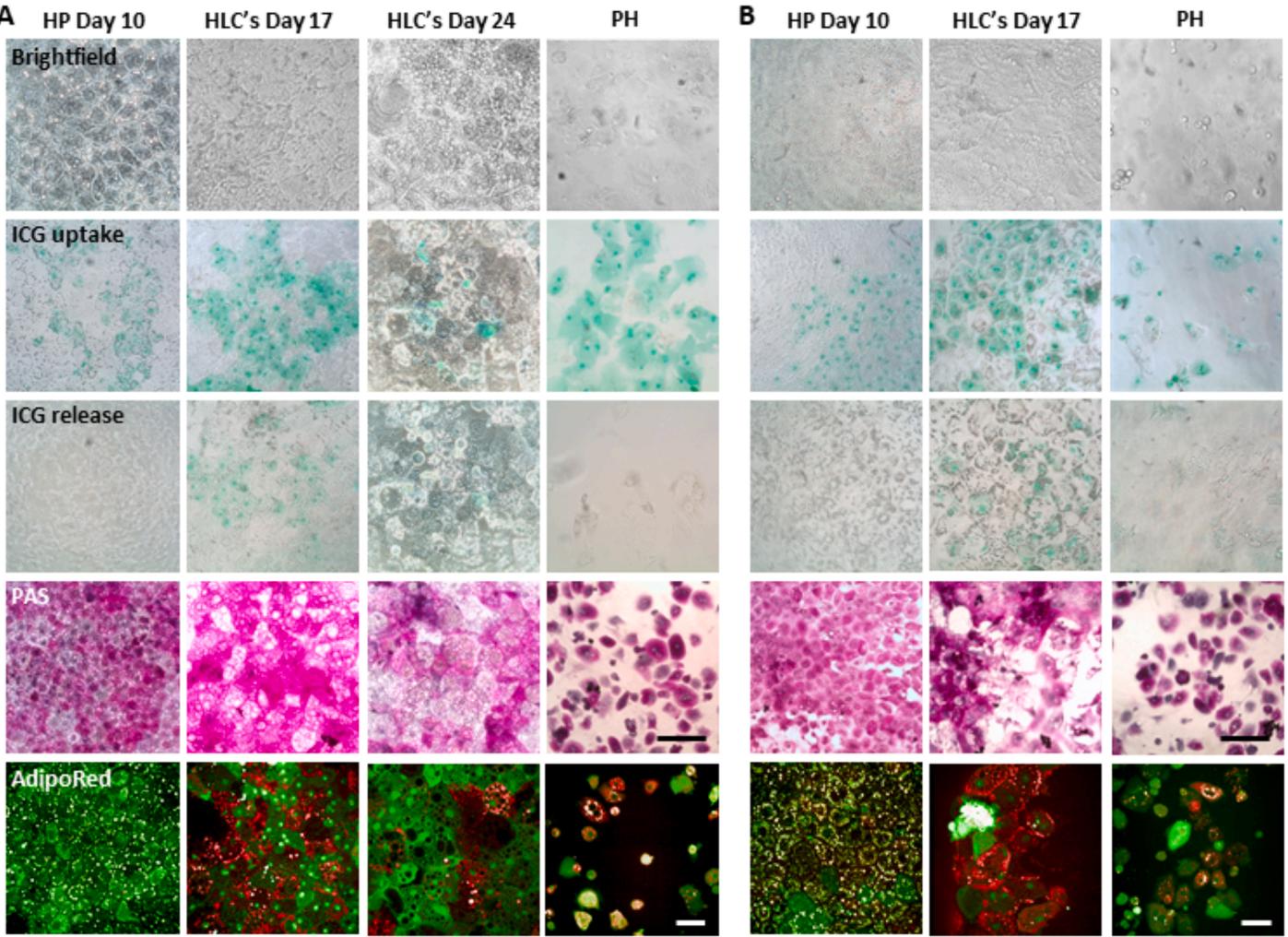
图6. hiPSC来源的HLC在96孔板(A)和384孔板(B)中的功能特征评估。明场图像显示96孔板(A)中培养10、17和24天后以及384孔板(B)中培养10和17天后HLC的形态。PAS染色显示96孔板(A)中培养10、17和24天后以及384孔板(B)中培养10和17天后原代肝细胞、PHH和HLC的糖原储存情况。AdipoRed™检测显示96孔板(A)中培养10、17和24天后以及384孔板(B)中培养10和17天后原代肝细胞、HP和HLC的细胞内甘油三酯储存。ICG摄取实验显示96孔板(A)中培养10、17和24天后以及384孔板(B)中培养10和17天后原代肝细胞、HP和HLC的肝脏摄取功能。比例尺= 500 µm适用于明场、PAS和ICG检测,比例尺= 50 µm适用于AdipoRed™检测。
总之,解冻后3天起,中间态冷冻类器官的CYP3A4表达快速恢复至与非冷冻对照组相当的水平;而在第21天冷冻的类器官则恢复不佳,其表达水平始终低于非冷冻对照组。
通过肝细胞特异性引物(包括HNF4A、AFP、TTR(HP特异性)、ALB、CYP2C9和CYP3A4(HLC特异性)的qRT-PCR对冻存类器官进行进一步表征(图8A和附图3A)。在分化第8天至第21天期间,无论是第8天冻存的类器官还是未冻存的对照组,均观察到未成熟HP标志物及更成熟HLC标志物的增加(图8A)。3D培养中基因表达的发展进程与2D样本的qRT-PCR数据具有可比性(图4A)。HP特异性标志物水平持续上升至第15天,随后随成熟度增加而下降;HLC特异性标志物表达则从分化后期开始增强,并在第21天达到峰值。尽管冻存与未冻存类器官的基因表达总体变化趋势相似,但冻存样本的检测值持续低于对照组。唯一例外的是第21天的CYP2C9和CYP3A4,在冻存样本中观察到更高表达量(尽管标准偏差较大)(图8A)。第21天冻存的类器官在继续分化过程中显示HP标志物下降和HLC特异性标志物表达上升(附图3A)。第21天冷冻类器官,在解冻24小时后几乎检测不到标记物表达。
通过免疫细胞化学进一步验证了类器官,显示成熟肝细胞标志物的染色,包括HNF4A、AFP、ALB、A1AT和CK18。图8B展示了分化第21天时具有代表性的未冷冻与第8天冷冻类器官。除HNF4A外,所有特定标志物在两种条件下均被检测到。在解冻后第3天进行分析的第21天冷冻类器官中,仅检测到ALB和A1AT的表达,而未识别到HNF4A和CYP3A4标志物。相比之下,在原代人类肝细胞(PHH)中所有标志物均被检测到(补充图3B)。
¶ 4.讨论
原代人肝细胞(PHHs)是评估新型药物肝毒性的理想模型,并已被广泛用作体外肝脏研究体系[31]。然而其来源受限,且在体外培养时易发生功能衰退[32]。因此,源自hiPSCs的肝样细胞(HLCs)作为PHH的替代品受到科学界高度重视。目前已有诸多研究致力于开发从人多能干细胞定向诱导功能性肝样细胞的方案,其中大多采用三阶段分化模式:从hiPSCs分化为定型内胚层(DE),继而转化为肝祖细胞(HP),最终成熟为HLCs[5-7]。本研究通过建立了优化的单层培养和类器官方案,该方案通过CYP3A4报告基因系的读数、qRT-PCR、免疫细胞化学及功能测定进行了验证。
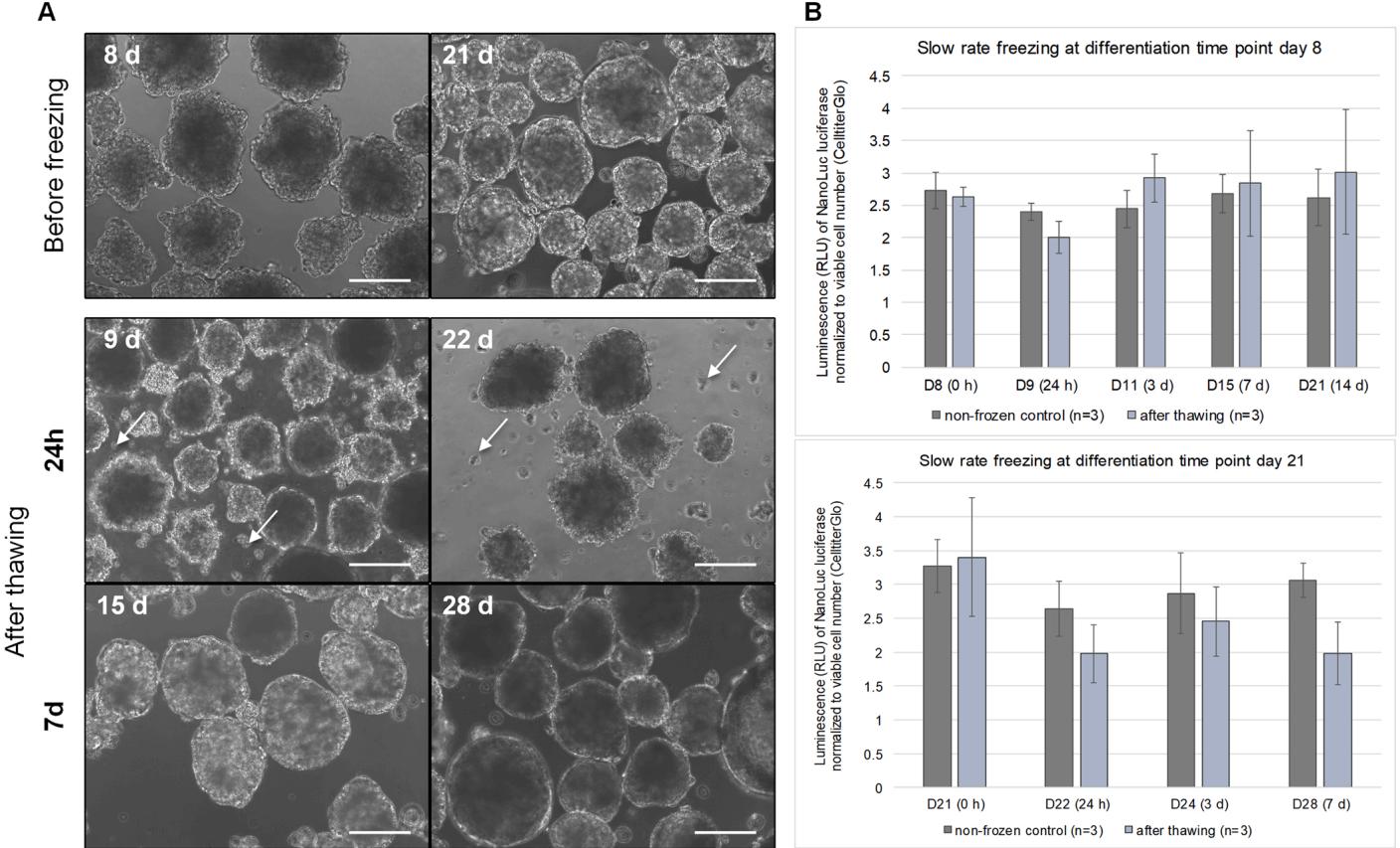
图7. 肝类器官冷冻保存前后的形态学与代谢特征。(A) 代表性肝类器官在冷冻前(分化第8天和21天)及解冻后(分别24小时和7天)的相差显微镜图像。比例尺= 200µm。(B) 在分化第8天和21天冷冻的肝类器官复苏期间,对功能性肝细胞标志物CYP3A4表达进行的代谢分析。分别于解冻后直接(8天或21天)、24小时(9天或22天)、3天(11天或24天)、7天(15天或28天)进行检测,仅对第8天冷冻的类器官额外检测解冻后14天(28天)数据。相应未冷冻对照组在对应时间点进行测量,n=3的平均值±标准差。
在验证单层细胞成功分化为HLCs后,我们对细胞施加了已知化合物。这些化合物选自Dragovic等人[33]公布的训练集,所选浓度则基于Bell及其同事[28]的研究。我们发现仅对肝毒性化合物对乙酰氨基酚和双氯芬酸会出现荧光素酶检测值的浓度依赖性下降,这表明荧光素酶报告系统功能正常,且CYP3A4阳性细胞群体对所用化合物具有浓度依赖性敏感。值得注意的是,在相同药物测试浓度下,常用的CelITiter-Glo检测法除最高浓度的双氯芬酸外均未显示细胞死亡存在显著差异。因此,与检测ATP水平的CellTiter-Glo法相比,Nano-Glo检测读数(CYP3A4表达)对这些药物具有更高敏感性。这印证了我们建立的CYP3A4报告细胞系作为肝细胞特异性检测读数的价值。
¶ 4.1.HTS 微型化
尝试使用冷冻保存的DE细胞在96孔板和384孔板中进一步成熟,以实现HTS方案的微型化。在成熟阶段,肝样细胞于第24天在96孔板中形成均匀的多角形细胞单层,而在384孔板中,细胞呈现成纤维细胞形态,并在17天后出现脱落倾向。尽管如此,在两种培养形式中,肝样细胞成熟过程中ALB、CYP3A4等肝样细胞标志物的表达均有所增强。而甲胎蛋白(AFP)和肝细胞核因子4α(HNF4A)等肝前体细胞标志物的表达出现下降。此外,研究发现从培养第10天开始,96孔板中已同时存在肝前体细胞和肝样细胞的特异性标志物。这些肝样细胞在培养第17天即表现出多种功能性肝脏特征,如糖原与甘油三酯储存、吲哚菁绿摄取与释放功能。然而,相较于原代肝细胞,肝样细胞的标志物表达水平较低,脂质/糖原储存能力及吲哚菁绿摄取释放功能相对薄弱,仍需进一步优化以促进其成熟度。此外,在研究促进肝细胞成熟的化合物时,应重点关注其对细胞成熟均质性的影响一一因为部分细胞群体并未展现一致的表型或功能特征。
¶ 4.2. 冷冻保存3D肝脏中间体,节省时间
在生物医学研究中,尤其是毒性研究领域,对源自hiPSCs的诊断相关、快速可得且即用型功能性3D细胞系统的需求正持续增长[10]。然而肝类器官的分化与成熟过程耗时较长,且终产物在下游实验中的保质期有限。为实现该3D细胞系统的库存储备,或通过冷冻中间态加速生产流程,我们针对肝类器官的低温保存与复苏进行了研究。
解冻24小时后,如图7和图8所示的形态学特征、基于发光的CYP3A4表达分析及基因表达模式表明,在两个分化阶段冷冻的类器官均保持经历冷冻损伤机制。对于单细胞,现有两种成熟的冷冻保存方案:慢速冷冻法与玻璃化法。Magalh˜ aes等人通过对比分析发现,在大鼠原代肝细胞经过慢速冷冻与玻璃化处理后,玻璃化处理的细胞聚集体表现出更低的冷冻损伤[24]。我们在iPSC来源肝类器官的初步研究中,解冻24小时后未观察到慢速冷冻与玻璃化处理类器官的形态学差异(数据未显示)。鉴于玻璃化方案目前存在通量限制[23],且现有实验室基础设施专为具备自动化潜力的慢速冷冻方案设计,我们选择聚焦后者以实现大规模操作并最大化生物质产量。在单细胞受控冷冻过程中,细胞外冰晶形成发生于−5℃至约−15◦℃区间[34]。根据Mazur提出的双因子假说[35],细胞能否成功冻存取决于与其类型相匹配的最优冷却速率。由于细胞内过冷水的化学势高于细胞外冻结溶液,细胞会脱水并避免溶质被浓缩,从而形成平衡状态[36]。当冷却和解冻速率{v*}不适宜时,
可能发生致命的低温损伤,例如细胞膜或细胞骨架的机械性破裂、DNA断裂,以及因细胞内冰晶形成、渗透压应激或冷冻保护剂细胞毒性引发
的生化改变[34, 37–40]。
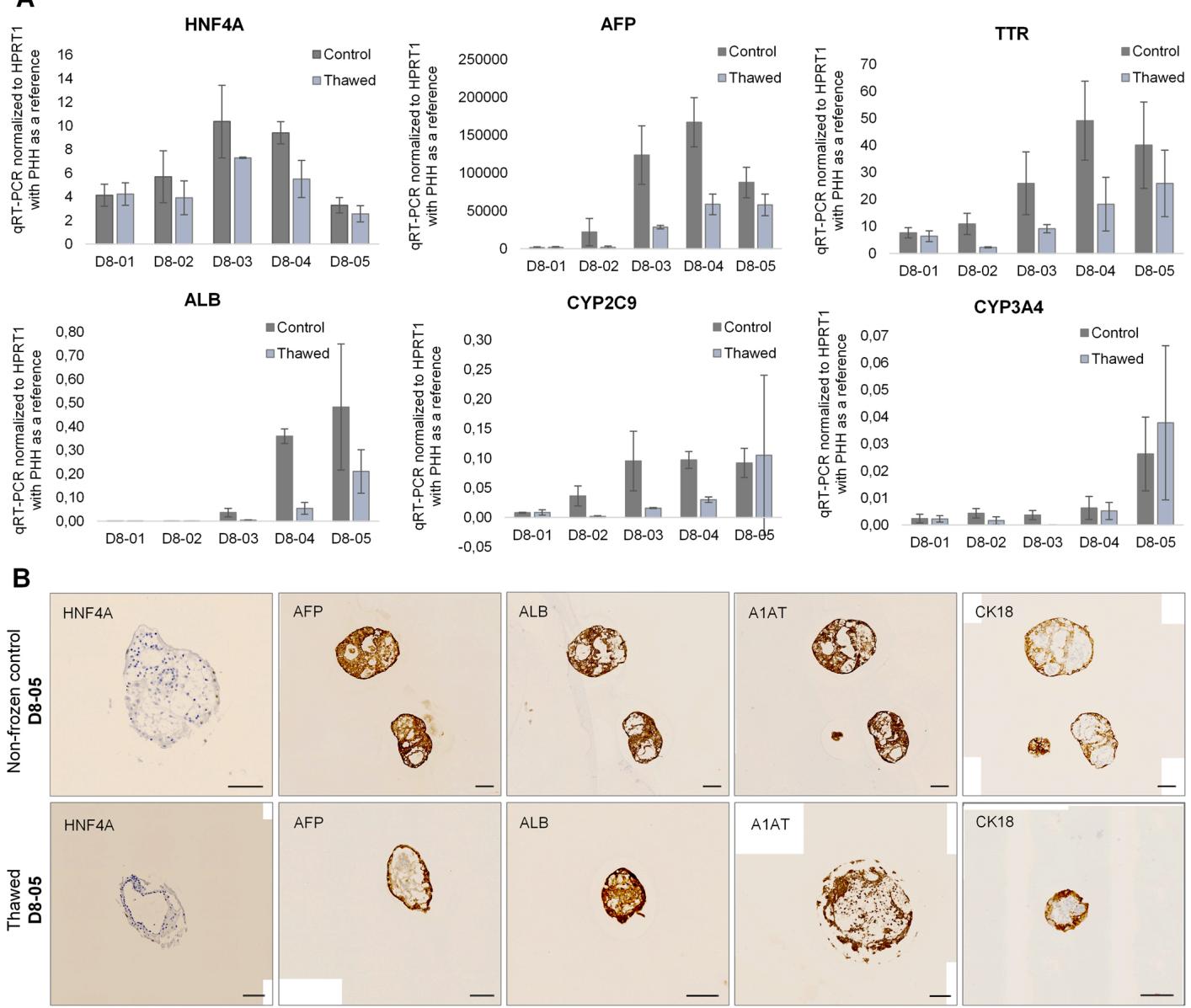
图8. (A) 通过RT-qPCR检测相关肝脏标志物(HNF4A、AFP、TTR、ALB、CYP2C9和CYP3A4)对未冷冻及第8天冷冻类器官进行验证。类器官在从第8天至第21天的不同分化时间点进行分析(D8–01:解冻后0小时,D8–02:解冻后24小时,D8–03:解冻后3天,D8–04:解冻后7天,D8–05:解冻后14天),数据表示为均值±标准差,n=3。(B) 解冻21天后未冷冻及第8天冷冻类器官的代表性免疫细胞化学图像,显示不同肝细胞特异性标志物包括HNF4A、AFP、ALB、A1AT和CK18。比例尺=100 µm。
与单细胞相比,类器官改变的生物学特性(如细胞类型的多样性、细胞密度和细胞间相互作用)会显著影响3D系统的完整性,从而影响冷冻与复苏的成功率[15,17]。由于不均匀的热质传递会产生有害的温度梯度和渗透压梯度,非最优的降温或复苏速率可能导致不受控的冰晶形成、细胞内外部牵引力以及代谢应激,最终引发严重冷冻损伤,例如膜结构与细胞连接破裂、细胞骨架结构破坏等[37]。类器官内受损的细胞区域会危及其结构完整性—一这是维持活力和功能的关键要素[15,41-43]。随着机械应力和渗透压应激因素的增强,细胞在复苏过程中,由于凋亡相关蛋白(如半胱天冬酶蛋白酶)的激活,会诱导细胞发生凋亡[44-46]。多项研究已表明,冷冻保存会通过诱导细胞在解冻后24小时内发生凋亡性死亡,从而降低代谢活性、细胞存活率和粘附潜能[47-49]。然而,冷冻保存与细胞凋亡之间的相关性,尤其在3D细胞系统中尚未被完全阐明。我们根据细胞碎片及CYP3A4表达下调的研究发现,证实了解冻后24小时因冷冻损伤机制引发的细胞凋亡。为验证冷冻前后类器官群体的构成保持不变,我们将单个类器官以多孔板形式进行慢速冷冻(数据未显示)。分析表明每个类器官最初均能存活,但在解冻24小时后出现细胞损失。不过,这些平板实验与本文提出的悬浮培养方法之间的可转换性,仍需在未来研究中加以验证。
在中间状态(第8天)冷冻的类器官在解冻3天后显示出更高的存活率及CYP3A4表达。由此可推断,其代谢活性已成功恢复并能进一步成熟。在后期恢复时间点(7天和14天,图7B),类器官直径增大,代谢标志物表达量与未冷冻对照组相近,细胞存活率约为冷冻前的43%,但冷冻样本在生物学重复实验中的标准差较大。
在复苏过程中,冷冻第21天的类器官CYP3A4表达量始终低于未冷冻对照组。其表达水平在解冻后24小时仍维持相似状态,这意味着功能性肝细胞标志物活性的恢复效果不如中间状态(第8天)冷冻的样本。这一假设得到以下证据支持:解冻后一天复苏期间,第21天冷冻类器官中代表性肝细胞标志物的基因表达显著下降(附图3A)。相比之下,根据成熟状态评估,第8天冷冻类器官的所有基因标志物表达在解冻后均再次提升,并与未冷冻对照组发展轨迹相似。但总体表达水平仍低于未冷冻对照组(图8A)。此外,在解冻后14天的第8天冷冻类器官中检测到肝细胞特异性ICC标志物AFP、ALB、A1AT和CK18(图8B),而在解冻后3天的第21天冷冻类器官中仅部分检测到低表达率的这些标志物(附图3B)。这些结果也证实了以下假设:中间状态冷冻类器官比成熟期冷冻类器官在功能性蛋白活性方面具有更成功的恢复效果。
这可通过分化诱导的3D系统形态和结构完整性变化来解释。由肝细胞样细胞(HLCs)组成的成熟类器官比第8天由肝祖细胞(HPs)组成的中间阶段类器官具有更致密的形态结构[50]。这表明随着分化和成熟程度的提高,HLCs会增强细胞间相互作用。快速冷冻诱导的渗透调节过程(如渗透驱动的水分子扩散)可导致质膜破裂,使细胞外冰晶得以扩展。这些结构变化会破坏对类器官完整性和功能至关重要的细胞间连接。由于成熟类器官中细胞连接紧密,水分子和溶质跨膜扩散以及冷冻保护剂的添加与去除更受限制,从而加剧类器官内部有害的渗透梯度与毒性效应。Acker等研究表明,与悬浮或贴壁单细胞相比,具有细胞间连接的细胞群内冰晶形成更为迅速[21]。多项研究指出细胞间接触会提高相邻细胞冰核形成的概率[20,21,51-53]。Higgins与Karlsson(2013)提出假说认为,细胞间冰晶渗透是通过相邻细胞紧密连接中的纳米级孔隙发生的,从而增加邻近细胞胞内冰晶形成的可能性[20]。其结果是,为减轻冷冻保存损伤所需的快速脱水过程及细胞骨架适应性调节由于细胞内冰晶快速形成,在密集排列的类器官中,诸如躲避细胞间冰晶等效应变得更具挑战性。
因此,在现有冷冻条件下,针对代谢酶CYP3A4的表达以及肝细胞特异性标志物的基因与蛋白表达水平,第21天类器官的保存尚无法令人满意地实现。祖细胞类器官仅呈现低度成熟状态,且细胞间相互作用可能较弱,因此冷冻保存肝脏祖细胞类器官或将成为建立高质量、有活性的肝脏3D细胞中间体生物样本库的可行途径。
¶ 5.结论
生物医学研究(例如药物开发)对稳健且可重复的肝细胞疾病建模系统的需求日益增长。为提升高通量平台中药物毒性检测的灵敏度与速度,我们提出了从hiPSCs中优化生成并微型化基因编辑的CYP3A4纳米荧光素酶报告基因HLC系,用以监测其成熟度。针对肝细胞的高需求,我们成功将2D方案转化为基于悬浮生物反应器的类器官3D规模化生产体系。此外,为实现即用型2D/3D肝系统的快速制备,对单细胞及类器官实施了可控冷冻保存。早期肝祖细胞及其衍生的类器官在复苏过程中均能保持表型,并恢复基因与蛋白标志物表达。据此,肝中间阶段冷冻类器官(第8天)的冻存可作为推进毒性研究的省时方案。然而目前对更成熟类器官(第21天)的保存尚难令人满意,仍需进一步优化步骤。
¶ 致谢
本研究由创新药物计划2(IMI2)联合执行体(JU)在“EBiSC2”资助协议(编号821362)下提供资金支持。该联合执行体获得欧盟“地平线2020”科研与创新计划及欧洲制药工业协会联盟(EFPIA)的资助。
CYP报告株系的生成得到了丹麦高等教育与科学部的资助,资助号为DK-1034-00006B。
¶ 附录A.补充信息
本文的补充数据可在网络版中查看,doi号码为10.1016/j.reprotox.2022.05.005。
¶ 参考文献
[1]D.P.Williams,《应用类肝细胞增强药物发现中的肝脏安全性风险评估》,英国皇家学会哲学汇刊B辑:生物科学373(2018),20170228,htps://doi.org/10.1098/rstb.2017.0228。
[2]P.B.Watkins,《药物安全科学与药物开发瓶颈》,临床药理学与治疗学89(2011)788-790,htps://doi.org/10.1038/clpt.2011.63。
[3]易凡、刘光慧、Juan Carlos Izpisua Belmonte,《人诱导多能干细胞来源的肝细胞:为疾病建模、药物开发和细胞治疗带来新希望》,蛋白质与细胞3(2012)246-250,https://doi.org/10.1007/s13238-012-2918-4。
[4] M.Subba Rao、M.Sasikala、D.Nageshwar Reddy,《突破肝脏局限:诱导多能干细胞在肝脏领域的应用》,世界胃肠病学杂志19(2013)3385-3396,htps://doi.org/10.3748/wjg.v19.i22.3385。
[5]N.R.F.Hannan、C.P.Segeritz、T.Touboul、L.Vallier,《从人多能干细胞制备类肝细胞》,自然实验手册8(2013)430-437,htps://oi.org/10.1038/nprot.2012.153。
[6]A.Carpentier,I.Nimgaonkar,V.Chu 等.人多能干细胞在适于高通量筛选的微型化体系中肝向分化.干细胞研究.16(2016)640-650.https:/doi.org/10.1016/j.scr.2016.03.009.
[7]杜超,冯源,邱东旭等.通过纯小分子鸡尾酒方案实现人多能干细胞高效快速肝向分化.干细胞研究与治疗.9(2018)58.htps://doi.org/10.1186/s13287-018-0794-4.
[8] G.PetinatoR.Ramanathan,R.A.Fisher等.通过直接抑制Wnt/β-连环蛋白通路将人iPSCs在基于多细胞球体的3D培养中可扩展分化为肝样细胞.科学报告.6(2016)32888.htps://doi.org/10.1038/srep32888.
[9]G.Pettinato,S.Lehoux,R.Ramanathan 等.将人诱导多能干细胞与内皮细胞混合生成全功能肝样类器官.科学报告.9(2019)8920.htps://doi.org/10.1038/s41598-019-45514-3.
[10] J.Kim,B.K.Koo,J.A.Knoblich.人类类器官:人类生物学与医学的模型系统.自然综述分子细胞生物学.21(2020) 571-584. https:/doi.org/10.1038/s41580-020-0259-3.
[11] M.Huch,B.K. Koo.利用类器官培养模拟小鼠和人类发育.发育.142(2015)3113-3125.htps://doi.org/10.1242/dev.118570.[12]D.Wendt,S.A.Riboldi,M.Cioffi等.生物反应器在3D细胞培养与组织制造中的潜力与瓶颈.先进材料.21(2009)3352-3367.https:/doi.org/10.1002/adma.200802748.
[13]M.N.Doulgkeroglou,A.Di Nubila,B.Niessing 等.细胞产品制造的自动化、监控与标准化.生物工程与生物技术前沿.8(2020)811.htps:/doi.org/10.3389/fbioe.2020.00811.
[14]郭志强,I. Sebastien,K.Hariharan 等.iPSCs及其多谱系衍生物的可扩展扩增.生殖毒理学.(2022).https://doi.org/10.1016/j.reprotox.2022.05.007.
[15]M.J.Taylor,B.P.Weegman,S.C.Baicu等.细胞、组织及器官冷冻保存的新方法.输血医学与治疗学.46(2019)197-215.htps://doi.org/10.1159/000499453.
[16] E.E.Guibert,A.Y.Petrenko,C.L.Balaban 等.器官保存:当前理念与未来十年新策略.输血医学与治疗学.38(2011) 125-142.https://doi.org/10.1159/000327033.
[17]石明,冯硕,张欣等.基于微滴玻璃化冷冻技术的细胞聚集体保存:数值分析.医用材料力学行为杂志.82(2018)383-393.https://doi.org/10.1016/j.jmbbm.2018.03.026.
[18] J.P.Acker.细胞与工程化组织的生物保存.生物化学工程与生物技术进展.103(2007)157-187.htps://doi.rg/10.1007/b137204.
[19] J.O.Karlsson,M.Toner.低温保存实现组织长期储存的关键问题.生物材料.17(1996)243-256. htps://doi.0rg/10.1016/0142-9612(96)85562-1.
[20]A.Z. Higgins,J.O.M.Karlsson.细胞连接蛋白表达对小鼠胰岛素瘤细胞胞内冰晶形成的影响.生物物理学报.105 (2013)2006-2015. htps://doi.org/10.1016/j.bpj.2013.09.028.
[21] J.P.Acker,A.Larese,H. Yang等.细胞相互作用影响胞内冰晶形成.低温生物学.38(1999)363-371.https://doi.org/10.1006/cryo.1999.2179.
[22]A.Hubel,T.B.Darr.冷冻保存肝细胞聚集体的解冻后功能与半胱天冬酶活性.细胞保存技术.2(2004)164-171.htps://doi.org/10.1089/cpt.2004.2.164.
[23]R.Magalhaes,王学文,S.S.Gouk等.玻璃化法成功保存肝细胞球状体.细胞移植.17(2008)813-828.https://doi.org/10.3727/096368908786516765.
[24]R.Magalhaes,B.Nugraha,S.Pervaiz等.细胞培养构型对大鼠原代肝细胞冷冻保存后存活率的影响.生物材料.33(2012)829-836.https://doi.org/10.1016/j.biomaterials.2011.10.015.
[25]R.Magalhaes,P.R.Anil Kumar,温方明等.应用玻璃化技术在胶原涂层聚对苯二甲酸乙二醇酯表面保存大鼠原代肝细胞单层用于混合型肝支持系统.生物材料.30 (2009)4136-4142.https://doi.org/10.1016/j.biomaterials.2009.04.037.
[26]A.Sharma,J.C.Bischof,E.B.Finger.用于再生医学的肝脏冷冻保存技术.再生工程与转化医学.7(2021)57-65.https:/doi.org/10.1007/s40883-019-00131-4.
[27]M.P.Nguyen,V.Jain,V.Iansante等.肝细胞移植的临床应用:现状、适用性、局限性与未来展望.胃肠病学与肝病学专家评论.14 (2020)185-196.htps://doi.org/10.1080/17474124.2020.1733975.
[28]A.Rezania,J.E.Bruin,P.Arora等.利用体外从人多能干细胞衍生的胰岛素生成细胞逆转糖尿病.自然生物技术.32(2014)1121-1133.https://doi.org/10.1038/nbt.3033.
[29]C.C.Bell,A.C.A. Dankers,V.M. Lauschke 等.P.Williams,A.W.M.van de Ven,F.Jacobs,J. van Houdt,T.Lahteenmaki,J. Snoeys, S.Juhila,L.Richert,M.Ingelman-Sundberg,肝脏2D夹心培养与3D球状体在长期毒性应用中的比较:一项多中心研究,毒理学科学:毒理学会官方期刊162(2018)655-666,https://doi.org/10.1093/toxsci/kfx289.
[30]P.D.Berk,W.Stremmel,有机阴离子的肝细胞摄取,肝脏疾病进展8(1986)125-144,https://doi.org/10.1016/j.taap.2006.11.015.
[31] S.D.Collins,G. Yuen,T.Tu,M.A.Budzinska,K.Spring,K.Bryant,N.A.Shackel,体外肝脏模型:疾病建模、药物发现与临床应用,见:J.E.E.Timitz-Parker(编),肝细胞癌,科顿出版社,布里斯班,2019.
[32]C.Hu,L.Li,离体培养原代肝细胞与干细胞来源肝样细胞用于肝脏再生,蛋白质与细胞6(2015)562-574,htps:/doi.org/10.1007/s13238-015-0180-2.
[33] S.Dragovic,N.P.E.Vermeulen,H.H. Gerets,P.G.Hewitt, M.Ingelman-Sundberg,B.K.Park, S.Juhila,J.Snoeys,R.J.Weaver,基于证据的机制整合预测人体药物性肝损伤训练化合物筛选,毒理学档案90(2016)2979-3003,https://doi.org/10.1007/s00204-016-1845-1.
[34]P.Mazur,超最佳速率冷冻过程中细胞内冰晶形成对细胞死亡的作用,低温生物学(1977)251-272,htps://doi.org/10.1016/0011-2240(77)90175-4.
[35]P.Mazur,S.P.Leibo,E.Chu,冷冻损伤的双因子假说,实验细胞研究71(1972)345-355,htps://doi.org/10.1016/0014-4827(72)90303-5.
[36]P.Mazur,亚零温度下细胞水分流失动力学与细胞内冷冻可能性,普通生理学杂志47(1963)347-369,https://doi.org/10.1085/jgp.47.2.347.
[37] A. Chatterjee,D.Saha,H.Niemann,O.Gryshkov,B.Glasmacher,N.Hofmann,冷冻保存对细胞表观遗传谱系的影响,低温生物学74(2017)1-7,https://doi.org/10.1016/j.cryobiol.2016.12.002.
[38] C.Lin,S.Tsai,冷冻保存对脊椎动物DNA损伤、基因表达及蛋白丰度的影响,意大利动物科学杂志11(2012),e21,htps://doi.org/10.4081/ijas.2012.e21.
[39]M.G.Larman,M.G. Katz-Jaffe,B.McCallie,J.A.Filipovits,D.K. Gardner,小鼠囊胚冷冻保存后全局基因表达分析,人类生殖26(2011) 2672-2680,htps://doi.org/10.1093/humrep/der238.
[40]J.E.Lovelock,甘油抗冷冻解融溶血保护作用机制,生物化学与生物物理学报11(1953)28-36,https:/doi.org/10.1016/0006-3002(53)90005-5.
[41] M.J. Taylor, D.E. Pegg,冰晶形成对-21℃与-60℃储存平滑肌组织功能的影响,低温生物学 (1983)36–40, https://doi.org/10.1016/0011-2240(83)90057-3.
[42] W.de Loecker,V.A.Koptelov,V.I.Grischenko,P.de Loecker,细胞浓度对冷冻保存期间存活率与代谢活性的影响,低温生物学37(1998)103-109,htps://doi.org/10.1006/cryo.1998.2106.
[43]C.J. Hunt, M.J. Taylor, D.E.Pegg,冷冻置换与等温冷冻固定研究阐明252K(-21◦℃)下平滑肌冰晶形成模式,显微镜学杂志 125 (1982) 177–186, https://doi.org/10.1111/j.1365-2818.1982.tb00335.x.
[44] V.P.Vanhulle,A.M.Neyrinck,J.M.Pycke,Y.Horsmans,N.M.Delzenne,冷冻保存后肝组织代谢紊乱中凋亡信号通路作用:大鼠精密肝切片研究,生命科学78(2006)1570-1577,https://doi.org/10.1016/j.lfs.2005.07.036.
[45] A. Bissoyi, K. Pramanik,凋亡通路在脐带血间充质干细胞冷冻保存诱导细胞死亡中的作用,生物保存与生物样本库 (2014) 246–254, https://doi.org/10.1089/bio.2014.0005.
[46] R. Fujita, T. Hui, M. Chelly, A.A. Demetriou,抗氧化剂与半胱天冬酶抑制剂对冷冻大鼠肝细胞的影响,细胞移植 14 (2005) 391–396, https://doi.org/10.3727/000000005783982981.
[47] S. Bahsoun, K. Coopman, E.C. Akam,冷冻保存对人骨髓来源间充质干细胞影响的定量评估:解冻后24小时及更长期限,干细胞研究与治疗 11 (2020) 540, https://doi.org/10.1186/s13287-020-02054-2.
[48] J.M. Baust, R. van Buskirk, J.G. Baust,抑制冷冻保存诱导的细胞凋亡可改善细胞存活率,体外细胞与发育生物学:动物 36 (2000) 262, https://doi.org/10.1290/1071-2690(2000)036<0262:cvifio>2.0.co;2.
[49] C. Terry, R.D. Hughes, R.R. Mitry, S.C. Lehec, A. Dhawan,冷冻保存诱导人肝细胞不贴壁:黏附分子作用,细胞移植 16 (2007) 639–647, https://doi.org/10.3727/000000007783465000.
[50] S.J. Mun, J.S. Ryu, M.O. Lee,C.R. Jung, K.S. Chung, M.J. Son,可扩增人多能干细胞来源肝样肝类器官的构建,肝脏病学杂志 (2019) 970–985, https://doi.org/10.1016/j.jhep.2019.06.030.
[51] W.K. Berger, B. Uhrik,唾液腺细胞链中单个细胞的冷冻诱导收缩与细胞内冰晶的细胞间传播,实验生物学 (1996)843–850, https://doi.org/10.1007/BF01938868. [52] M.S. Brown, F.W. Beuter,非木质植物组织的冷冻,低温生物学 (1974) 184–186, https://doi.org/10.1016/0011-2240(80)90025-5.
[53] R.C. Mc Leester, C.J. Weiser, T.C. Hall,多重冰点作为植物茎存活率测试 1968,植物生理学 (1969) 37–44, https://doi.org/10.1104/pp.44.1.37. [54] K. Cameron, R. Tan, W. Schmidt-Heck, G.Campos, M.J. Lyall, Y. Wang, B. Lucendo-Villarin, D. Szkolnicka, N. Bates, S.J. Kimber, J.G. Hengstler, P. Godoy, S.J. Forbes, D.C. Hay,重组层粘连蛋白驱动hESC来源肝细胞的分化与自组织,干细胞报告 5 (2015) 1250–1262, https://doi.org/10.1016/j.stemcr.2015.10.016.