¶ hiPSC 衍生心球的分化和解离的完整工作流程
本杰明·费舍尔a,1,安娜·迈尔a,2,1,安妮卡·德恩a,阿西姆·萨尔霍特拉a,3,陶·安·陈a,萨沙·诺伊曼a,4,卡塔琳娜·施密特a,伊娜·迈瑟a,朱莉娅·C·诺伊鲍尔a,b,海科·齐默尔曼a,b,c,d,卢卡·詹蒂莱a,e,f,⁎,5
a 弗劳恩霍夫生物医学工程研究所,Joseph-von-Fraunhofer-Weg 1, Sulzbach 66280, 德国
b 弗劳恩霍夫干细胞工艺工程项目中心,Neunerplatz 2, Würzburg 97082, 德国
c 萨尔大学,Gebäude A, Saarbrücken 66123, 德国
d 北方天主教大学,Larrondo 1281,Coquimbo 1780000, 智利
e 凯泽斯劳滕应用科技大学,Zweibrücken校区,Building
f 哈瑟尔特大学,Diepenbeek校区,Diepenbeek 3590, 比利时
G Amerikastr. 1, Zweibrücken 66482, 德国
关键词:hiPSCs 心肌细胞 心脏诱导 3D生物反应器 木瓜蛋白酶解离
¶ 摘 要
由人类诱导多能干细胞(hiPSC-CMs)衍生的心肌细胞是基础和转化心血管研究中无价的工具。这些细胞在治疗、疾病建模和药物发现中的潜力受到几个瓶颈的阻碍,这些瓶颈目前限制了心脏诱导的产量和效率。在此,我们提出了一种在动态悬浮生物反应器中生产可直接使用的hiPSC-CMs的完整工作流程。这包括将hiPSCs高效且高度可重复地分化为心球,与悬滴中的静态3D诱导相比,心球表现出增强的生理成熟度,以及一种新型的基于木瓜蛋白酶的解离方法,其产量和活力均高于广泛使用的解离试剂TrypLE和Accutase。解离后重新播种的心肌细胞的分子和功能分析证实了细胞的身份和功能性,这些细胞可以在下游应用中使用,无论是作为单层还是球体。
¶ 1. 介绍
由人类诱导多能干细胞(hiPSC-CMs)衍生的心肌细胞是药理学测试、疾病建模和心脏组织工程的患者特异性心脏细胞的极佳来源。近年来,已经完成了显著的工作,以识别在体外重现人类心脏发育所需的条件。经典Wnt通路的顺序激活和抑制被证明在中胚层特异化和终末心肌细胞分化中起关键作用(Burridge et al., 2015; Zhang et al., 2015)。这使得hiPSC-CMs的生产成为许多心血管领域的常规程序。然而,传统的二维或静态三维培养系统不适合中到大规模生产hiPSC-CMs。另一个限制是心脏诱导的效率,这取决于操作员和细胞系的差异性。这促使人们努力转向可扩展的悬浮培养系统中的心脏诱导,以实现更高程度的自动化(Chen et al., 2015; Kempf et al., 2014)。此外,动态悬浮中的分化具有提供细胞3D微环境的巨大优势,这种环境促进了更高的生理成熟,因为它允许更好的细胞间相互作用和空间组织(Pampaloni et al., 2007)。然而,这也带来了生成球体的问题,与传统2D单层细胞方法相比,这些球体更难以解离用于下游应用。在这项研究中,我们使用了一种台式、小型悬浮生物反应器(BioLevitator;BL,现在叫CERO)来生产来源于hiPSC的心球。这些心球显示出比悬滴(HD)获得的心球更高的成熟度。结合动态3D心脏诱导和一种新型的基于木瓜蛋白酶的解离方案,该方案始终比广泛使用的试剂TrypLE和Accutase产生更高的细胞数量和活力,我们建立了一个完整的工作流程,用于生产hiPSC-CMs以用于任何下游应用。
¶ 2. 材料和方法
¶ 2.1. hiPSCs 维护
使用了两条hiPSC细胞系:UKBi005,来自欧洲诱导多能干细胞库,以及IBMT1,使用来自BJ成纤维细胞(ATCC #CRL-2522)的mRNA(Stemgent #00-0071)在内部重编程。根据制造商的说明,细胞在涂有生长因子减少的Matrigel(Corning #356231)的60 mm组织培养板中,在mTeSR1培养基(Stem Cell Technologies #8580)中维持。细胞常规使用0.5 mM EDTA pH 8.0(Invitrogen #AM9260G)在不含Ca2+和Mg2+的DPBS中传代(DPBS−/−;Gibco #14190144)。
¶ 2.2. 三维心脏诱导
心脏命运的诱导如先前所述(Zhang et al., 2015)。简而言之,70-80%汇合的hiPSCs使用TrypLE Select(Gibco #12563011)进行收获。消化通过加入1体积的mTESR1(Stemcell Technologies #8580)和10 μM ROCK抑制剂Y27632(abcam #ab120129)来终止。所得的细胞簇用移液器尖端打散成单个细胞。计数后(NucleoCounter NC-200; NC; ChemoMetec,Denmark),细胞被稀释在第0天培养基(表S1)中,浓度为7.5 × 105个活细胞/mL。最多40 mL被转移到放置在BioLevitator(BL; Hamilton, Switzerland)中的LeviTube(LT; OMNI Life Sciences #2800005)中。细胞在37°C和5% CO2下培养,以60 rpm的速度在交替方向(2秒/方向)连续旋转。24小时后,将LT放在工作台上以使小球体沉到底部。用等体积的第1天培养基(表S1)更换用过的培养基。在接下来的几天中,培养基依次更换为第2天和第3天的培养基(表S1)。从第4天开始,每隔一天用TS培养基(表S1)更换培养基。在Perfecta3D 96孔悬滴板(Sigma #HDP1096)中进行的HD心脏诱导如先前所述(Zhang et al., 2015)。通过两次更换一半滴液体积来更换培养基。
¶ 2.3. hiPSC-CMs的酶解离
心脏球体在心脏诱导8或15天后被收获用于酶解。来自1到2个LTs的球体用2 mM EDTA在DPBS−/−中洗涤两次。洗涤后,球体被酶解。木瓜蛋白酶解在37°C的水浴中进行30分钟。简而言之,将球体吸入500μLDPBS−/−中,并加入500 μL新鲜制备的2×木瓜蛋白酶溶液(表S2)。通过加入1 mL新鲜制备的2×终止溶液(表S2)来停止消化。然后通过用宽孔移液器吸头大约20次轻轻移液,将球体破坏成均匀的悬浮液。然后通过加入5 mL KO-DMEM洗涤细胞。对于使用Accutase或TrypLE的解离,将球体吸入1 mL Accutase(Sigma #A6964)或1 mL TrypLE Select(Gibco #12563011)中,并在37°C的水浴中孵育15分钟。然后通过用宽孔移液器吸头轻轻上下移液5-10次使悬浮液均质化,并通过加入5 mL KODMEM来终止反应。添加终止液。
¶ 2.4. 在NucleoCounter上测量细胞浓度和活力
从新鲜解离的心球/单层细胞悬液通过放置在50 mL管上的40 μm细胞过滤器过滤。大于40 μm的未解离聚集体从过滤器中收集,过滤器被翻转到一个新管上,并用至少3 mL KO-DMEM小心洗涤。流出液中的细胞/小簇被重悬于1–3 mL KO-DMEM中。未解离部分和流出液中的细胞浓度在NC处根据制造商的说明进行测定。为了测量细胞浓度和活力,一个体积被裂解以计数总核数,另一个体积在不裂解的情况下测量,仅允许非活细胞用DAPI染色。
¶ 2.5. 流式细胞术
为了标记用于流式细胞术分析的活细胞,1 × 106 新鲜解离的hiPSCCMs在37°C下与50 ng calcein acetox- ymethil (AM; Fisher Scientific #C1430)孵育25分钟。碘化丙啶 (PI; Fisher Scientific #P1304MP) 以1 μg/mL的最终浓度加入以标记非活细胞。流式细胞术分析使用FACSAria III (BD)进行。
¶ 2.6. 基因表达分析
样本在心脏诱导的第1到第7天或在解离后作为心球体或单层培养2-3周后收集用于基因表达分析。简而言之,RNA使用RNeasy Micro试剂盒(Qiagen #74004)按照制造商的说明提取。RNA浓度使用Nanodrop 2000(Thermo Scientific)测量。逆转录使用高容量cDNA逆转录试剂盒(Applied Biosystems #4368814)按照制造商的说明进行。基因表达通过5′-核酸酶测定(TaqMan)定量PCR(qPCR)使用QuantStudio 7 Flex系统(Applied Biosystems)和TaqMan测定(Fisher Scientific #4331182;表S3)进行测量。相对定量使用2-ΔΔCt方法计算,使用GAPDH、HPRT1和GUSB作为内源性参考进行标准化。
¶ 2.7. 免疫细胞化学
样品在4.2% PFA(Cytofix, BD #554655)中固定15分钟后,在DPBS−/−中的0.2% Triton-X-100(Roth #3051.3)中透化20分钟(细胞层)或30分钟(球体)。在封闭液(BS;表S2)中孵育30分钟后,样品在4°C下与抗肌节性α-肌动蛋白(1:200;Sigma #A7811)、连接蛋白43(1:400;Abcam #ab11370)或结蛋白(1:500;Abcam #15200)的初级抗体孵育过夜。合适的Alexa-488或Alexa-555标记的次级抗体(Life Technologies #A11034和#A21422)在BS中以1:1000稀释,并在室温下孵育1小时。DNA用DAPI(Fisher Scientific #R37605)进行复染。样品使用共聚焦荧光显微镜(Leica TCS SP8)成像;每个样品200个细胞被评分以检测所测试标记的表达。
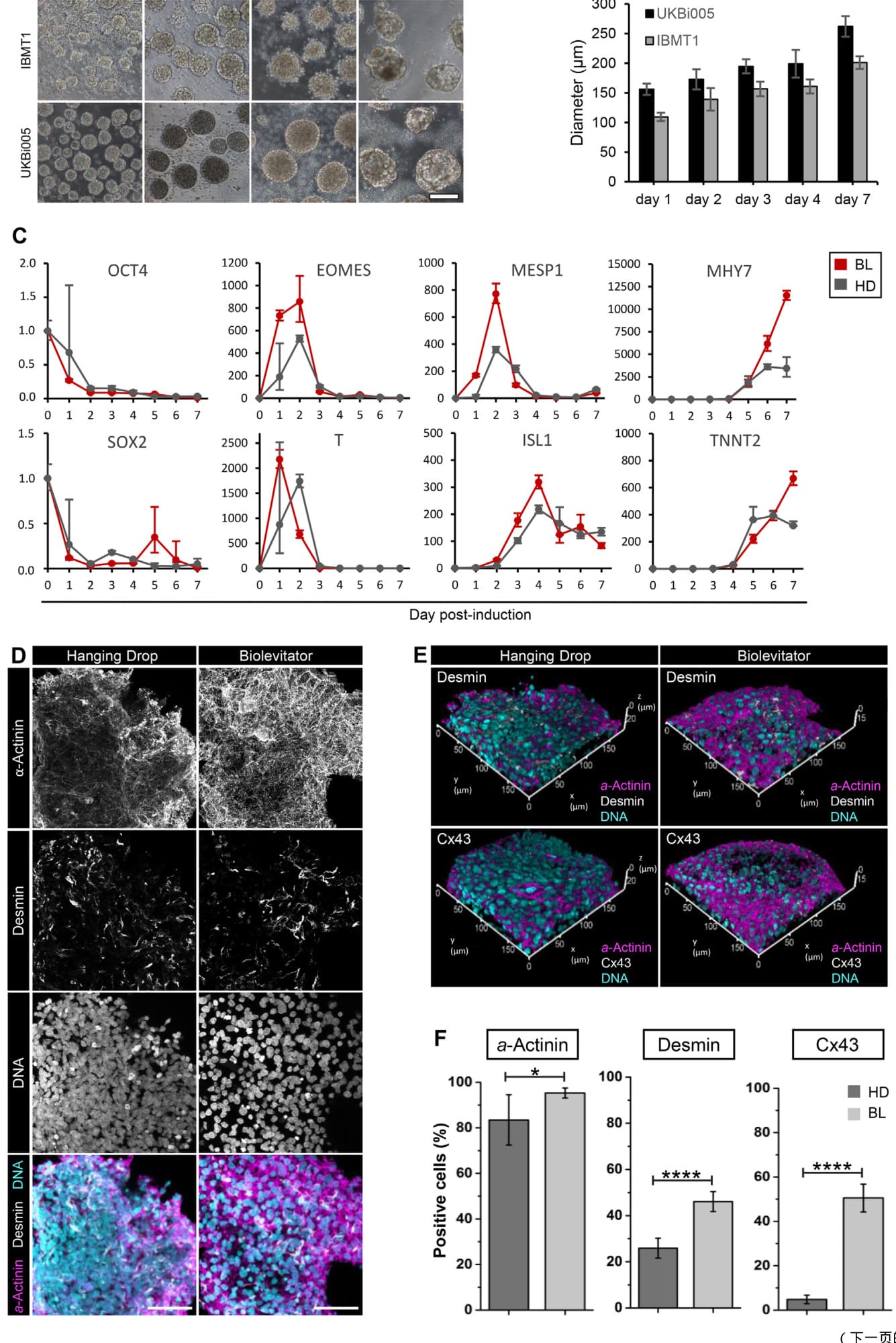
图1. 静态或动态条件下hiPSCs的3D心脏诱导。来自两个hiPSC系(UKBi005和IBMT1)的心球在不同天数(A)收获,并测量其直径(B;平均值±SEM;n = 20/天)。通过qPCR评估来源于UKBi005 hiPSCs并在BL或HD中培养的心球中多能性(OCT4, SOX2)、中胚层(T, EOMES)、心血管特异性(MESP1, ISL1)和心肌细胞分化(MYH7, TNNT2)标志物的表达。表达数据在对GAPDH, GUSB, HPRT1表达的几何平均值进行标准化后,以相对定量(2-ΔΔCt方法)呈现(C;n ≥ 3每天和每种条件)。代表性最大投影(D)和3D投影(E)为7 dpi时心球的α-肌动蛋白、肌膜蛋白和连接蛋白43免疫染色的共聚焦图像。基于D和E中呈现的免疫染色的定量分析,分析表达肌膜蛋白、连接蛋白43和α-肌动蛋白的细胞(F;平均值± SD;n = 3–6;每个重复计分200个细胞核)。A中的比例尺:200 μm。D中的比例尺:50 μm。
¶ 2.8. 统计分析
统计分析使用 GraphPad Prism 5.0 进行。计数数据通过单因素方差分析(ANOVA)和 Tukey 事后检验、Kruskal-Wallis 检验和 Dunn's 多重比较事后检验以及双尾 t 检验进行分析。当发现数据集之间的方差不同时,应用 Welch 校正。线性降维通过主成分分析实现,使用 R 中的 prcomp函数(Team, 2008)。
¶ 3. 结果与讨论
¶ 3.1. 在动态悬浮生物反应器中的心脏诱导
我们将Zhang及其同事为静态3D培养建立的心脏诱导方案(Zhang et al., 2015)改编为动态悬浮生物反应器BioLevitator(BL),以生成大量的hiPSC-CMs。使用两条hiPSC系,以密度7.5 × 105个细胞/mL接种,每管最多40 mL,经过7天的诱导后,我们平均获得1.3 ± 0.57或0.9 ± 0.43个CMs,分别对应于第0天的UKBi005或IBMT1 hiPSC输入(图1A;补充电影S1–S2)。在第7天,UKBi005或IBMT1心球的直径分别达到262.1 ±17.3 μm和215.4 ± 10.7 μm(图1B)。为了评估BL中心脏诱导的效率,我们比较了UKBi005 BL和HD球体的基因表达谱(图1C)。考虑的两个多能性标志物OCT4和SOX2在诱导后1天(dpi)下调(OCT4:在HD和BL中分别为0.68倍和0.27倍;SOX2:在HD和BL中分别为0.27倍和0.12倍)。在测试的两种条件下,介质层的特化发生在1到2 dpi之间,这由转录因子Brachyury(T)和EOMES的表达所指示。有趣的是,与BL球体(峰值在1 dpi)相比,Brachyury的表达峰值在HD球体中延迟了1天(峰值在2 dpi)。心源性中胚层标志物MESP1和心血管祖细胞标志物ISL1分别在2和4 dpi时显示出表达峰值。在BL和HD条件下,这两个标志物的表达水平存在显著差异(MESP1:在2 dpi时分别为359倍和771倍,p = .0044;ISL1:在4 dpi时分别为218倍和319倍,p = .0025)。在7 dpi时,成熟心肌细胞标志物MYH7(β-肌球蛋白重链)和TNNT2(心肌肌钙蛋白T)——两种对肌节组装至关重要的蛋白质——在BL心球中均以显著更高的水平表达(MYH7的p = .0021;TNNT2的p = .0351)。然后,我们对7 dpi时的球体进行了定量免疫细胞化学分析,针对心脏细胞的关键结构成分。我们发现BL球体含有95.3 ± 2.2%肌节α-肌动蛋白+细胞,而HD球体含有83.5 ± 11%(p = 0.0470;图1D,顶部面板;图1E;图1F,左侧面板,图S1A,B)。BL球体中脱明+细胞的百分比也显著更高(在BL和HD球体中分别为46.1 ± 4.3%和25.9 ± 4.3%;p ≤ 0.0001)(图1D,中间面板;图1E,顶部面板;图1F,中间面板,补充图S1 A)。这种中间丝蛋白在肌节的调节中很重要(Sequeira et al., 2014)。在体内,成熟的心肌细胞通过形成细胞间缝隙连接电耦合成一个功能性合胞体(Scuderi and Butcher, 2017)。我们发现表达连接蛋白43(一种主要的缝隙连接蛋白)的细胞百分比在BL球体中是HD球体(4.8 ± 1.9%;p ≤ .0001;图1E,底部面板;图1F,右侧面板,补充图S1 B)的十倍(50.5 ± 6.2%)。
总的来说,心脏诱导在静态(HD)和动态(BL)条件下都有效。然而,在分化过程中,MESP1和ISL1的表达水平较高,以及在7 dpi时心肌细胞特异性标记物的表达,表明动态诱导更为有效。此外,BL心球中的中胚层特异化比HD心球更快。与基因表达数据一致,BL心球中所需的功能性肌节组织和心肌细胞电耦合的蛋白质表达也显著更高,这表明动态培养诱导了更高水平的生理成熟。由于HD和BL培养方法都涉及3D结构的形成,BL的更好结果可能归因于由培养基流动产生的更好的氧气和营养物质分布,这可能改善了hiPSCs的心脏分化,正如其他分化途径所示(Wang et al., 2005; Li et al., 2009)。值得注意的是,为了生产在一个LT(40 mL)中获得的相同数量的心肌细胞,需要> 100 ×个96孔HD板或10个T75瓶。
¶ 3.2. 比较木瓜蛋白酶、TrypLE 和 Accutase 对 hiPSC-CMs 的解离效果
由于BL被证明是适合于3D心脏诱导的系统,我们寻找了一种有效地将球体解离为单个细胞的方法。三维细胞结构比单层更难解离,因为在单层中,每个细胞都可以同等地接触到所用的蛋白酶。酶处理必须足够有效,以实现完全解离而不造成显著的细胞损伤。我们决定测试木瓜蛋白酶的效率,这是一种来自番木瓜的半胱氨酸蛋白酶,已被证明比其他用于脑组织和涡虫的解离方法提供更高的产量和细胞活力(Brewer, 1997; Moritz et al., 2012)。我们将木瓜蛋白酶与两种广泛使用的解离试剂TrypLE和Accutase进行了比较。这两种试剂通常用于单层或3D培养中的hiPSC-CMs的解离(Zhang et al., 2015; Chen et al., 2015; Piccini et al., 2015)。为了比较这三种解离试剂的性能,我们使用两种平台评估了解离后获得的细胞悬液的产量和活力,一种是易于使用的台式细胞计数仪(Nucleocounter),另一种是流式细胞仪(FACSAria III)。
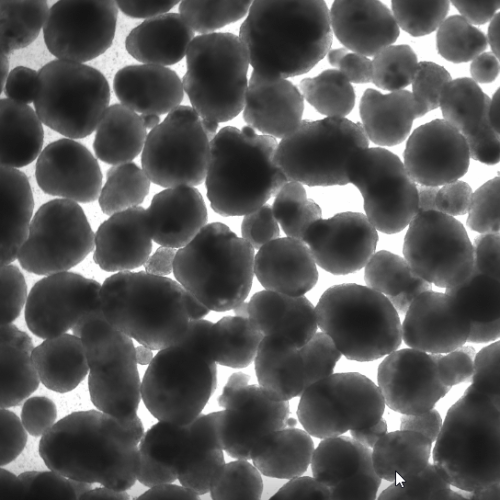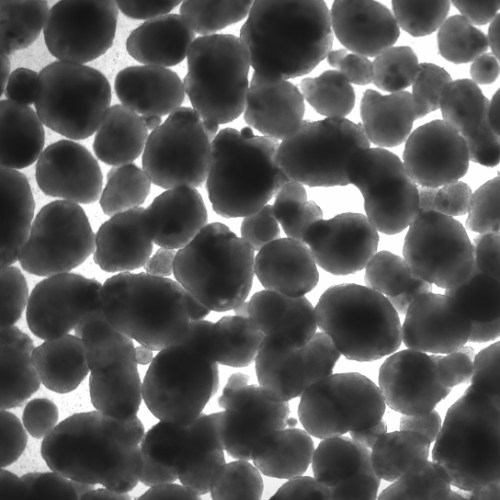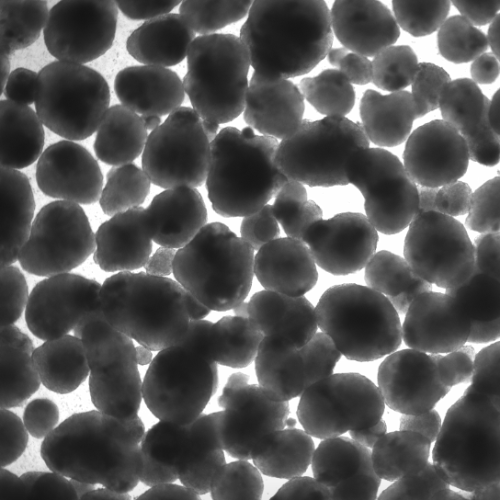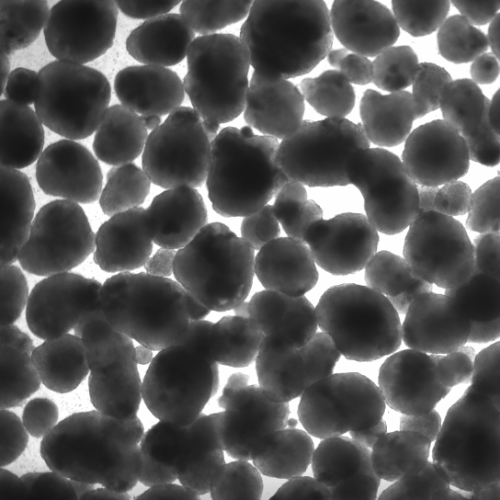
在酶处理后,通过将细胞悬液通过40 μm细胞过滤器,将单个细胞和小簇从大聚集体中分离出来;在计数之前对过滤器进行了目视检查(图2A)。随后,流出液中的细胞以及大聚集体中的细胞用NC计数。Accutase产生了57 ± 12.1%的单个细胞,TrypLE产生了76.1 ± 11.6%,而木瓜蛋白酶产生了95.3 ± 3.2%(图2B;p = 0.012)。通过使用NC的自动活力测量作为快速读数,我们计算出Accutase产生了41.5 ± 8.5%的单个活细胞,TrypLE产生了70.1 ± 10.8%,而木瓜蛋白酶产生了90.3 ± 3.7%(图2C;p = 0.0003)。
然后,我们通过流式细胞术分析了流过的组分,以精确量化单个细胞、小细胞簇和细胞碎片的比例。这些是基于它们的前向和侧向散射特性区分的,使用图2D中显示的门控策略。我们发现,处理后得到的单个细胞的百分比分别为:Accutase为33.5 ± 10%,TrypLE为45.9 ± 9%,以及74.8 ± 9.8%。
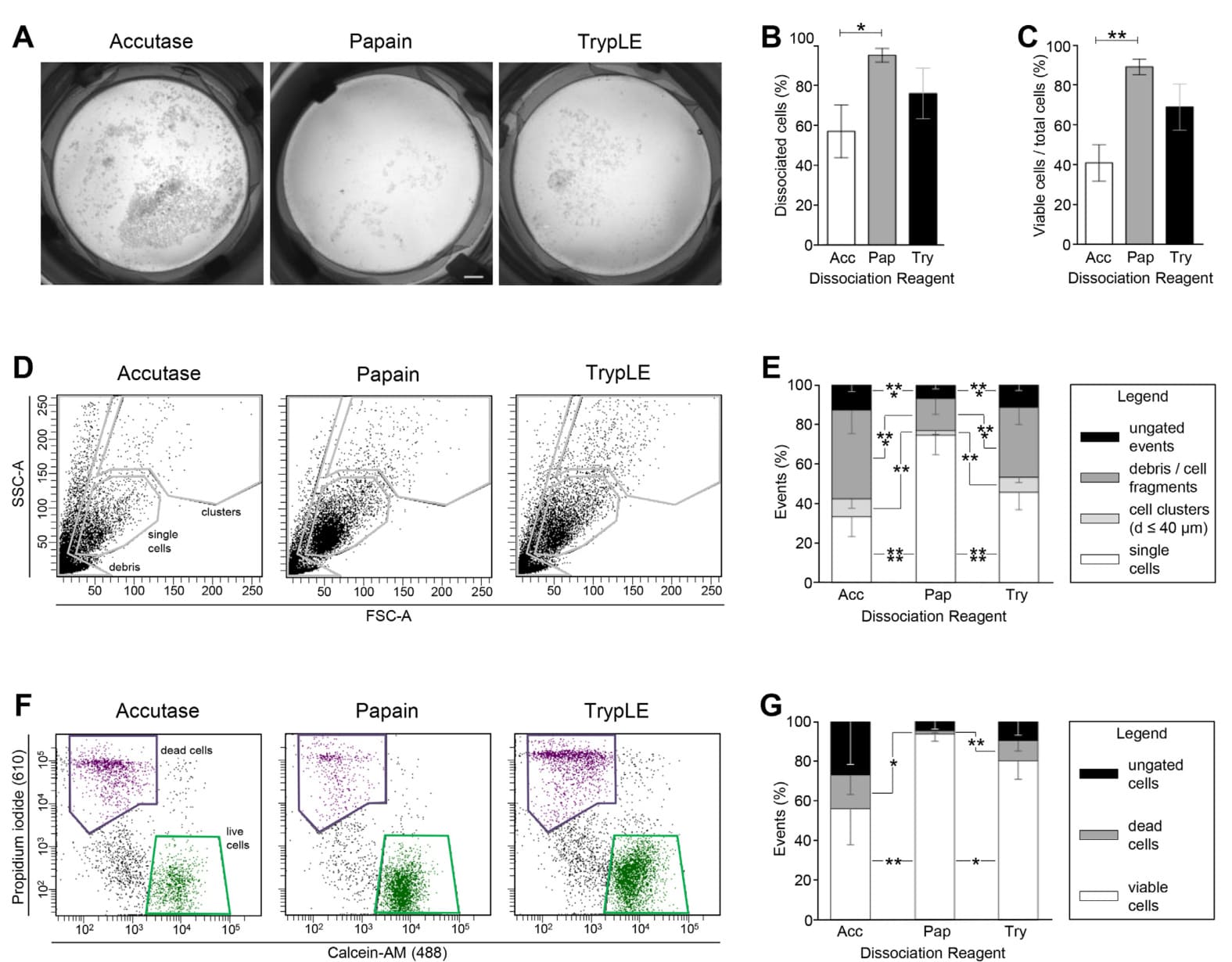
图2. 从hiPSC-心球获得的单个活细胞数量因所用解离试剂的不同而变化很大。未解离的聚集体在用Accutase、木瓜蛋白酶或TrypLE从心球在8 dpi获得的细胞悬液过滤后,收集在40 μm细胞滤器上的代表性图像(A)。使用NucleoCounter评估流出液中的单个(B)和活的单个(C)细胞数量(n = 6–7/条件);: p < 0.05;**: p ≤0.005。使用所考虑的解离试剂后获得的代表性FSC/SSC散点图(D)。门限定义了单个细胞、≤ 40 μm细胞簇和碎片/细胞片段。根据D进行门限的事件被量化为平均值± SD(E; n = 6–7/条件)。在D中定义的单细胞门限内测量细胞活力,基于Ca/PI双重染色(F)。每种解离试剂使用的活细胞、死细胞和未门限细胞的数量以平均值± SD表示(G; n = 6–7/条件)。
对于木瓜蛋白酶(图2E;p ≤ 0.0001)。用木瓜蛋白酶获得的流出部分也包含一定比例的碎屑(16.2 ± 8%)和小细胞簇(2.3 ± 2%),低于TrypLE(35.3 ± 8.6%;p ≤ 0.0001;7.4 ± 2.6%;p = 0.017)和Accutase(45 ± 12.1%;p ≤ 0.0001;8.9 ± 4.7%;p = 0.0095)(图2E)。单细胞的百分比是酶消化效率的直接测量,但同样重要的是活细胞和死细胞的比例。因此,我们将细胞与碘化丙啶(PI)和非荧光的钙黄绿素AM一起孵育——由活细胞水解转化为绿色荧光的钙黄绿素(Ca)。使用图2F中显示的门控,我们发现,在用木瓜蛋白酶消化的单细胞中,93.6 ± 3.7%是活的(图2G),显著多于用TrypLE(80.4 ± 9.3%;p = 0.016)或Accutase(56 ± 18.1%;p = 0.0018)获得的细胞。在这方面,TrypLE相对于Accutase的优势也是显著的(p = 0.014)。顺便提一下,我们注意到,与基于Ca和PI互斥染料的流式细胞仪数据相比,基于FSC/PI的经典活/死门控和由NC运行的自动化活力测定显著高估了活细胞的数量(补充图S2)。这可能是因为死亡细胞对PI(或用于NC计数的DAPI)可能呈阴性。由于它们对Ca也呈弱/阴性,因此基于Ca/PI的活死门控比单独基于PI(或DAPI)的更准确。
发现木瓜蛋白酶在将心球解离为单个、可存活的心肌细胞方面优于Accutase和TrypLE后,我们决定通过实验评估这种情况是否在其他培养条件下也成立。如报道所述(Burridge等,2015),hiPSC-CMs在长期培养中对解离的抵抗力增强。因此,我们比较了8 dpi心球与15 dpi心球的解离效率(图3A,左图)。长期培养并未显著改变Accutase消化后获得的细胞悬液的组成;然而,额外的培养时间减少了使用木瓜蛋白酶(54.4 ±2.7%;p = 0.0101)或TrypLE(17.1 ± 1.7%;p = 0.0008)获得的单细胞产量,与8 dpi心球相比。这与使用TrypLE获得的细胞悬液中显著更多的碎屑有关(59.4 ± 4.5%;p = 0.0032)。然而,重要的是,15 dpi时三种解离方法的相对效率与8 dpi时观察到的一致。在特别是,使用木瓜蛋白酶获得的单细胞百分比仍然显著更高(p ≤ 0.0001;图3A,左面板),而碎片的百分比显著更低(p ≤ 0.0001;图3A,中间面板),与TrypLE和Accutase获得的结果相比。观察单个活细胞的百分比,在使用任一试剂解离的8和15 dpi心球之间没有发现差异(图3A,右面板)。接下来,我们评估了木瓜蛋白酶在解离培养在单层中的心肌细胞的性能,因为这仍然是大多数实验室和商业供应商使用的心脏诱导的标准格式。我们对从96孔板上分离的细胞进行了流式细胞术分析,发现对于所考虑的三种解离方法,从心肌细胞单层获得的细胞悬液与从心球获得的在任何观察参数上都没有差异(图3B)。单层培养的心肌细胞的木瓜蛋白酶解离产生了53.4 ± 7.9%的单细胞(图3B,左面板),这高于TrypLE(29.3 ± 3.8%;p = 0.0144)和Accutase(30.7 ± 3.2%;p= 0.0171)。它还产生了显著更低的碎片百分比(26.1 ± 4.7%;图3B,中间面板),与TrypLE(48.5 ± 5.0%;p = 0.0048)和Accutase(45.7± 3.2%;p = 0.0033)相比。最重要的是,使用木瓜蛋白酶的单个活细胞百分比再次显著更高(92.2 ± 2.0%;图3B,右面板)比使用TrypLE(63.3 ± 6.0%;p = 0.0003)和Accutase(57.5 ± 5.2%;p≤ 0.0001)。最终,我们评估了细胞系相关的差异。解离UKBi005或IBMT1来源的心球时获得的结果表明,无论使用何种解离试剂,均无特定细胞系偏差影响消化效率(补充图S3 A,B)。
这些发现表明,木瓜蛋白酶优于其他常用试剂,用于解离hiPSC-CMs,无论是作为心球还是单层。
¶ 3.3. 解离后心肌细胞的特征描述
为了验证我们的木瓜蛋白酶解离方案,我们确认它对解离的hiPSC-CMs的播种和培养没有不良影响。为此,从心脏球体中用木瓜蛋白酶、TrypLE或Accutase解离的hiPSC-CMs被重新播种在Matrigel涂层的细胞培养板上(2D, 2.4 × 105 cells/cm2)或在BL中(3D, 7.5 × 105cells/mL)。我们注意到,用Accutase或TrypLE消化后获得的一些细胞在计数和铺板之间死亡。此外,用木瓜蛋白酶解离后新播种的细胞具有明确的形状,与那些不同。
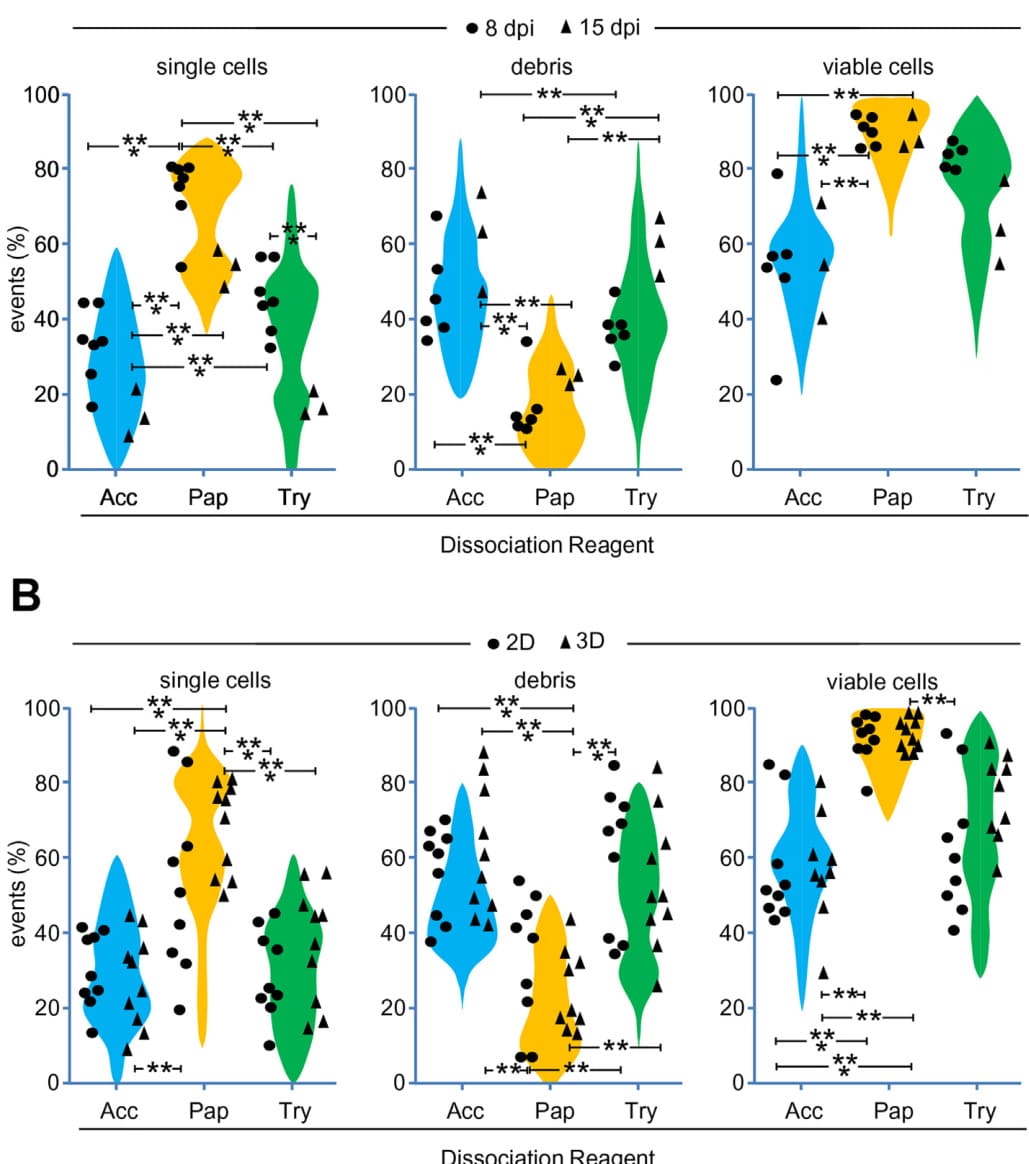
图3. 年龄和培养条件对hiPSC-CMs解离的影响。在8或15 dpi时,心球体分别用Accutase、木瓜蛋白酶或TrypLE解离,并对获得的单个活细胞数量进行评分(A)。混合散点图/小提琴图显示了个体数据点及其单峰或双峰分布。: p < 0.05; : p ≤ 0.01: p ≤ 0.005。A中展示的分析也用于显示球体(3D)与单层(2D)相比的解离效率(B)。: p < 0.05; : p ≤ 0.01: p ≤ 0.005。
与其他两种试剂分离(图4A,左面板)。通过时间推移显微镜评估单层播种的hiPSC-CMs的附着情况。木瓜蛋白酶消化的CMs附着在Matrigel涂层表面的速度比Accutase和TrypLE消化的CMs慢(补充电影S3–S5)。然而,这一初始延迟并未在细胞附着于基质和扩展的能力上产生显著差异(图4A)。在所有三个组中都迅速观察到自发的同步跳动,无论是在2D(播种后3天即可观察到;补充电影S6–S8)还是3D培养条件下(在U形底96孔板中;补充电影S9–S11)。这表明,尽管在可存活细胞数量方面结果不同,测试的三种解离试剂在重新播种后并未影响细胞的功能,无论是在2D还是3D中。然而,为了检测细胞解离后表型的细微差异,这些差异可能会干扰下游应用中生成的数据,我们观察了编码肌节蛋白的基因表达,包括心肌肌钙蛋白T(TNNT2)、肌联蛋白(TTN)、肌球蛋白重链(MYH7)、肌球蛋白轻链2(MYL2)、肌球蛋白轻链7(MYL7)、结蛋白(DES)以及离子通道Kv7.1(KCNQ1)和Nav1.5(SCN5A)。在培养2或3周后获得的定量PCR数据。
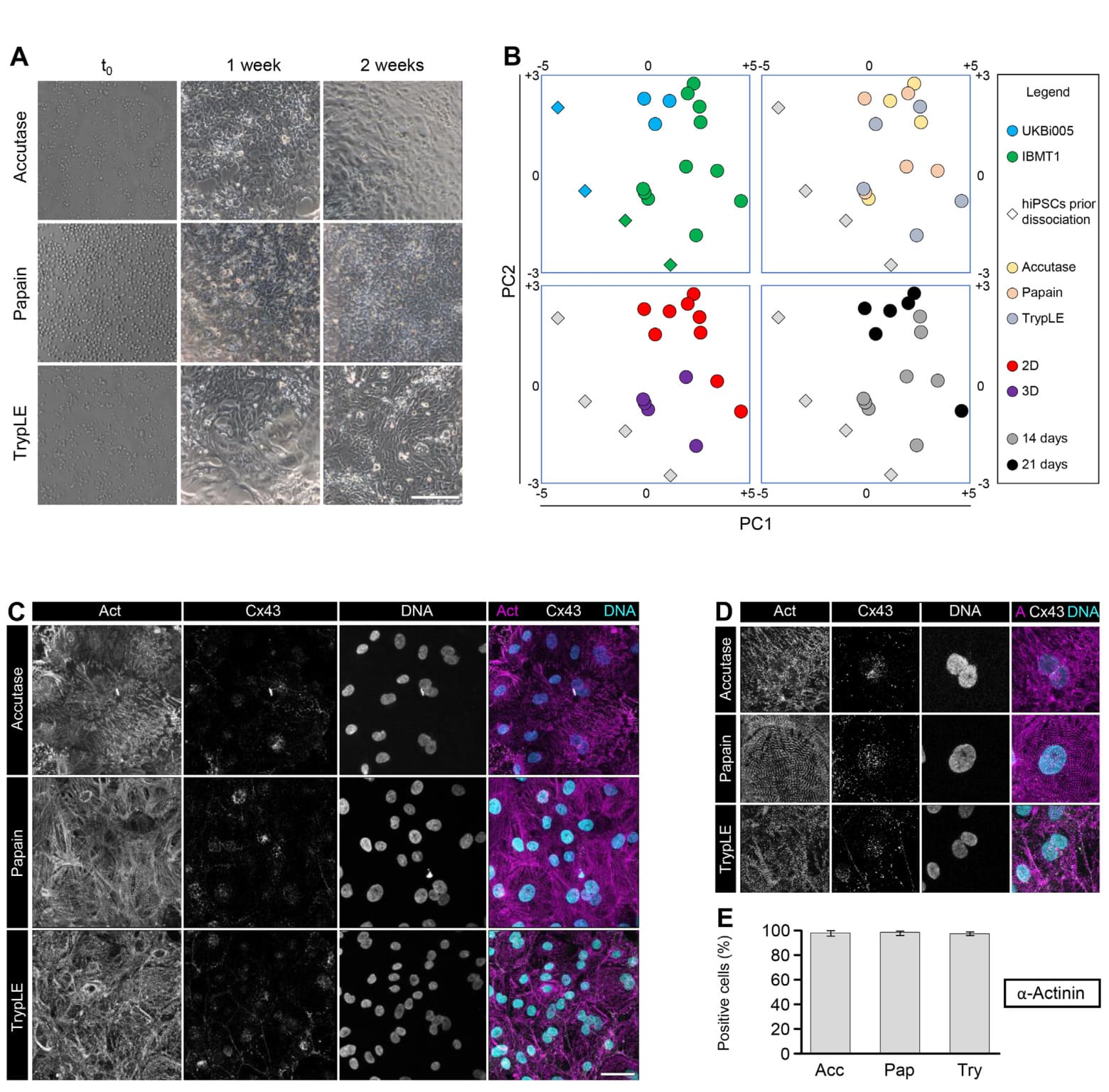
图4. 使用Accutase、木瓜蛋白酶或TrypLE解离后培养的hiPSC心肌细胞的表型。代表性图像显示2.4 × 105个解离的心肌细胞/cm2在t0时及培养1或2周后的情况(A)。在培养2/3周后,通过qPCR评估基因表达。通过主成分分析(PCA)分析的数据以个体数据点的形式绘制,作为前两个主成分的函数(B)。在4个相同的图中,颜色编码突出显示了4个变量:细胞系(左上)、培养条件(左下)、培养时间(右下)和使用的解离试剂(右上)。菱形代表解离前的hiPSCs,根据细胞系着色,或在考虑其他变量时保持灰色。双重免疫细胞化学针对α-肌动蛋白和连接蛋白43,显示单层培养2周后心肌细胞的肌节组织和缝隙连接(C)。提供了C中黄色方块的放大图(D)。α-肌动蛋白表达细胞的定量分析以平均值± SD表示(E; n = 3,每个重复计数200个细胞核)。A、C、D中的比例尺:50 μm。(关于此图例中颜色引用的解释,请读者参考本文的网络版本。)
通过主成分分析(PCA)对其进行分析,以获得一个不偏不倚的全球视角,了解众多变量如何可能影响细胞的基因表达谱(图4B)。我们可以观察到根据所使用的细胞系(图4B,左上角面板)、培养条件(图4B,左下角面板)和培养时间(图4B,右下角面板)进行的聚类,但与所用的解离试剂无关(图4B,右上角面板)。然后我们观察了蛋白质表达。发现所有重新接种的CMs都大量表达了肌节性α-肌动蛋白和连接蛋白43(图4C,D),这表明无论是木瓜蛋白酶还是其他使用的解离试剂都没有在hiPSC-CMs的表型中引入偏差。从定量的角度来看,> 97%的重新接种细胞表达了肌节性α-肌动蛋白(Accutase、木瓜蛋白酶和TrypLE处理的分别为97.73 ± 1.5%、98.27 ± 1.3%和97.32 ± 1.6%;图4E)。然而,从定性的角度来看,我们注意到,与使用的其他两种解离试剂相比,Accutase解离的CMs在单层重新接种后显示出较差的肌节组织(图4C,D)。在评估心球在BL中培养2周后的肌节性α-肌动蛋白、连接蛋白43和结蛋白的表达时,观察到了类似的结果(数据未显示)。这些发现进一步证实,从木瓜蛋白酶解离获得的细胞保留了完整的功能表型,可以用于任何下游应用。另一方面,基因表达数据表明,除了解离试剂之外的参数(例如细胞系、培养时间和条件)应被视为潜在的偏差诱导因素,并且必须根据所需的应用进行仔细考虑。
¶ 3.4. 结论
我们的数据表明,BL中的心脏诱导结合基于木瓜蛋白酶的细胞收获是一种强大的技术组合,可以重现性地生成大量可存活、功能性单个hiPSC-CMs,可有效用于心血管研究。
本文的补充数据可以在线查阅,网址为 https://doi.org/10.1016/j.scr.2018.08.015
资金来源
BF 和 TAT 得到了萨尔大学博士奖学金的支持;AS 得到了 Erasmus + 项目的支持;这项工作得到了弗劳恩霍夫生物医学工程研究所的支持。
补充材料下载地址(包括培养基配比、细胞视频):https://fb.biokingdom.top/d/4cefc643f93f489982a0/
¶ 参考文献
Brewer, G.J., 1997. Isolation and culture of adult rat hippocampal neurons. J. Neurosci.
Methods 71, 143–155.
Burridge, P.W., Holmström, A., Wu, J.C., 2015. Chemically defined culture and cardiomyocyte differentiation of human pluripotent stem cells. Curr. Protocols Human
Genetics 87, 21–25.
Chen, V.C., Ye, J., Shukla, P., Hua, G., Chen, D., Lin, Z., Liu, J.-c., Chai, J., Gold, J., Wu, J.,
Hsu, D., Couture, L.A., 2015. Development of a scalable suspension culture for cardiac differentiation from human pluripotent stem cells. Stem Cell Res. 15, 365–375.
Kempf, H., Olmer, R., Kropp, C., Rückert, M., Jara-Avaca, M., Robles-Diaz, D., Franke, A.,
Elliott, D.A., Wojciechowski, D., Fischer, M., Roa Lara, A., Kensah, G., Gruh, I.,
Haverich, A., Martin, U., Zweigerdt, R., 2014. Controlling expansion and cardiomyogenic differentiation of human pluripotent stem cells in scalable suspension
culture. Stem Cell Reports 3, 1132–1146.
Li, D., Tang, T., Lu, J., Dai, K., 2009. Effects of flow shear stress and mass transport on the
construction of a large-scale tissue-engineered bone in a perfusion bioreactor. Tissue
Eng. 15, 2773–2783.
Moritz, S., Stöckle, F., Ortmeier, C., Schmitz, H., Rodríguez-Esteban, G., Key, G., Gentile,
L., 2012. Heterogeneity of planarian stem cells in the S/G2/M phase. Int. J. Dev. Biol.
56, 117–125.
Pampaloni, F., Reynaud, E.G., Stelzer, E.H.K., 2007. The third dimension bridges the gap
between cell culture and live tissue. Nat. Rev. Mol. Cell Biol. 8, 839–845.
Piccini, I., Rao, J., Seebohm, G., Greber, B., 2015. Human pluripotent stem cell-derived
cardiomyocytes: Genome-wide expression profiling of long-term in vitro maturation
in comparison to human heart tissue. Genomics data 4, 69–72.
R.D.C. Team, 2008. R: A Language and Environment for Statistical Computing. R
Foundation for Statistical Computing, Vienna, Austria.
Scuderi, G.J., Butcher, J., 2017. Naturally engineered maturation of cardiomyocytes.
Front. Cell Dev. Biol. 5https://doi.org/10.3389/fcell.2017.00050. https://www.
frontiersin.org/article/10.3389/fcell.2017.00050 (50 pages, ISSN: 2296-634X).
Sequeira, V., Nijenkamp, L.L.A.M., Regan, J.A., van der Velden, J., 2014. The physiological role of cardiac cytoskeleton and its alterations in heart failure. Biochim.
Biophys. Acta Biomembr. 1838, 700–722.
Wang, H., Riha, G.M., Yan, S., Li, M., Chai, H., Yang, H., Yao, Q., Chen, C., 2005. Shear
stress induces endothelial differentiation from a murine embryonic mesenchymal
progenitor cell line. Arterioscler. Thromb. Vasc. Biol. 25, 1817–1823.
Zhang, M., Schulte, J.S., Heinick, A., Piccini, I., Rao, J., Quaranta, R., Zeuschner, D.,
Malan, D., Kim, K.-P., Röpke, A., Sasse, P., Araúzo-Bravo, M., Seebohm, G., Schöler,
H., Fabritz, L., Kirchhof, P., Müller, F.U., Greber, B., 2015. Universal cardiac induction of human pluripotent stem cells in two and three-dimensional formats:
Implications for in vitro maturation. Stem Cells 33, 1456–1469.