¶ 为COVID-19研究生物打印气道上皮模型
¶ 原文下载:https://fb.biokingdom.top/f/a757e35641734fa985b0/
Himjyot Jaiswal 博士,Isabella Bondesson 硕士,Volodymyr Kuzmenko 博士,Elin Pernevik 硕士,以及Itedale Namro Redwan 博士 CELLINK AB
Arvid Wallgrens Backe 20 43146,哥德堡,瑞典
¶ 摘要
预测性体外细胞模型可能有助于国际合作,开发新的疫苗和其他治疗方法,用于治疗与肺部相关的疾病,如COVID-19、慢性阻塞性肺病或特发性肺纤维化。将3D生物打印与气液界面培养相结合,能够构建出模拟呼吸道典型特征的组织模型,适用于健康和病态的体外环境。这些模型不仅能够提供深入理解病毒与宿主细胞在靶位点相互作用机制的机会,还能帮助减少未来研究中使用的动物数量,从而支持3R原则(替代、减少和优化)。在本研究中,我们描述了3D生物打印气道上皮模型的生成及其生理学相关性的评估。该模型的特点是表达血管紧张素转化酶2(ACE2),这一蛋白质是冠状病毒内化所必需的。ACE2蛋白在上皮细胞顶端膜的定位表明这些上皮细胞是极性化的,并且粘蛋白5AC(mucin 5AC)蛋白的存在表明该模型可以产生气道表面液体,这是气道上皮细胞的生理功能。因此,这些生物工程化的组织模型可以用于不同治疗方法和疫苗的开发。
¶ 引言
2019年末爆发的新型冠状病毒疾病(COVID-19)是由严重急性呼吸综合症冠状病毒2型(SARS-CoV-2)引起的。该病毒具有高度的传染性,利用血管紧张素转化酶2(ACE2)作为主要受体进入哺乳动物细胞。ACE2是一种细胞表面蛋白,存在于许多细胞和组织中,包括肺、心脏、血管、肾脏、肝脏和胃肠道(Hamming, 2004)。在健康的肺组织中,ACE2的表达处于中等水平,而在一些病理状态下,如慢性阻塞性肺病(COPD)、特发性肺纤维化(IPF)、哮喘、糖尿病和高血压等,ACE2的表达则较高(Saheb Sharif-Askari, 2020)。已知SARS-CoV-2会感染呼吸道并传播到全身,导致多脏器感染症状(de Melo, 2021)。因此,由于该病毒对人类健康的严重影响,急需开发新的诊断方法、疫苗和抗病毒药物。

图1. (A) 使用CAMotics绘制的3D生物打印模型示意图,顶视图(左)和侧视图(右)。(B) 转移至Transwell插入孔中的3D生物打印肺组织模型。
体外模型对于理解疾病机制以及在临床试验前验证治疗方法至关重要。尽管当前的2D培养模型在病毒复制筛查、感染研究和药物筛查中很常见,但它们无法重现组织的复杂性和生理特性。然而,像3D生物打印技术这样的新平台,可以生成更能反映原位组织的组织模型,在分子组成、生物力学和复杂性方面更为接近真实组织(Singh, 2020;Seyfoori, 2021)。这些3D生物打印模型有助于更好地理解宿主与病原体之间的相互作用,在类似于人类器官的微环境中进行研究,从而促进针对肺部疾病(如COVID-19)的药物筛选。
在本研究中,我们专注于生物打印人类支气管上皮或Calu-3细胞,生成气液界面(ALI)模型。Calu-3是从人类支气管下黏膜腺体衍生的已充分分化并表征的细胞系(Zhu, 2010)。人类肺部的下黏膜腺体是气道表面液体、粘蛋白和其他免疫活性物质的主要来源。
这些生物打印的肺部疾病模型在Transwell插入孔中培养了14天,并对ACE2和粘蛋白5AC(MUC5AC)蛋白进行了免疫染色。使用本研究中所展示的实验设置,可以研究SARS-CoV-2与气道上皮细胞之间的宿主-病原相互作用(Zhu, 2010)。
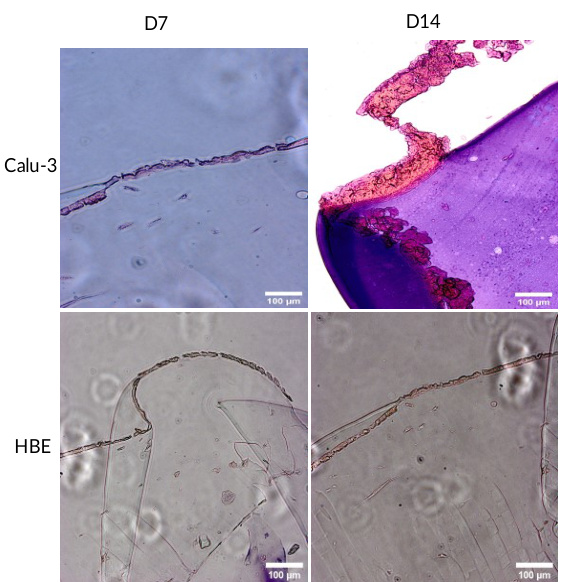
图2. 肺组织模型在第7天(D7)和第14天(D14)的H&E染色, 放大倍数。Calu-3和HBE细胞的上皮层位于构建物的顶部。标尺:。
¶ 材料与方法
¶ 细胞制备
在肺组织模型中使用了两种不同的上皮细胞类型:人类支气管上皮细胞(HBEpC;C-12640,PromoCell)和Calu-3(来源于肺腺癌的上皮细胞;HBT-55,ATCC)。人类肺成纤维细胞(HPF;C-12360,PromoCell)被用作支持细胞。细胞在按照各自制造商的协议进行生物打印之前,先在二维培养条件下解冻并扩增。HBEpC使用气道上皮细胞生长培养基(C-21060,PromoCell)培养,HPF使用成纤维细胞生长培养基2,并添加生长培养基2试剂盒(C-23020,PromoCell),分别使用第4代和第9代细胞;而Calu-3细胞则使用最低必需培养基(MEM;51200038,Gibco Thermo Fisher Scientific),并添加胎牛血清(FBS;10270106,Gibco Thermo Fisher Scientific)和青霉素-链霉素-新霉素混合液(PSN;15640055,Gibco Thermo Fisher Scientific)培养,使用第4代细胞。
¶ 肺组织模型的生物打印
肺模型被设计为一个圆盘,底部为实心层,顶部有5层边缘(图1A,1B)。这样设计是为了方便固定种植后的上皮细胞。该圆盘使用GelMA-Laminin 521(GelMA-LN521,CELLINK)进行3D打印。接着,个HPF细胞被胰蛋白酶消化、洗涤、收集、离心并轻轻重悬于100~\upmu\mathrm{L}的成纤维细胞培养基2中,然后小心地与1 mL预先加热至的GelMA-LN521生物墨水混合,并转移到琥珀色墨盒(CSO010311502,CELLINK)中。为去除空气泡沫,将嵌入HPF细胞的GelMA-LN521墨盒以离心1分钟。墨盒被安装在温控打印头(00000020346,CELLINK)中,并设置为,在生物打印机中放置20分钟,准备开始打印。打印前,将墨盒上下翻转两到三次,以避免细胞沉淀。对于GelMA-LN521生物墨水,适合的生物打印温度为至。
然后,在下使用温控打印头将圆盘篮子进行生物打印,放置在12孔培养板中。首先,对12个圆盘复制品进行光固化,每个构建体使用405 nm光固化模块固化10秒(距离设置为)。接着,向每个孔中添加成纤维细胞生长培养基。圆盘随后在的成纤维细胞生长培养基中孵育3天,然后才加入上皮层。

图3. HBE细胞中ACE2的免疫染色。ACE2(绿色)和细胞核染色DAPI(蓝色)在不同天数下的ALI培养构建体。标尺:。
¶ 添加肺上皮层
对于上皮层,HBE或Calu-3细胞分别在气道上皮生长培养基或完整的MEM培养基中重悬,并补充的LN521。每个圆盘上播种个细胞/cm²。移除孔中的成纤维细胞培养基,将个细胞重悬于360~\upmu\mathrm{L}完整培养基中,然后将30~\upmu\mathrm{L}的细胞悬液混合物添加到每个圆盘上。播种后,构建体在台面上静置10分钟,然后转移到培养箱中再孵育20分钟,使细胞沉降并附着在生物打印圆盘上。HBE构建体被轻轻浸入成纤维细胞和气道上皮培养基的1:9混合物中;Calu-3构建体则被浸入成纤维细胞和MEM培养基的1:9混合物中。浸泡培养在、 CO₂的环境中生长4天,然后转移到ALI培养中。ALI培养通过将构建体转移到Transwell插入孔中并补充上述相同的培养基来建立(图1B)。每2到3天更换一次培养基。

图4. Calu-3细胞中ACE2的免疫染色。细胞在GelMA-LN521上生长于ALI培养中。在第7天(D7)和第14天(D14),细胞被固定、切片并染色ACE2(绿色)。使用DAPI(蓝色)可视化细胞核。构建体在明场下观察,以查看ALI。标尺:={\o{100}}\,\mu m。
¶ 分析
在第7天和第14天(ALI培养)收集样本,并根据CELLINK的固定协议使用多聚甲醛(PFA)固定。样本随后被嵌入石蜡中,使用切片机按照CELLINK的切片协议切取10\;\upmu\mathrm{m}的切片。切片用ACE2(MAB933,R&D Systems)和MUC5AC(AB3649,Abcam)抗体染色,按照CELLINK的免疫荧光协议,使用Alexa Fluor 488(A-11029,Thermo Fisher Scientific)作为二抗。样本还使用H&E染色,遵循CELLINK的染色协议。所有协议可以在CELLINK的网站的“支持”标签下找到。
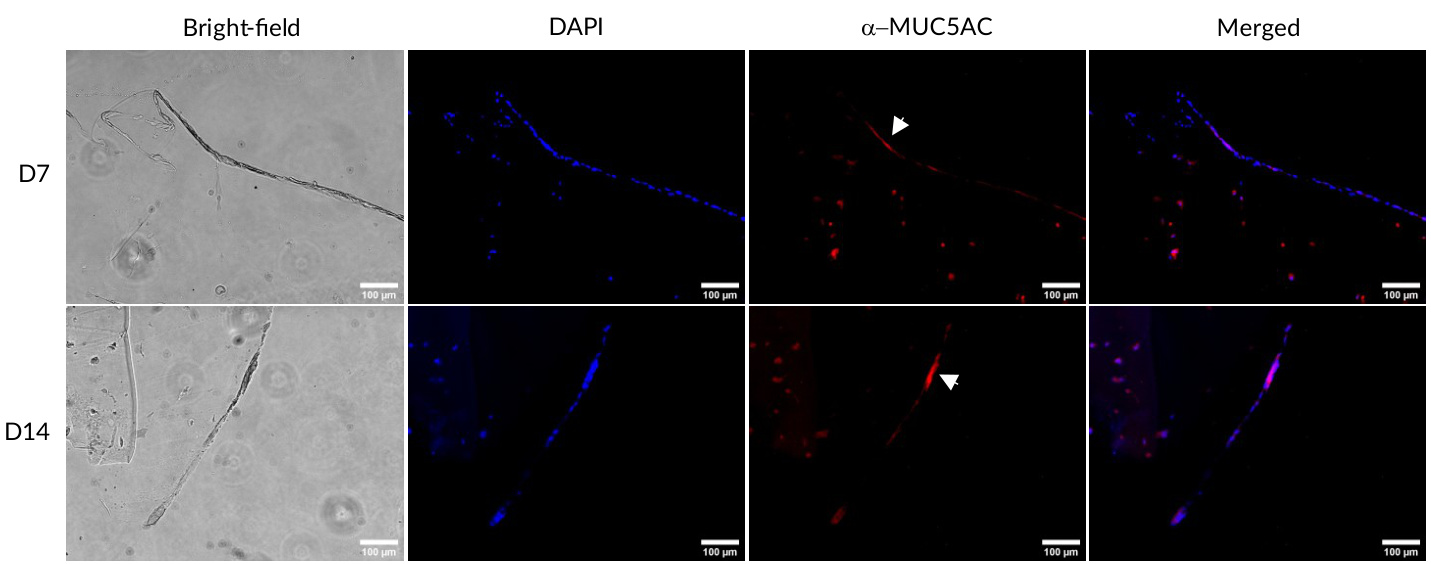
图5. HBE细胞中黏蛋白的免疫染色。细胞在GelMA-LN521上生长于ALI培养中。在第7天(D7)和第14天(D14),细胞被固定、切片并染色MUC5AC(红色)。使用DAPI(蓝色)可视化细胞核。构建体在明场下观察,以查看ALI。标尺:。
¶ 结果与讨论
用于生成肺组织模型的制造方法创建了一个完整且坚固的构建体,整个实验过程中保持了其形状。样本切片的H&E染色结果显示,在第7天,种植在构建体上的Calu-3和HBE细胞形成了紧密的单层。然而,在第14天,Calu-3细胞形成了厚实的多层上皮样结构,而HBE细胞仍保持薄层单层(图2)。这表明,原代支气管上皮细胞保持了接触抑制作用,而这种作用在癌细胞中丧失,导致细胞在彼此上方生长。
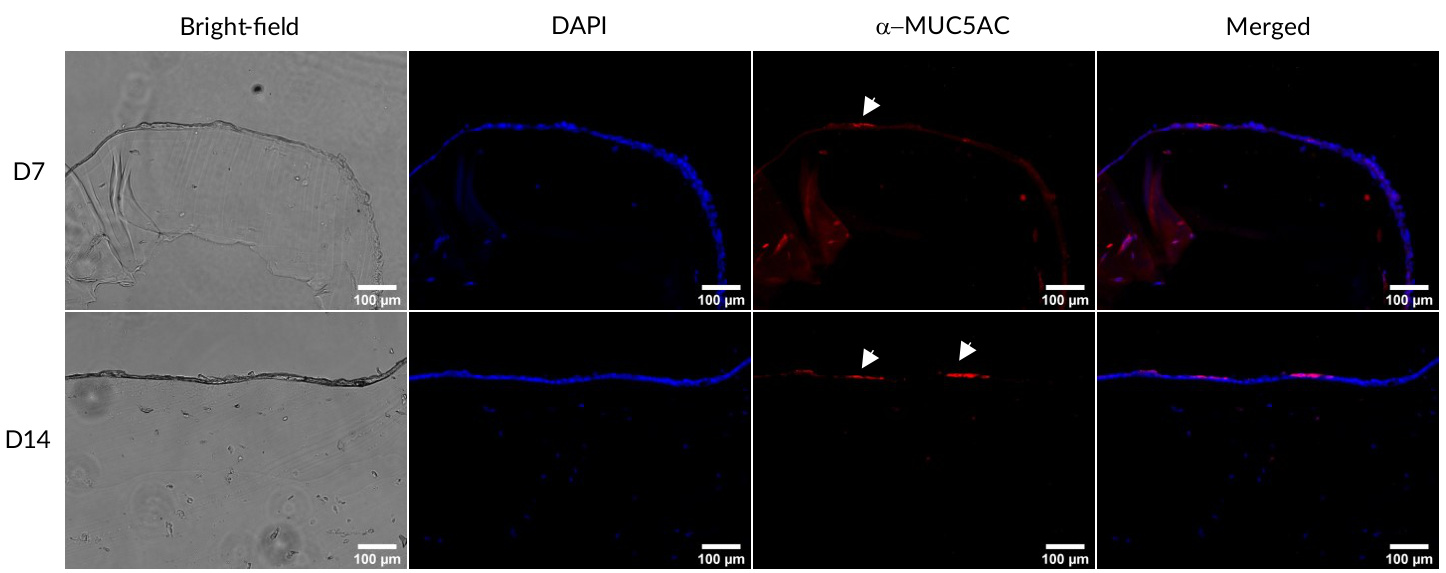
图6. Calu-3细胞中黏蛋白的免疫染色。细胞在GelMA-LN521上生长于ALI培养中。在第7天(D7)和第14天(D14),细胞被固定、切片并染色MUC5AC(红色)。使用DAPI(蓝色)可视化细胞核。构建体在明场下观察,以查看ALI。标尺:。
接下来,我们进行了ACE2的免疫染色,ACE2是一种细胞表面蛋白,参与冠状病毒的内化。在HBE样本中,在第7天的单层细胞中,只有很少的细胞染色为ACE2,而在第14天,许多细胞出现了ACE2染色(图3)。与HBE不同,在Calu-3样本中,第7天和第14天大多数细胞都染色为ACE2(图4)。此外,ACE2的免疫染色在顶端膜区域(ALI培养中的气道表面)也有所观察,绿色信号集中在第14天样本中的Calu-3细胞顶部(图4),这表明细胞层是极性的。综上所述,这些数据表明,我们的Transwell模型显示了极化的气道上皮细胞,且在原代细胞和癌症衍生细胞中均表达ACE2。
为了进一步表征该模型,我们对ALI培养构建体进行了黏蛋白的免疫染色,因为已有研究报告称MUC5AC是由气管支气管表面上皮的杯状细胞产生的(Kesimer, 2009)。我们观察到在ALI培养模型中,HBE和Calu-3细胞均表达了MUC5AC(图5,6),表明这些细胞已经分化。综上所述,我们的数据表明,本文呈现的3D生物打印模型将提供一个优秀的工具,用于快速筛选抗COVID-19的生物制剂。该模型还将有助于减少动物实验,从而支持3Rs原则。
¶ 结论
本研究表明,3D生物打印与Transwell细胞培养相结合,可用于生成复杂的体外肺上皮模型。
体外ALI模型显示了ACE2和MUC5AC蛋白的表达。
原代支气管上皮细胞在整个实验过程中保持了紧密的单层,而Calu-3细胞在第14天形成了多层上皮。
与腺癌衍生的Calu-3细胞系相比,原代支气管上皮细胞中ACE2的表达较为适中。
在ALI培养中生长的细胞显示了极性,ACE2在培养的顶端膜区域的表达表明了这一点。
¶ 参考文献
- Hamming I, Timens W, Bulthuis MLC, Lely AT, Navis GJ, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. The Journal of Pathology. 2004; 203(2): 631–637. DOI:10.1002/path.1570.
- Saheb Sharif-Askari N, Saheb Sharif-Askari F, Alabed M. Airways expression of SARS-CoV-2 receptor, ACE2, and TMPRSS2 is lower in children than adults and increases with smoking and COPD. Molecular Therapy - Methods & Clinical Development. 2020; 18: 1–6. DOI:10.1016/j.omtm.2020.05.013.
- de Melo BAG, Benincasa JC, Cruz EM, Maricato JT, Porcionatto MA. 3D culture models to study SARS-CoV-2 infectivity and antiviral candidates: From spheroids to bioprinting. Biomedical Journal. 2021; 44(1): 31–42. DOI:10.1016/j.bj.2020.11.009.
- Singh AK, Mishra G, Maurya A, Kulkarni GT, Awasthi R. Biofabrication: An interesting tool to create in vitro model for COVID-19 drug targets. Medical Hypotheses. 2020; 144: 110059. DOI:10.1016/j.mehy.2020.110059.
- Seyfoori A, Amereh M, Dabiri SMH, Askari E, Walsh T, Akbari M. The role of biomaterials and three dimensional (3D) in vitro tissue models in fighting against COVID-19. Biomaterials Science. 2021; 9(4): 1217–1226. DOI:10.1039/D0BM01616K.
- Zhu Y, Chideke lA, Shaffer TH. Cultured human airway epithelial cells (Calu-3): A model of human respiratory function, structure, and inflammatory responses. Critical Care Research and Practice. 2010: 394578. DOI:10.1155/2010/394578.
- Kesimer M, Kirkham S, Pickles RJ. Tracheobronchial air-liquid interface cell culture: a model for innate mucosal defense of the upper airways? American Journal of Physiology-Lung Cellular and Molecular Physiology. 2009; 296(1): L92–L100. DOI:10.1152/ajplung.90388.2008.