CELLINK挤出式3D生物打印应用案例
¶ 使用原代细胞进行3D打印皮肤组织模型
¶ Isabella Bondesson,理学硕士,和Itedale Namro Redwan,哲学博士,CELLINK,瑞典哥德堡
¶ 摘要
本研究介绍了使用原代细胞3D生物打印的皮肤组织模型的构建,以增强皮肤模型的体外研究相关性。通过BIO X生物打印机和适当的生物墨水配方,如GelXA
SKIN和ColMA,能够成功构建结构复杂的真皮和表皮层,实现细胞精确定位和生物组织层次的模拟。培养过程持续14天,在第6天(空气-液体界面开始时)
和第14天取样。免疫荧光染色结果显示,随着培养时间的延长,胶原蛋白类型1、角蛋白10、角蛋白14和丝聚合蛋白等标记物的表达逐渐增强,表皮层角质
形成细胞明显自我重组,表现出类似于体内皮肤的分化过程。
¶ 引言
皮肤作为人体与外部环境的屏障,是再生医学中研究的热点。现有的2D培养模型虽然简便,但无法有效再现皮肤的3D结构复杂性。3D 生物打印技术能精确
控制细胞和材料的组合,克服了传统模型在物理相关性和组织结构上的不足,从而提高了体外模型的可转化性。
¶ 材料与方法
- 细胞准备:使用原代真皮成纤维细胞(NHDF)和表皮角质形成细胞(NHEK)进行模型构建。
- 真皮生物打印:使用BIO X打印机和GelXA SKIN墨水生物打印真皮层,形成稳固的3D结构。
- 表皮层添加:表皮层用ColMA和角质形成细胞构成,通过光固化增强其与真皮的连接,并在空气-液体界面下继续培养。
¶ 结果
图1中展示了表皮层的角化过程,这一过程在实验中被再现,且标志性角蛋白的表达随着培养时间推移得到提升,表皮层分化显著。
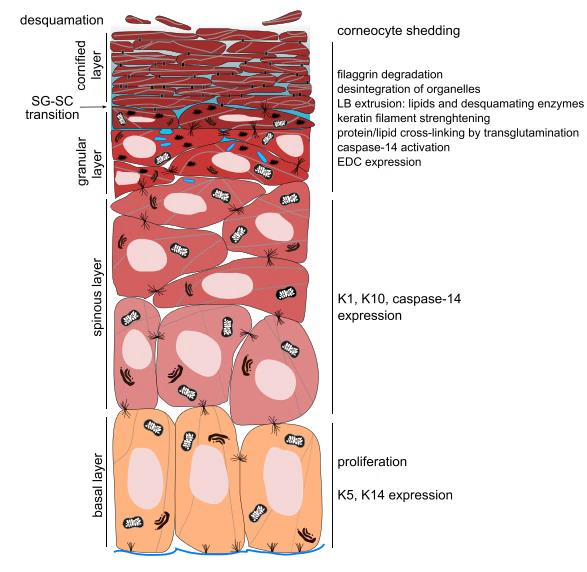
图2为3D生物打印模型的结构示意图:侧视图和顶视图展现了打印结构的精细布局,14天培养后形成的皮肤组织模型具有清晰分层。
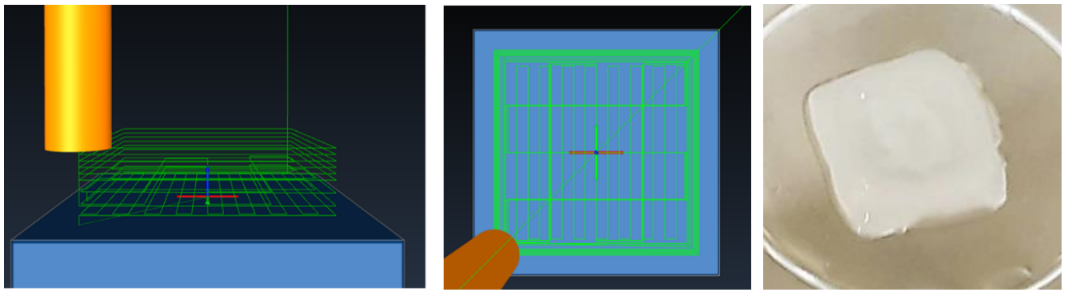
图3说明了实验中真皮和表皮构建方法。A图为生物打印后的真皮篮,B图展示了3D生物打印皮肤组织模型被转移至Transwell小室中,C图展示了气-液界面下
更好地模拟了皮肤在体内的环境。
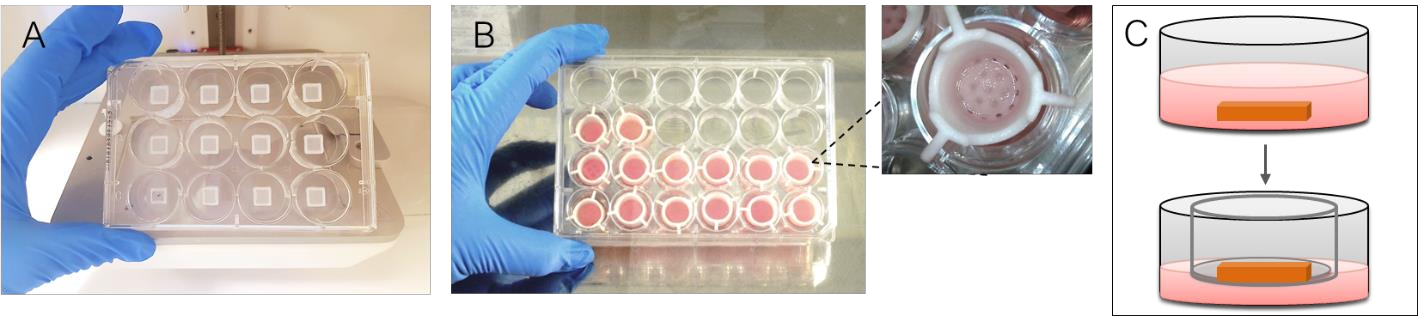
图4则展示了在培养期间通过免疫荧光对角蛋白10、角蛋白14等标记物的染色结果。随着时间推移,真皮中胶原蛋白网络增强,而表皮层角质形成细胞自我
重组显著,丝聚合蛋白聚集在表皮外层,角质层的形成逐步完善,验证了该模型的结构稳定性。
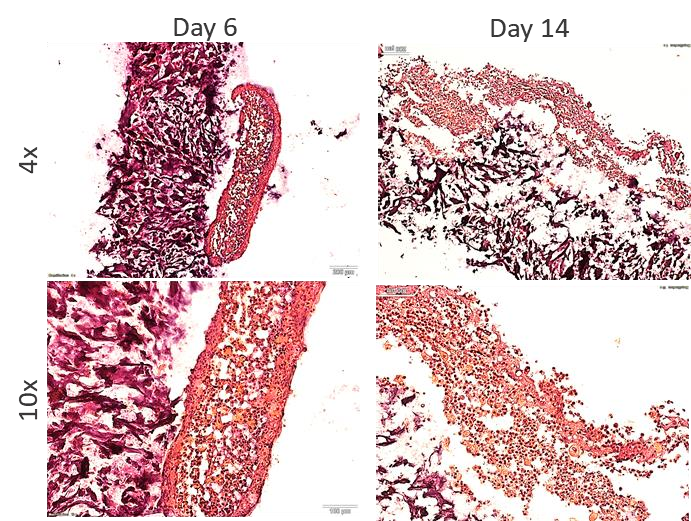
图5是一个免疫荧光染色的显微镜图像,展示了3D生物打印皮肤组织模型在培养过程中不同时间点的细胞和分子变化。图中可能包括以下标记物的染色结果:
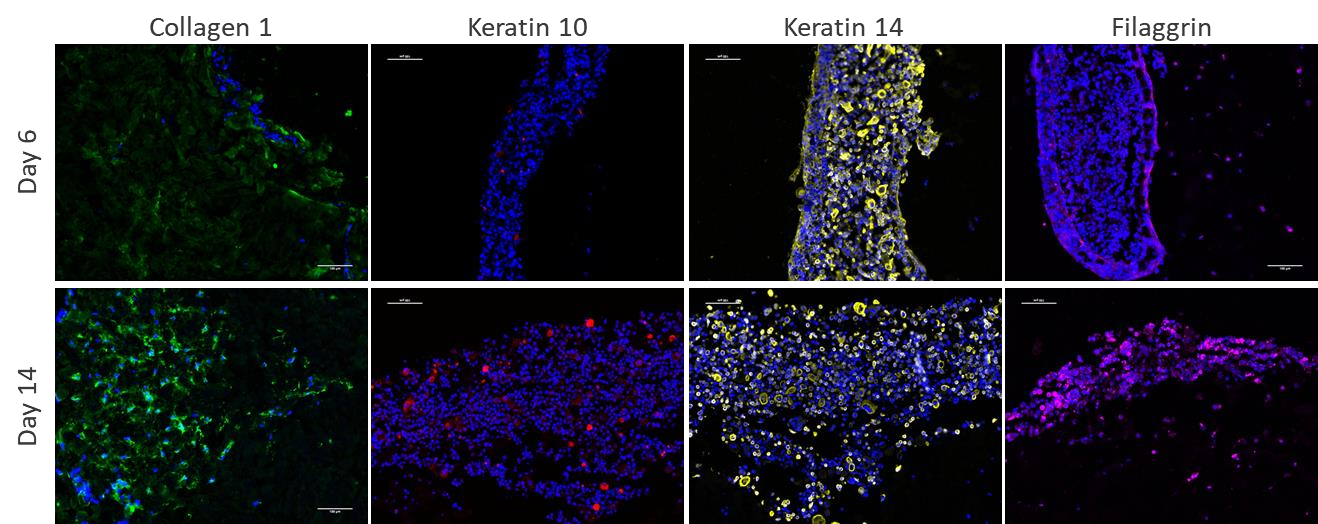
胶原蛋白类型1:显示真皮中胶原蛋白网络的形成和增强,表明真皮结构的成熟和稳定性。
角蛋白10:标记表皮中分化的角质形成细胞,其表达增加表明表皮细胞正在经历分化过程。
角蛋白14:标记表皮基底层的增殖性角质形成细胞,其稳定表达表明持续的细胞增殖。
丝聚合蛋白:参与角质层的形成,其在表皮外层的聚集表明角质层的发育。
DAPI:用于染色细胞核,显示细胞的分布和层次结构。
通过比较培养第6天和第14天的图像,图5展示了皮肤组织模型中细胞结构和分子标记物的动态变化,验证了3D生物打印模型在模拟真实皮肤结构和功能方
面的有效性。这些变化包括真皮中胶原蛋白的增加和表皮中角质形成细胞的分化,这些都是皮肤组织发育和成熟的关键特征。
¶ 分析
实验在第6和第14天采集样本,利用免疫荧光染色评估了胶原蛋白类型1、角蛋白10、角蛋白14和丝聚合蛋白的表达情况。结果表明,该模型在体外培养中
成功模拟了皮肤的层次结构和分化过程。
¶ 结论
这项研究证明了3D生物打印技术在构建皮肤组织模型方面的可行性,为药物测试、化妆品研究和伤口愈合等应用提供了坚实的基础,并展现了将3D生物打
印应用于复杂皮肤模型构建的潜力。通过精确的细胞定位和生物组织层次的模拟,我们成功构建了一个全层皮肤模型,不仅在结构上模拟了皮肤的复杂性,
而且在功能上也展现了皮肤组织的分化和成熟过程,进一步证实了这一技术在再生医学领域的应用前景。