¶ 高导电性3D可打印且生物兼容的PEDOT:PSS离子液体胶体,用于快速按需制造3D生物电子产品
原文下载地址:https://fb.biokingdom.top/f/873aa25021054c4cb34d/
¶ 作者:
Byungkook Oh, Seunghyeok Baek, Kum Seok Nam, Changhoon Sung, Congqi Yang, Young-Soo Lim, Min Sang Ju, Soomin Kim, Taek-Soo Kim, Sung-Min Park, Seongjun Park & Steve Park
摘要
3D打印已广泛应用于复杂三维结构的按需原型制造。在生物医学应用中,PEDOT:PSS因其类似组织的机械性能和适合的电学性能,已成为多功能生物电子学领域有前景的材料。然而,以往开发的PEDOT:PSS墨水由于需要较长的后处理时间、难以进行高纵横比打印以及低导电性,未能充分利用商业3D打印的优势。我们提出了一种单次策略,能够同时实现按需生物兼容性(无需后处理)、在3D打印过程中对高三维结构的结构完整性以及用于快速原型制造的高导电性。通过离子液体促进的PEDOT:PSS胶体堆积,并结合离心协议,我们开发了一种具有粘塑性的PEDOT:PSS-离子液体胶体(PILC)墨水。PILC墨水展现了高纵横比的垂直堆积、全方向打印能力,能够生成悬浮结构,高导电性(约286 S/cm)以及高分辨率打印(约50 μm)。我们通过制造3D电路板、皮肤贴附生理信号监测电子纹身以及可植入生物电子设备(光电皮层电图记录、低电压坐骨神经刺激和通过3D垂直尖峰阵列记录深层脑层信号)展示了PILC墨水的按需和多功能应用。
三维(3D)打印因其可定制性、快速生产周期以及能够制造复杂三维几何形状的能力,已广泛应用于商业领域。3D打印的这些特性促使其在生物医学应用中得到了广泛使用,特别是在组织样材料的多材料图案化方面,如导电聚合物和水凝胶,将其转化为复杂的解剖结构和生物电子设备。因此,这些柔性生物电子界面最大程度地减少了组织损伤,并使得制造个性化设备成为可能,从而提高了治疗效果。
对于生物电子设备,导电聚合物如聚(3,4-乙烯二氧噻吩):聚苯乙烯磺酸盐(PEDOT:PSS)由于其与组织的电气界面特性、类组织的机械性能和生物兼容性,已成为有前景的材料。然而,原始的PEDOT:PSS具有较低的屈服应力和储存模量,使其不适合用于3D打印。为了改善这些性能,二甲基亚砜(DMSO)和离子液体已被应用于此类材料中。然而,这些具有细胞毒性的物质的添加需要在打印后进行长时间的去除处理,如反复清洗或退火循环,这使得材料无法立即使用。理想情况下,打印的生物电子墨水应具有高导电性,具备足够的结构完整性,以便于多功能制造各种3D结构(如垂直堆叠或悬浮结构),并且在无需复杂后处理的情况下能够立即使用。然而,导电聚合物尚未实现这些特性。
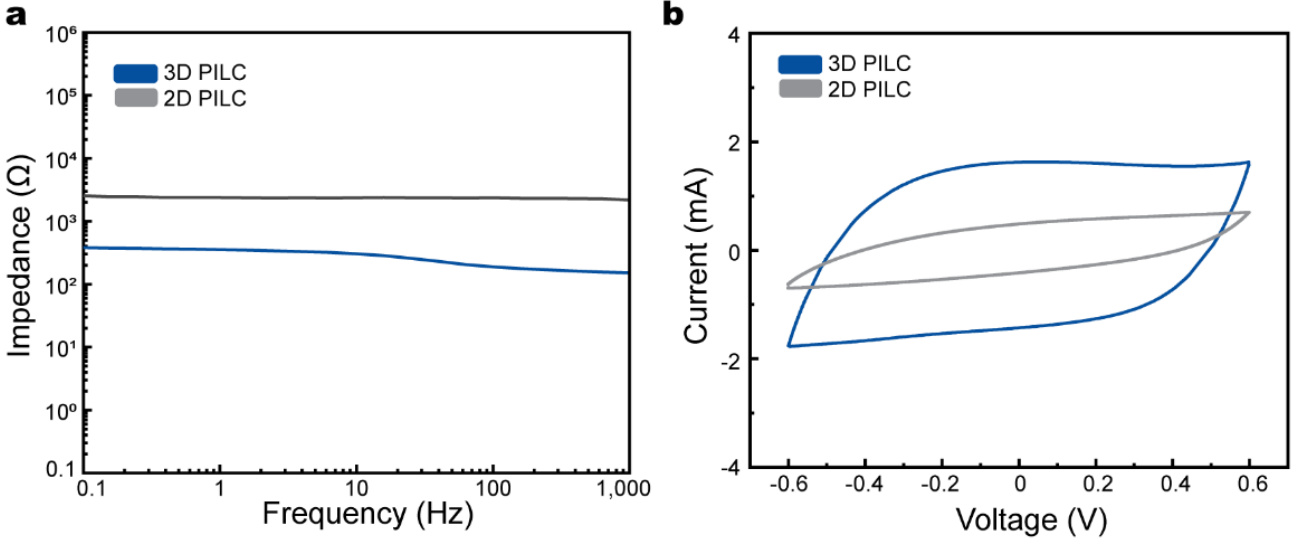
在这项研究中,我们提出了一种单次策略,用于制造一种生物兼容、高导电性且可进行3D打印的PEDOT:PSS-离子液体胶体(PILC)墨水,这种墨水可以按需制造生物电子设备,如补充图1所示,并在方法部分详细描述。通过离心策略,离子液体作为催化剂促进离子交换反应,从而形成一个氢键网络,密集地堆积了PEDOT胶体,形成了PILC墨水(图1a)。与原始PEDOT:PSS(约1 S/cm)相比,PILC墨水展现了高导电性(286 S/cm)(补充图2),使其适合作为电极材料。此外,通过离心处理,PILC墨水中的过量离子液体和PSS被有效去除,从而得到了无需任何后处理过程的生物兼容墨水。此外,PILC墨水中的密集胶体堆积使其在3D打印过程中具有较高的屈服应力和自支撑的机械刚性(即存储模量为105 Pa,屈服应力为103 Pa)(图1b)。这使得PILC墨水挤出时具有较高的结构完整性,而与传统的PEDOT:PSS墨水相比,后者由于流变学特性限制了3D堆叠(图1c)。因此,PILC墨水能够制造高堆叠的3D结构、高分辨率结构(50 μm)以及悬浮结构(2 mm悬垂)。此外,PILC墨水的高导电性和即时可用性使其在各种生物医学应用中能够迅速使用,从而提高生理信号监测等领域的效率。
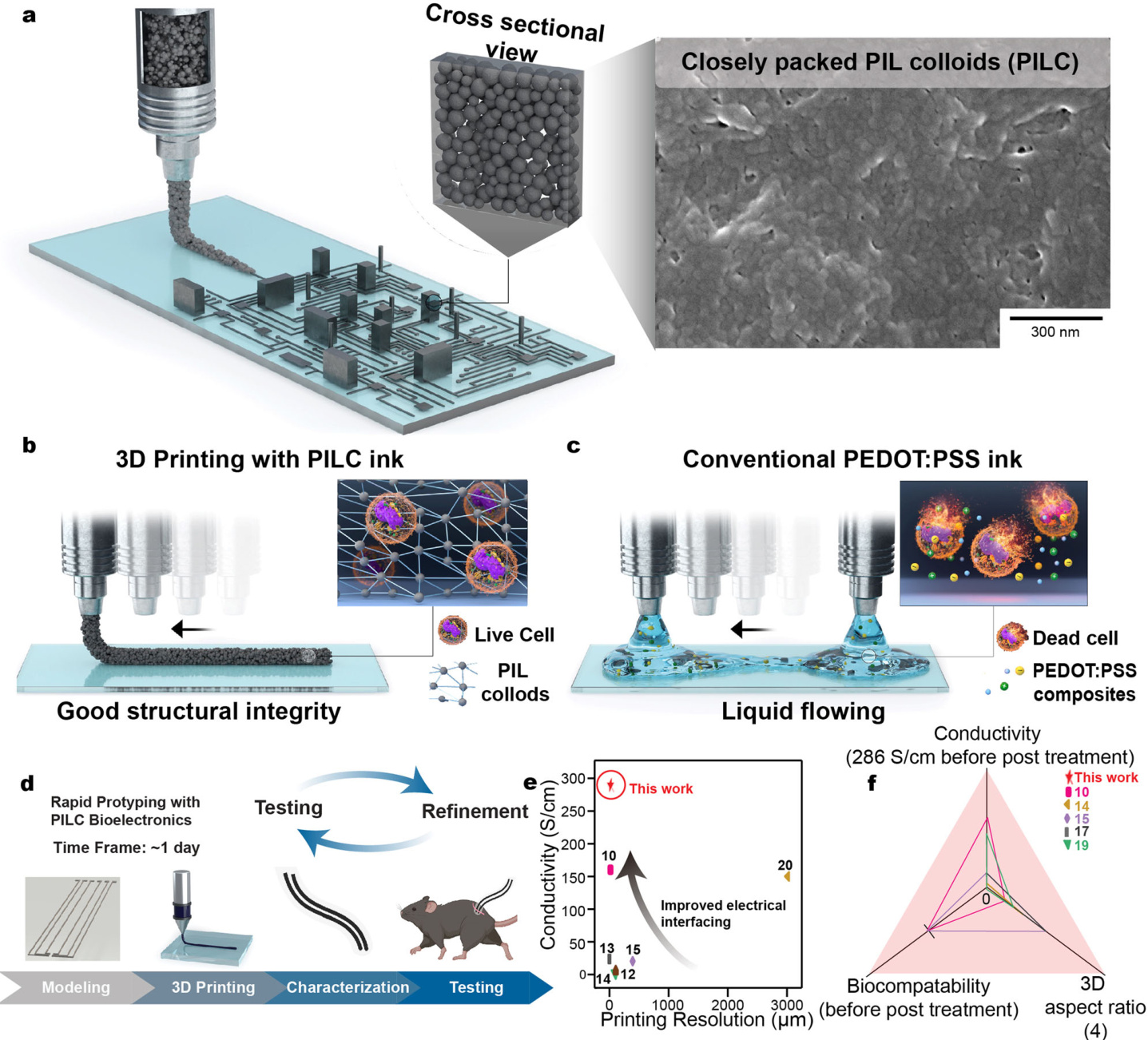
图1 | 用于3D打印生物电子设备的PEDOT:PSS离子液体胶体(PILC)墨水及其优异的结构完整性。
a. PILC墨水的示意图(左)和扫描电镜(SEM)图像(右);
b. PILC墨水的示意图,具有最小的离子液体含量和良好的结构完整性;
c. 常规PEDOT:PSS离子液体复合材料,含有细胞毒性离子液体成分;
d. PILC墨水用于快速原型制造PILC生物电子设备的示意图;
e. PILC墨水的导电性和打印分辨率,用于制造具有高结构完整性的3D打印结构,与以前使用3D可打印PEDOT:PSS墨水的工作进行比较;
f. 胶体粒子的3D堆积。数据的可重复性通过三次独立实验得到确认。
图1面板d由BioRender.com创建,使用Creative Commons Attribution-NonCommercial-NoDerivs 4.0国际许可协议发布。
由于PEDOT:PSS墨水受其流变学特性的限制,导致其在3D堆叠方面存在局限(图1c)。这使得能够制造高度堆叠的3D结构、高分辨率结构(50微米)和悬浮结构(2毫米悬垂)。此外,打印的PILC墨水具有高导电性和即时可用性,使其能够迅速应用于多种生物医学领域,从高效的生理信号记录(EMG和ECG)通过皮肤上的电子纹身(e-tattoos),到可植入生物电子设备用于光电皮层图谱(ECoG)记录和低电压(60 mV)坐骨神经体内刺激(图1d)。 独特的材料特性(高导电性、高打印分辨率、无后处理的生物兼容性以及高3D纵横比)使得PILC墨水作为通用PEDOT:PSS墨水在生物电子应用中具有广泛的适用性(图1e、f,补充图3和补充表1–3)。
¶ 结果:
¶ PILC墨水设计原理
PEDOT:PSS已被广泛报道在水溶液中以胶体状态存在。尽管先前的文献利用添加剂来诱导PEDOT链网络的相互连接,从而改善3D打印的流变学特性,但这些材料的流变学性能(例如低屈服应力和储存模量)限制了高纵横比结构的打印。与此相比,最近报道的材料通过密集堆积微液滴来提高储存模量,进而实现全方向打印。为了制造具有结构稳定性的PEDOT:PSS墨水以适应高立体结构的打印,我们假设PEDOT:PSS胶体颗粒在纳米尺度上的密集堆积能够引发类似的流变学特性。
为了实现上述目标,我们利用离子液体在水溶液(去离子水)中获得PEDOT:PSS胶体的密集堆积。假设离子液体在其中发挥三重作用:1)提高导电性;2)通过相分离诱导墨水形成;3)通过离子交换反应增强胶体颗粒之间的氢键作用,从而改善流变学特性(图2a)。我们选择了EMIM:TCB(1-乙基-3-甲基咪唑铵四氰硼酸盐)作为离子液体,因为它能显著提高导电性。通过在墨水制备过程中添加EMIM:TCB,PEDOT:PSS在离心后显示出相分离(补充图4)。与此对比,在不使用离子液体或使用DMSO的情况下,未观察到相分离,证明了离子液体在墨水形成中的关键作用。此外,在墨水制备过程中添加其他离子液体(1-乙基-3-甲基咪唑铵乙基硫酸盐(EMIM:ES)和1-己基-3-甲基咪唑铵四氰硼酸盐(HMIM:TCB))在离心后也未引起相分离(补充图5)。为了验证离子液体促进氢键作用的假设,我们测量了PILC墨水干燥时间变化下的FT-IR光谱(即薄膜中溶剂的不同含量)(图2b)。随着干燥时间的增加,–OH振动峰逐渐向低波数移动,表明氢键网络在增大。
¶ PILC墨水表征
为了研究PILC墨水在3D打印中的兼容性,我们评估了其流变学特性和3D图案化能力。PILC墨水的密集胶体微结构改善了挤出墨水的结构稳定性,表现为其粘度(在0.1Hz时约为1 MPa·s)和屈服应力(在0.01Hz时为1 kPa)显著高于原始PEDOT:PSS墨水的粘度(约为0.1 kPa·s在0.1Hz时)和屈服应力(47.4 Pa在0.01Hz时)(图2c、d)。原始PEDOT:PSS墨水在所有剪切速率下的粘度较低,这使其无法进行打印。相反,PILC墨水显示出剪切稀化行为,在低剪切速率下具有较高的粘度,这是由于PEDOT:PSS-离子液体胶体颗粒之间氢键作用的增强,以及墨水的长期稳定性(补充图6)。此外,原始墨水表现出牛顿流动行为;而PILC墨水则表现出流变增稠行为,在低剪切速率下表现出较高的剪切应力,说明PILC墨水可以在打印后保持其结构。为了分析PILC墨水中剪切稀化效应的来源,我们使用尿素来破坏氢键。随着尿素摩尔比的增加,PILC墨水的剪切稀化效应减弱,因为尿素会破坏PEDOT链之间相互连接的氢键(补充图7)。
PILC墨水的流变学特性可以通过调整PILC颗粒浓度来针对不同的打印条件进行调节(补充图8)。低浓度的PILC墨水适用于高分辨率打印;而高浓度的PILC墨水则具有较高的屈服应力,适用于制造高堆叠结构。这使得根据所需规格快速原型制造不同的设备设计成为可能。PILC墨水由于其18.8 nm的平均颗粒直径和8.1 nm的标准差(通过冷冻透射电子显微镜(cryo-TEM)测量),能够打印出高分辨率结构(约50 μm线宽)(图2e、补充图9和补充视频1)。
视频1观看地址:https://fb.biokingdom.top/f/986ab7f0551243339443/
由于其粘塑性行为,PILC墨水展示了通用的3D打印能力。当PILC墨水在低剪切速率下挤出后表现为固体状态,因此它不受液态打印行为(如润湿性)的限制。PILC墨水可以在多种基底上打印,无论其表面是亲水性还是疏水性,例如水凝胶、硅胶、猪皮等(补充图10)。此外,PILC墨水可以用于打印高的定制三维结构。PILC墨水的纵横比可达到4,相较于以往的PEDOT:PSS基墨水,这一比值相对较高,并且可以在60°C下1分钟内完全干燥(图2f–h)。
通过添加EMIM:TCB,PILC电极也表现出了高导电性(286 S/cm)。EMIM:TCB与PEDOT:PSS之间的相互作用已被证明能通过分离PEDOT和PSS,进而有效去除绝缘的PSS层,从而提高导电性。这一机制通过X射线光电子能谱(XPS)和拉曼光谱得到了验证(见补充图11)。PEDOT与PSS的比值可以通过整合S 2p XPS光谱中的PEDOT(162 ~ 167 eV)和PSS峰(166 ~ 171 eV)来计算。由于在离心过程中提取了PSS,PILC电极中的PEDOT相比例(PEDOT/PSS = 1.57)高于原始PEDOT:PSS(PEDOT/PSS = 0.46),这也解释了PILC电极导电性增强的原因。此外,拉曼光谱表明,PILC电极中的PEDOT链经历了从苯环型到奎啉型的结构转变。这一转变是由离子液体与PEDOT:PSS之间的离子交换反应引起的,并有助于PILC电极中的高导电性。
PILC电极通过离心相分离去除细胞毒性的离子液体,表现出即刻的生物兼容性,无需任何后处理(图3a)。首先,测量了残留的细胞毒性EMIM:TCB在沉淀中的存在情况。PILC电极的扫描电子显微镜-能谱(SEM-EDS)图谱显示,与原始PEDOT:PSS离子液体复合材料相比,PILC电极中的硼和氮原子的含量显著减少(图3b、c)。此外,XPS分析揭示了EMIM:TCB在上清液中的存在(补充图12),证明了细胞毒性成分的离心分离。
随后,利用体外MTT检测评估了PILC电极的生物兼容性,结果表明PILC电极的细胞毒性较原始PEDOT:PSS离子液体复合材料降低,并且与对照组的细胞毒性相似(图3d)。体外LIVE/DEAD试验进一步证明了PILC电极的高细胞活力(图3e)。为了进一步验证离心相分离对生物兼容性的作用,随着离心步骤的重复,细胞活力得到了改善。经过两次离心步骤后,细胞活力达到了92%(补充图13)。

图2 | 离子液体促进PILC墨水的氢键作用,用于高分辨率和高纵横比的3D打印。
a. 通过离子液体促进氢键作用形成的PILC墨水示意图。
b. PILC墨水在氢键作用进程中的FT-IR光谱(在干燥PILC墨水时测量)。
c. PILC墨水与传统PEDOT:PSS离子液体复合材料的粘度对比。
d. PILC墨水与传统PEDOT:PSS离子液体复合材料的剪切应力对比。屈服应力的增加表明了流变增稠行为的出现。
e. PILC墨水的高分辨率打印图像(约50 μm)。比例尺:50 μm。
f–g. 多层费里斯轮结构的顶部-前视图(f)和侧视图(g)图像。
h. 在打印多层结构过程中PILC墨水的图像。
¶ PILC墨水的按需应用
上述提到的PILC墨水的流变学特性使得全方位打印三维电路板成为可能(图4a)。PILC墨水可以通过同时移动x轴和z轴平台,在空中打印悬浮的互连线(图4b、c)。此外,三维斜向悬浮的电路线也可以打印到人造肾脏(由Ecoflex-0020材料制成,高度为7mm),展示了通过全方位打印实现PILC墨水三维互连的潜力。这种方法能够有效地桥接两个不同的接口,即使它们之间有较大的角度和间隙(见补充图14)。与先前报道的材料相比,PILC墨水表现出更高的屈服应力和储能模量,这对于实现全方位打印至关重要(图4d–f)。此外,通过改变PILC墨水的稀释比例,可以调节屈服应力和储能模量(补充图15)。为了提供适当的结构完整性并支持全方位打印,PILC墨水的稀释比需低于60%。此外,PILC墨水的高导电性使其可以用作LED互连线(图4g–i,补充视频2)。
视频观看地址2:https://fb.biokingdom.top/f/e206560e5b474f5399ba/
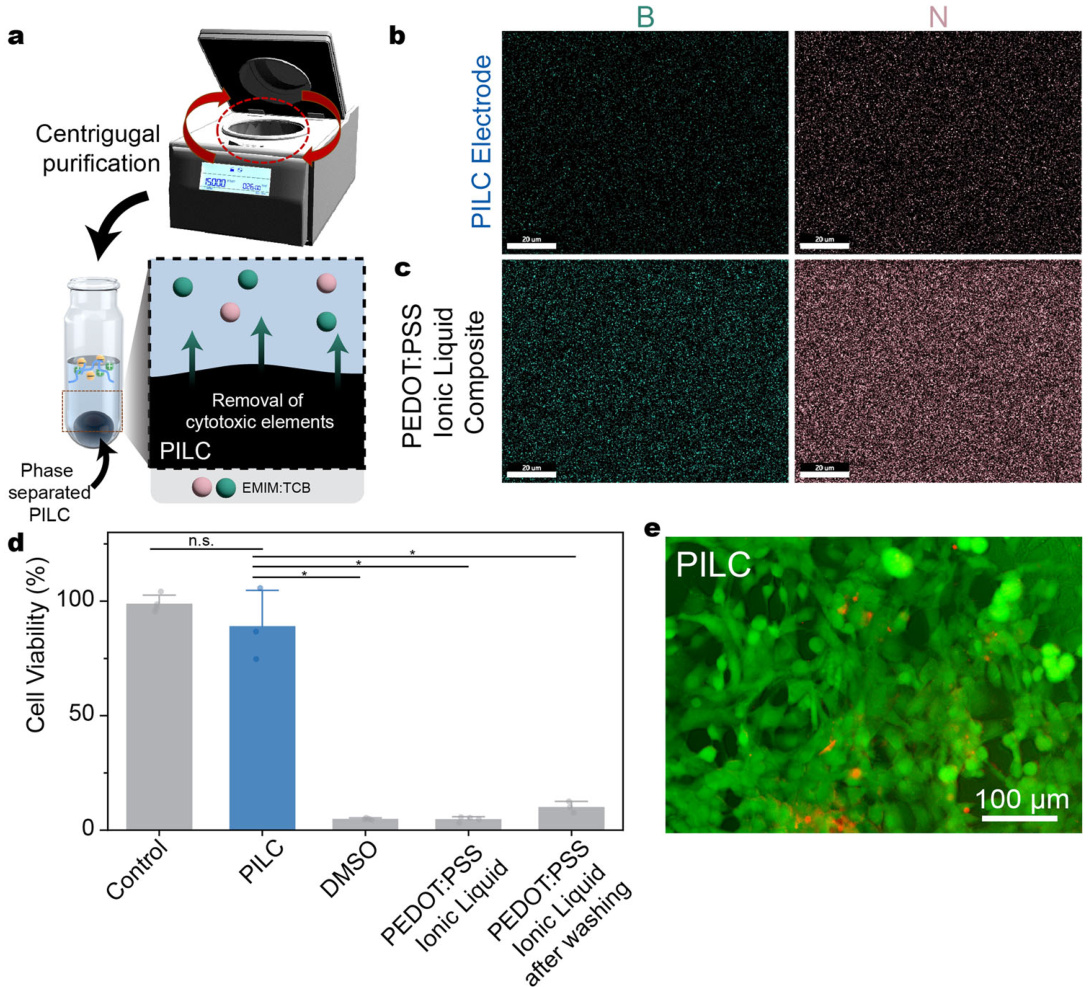
图3 | 通过离心去除离子液体来评估PILC墨水的生物兼容性。
a. PILC墨水中离子液体的离心去除示意图。
b、c. PILC电极(b)和PEDOT:PSS离子液体复合材料(c)中EMIM:TCB关键元素(硼和氮)的扫描电子显微镜-能谱(SEM-EDS)图谱。数据的可重复性通过三次独立实验得到验证。
d. PILC电极与PEDOT:PSS离子液体复合材料在清洗前后的细胞活力对比。PILC与对照组:P = 0.39175,t = −1.06193,d.f. = 2.17694;PILC与DMSO组:P = 0.01102,t = 9.33251,d.f. = 2.01484;PILC与PEDOT:PSS离子液体组:P = 0.01124,t = 9.33642,d.f. = 2.00211;PILC与PEDOT:PSS离子液体复合材料清洗后:P = 0.01124,t = −8.65617,d.f. = 2.10067。d小节中的值表示均值和标准差(PILC和PEDOT:PSS离子液体复合材料清洗后组,n = 3独立材料样本;DMSO、PEDOT:PSS离子液体和PEDOT:PSS离子液体复合材料清洗后组,n = 4独立材料样本)。统计显著性通过Welch校正后的双侧t检验进行确定;* p < 0.05,n.s.无显著性差异。
e. PILC电极的LIVE/DEAD细胞活力检测图像(n = 3独立PILC样本)。
与原始PEDOT:PSS墨水和其他PEDOT:PSS复合材料相比,PILC墨水提高的屈服应力和储能模量使得PILC墨水能够进行高纵横比的3D打印,而打印过程中打印结构不会塌陷(图5a)。此外,由于其高屈服应力和储能模量,PILC墨水可以在空气中打印,而无需支撑层,这使得能够创建具有3D互连潜力的桥接结构(图5b)。利用这些能力进行高纵横比和空气打印后,使用PILC墨水打印的金字塔结构上安装了LED芯片(图5c),并随后成功操作(图5d)。
PILC墨水的独特性质使其成为快速按需制造皮肤生物电子设备的理想材料,适用于健康监测应用。由于由PILC墨水打印的电极与生物组织具有相似的机械性能(杨氏模量750 kPa,拉伸强度139.3 kPa,韧性4.0 kJ/m³,见补充图16),因此PILC电极可以作为软电极与组织进行界面连接。此外,打印在软基材(如PDMS)上的PILC电极可在高达90%的应变下进行拉伸,并能承受70%应变的循环负荷,经过1000次循环(补充图17和图18),与只能拉伸至10%应变的自由悬挂PILC薄膜相比,具有更好的柔韧性。这可以归因于先前报告的能量耗散机制。
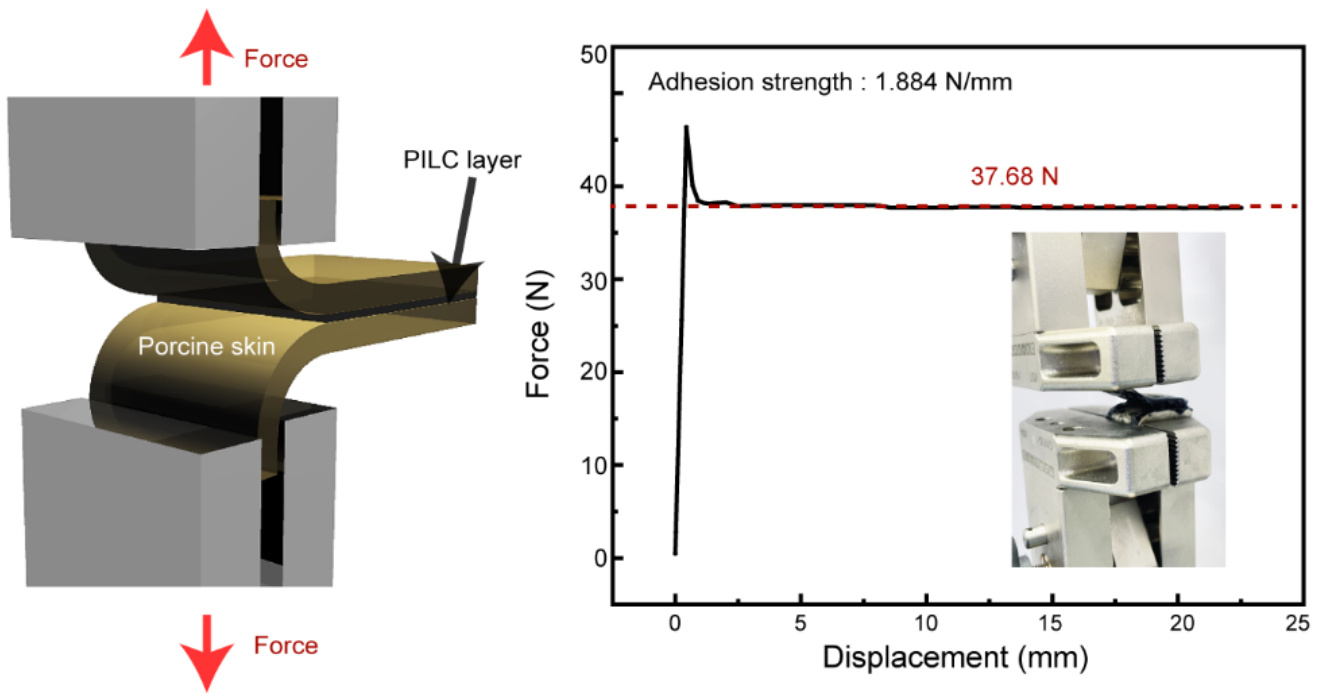
我们展示了使用PILC墨水制造大面积皮肤电子纹身(补充图19a)。将PILC墨水打印在超疏水(聚丙烯)柔性基材上后,PILC电极可在轻柔压力下转移到湿润的皮肤上(补充图19a,补充图20),并具有1.884N/mm的附着力强度,这意味着在从湿猪皮上剥离附着有PILC薄膜的皮肤时需要这种强度(补充图21)。PILC电极的高导电性和良好的附着接触,使其与皮肤的界面阻抗显著降低(1 kHz时为200 kΩ·mm²),与商业3M电极(1 kHz时为8000 kΩ·mm²)相比,具有更低的界面阻抗(补充图19b)。
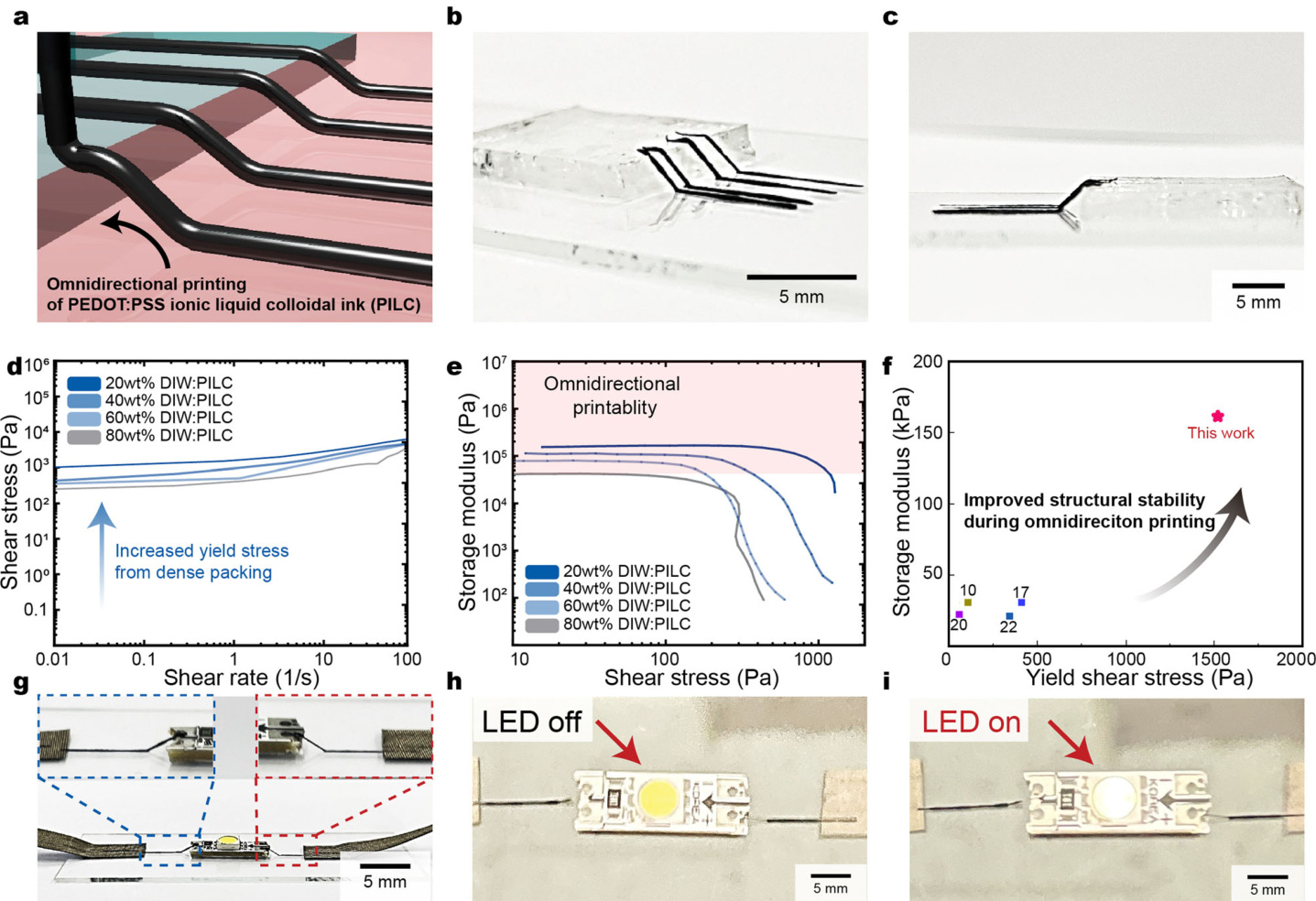
图 4 | PILC墨水实现了3D电路的全方位打印。
a. PILC墨水用于全方位打印导电互连的示意图。
b, c. 打印的PILC墨水3D电路的大型悬垂结构的顶部视图(b)和侧面视图(c)图像。
d. 优化后的PILC墨水的剪切应力,用于全方位打印。
e. 优化后的PILC墨水的储存模量,用于全方位打印。红色阴影区域标出稳定全方位打印所需的储存模量。
f. PILC墨水的储存模量与之前报告的用于3D打印的PEDOT:PSS墨水的比较。
g–i. 打印的PILC墨水用于与LED进行3D连接的图像(g)。LED关闭(h)和开启(i)的图像。
除了皮肤生物电子设备,PILC 墨水还可以用于制造可植入生物电子设备。为了使 PILC 设备能够在体内环境中使用,PILC 电极需要能够承受手术插入过程中的机械和电气应力,以及可能出现的动物运动反应(例如,腿部运动)。为了验证机械稳定性,进行了一个循环弯曲测试,弯曲半径为 1.5 毫米(图 6a)。PILC 电极在 10,000 次弯曲循环中电阻变化最小,证明其在体内电极应用过程中能承受机械变形。此外,PILC 电极在生理盐水中的电导率表现良好,并且耐湿生理条件,表明其可以用于电生理记录(图 6b 和补充图 22)。另外,PILC 电极相较于传统金属(如金)的高电荷储存能力,展示了其在生理环境中有效的电荷注入能力,并为使用较低刺激电压提供了可能,从而在体内创造了更安全的刺激条件(图 6c 和补充图 23)。为了评估 PILC 设备在可植入生物电子设备中的可行性,我们在小鼠体内模型中进行了不同应用(图 6d 和补充图 24)。PILC 墨水的高电导率和高分辨率打印(线宽和间距分别为 50 和 100 微米)使其可以用于光遗传学 ECoG 设备,而其高 CSC 也使其适用于坐骨神经刺激设备。一个多通道 PILC ECoG 设备能够在 Thy1-Chr2 转基因小鼠中以高信噪比(SNR 9.0)记录光诱发的 ECoG 信号。
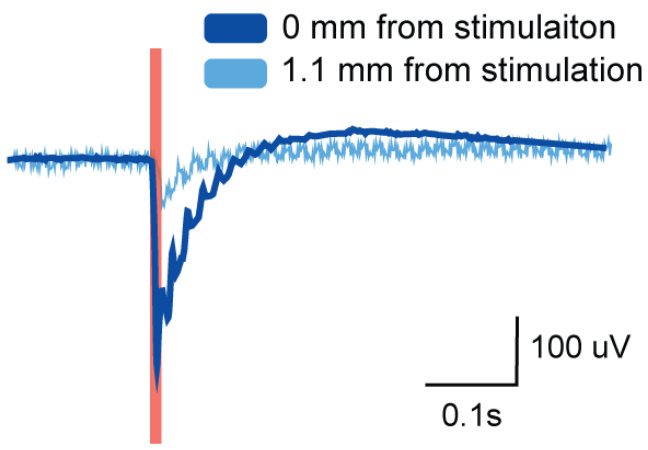
我们还展示了 PILC 墨水的多功能打印技术,使得制造 3D 生物电子设备成为可能,例如垂直尖峰阵列(图 7a,b)。这些由具有高纵横比的 PILC 电极阵列组成的柔性和生物兼容设备,可以记录来自深层脑区的神经信号,例如海马体,这是 2D 表面阵列难以实现的。我们通过检查信号频谱来验证所记录的信号具有海马信号的特征。海马体的一个主要信号特征是θ波振荡,它在 4~8Hz 的频率带中十分显著。3D PILC 阵列在 ~5Hz 及其谐波频率处显示出峰值,如功率谱密度图(图 7c)、频谱图(图 7d)和原始信号波形图(图 7e)所示。相比之下,2D PILC 阵列由于受限于大脑表面的空间限制,在这些频率处未观察到此峰值(图 7c–e)。
此外,3D PILC 阵列在感官诱发电位的电生理记录中表现出高保真度(图 7f)。当神经探头插入皮层表面下 300 ~ 500 微米(即 IV ~ V 层)时,皮层神经信号的幅度达到最大值。我们选择了次级视觉皮层,它已被证明在应用视觉刺激时,相比于初级视觉皮层,其信号幅度有所减弱。
在将视觉刺激应用于与 PILC 阵列对侧的眼睛时,我们在 3D PILC 阵列中观察到了与刺激强度相关的信号,而 2D 阵列则未能显示出相同的信号(图 7g,h)。视觉诱发信号幅度与刺激强度的相关性验证了成功记录感官诱发电位。此外,为了验证信号不是录制伪影,还进行了同侧视觉刺激实验。在同侧刺激下未观察到信号,表明光诱发伪影最小(图 7i)。

图 5 | 无支撑层的空气打印 3D 高纵横比 PILC 墨水打印。
a. 3D 高纵横比打印 PILC 墨水的图像。
b. 无支撑层的空气打印 PILC 墨水的图像。
c. 模拟金字塔结构的 3D 打印 PILC 结构图像。
d. 安装在 3D 打印 PILC 结构上的 LED 图像。
¶ 讨论
我们开发了一种一次性策略,用于制造 3D 可打印、生物兼容且导电性高的 PEDOT:PSS-离子液体胶体(PILC)墨水,适用于各种生物电子学应用。通过使用离子液体促进的相分离,PILC 墨水在无需后处理的情况下展示出高电导率,并具有有利的流变学特性,适用于打印高立体结构。此外,离心过程去除了多余的离子液体,使得墨水在无需后处理的情况下具备生物兼容性和化学稳定性。PILC 墨水的多功能打印能力使其在从 3D 电路板、皮肤生物电子设备(用于健康监测)到具有高定制性的植入式生物电子设备等领域都具有广泛的应用潜力。与当前需要长时间后处理的 3D 打印墨水相比,PILC 墨水的独特性能使其作为通用 PEDOT:PSS 墨水具有潜力。快速按需制造类似组织的 PILC 生物电子设备为未来疾病治疗中的身体探测提供了一个加速平台。
¶ 方法
¶ 材料
PEDOT:PSS 水溶液(1.0 ~ 1.3 wt%)购买自 Heraeus Electronic Materials。EMIM:TCB(1-乙基-3-甲基咪唑四氰基硼酸盐)、TWEEN 80 和 PBS(磷酸盐缓冲溶液)购自 Sigma-Aldrich。使用前,EMIM:TCB 需要进行精制,方法是将其与水(1:20 体积比)混合,然后以 3000 rpm 的速度进行离心(离心力(RCF):1006 g)20 分钟。收集上清液后,在 155°C 下加热 2 天以提取纯净的 EMIM:TCB。相对离心力(RCF)的计算公式如下:
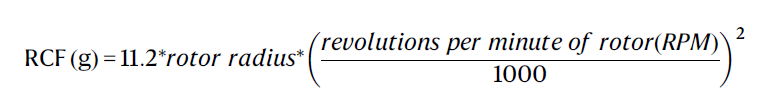
冻干 PEDOT:PSS-离子液体复合材料的制造
将 PEDOT:PSS 溶液、水和精制的 EMIM:TCB 按 2:1:0.03 wt% 的比例混合,在 900 rpm 下搅拌超过 12 小时。随后,将 PEDOT:PSS-离子液体复合材料浸入液氮中,冷冻处理 10 分钟,并进行 72 小时的冻干处理。
水不溶性纯 PEDOT:PSS 的制造
将 PEDOT:PSS 溶液和 DMSO 按 2:1 wt% 的比例混合,在 900 rpm 下搅拌超过 12 小时。随后,将 PEDOT:PSS-DMSO 复合材料浸入液氮中,冷冻处理 10 分钟,并进行 72 小时的冻干处理。
PILC 墨水的制造
将 10 毫升水和 200 毫克冻干的 PEDOT:PSS-离子液体复合材料放入超声处理中,在 30% 振幅下使用超声探头进行 2 小时的处理(VC 505,Sonics & Materials,3 毫米微探头)。在超声处理之前,将冻干的 PEDOT:PSS-离子液体复合材料切成小块。随后,加入 30 毫克 TWEEN 80,并在 20% 振幅下进行 3 分钟的超声处理。处理后的混合物进行离心,离心条件为 15,000 rpm,离心时间 45 分钟(RCF:25,155 g)。离心后,倒掉上清液,加入 10 毫升水,并与沉淀物充分混合。然后,将该溶液再次在相同条件下进行离心,最终获得的沉淀颗粒用作 PILC 3D 打印墨水。PILC 墨水的流变学性能通过在行星混合器(Thinky AR-100)中重新分散于水中进行调节,混合模式下搅拌 1 分钟。
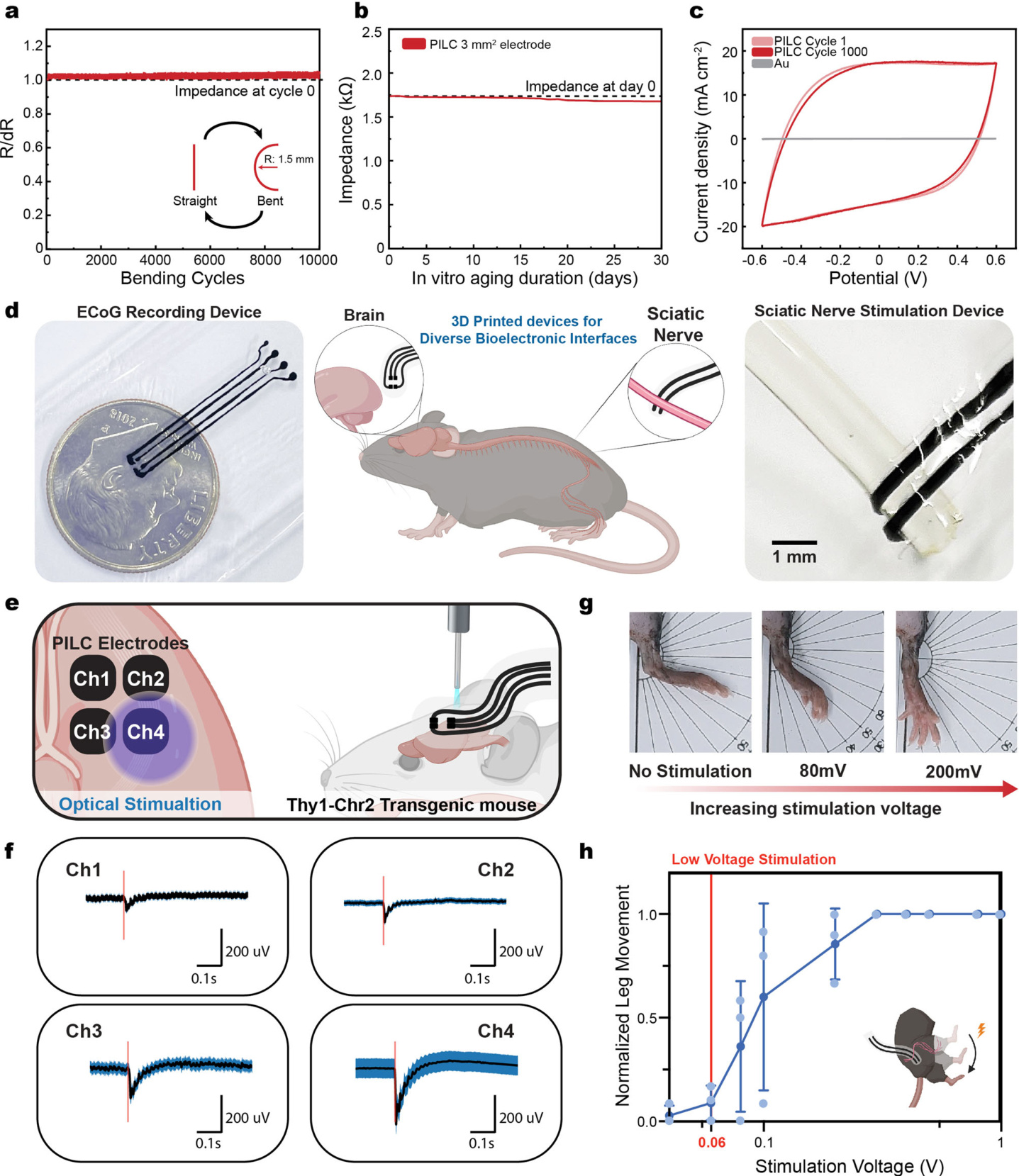
图 6 | 用于植入式生物电子设备的 3D 打印 PILC 设备
a. 弯曲循环次数与柔性 PILC 设备电阻变化的关系(弯曲半径为 1.5 毫米)。
b. PILC 设备在 37°C 的 PBS 溶液中孵育 30 天后的阻抗稳定性。
c. PILC 设备在 1000 次循环伏安测试中的电荷储存能力。金电极作为参考。
d. 光遗传学 ECoG 记录(左)和坐骨神经电刺激(右)用 PILC 植入设备的示意图(中)及图像。
e. Thy1-Chr2 转基因小鼠中光诱发 ECoG 记录的示意图。
f. 多通道设备中每个通道在光刺激下的 ECoG 信号平均波形。红色垂直线表示光刺激脉冲的开始(脉冲宽度为 5 毫秒)。
g, h. 电刺激坐骨神经时 PILC 设备的示意图及图像。
g. 图像展示了依赖于刺激电压的腿部运动(h)。
h. 刺激电压与标准化腿部运动的关系。60mV 标记以示腿部运动的开始。g 中的数值表示均值和标准偏差(n = 3 个独立 PILC 样品)。
图 6 / 面板 d, e 和 h 使用 BioRender.com 创建,并依据创作共用许可证(Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International)发布。

图 7 | 用于柔性体内生物电子设备的 3D PILC 设备
a. 3D PILC 阵列用于制造柔性、生物兼容的 3D 设备的示意图。3D PILC 阵列能够定制化与来自更深皮层层次和海马体的神经信号进行接口,而这是 2D 表面阵列难以实现的。
b. 通过高纵横比打印 PILC 墨水制造的 3D PILC 阵列图像。
c. 3D 和 2D PILC 阵列记录来自深层脑区(如海马体)内源性神经信号的功率谱密度(PSD)。红色阴影区域表示 θ 波振荡的频率带(4 ~ 12 Hz)。PSD 中的 θ 波带峰值及其谐波频率用红色箭头标出。
d. 3D(顶部)和 2D(底部)PILC 阵列的频谱图。
e. 从 3D PILC 阵列(顶部)和 2D PILC 阵列(底部)记录的原始局部场电位信号。
f. 在体内小鼠模型中次级视觉皮层的感官刺激示意图。
g–i. 来自(g)2D 阵列在对侧刺激下的诱发神经信号,(h)3D 阵列在对侧刺激下的诱发神经信号,以及(i)3D 阵列在同侧刺激下的诱发神经信号。
图 7 / 面板 a 和 f 使用 BioRender.com 创建,并依据创作共用许可证(Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International)发布。
PILC 墨水的 2D 和 3D 打印
使用直接墨水写入打印机(BIO X6,CELLINK)将 PILC 墨水打印到各种薄膜上。将制备好的 PILC 墨水装入 3 毫升注射器,并在打印过程中通过压力驱动挤出 PILC 墨水。喷嘴的尖端直径和打印速度根据具体要求进行设置(喷嘴直径:30 μm 至 250 μm,打印速度:6.4 mm/s 至 12 mm/s)。对于 PILC 墨水的 3D 打印,如全方向打印,使用 MATLAB 软件(R2019a,The MathWorks, Inc.)定制 g-code,并结合自动 x 轴运动(打印速度:1.4 mm/s 至 2.0 mm/s,使用 30 号喷嘴)、z 轴运动(打印速度:1.4 mm/s 至 2.0 mm/s)和压力控制(50–100 kPa)。
全方向打印过程中 3D 互连的制造
为了展示 3D 互连的制造,将一个 SMD LED 芯片(5 V;GrinMax,带有 1.5 毫米悬垂)安装在玻璃基底上。PILC 墨水被打印到 LED 的阴极和阳极上,并通过镍导电胶带(3M)连接。为了启动 3D 互连的 LED,通过源表(Keithley 2400,Tektronix Inc.)向 LED 芯片施加 5 V 电压。
制造用于 LED 芯片操作的 3D 高纵横比电路
为了展示 3D 高纵横比电路的制造,将一个 SMD LED 芯片(2.6 V;HSMH-H170,带有 7 毫米的打印高度)安装在一个金字塔形的 PILC 结构上。使用银膏将 PILC 墨水连接到 LED 的阴极和阳极,并通过特氟龙包裹的电线(SME)连接。为了启动 LED,通过源表(Keithley 2400,Tektronix Inc.)向 LED 芯片施加 2.6 V 的电压。
制造皮肤贴合电子纹身(e-tattoo)生物电子设备
PILC 墨水直接打印在超疏水薄膜(聚噻吩)上,以制造皮肤贴合电子纹身生物电子设备。采用 CAD 软件(Solidworks)绘制的自定义设计进行制造。打印后的 PILC 皮肤电子纹身用于在将其转移到湿润皮肤上后监测生理信号(EMG 和 ECG)。
原始数据通过 LabScribe 进行滤波,以去除噪声和伪影。EMG 和 ECG 信号都经过了 60 Hz 的陷波滤波器,以消除电力线噪声。EMG 信号进一步经过 50 Hz 的高通滤波器和 150 Hz 的低通滤波器,以去除潜在的低频运动伪影,同时保留相关的 EMG 频率范围(50–150 Hz)。ECG 信号通过 LabScribe 中的心脏设置进行测量,经过了 0.5 Hz 的高通滤波器和 30 Hz 的低通滤波器。
对于 EMG 信号,信噪比的计算公式如下:
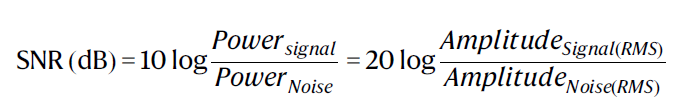
制造 PILC 打印的 2D 植入式设备
首先,将聚二甲基硅氧烷(PDMS;Sylgard 184,Dow Corning)预聚物溶液进行打印,作为体内条件下的绝缘基底。打印完 PDMS 预聚物溶液后,在 80°C 的烘箱(OV3-30,JEIO TECH)中固化 30 分钟。然后,直接在固化后的 PDMS 基底上打印 PILC 墨水,制造植入式设备。
制造 PILC 打印的 3D 植入式设备
首先,将 PDMS 预聚物溶液进行打印,作为体内条件下的绝缘基底,并在 80°C 下固化 30 分钟。
然后,使用高分辨率(50μm)直接在固化后的 PDMS 基底上进行 2D 打印,以制造 3D 植入式设备。
接着,使用定制的 g-code 在 2D 记录区域上直接打印具有高纵横比的 3D PILC 微针。最后,对除记录区域外的 3D 植入式设备进行 PDMS 封装。打印的纵横比如补充图 27 所示。
材料表征
SEM 图像和 EDS 分析使用 SU8230 扫描电子显微镜(Hitachi High-Technologies Co.,日本)进行。为了防止表面电荷积累,PILC 电极在 SEM 测量前涂上一层 3 nm 的锇层。
Cryo-TEM 图像使用 200 kV Cryo-场发射 TEM(Thermo Fisher,USA)获取。样品通过将 PILC 墨水稀释在去离子水中,然后在液氮中冻干制备。
FT-IR 光谱使用 Nicolet iS50(Thermo Fisher Scientific Instrument,USA)对 PILC 墨水在干燥过程中进行测量。
X 射线光电子能谱(XPS)使用 sigma 探针(Thermo VG Scientific,USA)对 PILC 电极进行分析。
高分辨率拉曼光谱使用 ARAMIS(Horiba Jobin Yvon,法国)与 633 nm 波长激光对 PILC 电极进行测量。
流变学表征
PILC 墨水的流变学表征使用流变仪(Anton Paar MCR302,8 mm 平行板)在室温下进行。
在 0.1 /s 到 100 /s 的剪切速率范围内,测量了不同浓度 PILC 墨水的粘度。
在 1% 固定剪切应变下,测量了不同 PILC 颗粒与水的比例下的剪切应力与剪切速率的关系。基于剪切速率下的粘度和屈服应力,可以进一步评估 PILC 墨水的流动特性和适用于打印过程中的稳定性。
机械表征
自由悬挂的打印 PILC 电极使用锋利的剃刀片处理,形成一个条形试样,尺寸为 3 mm(宽度)、12 mm(长度)和 7 μm(厚度)。该试样固定在铝夹具之间,并用胶粘剂(DP-420 Off-White, 3M, USA)粘贴在水面上。水面表征具有保持水合的优点,能够最小化张力测试过程中由于重力引起的偏移。
负载通过线性驱动器(M-111.1DG,PI,德国)和高分辨率负载传感器(LTS-5GA,KYOWA,日本)施加在膨胀的 PILC 电极上,系统集成在线性 XYZ 阶段中。为了精确测量应变数据,使用了与数字图像相关性(DIC)系统配合的电荷耦合器件相机。应力-应变曲线通过收集的负载和应变数据推导得到。拉伸测试在室温下进行,以确保获得的应力-应变数据的可靠性和可重复性。
电气表征
PILC 电极的电导率使用四探针仪(Keithley 2420,Keithley Instruments,USA)进行测量。循环伏安(CV)和电化学阻抗谱(EIS)分析使用电位仪(ZIVE SP1,Won A tech,韩国)进行。打印的 2D 和 3D PILC 电极同时用作工作电极和对电极,而金电极作为参考电极。PBS(磷酸盐缓冲溶液)用作电解质。CV 在 300 mV/s 的扫描速率下测量,扫描电压范围为 −0.6 V 到 0.6 V。根据补充图 23 中的公式,从 CV 曲线计算 CSC。使用电位仪对打印的 PILC 生物电子设备的阻抗进行评估,评估周期为一个月,每天测试一次(幅度 10 mV,频率范围 100 Hz 至 1 MHz),在 PBS 溶液中进行,以证明其化学稳定性。
体外生物相容性
体外生物相容性通过将 PILC 电极或对照材料与 NIH/3T3 细胞(ATCC,CRL-1658)共同孵育在细胞培养基中进行评估。细胞孵育在 5% CO2 氛围下,37°C 环境中孵育 24 小时。细胞培养基由 Dulbecco 改良 Eagle 培养基、10% 胎牛血清和 1% 青霉素/链霉素组成。NIH/3T3 细胞孵育在 24 孔细胞培养板中。细胞活力使用 MTT 检测法(ABCAM,ab228554)测量,吸光度在 460 nm 处测量,使用微孔板读数仪(Molecular Devices,SpectraMax iD3)。对于细胞活力成像,使用 LIVE/DEAD 活性/细胞毒性试剂盒(ThermoFisher,L3224),并使用荧光显微镜(Nikon)拍摄图像。
人体实验
关于电子皮肤(e-skin)电子设备的离体实验在韩国科学技术院(KAIST)伦理审查委员会的批准下进行(批准号:KH2023-153)。我们招募了健康成人作为实验参与者(2名男性;年龄均超过 25 岁)。所有受试者在知情同意后自愿参与实验。
动物实验与外科手术程序
使用了雄性 C57BL/6 Thy1-ChR2-YFP 转基因小鼠(8 周龄或以上,Jackson Laboratory,品系 B6.Cg-Tg(Thy1-COP4/EYFP)18Gfng/J,n = 3)进行体内光诱发电皮层图(ECoG)记录实验。C57BL/6 N(8 周龄或以上,Koatech,n = 3)和 C57BL/6 J(8 周龄或以上,Jackson Laboratory,n = 3)野生型小鼠用于体内坐骨神经刺激实验、2D 和 3D 内源性电皮层图信号及视觉诱发电位。此研究未涉及基于性别的分析。所有小鼠均在12小时昼夜循环、22–24°C、45%湿度的条件下饲养,并自由获取食物和水。所有小鼠实验已通过 KAIST 动物伦理委员会审核和批准。
在体内实验过程中,小鼠通过异氟烷吸入麻醉(诱导浓度 4-5%,维持浓度 1-2%)进行麻醉,并在氧气流下维持麻醉。手术过程中,监测了呼吸频率和体温等生命体征。
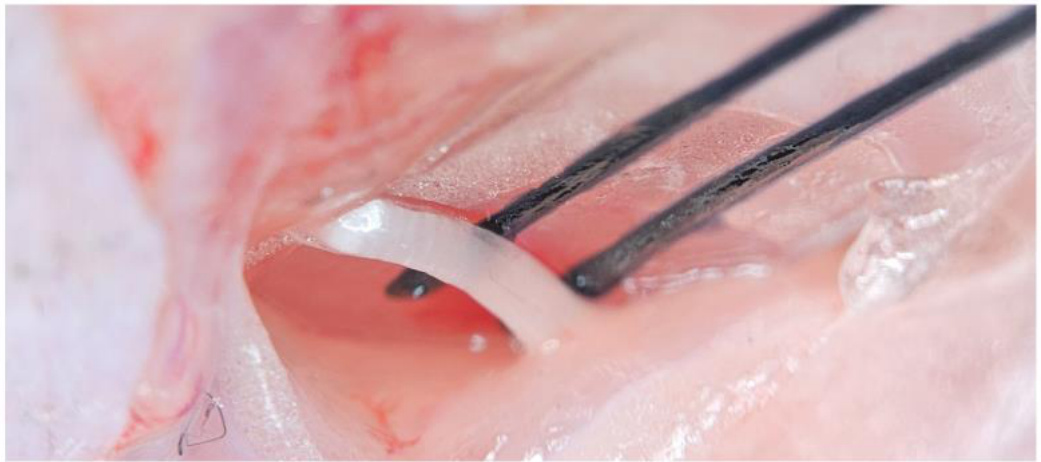
体内坐骨神经刺激实验
在小鼠麻醉后,C57BL/6N(8 周龄或以上,Koatech)或 C57BL/6 J(8 周龄或以上,Jackson Laboratory)野生型小鼠的后肢皮肤毛发被去除,并通过分离臀大肌和股二头肌暴露坐骨神经。按照之前的描述,制备好的 PILC 设备被放置在坐骨神经下方,并连接了两个电极用于电刺激。使用隔离脉冲刺激仪(Model 2100, AM Systems)施加电刺激(1Hz,5ms 脉冲持续时间)。在小鼠腿部下方放置了一个量角器,并通过视频录像记录电刺激过程中腿部的位移角度。
体内光学诱发的皮层电图信号记录
在小鼠麻醉后,使用 C57BL/6 Thy1-ChR2-YFP 转基因小鼠(8 周龄或以上,Jackson Laboratory,品系 B6.Cg-Tg(Thy1-COP4/EYFP)18Gfng/J)进行立体定位手术。通过切开头皮暴露颅骨,使用经过消毒的牙科钻头在头骨上开设 3mm×3mm 的颅窗。将 4 通道 PILC 设备放置在颅窗上,并与多通道电生理记录设备(Lab Rat Ephys,Tucker-Davis Technologies)连接,用于记录 OEP 信号。将蓝色激光(465 nm,IOS-465 Intelligent Optogenetics System,RWD)连接到光纤上,以对皮层表面进行光学刺激。光纤被对准到四个通道之一,并施加光学刺激(1Hz,5ms 脉冲持续时间)。
在分析过程中,OEP 信号通过模拟带通滤波器(1 ~ 1000 Hz)进行滤波。随后,使用数字低通滤波器(400Hz)进一步处理信号,并通过自定义代码对每个刺激脉冲的起始时刻对波形进行对齐和分段,计算并可视化平均光学诱发的皮层电图信号。
体内2D和3D内源性皮层电图信号与视觉诱发电位的记录
手术过程与光学诱发皮层电图信号记录相同,使用 C57BL/6N(8 周龄或以上,Koatech)和 C57BL/6 J(8 周龄或以上,Jackson Laboratory)野生型小鼠。在硬膜上方放置 2D 或 3D PILC 设备进行信号记录。OEP 信号通过模拟带通滤波器(3 ~ 300 Hz)进行滤波,使用多通道电生理记录设备(Lab Rat Ephys,Tucker-Davis Technologies)。
为了记录视觉诱发电位,将 2D 或 3D PILC 设备放置在次级视觉皮层上(−1mm ML;−3mm AP)。使用蓝色激光(465 nm,IOS-465 Intelligent Optogenetics System,RWD)从距离处对对侧或同侧眼睛进行光学刺激。通过 MATLAB 对每次刺激脉冲起始时刻对波形进行对齐并计算平均波形,从而得到视觉刺激期间的平均波形。
统计分析
使用 Origin Pro 进行统计分析。所有组都进行了 Shapiro-Wilk 正态性检验,结果显示所有数据均符合正态分布。还使用 F 检验测试了样本组之间方差的齐性。对于具有相等方差的组之间,使用两样本 t 检验来确定是否存在统计学差异。如果测试组之间的方差不相等,则使用 Welch 校正的两样本 t 检验。
报告摘要
有关研究设计的更多信息,请参阅链接到本文的《Nature Portfolio Reporting Summary》。
数据可用性
作者声明,支持本研究发现的数据可在本文及其补充信息文件中找到。源数据已在本文提供。
代码可用性
用于 PILC 墨水打印应用的软件代码可在请求时从通讯作者处获得。
¶ 参考文献
- Ashish, Ahmad, N., Gopinath, P. & Vinogradov, A. 3D Printing In Medicine: Current Challenges And Potential Applications. in 3D Printing Technology in Nanomedicine (eds. Ahmad, N., Gopinath, P. & Dutta, R.) Ch.1 (Elsevier, 2019).
- Shahrubudin, N., Lee, T. C. & Ramlan, R. An Overview on 3D Printing Technology: Technological, Materials, and Applications. Procedia Manuf. 35, 1286–1296 (2019).
- Kalkal, A. et al. Recent advances in 3D printing technologies for wearable (bio). Sens. Addit. Manuf. 46, 102088 (2021).
- Park, Y.-G. et al. High-resolution 3D printing for electronics. Adv. Sci. 9, 2104623 (2022).
- Liu, J. et al. 3D Printing of multifunctional conductive polymer composite hydrogels. Adv. Funct. Mater. 33, 2214196 (2023).
- Yuk, H., Lu, B. & Zhao, X. Hydrogel bioelectronics. Chem. Soc. Rev. 48, 1642–1667 (2019).
- Oh, B. et al. Ultra-soft and highly stretchable tissue-adhesive hydrogel based multifunctional implantable sensor for monitoring of overactive bladder. Biosens. Bioelectron. 225, 115060 (2023).
- Choi, S. et al. Fibre-infused gel scaffolds guide cardiomyocyte alignment in 3D-printed ventricles. Nat. Mater. 22, 1039–1046 (2023).
- Zhou, T. et al. 3D printable high-performance conducting polymer hydrogel for all-hydrogel bioelectronic interfaces. Nat. Mater. 22, 895–902 (2023).
- Yuk, H. et al. 3D printing of conducting polymers. Nat. Commun. 11, 1604 (2020).
- Xu, Y. et al. Poly(3,4-ethylenedioxythiophene) (PEDOT) as promising thermoelectric materials and devices. Chem. Eng. J. 404, 126552 (2021).
- Xie, X. et al. Liquid-in-liquid printing of 3D and mechanically tunable conductive hydrogels. Nat. Commun. 14, 4289 (2023).
- Mire, C. A., Agrawal, A., Wallace, G. G., Calvert, P. & Panhuis, M. in het. Inkjet and extrusion printing of conducting poly(3,4-ethylenedioxythiophene) tracks on and embedded in biopolymer materials. J. Mater. Chem. 21, 2671–2678 (2011).
- Wei, H. et al. Orthogonal photochemistry-assisted printing of 3D tough and stretchable conductive hydrogels. Nat. Commun. 12, 2082 (2021).
- Lu, B. et al. Pure PEDOT:PSS hydrogels. Nat. Commun. 10, 1043 (2019).
- Zhang, P., Aydemir, N., Alkaisi, M., Williams, D. E. & Travas-Sejdic, J. Direct writing and characterization of three-dimensional conducting polymer PEDOT Arrays. ACS Appl. Mater. Interfaces 10, 11888–11895 (2018).
- Ghaderi, S., Hosseini, H., Arash Haddadi, S., Kamkar, M. & Arjmand, M. 3D printing of solvent-treated PEDOT:PSS inks for electromagnetic interference shielding. J. Mater. Chem. A. 11, 16027–16038 (2023).
- Xing, W. et al. Omnidirectional printing of PEDOT:PSS for highconductivity spanning structures. ACS Appl. Mater. Interfaces 15, 57717–55725 (2023).
- Hill, I. M. et al. Imparting High Conductivity to 3D Printed PEDOT:PSS. ACS Appl. Polym. Mater. 5, 3989–3998 (2023).
- Kee, S., Haque, M. A., Corzo, D., Alshareef, H. N. & Baran, D. Selfhealing and stretchable 3D-printed organic thermoelectrics. Adv. Funct. Mater. 29, 1905426 (2019).
- Lee, B. et al. Omnidirectional printing of elastic conductors for three-dimensional stretchable electronics. Nat. Electron 6, 307–318 (2023).
- Teo, M. Y. et al. Highly stretchable and highly conductive pedot:pss/ionic liquid composite transparent electrodes for solutionprocessed stretchable electronics. ACS Appl. Mater. Interfaces 9, 819–826 (2017).
- Kee, S. et al. Controlling molecular ordering in aqueous conducting polymers using ionic liquids. Adv. Mater. 28, 8625–8631 (2016).
- de Izarra, A., Park, S., Lee, J., Lansac, Y. & Jang, Y. H. Ionic Liquid Designed for PEDOT:PSS Conductivity Enhancement. J. Am. Chem. Soc. 140, 5375–5384 (2018).
- Park, H. et al. Retarding ion exchange between conducting polymers and ionic liquids for printable top electrodes in semitransparent organic solar cells. ACS Appl. Mater. Interfaces 12, 2276–2284 (2020).
- Petit, T. et al. Unusual water hydrogen bond network around hydrogenated nanodiamonds. J. Phys. Chem. C. 121, 5185–5194 (2017).
- Gong, K., Hou, L. & Wu, P. Hydrogen-bonding affords sustainable plastics with ultrahigh robustness and water-assisted arbitrarily shape engineering. Adv. Mater. 34, 2201065 (2022).
- Amat Yusof, F. A. et al. Rheopectic behavior for aqueous solutions of megamolecular polysaccharide sacran. Biomolecules 10, 155 (2020).
- Hua, L., Zhou, R., Thirumalai, D. & Berne, B. J. Urea denaturation by stronger dispersion interactions with proteins than water implies a 2-stage unfolding. Proc. Natl Acad. Sci. 105, 16928–16933 (2008).
- Won, D. et al. Digital selective transformation and patterning of highly conductive hydrogel bioelectronics by laser-induced phase separation. Sci. Adv. 8, eabo3209 (2022).
- Kim, Y., Kim, Y. & Kim, J. H. Highly conductive PEDOT:PSS Thin films with two-dimensional lamellar stacked multi-layers. Nanomaterials 10, 2211 (2020).
- Kanwat, A. & Jang, J. High work function with reduced phase separation of PSS in metal oxide modified PEDOT:PSS interlayers for organic photovoltaics. RSC Adv. 6, 114800–114807 (2016).
- Singh, G. & Chanda, A. Mechanical properties of whole-body soft human tissues: a review. Biomed. Mater. 16, 062004 (2021).
- Yang, J. C. et al. Geometrically engineered rigid island array for stretchable electronics capable of withstanding various deformation modes. Sci. Adv. 8, eabn3863 (2022).
- Cai, M., Nie, S., Du, Y., Wang, C. & Song, J. Soft elastomers with programmable stiffness as strain-isolating substrates for stretchable electronics. ACS Appl. Mater. Interfaces 11, 14340–14346 (2019).
- Nuñez, A. & Buño, W. The theta rhythm of the hippocampus: from neuronal and circuit mechanisms to behavior. Front. cell. neurosci. 15, 649262 (2021).
- Narcisse et al. Monitoring visual cortical activities during progressive retinal degeneration using functional bioluminescence imaging. Front. neurol. 15, 750684 (2021).
¶ 补充材料内容:
¶ 3D 可打印且生物相容的 PEDOT:PSS-离子液体胶体,具有高导电性,用于快速按需制造 3D 生物电子设备
¶ Results
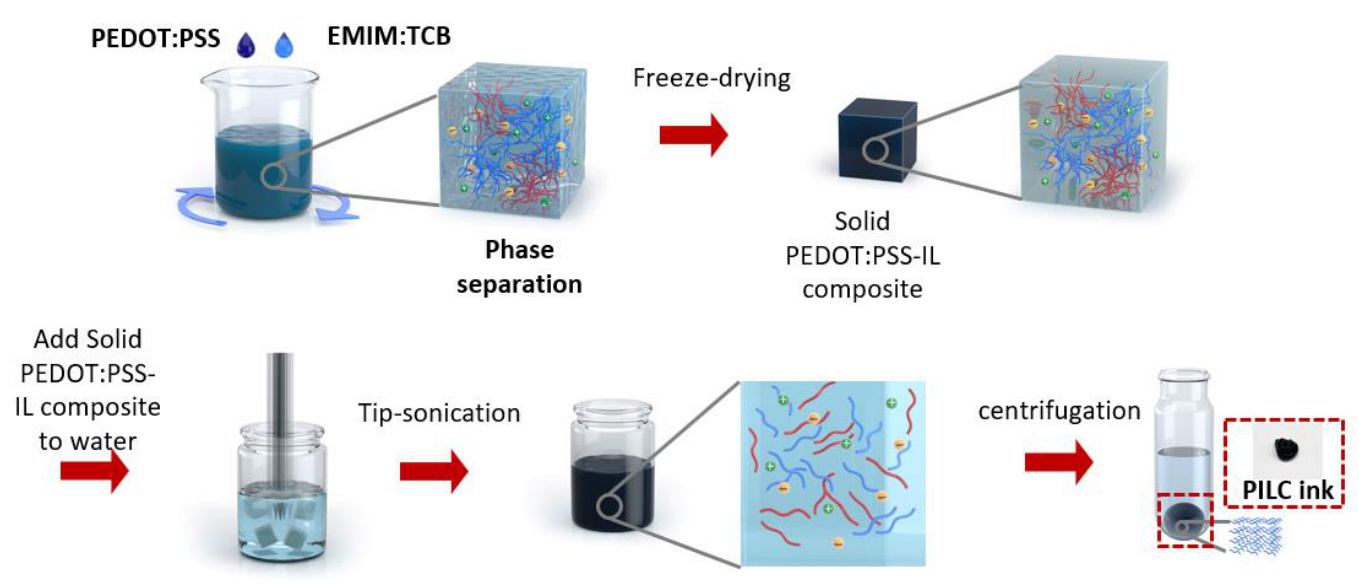
补充图1 | 3D可打印、生物兼容性强且高导电性的PEDOT:PSS-离子液体胶体(PILC)墨水的制造方法。适用于多种应用的一次性通用PEDOT:PSS墨水策略。
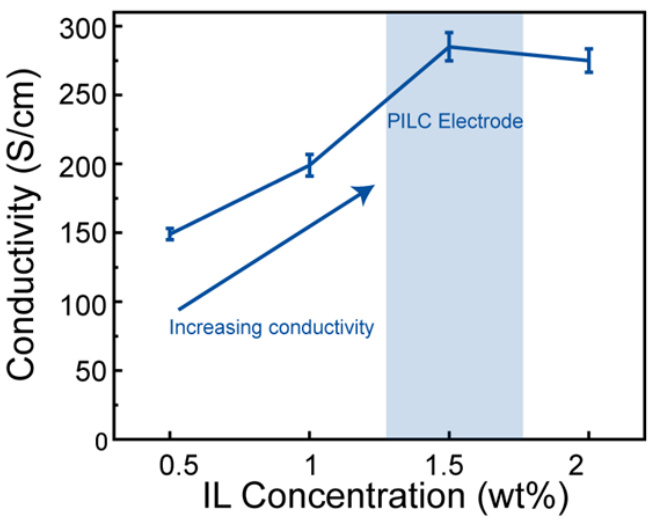
补充图2 | 不同离子液体(IL)浓度下的优化导电性。随着IL浓度的增加,PILC墨水的导电性提高。数据以均值表示(n独立实验)。
| Ref | Viscosity (Pa*s) | Yield stress (Pa) | Storage modulus (Pa) | Conductivity (S/cm) | Intrinsic biocompatability | 3D-Printed Layers (aspect ratio) | Water content (%) | Printing resolution (um) |
| [1] | 5*102 | 102 | 5*103 |
28 (dry) 155 (wet) |
X (>24 hr post annealing) | 20 (N/R) | 87 | 30 |
| [2] | 23 | N/R | N/R | 0.022 | N/A (> 1.5 hr post-treatment) | N/A | 260 | 94 |
| [e] | 102 | 104 | 5*103 | 858.1 (Post-acidtreatment) | N/A | 25 (N/R) | N/R | 50 |
| [4] | 3*103 | 4*104 | 4*103 |
72 (wet) 654 (Post-acid treatment) |
N/A | N/R (8~15) | N/R | 15 |
| [5] | 100 | N/R | N/R | 11 | N/A (> 24 hr post-treatment) | N/A | 80 | 100 |
| [9] | 15 | N/R | 103 | 0.0159 | N/A (>1 hr post-treatment) | N/A | N/R | 150 |
| [7] | 103 | 103 | 330 | 1,200 (Post-acid treatment) | N/A | 10 (N/R) | N/R | 50 |
| [8] | 102 | 103 | 103 | 0.09 | N/A (> 24 hr post-treatment) | N/A | 75 | 80 |
| This Work | 106 | 105 | 105 | 286 | O | >100 (>4) | 28.75 | 50 |
N/A:不适用
N/R:未报告
补充表1 | 与先前报道的使用可打印PEDOT:PSS墨水的文献比较
| Ref | Method | sninpow s,buno (kPa) | Tensile strength (MPa) | Stretchability (%) | Charge Storage Capacity (mCcm-²) | Initial Conductivity (S/cm) |
| [1] | Nozzleprinting | 1,100 | N/R | N/R | N/R | 28 (dry) 155(wet) |
| [2] | Liquid-in-Liquid Printing | 41.2-3,875 | 1-2.5 | 76-800 | N/R | 0.022 |
| [5] | Nozzle printing | 1,000 | 0.5-3.5 | 400 | 6 | 11 |
| [6] | Nozzleprinting | 5-65 | 110 | 349 | 12.37 | 0.0159 |
| [8] | Nozzleprinting | 650 | 0.9 | 120 | 5.83 | 0.09 |
| [6] | Photolithography | 2,000 | 0.5-2.2 | 15-35 | 60 | 20-40 |
| [10] | Molding | 25 | 130 | 610 | 80 | 247 |
| [11] | Laser-lnduced hase separation | 120 | 15 | 15 | 32.13 | 670 |
| This Work | Nozzle printing | 750 | 0.139 | 88.6 |
2D:47.04 3D:104.827 |
286 |
N/R:未报告
|
Ref |
Method |
Resolution (um) |
2D In / Ex-vivo Application |
3D Suspended Structure |
3D In-vivo Application |
|
[1] |
Nozzle printing |
30 |
O (In-vivo) |
X |
X |
|
[2] |
Liquid-in-Liquid Printing |
94 |
X |
O |
X |
|
[4] |
Nozzle printing |
15 |
X |
O |
X |
|
[5] |
Nozzle printing |
100 |
O (In-vivo) |
X |
X |
|
[6] |
Nozzle printing |
150 |
O (Ex-vivo) |
X |
X |
|
[8] |
Nozzle printing |
80 |
O (In-vivo) |
X |
X |
|
[10] |
Molding |
N/R |
O (In-vivo) |
X |
X |
|
[11] |
Laser-lnduced phase separation |
6 |
O (In-vivo) |
X |
x |
|
[12] |
orthogonal photochemistry printing |
100 |
O (Ex-vivo) |
O |
X |
|
[13] |
Coating |
N/R |
O (In-vivo) |
X |
X |
|
[14] |
Laser cutting |
150 |
O (In-vivo) |
O |
X |
|
This Work |
Nozzle printing |
50 |
O (In-vivo & Ex-vivo) |
O |
O |
补充表3 | 与先前使用PEDOT:PSS墨水的文献相比,应用的多样性比较
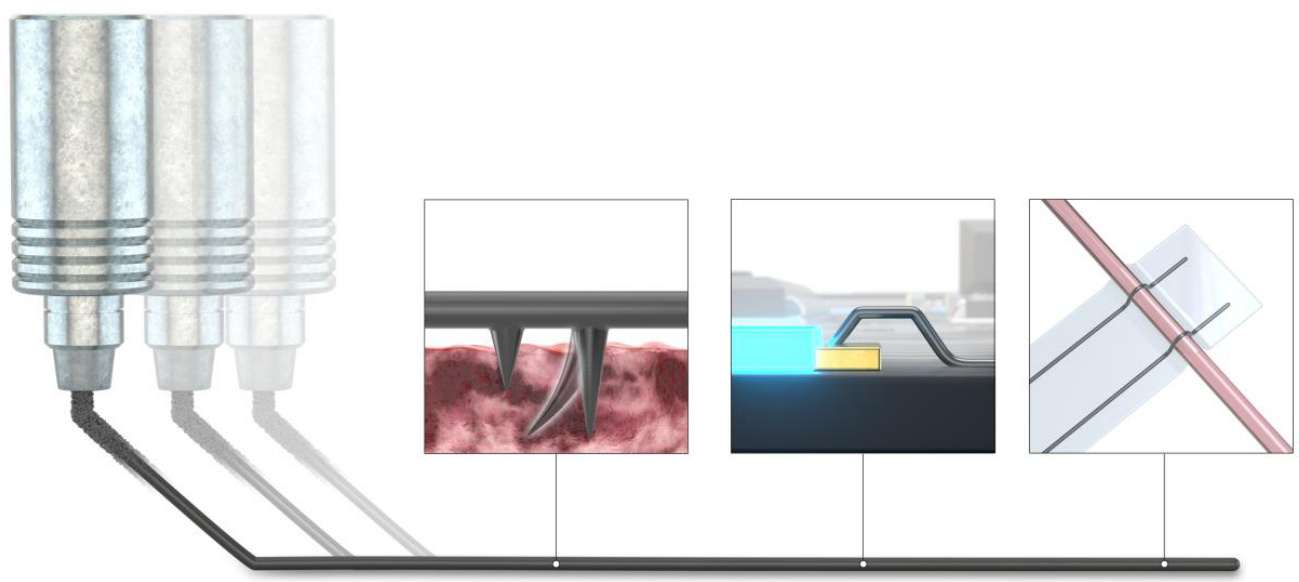
补充图3 | PILC墨水的多样化应用示意图,从二维体内/体外电极和三维斜向打印电路线路到三维体内电极。通过快速制造可植入的生物电子设备、皮肤生物电子设备和三维电路板,PILC墨水具有按需和多样化的应用性。

with PILC protocol
补充图4 | 离子液体对离心相分离的影响。左侧为使用冻干PEDOT:PSS-离子液体复合物作为溶质时的离心相分离照片,中央为使用冻干纯PEDOT:PSS作为溶质时无相分离的照片,右侧为使用冻干水不溶性纯PEDOT:PSS(冻干PEDOT:PSS-DMSO复合物)作为溶质时的照片。
为了确认离子液体在PILC墨水形成中的作用,所有样本均按照PILC墨水制造协议制备,只改变溶质。左侧使用冻干PEDOT:PSS-离子液体复合物,中央使用冻干PEDOT:PSS,右侧使用冻干PEDOT:PSS-DMSO复合物作为每个样本的溶质。离心后,只有含有冻干PEDOT:PSS-离子液体的样本显示出墨水形成。
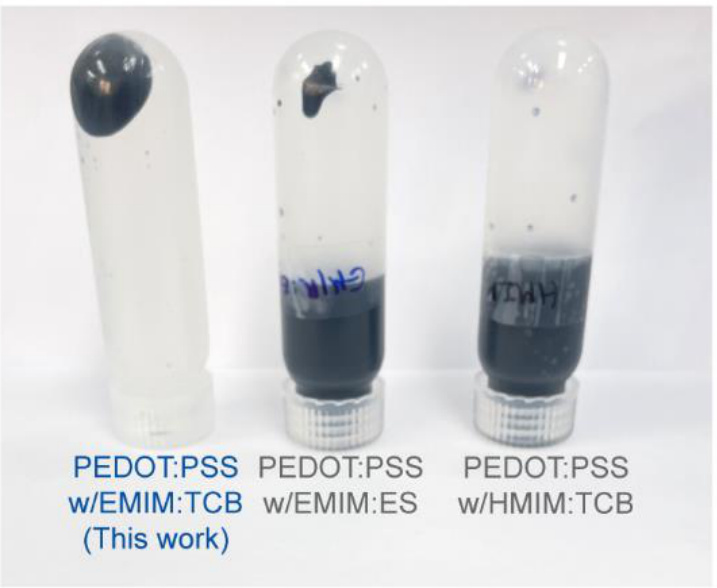
补充图5 | PEDOT:PSS与其他离子液体(EMIM:ES和HMIM:TCB)的离心效果。当使用EMIM:TCB离子液体制备PILC墨水时的离心相分离照片(左),当使用EMIM:ES(中)和HMIM:TCB(右)离子液体制备PILC墨水时无相分离的照片。
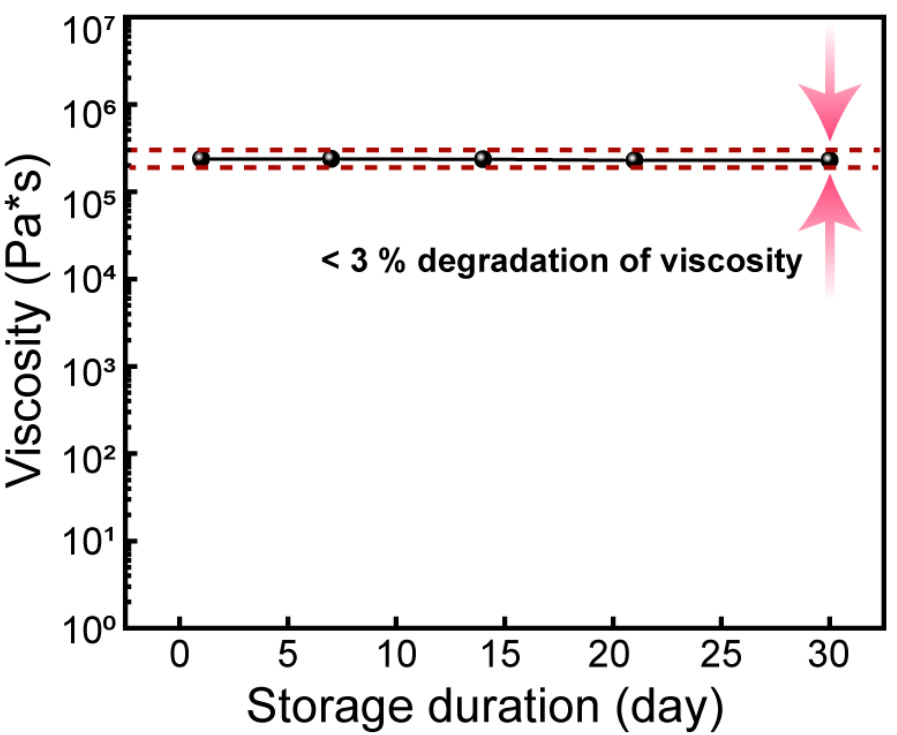
补充图6 | PILC墨水的稳定流变性。PILC墨水在室温下存储30天的粘度变化。
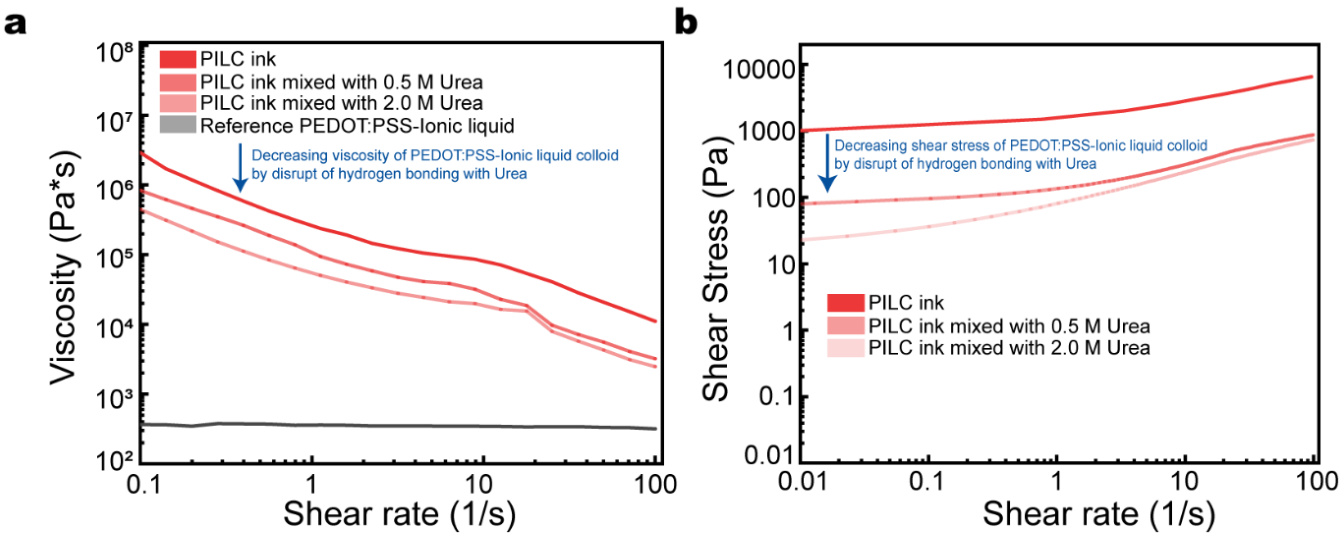
补充图7 | 不同尿素浓度下PILC墨水的剪切稀化行为(以及2.0M)。
a,PILC颗粒和不同浓度尿素的粘度与剪切速率关系。
b,PILC颗粒和不同浓度尿素的剪切应力与剪切速率关系。
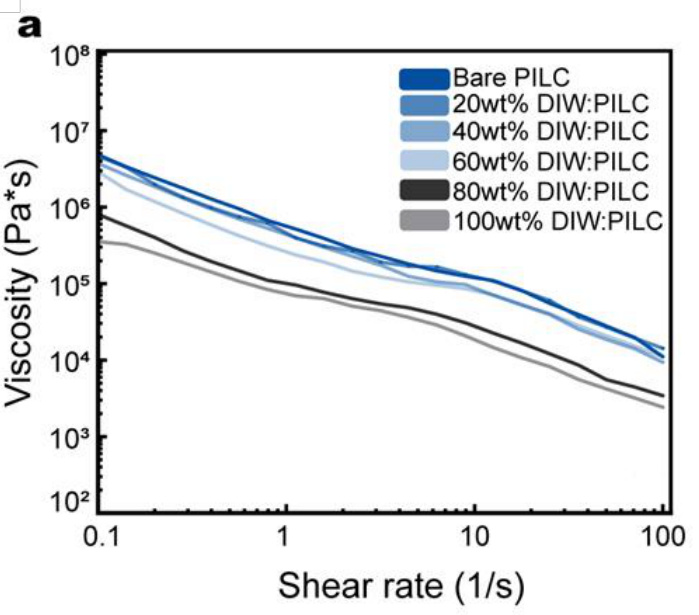
补充图8 | 不同浓度下PILC墨水的流变学性质。
a,PILC颗粒与不同浓度去离子水(DIW)混合后的粘度与剪切速率关系。PILC墨水的粘度可通过在水中分散来控制,以满足不同的按需应用。
b,不同浓度PILC墨水挤出的图像。

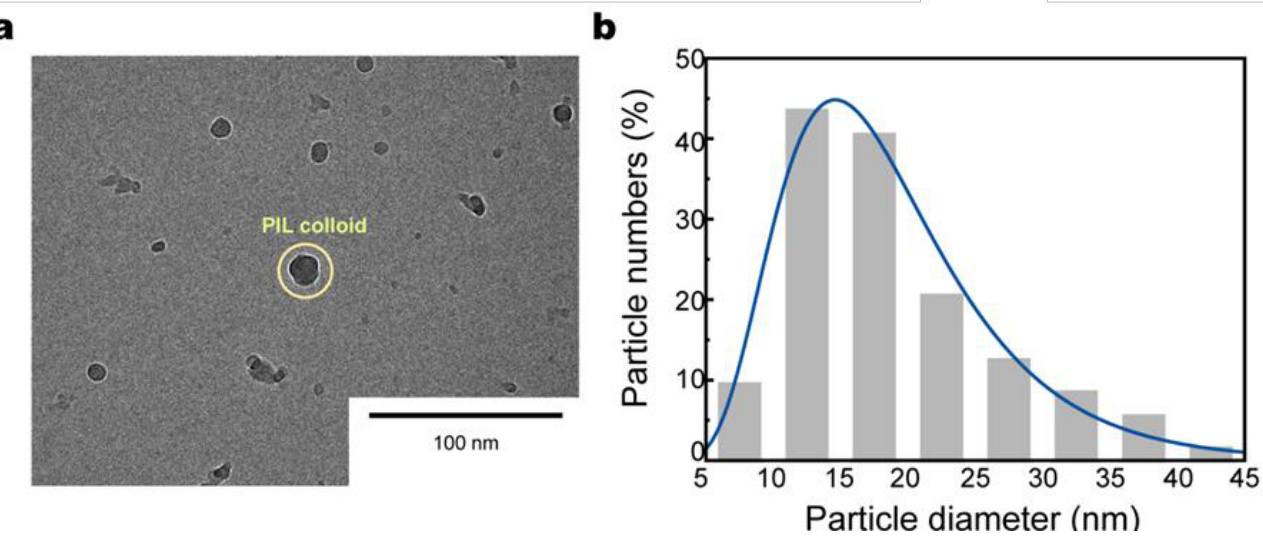
补充图9 | PILC墨水的冷冻透射电子显微镜(Cryo-TEM)图像及其粒径分布。
a,PILC墨水的冷冻透射电子显微镜图像。
b,PILC墨水颗粒直径分布。

补充图10 | PILC墨水在不同表面上的打印。
PILC墨水打印在不同薄膜上的图像,范围从超疏水膜到水凝胶和猪皮肤,且未进行任何表面预处理。
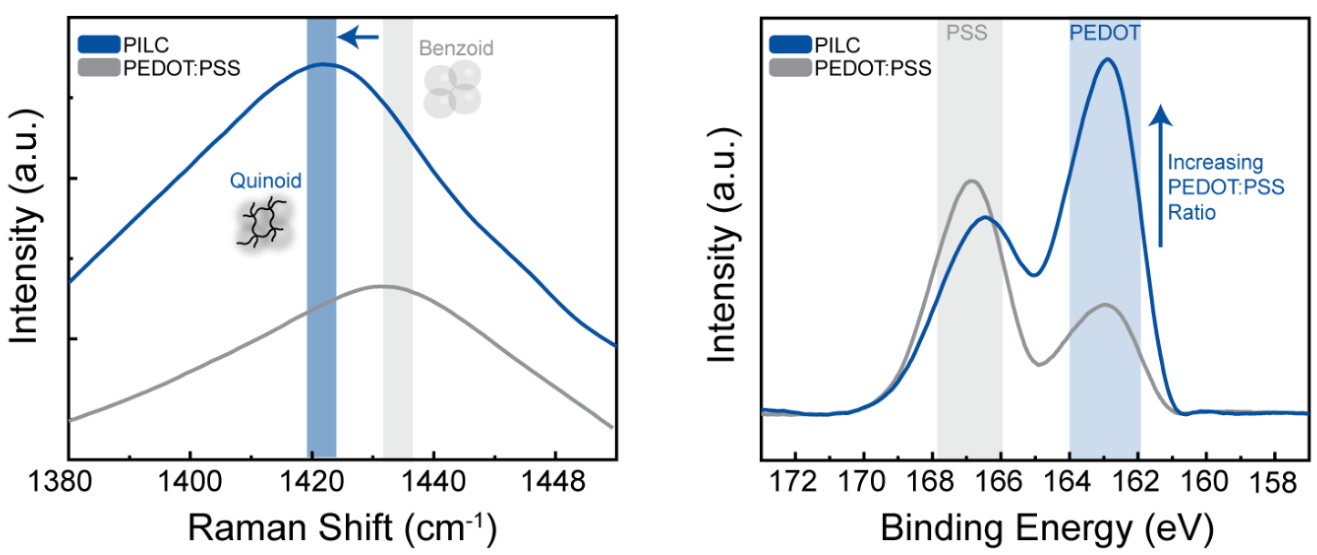
补充图11 | PILC高导电性机制。
PILC的拉曼光谱(左)和X射线光电子能谱(XPS)分析(右)。拉曼光谱显示,PEDOT:PSS由于离子液体促进的相分离,发生了从苯环型到奎烯型的结构转变。XPS反映出与原始PEDOT:PSS相比,PILC墨水中PEDOT相的硫峰值有所增加。
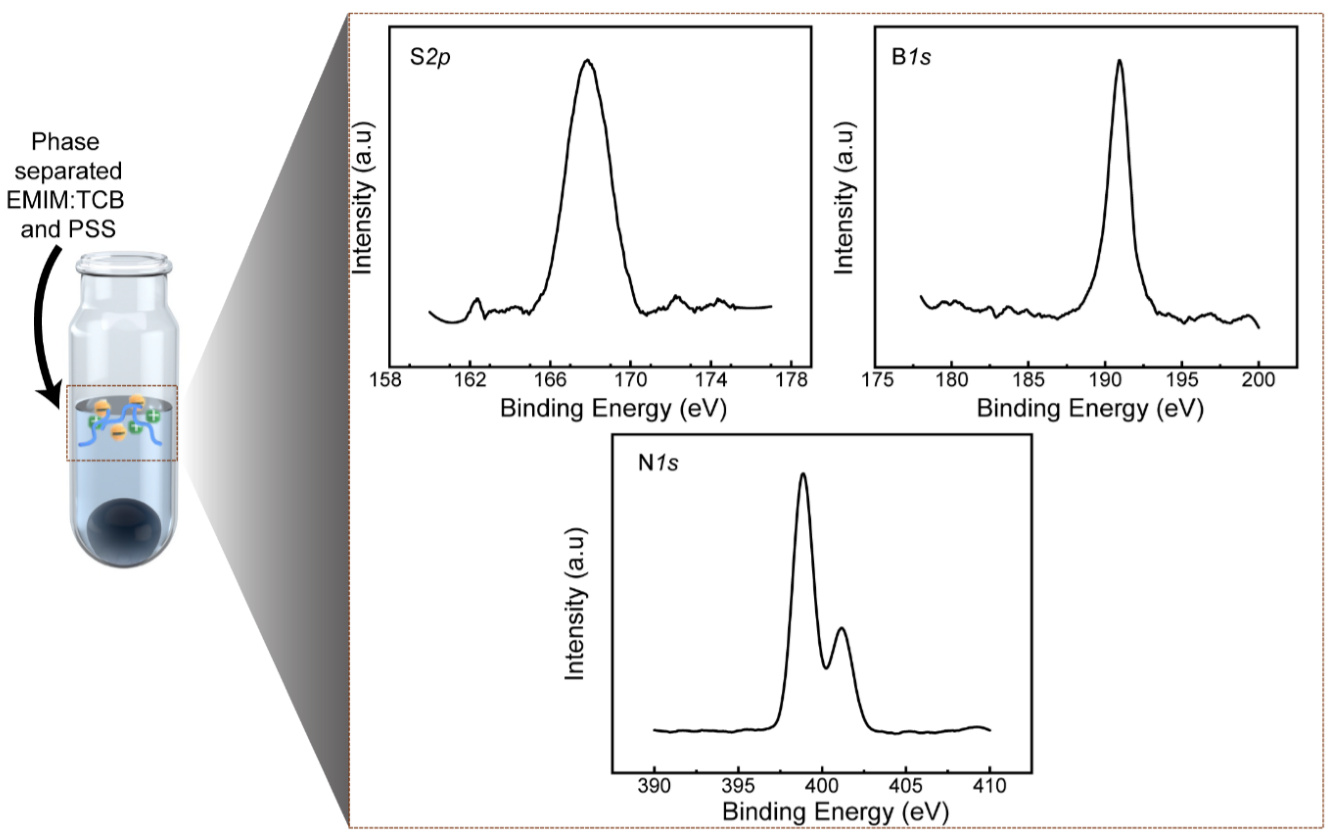
补充图12 | 离心纯化后PILC的XPS分析。
S(左上)、B(右上)和N 1s(下中)峰反映了水溶性PSS和离子液体在上清液中的相分离。
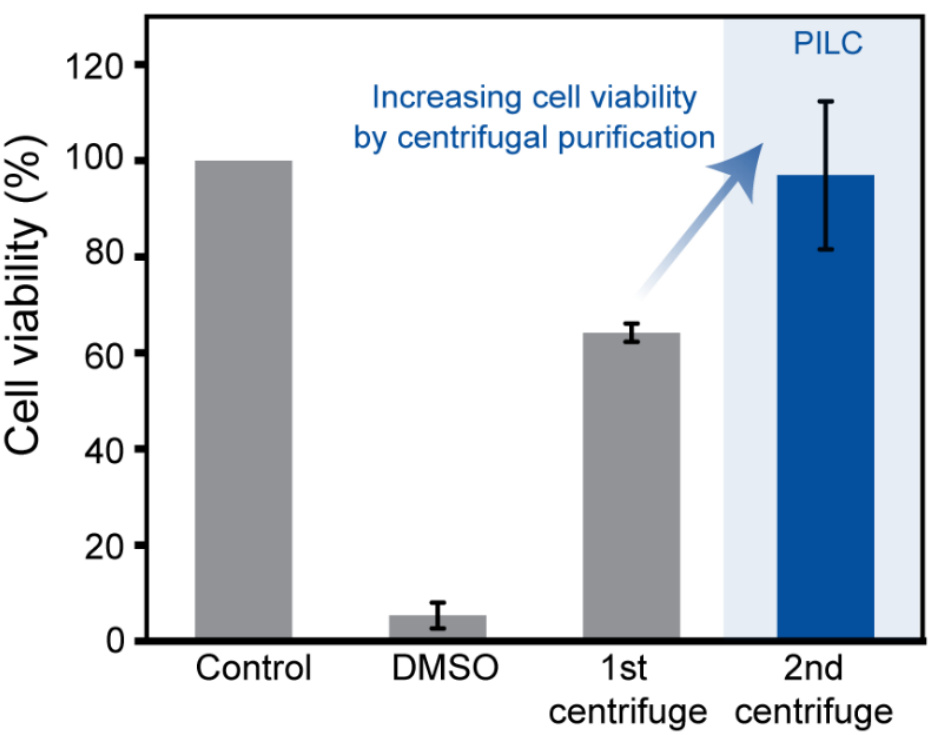
补充图13 | 离心纯化后PILC墨水的生物兼容性。
离心一次和两次后的PILC墨水细胞活力。DMSO作为阴性对照组。数据以均值±标准差表示,控制组、DMSO组和离心组为独立材料样本的结果。
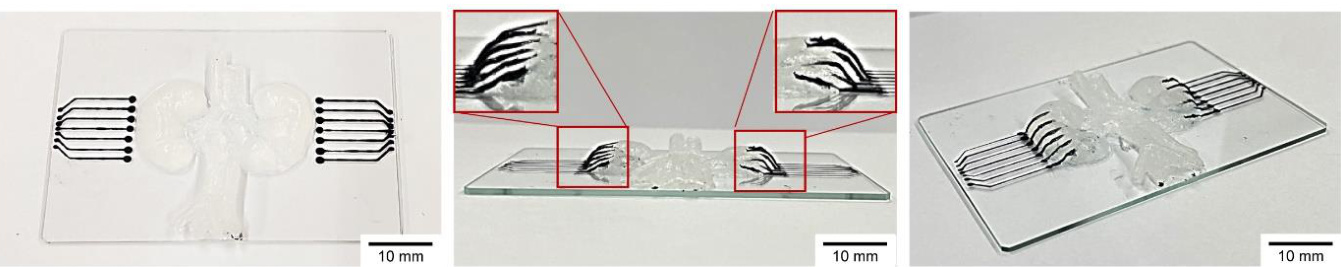
补充图14 | 用于实现人工3D组织结构的3D对角线打印电路线路,人工肾脏由Ecoflex-0020制成。左图显示了2D PILC线路与由Ecoflex-0020制成的人工肾脏之间的两种不同界面;中图和右图显示了打印到人工肾脏上的3D对角悬挂电路线路,带有对角悬垂:不同打印角度。
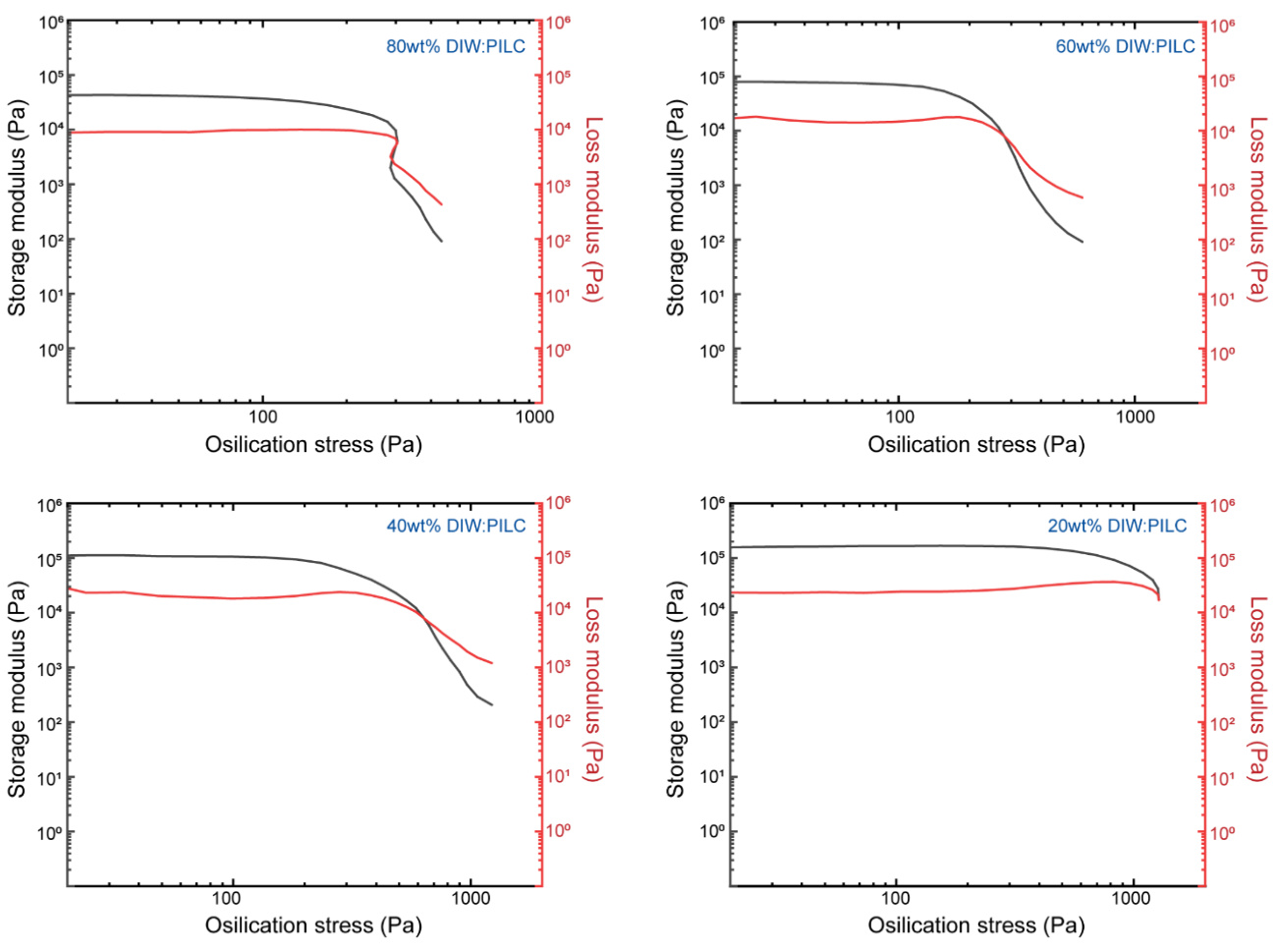
补充图15 | 不同浓度PILC墨水的流变学表征。不同稀释比的存储模量和损耗模量随剪切屈服应力的变化图,分别显示于(左上)、(右上)、(左下)和(右下)。
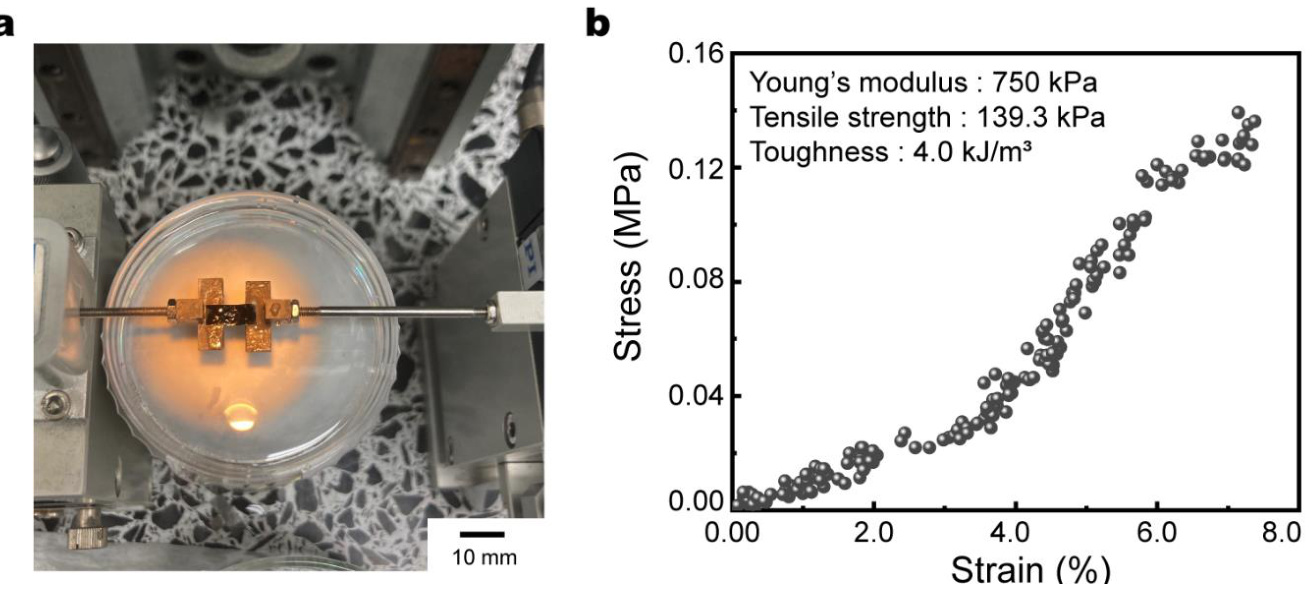
补充图16 | 自立PILC薄膜的机械性能。a,测量PILC墨水在水上机械性能的设置照片。b,PILC薄膜的应力-应变曲线。打印的PILC薄膜显示出类似于组织的低杨氏模量。
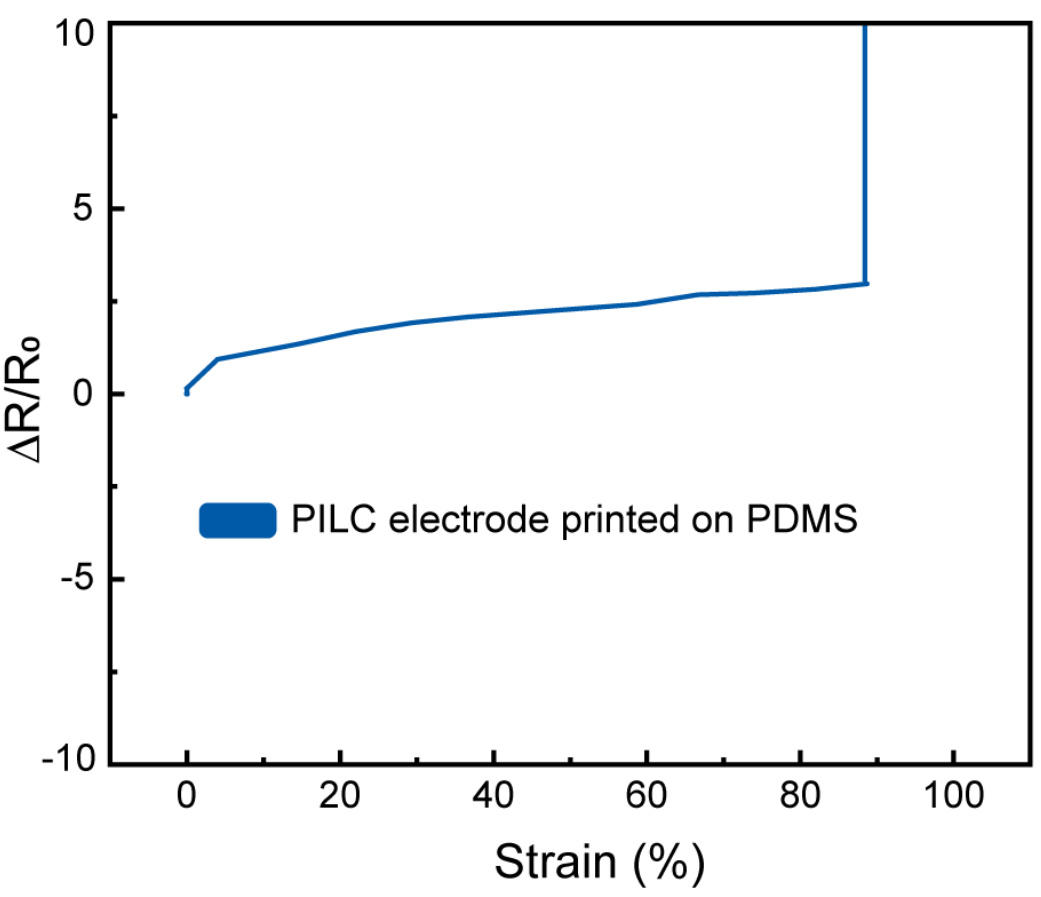
补充图17 | 打印在PDMS基板上的PILC的机械性能,变形速率:50。PILC电极打印在PDMS上的应变与电阻变化的关系。
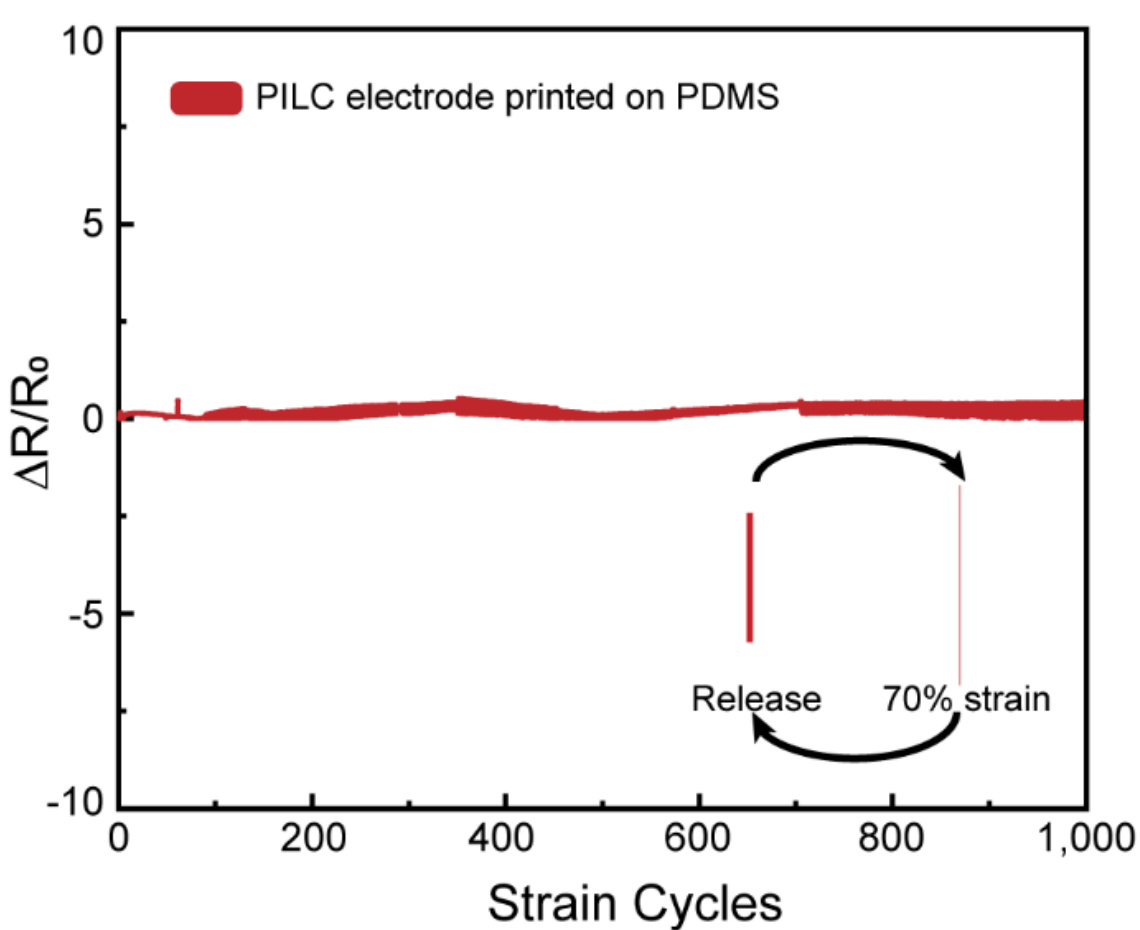
补充图18 | 打印在PDMS基板上的PILC的重复性,1000次循环应变,变形速率:)。在PDMS上打印的PILC电极在重复应变周期下的电阻变化。

补充图19 | 用于皮肤生物电子学的3D打印PILC电极。a,使用PILC墨水打印的多电极肌电图(EMG)阵列图像(左)及其转移到湿润皮肤上的过程(右)。b,PILC肌电图(EMG)电极与商业3M电极的阻抗谱对比。c,PILC心电图(ECG)电极的示意图(左)及其平均ECG波形(中)与传统3M电极的ECG波形(右)。d,PILC肌电图(EMG)电极在二头肌收缩时收集的示意图(左)及EMG波形(右)。补充图19/c和d面板使用BioRender.com创建,并发布在知识共享署名-非商业性使用-禁止演绎 4.0 国际许可下。

补充图20 | PILC电极在生物电子设备中的应用。a,PILC电极用于心电图(ECG)监测的示意图;b,ECG信号采集的实际照片,展示PILC电极在皮肤上的应用。c,PILC电极与皮肤的接触界面,放大视图展示电极与皮肤的良好附着。
补充图21 | 3D打印PILC电极阵列的电化学性能。a,电化学测试设备的设置图,用于测试PILC电极的导电性和稳定性;b,PILC电极的电流-电压(I-V)曲线,显示出其良好的导电性能。

补充图22 | PILC电极的生物相容性测试。a,细胞培养照片,显示皮肤细胞与PILC电极的相互作用;b,PILC电极与细胞生长的相容性分析,展示细胞在PILC电极表面的健康生长。
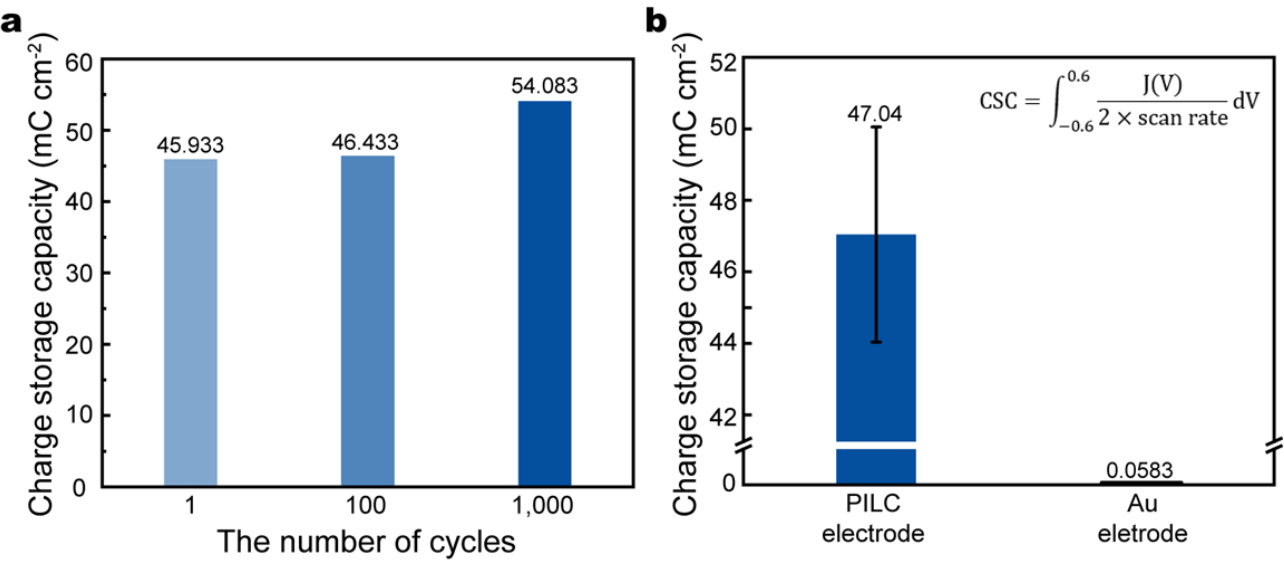
补充图23 | 打印PILC电极与传统金属电极的电荷储存容量(CSC)比较。a,打印PILC电极在1000个循环中的CSC变化。b,比较打印PILC电极和金电极CSC的图表。PILC电极显示出较高的CSC(47.04,相比金电极)。数据以平均值 ± 标准差(SD)表示,基于独立实验。
补充图24 | 3D打印PILC电极阵列的长期使用稳定性。a,长期应变测试中的PILC电极电阻变化;b,PILC电极在反复拉伸和压缩后的电性能保持情况,展示其长期稳定性。
补充图25 | Thy1-Chr2转基因小鼠中ECoG光学诱发电位的空间选择性。使用PILC ECoG设备在不同光刺激部位收集的光学诱发ECoG波形。
补充图26 | 3D打印与2D打印PILC电极的阻抗和电荷储存容量(CSC)比较。a,比较3D打印和2D打印PILC电极的阻抗图。b,比较3D打印和2D打印PILC电极的CSC图。3D打印的PILC电极表现出较高的阻抗(在1kHz时)和CSC(相比2D打印PILC电极在1kHz时的表现)。
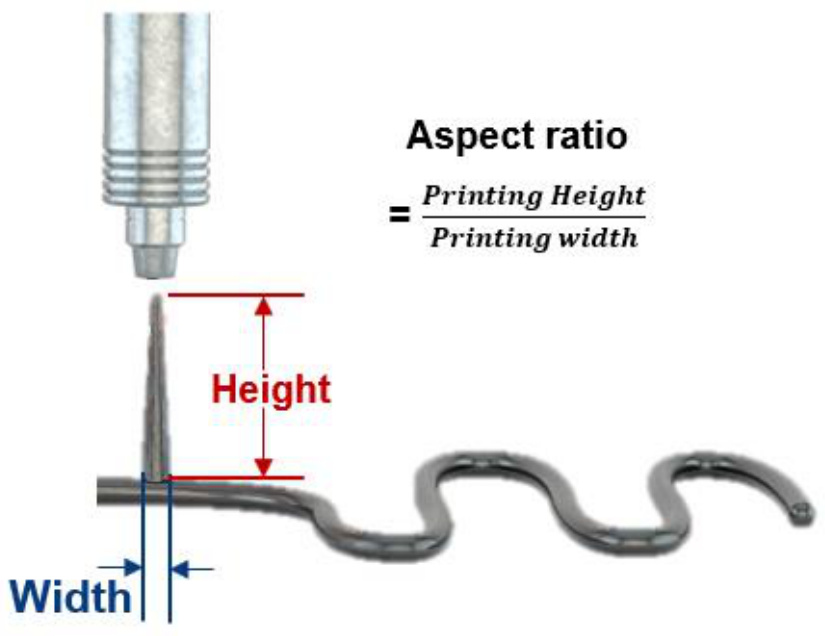
补充图27 | 3D纵横比的计算方法。示意图说明了计算纵横比的方法。
¶ Reference
- Yuk, H. et al. 3D printing of conducting polymers. Nat Commun 11, 1604 (2020).
- Xie, X. et al. Liquid-in-liquid printing of 3D and mechanically tunable conductive hydrogels. Nat Commun 14, 4289 (2023).
3.Ghaderi, S., Hosseini, H., Arash Haddadi, S., Kamkar, M. & Arjmand, M. 3D printing of solvent-treated PEDOT:PSS inks for electromagnetic interference shielding. J. Mater. Chem. A. 11, 16027–16038 (2023). 4. Xing, W. et al. Omnidirectional Printing of PEDOT:PSS for High-Conductivity Spanning Structures. ACS Appl. Mater. Interfaces. 15, 57717-57725 (2023)
5.Zhou, T. et al. 3D printable high-performance conducting polymer hydrogel for all-hydrogel bioelectronic interfaces. Nat. Mater. 22, 895–902 (2023). - Yu, J. et al. 3D Printing of Robust High-Performance Conducting Polymer Hydrogel-Based Electrical Bioadhesive Interface for Soft Bioelectronics. Small, 2308778.
- Hill, I. M. et al. Imparting High Conductivity to 3D Printed PEDOT:PSS. ACS Appl. Polym. Mater. 5, 3989– 3998 (2023).
- Wang, F. et al. 3D Printed Implantable Hydrogel Bioelectronics for Electrophysiological Monitoring and Electrical Modulation. Adv. Funct. Mater. 2314471 (2023).
- Lu, B. et al. Pure PEDOT:PSS hydrogels. Nat. Commun. 10, 1043 (2019).
- Chong, J. et al. Highly conductive tissue-like hydrogel interface through template-directed assembly. Nat. Commun 14, 2206 (2023).
- Won, D. et al. Digital selective transformation and patterning of highly conductive hydrogel bioelectronics by laser-induced phase separation. Sci. Adv. 8, eabo3209.
- Wei, H. et al. Orthogonal photochemistry-assisted printing of 3D tough and stretchable conductive hydrogels. Nat Commun 12, 2082 (2021).
- Zhang, J. et al. Engineering Electrodes with Robust Conducting Hydrogel Coating for Neural Recording and Modulation. Adv. Mater. 35, 2209324 (2023).
- Yao, B. et al. Ultrastrong, highly conductive and capacitive hydrogel electrode for electron-ion transduction. Matter 5, 4407–4424 (2022).