¶ 高密度多电极平台研究辐射对体外皮质网络的影响
梅根·布歇‑R 乌蒂埃1、亚诺什·桑托2、维莫吉·奈尔2 和让-菲利普·蒂夫合并1,3*
放射治疗和立体定向放射外科是脑部恶性肿瘤的常用疗法。然而,辐射对底层神经元回路的影响尚不明确。在前额叶皮层中,神经元通过控制认知过程的动作电位进行通信,因此理解辐射对这些回路的影响至关重要。本文提出一种创新方案,用于研究辐射对体外前额叶皮层网络活动与存活的影响。通过机器人放射外科平台以10 Gy/min的标准剂量率对前额叶皮层切片进行梯度剂量照射,并利用高密度微电极阵列记录辐射切片数据,通过4,096个通道采集细胞外活动。辐射切片表现出放电频率、功能连接性与复杂性的提升。基于图论的功能性分析显示在辐射后,神经连接发生了改变。这些结果与药物诱导的癫痫脑切片进行了对比,后者显示神经复杂性显著升高,功能连接强烈但仍保持空间集中。最后,碘化丙啶染色揭示了辐射对细胞凋亡的剂量依赖性影响。这些发现为研究临床相关剂量辐射对脑回路的影响提供了一种新方法,并强调了递增辐射剂量对前额叶皮层神经元的急性影响。
关键词:辐射,多电极阵列,前额叶皮层,复杂性,功能连接,神经元活动
放射治疗和立体定向放射外科越来越多地用于治疗原发性和转移性脑肿瘤、三叉神经痛和难治性癫痫等疾病1, 2。尽管这些技术已被广泛使用,但辐射对存活神经元网络的影响仍知之甚少2。放射线可引发在治疗后不同时间尺度出现的脑损伤:急性放射损伤通常在放射后数天内发生;早期迟发性损伤出现在放射后1至6个月内;而晚期迟发性损伤则发生于放射治疗6个月之后3, 4。放射诱导的脑损伤与多种认知障碍相关,包括记忆、注意力和执行功能缺陷,以及处理速度下降,偶尔可能发展为痴呆3, 4, 5。这类损伤具有剂量依赖性特征,接受较高放射剂量的患者往往长期预后更差5。
辐射诱发的脑损伤被认为是由存活脑细胞的细胞死亡和功能障碍共同引起的。先前研究辐射急性及早期迟发效应的文献已证实:受照射神经元表现出显著增加的放电频率2, 6、突触形态改变2, 7,以及包括长时程增强缺陷在内的突触功能与可塑性抑制4, 8。在哥廷根小型猪初级视觉皮层施加较大辐射剂量( Gy)的研究亦显示,照射后6个月神经元放电频率显著降低,这提示急性期与晚期迟发性辐射脑损伤存在不同作用机制6。
以往的研究主要关注辐射对海马体的影响,因其与记忆功能障碍密切相关。然而,近期研究更强调探索前额叶皮层等其他脑区的重要性。前额叶皮层之所以成为关键研究区域,在于其负责执行功能、决策制定和工作记忆9等重要认知功能。该区域的神经元不仅彼此相互连接,还与相邻的感觉皮层、运动皮层及皮层下区域保持密切通讯。
通过受放射治疗影响且时间精确的动作电位4, 10。此外,前额叶皮层通过直接单突触通路与海马体保持密切的功能连接,该通路起源于海马体的CA1/下托区域,并投射至前额叶皮层的前边缘区和内侧眶额区4, 11。因此,前额叶皮层不仅是海马体区域间通信的主要参与者,更是理解放射后认知缺陷的核心关键区域2, 12。
大规模、高密度多电极阵列(hd-MEAs)作为体外13监测脑网络的工具正获得广泛关注。凭借其能以高时空分辨率记录广泛网络活动的能力,hd-MEAs在单细胞记录与通过皮层脑电图或脑电图获取的超大规模神经活动之间提供了中间地带。最先进的hd-MEAs能以足够的时间分辨率同时监测数千个神经元,从而分离出单个动作电位,为健康与异常皮层状态下14的网络活动模式提供深入洞察。
本研究开发了一种新型检测方法,采用高密度微电极阵列(hd-MEA)监测辐射后体外前额叶皮层(PFC)切片神经元活动,重点关注急性辐射诱导的功能障碍。据我们所知,这是首次利用MEA技术研究治疗剂量辐射对体外前额叶皮层神经回路的影响。我们设计了多种指标来量化网络动力学与细胞凋亡的变化,包括群体放电频率、功能连接性、图论度量及神经复杂性。通过比较辐射与药理学诱导癫痫样活动对这些指标的影响,发现了辐射诱导网络功能改变的特征性模式。这些结果表明,hd-MEA可作为新型有效的研究工具,用于探索临床相关剂量辐射15, 16对神经元功能障碍与细胞凋亡的影响。
¶ 结果
¶ 受辐照脑切片揭示皮层群体活动的变化
在高密度微电极阵列(hd-MEA)上记录的神经元活动特征表现为单个通道出现明显的电压偏转,表明电极附近神经元簇中存在多单元放电(图1A)。这些偏转通过施加低于电压平均值的阈值进行检测(见“方法”部分)。单个通道的神经活动速率通过计算平均放电次数得出,结果显示PE处理后神经元放电速率出现显著提升(平均速率 ,基线放电速率 ,p值=4.9558e−39)。关于癫痫样活动在传播波方面的特征研究另有文献17报道。这些结果表明,辐射诱导的神经元活动变化仍显著低于癫痫样活动水平。
每秒的阈值穿越事件被存储为光栅图以供离线分析。这些光栅图显示,与对照组相比,受辐射切片的活动有所增加(图1B)。20Gy的辐射剂量相较于假性辐射,在平均放电频率上产生了统计学上可靠的增加(威尔科克森秩和检验,p = 2.4546e−27),50 Gy(p = 7.2954e−05)和100 Gy(p = 0.0028935)的辐射剂量也产生了类似效果。单个光栅图的示例如图1C所示,其中的各个点标识了这些事件发生的时间和通道。
¶ 探究功能连接的变化
接下来,我们通过计算高密度微电极阵列上所有通道对之间的相关性,检查了皮层神经元之间的功能连接性(图2A, B)。功能连接性指示了神经元群体之间的通信,并且已知在疾病状态18, 19, 20, 21下会波动。为了便于解释功能网络,应用了一个截止值 来拒绝通道对之间的较低相关性。
我们分析了两个功能连接性指标:不同辐射条件下的功能连接强度与连接数量。在所有接受前额叶皮层局部辐射的剂量组中,辐射后的功能连接强度均高于对照组(图2C)。其中,50 Gy剂量组的连接强度显著高于对照组(p = 0.00148),而20 Gy(p = 0.088)与100 Gy(p = 0.168)剂量组与对照组的差异未达到统计学显著性。尽管存在剂量间的变异,但辐射的整体效应是增强了前额叶皮层网络的功能连接强度,这表明神经元同步化程度有所提升。
在受辐射的脑切片中,功能连接的数量呈现出剂量依赖性反应,较高剂量组比较低剂量组产生更丰富的功能连接(图2D)。与对照组相比,20 Gy(p = 3.3951e−07)、50 Gy(p = 2.2621e−11)和100 Gy(p = 1.9287e−19)剂量组的功能连接数量均显著增加。因此,辐射通过增加阵列中通道对之间的连接密度,影响了前额叶皮层的功能连接性。
这些结果与接受PE处理的网络进行了比较(图2B)。PE组的功能连接平均强度显著高于辐照切片组(20 Gy: p=9.543e−14;50 Gy: p=1.4247e−13;100 Gy: p=3.3604e−11),表明PE活动期间同步性增强。相反,PE组的功能连接数量低于辐照切片组( ;50 Gy: p=2.6966e−39; )。PE处理下连接数量较少的原因是癫痫样活动产生的功能相互作用集中于阵列记录的大量神经元中的小群体(图2B)。事实上,PE条件下观察到的癫痫样事件具有空间聚焦传播的特征,表现为强烈且可重复的活动模式17。总之,辐射诱导了前额叶皮层神经元间更丰富的功能连接。这些结果与癫痫样活动存在明显区别,后者虽存在强连接,但由于癫痫样活动在阵列上的空间聚焦传播特性,其连接分布更为稀疏。
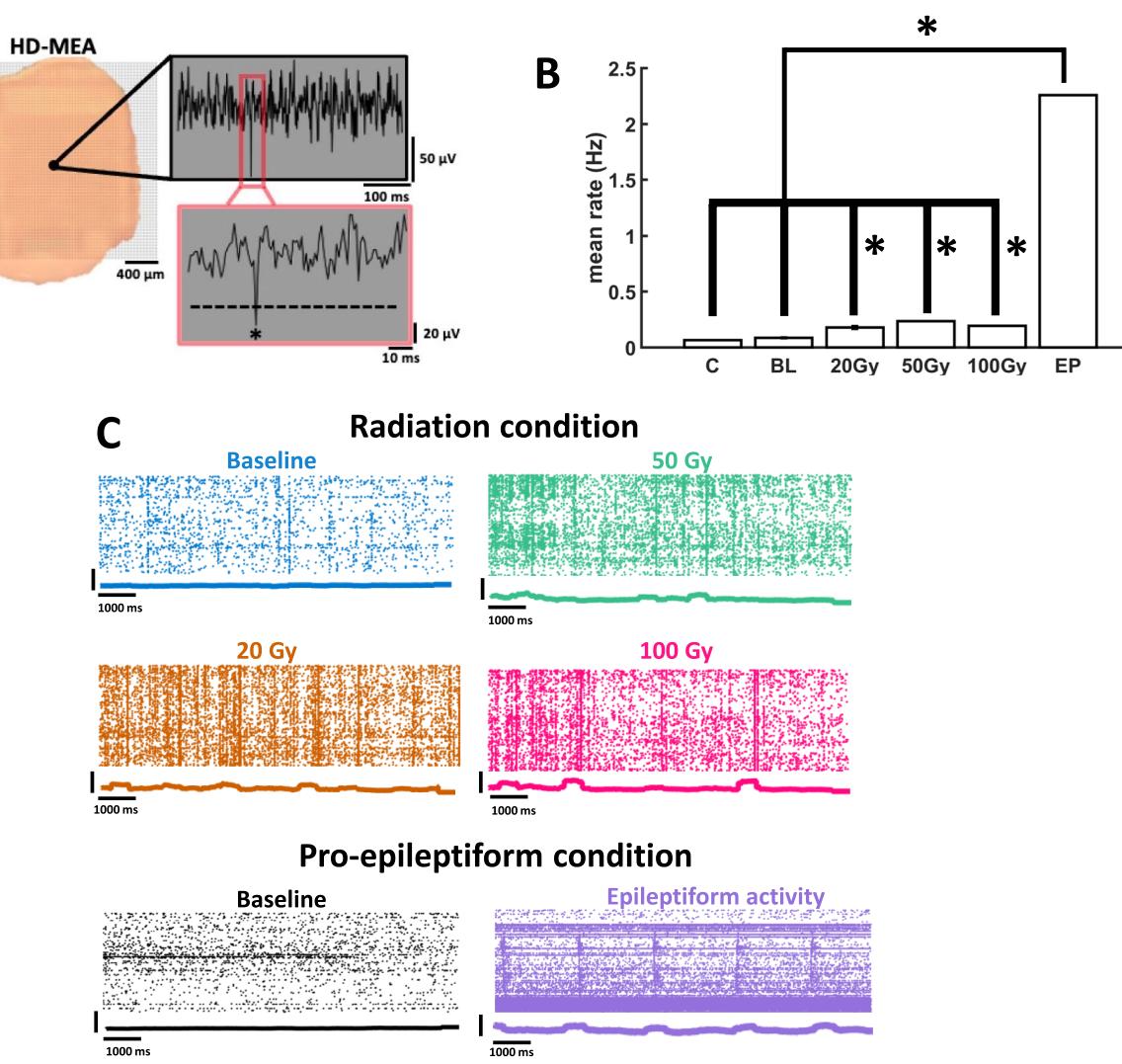
图1. 前额叶皮层神经元群体中的神经活动。(A)左图:前额叶皮层切片在hd-MEA上的放置示例。右图:从单个通道识别出的电压偏转中提取的多单元放电(以星号“*”标识)。(B)不同条件下前额叶皮层神经元的平均放电频率。 辐射治疗的对照组切片; PE条件下的基线; 辐射条件;EP 癫痫样活动。*表示统计学显著性 。©活动点阵图显示梯度辐射剂量或促癫痫样溶液灌注后整个神经元群体的放电活动。每个点阵图下方的刺激前后时间直方图使用500毫秒滚动窗口显示累计活动。
¶ 功能网络的图论测度
通过考察五个图论指标,即模块化、全局效率、局部效率、同配性和传递性22,进一步表征了功能网络特性。网络的模块化反映了节点被划分为非重叠模块的程度,模块内节点具有高度连接性。相较于基线网络,癫痫样(EP)网络的模块化程度较低( $\mathrm { ( p { = } 8 . 6 7 3 5 e { - } } 2 8 $ )(图3A)。低剂量辐射( )使模块化相对于对照组适度提升( ),但更高剂量(50Gy和100Gy)未产生显著影响。由此可见,癫痫样活动会降低功能网络的模块化程度,而辐射网络并未呈现稳定变化。
功能网络的全局效率计算节点间最短路径倒数的平均值。若网络中任意节点对之间仅需少量连接即可贯通,则具有较高的全局效率。我们在辐照后的功能网络中发现了较高的全局效率( 13e−20;50 Gy: ;100 Gy: )(图3B)。这种现象在EP网络中并未复现,其全局效率始终维持较低水平。我们推测该结果可能源于EP网络在阵列中仅占据有限区域(图 2B)。为控制此效应,我们计算了衡量单个连接节点周边连接情况的局部效率。EP网络的局部效率较基线水平显著提升( ),这与EP会增强局部连接效率的观点相符(图 3B)。辐照网络的局部效率同样有所增加(20 Gy: ;50 Gy: ;100 Gy: )。
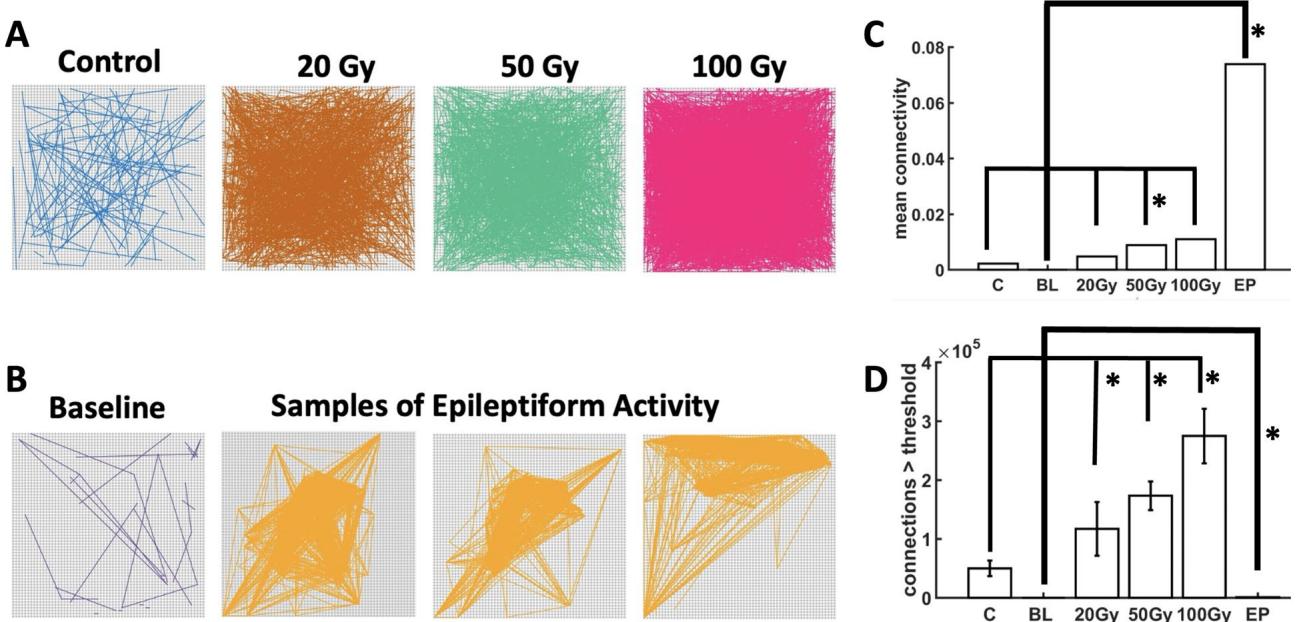
图2. 皮层网络的功能连接。辐射 (A)。灌注促癫痫样 (PE) 溶液 (B)。平均强度 © 和超过预定义阈值的功能连接数量 (D)。星号 (“*”) 表示在 水平上显著(Wilcoxon 秩和检验)。
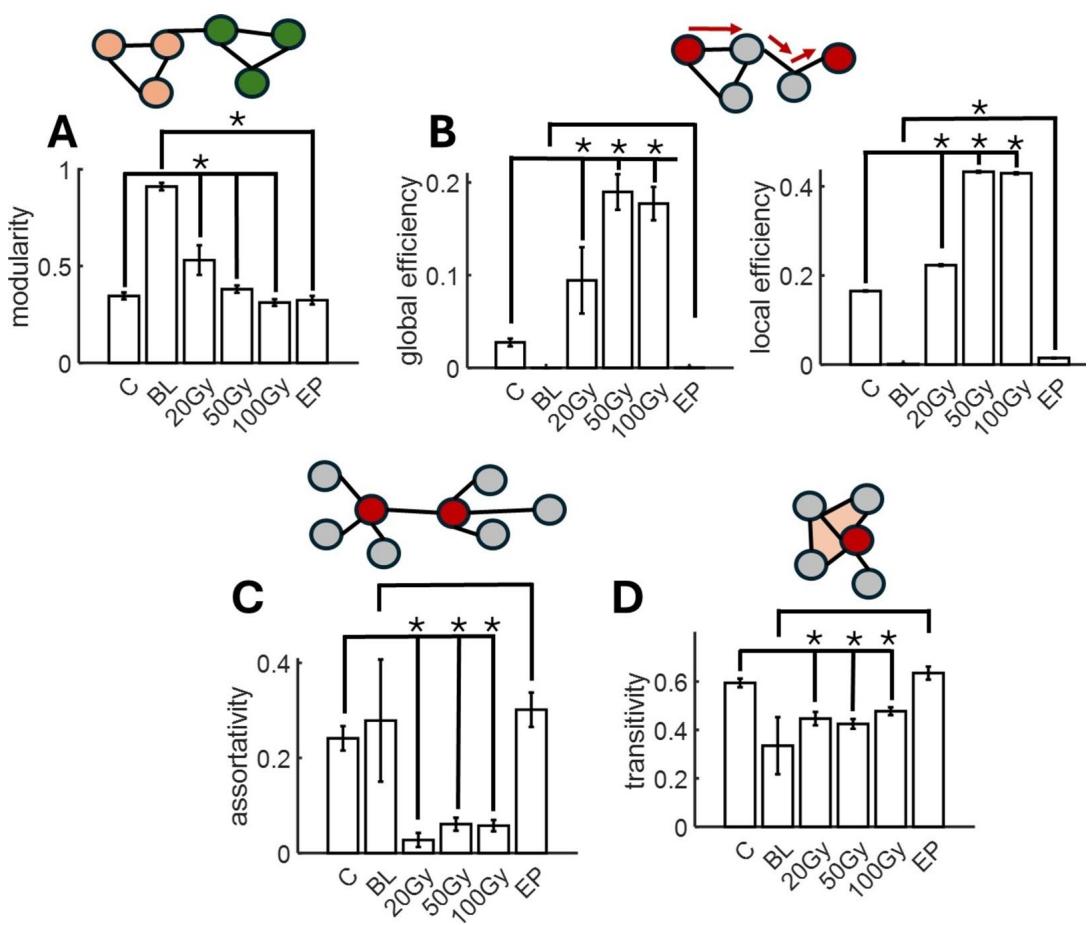
图3. 功能连接的图论性质。模块化(A)、全局和局部效率(B)、同配性©和传递性(D)在实验条件下进行了计算。每个指标的示意图显示在图表上方。
网络同配性决定了相互连接的节点对在与其他节点连接数量(技术上称为节点的度)方面的相似程度。举例来说,图3C展示了两个具有相同连接数的节点,因此具有高同配性。我们发现辐照网络的同配性有所降低(20 Gy: p = 6.0098e−16;50 Gy: p = 3.5354e−12;100 Gy: p = 6.4025e−14),但EP网络未出现可靠变化。
网络的传递性衡量了相互连接的节点对共享共同邻居的程度。从视觉上看,具有高传递性的功能网络在节点三元组之间呈现封闭三角形(图 3D)。我们发现相对于对照组,辐照切片的传递性出现适度下降(20 Gy:p=5.7301e−07;50 Gy:p=1.6429e−08;100 Gy:p=1.0579e−07)。在电生理网络中未观察到类似效应。
综上所述,功能网络的图论测量揭示了不同类别的指标,其中某些指标在辐射网络中更易发生变化(全局效率、同配性和传递性),而其他指标则在EP网络中(模块化)或辐射与EP共同作用下(局部效率)表现出更特异性的改变。这些功能连接测量指标为研究不同神经元状态和条件下网络层面的改变开启了一个潜在丰富的研究领域。
¶ 全局同步
为探究辐射和癫痫样活动诱导的同步性改变,我们首先采用500毫秒滚动窗口对脉冲序列进行时间平均,再通过跨通道活动累加计算刺激前后时间直方图(PSTH)。接着我们计算了各通道脉冲与PSTH之间的相关性(图4A)。高相关性表明单个神经元与群体活动波动之间存在全局同步。总体而言,高剂量辐射( )显著增强了同步性(图 4B)( ),而较低剂量则无此效应(20 Gy:p ;50 Gy: )。癫痫样网络中的全局同步仅轻微增强( ),可能原因有二:首先,癫痫样活动期与静息期交替出现,后者缺乏显著同步性17;其次,癫痫样活动仍保持空间局限性(图2B),从而限制了全局同步。将滚动窗口缩短至250毫秒仍获得类似结果(图4C)。由此可见,全局同步增强仅出现在高剂量辐射条件下,而未见于低剂量辐射或癫痫样活动中。
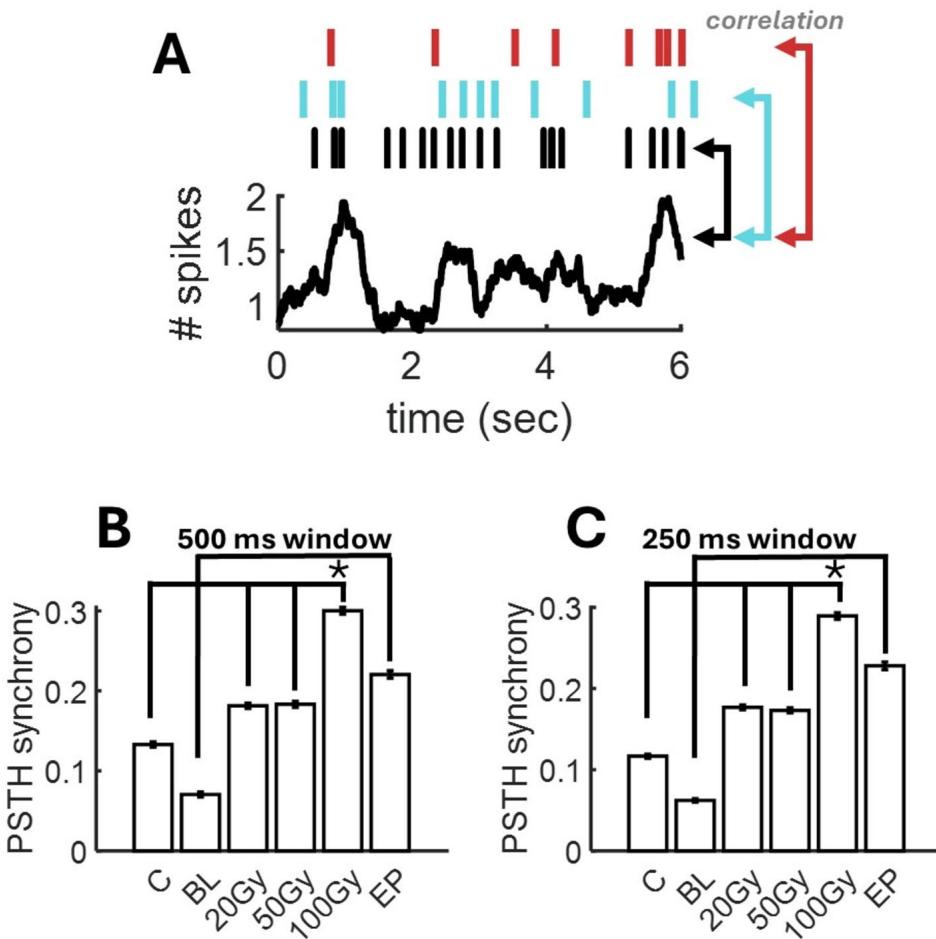
图4. 全局同步性变化。(A) 同步性通过各通道峰值(上图)与经滚动时间窗口平均后群体所有神经元总和得到的PSTH之间的相关性计算。(B-C) 使用500毫秒或250毫秒滚动窗口条件下各情形平均同步性。
¶ 群体活动的动态复杂性
在辐射和PE切片中检查了群体活动的复杂性,这指示了捕获神经元数据所需因子的数量23, 24, 25, 26。在所有递送到PFC的辐射剂量下,辐射切片的复杂性均高于对照组(图 5A)。对于20 Gy( )、50 Gy( )和100 Gy(p1.0041e−17),复杂性显著高于对照组。因此,辐射可靠地增加了在hd-MEA上记录的神经数据的复杂性。
该结果与PE处理的效果进行了比较。相对于基线活动,经PE处理的切片显示出复杂性显著增加(p )(图5B)。这种效应的强度超过了受辐射切片的复杂性,表明虽然辐射增加了神经活动的复杂性,但与癫痫样活动产生的高复杂性相比,这种效应有限,由此证明辐射后的群体活动不同于PE诱导的癫痫发作状态。不同实验条件下的特征值分布进一步支持了这一观点。在对照组和受辐射切片中,仅有有限数量的特征值呈现正值;相比之下,PE活动的特征在于跨越至少两个数量级的广泛特征值分布(图5C)。
上述关于放电频率、功能连接性和复杂度的结果共同表明,皮质细胞群中癫痫样活动与辐射诱导的神经元活动变化存在明显差异。虽然两种活动形式均表现为放电频率的增加,但辐射处理的脑片展现出与PE处理脑片不同的功能连接模式,且复杂度更低。
¶ 辐射后细胞死亡的量化
部分切片在辐射或假辐射(对照)条件下进行PI染色(图6A)。不同辐射剂量下的平均像素强度显示出一个趋势:剂量越高,细胞死亡水平越高(图6B)。具体而言,20Gy组的强度高于对照组(p=1.8954e−10),50 Gy组高于20 Gy组(p=4.1943e−12),100 Gy组高于50 Gy组(p=2.426e−12)。这表明细胞死亡与施加于前额皮质神经元的辐射剂量相关。在较高剂量(尤其是100Gy)下,我们观察到高强度像素呈聚集性空间分布,提示该区域细胞损伤更为显著(图6A,箭头)。值得注意的是,该区域邻近次级运动区(M2) —一个已知在辐射暴露后会出现细胞死亡增加的脑区27, 28。然而受高密度微电极阵列芯片所限,我们无法在成像后记录切片神经活动,因此这些区域是否表现出异常神经元活动仍有待探究。
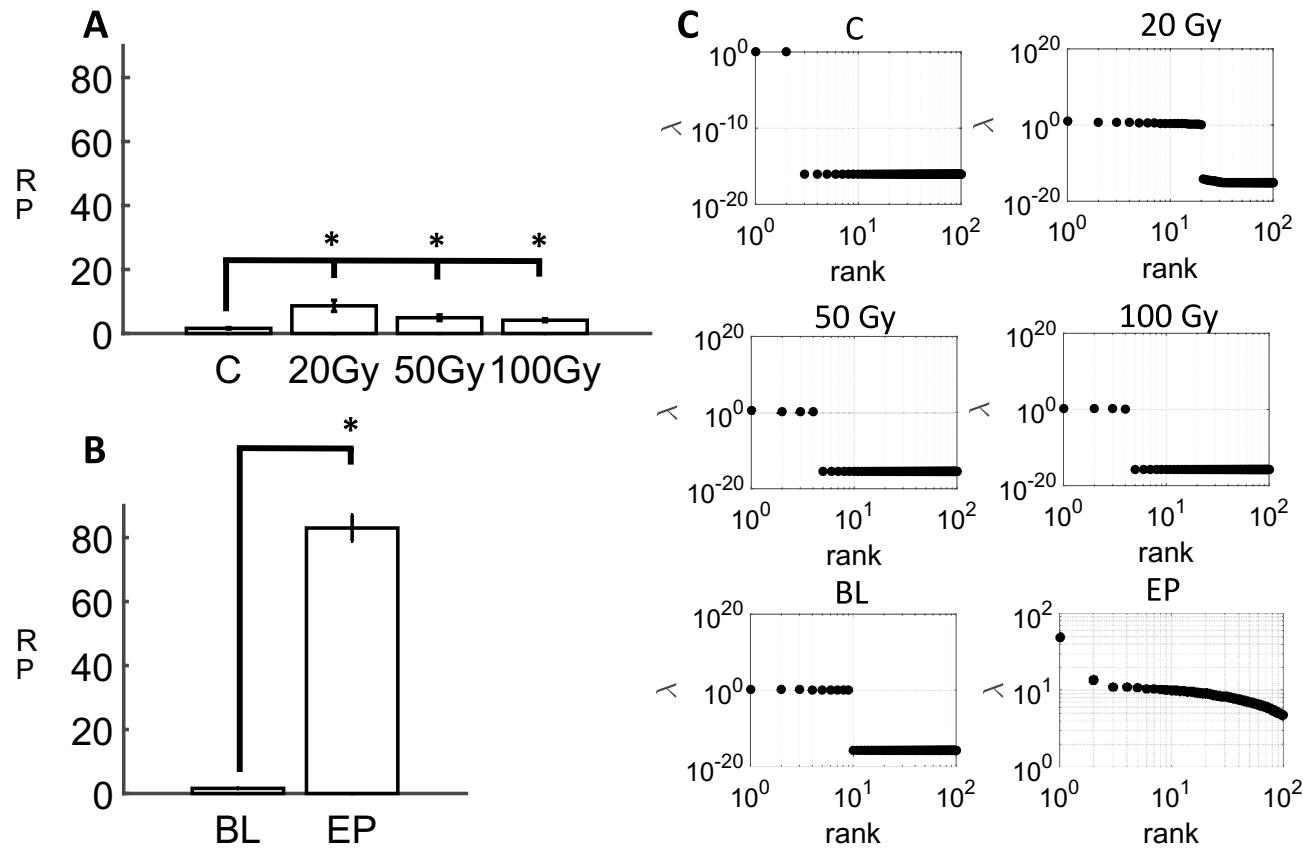
图5. 皮层网络的神经元复杂性。辐射切片中的参与率(PR)(A)。PE溶液处理的切片中的PR(B)。不同实验条件下的特征值分布(C)。
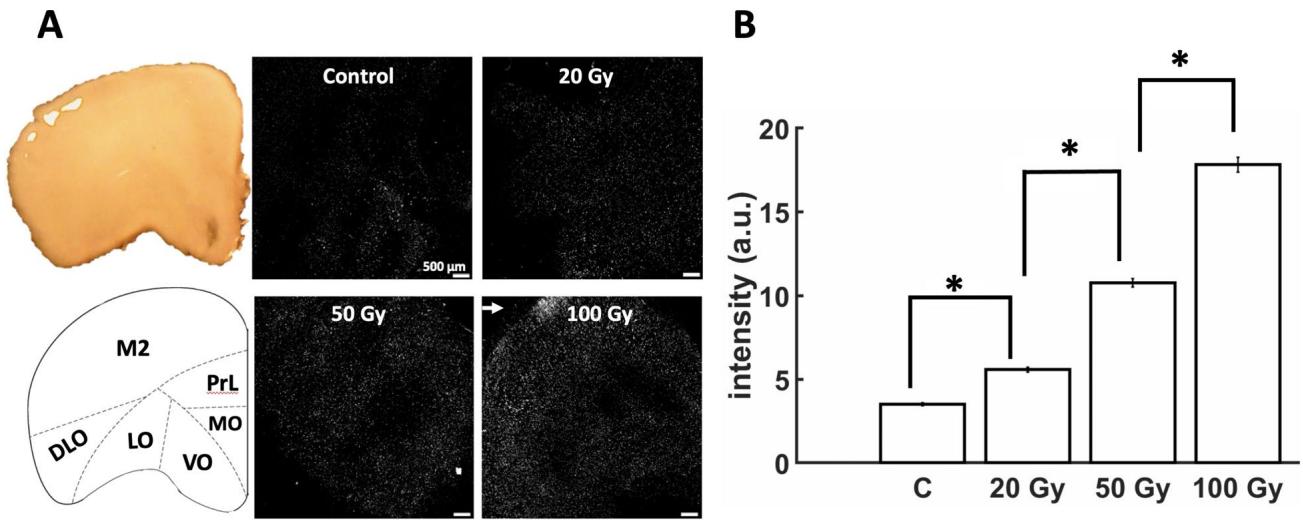
图6. 辐射后前额叶切片的碘化丙啶(PI)染色结果。(A)代表性样本显示PI强度随辐射剂量呈梯度增加。箭头指示100Gy处的PI强度聚集现象。左侧面板显示次级运动皮层(M2)、前边缘皮层(PrL)、内侧眶皮层(MO)、腹侧眶皮层(VO)、外侧眶皮层(LO)和背外侧眶皮层(DLO)的大致位置。(B)PI平均强度(“a.u.”:任意单位)。
¶ 讨论
本研究旨在探讨辐射对前额叶皮层细胞放电率、功能连接、复杂性及存活率的神经调控效应,并将结果与癫痫样活动期间获得的数据进行对比29。研究发现急性辐射剂量会显著增强神经元活动2,同时伴随复杂性的提升,以及功能连接密度和部分情况下连接强度的增加。功能连接图谱理论指标——包括全局效率、同配性和传递性——在辐射网络中呈现特异性改变。高剂量辐射(100Gy)下全局同步化显著增强。最终,辐射诱导了剂量依赖性细胞死亡,且损伤选择性定位于M2周围区域,该区域对辐射损伤具有特殊易感性27, 28。
这些结果与癫痫样活动存在明显区别:后者的复杂度显著更高,且功能连接虽强,但由于癫痫发作空间聚焦范围有限,其连接密度低于辐射切片。辐射切片与癫痫样活动之间的差异凸显了两种条件下获得效应的明显区别:虽然辐射切片和PE切片中的神经元活动与复杂度均有所提升,但辐射条件下的功能连接分布范围较PE处理更为广泛。本研究提出了一种新型检测方法,用于测试临床相关剂量辐射15, 16对神经动力学及细胞凋亡的影响。
以往的研究已证实,放电率与互相关性可能同步提升30,导致二者难以区分。但值得注意的是,这两种标志物并非总是同步增强。例如在癫痫样活动期间,与辐射切片相比,神经元放电率与平均关联强度均有所升高,但功能连接密度却显著降低。这是因为癫痫样活动的电波仅覆盖了阵列中特定的空间区域(图2B)17。在大脑皮层网络中,相关性受到兴奋性与抑制性突触传递的动态平衡调节,这使得它们成为广泛神经元群体活动中错综复杂的标志物31。
我们的研究结果指出,癫痫样活动期间复杂性显著增加,而相较于对照组,放射处理切片仅呈现适度上升。这些发现可通过以下方式理解:由于大量神经元间的协同变化32,记录到的大规模神经元活动表现出高度冗余性。这种冗余性导致神经活动在动力学空间中所占区域,相对于可能产生的活动模式总数而言较小,类似于持续投掷六面骰子只出现“1”或“2”的情况。参与比(PR)旨在量化神经活动所占区域的大小,技术上称为流形的维度。该维度反映了捕捉神经元间协同变化23, 25, 33, 34所需的自由度。若单一特征值足以解释所有活动变异,PR将得出数值1;反之若需多个特征值,PR将趋近于所记录神经元数量。我们的结果表明,癫痫发作和放射处理都会扩展活动流形,导致随时间推移出现更不可重复的模式。
辐射对前额叶皮层(PFC)网络内神经动力学的影响尚待完全阐明。既往文献表明,辐射会导致神经元放电频率增加2、突触形态改变2, 7、突触功能抑制及突触可塑性破坏4, 8。然而迄今为止,针对脑区内或脑区间的功能连接研究仍鲜有关注。此外,现有研究多聚焦于辐射对海马体的影响,而鉴于前额叶皮层在海马-前额叶通路中的重要作用,针对该脑区的研究需求日益凸显。该通路被认为在辐射后认知缺陷/障碍的发生中起关键作用2, 27, 35, 36。更有研究指出,前额叶皮层是对辐射最敏感的脑区之一27, 36, 37。
鉴于功能连接与认知结果19, 20, 38之间已确立的关联,在简化版高密度微电极阵列制备中研究辐射对功能连接的影响,对于理解辐射损伤的神经生理学机制及其临床影响至关重要。我们发现的剂量依赖性功能连接紊乱与人类影像学研究结果一致,后者显示受辐射区域35, 39, 40, 41的功能连接发生改变。而更高剂量的辐射与较差的长期认知预后5相关。理解健康和受辐射脑回路中功能连接的细胞起源,为开发限制辐射性认知损伤的干预措施提供了有效途径。
由于本研究聚焦于辐射的急性效应,活动性与功能连接在辐射后改变的时间尺度仍较为有限。标准实验条件下的体外急性脑切片通常具有6-12小时42的存活周期。因此,本研究仅限于辐射后数小时的观察窗口,无法考察早发性延迟或晚发性延迟辐射损伤3, 4。尽管存在此局限,鉴于在极短时间内施加了极高剂量辐射,我们有理由认为放射外科诱发的大部分损伤本质上属于急性损伤。这些发现也与先前关于辐射对前额叶皮层神经元急性效应的研究一致2。针对早发性和晚发性延迟辐射损伤的进一步研究表明,基于辐射后不同时间尺度会产生差异化效应:初期神经元放电频率的升高最终会伴随活动性的降低2, 6。人类鼻咽癌患者研究也报告了类似结果43,显示局部活动性在急性期增强,而这一现象与晚发性延迟阶段功能连接减弱及更高程度的组织坏死相关。
需要进一步研究辐射引起神经元活动、功能连接和细胞凋亡改变的细胞内机制,因为高密度微电极阵列仅能记录细胞附近的胞外电压波动。例如,离子通道动力学或膜片钳实验可能有助于解释前额叶皮层神经元为何出现过度兴奋现象——这些机制无法通过高密度微电极阵列记录获取。既往研究表明,N-甲基-D-天冬氨酸受体(NMDAR)中兴奋性NR2A亚基的急性下调,以及抑制性γ-氨基丁酸受体( )的增加,会引发突触功能改变并抑制长时程增强8。目前尚不清楚这些现象如何影响神经元网络整体功能,例如功能连接的密度与强度变化。虽然技术层面存在挑战,但同步进行胞内/胞外记录可能为此提供重要线索44, 45。
鉴于高密度微电极阵列揭示了神经元活动和网络互作中辐射损伤的标志物,研究药物预处理在预防这些改变方面的潜在影响将大有裨益。既往研究表明,使用美金刚(一种NMDAR拮抗剂)预处理脑切片8,或口服表没食子儿茶素没食子酸酯(绿茶主要多酚化合物46)及槲皮素(多种蔬果中含有的黄酮类化合物47),均可对辐射损伤产生神经保护作用。
高清微电极阵列记录的一个局限是,在操作上无法实施典型放射治疗方案中使用的分次剂量照射。尽管现有可植入式在体阵列,但该平台对放射线的高度敏感性引发重大关切。此外,在体实验过程中使用的麻醉剂已知会影响大脑活动并改变神经元功能,这可能对记录数据造成干扰。我们选择采用大剂量单次放射方案,例如立体定向放射外科、脉冲高剂量率近距离放疗以及某些大分割姑息治疗方案所使用的剂量。这些剂量同时为比较标准剂量率(5-10戈瑞/分钟)与超快剂量率(40戈瑞/秒)对神经活动各项标志物及细胞死亡的影响提供了基准参照。
未来的研究可以采用其他剂量范围,例如低于20Gy或高于100Gy的剂量,以确定是否会出现相同的神经动力学和剂量依赖性细胞凋亡。值得注意的是,超过60Gy的剂量已被证明会在动物模型中产生辐射诱导的坏死(放射性坏死)和病变6, 51;然而临床研究显示,暴露于低至12Gy52, 53, 54剂量的正常组织也会出现放射性坏死。与这些发现相似,我们的研究结果表明从低至20Gy的剂量开始,细胞死亡就以剂量依赖性方式发生。最后,后续研究应采用本实验方法检测大脑不同区域,以确定这些剂量是否会产生区域特异性影响。
总之,高密度微电极阵列揭示了前额叶皮层广域网络中由辐射引起的变化,这些变化的特点是放电率增加、复杂度提高、功能连接中断以及剂量依赖性细胞凋亡。这些标志物与在癫痫样活动的高密度微电极阵列记录中观察到的标志物不同,从而表明辐射不仅仅诱发癫痫状态。这些结果表明,高密度微电极阵列是一种新颖且有前景的工具,可用于研究临床相关剂量辐射的相互作用以及辐射防护的潜在靶点。
¶ 方法
¶ 电生理数据采集概述
共12个急性前额皮质切片被分配至促癫痫样组(PE组,2个切片)或放射治疗组(10个切片)(图7)。该样本量在高密度微电极阵列记录中较为常见,因为统计样本量取决于同步记录的电极数量( 96),而非切片总数。促癫痫样治疗组分析的切片数量较少,是因为广泛性发作事件属于罕见现象,且数据源自既往已发表数据集17。PE组切片首先通过hd-MEA进行基线记录,随后灌注PE溶液并在20分钟后再次记录。放射治疗组切片分为对照组(4个切片)与照射组(6个切片),分别接受20戈瑞、50戈瑞和100戈瑞的梯度剂量照射,每次照射后均进行45分钟恢复期。这些切片随后分别进行hd-MEA记录或碘化丙啶染色成像分析。
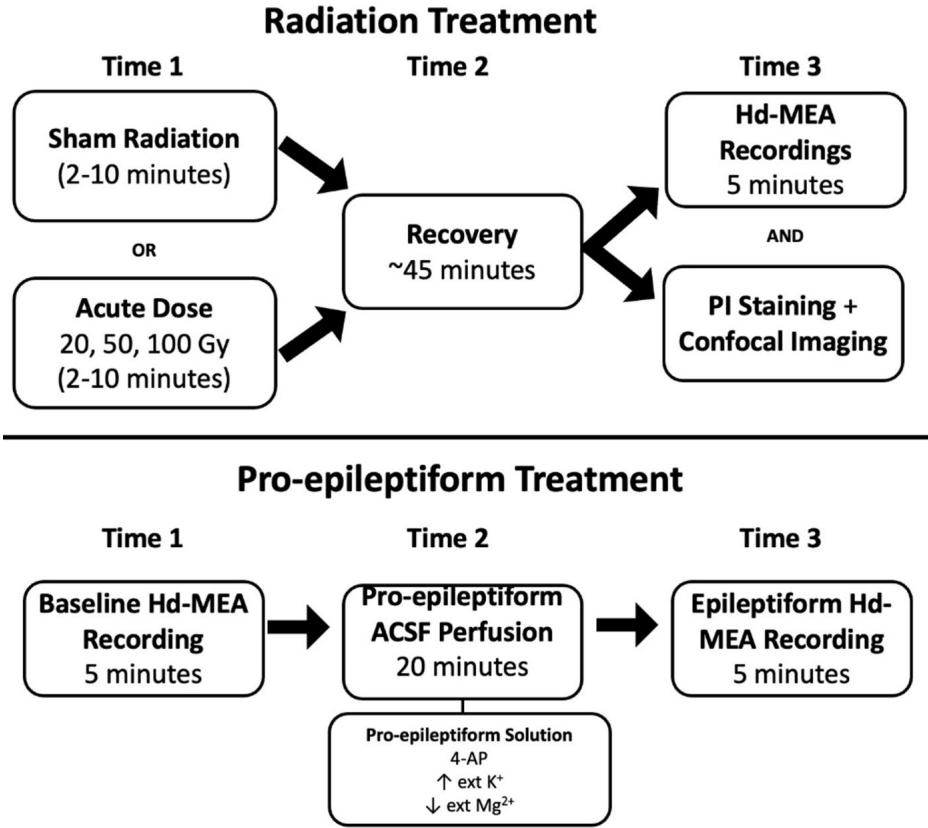
图7. 用于对前额叶皮层切片进行辐射、记录神经活动及应用PI染色的实验流程示意图。比较了辐射与PE处理下的神经活动情况。
对照切片接受假照射后,经过45分钟的恢复期再进行记录或成像步骤。综上,该平台可直接比较癫痫样活动与辐射诱导的神经活动变化,并能评估剂量依赖性细胞凋亡。
¶ 动物
数据采集使用14-21日龄、雌雄皆有的Sprague Dawley大鼠,购自Charles River公司。我们选择研究幼年动物,因为既往研究表明幼年个体的脑切片存活率高于后期发育阶段55。与成年动物相比,幼年切片中的神经元通常对各种损伤具有更强抵抗力,这表明在成熟动物中报道的效果可能更为显著56。研究幼年啮齿动物的另一个动机来自人类患者的年龄相关性发现。既往研究显示辐射存在年龄依赖性效应,年轻患者通常比成年患者预后更差,这凸显了研究这些效应的重要性57。这些发现在啮齿动物研究中也得到了重复验证4。
动物饲养在标准环境中,配备笼内丰容设施,可自由摄取饮水和标准饲料。所有实验均遵循加拿大动物护理委员会指南进行。所有操作程序均获得渥太华大学动物护理与兽医服务部门批准,并符合ARRIVE指南要求。
¶ 急性切片制备
动物使用异氟烷(Baxter Corporation)深度麻醉,随后通过断头术实施安乐死。迅速取出动物大脑并浸入冷冻胆碱解剖缓冲液中。该缓冲液的组成如下: 氯化胆碱、 、 、 、 、 抗坏血酸钠、 葡萄糖、 NaHCO3,并在进行解剖前用碳合气( )灌注25分钟。使用Leica VT1000S振动切片机将大脑冠状切片,厚度为 微米。含有前额叶皮层(PFC)的急性切片被用于所有实验。由于高密度微电极阵列(hd-MEA)实验的技术限制,我们只能对切片内的解剖区域进行粗略的识别。鉴于我们无法确定切片的精确解剖定位,我们的目标是更广泛地理解辐射对前额叶皮层网络的影响,而不是提供辐射对PFC特定区域的局部效应。
切片采集完成后,被放入充满标准人工脑脊液(ACSF)的恢复室中。该人工脑脊液包含以下成分: 、 KCl、 、 、 、 葡萄糖以及 。整个过程中持续使用碳合气对人工脑脊液进行灌注。
CO )混合气体环境中,并维持温度在 。切片完成后,将脑切片静置恢复。
实验前 1 小时,使人工脑脊液平衡至室温。
¶ 辐射
使用机器人放射外科平台(射波刀® G4)以10戈瑞/分钟的标准剂量率,对部分健康脑切片施加了20戈瑞、50戈瑞或100戈瑞的急性辐射剂量。选择单次大剂量照射方案是为后续比较标准剂量率与FLASH放射治疗等超高速照射方法奠定基础。这些超高速剂量率较常规放疗高出数个数量级,在保持治疗效果的同时有望减少辐射损伤58, 59, 60, 61, 62。 实验中急性前额叶皮层脑切片持续灌注碳合气(95%氧 二氧化碳 ),但在辐射给照期间暂停灌注(根据剂量不同持续2-10分钟)。辐射束直径为60毫米,脑切片置于束流中心以确保整体受照剂量均匀。对照切片被运送至射波刀相同位置以排除运输过程中可能存在的机械损伤,同时碳合气灌注也暂停~2-10分钟以模拟实验条件,但未对这些切片进行辐照。由于高清微电极阵列可能因辐照导致芯片损坏,实验采用不同切片分别进行辐射处理与对照。两组切片随后分别用于神经电信号记录或碘化丙啶染色以量化细胞死亡。
¶ 癫痫样活动
我们使用了一种促癫痫样人工脑脊液(PE-ACSF)来诱发发作间期样神经活动29,其成分包括: M NaCl、8.5 mM KCl、1.25 mM NaH2PO4、 、 、24 mM NaHCO3、 葡萄糖和 。在此条件下,基线记录取自同一批脑片在接触PE-ACSF前的状态。完成基线记录后,将脑片在PE-ACSF中灌流20分钟,并采集10分钟的神经活动记录。基线组脑片与放射对照组脑片的区别在于,前者未经历因运送脑片至辐照场所而可能造成的机械损伤。
¶ 高密度微电极阵列记录
系统描述。使用有源像素传感器高清微电极阵列采集网络级神经活动的记录。该高清微电极阵列采用基于CMOS的CCD单片芯片,其像素经过改良可检测电活性组织中的电压变化。该阵列能够以 采样频率在全阵列范围内同步采集4,096个电极的信号。高清微电极阵列芯片包含 个电极,以像素单元阵列形式排列,每个像素尺寸为 微米,电极间距为42微米。阵列有效面积为7.22平方毫米2,像素密度达567像素/平方毫米214, 63。数据通过BrainWave软件(3Brain公司,瑞士)采集,并导入MATLAB(MathWorks,纳蒂克)进行离线分析。
高清微电极阵列记录方案。将每种条件下的急性前额叶皮层切片样本置于高清微电极阵列芯片上,用铂金网格固定并浸没在持续通入碳合气( 的标准人工脑脊液中。整个记录过程中切片始终保持在 恒温环境。实验在暗环境下完成以避免光学伪迹干扰。每个切片均记录五分钟神经电活动。
量化辐照脑切片中的细胞死亡。从每个剂量条件(20、50和 )及对照条件中取不同脑切片子集(4片),随后采用PI染色剂( ,Sigma–Aldrich)进行染色。该细胞死亡标记物可与质膜破碎的神经元DNA结合,但在健康神经元中保持膜不通透性64。施加PI染色15分钟后,对PI染色的ACSF进行连续稀释,并使用蔡司LSM880共聚焦显微镜对急性脑切片进行成像。我们基于PI染色切片图像的平均强度来量化细胞死亡。
数据准备。从所有条件下收集的数据最初采用二阶带通巴特沃斯滤波器进行正向和反向处理(300-5000赫兹),该滤波器应用于原始电压以去除高频噪声和缓慢变化的场电位{v30。任何电压超过1000微伏的时间点均被识别为伪迹。随后用滤波数据的均值替换这些伪迹。接着基于多单元活动(MUA)采用电压阈值法66提取尖峰时间,该方法通过识别滤波信号均值以下5个标准差(SD)的负信号峰值来确定。为确定最终阈值,我们首先计算滤波基线数据的均值和标准差,然后取两者差值作为整体阈值。将此最终阈值应用于电压数据以识别多单元尖峰时间,代表hd-MEA单个通道附近神经元的活动。数据样本和MATLAB教程脚本可作为补充材料获取。
与多单元活动(MUA)相关的一个已知局限性是可能捕获信号冗余,即单个通道采集到多个神经元的活动,或单个神经元的活动被阵列67, 68, 69上的多个通道采集。因此,该方法缺乏提供单神经元分辨率数据所需的基础事实。尽管如此,宽带信号可分解为表示局部场电位的较慢成分( )和构成MUA(即单个电极70, 71, 72, 73, 74附近神经元活动总和)的较快成分( )。虽然可采用推断方法将MUA分离为假定的单细胞贡献67, 68, 69,但需要基础事实对比以实现精确的尖峰排序。即使没有直接的基础事实验证,研究仍表明MUA能捕获神经环路活动的关键特性,并可充分推断神经元间的放电频率与相关性75。
神经元放电频率。通过利用脉冲发放时刻生成栅格图,用以呈现整个网络随时间变化的放电活动。将原始18千赫兹的栅格数据降采样至1千赫兹,采用非重叠时间窗进行二值化处理:当窗内出现一个或多个脉冲时记为“1”,无脉冲则记为“0”。随后采用滑动时间窗计算刺激前后时间直方图。鉴于放电频率较低,我们选用500毫秒的宽时间窗进行分析。无活动信号的通道被排除在后续分析之外。通过柯尔莫戈罗夫-斯米尔诺夫正态性检验发现,所有实验条件下的放电频率均不符合正态分布( 1)。既往研究亦证实皮层神经元放电频率遵循对数正态分布而非正态分布76, 77。因此我们选用非参数威尔科克森秩和检验进行放电频率(赫兹)比较(显著性水平: ),该检验要求样本间相互独立,但放宽了对高斯正态性的假设78。最后,对全局数据分布采用非参数检验方法,确保不会因高密度微电极阵列同步记录的通路数量巨大( )而放大可能存在的微小效应。
功能连接性。数据从18千赫降采样至1千赫,在计算皮尔逊相关性前应用了10毫秒的滚动窗口。针对高密度微电极阵列内每对电极计算皮尔逊互相关,得到一个 的交互矩阵。随后将这些相关性通过 的阈值进行处理,以检测通道对之间功能连接的存在与否,这代表了这些通道上多单元尖峰信号的统计重合性。使用柯尔莫戈洛夫-斯米诺夫检验及后续的威尔科克森秩和检验对数据正态性进行评估。
神经复杂性。高清微电极阵列记录的活动时空模式通过其参与比进行描述,该指标是反映捕获数据波动所需因子数量的神经复杂性度量23, 25, 33, 34。群体记录参与比的计算首先需提取各实验条件下10个短时段数据(平均时长:3,811.5毫秒,标准误:145.17)。通过特征谱分解79计算各时段参与比,得到排序后的特征值 1、. . .、 ,其中N表示高清微电极阵列的通道总数。随后将参与比计算为特征谱第一矩与第二矩的归一化比值,
如果群体活动模式可以用有限数量的维度来描述,那么只有一部分特征值为正,从而导致较低的PR。然而,具有更高复杂性的活动模式会产生大量正特征值,因此PR也更高。
数据可用性
本研究所述数据可根据合理要求向通讯作者(J.P. Thivierge, jthivier@uottawa.ca)获取。Matlab教程(dx.doi.org/10.6084/m9.figshare.26789953)与示例数据(dx.doi.org/10.6084/m9.figshare.26597269)已作为免费资源在线发布。
收到:2024年6月11日;接受:2024年8月23日Published online: 29 August 2024
¶ 参考文献
- Quigg, M., Rolston, J. & Barbaro, N. M. 癫痫放射外科治疗:临床经验及潜在抗癫痫机制。《癫痫》53(1), 7–15. https:// doi . org/ 10. 1111/j. 1528- 1167. 2011. 03339.x (2012).
- 张迪等. 颅脑照射诱导前额叶皮层轴突起始段功能障碍与神经元损伤并 损害海马耦合。《神经肿瘤学进展》2(1), vdaa058. https:// doi. org/ 10. 1093/ noajnl/ vdaa0 58 (2020).
- Greene-Schloesser, D. 等. 辐射性脑损伤研究综述。《肿瘤学前沿》2, 73 (2012).
- 张迪等. 辐射引发与年龄相关的皮质突触可塑性缺陷。《神经 肿瘤学》20(9), 1207–1214. https:// doi. org/ 10. 1093/ neuonc/ noy052 (2018).
- Brière, M. E., Scott, J. G., McNall-Knapp, R. Y. & Adams, R. L. 儿童脑肿瘤幸存者认知结局:长期随访中出现注意缺陷延迟。《儿科血液与癌症》50(2), 337–340. https:// do i. org/ 10. 1002/ pbc. 21223 (2008).
- Zaer, H.等. 局部电离辐射非消融剂量改变中枢神经网络功能。《脑刺激》15(3), 586–5 97. https:// doi. org/ 10. 1016/j. brs. 2022. 04. 001 (2022).
- Kempf, S. J.等. 新生期照射导致小鼠海马与皮层突触可塑性相关蛋 白质组持续改变。《蛋白质组学研究》14(11), 4674–4686. https:// doi. org/ 10. 1021/ acs. jprot eome. 5b005 64 (2015).
- 吴鹏 等. 辐射引起神经元功能的急性改变。《PLOS综合》7(5), e37677. https:// doi. org/ 10. 1371/ journ al. pone. 00376 77 (2012).
- Carlén, M. 前额叶皮层的构成要素?《科学》358(6362), 478–482. https:// doi. org/ 10. 1126/ scien ce. aan88 66 (2017).
- Mill er, E. K. & Cohen, J. D. 前额叶皮层功能的整合理论。《神经科学年度评论》24(1), 167–202. https:// doi. org/ 10. 1146/ annur e v. neuro. 24.1. 167 (2001).
- Thierry, A. M., Gioanni, Y., Dégénétais, E. & Glowinski, J. 海马-前额叶皮层通路:解剖学与电 生理学特征。《海马》10(4), 411–419. https://doi.org/10.1002/1098-1063(2000)10:4<411::AID-HIPO7>3.0.CO;2-A (2000).
- Gould, J. 解析脑癌流行病学。《自然》561(7724), S40–S41. https:// doi. org/ 10. 1038/ d41586- 018- 06704-7 (2018).
- Steve nson, I. H. & Kording, K. P. 神经记录技术进步对数据分析的影响。《自然神经科学》14(2), 2. https:// doi. org/ 10. 1038/ nn. 27 31 (2011).
- Ferrea, E.等. 利用微电子多电极阵列实现脑切片场电位的大规模高分辨率电生理成像。《神经回路前沿》6, 8 0 (2012).
- Redmond, K. J.等. 脑转移瘤放射外科与分次立体定向放射外科的肿瘤控制概率。《国际放射肿瘤学杂志》110 (1), 53–67. https:// doi. org/ 10. 1016/j. ijrobp. 2020. 10. 034 (2021).
- Tuleasca, C., Vermandel, M. & Reyns, N. 立体定向放射 外科:从处方物理辐射剂量到生物有效剂量。《梅奥诊所学报》96(5), 1114–1116. https:// doi. org/ 10. 1016/j. mayocp. 2021. 03. 027 (2021).
- 布歇-鲁蒂埃, M. 和蒂维耶格, J. P. 一种深度生成对抗网络捕捉大脑皮层去抑制回路中的复杂螺旋波。BMC 神经科学 24(1), 22. https://doi.org/10.1186/s12868-023-00792-6 (2023)。
- 克拉多克, R. C., 霍尔茨海默, P. E. III, 胡, X. P. 和梅伯格, H.S. 从静息态功能连接预测疾病状态。磁共振医学 62(6), 1619–1628. https://doi.org/10.1002/mrm.22159 (2009)。
- 康斯坦丁努, N., 佩特梅里杜, E., 斯塔马塔基斯, E. A., 塞梅尼斯, I. 和康斯坦丁尼杜, F. 改变静息功能连接与中度至重度创伤性脑损伤男性的认知结果相关。神经科学前沿 9, 1163. https://doi.org/10.3389/fneur.2018.01163 (2019)。
- 朗 S 等 人. (2017) 额顶网络中的功能连接:胶质瘤患者术前认知功能和术后认知结果的指标。世界神经外科 105, 913–922. https://doi.org/10.1016/j.wneu.2017.05.149
- 王, K. 等人. 早期阿尔茨海默病中改变的功能连接:一项静息态功能磁共振成像研究。人类脑图谱 28(10), 967–978. https://doi.org/10.1002/hbm.20324 (2007)。
- 鲁比诺夫, M. 和斯庞斯, O. 脑连接性的复杂网络度量:用途和解释。神经影像 52(3), 1059–1069. https://doi.org/10.1016/j.neuroimage.2009.10.003 (2010)。
- 阿尔坦, E., 索拉, S. A., 米勒, L.E. 和佩罗, E. J. 估计多电极神经记录背后流形的维度。PLOS 计算生物学 17(11), e1008591. https://doi.org/10.1371/journal.pcbi.1008591 (2021)。
- 胡, Y. 和松波林斯基, H. 随机连接递归神经元网络的协方差矩阵谱,第24页,(2020)。
- 利特温-库马尔, A., 哈里斯, K. D., 阿克塞尔, R., 松波林斯基, H. 和雅培, L. F. 突触连接的最佳程度。神经元 93(5), 1153–1164. https://doi.org/10.1016/j.neuron.2017.01.030 (2017) (.e7)。
- 马祖卡托, L., 丰塔尼尼, A. 和卡梅拉, G. L. 刺激降低皮层活动维度。系统神经科学前沿 10, 11. https://doi.org/10.3389/fnsys.2016.00011 (2016)。
- 赫尼利科娃, P. 等人. 临床相关分次全脑照射引起啮齿动物前额叶皮层的解剖和代谢改变。国际神经化学 154, 105293. https://doi.org/10.1016/j.neuint.2022.105293 (2022)。
- 上野, H. 等人. 单次颅脑照射后成年小鼠特定区域小清蛋白神经元减少和行为改变。国际放射生物学杂志 95(5), 611–625. https://doi.org/10.1080/09553002.2019.1564081 (2019)。
- 波斯尼科娃, T. Y., 阿马欣, D. V., 特罗菲莫娃, A. M. 和扎伊采夫, A. V. 钙渗透性AMPA受体对大鼠海马切片中癫痫样活动诱导的突触可塑性至关重要。生物化学与生物物理研究通讯529(4), 1145–1150. https://doi.org/10.1016/j.bbrc.2020.06.121 (2020)。
- 德拉罗查, J., 杜瓦恩, B., 谢亚-布朗, E., 乔西奇, K.和雷耶斯, A. 神经放电序列之间的相关性随放电率增加而增加。自然 448(7155), 802–806. https://doi.org/10.1038/nature06028(2007)。
- 马佐尼, A. 等人. 关于神经元网络中自发活动的动力学。PLOS ONE 2(5), e439. https://doi.org/10.1371/journal.pone.0000439 (2007)。
- 坎宁安, J. P. 和于, B. M. 大规模神经记录的降维。自然神经科学 17(11), 1500–1510. https://doi.org/10.1038/nn.3776 (2014)。
- 马祖卡托, L., 丰塔尼尼, A. 和卡梅拉, G. L. 刺激降低皮层活动维度。系统神经科学前沿 10(11),11. https://doi.org/10.3389/fnsys.2016.00011 (2016)。
- 胡, Y. 和松波林斯基, H. 具有线性动力学的随机连接递归神经元网络协方差矩阵的谱。PLoS 计算生物学 18, e1010327. https://doi.org/10.1371/journal.pcbi.1010327 (2022)。
- , S. C. 等 人.鼻咽癌患者亚致死性放射脑损伤后海马功能的预后。科学报告 7(1), 14697 (2017). https://doi.org/10.1038/s41598-017-13972-2。
- 科瓦尔丘克, A. 和科尔布, B. 低剂量辐射对大脑的影响——从机制和行为结果到缓解策略。细胞周期 16(13), 1266–1270 (2017)。
- 科尔涅夫, M. A., 库利科娃, E. A. 和库尔巴赫, O. S. 分次低剂量照射后大鼠胎儿大脑皮层的细胞组成。神经科学与行为生理学 35(6), 635–638. https://doi.org/10.1007/s11055-005-0104-3 (2005)。
- 哈韦莱克, D. J., 希普, J. F., 刘易斯,C. M., 科贝塔, M. 和恩格尔, A. K. 功能连接增加表明多发性硬化症认知障碍的严重程度。美国国家科学院院刊 108(47), 19066–19071. https://doi.org/10.1073/pnas.1110024108 (2011)。
- 科瓦奇, Á. 等人. 多形性胶质母细胞瘤基于3D放疗后功能MRI信号的变化。神经肿瘤学杂志 125(1), 157–166. https://doi.org/10.1007/s11060-015-1882-2 (2015)。
- 马, Q. 等人. 鼻咽癌患者放疗后辐射诱导的功能连接改变。医学(巴尔的摩)95(29), e4275. https://doi.org/10.1097/MD.0000000000004275 (2016)。
- 米切尔, T. J. 等人. 全脑放疗后人类大脑功能网络组织被破坏。大脑连接 10(1), 29–38. https://doi.org/10.1089/brain.2019.0713 (2020)。
- 布斯基拉, Y. 等人. 延长急性脑切片的存活时间。科学报告 4(4), 4. https://doi.org/10.1038/srep05309 (2014)。
- 丁, Z. 等人. 症状前期辐射诱导的大脑结构和功能异常及结果预测。人类脑图谱 39(1), 407–427. https://doi.org/10.1002/hbm.23852 (2018)。
- 迪帕洛, M. 等人. 使用3D等离子体纳米电极记录哺乳动物神经元和心脏细胞的自发动作电位:细胞内和细胞外记录。纳米快报 17(6), 3932–3939. https://doi.org/10.1021/acs.nanolett.7b01523 (2017)。
- 汉密尔顿, F., 贝里, T. 和绍尔, T. 通过细胞外测量追踪细胞内动力学。PLOS ONE 13(10), e0205031. https://doi.org/10.1371/journal.pone.0205031 (2018)。
- 埃尔-米西里, M. A., 奥斯曼, A. I., 埃尔-萨维, M. R. 和莱贝德, M. F. 表没食子儿茶素-3-没食子酸酯(EGCG)对辐射诱导的大鼠海马损伤和凋亡的神经保护作用。国际放射生物学杂志 94(9), 798–808. https://doi.org/10.1080/09553002.2018.1492755 (2018)。
- 卡莱, A. 等人. 槲皮素对辐射诱导的大鼠脑损伤的神经保护作用。辐射研究(东京)59(4), 404–410. https://doi.org/10.1093/jrr/rry032 (2018)。
- 黄, Z. 等人. 麻醉中自发大脑活动的时间变异性和神经同步性改变。人类脑图谱 35(11), 5368–5378. https://doi.org/10.1002/hbm.22556 (2014)。
- 索伦蒂, V. 等人. 理解麻醉对皮层电生理记录的影响:范围综述。国际分子科学杂志 22(3), 3. https://doi.org/10.3390/ijms22031286 (2021)。
- 袁, H. 等人. 分次辐射对小鼠模型脑血管的影响:血脑屏障通透性、星形胶质细胞增殖和超微结构变化。国际放射肿瘤学杂志 66(3), 860–866. https://doi.org/10.1016/j.ijrobp.2006.06.043 (2006)。
- 扎尔, H. 等人. 猪模型中小体积立体定向脑放射外科的放射性坏死和细胞变化。科学报告 10(1), 16223. https://doi.org/10.1038/s41598-020-72876-w (2020)。
- 布洛尼根, B. J. 等人. 照射体积作为直线加速器立体定向放射外科后脑放射性坏死的预测因子。国际放射肿瘤学杂志 77(4), 996–1001. https://doi.org/10.1016/j.ijrobp.2009.06.006 (2010)。
- 科里特科, T. 等人. 12 Gy伽玛刀放射外科体积是非动静脉畸形颅内肿瘤放射性坏死的预测因子。国际放射肿瘤学杂志 64(2), 419–424. https://doi.org/10.1016/j.ijrobp.2005.07.980 (2006)。
- 雷诺兹, T. A., 詹森, A. R., 贝莱尔斯, E. E. 和奥泽, M. 立体定向放射外科/放射治疗的剂量梯度指数。国际放射肿瘤学杂志 106(3), 604–611. https://doi.org/10.1016/j.ijrobp.2019.11.408 (2020)。
- 利普顿, P. 等人. 充分利用脑切片:比较制备方法。神经科学方法 59(1), 151–156. https://doi.org/10.1016/0165-0270(94)00205-U (1995)。
- Huang, S. & Uusisaari, M. Y. 脑切片制备过程中保持生理温度可提升急性脑片标本质量。前沿·细胞神经科学 7, 48. https:// doi. org/ 10. 3389/ fncel. 2013. 00048 (2013).
- Mulhern, R. K., Merchant, T. E., Gajjar, A., Reddick, W. E. & Kun, L. E. 儿童脑肿瘤幸存者的晚期神经认知后遗症。柳叶刀·肿瘤学 5(7), 399–408. https:// doi. org/ 10. 1016/ S1470- 2045(04) 01507-4 (2004).
- Favaudon, V. 等。超高剂量率FLASH照射增强小鼠正常组织与肿瘤组织的反应差异。科学·转化医学 6(245), 245ra93-245ra93. https:// doi. org/ 10. 1126/ scitr anslm ed. 30089 73 (2014).
- Hughes, J. R. & Parsons, J. L. FLASH放疗:基于质子束治疗的当前认知与未来展望。国际分子科学杂志 21(18), 18. https:// doi. org/ 10. 3390/ ijms2 11864 92 (2020).
- Matuszak, N. 等。FLASH放疗:放射治疗领域的新兴技术。肿瘤放射治疗实践与报告 27(2), 2. https:// doi. org/ 10. 5603/ RPOR. a2022. 0038 (2022).
- Montay-Gruel, P. 等。闪速照射:剂量率超过100Gy/s的全脑照射后小鼠记忆功能独特保留。放射肿瘤学 124(3), 365–369. https:// doi. org/ 10. 1016/j. radonc. 2017. 05. 003 (2017).
- Simmons, D. A. 等。FLASH照射小鼠全脑后认知缺陷减轻与海马树突棘丢失减少及神经炎症减弱相关。放射肿瘤学 139, 4–10. https:// doi. org/ 10. 1016/j. radonc. 2019. 06. 006 (2019).
- Imfeld, K. 等。用于电生理活动细胞外记录的大规模高分辨率数据采集系统。IEEE生物医学工程汇刊 55(8), 2064–2073. https:// doi. org/ 10. 1109/ TBME. 2008. 919139 (2008).
- Kuebler, E. S., Tauskela, J. S., Aylsworth, A., Zhao, X. & Thivierge, J. P. 爆发预测神经元在体外谷氨酸损伤模型中的脑缺血存活研究。科学报告 5(1), 1. https:// doi. org/ 10. 1038/ srep1 7718 (2015).
- Bullmann, T. 等。基于高密度微电极阵列的轴突分支大规模映射研究。前沿·细胞神经科学 13, 404. https:// doi. org/ 10. 3389/ fncel. 2019. 00404 (2019).
- Lewicki, M. S. 锋电位分类方法综述:神经动作电位的检测与分类。网络:神经系统计算 9(4), R53-77 (1998).
- Hilgen, G. 等。面向大规模高密度微电极阵列的无监督锋电位分类。细胞报告 18(10), 2521–2532. https:// doi. org/ 10. 1016/j. celrep. 2017. 02. 038 (2017).
- Prentice, J. S. 等。多电极阵列快速可扩展贝叶斯锋电位识别方法。PLOS ONE 6(7), e19884. https:// doi. org/ 10. 1371/ journ al. pone. 00198 84 (2011).
- Rossant, C. 等。大规模高密度电极阵列的锋电位分类。自然·神经科学 19(4), 634–641. https:// doi. org/ 10. 1038/ nn. 4268 (2016).
- Bansal, A. K., Vargas-Irwin, C. E., Truccolo, W. & Donoghue, J. P. 初级运动皮层与腹侧前运动皮层低频局部场电位、锋电位活动与三维抓取运动学的关系。神经生理学杂志 105(4), 1603–1619. https:// doi. org/ 10. 1152/ jn. 00532. 2010 (2011).
- Davis, Z. W., Muller, L.& Reynolds, J. H. 自发性锋电位活动受宽带波动调控。神经科学杂志 42(26), 5159–5172. https:// doi. org/ 10. 1523/ JNEUR OSCI. 1899- 21. 2022 (2022).
- Legatt, A. D., Arezzo, J. & Vaughan, H. G. 多单元平均活性作为局部神经元活动相位性变化的评估指标:容积传导电位的影响。神经科学方法 2(2), 203–217. https:// doi. org/ 10. 1016/ 0165- 0270(80) 90061-8 (1980).
73.Mitzdorf, U. 电流源密度方法及其在猫大脑皮层中的应用:诱发电位与脑电现象研究。生理学评论 65(1), 37–100. https:// doi.org/ 10. 1152/ physr ev. 1985. 65.1. 37 (1985). - Stark, E. & Abeles, M. 基于多单元活动的运动预测。神经科学杂志 27(31), 8387–8394. https:// doi. org/ 10. 1523/ JNEUR OSCI. 1321- 07. 2007 (2007).
- Trautmann, E. M. 等。无需锋电位分类的神经群体动态精准估计。神经元 103(2), 292–308. https:// doi. org/ 10. 1016/j. neuron. 2019. 05. 003 (2019).
- Buzsáki, G. & Mizuseki, K. 对数动态大脑:偏态分布如何影响网络运作。自然综述·神经科学 15(4), 264–278. https:// doi. org/ 10. 1038/ nrn36 87 (2014).
- Song, S., Sjöström, P. J., Reigl, M., Nelson, S. & Chklovskii, D. B. 局部皮层环路中突触连接的高度非随机特征。PLOS生物学 3, e68. https:// doi. org/ 10. 1371/ journ al. pbio. 00300 68 (2005).
- 夏勇。第十一章 健康与疾病中多组学整合的微生物组关联分析研究,见《分子生物学与转化科学进展》第171卷,孙健主编,《健康与疾病中的微生物组》第171卷,学术出版社,第309–491页。(2020). https:// doi. org/ 10. 1016/ bs. pmbts. 2020. 04. 003
- Chapin, J. K. & Nicolelis, M. A. L. 神经元群体活动的主成分分析揭示多维体感表征。神经科学方法 94(1), 121–140. https:// doi. org/ 10. 1016/ S0165- 0270(99) 00130-2 (1999).