¶ MAPK/ERK和BMP信号的双重抑制诱导小鼠ESC来源的大脑皮层祖细胞获得内嗅样特性
法布里齐奥·托内利、1 卢多维科·伊安内洛、2 斯特凡诺·古斯廷西奇、3 安杰洛·迪加尔博、2,4 卢卡·潘多尔菲尼、 以及费代里科·克雷米西1,2,5,6,*
1比萨高等师范学院生物学实验室,意大利比萨 56126
2国家研究委员会生物物理研究所,意大利比萨 56124
3意大利技术研究院人类技术中心核心RNA实验室,意大利热那亚 16152
4比萨大学物理系,意大利比萨 56127
5这些作者对研究贡献均等
6通讯作者 *联系人:luca.pandolfini@iit.it (L.P.), federico.cremisi@sns.it (F.C.) https://doi.org/10.1016/j.stemcr.2024.12.002
¶ 摘要
决定不同胚胎大脑皮层特性的机制仍不明确。Wnt信号在引导背侧端脑前体细胞分化为同形皮质或海马中的核心作用已被阐明。本研究显示在神经化小鼠胚胎干细胞中适时抑制MAPK/ERK和BMP信号通路,可定向诱导出异质皮质特征的细胞身份。通过对比MAPK/ERK与BMP抑制生成的神经细胞(MiBi细胞)与早期产后脑区细胞的全局基因表达谱,发现MiBi细胞具有不同于同形皮质和海马细胞的大脑皮层特性。这些细胞展现出独特的基因表达模式和连接特性,并具备内嗅皮质的分子特征与电生理特性。我们的研究结果表明,细胞信号通路的早期改变能够定向决定特定的大脑皮层命运,这种命运由特定神经元谱系维持且不受后续胚胎形态发生相互作用的影响,并最终决定其功能连接模式。
¶ 引言
小鼠胚胎干细胞(mESCs)和人诱导多能干细胞(hiPSCs)的神经化研究,对于阐明皮质细胞特异性分化的普遍机制具有重要作用(Kelava and Lancaster, 2016; Qian et al., 2020)。然而,解析不同大脑皮层区域身份精确特化的机制仍然是一个挑战。
构成人类皮层90%和10%的主要脑区分别为六层同皮质(IsC)与异皮质(Creutzfeldt, 1995),后者可根据细胞构筑、功能和进化分类进一步划分为不同区域(Zilles, 2004)。通过神经化小鼠胚胎干细胞(mESCs)和人诱导多能干细胞(hiPSCs),我们解析了细胞外信号对背侧端脑前体细胞定向分化及模式形成的影响。在对应于同皮质前后轴特化的体内关键时间窗内激活MAPK/ERK信号通路,能够诱导mESCs和hiPSCs来源的神经祖细胞(NPCs)表达皮质区域化的喙侧标记物(Imaizumi等,2018;Terrigno等,2018a)。Wnt信号通路对于引导背侧端脑前体细胞向海马齿状回命运定向分化具有关键作用(Terrigno等,2018b;Yu等,2014)。从hiPSCs分化获得的海马神经祖细胞可在体外分化为CA3神经元(Sarkar等人,2018),或作为祖细胞维持在含有Wnt信号和层粘连蛋白511的体外海马干细胞生态位中(Dunville等人,2022)。然而,尽管同脑皮层和海马体模式形成已被广泛研究,但关于最终使大脑作为整体运作的不同大脑皮层身份的发展和获取,我们知之甚少。在此,我们表明:(1)在狭窄时间窗口内同时抑制MAPK/ERK和BMP信号足以指定类似于内嗅皮层(EnC)的异源皮层身份;(2)这种命运在体外维持直至电活性神经元完全成熟。令人惊讶的是,双MAPK/ERK和BMP抑制细胞在贴壁培养中展现出全局基因表达谱、连接性和电活动模式,这些特征不同于具有海马和皮层身份的细胞,而更接近于内嗅皮层细胞。总体而言,我们的研究结果表明,在发育后期阶段获得不同的大脑皮层命运和连接模式,可能由早期皮层模式形成过程中的通路活动指定和调控,并且似乎基本不受后续与其他细胞类型相互作用的影响。最后,我们证明了同型神经元培养物会随时间发展出独特的网络电生理活动,但当不同神经元回路在体外组装时,这些活动模式的 repertoire 可以被修改和扩展。
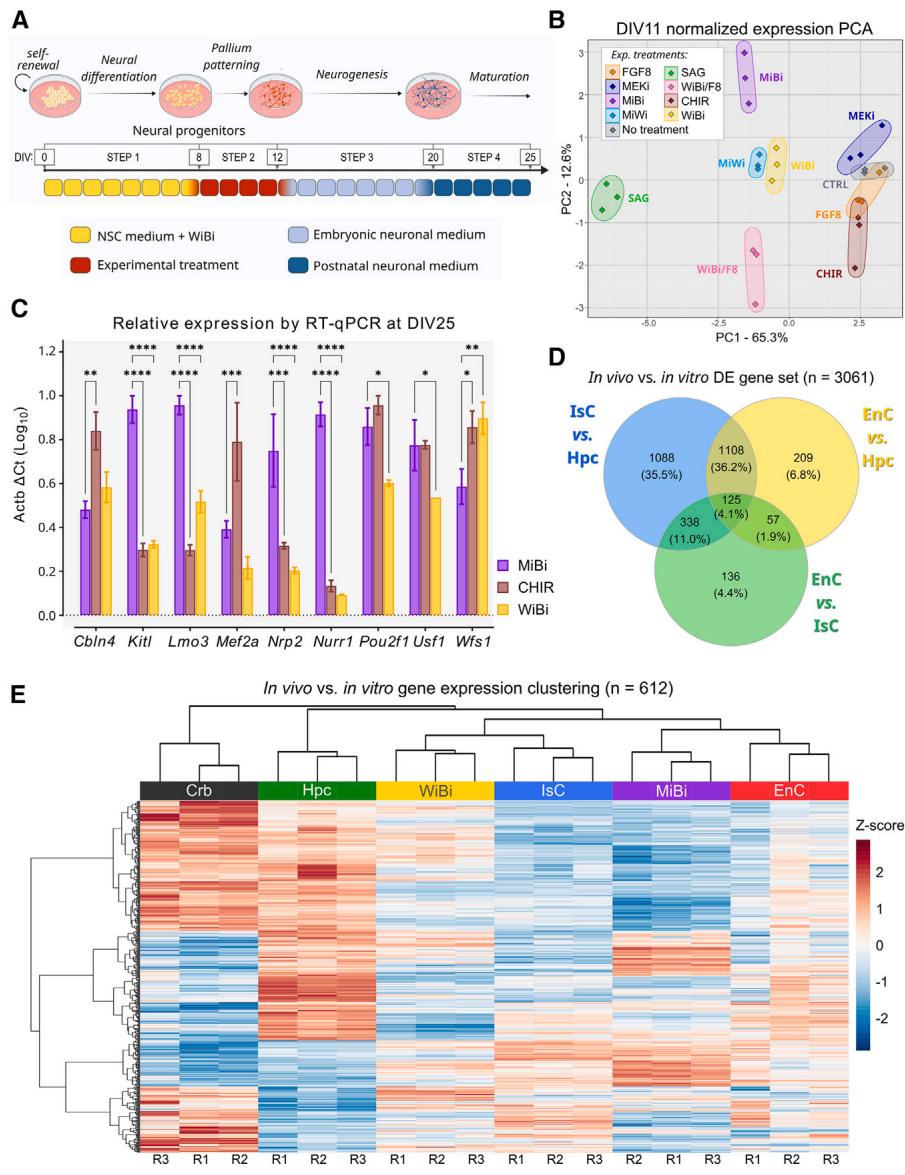
图1. MAPK/ERK与BMP信号传导的抑制作用可诱导不同于同型皮质和海马特性的皮层特性
(A) mESC分化方案。分化培养基包含(B)中列出的不同处理组合(参见文本对缩略语的解释和方法部分对组成的描述)。NSC,神经干细胞。
(B) 对DIV11时期不同培养体系中12种早期大脑皮层及皮层外标志物表达水平进行定量逆转录PCR(RT-qPCR)分析的主成分分析(参见表S1;图S1A; 次独立实验)。图中展示的PC1和PC2以其方差贡献率标注,分别模拟大脑的背腹轴(从右至左)和头尾轴(从下至上)空间分布。
© DIV25 培养物中分配皮层和内侧标志物的 RT-qPCR 分析(n = 3 个独立实验)。显示的是平均值 ± SEM;仅显示了与 MiBi 的比较;双向方差分析,邓尼特多重比较检验;*p 值 < 0.05,**p 值 < 0.01,***p 值 < 0.001,****p 值 < 0.0001。
(D) 用于“体内与体外”分析的内嗅皮层(EnC)、海马体(Hpc)和同皮层(IsC)之间差异表达基因的维恩图。
(E) 基于主成分分析(图S1G)中第二和第三主成分的样本层级聚类与基因表达水平热图。R1、R2和R3表示重复样本。热图色阶显示标准化Z值基因表达水平。
¶ 结果
及时抑制MAPK/ERK和BMP信号通路可诱导产生异源皮质的典型基因表达谱我们通过从体外培养第0天至第7天(图1A)抑制Wnt/BMP信号通路(使用53AH和LDN193189:WiBi方案),诱导小鼠胚胎干细胞发生端脑神经化。至DIV8时,端脑神经前体细胞可通过延长Wnt/BMP抑制或重启Wnt信号(使用CHIR99021:CHIR)分别进一步分化为新皮层或海马特异性细胞(Terrigno等,2018b)。在早期发育过程中,关键信号通路的激活/抑制会建立形态发生素梯度,从而沿胚胎轴线(头-尾、背-腹和内侧-外侧轴)塑造大脑分区模式(Puelles等,2019)。特别值得注意的是,成纤维细胞生长因子(FGF)信号通路通过拮抗尾部模式转录因子COUP-TF1(Nr2f1)的表达,在前脑皮层的额尾模式形成中起关键作用——该转录因子在皮质发生早期过表达时能特异性诱导内嗅皮质特征的形成(Feng et al., 2021)。为鉴定尾部异型皮质特征形成的分子决定因素,我们研究了MAPK/ERK(MEK)信号抑制的效应:该通路通过抑制额部标志物表达并维持COUP-TF1在前脑皮层的表达,从而拮抗FGF信号(Terrigno et al., 2018a)。我们在DIV8至DIV11的时间窗口内,将MEK抑制效应与操控其他信号通路(Wnt、BMP、Shh和FGF)的效应进行对比,并在DIV11这一体外时间点检测了前脑早期标志物的表达。
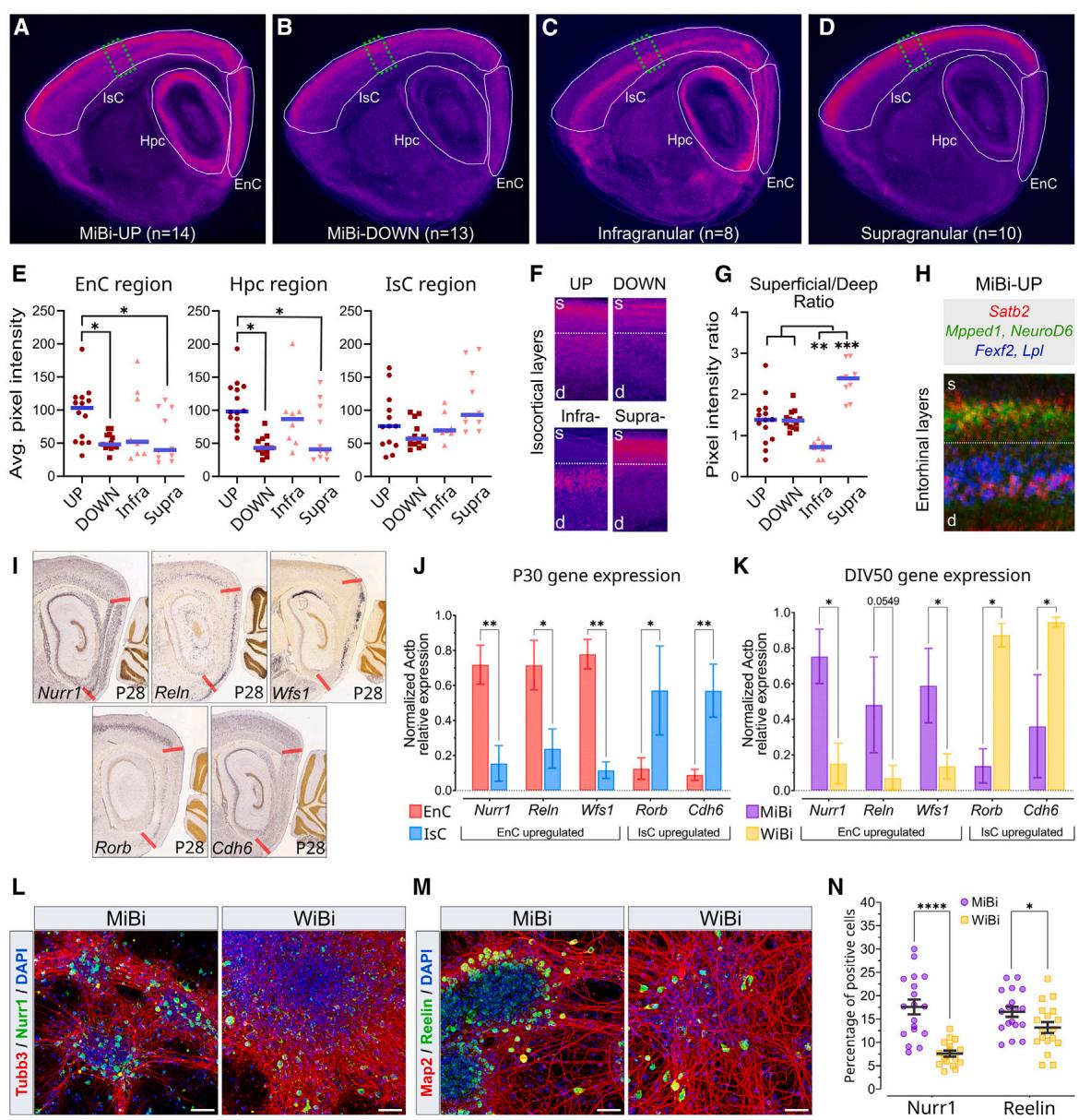
图2.MiBi神经元表达内嗅皮层身份的标记物
(A-D)P4 小鼠矢状脑切片的虚拟原位杂交(ISH)。MiBi与WiBi细胞中DE基因的累积表达水平(A和B)以及颅下和颅上神经元的标记物(C和D)在IsC、Hpc和EnC中显示出不同的表达模式(n = 基因数)。
(E)单个ISH图像信号的量化分析,叠加显示于(A-D)图中。符号代表单个ISH图像的像素强度值,条形图表示平均值;采用克鲁斯卡尔-沃利斯检验,*p值 。
(F)(A–D)中皮质区域绿色虚线区域的放大图,显示MiBi与WiBi细胞中DE基因的浅层(s)和深层(d)表达(UP, DOWN)以及颗粒下层和颗粒上层之间(Infra-, Supra-)的表达。
(G)对(F)中叠加的各张ISH图像信号进行量化。符号表示每张ISH图像表层与深层表达的像素强度值比率,条形表示平均值;
Kruskal-Wallis检验, , 。(H) MiBi与WiBi上调基因在EnC层中具有特异性表达模式的ISH叠加图谱。
(I)来自艾伦脑图谱的P28小鼠脑切片的ISH图像,显示了内嗅区标记物(Nurr1、Reln和Wfs1)及同型皮质标记物(Rorb和Cdh6)的表达模式。粗红线标示出内嗅皮层边界。
(J和K)体内或体外对(I)中所示标记物进行的RT-qPCR分析(体内比较:脑区样本取自 只小鼠;体外比较: 次独立实验)。两组比较数据均以均值 标准误表示;采用双向方差分析,并经由Benjamini、Krieger和Yekutieli两步线性逐步上升程序进行多重检验校正。除特别说明外, 值 ,**p值 。
与胚胎中期阶段相当(Terrigno等,2018a)。对早期胚胎皮层区域差异表达的12种标志物表达水平进行主成分分析(表S1)显示,仅有4种处理方案能产生与同皮质(WiBi)和海马(CHIR)培养体系分子特征迥异的细胞:Shh激活(SAG)、WiBi联合FGF8激活(WiBi/F8)、MEK/Wnt抑制(MiWi)以及MEK/BMP抑制(MiBi;图1B与S1A)。具体而言,主成分分析通过模拟胚胎大脑发育轴的取向对培养体系进行区分。贡献主要方差(65.3%)的第一主成分(PC1)将Shh通路激活(SAG,图1B左)及腹侧皮层特征基因(Dlx2、CoupTFI与Lmo3)表达的培养体系,与表达海马和同皮质标志物(图1B右)如Emx2、Pax6、Lhx2和Foxg1的培养体系区分开来(图S1A)。相反,贡献12.6%方差的第二主成分(PC2)则显示出区分皮层头尾轴向特征的能力,表现为FGF通路抑制或激活的培养体系(分别为图1B上下半区)在空间分布上形成隔离。这些发现与SAG和WiBi/F8处理分别定向诱导皮层下结构与前部同皮质神经元的研究一致(Cederquist等,2019;Imaizumi等,2018;Kim等,2014;Terrigno等,2018a)。此外,MiWi细胞的分子特征在PCA中与WiBi细胞高度相似。因此我们聚焦于MiBi处理——该方案能在神经前体细胞中诱导更显著的尾侧皮层细胞特征(图1B与S1A)。该发现与研究表明FGF信号激活拮抗早期尾侧皮层发育转录机制的观点相符(Borello等,2008;Faedo等,2008;Feng等,2021)。基于MiBi细胞的尾侧皮层特征,我们在体外分化后期(DIV25)分析了更分化阶段异源皮层和内嗅皮层神经元的特定标志物表达(Abella´ n等,2014;Feng等,2021;Puelles等,2019;Ramsden等,2015)。与CHIR相比,MiBi处理显著富集了这些基因(Kitl、Lmo3、Nrp2和Nr4a2),相较于WiBi则呈现更广泛的富集(Kitl、Lmo3、Nrp2、Nr4a2、Pou2f1和Usf1;图1C)。这些结果表明MiBi细胞不同于WiBi与CHIR细胞,且提示其与CHIR细胞共享异源皮层特征。
为了更好地研究MiBi培养物的皮层身份,我们比较了DIV25 WiBi和MiBi细胞与来自出生后第5天(P5)小鼠的IsC、海马(Hpc)、小脑和EnC,一个发育上可比的时间点如建议根据先前观察结果(Gaspard等人,2008)的建议,P5 EnC和IsC表现出最低程度的全局基因表达差异(n= 656个差异表达[DE]基因,占总基因数的4.4%),其次是EnC与Hpc的比较(n= 1,499个DE基因,占总基因数的10.1%,图S1B)。正如最近一项研究(Franjic等人,2020)所指出的,这些发现可能源于EnC和IsC层状结构的相似性——EnC层中充分体现了深层层状皮质兴奋性神经元,以及海马亚区域内观察到的显著异质性。我们选择了三个皮质区域(IsC、Hpc和EnC,n= 3061)中的DE基因,以降低转录组数据的复杂性,并分析主成分分析(PCA)中体现体外和体内样本位置细胞身份的成分(图1D和S1C-S1E;参见方法)。第一和第二主成分(PC1和2)区分了体内和体外样本(图S1F),而占总方差36.1%的第二和第三成分(PC2和3)则区分了不同培养条件和脑区域的表达谱(图S1G)。对构成PC2和3大部分方差的基因进行层次聚类(参见方法)揭示了3个基因簇的存在(图S1H),这些基因簇参与调控不同的生物过程(图S1I)。该基因集突出了MiBi与EnC样本之间的显著相似性,而这两者与WiBi和IsC存在差异(图1E)。综上所述,这些观察结果表明MiBi细胞具有与EnC相似的皮质身份。
¶ MiBi细胞表现出与内嗅样特征相似的分子特征和轴突生成程序
为深入研究MiBi细胞的性质,我们在体外神经元分化后期(DIV50)分析了内嗅皮层(EnC)和岛叶皮层(IsC)标志物的表达,并将其表达水平与P30大脑区域进行对比。研究发现,真正的EnC标志物(Nurr1和Wls1)与IsC标志物(Rorb和Cdh6;图2I、2J)分别在MiBi和WiBi细胞中表达上调(图2K、2L、2N)。此外,啮齿类动物EnC第二层的特征在于存在兴奋性锥体神经元与大型多极神经元的混合群落,后者分别在内侧和外侧EnC中被称为星形细胞(SCs)或扇形细胞(FCs)(Witter等,2017)。与WiBi培养组相比,EnC星形细胞/扇形细胞标志物Reelin在MiBi细胞中的表达比例更高(图2M、2N),这支持了MiBi培养组具有增强型内嗅皮层特性的观点。我们随后通过星形细胞特异性报告基因检测了MiBi处理能否激活星形细胞分化程序,并构建了慢病毒采用Teneurin-3(Tenm3)基因的SC特异性增强子MEC-13-53A构建的GFP报告系统(图S2G;Nair等人,2020),该基因编码一种参与内嗅-海马环路形成的跨突触跨膜蛋白(Berns等人,2018)。与其他大脑皮层及皮层外培养物相比,转导的MiBi培养物显示表达GFP报告基因的细胞比例显著更高(图S2H和S2I)。这一观察结果与MiBi培养物中表达Reelin蛋白的细胞比例较高相一致(图2M和2N),表明MiBi处理可能支持SCs的分化过程。
为了理解MiBi细胞和EnC细胞特化过程中涉及的机制,我们分析了来自体外(MiBi vs WiBi)和体内(EnC vs IsC)比较的差异表达基因集的生物过程基因本体(GO)。在体外和体内上调的基因共享了20个最富集GO术语中的9个,而下调基因之间未发现共同术语(图S3A和S3B)。我们将属于共同上调GO术语的基因汇集到一个独特数据集中(表S3),并基于生物过程的基因重叠生成配对相似性矩阵,以此构建网络图。最终得到的MiBi/EnC共同术语富集图谱(图3A)显示出4个聚集相似过程的簇。随后我们重点关注三个最富集的术语:轴突发生、细胞投射组织正向调控以及膜电位调控。描绘这三个术语内基因连接关系的基因-概念网络显示,其中84.4 的基因同时也是MiBi上调基因(图3B中黄点对应灰点;基因总数 ;表S4)。这些发现表明MiBi细胞与EnC共享独特的基因表达谱,该表达谱特异性地与神经元连接调控相关。总体而言,我们的数据表明MiBi处理能够在体外生成与真实EnC神经元相似的神经元培养物。
¶ MiBi和WiBi神经元表现出不同的连接模式
内嗅皮层(EnC)和海马(Hpc)能够形成独特的神经环路连接性,这种连接性反映了高等动物的重要功能,例如记忆引导与目标导向的导航行为(Issa等,2024;Malone等,2024;Nilssen等,2019)。我们尝试探究在体外培养体系中能否观察到细胞连接性的差异。通过CHIR、WiBi和MiBi方法培养的贴壁细胞在体外培养第30天(DIV30)形成了具有PSD95阳性树突棘的成熟突触连接,且三种培养体系中的树突棘密度相当(图S4)。

图3. MiBi神经元与EnC神经元共享参与轴突发生和细胞身份识别的基因激活(A)MiBi与EnC共同上调GO术语的富集图谱(参见图S3A)。对MiBi vs. WiBi和EnC vs. IsC共有的术语进行了分析方法所述的比较(参见方法部分)。点大小表示属于该本体的基因数量,色标则显示错误发现率值。链接的粗细程度反映术语间的相似度(灰色线条表示)。基于相似性归类的GO术语簇以颜色编码区分。(B)从(A)中提取三个最富集术语的基因概念网络(彩色箭头标示)。黄点表示MiBi上调基因,灰点表示非差异表达基因。分类项目采用颜色编码,其点大小对应属于该本体的基因数量。
为了比较MiBi和WiBi神经元的连接性,我们测试了它们产生长程投射和形成异型连接的能力。为此,我们开发了一种体外连接性实验,其中使用十字形4孔培养插件(见方法部分)将贴壁培养物接种在玻璃底培养皿上,间距500微米,并测量了病毒标记的MiBi和WiBi神经元向周围未标记的WiBi或CHIR培养物发出突触的能力(图4A–4E和S5)。共培养10天后,携带mCherry标签的WiBi细胞突触有效跨越500微米间隙,抵达未标记的WiBi与CHIR培养物(图4B插图D1和D2)。但多数抵达CHIR细胞的WiBi突触易发生弯曲,未能与培养体系建立深层连接(图4B插图D2箭头所示),这与侵入同型培养物的突触形成鲜明对比(图4B插图D1)。相反,带有EGFP标签的MiBi细胞突触能以相当效率成功侵入未标记的WiBi与CHIR培养物(图4C插图D3和D4)。我们分别量化了在CHIR和WiBi未标记培养体系中,由病毒标记的WiBi或MiBi细胞产生的纤维分支总数、长度、平均分支数量及弯曲度(图4E–4I、S5B和S5C)。该分析在未标记培养物的特定区域进行,这些区域与标记培养物相对,且远离所有培养物纤维汇集的中心区(图S5A–S5C;见方法)。WiBi培养体系中WiBi与MiBi神经元的总分支长度相当,而CHIR培养体系内WiBi神经元的总分支长度则显著缩短。
显著低于MiBi细胞(图4F),证实了WiBi和MiBi轴突对CHIR培养物的不同亲和力。在比较中,CHIR内的WiBi突起还显示出最低的分支数量,而令人惊讶的是,WiBi培养物内的MiBi突起显示出最高的分支数量(图4G)。然而,后一观察结果与WiBi纤维的平均分支长度和曲折指数一致,表明它们优先在WiBi培养物中比MiBi突起更直接地导航,避开CHIR细胞(图4H和4I)。相反,MiBi突起在CHIR或WiBi培养物中的平均分支长度和曲折指数没有显著差异,表明MiBi和WiBi神经元在轴突路径寻找上存在明显差异(图4H和4I)。基于GO分析,MiBi培养物中涉及轴突生成和细胞突起的基因富集表明,与WiBi神经元相比,MiBi神经元表现出更强劲的轴突生长,这可能有助于在CHIR培养物中产生更深的投射。为了验证这一假设,我们检测了标记神经元突起在未标记海马培养物与未标记同脑皮层培养物中的密度归一化比率,分别对MiBi和WiBi培养物进行了计算。该值不受纤维绝对轴突生长速率的影响,并指示突起在两种培养物之一中延伸的倾向。该分析显示,在CHIR培养体系中,MiBi细胞突起显著长于WiBi细胞突起(图S5D和S5E),但不同培养体系间细长突起的相对比例未见明显差异(图S5F)。因此,这些结果证实:MiBi与WiBi培养体系间观察到的细胞连接性差异,主要源于调节不同轴突亲和性的特定分子特性存在,而非两类细胞轴突生长速率的差异。
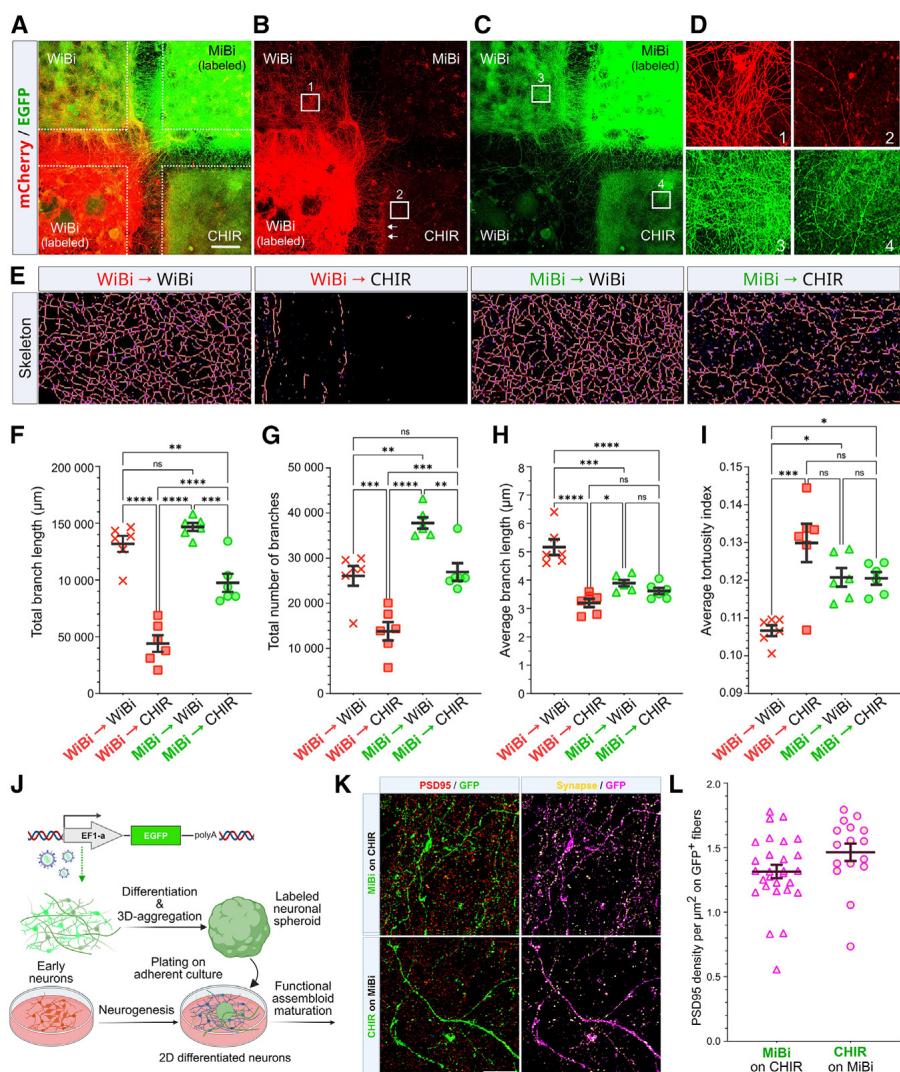
图4. 体外培养的连接性
(A–D) 连通性检测。
(A) DIV30培养物的代表性图像,分别用EGFP(MiBi,右上)或mCherry(WiBi,左下)慢病毒载体标记,并与未标记的CHIR(右下)及WiBi(左上)培养物在DIV18时共同接种于四分区培养插片中(参见方法;比例尺:500毫米)。
(B和C) 与(A)中相同,突显WiBi (B) 或 MiBi © 纤维连接性的贡献。
(D) (B) 和 (D) 中标号区域的放大展示。(E) 用于 EGFP 与 mCherry 纤维定量及模式分析的典型区域放大图(参见方法部分)。经分割处理的细胞突起骨架经伪彩色标记,用以突显网络分支结构。
(F–I) 连通性与纤维参数量化。测量值为图S4所示区域平均值( 次独立实验)。各图表中数据表示为均值 标准误;采用单因素方差分析及Tukey多重比较检验; 值 , 值 , *p值 , 值 ;ns表示无显著性差异。
(J) 功能性组装体示意图,其中绿色纤维连接至底层贴壁培养层。该功能性组装体由表达EGFP慢病毒的DIV18细胞团(球状体)聚集而成,并接种于同年龄贴壁培养层上(详见方法部分)。
(K) 贴壁培养中球状纤维的GFP与PSD95染色放大图像。通过筛选PSD95与GFP双阳性像素点(黄色)并与GFP信号(洋红色)叠加,实现球状纤维突触的可视化(详见方法;标尺:25毫米)。(L) 采用(K)中相同的阳性像素点标准进行突触定量分析。突触数量以被突触覆盖的GFP阳性区域密度作为衡量指标。MiBi/CHIR与CHIR/MiBi FA两组图像在突触密度方面未显示统计学差异( 次独立实验;双尾t检验,p值=0.0879)。
在证实MiBi神经元突起能够在贴壁培养中探索并接触CHIR细胞后,我们进一步研究这种能力是否也能通过细胞聚集体(球状体)得以维持。研究发现,当培养20天的神经元球状体将病毒标记的MiBi球体接种在贴壁的CHIR培养物上(MiBi/CHIR),或反向操作(CHIR/MiBi),并统计与球体延伸的荧光突起接触的PSD95阳性树突棘数量(图4K)。在MiBi/CHIR和CHIR/MiBI的FA中,球体纤维均与多个PSD95阳性斑点存在关联,两者间的连接程度无显著差异(图4L)。
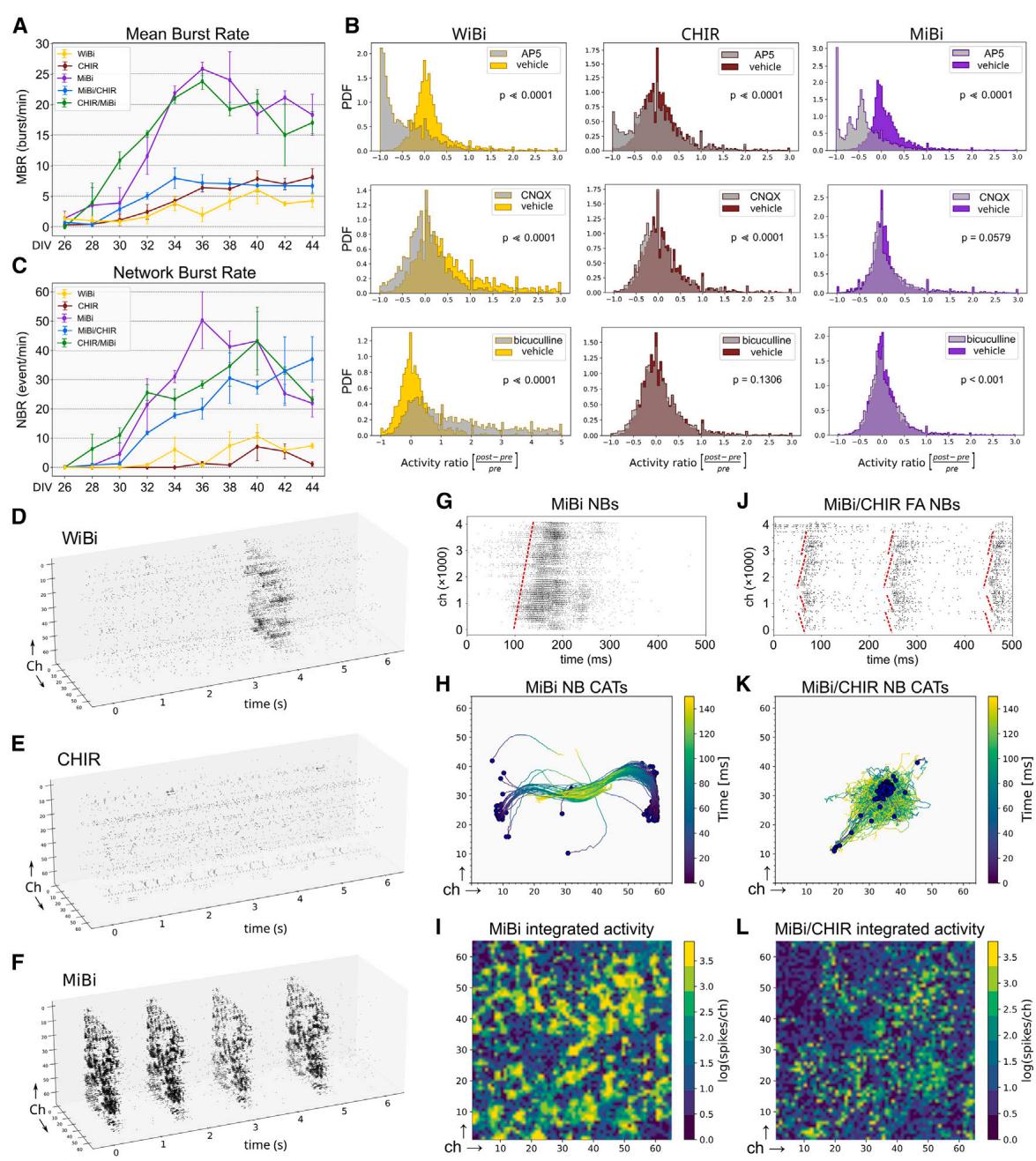
图5. 体外培养的电生理及网络活动
(A) 单通道中MBR的时间趋势(均值 标准误)。
(B) DIV44时给药前后各通道活性变化的概率分布。彩色分布表示考虑自发性活动不同时间段的基线活性(无药物)变化。灰色分布表示给药后的活性变化。采用非参数曼-惠特尼U检验判定基线分布与给药后分布间的统计学显著差异。p值 视为具有显著性。PDF为概率密度函数。
© 所有培养体系中NBR的时间趋势(均值 标准误)。(A)、(B)和©中数据代表2次独立实验。(D–F) 纯培养条件下短时间窗口的三维光栅图重建,保留通道空间位置。(G和J) MiBi与MiBi/CHIR FA的代表性二维光栅图,显示NB在芯片上传播的时间延迟(红色虚线标注)。
¶ WiBi、CHIR 和 MiBi 神经元培养发展出不同的网络活动模式
在贴壁培养条件下,原代皮层神经元会生成表现出复杂 模式的神经网络活动(Charlesworth等人,2015;Dias等人,2021)。然而,与培养神经元特性相关的活动模式差异尚未得到充分研究。通过使用具有4,096个通道的高密度微电极阵列(HD-MEA),我们能够纵向比较纯培养物和FAs的多个活动参数(视频S1和S2)。我们重点评估了单通道平均放电率(MFR)、神经元峰电位的平均爆发持续时间(MBD)与平均爆发频率(MBR),以及网络爆发率(NBR)、网络爆发(NBs)的活动轨迹中心(CATs)和功能连接性。

视频下载地址:1.mp4
.gif)
视频下载地址:2.mp4
对每个活性通道记录到的不同尖峰波形进行聚类分析表明,所有培养体系均呈现相似的通道内聚类分布,其中 -99%的通道关联着1-4个功能单元(图S6A),这使得单通道分析足以代表极小局部环路的功能特性。在所有培养体系中,平均发放率(MFR)、平均簇发放率(MBR)和平均簇时长(MBD)从最早时间点(DIV26)至最终分析时间点(DIV44)均持续增长,证实了神经网络功能逐步成熟的过程(图5A、S6B、S6C;视频S1)。为探究兴奋性与抑制性输入对观测活动模式的贡献,我们在DIV44培养体系中检测了离子型谷氨酸受体与GABA受体选择性拮抗剂的作用。虽然WiBi和CHIR细胞的MFR对CNQX(AMPA与红藻氨酸盐拮抗剂)及AP5(NMDA拮抗剂)均产生响应,且AP5抑制的通道比例更高,但MiBi细胞的MFR仅被AP5显著影响(图5B)。与之相反,在WiBi(图S6D、S6F)和MiBi(图S6E、S6G)培养体系中,AP5(图S6D、S6E)或CNQX(图S6F、S6G)均能显著降低MBR。值得注意的是,AP5不仅降低了MiBi细胞的MBR,更完全消除了WiBi细胞的簇发放活动(图S6D、S6E),表明NMDA受体在爆发活动生成中起关键作用。此外,AP5对WiBi和MiBi细胞的抑制作用强于CHIR细胞(图5B)。最后,仅WiBi和MiBi培养体系在暴露于荷包牡丹碱(GABA 拮抗剂)后呈现活动强度的显著提升(图5B)。这些结果共同表明,经过20天成熟培养(DIV44)后,三种培养体系的神经活动均由表现NMDA依赖性可塑性的谷氨酸能神经元驱动,且仅WiBi与MiBi培养体系对GABA能抑制具有敏感性。
从第40天开始,神经母细胞在WiBi培养物的整个网络中扩散(参见方法部分;图5C和而在CHIR培养物中则很少观察到(图5C和5E)。有趣的是,MiBi培养体系相较于WiBi培养体系更早(在DIV32时)且更频繁地产生神经球(图5C、5F、S6I和S6K)。为验证MiBi与WiBi培养物中神经球活动起始时间的差异是否与神经元成熟程度有关,我们在长期培养过程(DIV25-50)中监测了Egr1和Fos的表达——这两个参与神经元可塑性的基因被视为功能成熟神经元的重要标志物(Minatohara等人,2016)。Egr1在两组培养物中始终未呈现差异表达,而Fos表达在DIV25至DIV35期间显著波动,直至DIV50时两种细胞类型的表达水平趋于接近(图S6H)。这一发现提示神经元成熟程度可能并非WiBi与MiBi细胞中神经球活动启动的主要影响因素,意味着不同培养体系间网络活动起始时间及模式的差异主要取决于其神经元身份特征。
球状体和贴壁培养物形成突触连接FA的能力(图4K和4L)使我们能够研究一种神经元培养物对另一种神经元活动的影响。为了在体外模拟内嗅皮层与海马之间连接特性的某些特征,我们重点关注FA中CHIR与MiBi神经元之间的连接。与体内观察结果一致——即来自内嗅皮层的传入纤维会影响并引导海马同步活动的建立(Donato等人,2017;Shipkov等人,2024;Valeeva等人,2019),我们观察到MiBi神经元产生高频NB的先天倾向在MiBi/CHIR FA中转移到了CHIR贴壁培养物上(图5C–5G、5J、S6、S6J、S6K和S6L)。相反,在成熟末期(DIV44,图5C),CHIR球状体并未影响CHIR/MiBi FA中MiBi神经元的NB发生率,尽管其NB模式与贴壁培养的CHIR和MiBi神经元不同(图S6J、S6K和S6M;视频S1和S2)。
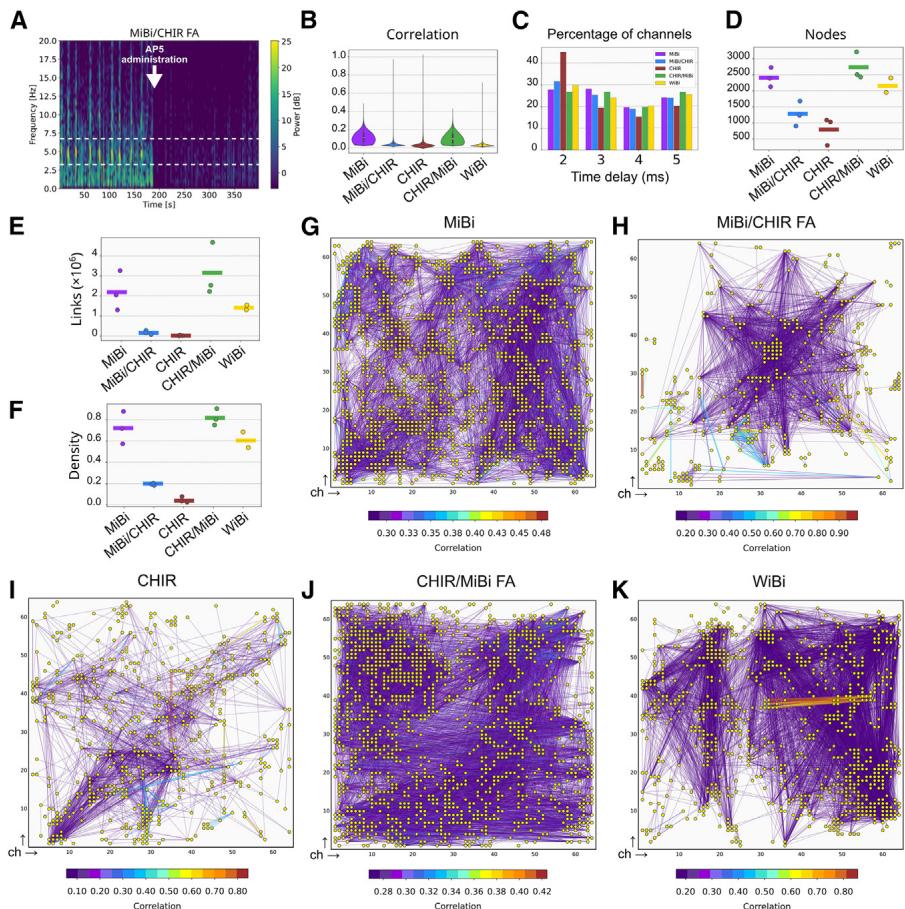
图6. 网络连接性表征
(A) MiBi/CHIR FA培养记录的代表性放电率活动(MFR,时间仓为5毫秒)的频谱图分析,显示NB活动期间强烈的θ波功率。输注NMDA受体拮抗剂AP5(白色箭头)可抑制θ波功率。白色虚线标示出θ振荡的频率范围。
(B) 每种文化的显著相关性小提琴图(见方法)
© 不同一级和二级通道的两个尖峰之间时间延迟的分布,从连通性分析中获得。每个直方图对应于显示特定时间延迟值的通道百分比。
神经元培养物。每个黄点代表一个活跃通道(仅显示相关性最高的 节点);彩色线条表示两点之间的相关性强度。颜色条表示相关性指数。
(D) 不同培养条件下每次重复实验所获连通图的平均节点数。
(E) 每个培养重复的平均链接数(F) 各培养重复的网络密度均值。彩色柱表示同一培养体系不同重复的平均值。在(B)–(F)中,n R 2 次独立实验。
(G–K) 代表性连通性图
为评估信号传播的动态特性,我们对每个神经爆发进行了CAT分析,以确定同步事件的起始点(参见方法部分)。各神经爆发的起始点出现在MiBi与WiBi培养网络的不同区域,CAT在150毫秒内向网络中心移动(图5H、5I和S6N)。事实上,相邻通道间的爆发起始时间似乎以时间增量形式分离神经元培养物。每个黄点代表一个活跃通道(仅显示相关性最高的0.5%节点);彩色线条表示两点之间的相关性强度。颜色条表示相关性指数。
与突触连接顺序一致(芯片上传播时间约数十毫秒;参见图5G raster图中的红色虚线)。这一特征同样存在于CHIR/MiBi和MiBi/CHIR功能单元中,尽管在后一种情况下CHIR神经元的活动是由MiBi球体传入驱动的(图5J和S6O)。相应地,在MiBi/CHIR功能单元中,活动中心集中在MiBi球体与CHIR培养物的接触界面附近(图5K),但网络爆发也覆盖了高密度微电极阵列外围的通道(图5J和5L)。因此我们得出结论:球体下方的CHIR神经元是MiBi/CHIR功能单元中记录到的大部分网络爆发活动的来源。值得注意的是,MiBi/CHIR功能单元表现出与MiBi细胞完全相同的网络爆发活动,而CHIR细胞的网络爆发活动几乎无法检测到(图5C–5E、5F和S6J–S6L)。此外,MiBi/CHIR功能单元在爆发波(网络爆发多于MiBi网络爆发)与静默波之间交替,而MiBi培养物中的网络爆发则具有连续性(图S6K和S6M),这表明存在两种不同的网络活动类型。需特别指出的是,MiBi球体诱导的CHIR神经元活动在3个分析的功能单元中有2个显示出θ节律网络爆发期,峰值频率分别为5.1Hz和5.2Hz(图6A和S6P)。θ节律活动期的持续时间从在NB活动期间持续数秒至数十秒,并且对AP5敏感,后者能完全消除NBs(图6A)。与MiBi/CHIR FAs相反,单独培养的CHIR细胞在其放电活动中未表现出θ频率振荡(图S6Q)。有趣的是,海马CA1区的θ活动在体内和培养脑切片中均可通过内嗅区主要兴奋性输入经由穿通通路/颞叶氨能通路(PP/TA)被诱导,且通过EnC的AP5灌流可抑制该活动,这凸显了内嗅区NMDA受体在海马神经元θ节律生成中的重要性(Gu and Yakel, 2017; Gu et al., 2017)。此外,在HpC中灌流AP5效果不显著,并且在我们的研究中,AP5对CHIR神经元的影响程度小于对MiBi神经元的影响(图5B)。基于这些观察,我们推测MiBi纤维的活动可能在诱导θ节律方面发挥着类似于内嗅区PP/TA通路的作用,且MiBi/CHIR FAs可能体外模拟了EnCHpC连接的部分功能特征。
最后,我们通过分析DIV44时通道脉冲瞬间的相关性来评估网络连接性,并考虑了事件周围2-5毫秒的时间窗口,这是一级和二级突触延迟的估计值。连接性(图6B;Sabatini和Regehr,1999)。基于打乱脉冲序列相关性的分布设定相关性阈值(见方法)后,我们评估了不同培养体系通道的网络活动连接性。由此得到的时间延迟分布证实了一级和二级连接性的存在(图6C)。我们发现节点数、连接数和图形密度的平均值存在差异(图6D–6F),这表明网络复杂性具有不同的模式(图6G–6K)。具体而言,MiBi和CHIR网络(图6G和6I)分别显示出最高和最低的节点数、连接数及密度值(图6D–6F),而WiBi网络(图6K)呈现中间值。MiBi/CHIR与CHIR/MiBI荧光检测体系(图6H和6J)在节点数、连接数和图形密度方面与其对应的单一培养体系(分别为CHIR和MiBi)高度相似。虽然MiBi/CHIR荧光检测体系相比CHIR培养体系显示出略高的网络密度和节点数(图6D–6F、6H和6I),但这些数值远低于MiBi培养体系。总体而言,我们得出结论:神经元局部网络连接性是由发育程序内在驱动的,该程序通过Wnt、BMP和MEK信号通路促使细胞定向分化为不同位置命运。不同网络间的进一步相互作用最终会优化其固有的活动模式。
¶ 讨论
在特定时间窗口内同时抑制MAPK/ERK和BMP信号通路(MiBi),可诱导mESC来源的NPCs分化轨迹产生稳定改变。MiBi细胞表达背侧前脑标记物,其细胞类型不同于海马体和同型皮质细胞。以下三项观察结果支持MiBi细胞具有内嗅皮质样特性的假说:(1)MiBi上调基因在内嗅皮质中的优先表达;(2)MiBi细胞激活Tenm3启动子的能力(该启动子在内嗅皮质SCs中尤为活跃,Nair等人,2020);(3)MiBi细胞整体基因表达谱与出生后早期内嗅皮质细胞的高度相似性。
MiBi神经元的突起可同时接触同型皮层(WiBi)与海马体(CHIR)培养组织,而同型皮层神经元则明显更倾向于连接同源培养组织而非海马培养组织。这一特性令人联想到体内内嗅皮层的连接模式——该结构作为信息中转站,负责同型皮层与海马体之间的双向信号传递(Nilssen等,2019;Witter等,2017)。
出乎意料的是,采用WiBi、CHIR和MiBi方案的贴壁培养物形成了不同的电活动模式。其中MiBi神经元的自发活动尤为显著,其NBR值 远高于WiBi,表明它们在神经元网络的从头形成和塑造中发挥作用。发育过程中内侧内嗅皮层浅层的神经元通过特定神经元类型的作用以及内在的持续性爆发活动,参与内嗅-海马回路的神经元及网络成熟过程(Donato等人,2017;Griguoli与Cherubini,2017;Sheroziya等人,2009)。
有趣的是,MiBi与高密度微电极阵列上的CHIR神经元之间的相互作用影响了CHIR网络的活动,表明MiBi/CHIR功能性组装体在体外形成功能性连接的能力。值得注意的是,MiBi球体诱导的CHIR网络活动变化,让人联想到出生后早期内嗅皮层与海马活动的同步化现象(Shipkov等,2024;Valeeva等,2019),这表明由内嗅皮层神经元主导的内源性活动模式可能调控此类同步化过程(Gu等,2017;Leprince等,2023)。然而,这些差异不太可能由CHIR网络的细胞密度变化驱动,因为在功能性组装体中,MiBi球体对CHIR网络细胞密度的影响远小于对MiBi自身的影响。因此我们提出假设:不同类型神经元网络之间的功能性相互作用,能够在不影响局部网络连接的情况下改变各自的自发活动模式。
总的来说,我们的研究结果表明,早期神经祖细胞中Wnt、BMP和MAPK/ERK信号的适时变化,足以指定不同类型的皮层特性。这些特性在后续形态发生相互作用缺失的情况下仍得以维持,并产生不同的连接模式和电活动模式。
¶ 实验步骤
小鼠胚胎干细胞通过四步法分化为皮质细胞。细胞在含有Wnt/BMP抑制剂(WiBi)的化学限定基础培养基中培养,并重新接种到多聚鸟氨酸/层粘连蛋白包被的表面上。特定皮质亚型通过Wnt激动剂(53AH)与BMP及MEK抑制剂(LDN193189盐酸盐和PD0325901)的组合进行诱导。从第20天体外培养起,神经元使用含BDNF的Neurobasal-A培养基进行条件化培养。
对于连接性检测,神经元被转导了荧光报告基因,接种在预涂硅胶培养板中,并培养10天。神经元球体在低吸附性培养板中形成,随后转移至贴壁培养体系以形成功能性附着,并进行后续培养。
采用高密度CMOS基4096微电极阵列(Accura,3Brain)进行电生理记录,以分析神经元放电、簇状放电及网络同步现象。药物反应和功能连接性通过定制Python代码进行评估。尖峰排序和网络分析主要基于主成分分析与互相关方法。
所有实验步骤的详细描述均可在补充信息的方法部分找到。
¶ 参考文献
阿贝拉´n, A., 德斯菲利斯, E., 和 梅迪纳, L. (2014). Lef1、Lhx2、Lhx5、Lhx9、Lmo3、Lmo4 和 Prox1 的组合表达有助于识别发育中的海马中的可比较细分区域冯杰、许文宏、帕特森、曾俊升、黄星玮、庄宗翰、黄彦棠、费多、鲁宾斯坦、图博尔与周仕政(2021)。COUP-TFI通过界定内嗅皮层内侧特性并诱导差异性细胞粘附,决定其与新皮层边界的完整性。《科学进展》7卷,eabf6808。https://doi.org/10.1126/sciadv.abf6808。
Franjic, D.、Choi, J.、Skarica, M.、Xu, C.、Li, Q.、Ma, S.、Tebbenkamp, A.T.N.、Santpere, G.、Arellano, J.I.、Gudelj, I.等人(2020)。成人海马与内嗅皮层细胞的分子多样性。bioRxiv预印本。https://doi.org/10.1101/2019.12.31.889139。
加斯帕尔,N.,布谢,T.,霍雷兹,R.,迪米德施泰因,J.,纳埃热,G.,范登阿梅勒,J.,埃斯普尼-卡马乔,I.,埃尔波埃尔,A.,帕桑特,L.,希夫曼,S.N.等(2008)。胚胎干细胞皮质发生的固有机制。《自然》455,351–357。https:// doi.org/10.1038/nature07287。
Griguoli, M., 与 Cherubini, E. (2017). 海马早期相关网络活动:其在塑造中的假定作用神经元回路。《细胞神经科学前沿》第11卷,第255页。https://doi.or 10.3389/fncel.2017.00255。
Gu, Z., and Yakel, J.L. (2017). 体外诱导内嗅海马网络中的θ振荡. 脑结构与功能, 222, 943–955. https://doi.org/10.1007/s00429-016-1256-3.
顾志、亚历山大·G.M.、杜德克·S.M.与亚克尔·J.L.(2017)。海马与内嗅皮层分别通过招募胆碱能受体和NMDA受体生成海马theta振荡。《细胞报告》21卷,3585–3595页。https://doi.org/10.1016/j.celrep.2017.11.080。
今泉和幸、藤森健太、石井慎一郎、友章晃、細井義幸、宮島秀樹、割田祥子、青木雅陽、波多野峻、赤松悟、岡野栄之(2018)。FGF8信号传导介导人PSC来源皮层神经元的头尾区域模式形成。《e神经科学》5,ENEURO.0368-17.2018。https://doi.org/10.1523/ENEURO.0368-17.2018。
伊萨、拉德万斯基、宣峰与多姆贝克(2024)的研究表明,外侧内嗅皮层亚群能够表征奖赏相关体验时段。发表于《自然-神经科学》第27卷,第536-546页。详见 https://doi.org/10.1038/s41593-023-01557-4。
Kelava, I., 与 Lancaster, M.A. (2016). 人类大脑发育的干细胞模型. 细胞 干细胞 18, 736–748. https://doi.org/ 10.1016/j.stem.2016.05.022.
Kim, T.-G., Yao, R., Monnell, T., Cho, J.-H., Vasudevan, A., Koh, A., Pee yush, K.T., Moon, M., Datta, D., Bolshakov, V.Y., et al. (2014). 通过背腹 和头尾调控从人类多能干细胞高效特化中间神经元。干细胞。32, 178 9–1804. https://doi.org/10.1002/stem.1704.
莱普林斯,E.,达德,R.F.,莫尔泰,S.,菲利皮,C.,乔治-库尔兹,M.,布尔布卢,R.,伦克-桑蒂尼,P.-P.,皮卡多,M.A.,博基奥,M.,博德,A.,与科萨特,R.(2023)。出生后早期CA1海马环路的外在调控。《神经元》111, 888–902.e8. https://doi.org/10.1016/j.neuron.2022.12.013.
Lodato, S. 与 Arlotta, P. (2015). 哺乳动物大脑皮层中神经元多样性的 产生. Annu. Rev. Cell Dev. Biol. 31, 699–720. https://doi.org/10.1146/an nurev-cellbio-100814-125353.
Malone, T.J.、田南纬、马越、崔蕾、吕帅、王冠、Nguyen, D.、张凯、Myroshnychenko, M.V.、Tyan, J.等 (2024). 内侧内嗅皮层的一致映射支持空间记忆。自然·通讯 15, 1457. https://doi.org/10.1038/s41467-024-45853-4.
南原 K.、秋吉 M. 与奥野 H.(2016)。即刻早期基因在记忆痕迹相关的突触可塑性及神经元集群中的作用。《分子神经科学前沿》8. https://doi.org/10.3389/fnmol.2015.00078。
Nair, R.R., Blankvoort, S., Lagartos, M.J. 与 Kentros, C. (2020). 增强子 驱动基因表达(EDGE)技术实现神经元亚型特异性病毒载体的构建 。《i科学》23卷, 100888. https://doi.org/10.1016/j.isci.2020.100888.
Nilssen, E.S.、Doan, T.P.、Nigro, M.J.、Ohara, S. 与 Witter, M.P. (2019). 内嗅皮层中的神经元与网络:介导平行皮层通路的内外侧内嗅分区重探. Hippocampus 29, 1238–1254. https:// doi.org/10.1002/hipo.23145.
普埃列斯,L.,阿隆索,A.,加西亚-卡莱罗,E.,和马丁内斯-德拉托雷,M.(2019)。哺乳动物皮质扇区的同心圆拓扑结构及其对模式化研究的意义。《比较神经学杂志》527,1731–1752。https://doi.org/10.1002/cne.24650。
钱 X., 苏 Y., 亚当 C.D., 多伊奇曼 A.U., 帕瑟 S.R., 戈德堡 E.M., 苏 K.,李 S., 卢 L., 雅各布 F., 等. (2020). 切片人脑皮层类器官用于模拟不同皮层层的形成. Cell Stem Cell 26, 766–781.e9. https://doi.org/10.1016/j.stem.2020.02.002.
Ramsden, H.L., 苏¨尔梅利, G., 麦克多纳, S.G., 与诺兰, M.F. (2015). 大规模基因表达解剖学分析揭示内侧内嗅皮层的层状与背腹分子组织结构. PLoS 计算生物学 11, e1004032. https://doi.org/10.1371/journal.pcbi.1004032.
Sabatini, B.L. 与 Regehr, W.G. (1999). 突触传递的时间调控. 生理学年 评 61, 521–542. https://doi. org/10.1146/annurev.physiol.61.1.521.
Sarkar, A., Mei, A., Paquola, A.C.M., Stern, S., Bardy, C., Klug, J.R., Kim, S., Neshat, N., Kim, H.J., Ku, M., 等人 (2018)。高效生成人源多能干细胞衍生的CA3神经元实现海马连接性的体外模拟。细胞·干细胞 22,684–697.e9. https://doi.org/10.1016/j.stem.2018.04.009.
Sheroziya, M.G., Von Bohlen Und Halbach, O., Unsicker, K., 和 Egorov,A.V. (2009). 发育过程中内嗅皮层的自发性爆发活动. 神经科学杂志 29, 12131–12144. https:// doi.org/10.1523/JNEUROSCI.1333-09.2009.
Shipkov, D., Nasretdinov, A., Khazipov, R., and Valeeva, G. (2024). 内侧 内嗅皮层浅层与深层的同步兴奋活动先于新生大鼠海马早期尖波的出 现。Front. Cell. Neurosci. 18, 1403073. https://doi.org/10.3389/fncel.202 4.1403073.
Terrigno, M., Bertacchi, M., Pandolfini, L., Baumgart, M., Calvello, M., C ellerino, A., Studer, M., and Cremisi, F. (2018a). 微小RNA miR-21介导F GF8对皮层COUP-TFI翻译的调控作用。《干细胞报告》11, 756–769. https://doi.org/10.1016/j.stemcr.2018.08.002.
Terrigno, M., Busti, I., Alia, C., Pietrasanta, M., Arisi, I., D’Onofrio, M., C aleo, M., and Cremisi, F. (2018b). 具有海马或皮质特性的小鼠胚胎干细 胞生成的神经元在成年大脑中共移植时投射模式存在显著差异。《干 细胞报告》10, 1016–1029. https://doi.org/10.1016/j.stemcr.2018.01.010.
瓦列娃, G., 亚纳奇科娃, S., 纳斯列特季诺夫, A., 雷奇科娃, V., 马卡罗夫, R., 霍姆斯, G.L., 哈济波夫, R., 伦克-桑蒂尼, P.-P. (2019). 发育期内嗅皮层-海马网络协同活动的涌现. 大脑皮层 29, 906–920. https://doi.org/10.1093/cercor/bhy309.
维特,M.P.,多安,T.P.,雅各布森,B.,尼尔森,E.S.,和小原,S.(2017)。内嗅皮层结构:啮齿类动物内嗅皮层解剖学综述及若干比较注释。《系统神经科学前沿》11, 46. https://doi.org/10.3389/fnsys.2017.00046.
俞德超、乔治·P·迪乔治、姚军、马凯托·M·C、布伦南·K、赖特·R、梅奥·A、麦克亨利·L、利苏克·D、格拉斯米克·J·M等(2014)。利用人多能干细胞构建海马神经发生模型。《干细胞报告》2卷,295–310页。https://doi.org/10.1016/j.stemcr.2014.01.009。
齐勒斯, K. (2004). 人类大脑皮层的结构. 见《人脑神经系统》(爱思唯尔), 第997–1055页.