¶ 在肌张力障碍动物模型中,苍白球脑深部电刺激通过全网络效应使异常的小脑皮层活动恢复正常
原文下载:在肌张力障碍动物模型中,苍白球脑深部电刺激通过全网络效应使异常的小脑皮层活动恢复正常.pdf
Fabiana Santana Kragelund a, Konstantinos Spiliotis b,¹, Marco Heerdegen a, Tina Sellmann a, Henning Bathel c, Anika Lüttig d, Angelika Richter d, Jens Starke b, Rüdiger Köhling a, Denise Franz a,*
a 德国罗斯托克大学医学中心,奥斯卡·兰根多夫生理学研究所
b 德国罗斯托克大学数学研究所
c 德国罗斯托克大学普通电气工程研究所
d 德国莱比锡大学药理学、药学与毒理学研究所
关键词:小脑网络活动 苍白球深部脑刺激 全身性肌张力障碍 高密度微电极阵列 dtsz突变仓鼠 时空分析
¶ 文章信息
¶ 摘要
背景:以内侧苍白球为靶点的脑深部电刺激是治疗药物难治性肌张力障碍的公认疗法。然而,其作用机制尚未被完全阐明。本研究旨在探明,在肌张力障碍动物模型dtsz仓鼠中,苍白球脑深部电刺激如何改变小脑皮层神经元动力学的时空模式。
方法:我们在小脑皮层中使用高密度微电极阵列进行了体外分析。为研究时空模式,我们分析了健康对照仓鼠、肌张力障碍dtsz仓鼠、接受DBS治疗和假DBS治疗的dtsz仓鼠的平均放电频率、峰电位间隔、峰电位振幅和小脑连接性。采用非线性数据驱动方法表征了MEA数据中模式的低维表示。
结果:我们的高密度微电极阵列记录显示,与健康对照组相比,dtsz仓鼠的平均放电频率和峰电位振幅降低。苍白球脑深部电刺激产生了全网络效应,使仓鼠的平均放电频率、峰电位振幅和连接性指标恢复正常,从而抵消了这些电生理异常。此外,网络分析显示神经活动模式被组织成不同的群落,健康组和DBS治疗组的连接性均高于dtsz组。
结论:这些发现表明,苍白球脑深部电刺激通过使小脑皮层内的神经元活动正常化,从而发挥其部分治疗肌张力障碍的疗效。我们在dtsz仓鼠中观察到的平均放电频率和峰电位振幅降低,可能提示神经元纤维和突触可塑性的减少。苍白球脑深部电刺激治疗使小脑皮层活动趋于健康对照组水平,显示了局部刺激所具有的全网络影响力。
¶ 1. 引言
肌张力障碍是一种影响肌肉控制的神经系统疾病,会导致不自主运动和持续性异常姿势(Phukan 等,2011)。其诱发因素多样,包括遗传性、先天性和特发性原因(Németh, 2002; Grütz 和 Klein, 2021)。此外,基底节功能障碍和小脑活动异常是肌张力障碍的潜在病理机制(Pizoli 等,2002)。尽管小脑在运动环路中的作用已知,但肌张力障碍及肌张力障碍性震颤主要与基底节功能异常相关,对小脑参与的关注相对较少(Neymotin 等,2016; Shakkottai 等,2017; Bédard 等,2022; Prudente 等,2014)。
小脑皮层由三层结构组成:包含星状细胞和篮状细胞的分子层,包含浦肯野细胞的浦肯野细胞层,以及包含颗粒细胞、卢加罗细胞和高尔基细胞的颗粒细胞层。小脑接收来自大脑皮层的感觉和运动信息,其输出完全通过浦肯野细胞传递至深部小脑核团,从而调节大脑皮层及全脑的运动功能(Kim 和 Augustine, 2021)。
脑深部电刺激是治疗药物难治性肌张力障碍最有前景的方法,其中内侧苍白球或丘脑底核是最有效的刺激靶点(Honkanen 等,2023; Kosutzka 等,2019; Tambirajoo 等,2020; Hock 等,2022)。尽管DBS能成功缓解症状,但其作用机制仍不明确,且对个体患者的疗效难以预测。丘脑底核-DBS与内侧苍白球-DBS以及毁损疗法效果相当,这表明DBS可能抑制了局部神经元元件(Chiken 和 Nambu, 2016)。多项研究报道,在帕金森病患者中,无论是丘脑底核还是内侧苍白球-DBS,其刺激电极附近的神经元放电率均受到抑制(Franz 等,2023)。另一些研究则支持刺激位点附近神经元元件被激活的观点(Anderson 等,2003; Montgomery, 2006)。然而,在我们最近对肌张力障碍动物模型的研究中,发现了激活和抑制并存的现象,这与在患者中的发现一致(Franz 等,2023; Perl 等,2022)。这凸显了DBS作用机制的复杂性。
脑深部电刺激的效应远不止于局部刺激。正电子发射断层成像研究显示,在帕金森病患者中,STN-DBS和GPi-DBS分别能够增强小脑和前额叶/前运动皮层的神经元活动,并改善序列学习能力(Fukuda等,2002;Mure等,2012)。肌张力障碍患者对DBS的延迟和晚期反应可能涉及突触活动或形态的重组。通过配对联合刺激技术,Ruge等人证实肌张力障碍患者存在增强的可塑性,而GPi-DBS能够使这种可塑性恢复正常至健康对照水平(Ruge等,2011)。尽管PAS后的可塑性增强并不总是与健康对照组存在显著差异,但PAS诱导的可塑性程度与肌张力障碍严重程度及DBS临床疗效具有相关性(Kroneberg等,2018)。
近期对肌张力障碍动物模型的研究表明,无论作用于GPi还是STN,DBS都能在全网络范围内影响突触可塑性。我们的研究证实,在dtsz仓鼠中,苍白球DBS能够降低反映自发谷氨酸释放的微小兴奋性突触后电流频率(Heerdegen等,2021)。然而,苍白球DBS对小脑网络的影响仍待深入探索。对肌张力障碍患者的MRI研究显示,比较GPi-DBS开启与关闭状态时,可观察到小脑蚓部和辅助运动区的体积变化,这提示突触数量的增加(Fečíková等,2018)。
高密度微电极阵列能够同步采集多个单一神经元的数据,为研究神经元微环路活动与连接性提供了技术条件。这种平面或三维结构的高密度电极(例如在2.7 mm × 2.7 mm区域内集成4096个电极)可实现具有高时空分辨率的细胞外记录。通过检测神经元网络中的锋电位活动和主要由突触活动产生的局部场电位,HD-MEA为研究网络动力学特征提供了有效的电生理学研究手段(Tognolina等,2022)。
本研究通过对长期接受苍白球DBS治疗的肌张力障碍动物模型小脑皮层神经元动力学特征进行高时空分辨率分析,利用HD-MEA检测小脑皮层各层结构中的平均放电频率、峰电位间隔和局部场电位振幅,并采用包含互相关函数和扩散映射方法的数学模型重建小脑皮层连接网络。我们的研究结果揭示了苍白球DBS对小脑皮层网络动力学特征的全网络调控作用。
¶ 2. 材料与方法
¶ 2.1. 动物
选用雌性、年龄匹配的肌张力障碍dtsz仓鼠(德国莱比锡大学,近交系)及非肌张力障碍对照仓鼠(金仓鼠;JANVIER LABS,远交系)。所有动物单笼饲养,光照周期为14小时光照/10小时黑暗,恒温23°C,自由获取饮水和食物。在27±4日龄时,采用轻度应激(三重刺激技术)对dtsz仓鼠进行肌张力障碍症状筛查。所有dtsz仓鼠均在3小时内表现出严重的肌张力障碍(5级),其特征为后肢过度伸展。非肌张力障碍对照仓鼠也接受同等三重刺激,以获得可比较的电生理数据。所有实验均遵循欧盟指令2012/63/EU及联邦动物保护法,实验许可证号为7221.3–1-029/20。
¶ 2.2 脑深部电刺激及电极植入手术流程
实验动物(31-48日龄)采用异氟烷麻醉(诱导浓度4%,维持浓度1.5–2%),剃除手术区域毛发后固定于立体定位仪。使用人工泪膏保护眼睛。切口前局部注射布比卡因进行浸润麻醉。将双侧同心双极电极植入脚内核(相当于人脑的内侧苍白球;坐标定位参考前囟:前囟后0.6 mm,中线两侧±2.2 mm,深度-6 mm)。将STELLA刺激器皮下植入颈部下方。为预防感染,植入前局部涂抹1 ml梭链孢酸。
在颅骨内锚固最多四颗螺钉,使用牙科粘接剂固定电极。动物恢复至少三天后,通过磁力激活刺激器进行连续11天的持续刺激,期间动物可自由活动。刺激参数设置为130 Hz、50 μA和60 μs,与临床实践相符。考虑到dtsz仓鼠在出生第45天后会出现症状自然缓解,刺激总时长限定为11天。
¶ 2.3 小脑切片制备
实验包含四个年龄匹配的组别:(1) 未经处理的dtsz仓鼠;(2) 非肌张力障碍对照仓鼠;(3) 接受连续11天DBS治疗的dtsz仓鼠;(4) 接受假手术的dtsz仓鼠。在关闭DBS后或相应时间点,各组动物在深度异氟烷麻醉下立即断头。取出电极后快速剥离脑组织,并置于冰镇蔗糖溶液中冷却。
使用显微切片机从小脑蚓部切割获得200μm厚的旁矢状小脑切片。切片在室温蔗糖溶液中持续通入碳合气混合气体孵育60分钟,随后转移至界面式HD-MEA记录槽中。记录过程中使用蠕动泵以2ml/min流速持续灌注无镁人工脑脊液。
¶ 2.4 高密度微电极阵列记录
在立体显微镜下将切片置于HD-MEA记录区域,采用组织锚定器固定。使用配备4096个记录电极的Accura HD-MEA系统记录小脑皮层分子层、浦肯野细胞层和颗粒细胞层的网络活动。通过BioCAM DupleX平台以20,000Hz采样率检测信号。连续记录10分钟,为避免初始电位波动,选取5-10分钟时段数据进行分析。采用12秒分箱宽度生成7-10分钟时段的平均放电率趋势图。
¶ 2.5 数据分析与统计学处理
所有分析均使用BrainWave 5软件进行离线处理。在叠加活动图谱与立体图像后,手动将记录到的活动分配至分子层、浦肯野细胞层和颗粒细胞层。针对这三层结构,分别分析了峰电位间隔、平均放电频率(以12秒为时间窗的放电次数)以及复合动作电位的振幅(绝对最小峰值振幅)。
我们采用精确时序锋电位检测算法进行分析,设置不应期为1.0毫秒,波前波后时程为1.0-1.5毫秒。仅考虑具有负峰的锋电位,这些信号代表局部单一位点或复合动作电位。自动锋电位分类算法设置峰前后波时程为0.5-1.0毫秒,并将每个电极的波形数量限制为三个。
使用SigmaStat进行统计分析。结果以均值±标准误表示。通过标准差除以均值计算变异系数。采用Shapiro-Wilk检验进行单变量正态性检验。若未满足单因素方差分析条件,则使用Kruskal-Wallis检验及后续的Dunn事后检验。对均值采用标准方差分析(针对MFR使用单因素或双因素设计)及Tukey事后检验。当p < 0.05时认为差异具有统计学意义。
¶ 2.6 基于复杂网络的时空活动数学分析
通过分析HD-MEA上不同电极间平均放电频率相似性所构建的连接网络,我们探究了健康状态、病理状态(dtsz)与DBS处理条件间的潜在差异。运用图论度量方法,我们对底层连接特性进行表征,从而揭示神经活动时空分布的特征。该分析可识别网络中的动作电位枢纽节点,这些节点对网络同步至关重要。现有多种方法可测量神经元件间的同步性或相关性,进而构建神经活动与连接网络。本研究采用皮尔逊相关系数这一常用且简便的相关性度量方法。
首先,对于MEA记录的每个时间序列Xi(MEA电极,12秒分箱),我们应用相关函数:
其中 和 分别是 的均值和标准差, 分别是Xj的均值和标准差。随后定义伪距离 为(Gallos等人,2021;Anderson与Cohen,2013):
如果神经元活动对应于一个高度相关的时间序列,其中 则伪距离可以被假定为非常小,意味着 。连接性 是根据伪距离 形成一个方阵:
考虑到我们多电极数据的高维特性,我们探索了距离矩阵的低维表示方法。我们应用非线性流形学习算法(如等距映射,isomap)来生成相关距离矩阵 的低维嵌入表示(Tenenbaum 等,2000)。这种非线性方法类似于主成分分析这一线性方法,后者通过前两个最大特征值对应的特征向量来定义低维空间。
网络在基于距离相似性的降维空间中构建。二维空间中的每个节点 与其 个最近邻节点相连,其中, 对应 MEA 中活跃电极的数量。最终构建的网络表示为 ,其中 为节点集合, 为边集合。我们利用网络数据识别神经元网络的结构特性,描绘网络群落的存在并分析介数中心性。介数中心性可量化节点在网络信息流中的影响力(Newman, 2018;Spiliotis 等, 2022)。
我们对野生型()、dtsz()和 dtsz-DBS()三组动物的分子层、浦肯野细胞层和颗粒细胞层的平均放电频率数据进行了网络连接性分析。采用单因素方差分析和 Tukey 事后检验对平均介数值进行统计学分析,以识别健康状态、dtsz 病理状态与 DBS 处理组之间的显著性差异(Hogg 和 Ledolter, 1987)。
¶ 3. 结果
我们分析了四个实验组(1) 、(2)野生型WT、(3) -DBS和(4)dtsz-假手术组的小脑皮质三层(分子层 、浦肯野层 PL和颗粒层 )的自发锋电位活动。
¶ 3.1. 尖波波形指标(最小峰值振幅,MPA):苍白球深部脑刺激使尖波振幅恢复至与健康对照组相近的水平
通过分析深部脑刺激(DBS)对 spike 振幅及形态变化的影响,本研究为 DBS 能够正常化或至少部分挽救肌张力障碍状态下兴奋性降低的现象提供了证据:图1展示了四个实验组中 spike 振幅的变异性。虽然野生型(WT)和 dtsz-DBS 组的变异系数(CV)在小脑皮质各层中呈现相似数值(表1),但这些数值显著高于 与 -Sham 组(高出 至 )。在此线性分析方法中,PL 层与 GL 层的数据如表1所示。此外,与未处理的 dtsz 组相比,DBS 在所有皮层中均显著提升了最小峰值振幅(MPA)(图1)。这种振幅增长接近健康对照组水平,尤其在 PL 层和 GL 层最为显著,如图1 B、C 部分及表1所示。dtsz-Sham 组与 组无显著差异,且表现出相似的 CV 值(前文已述)及振幅(表1)。
(A) 分子层(ML),(B) 浦肯野细胞层(PL),© 颗粒层(GL)。(I) 箱线图显示均值与中位数值,分别以十字线和水平线标示,同时标注第25与第75百分位数。(II) 展示各组典型波形(野生型(WT, 切片)、未手术dtsz ( 切片)、 关闭DBS(假手术组, 切片)及dtsz开启DBS( 切片))。ML数据采用单因素方差分析结合Tukey事后检验,PL与GL数据采用Kruskal-Wallis秩和检验( )。
¶ A) MPA-分子层
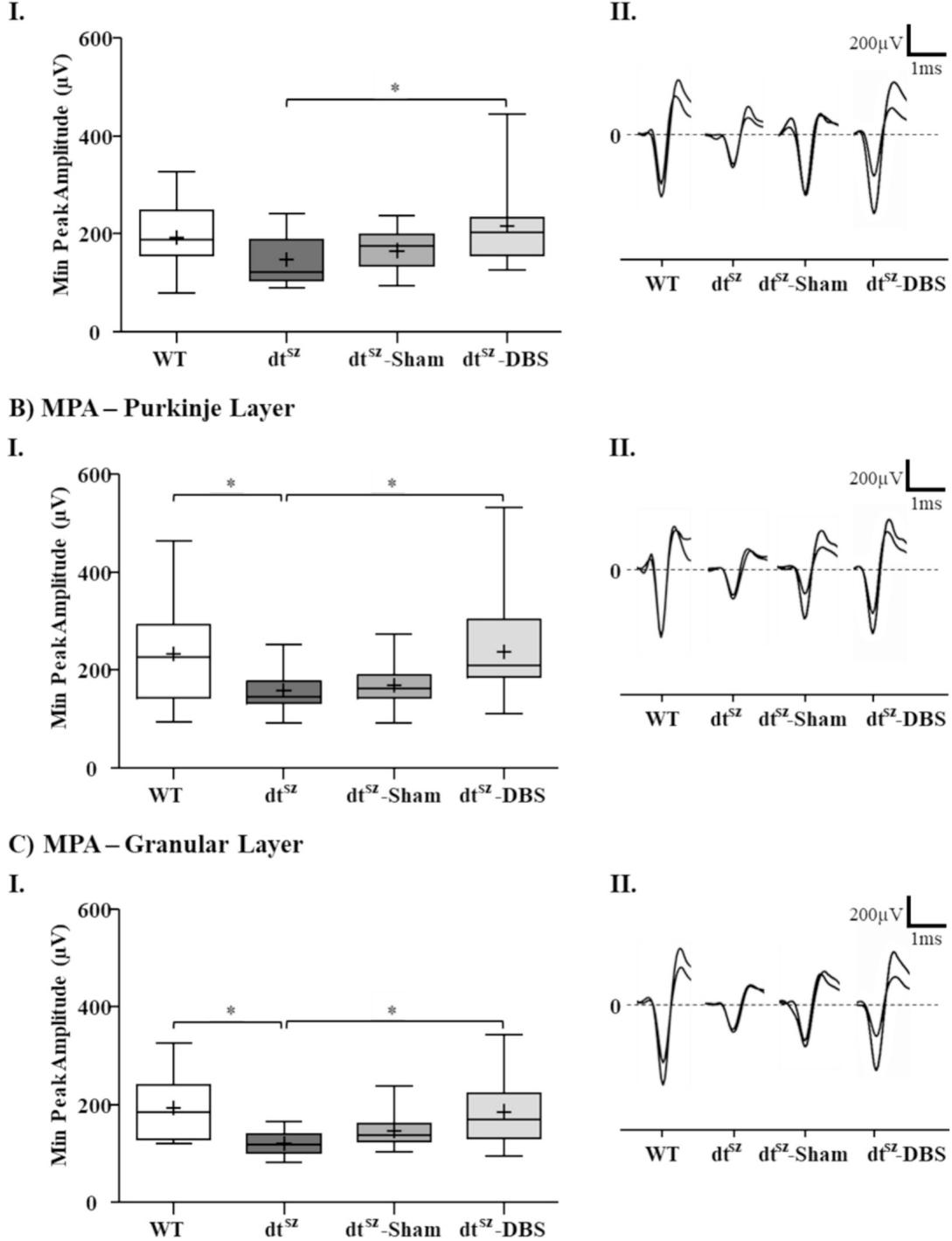
图1. 丘脑底核深部脑刺激对小脑皮层层内最小峰值振幅(MPA)的影响。
3.2. 平均放电频率(MFR):苍白球深部脑刺激将MFR提升至正常水平
我们进一步分析了放电活动的平均放电率(MFR),即每12秒时间窗口内的平均脉冲数。一个重要发现是,至少在本研究观察的时间窗口内,所有组别的神经活动都随时间保持显著稳定,这一发现促进了组间比较。因此,图2C-E中的趋势图证实了所有四个实验组及小脑皮质三个层次中的MFR保持恒定,未出现任何衰减效应。双向方差分析显示无显著差异(分子层:F值 , ;浦肯野层:F值 ,p值 ;颗粒层:F值 ,p值 )。
然而,不同群体之间存在着非常显著的差异与振幅方面的发现高度一致:尽管肌张力障碍组织产生的平均放电频率(MFR)整体显著更低(尤其在分子层和颗粒层),但苍白球脑深部电刺激(DBS)将MFR提升至健康对照组水平,且在小脑皮质所有层中较dtsz 和dtsz-假刺激组均实现显著增加(图2C-E;表1)。
(A) 小脑旁矢状切片上的高密度微电极阵列(HD-MEA)采集的示例性自发性神经放电记录,显示在HD-MEA每个电极上检测到的峰峰值振幅;(B) 后续对总记录时间内平均放电频率(MFR)的分析。蓝色、紫色和红色的色点分别标记小脑皮层特定层(即分子层、浦肯野细胞层和颗粒层)中选定的阵列电极。对小脑皮层各层的MFR进行分析:(C)分子层(ML)、(D)浦肯野细胞层(PL)和(E)颗粒层。(GL)的MFR数据。(I)展示时间序列图,包含12秒时间窗内的均值及均值标准误差。(II)呈现MFR的箱线图,其中均值与中位数分别以十字标记和水平线表示,同时标注第25与第75百分位数。统计分析采用Kruskal-Wallis单因素秩和检验(*p < 0.05),纳入数据来源包括:野生型(WT,n=22片)、未经手术处理的dtsz组(n=20片)、dtsz DBS关闭组(假手术组,n=20片)及dtsz DBS开启组(n=20片)。
表1 数据摘要
| Groups: | WT | dtsz | dt-DBS | dts-Sham |
| Number of slices | 22 | 20 | 20 | 20 |
| Number of animals | 11 | 13 | 7 | 7 |
| Coefficient of variance | ||||
| ML | 0.31 | 0.34 | 0.37 | 0.23 |
| PL | 0.44 | 0.27 | 0.44 | 0.25 |
| GL | 0.31 | 0.2 | 0.35 | 0.2 |
| Minimum peak amplitude[μV] | ||||
| ML | 192.4± | 146.6± | 216.2 ± | 166±9 |
| 13.1 | 11.6 | 18.3 | ||
| PL | 232.5± 22.2 | 157.3 ± 9.7 | 236.5± 23.8 | 169.4± 9.8 |
| GL | 193.5 ± 13 | 121.5 ± 5.5 | 185.9± 14.9 | 145.7 ± 6.9 |
| Mean firing rate[spike/s] | ||||
| ML | 4.3 ± 0.06 | 3.9 ±0.05 | 4.5 ± 0.05 | 3.8 ±0.05 |
| PL | 4.7 ± 0.06 | 4.6 ± 0.07 | 4.8 ± 0.09 | 4.2 ± 0.04 |
| GL | 4.3 ± 0.05 | 3.8 ±0.05 | 4.5 ± 0.1 | 3.7 ± 0.04 |
| Interspike interval[ms] | ||||
| ML | 184.7 ± 9.1 | 185.3± 12.4 | 172.7 ± 7.4 | 218.4± 12.6 |
| PL | 162.9 ± 6.1 | 169.9±8.3 | 167.6 ±8.8 | 196.8 ± 7.2 |
| GL | 181.8 ± 6.3 | 194.9 ± 11.5 | 180.6 ± 8.6 | 218.1 ± 8.2 |
缩写:WT -非肌张力障碍对照仓鼠; -天然dtsz 仓鼠; -DBS -连续刺激11 天的dtsz 仓鼠; -Sham -接受手术但未进行主动脑深部电刺激的dtsz 仓鼠;ML –分子层;PL –浦肯野细胞层;GL –颗粒层。
¶ 3.3. 尖峰指标:苍白球深部脑刺激未影响小脑皮层层间尖峰间期(ISI)
肌张力障碍仓鼠表现出较低的MFR值,但随着DBS治疗该数值有所上升。有趣的是,对ISI的分析显示,所有四组实验对象的小脑皮质三层结构之间均无显著差异。健康对照组(WT)与肌张力障碍仓鼠( )的ISI也未出现波动。最重要的是,DBS对小脑分子层(ML)、浦肯野层(PL)和颗粒层(GL)的ISI均未产生显著影响(图3;表1)。
(A)分子层(ML)、(B)浦肯野细胞层(PL)与©颗粒层 。(I)为箱形图,其中均值与中位数分别以十字标记和水平线标示,并显示第25及第75百分位数。(II)展示各组(野生型(WT, 切片)、未手术dtsz 切片)、 关闭脑深部电刺激(假手术组, 切片)以及dtsz开启脑深部电刺激 切片))自发产生峰电位的原始示例波形。峰电位检测结果示于波形下方,同组峰电位以相同颜色标记,灰色标记低于阈值的离群值。采用单因素方差分析(ANOVA)与Tukey事后检验对符合正态分布的数据进行统计学分析 。
¶ 3.4. 时空活动:苍白球深部脑刺激增强了ML和PL内的网络连接性,使其达到与健康对照组相似的水平。
在健康状态下(即野生型组织中),分子层(ML)和浦肯野层(PL)表现出高度活跃性和同步化水平,其介数中心性(即组织内信息分布的节点)分别处于300-800和320-900的范围内(图4G)。图4A展示了二维简化空间中ML神经网络的典型示例,取自一片野生型脑切片。图4B呈现了与高密度微电极阵列电极布局相对应的图4A网络连接结构。��dtsz 仓鼠表现出ML网络信息分布减弱,即活跃节点和连接边数量减少(图4C和D)。与健康对照组相比,所有小脑皮层中介数中心性降低超过 具有显著性差异(图4G)。对dtsz 仓鼠进行苍白球脑深部电刺激治疗后,其ML区域的节点和连接边数量较未治疗的肌张力障碍仓鼠显著增加(图4E和F)。值得注意的是,DBS成功逆转了这种变化,使ML、PL及颗粒层(GL)的介数中心性恢复至健康对照组的正常范围(图4G)。
图表(A至C)展示了单次测量中数学网络分析结果的示例。节点颜色表示神经元群落分组,同一群落成员表现出强烈的活动相关性(同步化)。(A) 野生型(健康数据集)分子层(ML)的神经元网络通过前两个特征向量定义的低维空间计算得出(I)。(II) 呈现了与高密度微电极阵列(HD-MEA)电极布局对应的相同网络连接。(B) 肌张力障碍数据集(dtsz)的ML神经元网络显示连接性降低,表现为节点和边数量较野生型状态减少(I)。(II) 将该网络反向投影至MEA原始坐标系。(C-I、C-II)ML层DBS数据集的对应分析结果。(D) 采用单因素方差分析对ML、浦肯野细胞层(PL)和颗粒层(GL)的介数中心度平均值进行统计分析(使用十个脑片样本)。( 组与WT相同层级及dtsz-DBS组存在显著差异,显著性水平 ; 组仅与WT相同层级存在显著差异,显著性水平 )
¶ 4. 讨论
本研究采用高密度微电极阵列记录了肌张力障碍仓鼠小脑皮层颗粒层、分子层和浦肯野细胞层的体外高密度电生理数据。数据显示,尽管在组织制备后进行体外记录,预先实施的体内苍白球脑深部电刺激仍通过改变小脑皮层各层的平均放电频率和峰电位幅度产生显著影响。此外,仅植入DBS电极便足以引发电生理网络特性的改变。
¶ 4.1. 仓鼠的病理机制(野生型与dtsz突变体比较)
先前研究表明,作为孤立性遗传性阵发性肌张力障碍模型的dtsz 仓鼠,其小脑中GABA 受体-氯离子通道复合体存在功能障碍,尤其在颗粒层表现明显(Nobrega等,1995)。小脑皮层中GABA浓度升高暗示着对功能异常的GABAA受体-氯离子通道复合体存在代偿机制(Nobrega等,1995;L¨oscher与H¨orstermann,1992)。我们的实验证实dtsz 仓鼠小脑皮层所有层次的棘波振幅均显著降低,与既往研究结果一致(图1)。除颗粒细胞(GrCs)外,小脑皮层的所有神经元均为抑制性神经元。它们主要使用γ-氨基丁酸(GABA)作为神经递质,部分使用甘氨酸(Prestori et al.,2019)。抑制性中间神经元(包括星形细胞、篮细胞、高尔基细胞和卢加罗细胞)通过涉及前馈、反馈及侧向抑制的复杂微回路处理小脑时空动态。仓鼠中减少且波动较小的尖峰振幅表明爆发生成能力减弱。Harris等人(2001)发现爆发首尖峰振幅大于单个尖峰,这与我们的结果一致(Harris等人,2001)(图1)。幅度变异系数的降低进一步表明dtsz 仓鼠的爆发生成减少。虽然MEA记录分析必须考虑信号源与电极之间的距离(Obien等人,2019),但我们通过最小化系统误差,将幅度差异归因于dtsz 仓鼠的组织变异。
¶ A) 原始信号指标:峰峰值, B) 尖峰指标:MFR(活动图)
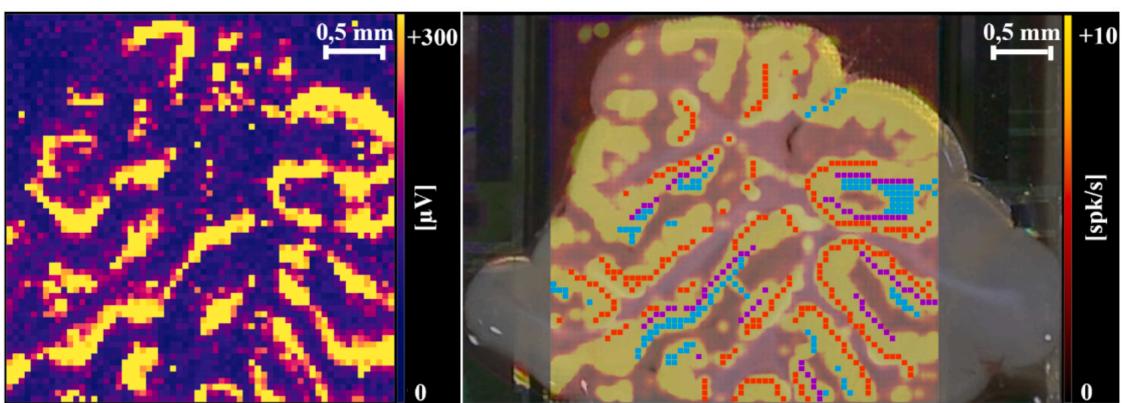
¶ C) MFR-分子层

图2. 苍白球脑深部电刺激对平均放电频率的影响。
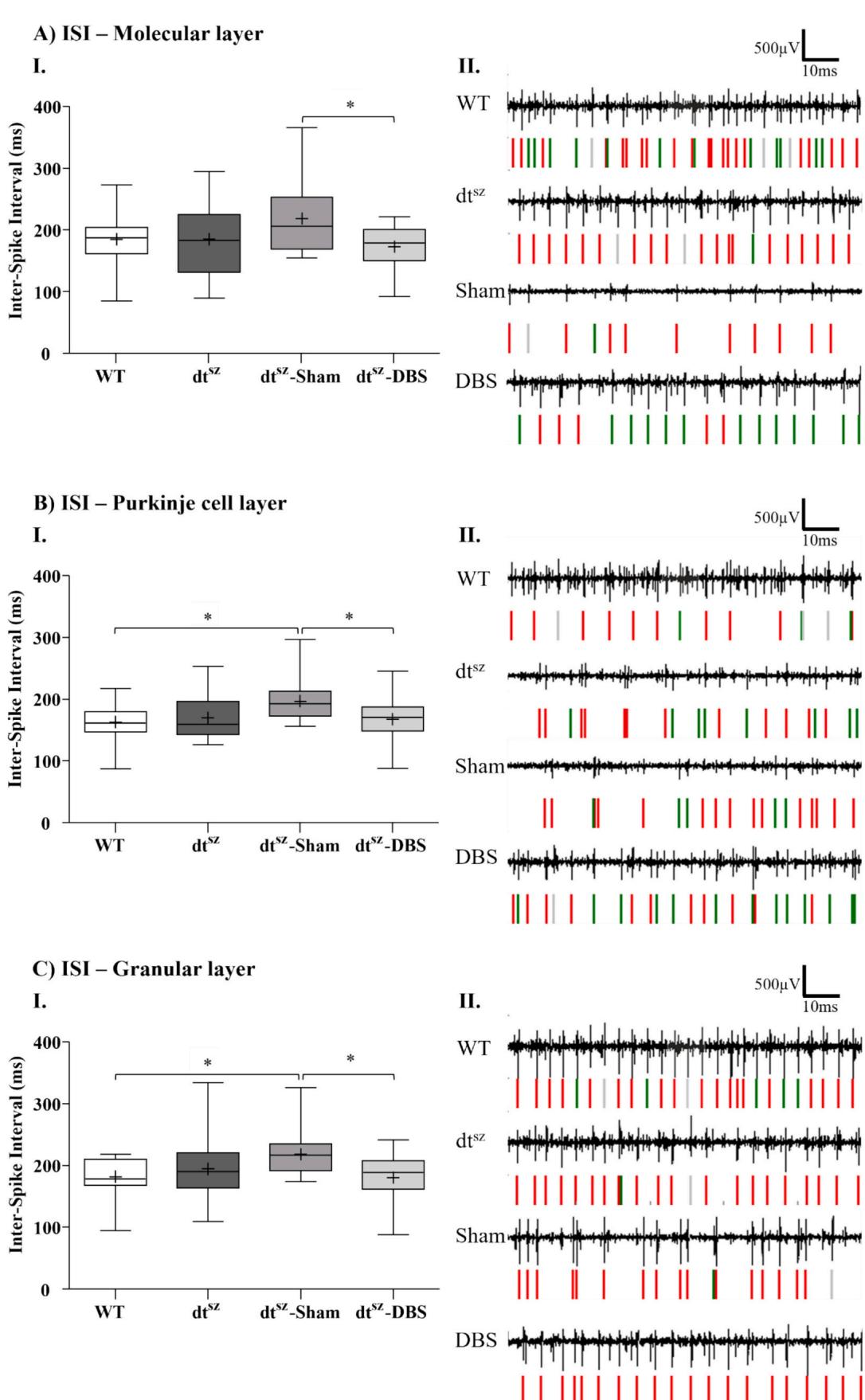
图 3. Effec 苍白球深部脑刺激(DBS)对小脑皮质内峰间期(ISI)的影响
¶ A) 时空活动 -WT
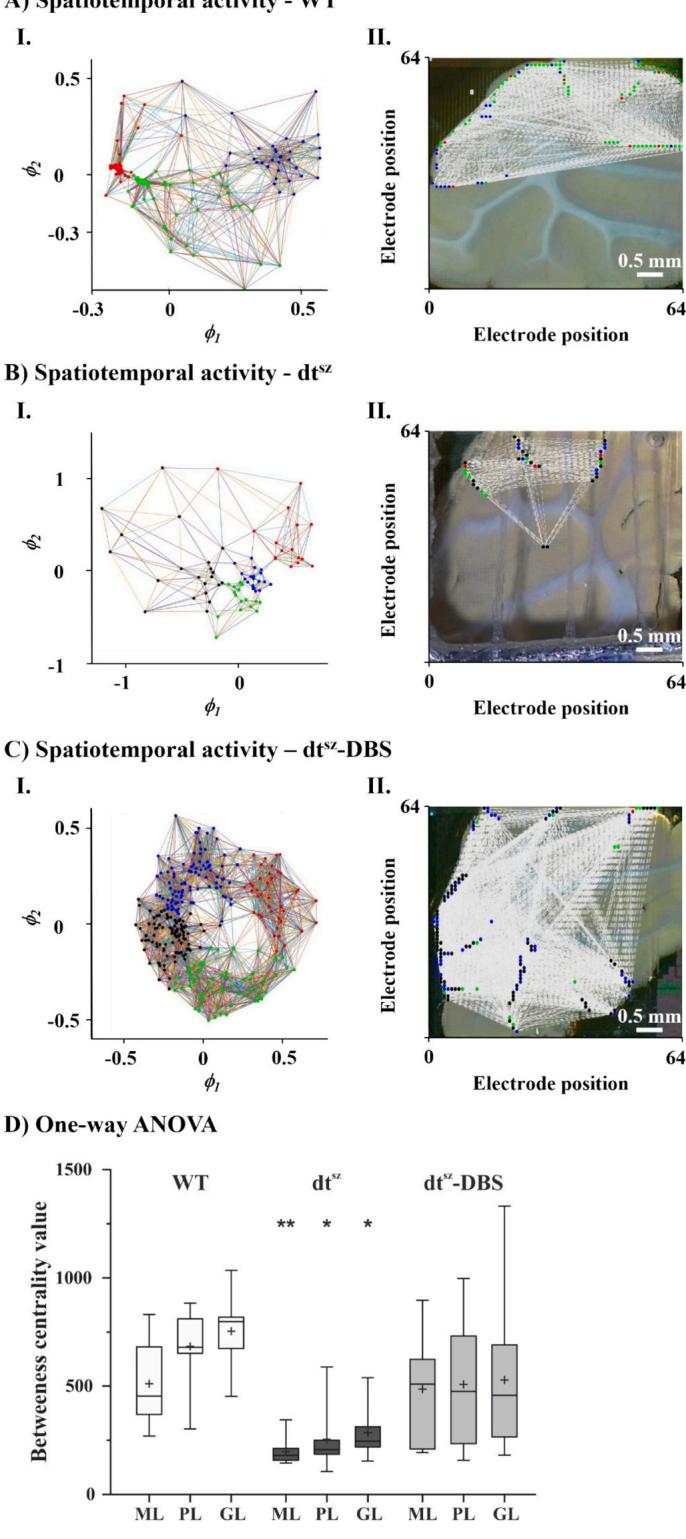
图4. 健康状态(WT)、肌张力障碍( )及深部脑刺激作用下小脑区域时空活动。
除了爆发性发放减少外,细胞密度降低(包括纤维数量和分支减少)也可能因电极周围电流密度降低而导致振幅减小。神经解剖学研究表明,在动物模型和人类DYT1肌张力障碍中均发现小脑纤维束减少(Ulu˘g等,2011)。
在dtsz 仓鼠中观察到的第二个现象是,ML和GL区的MFR降低,但PL区未见变化(图2C-E)。在缺乏苔藓纤维输入的情况下,颗粒细胞保持静默(D’Angelo, 2018),这表明星形胶质细胞、高尔基细胞、卢迦斯细胞以及浦肯野细胞的起搏特性产生了我们实验中测量到的自发性MFR活动(D’Angelo, 2018)。MFR降低及峰值振幅减弱,支持了dtsz 仓鼠存在纤维密度降低和突触可塑性减弱的假说(Richter等,1998)。尽管ML和GL区的MFR发生改变,但dtsz 仓鼠PL区的MFR与健康对照组相当,这可能是通过中间神经元微环路控制机制将浦肯野细胞输出调节至正常水平所致。
值得注意的是,尽管MFR发生改变,但对放电间期(ISI)并无影响。sz 组显示MFR显著降低(PL区除外),但各层间的ISI并无差异(图4)。这可能是由于我们采用12秒时间窗计算MFR和ISI的分析方法所致。在相同ISI条件下,若WT组在时间窗内出现更多事件且具有相似的时间分布,则会提高其MFR值。
¶ 4.2. 大鼠丘脑深部脑刺激(DBS)的作用机制
以内侧苍白球(GPi)为靶点的脑深部电刺激(DBS)可有效治疗全身性肌张力障碍,使肌张力障碍严重程度改善 (Franz等,2023),并已在dtsz 仓鼠模型中得到证实(Paap等,2021)。虽然具体机制尚未明确,但DBS似乎能诱导受影响网络内特定核团活动产生改变或适应性变化。苍白球DBS可改变纹状体中型多棘神经元的兴奋性突触输入(Heerdegen等,2021)及小脑活动(Heerdegen等,2021;Lüttig等,2024)。我们的实验证实了DBS的网络级效应,但其对小脑的具体影响仍不明确。潜在研究方向包括:齿状核-苍白球通路(该通路直接连接齿状核与丘脑底核、苍白球内侧部,并与感觉运动皮层输入存在重叠)、纹状体与齿状核之间的双突触传入通路,以及丘脑底核与小脑皮层之间的连接(Hanssen等,2019)。
¶ 4.2.1. 尖波波形指标(最小峰值振幅,MPA):苍白球脑深部刺激术使尖波振幅增至健康水平
苍白球DBS将所有层级的 spike 振幅提升至健康水平,同时降低了变异系数(图1,表1)。连续高频DBS可能改变活动模式的空间与时间编码,影响长期突触可塑性与信号传递。这些突触传递的变化影响了小脑皮层微环路,可能增强爆发性电活动生成——表现为更高且更具变异性的spike 振幅(Harris et al., 2001)。长期DBS后记录电极电流密度的增加提示小脑皮层内细胞密度、突触数量及神经纤维数量可能有所提升。
4.2.2. Mean firing rate (MFR): Pallidal DBS resulted in a significantincrease in the mean firing rate (MFR) to a level that was considered healthy苍白球DBS显著提升了所有小脑皮质层的平均放电频率(MFR),使其恢复至正常水平(图2CD)。所观察到的星状细胞、浦肯野细胞、篮状细胞和高尔基细胞的起搏活动,源于小脑皮质缺乏信号输入。在体外实验前11天实施的持续苍白球DBS,可能改变了中间神经元和浦肯野细胞的起搏特性,从而提高了MFR。MFR和峰值振幅的增加表明对小脑深部核团的抑制性输出增强,这一点通过DCN神经元活动减少得到证实与幼稚的dtsz 仓鼠相比,c-Fos+细胞密度较低(Lüttig等,2024)。
¶ 4.2.3. 尖峰指标:苍白球深部脑刺激未影响小脑皮层层间尖峰间期(ISI)
尽管WT组与dtsz 组之间存在平均放电频率差异,但未观察到放电间隔差异,因此苍白球深部脑刺激与WT组及dtsz 组相比未表现出显著的放电间隔变化(图3)。
在dtsz-假手术组中观察到一个意外效应:所有皮层的ISI均显著高于dtsz-脑深部电刺激组。与dtsz-脑深部电刺激组相比,dtsz-假手术组在所有皮层中MFR的显著降低支持了电极植入会显著影响网络活动的假说。这可能是通过损伤目标结构实现的——临床研究显示该方法对肌张力障碍患者具有改善作用(Chiken and Nambu, 2016)。此外,脑部损伤可导致跨神经元变性,使损伤对侧小脑半球代谢活动及血流量降低(D’Angelo, 2018)。脑深部电刺激则通过预防谷氨酸兴奋性毒性、神经炎症及胶质细胞活化显现出治疗优势(Lenarz et al., 2007; Orlowski et al., 2017)。
¶ 4.3. 网络分析揭示健康组(WT)、病理组($d t ^ { s z })与脑深部刺激组之间存在时空差异
我们的分析显示,与野生型相比, 组切片的多电极阵列记录中活动减少,活跃节点和边数量更少,相关性更低。这些发现与先前在dtsz 仓鼠(Richter等人,1998年)和患者(Pan等人,2020年;Delnooz等人,2013年)中的实验一致。苍白球脑深部电刺激使网络活动正常化,形成类似于健康状态的结构,这通过数学网络分析得到了证实。利用中介中心性度量,我们量化并表征了所有层中的网络差异,野生型和脑深部电刺激组的平均值与dtsz 组相比存在显著差异(图4G)。网络分析还揭示了社区结构(具有相似活动的神经元素),为肌张力障碍病理学和脑深部电刺激机制提供了新的见解。
¶ 4.4. 限制
需要注意的是,该研究未探讨苔状纤维或攀爬纤维对小脑皮层网络自发活动的影响。这一研究局限性使得我们无法在颗粒细胞(GrCs)和平行纤维的影响背景下,对起搏神经元(星形细胞、篮状细胞、高尔基细胞和浦肯野细胞)的电生理特性进行研究。
由于dtsz仓鼠在出生45天后出现渐进性缓解,我们的刺激持续时间也被限制在11天。由于在手术后三天才开启刺激,病变过程可能会额外影响DBS组的结果。
本研究只研究了雌性仓鼠,因为我们未能研究雄性dtsz 仓鼠。
¶ 5. 结论
总之,我们的研究表明,苍白球脑深部电刺激可显著影响肌张力障碍仓鼠小脑皮质各层的平均放电频率与峰值振幅。该疗法使上述参数恢复至健康对照组水平,推测其作用机制与突触可塑性增强及抑制性输出提升有关。为验证该假说,需开展免疫组织学染色等进一步研究。网络分析显示,脑深部电刺激可标准化时空活动结构,这为理解肌张力障碍中DBS的全网络治疗机制提供了新见解。
¶ 参考文献
Albin, R.L., Young, A.B., Penney, J.B., 1989. The functional anatomy of basal ganglia disorders. Trends in Neurosciences 12, 366-375. https://doi.org/10.1016/0166-2236(89)90074-X.
Andersson, A., Cohen, M., 2013. Reduced small-world functional connectivity and clustering in resting-state networks in schizophrenia: a tutorial on fMRI classification. Frontiers in Human Neuroscience 7.
Anderson, M.E., Postupna, N., Ruffo, M., 2003. Effects of high-frequency stimulation in the internal pallidum on the activity of thalamic neurons in the awake monkey. Journal of Neurophysiology 89, 1150-1160. https://doi.org/10.1152/jn.00475.2002.
Bastos, A.M., Schoffelen, J.-M., 2016. A tutorial review of functional connectivity analysis methods and their interpretational pitfalls. Frontiers in Systems Neuroscience 9, 175. https://doi.org/10.3389/fnsys.2015.00175.
Bédard, P., Panyakaew, P., Zhao, H.-J., Hallett, M., Horovitz, S.G., 2022. Multimodal imaging of essential tremor and dystonic tremor. NeuroImage: Clinical 36, 103247. https://doi.org/10.1016/j.nicl.2022.103247.
Bullmore, E., Sporns, O., 2012. The economy of brain network organization. Nature Reviews Neuroscience 13, 336-349. https://doi.org/10.1038/nrn3214.
Chiken, S., Nambu, A., 2016. Mechanism of deep brain stimulation: Inhibition, excitation, or disruption? The Neuroscientist 22, 313-322. https://doi.org/10.1177/1073858415581986.
D’Angelo, E., 2018. Cerebellar physiology. Handbook of Clinical Neurology 154, 85-108. https://doi.org/10.1016/B978-0-444-63956-1.00006-0.
Delnooz, C.C.S., Pasman, J.W., Beckmann, C.F., van de Warrenburg, B.P.C., 2013. Task-free functional MRI in cervical dystonia reveals multi-network changes that partially normalize with botulinum toxin. PLoS ONE 8, e62877. https://doi.org/10.1371/journal.pone.0062877.
Fečíková, A., Jech, R., Čejka, V., Čapek, V., Šaštná, D., Stětkářová, I., et al., 2018. Pallidal stimulation effect in dystonia is associated with cerebellar volume and cortical inhibition. Scientific Reports 8, 17218. https://doi.org/10.1038/s41598-018-34880-z.
Franz, D., Richter, A., Köhling, R., 2023. Electrophysiological insights into deep brain stimulation of the network disorder dystonia. Pflügers Archiv 475, 1133. https://doi.org/10.1007/s00424-023-02845-5.
Fukuda, M., Ghilardi, M.F., Carbon, M., Dhawan, V., Ma, Y., Feigin, A., et al., 2002. Pallidal stimulation for Parkinson’s disease: enhanced activation during sequence learning. Annals of Neurology 52, 144-152. https://doi.org/10.1002/ana.10261.
Gallos, I.K., Gkiatis, K., Matsopoulos, G.K., Siettos, C., 2021. Embedded functional connectivity of the anatomy-disconnected brain regions from resting-state fMRI data of schizophrenia patients using isometric mapping and machine learning algorithms. AIMS Neuroscience 8, 295-321. https://doi.org/10.3934/Neuroscience.2021016.
Grütz, K., Klein, C., 2021. Dystonia update: definition, nomenclature, clinical classification, and etiology. Journal of Neural Transmission 128, 395-404. https://doi.org/10.1007/s00702-021-02314-2.
Hanssen, H., Steinhardt, J., Münchau, A., Al-Zubaidi, A., Tzvi, E., Heldmann, M., et al., 2019. Cerebellar-striatal interactions mediate the effects of subthalamic nucleus deep brain stimulation in Parkinson’s disease. Parkinsonism & Related Disorders 67, 99-104. https://doi.org/10.1016/j.parkreldis.2019.09.003.
Harris, K.D., Hirase, H., Leinekugel, X., Henze, D.A., Buzsáki, G., 2001. Temporal interaction between single spikes and complex spike bursts in hippocampal pyramidal cells. Neuron 32, 141-149. https://doi.org/10.1016/s0896-6273(01)00447-0.
Heerdegen, M., Zwar, M., Franz, D., Hörnschemeyer, J., Neubert, V., Plocksties, F., et al., 2021. Mechanisms of pallidal deep brain stimulation: Alteration of cortico-striatal synaptic communication in a dystonia animal model. Neurobiology of Disease 154, 105341. https://doi.org/10.1016/j.nbd.2021.105341.
Hock, A.N., Jensen, S.R., Svaerke, K.W., Brennum, J., Jespersen, B., Bergdal, O., et al., 2022. A randomized double-blind controlled study of subthalamic nucleus and globus pallidus interna deep brain stimulation for dystonia - follow-up after 15 years. Parkinsonism & Related Disorders 96, 74-79. https://doi.org/10.1016/j.parkreldis.2022.02.001.
Hogg, R.V., Ledolter, J., 1987. Engineering Statistics. Macmillan; Collier Macmillan, New York, London.
Honkanen, E.A., Rönkä, J., Pekkonen, E., Aaltonen, J., Koivu, M., Eskola, O., et al., 2023. Brain metabolic activation by pallidal deep brain stimulation in cervical dystonia. Journal of Neurology, Neurosurgery & Psychiatry, 331668. https://doi.org/10.1136/jnnp-2023-331668.
Kim, J., Augustine, G.J., 2021. Molecular layer interneurons: key elements of cerebellar network computation and behavior. Neuroscience 462, 22-35. https://doi.org/10.1016/j.neuroscience.2020.10.008.
Kosutzka, Z., Tisch, S., Bonnet, C., Ruiz, M., Hainque, E., Welter, M.-L., et al., 2019. Long-term GPi-DBS improves motor features in myoclonus-dystonia and enhances social adjustment. Movement Disorders 34, 87-94. https://doi.org/10.1002/mds.27474.
Kreuz, T., Mormann, F., Andrzejak, R.G., Kraskov, A., Lehnertz, K., Grassberger, P., 2007. Measuring synchronization in coupled model systems: A comparison of different approaches. Physica D: Nonlinear Phenomena 225, 29-42. https://doi.org/10.1016/j.physd.2006.09.039.
Kroneberg, D., Plettig, P., Schneider, G.-H., Kühn, A.A., 2018. Motor cortical plasticity relates to symptom severity and clinical benefit from deep brain stimulation in cervical dystonia. Neuromodulation 21, 735-740. https://doi.org/10.1111/ner.12690.
Lenarz, M., Lim, H.H., Lenarz, T., Reich, U., Marquardt, N., Klingberg, M.N., et al., 2007. Auditory midbrain implant: a new approach to auditory stimulation of the midbrain. Otology & Neurotology 28, 1045. https://doi.org/10.1097/MAO.0b013e318159e74f.
Löscher, W., Hörstermann, D., 1992. Abnormalities of amino acid neurotransmitters in discrete brain regions of genetically dystonic hamsters. Journal of Neurochemistry 59, 689-694. https://doi.org/10.1111/j.1471-4159.1992.tb09423.x.
Löscher, W., Fisher Jr., J.E., Schmidt, D., Fredow, G., Hönack, D., Iturrian, W.B., 1989. The sz mutant hamster: a genetic model of epilepsy or of paroxysmal dystonia? Movement Disorders 4, 219-232. https://doi.org/10.1002/mds.870040304.
Lüttig, A., Perl, S., Zetsche, M., Richter, F., Franz, D., Heerdegen, M., et al., 2024. Cerebellar changes in c-Fos expression following short-term stimulation of the entopeduncular nucleus in an animal model of paroxysmal dystonia. Brain Research 1823, 148672. https://doi.org/10.1016/j.brainres.2023.148672.
Montgomery, E.B., 2006. Effects of GPi stimulation on human thalamic neuronal activity. Clinical Neurophysiology 117, 2691-2702. https://doi.org/10.1016/j.clinph.2006.08.011.
Mure, H., Tang, C.C., Argyelan, M., Ghilardi, M.-F., Kaplitt, M.G., Dhawan, V., et al., 2012. Improved sequence learning with subthalamic nucleus deep brain stimulation: evidence for treatment-specific network modulation. Journal of Neuroscience 32, 2804-2813. https://doi.org/10.1523/JNEUROSCI.4331-11.2012.
Nauta, W.J.H., Mehler, W.R., 1966. Projections of the lentiform nucleus in the monkey. Brain Research 1, 3-42. https://doi.org/10.1016/0006-8993(66)90103-X.
Németh, A.H., 2002. The genetics of primary dystonias and related disorders. Brain 125, 695-721. https://doi.org/10.1093/brain/awf090.
Newman, M., 2018. Networks. Oxford University Press. https://doi.org/10.1093/oso/9780198805090.001.0001.
Neymotin, S.A., Dura-Bernal, S., Lakatos, P., Sanger, T.D., Lytton, W.W., 2016. Multitarget multiscale simulation for pharmacological treatment of dystonia in motor cortex. Frontiers in Pharmacology 7.
Nobrega, J.N., Richter, A., McIntyre Burnham, W., Löscher, W., 1995. Alterations in the brain GABAA/benzodiazepine receptor-chloride ionophore complex in a genetic model of paroxysmal dystonia: a quantitative autoradiographic analysis. Neuroscience 64, 229-239. https://doi.org/10.1016/0306-4522(94)00334-2.
Obien, M.E.J., Hierlemann, A., Frey, U., 2019. Accurate spike localization in brain slices using high-density microelectrode arrays. Scientific Reports 9, 788. https://doi.org/10.1038/s41598-018-36895-y.
Orlowski, D., Michalis, A., Glud, A.N., Korshøj, A.R., Fitting, L.M., Mikkelsen, T.W., et al., 2017. Brain tissue reaction to deep brain stimulation—A longitudinal study of DBS in the Goettingen minipig. Neuromodulation 20, 417-423. https://doi.org/10.1111/ner.12576.
Paap, M., Perl, S., Lüttig, A., Plocksties, F., Niemann, C., Timmermann, D., et al., 2021. Optimized deep brain stimulation in the phenotypic model of dystonia: effects of different frequencies. Neurobiology of Disease 147, 105163. https://doi.org/10.1016/j.nbd.2020.105163.
Pan, P., Wei, S., Ou, Y., Jiang, W., Li, W., Lei, Y., et al., 2020. Decreased whole-brain functional connectivity and its relationship with symptom severity in cervical dystonia. Frontiers in Neurology 10. https://doi.org/10.3389/fneur.2019.01358.
Perl, S., Lüttig, A., Köhling, R., Richter, A., 2022. Deep brain stimulation in animal models of dystonia. Neurobiology of Disease 175, 105912. https://doi.org/10.1016/j.nbd.2022.105912.
Phukan, J., Albanese, A., Gasser, T., Warner, T., 2011. Primary dystonia and dystonia-plus syndromes: clinical features, diagnosis, and pathogenesis. The Lancet Neurology 10, 1074-1085. https://doi.org/10.1016/S1474-4422(11)70232-0.
Pizoli, C.E., Jinnah, H.A., Billingsley, M.L., Hess, E.J., 2002. Abnormal cerebellar signaling induces dystonia in mice. Journal of Neuroscience 22, 7825-7833.
Plocksties, F., Kober, M., Niemann, C., Heller, J., Fauser, M., Nüssel, M., et al., 2021. STELLA: A software-defined implantable and modular platform for preclinical deep brain stimulation research in rodents. Journal of Neural Engineering 18. https://doi.org/10.1088/1741-2552/ac23e1.
Prestori, F., Mapelli, L., D’Angelo, E., 2019. Diverse neuron properties and complex network dynamics in the cerebellar cortical inhibitory circuit. Frontiers in Molecular Neuroscience 12, 267. https://doi.org/10.3389/fnmol.2019.00267.
Prudente, C.N., Hess, E.J., Jinnah, H.A., 2014. Dystonia as a network disorder: what is the role of the cerebellum? Neuroscience 260, 23-35. https://doi.org/10.1016/j.neuroscience.2013.11.062.
Richter, A., Löscher, W., 1998. Pathophysiology of idiopathic dystonia: findings from genetic animal models. Progress in Neurobiology 54, 633-677. https://doi.org/10.1016/S0301-0082(97)00089-0.
Richter, A., Brotchie, J.M., Crossman, A.R., Löscher, W., 1998. [3H]-2-deoxyglucose uptake study in mutant dystonic hamsters: abnormalities in discrete brain regions of the motor system. Movement Disorders 13, 718-725. https://doi.org/10.1002/mds.870130419.
Ruge, D., Tisch, S., Hariz, M.I., Zrinzo, L., Bhatia, K.P., Quinn, N.P., et al., 2011. Deep brain stimulation effects in dystonia: time course of electrophysiological changes in early treatment. Movement Disorders 26, 1913-1921. https://doi.org/10.1002/mds.23731.
Shakkottai, V.G., Batla, A., Bhatia, K., Dauer, W.T., Dresel, C., Niethammer, M., et al., 2017. Current opinions and areas of consensus on the role of the cerebellum in dystonia. Cerebellum 16, 577-594. https://doi.org/10.1007/s12311-016-0825-6.
Spiliotis, K., Butenko, K., van Rienen, U., Starke, J., Köhling, R., 2022. Complex network measures reveal optimal deep brain stimulation targets and identify clusters of collective brain dynamics. Frontiers in Physics 10. https://doi.org/10.3389/fphy.2022.951724.
Tambirajoo, K., Furlanetti, L., Samuel, M., Ashkan, K., 2020. Subthalamic nucleus deep brain stimulation for post-stroke dystonia: a case series. Stereotactic and Functional Neurosurgery 98, 386-398. https://doi.org/10.1159/000509317.
Tenenbaum, J.B., de Silva, V., Langford, J.C., 2000. A global geometric framework for nonlinear dimensionality reduction. Science 290, 2319-2323. https://doi.org/10.1126/science.290.5500.2319.
Tognolina, M., Monteverdi, A., D’Angelo, E., 2022. Unveiling microcircuit secrets with multi-site imaging and electrophysiological recordings: the example of cerebellar network dynamics. Frontiers in Cellular Neuroscience 16, 805670. https://doi.org/10.3389/fncel.2022.805670.
Uluğ, A.M., Vo, A., Argyelan, M., Tanabe, L., Schiffer, W.K., Dewey, S., et al., 2011. Cerebellothalamocortical pathway abnormalities in torsinA DYT1 knock-in mice. Proceedings of the National Academy of Sciences 108, 6638-6643. https://doi.org/10.1073/pnas.1016445108.