¶ 高密度阵列上均质与异质人源诱导多能干细胞分化神经元网络的电化学调控
¶ 朱莉亚·帕罗迪, 乔治亚·扎尼尼, 米凯拉·基亚帕隆, 塞尔吉奥·马尔蒂诺伊亚*
热那亚大学信息学、生物工程、机器人技术与系统工程系 (DIBRIS),意大利热那亚
神经元之间微妙的“兴奋性/抑制性平衡”在神经退行性和神经发育疾病中具有重要 意义。本研究的最终目标是创建一个忠实的 in vitro 人脑模型,我们调查了异质性 的关键因素,重点关注神经网络中兴奋性谷氨酸能(E)和抑制性γ-氨基丁酸能(I )神经元之间的相互作用。我们使用高密度微电极阵列(MEA),配备2304个记录 电极,研究了两种神经元培养配置:100%谷氨酸能(100E)和75%谷氨酸能/25% γ-氨基丁酸能(75E25I)神经元。这使我们能够全面表征在56天 in vitro 时成熟培 养物所表现出的自发电生理活动,此时GABA转变已经发生。我们还通过电刺激探 索了异质性的影响,发现100E配置的反应可靠,而75E25I则需要更多的参数调整以 改善反应。用BIC进行化学刺激仅在75E25I条件下显示出发放和爆发活动的增加, 而APV和CNQX则对两者的动态和功能连接产生了显著改变。我们的发现推动了对 多样化神经元相互作用及其在网络活动中作用的理解,为神经系统疾病的潜在治疗 干预提供了见解。总体而言,这项工作有助于开发一个有价值的人类基础 in vitro 系统,用于研究生理和病理条件,强调了神经元多样性在神经网络动态中的关键作 用。
¶ 1 介绍
人脑的特点是具有多种复杂特征,这些特征对于创建一个 忠实的体外功能模型至关重要。这些特征包括整合、调制、 三维性,以及最重要的异质性(Bro ga et al., 2023)。在这 个背景下,异质性意味着存在多种具有不同特征和功能的神 经元。在人脑中,特别是在皮层和海马等区域,神经网络主 要由两种关键类型的神经元组成:谷氨酸能神经元,占网络 的70-80%,以及GABA能神经元,占剩余的20-30%(Sahara et al., 2012)。这些神经元在协调神经通信中发挥着关键作用, 其中谷氨酸能神经元执行兴奋性(E)功能,而GABA能神经 元则承担抑制性(I)功能。这两种神经元之间的平衡,通常 被称为“E/I平衡”,是极其脆弱的。打破这种平衡可能导致 严重的神经退行性疾病的发生,如癫痫或精神分裂症(Robert s, 1984;Grent-’t-jong et al., 2018),以及神经发育和自闭症 谱系障碍(Pietropaolo and Provenzano, 2022)。尽管异质性在 这些过程中发挥着关键作用,但在使用人诱导多能干细胞(hi PSCs)构建的神经网络模型中,它受到的关注有限。最近, 我们小组的一项研究展示了从hiPSCs获得的均质和异质神经 培养物的可行性和稳定性,并且E/I比率得到了精细控制(Par odi et al., 2023)。在那项研究中,我们监测并表征了在标准 低密度微电极阵列(MEA)上生长的hiPSCs衍生神经元在其 体外发育过程中的自发电生理活动。
通过利用我们(Parodi et al., 2023; Zanini et al., 2023)和其 他人(Mossink et al., 2021a; Wang et al., 2023)之前的研究成 果,并利用最近在MEA技术方面的进展,该技术现在也依赖 于高密度阵列(Amin et al., 2016; Ronchi et al., 2021),我们 在这里迈出了一步,为科学界提供了一个基于人类的体外系 统,该系统在研究广泛的生理和病理条件方面具有显著潜力 。
我们的研究集中在两种不同的神经元培养配置上,这些配 置稳定地与具有2304个记录电极的高密度MEA(3Brain Gmb H)耦合。第一种配置仅由纯假定的谷氨酸能神经元组成(称 为100E),而第二种配置则由75%的兴奋性神经元和25%的抑 制性神经元组成(称为75E25I)。这些配置使我们能够探索 成熟网络中的自发电生理活动(即,在体外56天时),从而 全面表征神经元培养。我们通过进行电刺激来探索异质性的 影响,以观察两种配置在诱发活动方面可能存在的差异性效 应。最后,我们研究了作用于谷氨酸能和GABA能神经元的药 物引入如何影响监测网络的动态和功能连接。
我们发现电刺激在100E配置中有效地产生可靠的反应。然 而,在75E25I的情况下,需要更彻底的参数调优阶段,因为 电流幅度的增加在诱发反应中显示出改善,尽管与100E配置 相比仍然不够。至于化学刺激,BIC对100E网络的动态和连接 性没有产生重大变化,而APV和CNQX在两种配置中都造成了 剧烈的变化。
我们的结果是向揭示不同神经元类型之间复杂相互作用迈出的重要一步,并通过高密度MEA推进我们对这些相互作用如何支撑网络活动的理解,从而为各种神经系统疾病的潜在治疗干预提供了启示。
¶ 2 材料与方法
¶ 2.1 伦理声明
实验方案已获得欧洲动物保护立法(2010/63/EU)、意大利卫生部根据D.L. 116/1992的批准,以及热那亚大学的指导方针(Prot. 75F11.N.6JI, 08/08/18)。我们使用了两条先前表征的hiPSCs细胞系(Mossink等,2021a)。这两条细胞系均由成纤维细胞生成。对照细胞系1(C1,健康的30岁女性)通过外源性重编程进行重编程(Coriell医学研究所,GM25256)。对照细胞系2(C2,健康的51岁男性)通过非整合性仙台病毒进行重编程(比利时鲁汶KULSTEM iPSC核心设施,KSF-16-025)。我们从Frega博士(特温特大学)处以冷冻小瓶的形式获得了hiPSCs细胞系。我们声明研究是根据《赫尔辛基宣言》中所体现的原则以及当地法定要求进行的。我们声明所有参与者均已书面知情同意参与研究(Coriell医学研究所,GM25256和比利时鲁汶KULSTEM iPSC核心设施,KSF-16-025)。我们声明研究涉及不可识别的人类受试者,确认参与者的匿名性得到了完全保护。
¶ 2.2 HiPSCs培养
我们使用了两条先前表征的基因修饰hiPSCs细胞系,以获 得均一的兴奋性和抑制性神经元群体(图1A),这得益于转 录因子Neurogenin-2(Ngn2)和Achaete-scute同源物1(Ascl1 )的强制表达(Mossink等,2021a)。我们从Frega博士(特 温特大学)那里收到了冷冻小瓶中的hiPSCs细胞系。谷氨酸 能神经元来源于对照细胞系1(C1,健康的30岁女性,Ngn2 ),而GABA能神经元则来源于对照细胞系2(C2,健康的51 岁男性,Ascl1)。细胞被解冻并在E8Flex培养基(赛默飞世 尔科技)中维持,添加了以下补充成分:E8补充剂(2%,赛 默飞世尔科技)、青霉素/链霉素(1%,西格玛-阿尔德里奇 )、G418(50 µg/ml,Sigma-Aldrich) 和嘌呤霉素 (0.5 µg/ml, Sigma-Aldrich)。为了 将hiPSCs培养物分化为神经元,使用ReLeSR (StemCell Techn ologies) 使细胞群体脱离,并用上述补充培养基与RevitaCell (1 %, Thermo Fisher Scientific) 一起铺板,以促进细胞的恢复, 同时添加多西环素 (4 µg/ml, Sigma-Aldrich) 和福斯可林 (4 µg/ ml, Sigma-Aldrich) 以诱导早期诱导神经元 (iNs) 的分化。在经 过约3天的多西环素和福斯可林处理后,hiPSCs可以被视为分 化为早期神经元 (Frega et al., 2017; Mossink et al., 2021a)。培 养物在稳定条件下(37◦C, 5.5% CO2, 95%湿度气氛)在培养 箱中维持。每2天更新50%的培养基。
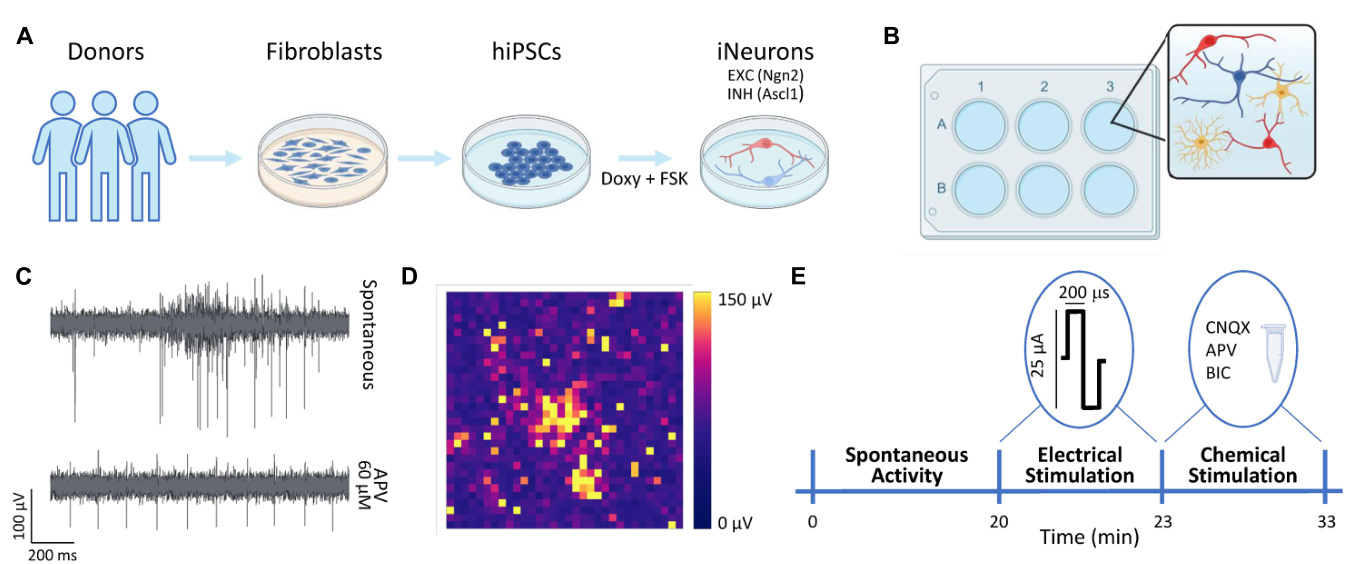
¶ 2.3 神经网络培养
神经网络采用了Wang等人(2023)提出的适应性协议进 行处理。简而言之,3Brain设备在乙醇(70%,1小时)和紫 外线(45分钟)中进行了灭菌。在培养基铺设的前一天,这 些设备用聚-L-鸟氨酸(50 µg/ml,Sigma-Aldrich)和人类层 粘连蛋白(50 µg/ml,BioLamina)预涂覆过夜(Hyvärinen等 ,2019)。在体外培养的第0天(DIV 0),神经元(iNs)与 大鼠星形胶质细胞(As)共同铺设,以促进神经元的生长和 成熟(Banker,1980;Tang等,2013;Bellot-Saez等,2018) ,比例为70:30(iNs:As)(图1B)。为了获得均匀配置(E:I 100:0),仅铺设了谷氨酸能神经元,我们将这种配置称为100 E。为了获得异质配置,谷氨酸能和GABA能神经元被混合在 一起。比例为E:I 75:25。我们将这种配置称为75E25I。神经元培养的 密度为1600个细胞/mm2。在第一周,神经元培养在含有以下 补充成分的Neurobasal培养基(Thermo Fisher Scientific)中维 持:B27补充剂(2%,Thermo Fisher Scientific)、青霉素/链 霉素(1%,Sigma-Aldrich)、稳定的L-谷氨酰胺(1% Gluta Max 100x,Thermo Fisher Scientific)、人脑源性神经营养因 子(BDNF,10 g/ml,Sigma-Aldrich)、人神经营养因子-3( NT-3,10 ng/ml,Sigma-Aldrich)、多西环素(4 µg/ml,Sig ma-Aldrich)和福斯可林(4 µg/ml,Sigma-Aldrich)。在7 DI V后,向上述补充培养基中添加胎牛血清(FBS,2%,Therm o Fisher Scientific)以支持星形胶质细胞。在14 DIV后,从培 养基中去除了多西环素和福斯可林。MEAs上的神经元培养在 稳定条件下(37◦C,5.5% CO2,95%湿度气氛)在培养箱中 维持至59 DIV。每2天更新50%的培养基。
¶ 2.4 设置和电生理记录
神经元培养物被铺在商业CorePlate 6孔设备上(3Brain Gm bH)。这些设备为每个孔集成了2304个电极,电极间距为60 µm,电极大小为25 µm,能够记录细胞外信号轨迹(图1C) ,从而提供整个网络的高分辨率尖峰活动记录。2304个电极 排列在一个48 × 48的网格中(图1D)。电生理记录在DIV 59 时使用HyperCam系统(3Brain GmbH)进行。在离开培养箱 后的10分钟适应期后,自发神经元活动在稳定条件下(37◦C,5% CO2)记录了20分 钟,并以10 kHz的频率采样。随后,神经元培养物被用双相 (先正后负)脉冲刺激,脉冲幅度为25或35 µA(峰对峰), 持续时间为200 µs。刺激以0.1 Hz的频率发出,每次刺激会话 总共进行20次刺激。每个孔的刺激位置通过选择在自发活动 记录中显示相关尖峰活动的电极来确定。最后,通过将化学 化合物添加到培养基中进行化学刺激,即,使用Bicuculine( BIC,30 µM)阻断GABA受体,D-2-氨基-5-磷酸戊酸(D-AP V,60 µM)阻断NMDA受体,以及6-氰基-7-硝基喹啉-2,3-二 酮(CNQX,30 µM,Sigma-Aldrich)阻断AMPA受体。在药 物给药后记录电生理活动10分钟。该协议流程在图1E中总结 。
¶ 2.5 数据分析
在以下小节中,我们展示了对数据进行的分析以及用于表征神经元培养物的特征。这些特征在术语表中进行了总结(补充材料)。
¶ 2.5.1 刺激和爆发活动
离线数据分析使用BrainWave软件(3Brain GmbH)和在M ATLAB(The Mathworks, Natick, MA, USA)中开发的定制内 部代码进行,以提取描述自发网络活动的参数。特别地,使 用精确时间尖峰检测(PTSD)算法(Maccione等,2009)进 行尖峰检测。单个尖峰检测的噪声阈值设定为基线噪声标准 差的10倍。PTSD所需的参数包括峰值寿命期(设定为2毫秒 ),与尖峰的持续时间相关,以及不应期(设定为2毫秒), 即连续尖峰之间经过的最短时间。每个培养物的平均发射率 (MFR,即单位时间内的尖峰数量)通过对每个活跃通道的 发射率进行平均计算。如果一个通道的发射率大于0.1尖峰/秒 ,则认为该通道是活跃的(Mossink等,2021b)。通过设定 神经元间尖峰间隔(ISI)的阈值和属于爆发事件的最小尖峰 数量来检测爆发。如果至少发生5个尖峰且ISI低于100毫秒, 则定义为一个爆发。如果其爆发率大于0.4爆发/分钟,则认为 一个活跃通道正在爆发(Mossink等,2021b)。通过爆发检 测,我们推导出平均爆发率(MBR,即每分钟的爆发数量) 、爆发持续时间(BD)和随机尖峰的百分比(RS,即不属于 爆发的尖峰数量)。如果满足以下条件,我们将事件定义为 网络爆发:在100毫秒窗口内由至少50个连续尖峰组成的活动 ,且至少招募了15%的通道。通过网络爆发检测,计算网络爆 发持续时间(NBD)。
¶ 2.5.2 基于互相关的分析
基于互相关的分析是使用BrainWave软件(3Brain)进行的 。简而言之,互相关(CC) 测量神经元或电极发放(目标)的频率作为时间的函数,与 另一个事件的发放(参考)相关。给定参考电极 x 和目标电 极 y,相关函数 Cxy(τ) 表示在时间 t 时观察到火花在火花列 y 中的概率,前提是火花列 x 在时间 t 时有一个火花。交叉相关 图被定义为在选择的相关窗口(W = 100 ms)上计算的相关 函数,并具有定义的分箱(分箱大小 = 4 ms)。交叉相关图 中的显著偏差,即峰值(兴奋性连接)或谷值(抑制性连接 ),是功能性兴奋性或抑制性连接的指示。峰值的不同幅度 可以与神经火花列之间不同水平的同步性存在相关:我们称 这个参数为 Cpeak,它被计算为交叉相关图的最大值在 [0 和 1] 之间的归一化值。我们计算时间延迟为交叉相关图明显单侧 峰值相对于原点的位移,这表明与突触延迟相对应的潜伏期 。
通过考虑从交叉相关分析中获得的连接,连接矩阵是通过 执行基于分布的阈值计算的,假设阈值为 µ + 2σ,其中 µ 和 σ 分别表示值的平均值和标准差。通过这种方式,我们获得了 连接图,其中报告了所有功能连接(边)和涉及的神经元( 节点)。从图中,我们计算了几个特征,以定量探索电生理 活动随着网络拓扑的变化。我们计算了小世界指数(SWI), 以评估网络的整合水平及其拓扑,采用了 Humphries 和 Gurne y(2008)的定义。为了量化网络发展出的功能连接的数量, 我们计算了网络内部的平均节点数和链接数。最后,为了表 征每个节点的连接度,我们考虑了每个节点的入度和出度, 表示进入和离开边的数量。我们计算了总节点度,作为每个 节点的入度和出度之和。由于最后三个参数(即节点数、链 接数和节点度)与活跃区域内细胞的数量相关,我们决定将 化学刺激获得的值相对于同一网络的自发活动进行归一化, 从而计算这些参数的变化百分比(Var)。
¶ 2.5.3 电刺激引发的活动
为了获得关于诱发神经元活动的定量信息,我们计算了刺 激后时间直方图(PSTH)。PSTH是通过考虑刺激发射后的2. 4秒时间窗口来计算的。具体来说,我们将每个时间窗口划分 为4毫秒的区间,并计算每个时间区间内发生的尖峰数量。PS TH面积(即尖峰总数)低于4的电极被排除在分析之外,因为 它们被认为是非活跃的。为了确定刺激的有效性,我们计算 了能够诱发反应的刺激百分比,基于总共20个刺激。此外, 为了评估神经网络的响应性,我们通过考虑刺激发射后的1.2 秒时间窗口来计算PSTH的面积,并计算潜伏期,表示刺激发 射与第一次诱发尖峰之间的时间。
¶ 2.5.4 统计分析
统计分析使用 MATLAB(The MathWorks,Natick,MA ,USA)进行。我们使用 Kolmogorov-Smirnov 正态性检验评 估数据的正态分布。由于数据不符合正态分布,我们进行了 非参数 Kruskal-Wallis 检验。关于化学刺激,我们的统计检验 评估了每种条件与自发活动的关系,而不涉及两种不同配置 (即 100E 和 75E25I)之间的比较。由于每种药物在不同的 MEA 上进行测试,使得每组相互独立,我们没有比较不同药 物之间的效果。为了确定统计学上显著的差异,p 值 < 0.05 被视为显著。为了最小化假阳性的风险,我们通过验证每个 假设在显著性水平为 α/η 的情况下,利用 Bonferroni 校正调整 了 p 值,其中 α 是统计显著性水平,η 是假设的数量。图表上 的星号表示与调整后的 p 值相比的统计显著差异。文本中的 所有值均以均值 ± 标准差报告,除非另有说明。
¶ 3 结果
¶ 3.1 自发活动
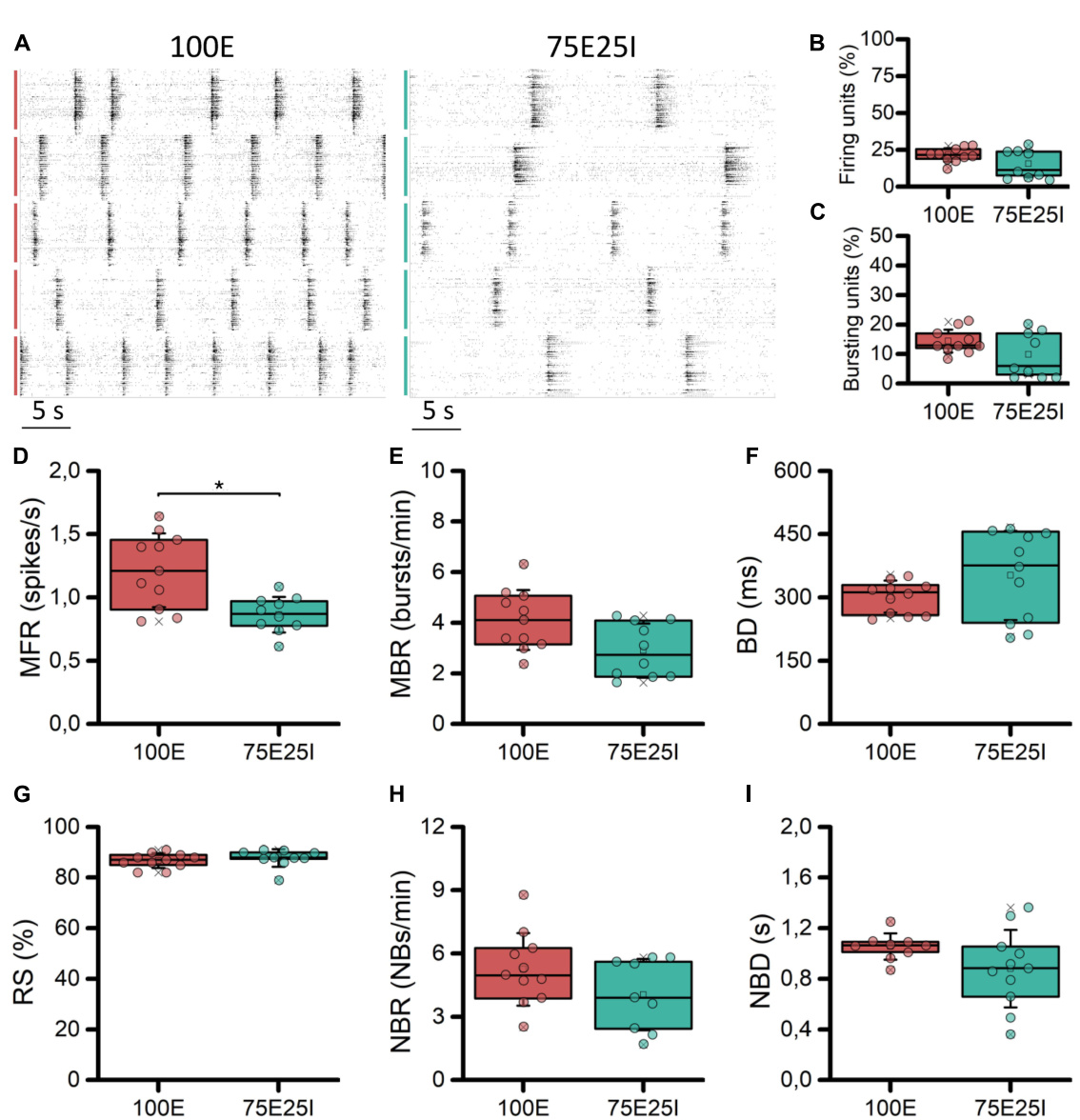
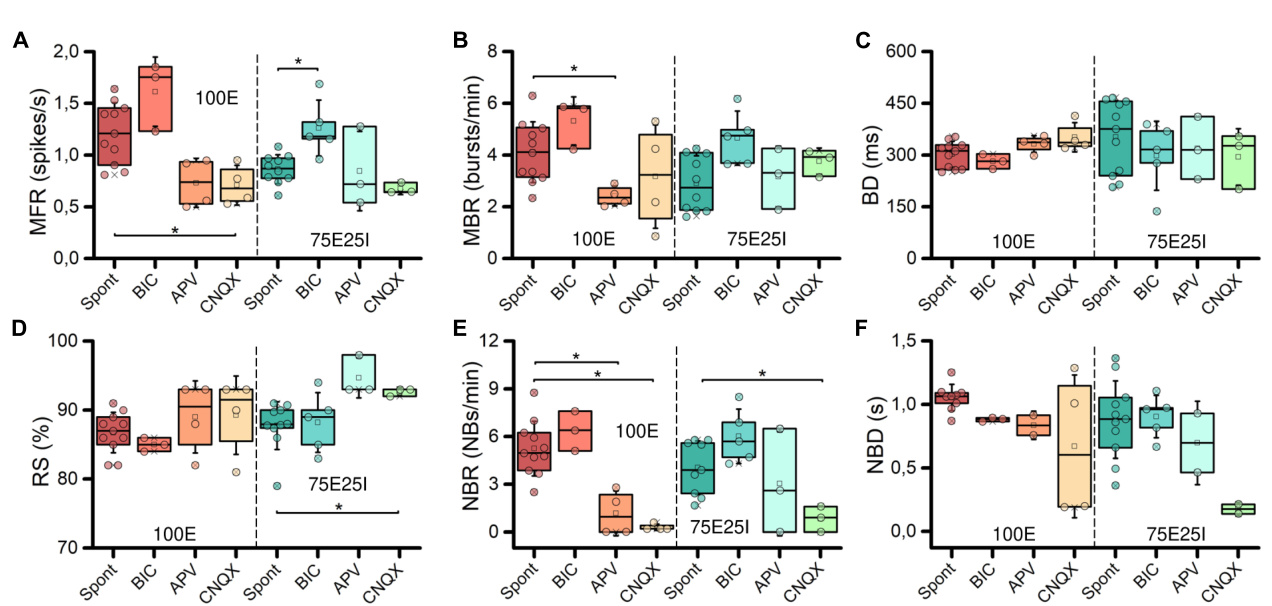
为了表征成熟均质(100E, N = 11)和非均质(75E25I, N = 11)神经元培养物在高密度MEA上稳定耦合的差异行为, 我们首先评估了它们的自发电生理活动。通过观察两个代表 性多孔板的光栅图(图2A),我们定性地观察到100E和75E2 5I的活动存在差异。具体而言,100E的放电水平定性上高于7 5E25I配置。此外,完全兴奋性网络的特征还包括持续的爆发 活动。另一方面,两个配置的爆发和网络爆发事件的持续时 间似乎是可比的。为了量化这一点,我们首先计算了放电和 爆发单元的数量,以确定神经元培养物在多大程度上均匀附 着并有效耦合到设备表面。放电单元的百分比(图2B)分别 为100E的21.61 ± 4.54%和75E25I的15.47 ± 9.05%,显示出细 胞在设备上的附着是可比且令人满意的,考虑到高密度设备 单元的20%对应于超过450个电极。对于爆发单元(图2C), 同样的结果被获得,其中100E显示为14.40 ± 3.86%,而75E25 I显示为9.89 ± 7.22%。从定量的角度来看,之前在光栅图中 观察到的差异通过MFR的计算(图2D和补充表1)和MBR( 图2E和补充表1)得到了反映,其中100E在这两个参数上均显 示出高于75E25I配置的值(补充表1, 2)。此外,爆发持续时 间(BD,图2F和补充表1)和随机尖峰的百分比(RS,图2G 和补充表1)没有显示出显著差异(补充表2)。虽然存在明 显的差异。在光栅图(图2A)和箱线图(NBR,图2H)中,网络突发率 明显,但对于这一特征(补充表2),以及两种配置之间的网 络突发持续时间(NBD,图2I),没有出现统计学上显著的 差异。
¶ 3.2 电刺激
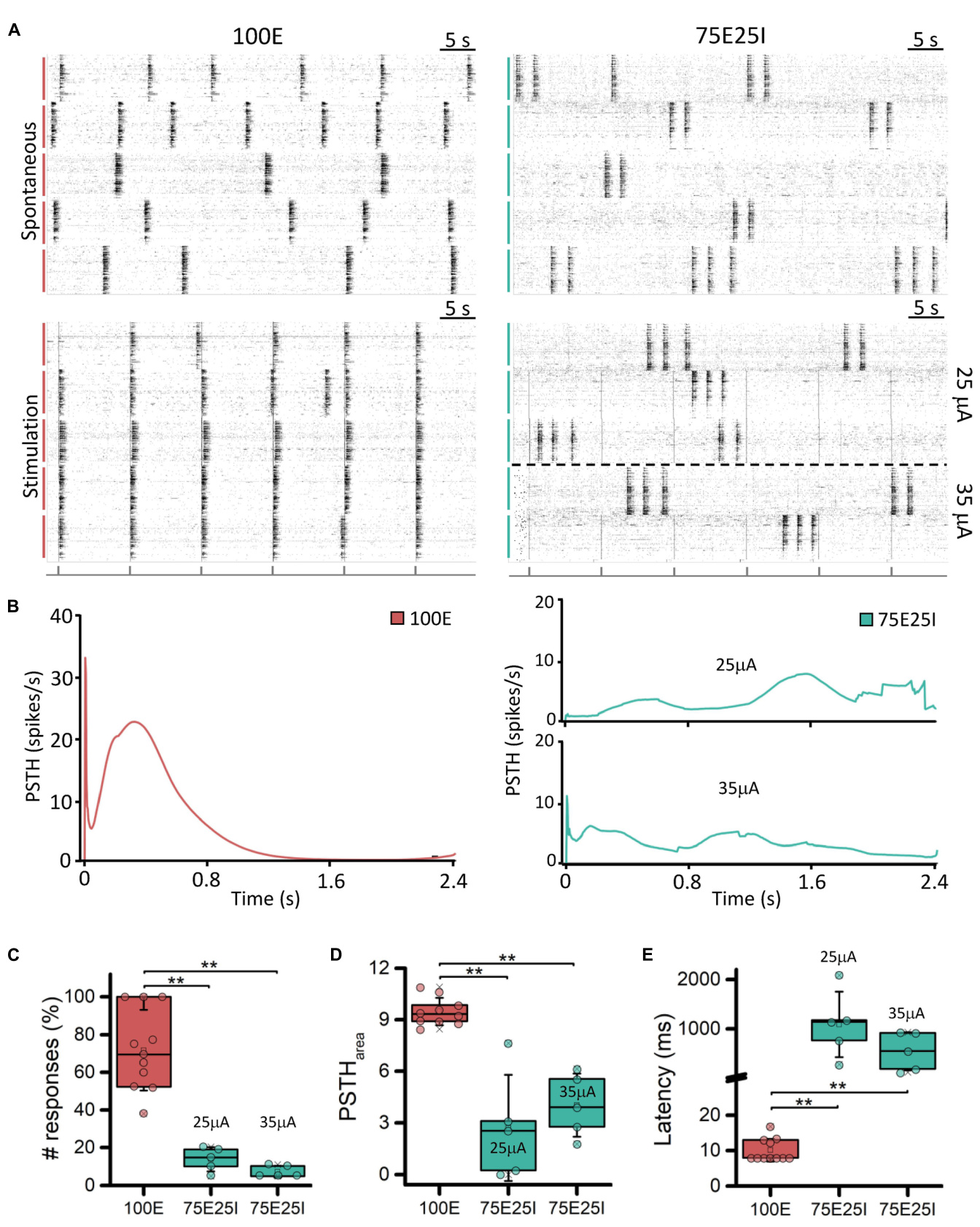
为了更好地表征我们的实验模型并测试它们对电刺激的响 应,我们施加了不同电流幅度的电流刺激。观察图3A中的光 栅图,可以定性地欣赏到电刺激对网络的影响。特别是,100 E网络(N = 11)对所有刺激均有积极反应。实际上,在五个 记录的孔中,网络活动在刺激发出时对齐,而上面的光栅图 则显示出培养物在自发活动期间独立地表现出同步网络事件 。关于75E25I配置(N = 10),刺激的效果不如100E,网络活 动几乎没有变化,且在使用最高电流幅度(即35 µA)时也没 有明显的与刺激发出同步。观察PSTH(图3B),100E的反应 显示出典型的形状,其中我们欣赏到在前十毫秒内的早期反 应,特征是一个尖锐的峰值。早期反应随后被一个宽广的晚 期反应所跟随,结束于大约1秒。总体而言,100E PSTH勾勒 出了网络的高招募和积极反应。另一方面,75E25I显示出不 稳定的PSTH,特征是反应的不规则形状,可能是由于网络本 身的基线活动,确认了光栅图所定性暗示的内容,无论是在2 5 µA(底部)还是35 µA(顶部)。唯一可察觉的差异是35 µ A刺激下早期和晚期反应的迹象,尽管小于在100E网络中引发 的反应。关于反应数量的量化(图3C和补充表3),100E平均 对71.70%的刺激作出反应,因此显示出良好的培养物招募。 后者的观察通过查看100E PSTH面积(图3D和补充表3)和潜 伏期(图3E和补充表3)得到了进一步确认。另一方面,75E2 5I在25和35 µA刺激下分别对13.83%和7.26%的刺激作出反应 ,且在使用的幅度之间没有观察到显著差异(补充表4)。然 而,35 µA刺激引发的反应略高(图3D和补充表3)且更短( 图3E和补充表3)于25 µA。
¶ 3.3 化学刺激
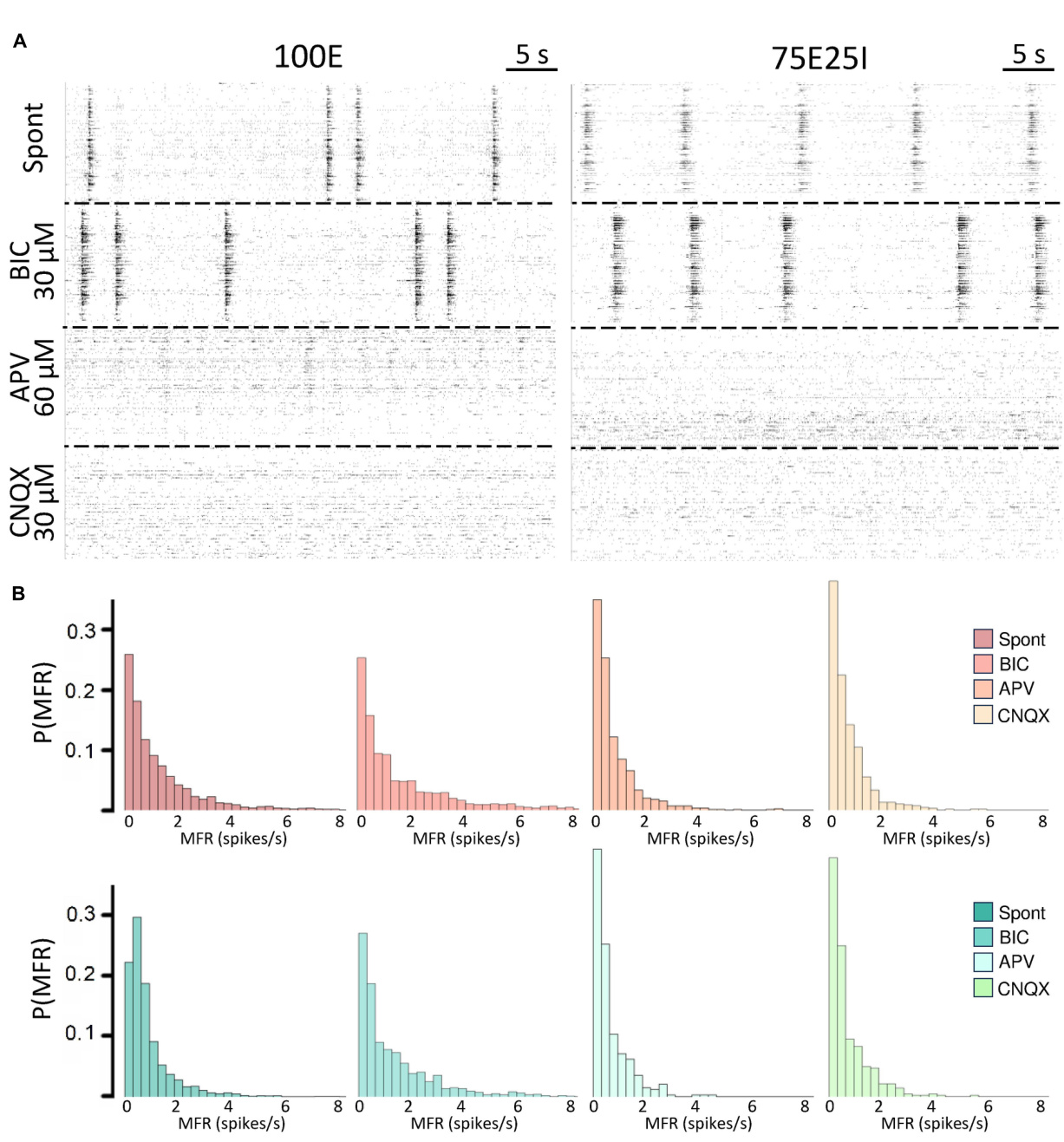
为了进一步探索我们神经网络配置的动态(即100E和混合 75E25I),我们分析了化学刺激引发的反应。通过使用CNQX (N100E = 4,N75E25I = 3)和APV(N100E = 4,N75E25I = 3) ,这两者分别是AMPA和NMDA受体的阻滞剂,我们观察到在两种配置中,发放和网络爆发活动显著减少( 图4A)。然而,在初步的定性评估中,似乎BIC对自发活动 没有产生明显变化(N100E = 3,N75E25I = 5,图4A)。为了 精确确定这些药物对神经元活动的影响程度,我们计算了两 种配置的发放模式分布(图4B)。在施用BIC后,100E神经 网络表现出与自发发放分布相似的模式。75E25I没有显示出 很大的差异,除了峰值(从第二个箱到第一个箱)的小幅移 动和与更高发放率相关的箱的轻微增加。在施用CNQX和APV 后,两种配置都明显向较低发放率移动。这种移动的特征是 在范围内出现了一个明显的峰值。MFR值在0到0.4次/秒之间。从定量的角度来看,MFR(图5A 和补充表5、7)在施用CNQX后相对于自发活动显示出较低的 值,适用于两种配置(补充表6、8)。同样,APV导致放电 活动减少,尽管与自发状态相比未显示出统计学差异(补充 表6、8)。另一方面,BIC在75E25I配置中显著增加了放电率 (p = 0.0071)。对于两种配置的MBR(图5B和补充表5、7) 也可以观察到类似的趋势,而药物的施用对爆发持续时间没 有影响(图5C和补充表5、7)。有趣的是,当施用CNQX和A PV时,RS(图5D和补充表5、7)在两种配置中显示出上升趋 势,表明爆发事件的分散。 在神经网络内。实际上,主要显著差异出现在网络爆发率(N BR,图5E和补充表5-8):CNQX和APV完全消除了网络爆发 事件,导致NBR接近零,特别是在施用CNQX后。因此,NB D也减少了(图5F和补充表5、7)。
¶ 3.4 功能连接性
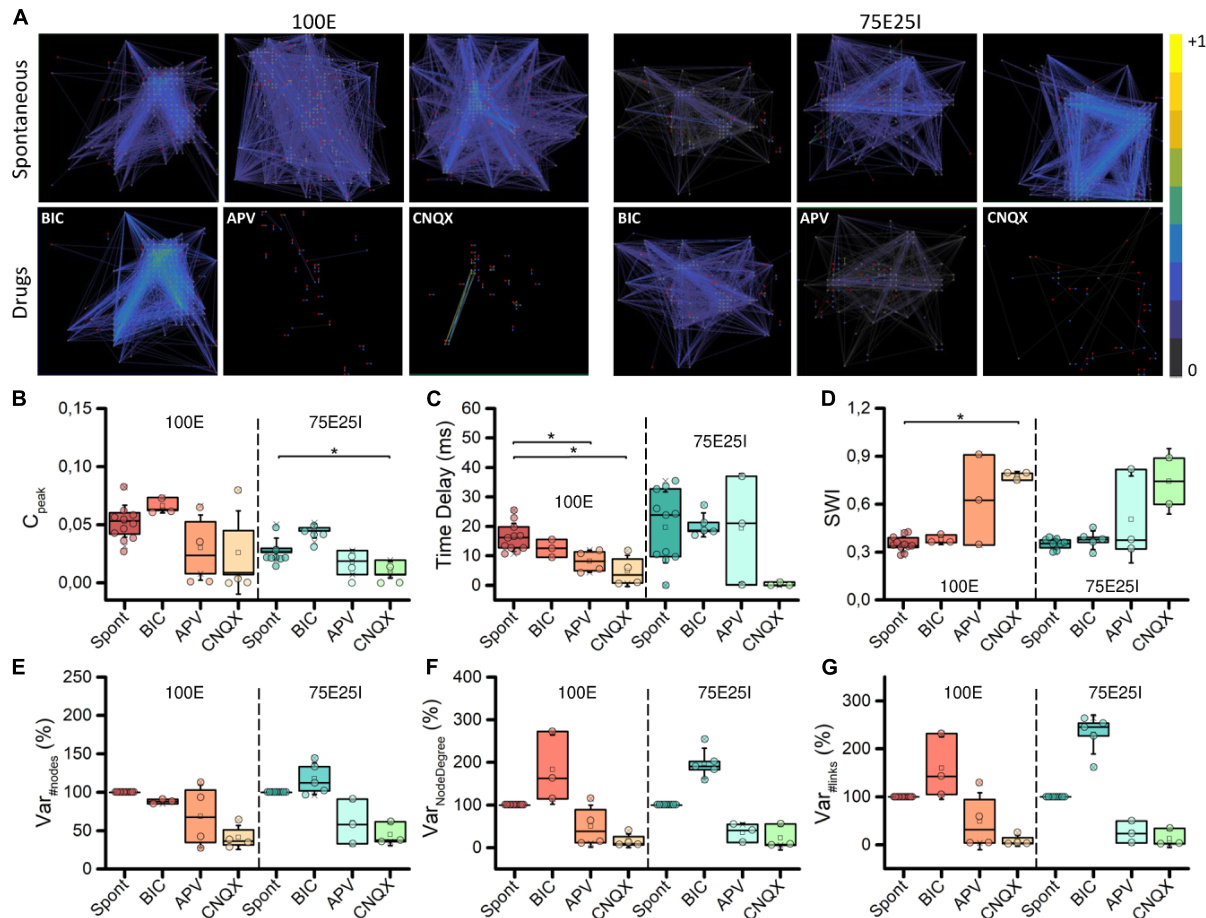
为了加深hiPSCs衍生神经网络的突触生理学,我们研究了 图的拓扑结构以及化合物施用对功能连接性的影响(图6A) 。关于从自发活动分析中获得的图, 拓扑显示出一种定性的无尺度组织:存在少数高度连接的节 点(枢纽)与许多其他节点,自我组织并为100E和75E25I配 置产生分支结构。关于自发条件,BIC管理并未导致图的拓扑 发生显著变化,但倾向于增强连接的强度,从两个配置的图 边缘更强烈的颜色可以看出(图6A)。CNQX引起了两个配 置的连接性明显变化,极大地修改了拓扑,并减少了链接和 节点的数量。对于APV的使用也可以提出类似的考虑,尽管 与CNQX相比,它导致的节点和链接的减少较少。为了量化上 述获得的定性结果,我们计算了交叉相关指数Cpeak (见“材 料和方法”部分)。
我们发现,在自发活动期间,Cpeak 值几乎与 100E 和 75E25I 的 BIC 给药期间获得的值相当(即,自发与 BIC 之间没有统 计学差异,见图 6B 和补充表 9-12)。相反,自发活动期间的 Cpeak 平均值高于 CNQX 和 APV 计算得出的值(见图 6B 和补 充表 9、11)。时间延迟(见图 6C),作为信息传输速度的 指标,在使用药物时显示出较低的值,但仅在 100E 的 CNQX 和 APV 使用情况下具有统计学显著性(补充表 10、12)。在 造成拓扑显著变化后,Cpeak 值的降低(表明连接性增强)导 致在使用 CNQX 和 APV 后两种配置中小世界指数(SWI,见 图 6D)更高,尽管在 100E 配置中仅在使用 CNQX 时始终显 著(补充表 10、12)。这表明,药物给药后剩余的连接表现 出更接近小世界组织的拓扑。与上述情况并行,使用 CNQX 和 APV 后节点数量的变化百分比大幅减少(见图 6E)。这些 药物对网络连接性产生了破坏性影响,导致节点数量(见图 6 E)和链接数量(见图 6G)的减少。剩余的节点无法弥补节 点数量的减少,导致节点度数(见图 6F)的同时下降。相反 ,使用 BIC 导致节点数量相当。然而,与自发阶段相比,网 络能够建立强连接性,导致节点度数(见图 6F)和链接数量 (见图 6G)的增加。
¶ 4 讨论
在本研究中,我们调查了人类诱导多能干细胞衍生的神经 网络的活动性和功能连接性,特别是均质网络(由100%兴奋 性神经元组成,记作100E)和异质网络(由75%兴奋性和25% 抑制性神经元组成,记作75E25I)。我们的主要目标是全面 理解这些网络,特别关注阐明异质性的意义。为了实现这一 目标,我们利用高密度微电极阵列广泛分析了均质和异质神 经网络的电生理活动。我们在DIV 56进行实验,因为GABA的 转变发生在大约DIV42之后(Mossink等,2021a)。我们的研 究包括评估自发和诱发的神经活动,这些活动是通过电刺激 和化学调节引发的。
我们证明了细胞有效地并且以合理的数量附着在高密度设 备的表面,显示出超过350个活跃电极。关于自发的电生理活 动,我们观察到均匀网络的发放和爆发活动比异质网络更高 。这与之前研究中低密度设备(如60电极MEA)的发现形成 对比(Parodi等,2023)。我们的结果可能与高密度设备的特 性有关,这些设备体积更小,能够在单细胞水平上记录活动 。这一能力使我们能够推导出与传统MEA观察到的参数不同 的参数。
我们随后评估了神经元培养物对两种配置(即100E和75E2 5I)电刺激的响应性。我们的发现揭示了这两种配置之间显著 的差异。100E网络对电刺激表现出强烈且同步的响应,具有 特征性。
PSTH 形状,表明高网络招募。此外,这些人源网络显示出更 长的响应,持续约 1.2 秒,这与通常在原代啮齿动物源网络中 观察到的响应形成对比,后者持续 500-600 毫秒(Chiappalon e et al., 2008; Vajda et al., 2008; Le Feber et al., 2010; Scarsi et al. , 2017)。另一方面,75E25I 网络即使在最高电流幅度下也表 现出低响应性。需要进一步的研究来阐明这些差异背后的机 制,并优化特定网络配置的刺激协议。
关于化学刺激,我们评估了药物施用后体外神经元的活动 。我们研究了对兴奋性神经传递(通过应用APV和CNQX减少 谷氨酸能信号传递实现)和抑制性神经传递(通过BIC应用减 少GABA能信号传递实现)的影响。与小鼠来源和人类胚胎干 细胞来源的神经元的结果一致(Bonzano et al., 2006; Ylä-Outin en et al., 2010),我们显示APV和CNQX主要通过抑制网络的 爆发活动来减少网络的整体活动,导致少量孤立的尖峰。另 一方面,正如预期的那样,BIC的应用在这方面没有显示出显 著差异。 对于100E配置的自发活动,同时它导致75E25I网络的发射和 爆发活动增加。
先前的研究使用人类iPSC结合低密度设备进行了毒性测试 和特征分析(Odawara et al., 2016; Frega et al., 2019; Hyvärinen et al., 2019; Kang et al., 2022),这限制了分析的深度。实际上 ,这些设备缺乏进行详细调查的能力,例如连接性分析,这 对于理解网络突触动态至关重要。相比之下,使用高密度设 备,如在大鼠模型中所示(Ullo et al., 2014),提供了显著的 优势。在我们的研究中,我们使用了高密度微电极阵列,这 提供了细胞分辨率,使我们能够全面探索单个细胞层面的功 能连接。然后,我们能够构建网络的功能图,并提取多个与 图相关的指标,以突出它们的功能和拓扑组织。我们发现BIC 影响了75E25I网络的连接性,通过增加链接数量和节点度, 而APV和CNQX则影响了两种配置的连接性,通过全局减少链 接的强度和数量。尽管如此,小世界指数达到了CNQX的最大值表明,在更多随机尖峰的情况下,小世界组织 更有可能发生。这可以表明,较低水平的爆发活动可能是创 造更合理的体外系统的关键,类似于人脑中观察到的功能连 接和特性(Watts和Strogatz,1998;Bassett等,2006;Caliand ro等,2017)。
总之,来源于hiPSCs的神经网络与高密度阵列相结合,可 以为更全面地探索复杂神经电路铺平道路。这种对低级功能 的增强理解将对阐明生理和病理条件下的高级脑行为起到重 要作用。具体而言,针对与E/I失衡相关的神经发育疾病(Piet ropaolo和Provenzano,2022),我们的网络可以用于模拟发育 的初始阶段,作为研究这些疾病的强大模型。
¶ 参考文献
Amin, H., Maccione, A., Marinaro, F., Zordan, S., Nieus, T., 和 Berdondini, L. (2016). 具有4096电极阵列的3个月培养的人类iPS衍生神经网络的电响应和自发活动特征。前沿神经科学. 10:121. doi: 10.3389/FNINS.2016.00121
Banker, G. A. (1980). Trophic interactions between astroglial cells and hippocampal neurons in culture. Science 209, 809–810. doi: 10.1126/science.7403847
¶ 补充材料
本文的补充材料可以在线找到,网址为:https://www.frontiersin.org/articles/10.3389/fnmol.2024.1304507/full#supplementary-material
¶ 参考文献
Amin, H., Maccione, A., Marinaro, F., Zordan, S., Nieus, T., 和 Berdondini, L. (20 16). 具有4096电极阵列的3个月培养的人类iPS衍生神经网络的电响应和自发活 动特征。前沿神经科学. 10:121. doi: 10.3389/FNINS.2016.00121
Banker, G. A. (1980). Trophic interactions between astroglial cells and hippocampal neurons in culture. Science 209, 809–810. doi: 10.1126/science.7403847
Bassett, D. S., Meyer-Lindenberg, A., Achard, S., Duke, T., and Bullmore, E. (2006). Adaptive reconfiguration of fractal small-world human brain functional networks. Proc. Natl. Acad. Sci. U S A. 103, 19518–19523. doi: 10.1073/pnas.0606005103
Bellot-Saez, A., Cohen, G., van Schaik, A., Ooi, L. W., Morley, J., and Buskila, Y. (2018). Astrocytic modulation of cortical oscillations. Sci. Rep. 8:11565. doi: 10.1038/ s41598-018-30003-w
Bonzano, L., Bove, M., 和 Martinoia, S. (2006). NMDA 和非 NMDA 受体拮抗剂 对培养皮层网络动态行为的影响。神经计算 69, 1897–1903. doi: 10.1016/j.neuc om.2005.11.014
Bro ga, M., Poggio, F., Callegari, F., Tedesco, M., 和 Massobrio, P. (2023). 模块 化和神经元异质性:影响体外神经药理实验的两个特性. Front. Cell. Neurosci. 1 7:1147381. doi: 10.3389/ fncel.2023.1147381
Caliandro, P., Vecchio, F., Miraglia, F., Reale, G., Della Marca, G., La Torre, G., 等. (2017). 急性中风中皮层连接变化的小世界特征. 神经康复. 神经修复 31, 81 –94. doi: 10.1177/1545968316662525 Chiappalone, M., Massobrio, P., 和 Martinoia, S. (2008). 皮层集合中的网络可塑 性. 欧盟神经科学杂志 28, 221–237. doi: 10.1111/j.1460-9568.2008. 06259.x
Frega, M., Linda, K., Keller, J. M., Gümü¸s-Akay, G., Mossink, B., van Rhijn, J. R., 等. (2019). 通过增强的 NMDAR 信号传导介导的 Kleefstra 综合症模型中的神经 网络功能障碍. Nat. Commun. 10:4928. doi: 10.1038/s41467-019-12947-3
Frega, M., Van Gestel, S. H. C., Linda, K., Van Der Raadt, J., Keller, J., Van Rhijn , J. R., 等. (2017). 用于测量微电极阵列上网络活动的诱导多能干细胞的快速神 经分化. J. Visualized Exp. 2017:54900. doi: 10.3791/54900
Grent-’t-jong, T., Gross, J., Goense, J., Wibral, M., Gajwani, R., Gumley, A. I., 等. (2018). 精神分裂症中静息态伽马波段功率的变化揭示了疾病阶段之间的兴 奋/抑制平衡异常。ELife 7:e37799. doi: 10.7554/eLife.37799
Humphries, M. D. 和 Gurney, K. (2008)。网络“小世界特性”:一种确定典型 网络等价性的定量方法。PLoS One 3:e0002051。doi: 10.1371/journal.pone.00020 51 Hyvärinen, T., Hyysalo, A., Kapucu, F. E., Aarnos, L., Vinogradov, A., Eglen, S. J. , 等. (2019). 基于层粘连蛋白-521基质分化的人类多能干细胞衍生皮层网络的功 能特征:与大鼠皮层培养的比较。科学报告 9:106. doi: 10.1038/s41598-019-536 47-8
Kang, K., Kim, C. Y., Kim, J., Ryu, B., Lee, S. G., Baek, J., 等. (2022). 使用微电 极阵列(MEA)与hiPSC衍生神经元建立神经毒性评估及新精神活性物质(NP S)的评估。国际干细胞杂志 15, 258–269. doi: 10.15283/ijsc21217 Le Feber, J., Stegenga, J., 和 Rutten, W. L. C. (2010). 慢速电刺激对培养的老鼠 皮层神经元网络学习的影响。PLoS One 5:e8871. doi: 10.1371/journal.pone.00088 71
Maccione, A., Gandolfo, M., Massobrio, P., Novellino, A., Martinoia, S., 和 Chiap palone, M. (2009)。一种新算法用于精确识别细胞外记录的神经信号中的尖峰。 J. Neurosci. Methods 177, 241–249。doi: 10.1016/j.jneumeth.2008.09.026
Mossink, B., van Rhijn, J. R., Wang, S., Linda, K., Vitale, M. R., 和 Zöller, J. E. M . (2021a). Cadherin-13 是人类干细胞衍生神经网络中 GABA 能调节的重要调控 因子。分子精神病学 27, 1–18. doi: 10.1038/s41380-021-01117-x
Mossink, B., Verboven, A. H. A., van Hugte, E. J. H., Klein Gunnewiek, T. M., Pa rodi, G., Linda, K., 等 (2021b)。人类神经元网络在微电极阵列上是研究特定疾病 基因型-表型相关性的高度稳健工具。干细胞报告,16,2182–2196。doi: 10.10 16/j.stemcr.2021.07.001
小田原, A., 加藤, H., 松田, N., 和铃木, I. (2016). 人工诱导多能干细胞衍生的皮 层神经网络在长期培养中的生理成熟和药物反应. Sci. Rep. 6:26181. doi: 10.1038 /srep26181
Parodi, G., Bro ga, M., Pastore, V. P., Chiappalone, M., 和 Martinoia, S. (2023). 加深兴奋/抑制平衡在长期发展中与多电极阵列(MEAs)耦合的人类诱导多能 干细胞(iPSCs)衍生神经网络中的作用。神经工程杂志 20:056011. doi: 10.108 8/1741-2552/acf78b
Pietropaolo, S.,和 Provenzano, G.(2022)。社论:针对神经发育和自闭症谱 系障碍中的兴奋-抑制失衡。前沿神经科学 16:968115。doi: 10.3389/fnins.2022.9 68115 罗伯茨,E.(1984)。GABA相关现象、神经系统功能模型和癫痫。神经学年鉴,16,S77–S89。doi: 10.1002/ana.410160713
Ronchi, S., Buccino, A. P., Prack, G., Kumar, S. S., Schröter, M., Fiscella, M., 等. (2021). 通过高密度微电极阵列对人类iPSC衍生神经细胞系的电生理表型特征进 行表征。 Adv. Biol. 5:2000223. doi: 10.1002/adbi.202000223
撒哈拉,S.,柳川,Y.,奥利里,D. D. M.,和史蒂文斯,C. F.(2012)。皮层GABA能神经元的比例从皮层神经发生开始到成年期是恒定的。神经科学杂 志,32,4755–4761。doi: 10.1523/JNEUROSCI.6412-11.2012
Scarsi, F., Tessadori, J., Chiappalone, M., 和 Pasquale, V. (2017). 研究电刺激时 间分布对皮层网络反应的影响. BMC 神经科学. 18:49. doi: 10.1186/s12868-017-0 366-z 唐, X., 周, L., 瓦格纳, A. M., 马尔凯托, M. C. N., 穆特里, A. R., 盖奇, F. H., 等. (2013). 星形胶质细胞调节从诱导多能干细胞分化的人类神经元的发育时间表. 干细胞研究. 11, 743–757. doi: 10.1016/j.scr.2013.05.002
Ullo, S., Nieus, T. R., Sona, D., Maccione, A., Berdondini, L., 和 Murino, V. (201 4). 基于电生理记录和结构先验的大规模网络功能连接性估计,具有细胞分辨率 。前沿神经解剖学 8:137. doi: 10.3389/fnana.2014.00137
Vajda, I., Van Pelt, J., Wolters, P., Chiappalone, M., Martinoia, S., Van Someren, E., 等. (2008). 低频刺激诱导皮层网络中刻板活动的稳定转变. 生物物理学杂志. 94, 5028–5039. doi: 10.1529/biophysj.107.112730
王, S., Hesen, R., Mossink, B., Nadif Kasri, N., 和 Schubert, D. (2023). 从人类诱 导多能干细胞中生成谷氨酸能/GABA能神经元共培养,以表征体外E/I平衡. ST AR Protoc. 4:101967. doi: 10.1016/j.xpro.2022.101967
Watts, D. J. 和 Strogatz, S. H. (1998). “小世界”网络的集体动态. 自然 393, 44 0–442. doi: 10.1038/30918
Ylä-Outinen, L., Heikkilä, J., Skottman, H., Suuronen, R., Äänismaa, R., 和 Narkil ahti, S. (2010). 基于人类细胞的微电极阵列平台用于研究神经毒性. Front. Neuroe ng. 3:111. doi: 10.3389/fneng.2010. 00111
Zanini, G., Parodi, G., Chiappalone, M., 和 Martinoia, S. (2023). 研究人类iPSC衍 生神经网络与微电极阵列耦合时诱发反应的可靠性。APL Bioeng. 7:046121. doi: 10.1063/5.0174227