¶ lncRNA Gas5是一种活动响应性支架,用于介导cAMP依赖性突触可塑性
考希克·钱达¹,#,埃迪·格林曼¹,#,凯琳·克拉克¹,阿布舍克·萨杜¹,宾杜·拉文德拉¹,苏普里亚·斯瓦卡¹,萨蒂亚纳拉亚南·V·普坦维蒂尔¹,*
¹神经科学系,斯克里普斯研究所,130斯克里普斯路,佛罗里达州朱庇特市,33458,美国
#这些作者贡献均等;*通讯作者:sputhanveettil@ufl.edu
¶ 摘要
转录组的变化对于塑造神经元的结构可塑性至关重要,这种可塑性是学习和长期记忆存储的基础。本研究探讨了两种相互对立的可塑性相关通路——cAMP第二信使信号通路与代谢型谷氨酸受体(mGluR1和mGluR5)信号通路——对海马神经元转录组的影响,以及这些通路如何以独特且协同的方式诱导结构变化。通过整合转录组数据和分子通路分析,我们发现了海马神经元中受cAMP和/或mGluR1/5快速诱导的核心“枢纽”基因,其中包括长链非编码RNA(lncRNA)Gas5。该lncRNA的表达特异性受cAMP诱导,并通过驱动蛋白KIF1A靶向树突。在树突中,Gas5与多种突触功能和可塑性相关的蛋白质、编码RNA及非编码RNA发生相互作用,且这些相互作用受cAMP信号调控。值得注意的是,Gas5与微RNA(miRNA)miR-26a-5p结合,使其与多个参与神经元功能的靶mRNA分离——这些mRNA的翻译过程受cAMP诱导。Gas5对cAMP诱导的兴奋性突触传递至关重要,但对mGluR1/5诱导的突触传递无影响。此外,Gas5缺失会损害树突分枝和突触形态,且在阿尔茨海默病(AD)小鼠模型的海马体中Gas5丰度降低。这些发现共同揭示了参与突触可塑性的转录网络,以及一个介导兴奋性突触传递和神经元树突结构局部调控的lncRNA相互作用组。
¶ 引言
由信号转导通路产生的转录网络对于决定神经元对激活的反应至关重要。这些网络会导致神经元结构和连接性的特定改变,对学习和记忆等认知过程产生持久影响[1–3]。广义而言,这些通路可分为兴奋性或抑制性的,反映神经元在各种学习形式中突触连接最终是增强还是减弱[4–6]。鉴于神经元的长期突触能力根本上由其转录网络塑造,理解这些网络如何影响兴奋性和抑制性信号传递相关基因,以及这些基因如何相互作用以调控突触可塑性至关重要。因此,深入了解这些转录网络的具体组成部分及其在突触可塑性中的作用十分必要。
高通量测序技术和功能分析方法的最新进展,通过揭示从微小RNA(miRNA)、核小RNA(snRNA)、核仁小RNA(snoRNA)到长链非编码RNA(lncRNA)及假基因等大量非编码RNA,拓展了我们对转录网络的理解。这些发现为转录调控的复杂性提供了更深刻的见解,将非编码RNA确立为转录网络的核心组成部分。许多非编码RNA被发现在学习、记忆及导致记忆障碍的疾病相关神经生物过程中发挥功能性和机制性作用[7,8]。因此,多种miRNA和lncRNA已被确认为基因表达的关键调控因子,能够增强或抑制蛋白编码基因的表达[9-11]。由此可见,在绘制受兴奋性和抑制性信号影响的基因网络时,必须充分考虑编码RNA与非编码RNA之间复杂的相互作用。
本研究考察了海马神经元对两种与学习和长期记忆存储相关信号通路的转录响应。具体而言,我们采用了兴奋性与抑制性信号的有效激活剂:福斯高林(forskolin)——可通过激活腺苷酸环化酶启动cAMP信号通路(该信号级联因与长时程增强及学习强化相关而广为熟知),以及二羟基苯基甘氨酸(DHPG)——I组代谢型谷氨酸受体(mGluR1与mGluR5)的高效激动剂,可诱导突触传递的长时程抑制[12,13]。通过分析cAMP和mGluR1/5信号条件下mRNA、lncRNA及miRNA的差异调控规律,我们揭示了转录组中编码与非编码元件之间复杂的相互作用网络。
我们进一步探究了lncRNA与mRNA顺式表达模式之间的关系,构建了差异表达基因的共表达网络以识别这些通路中的关键调控因子,并对相关体内数据集进行了荟萃分析。通过整合这些数据,我们揭示了cAMP和mGluR1/5条件下多个调控性RNA互作网络。随后我们通过沉默核心lncRNA——Gas5对这些网络之一进行功能验证,发现该lncRNA通过直接干扰脑组织富集的miR-26a-5p来维持cAMP介导的RNA表达。对Gas5复合物的转录组学与蛋白质组学分析表明,Gas5可作为参与突触功能的多种RNA及蛋白质因子的支架,且Gas5对兴奋性突触传递、树突分枝及突触形态形成至关重要。
¶ 结果
¶ 1. cAMP和mGluR1/5信号在海马神经元中引发独特的转录组特征
为探究不同学习相关信号通路是否在海马神经元中产生截然不同或存在重叠的转录变化,我们分析了cAMP与mGluR1/5信号通路诱导的编码和非编码转录组。具体而言,我们培养了源自CD1小鼠幼崽海马区的原代神经元。在体外培养第18天(DIV 18),分别使用福斯高林(forskolin)或DHPG处理这些神经元30分钟以激活cAMP或mGluR1/5信号通路,以DMSO作为对照。处理后从神经元中提取RNA,并对同一样本进行总RNA和小RNA测序(图1A)。
对批次校正数据的主成分分析显示,样本根据其药物治疗方案紧密聚集(图1B)。为验证RNA-seq结果,我们选取特征明确的即刻早期基因(IEGs)进行qRT-PCR验证。RNA-seq与qRT-PCR均证实福斯高林与DHPG对Arc、Egr2、cFos等IEGs表达的调控作用(图S1A-C;数据文件S1)。相比之下,Syt4表达在RNA-seq和qRT-PCR分析中均未见组间差异(图S1D),这凸显了不同实验方法间基因表达数据的高度可重复性。
此外,鉴于cAMP与mGluR1/5信号通路在已验证的即刻早期基因中存在重叠(图S1B-D),我们推测这些通路可能以不同强度抑制基本相同的基因集。差异表达分析显示,与DMSO相比,福斯高林处理导致1438个差异表达基因(占所有注释基因的2.89%;图1C及数据文件S1);而DHPG处理则产生239个差异表达基因(占全部基因的0.48%;图1D及数据文件S1)。值得注意的是,福斯高林与DHPG处理的对比分析识别出5857个差异表达基因(占全部基因的11.6%;图1E),其中仅有14个基因被福斯高林上调但被DHPG下调。此外,在检查相对于DMSO上调或下调的基因时,分别只有12个和9个基因重叠(图1E)。
基因本体(GO)分析表明,福斯高林主要调控的基因与突触功能、RNA加工及分解代谢过程相关(图S1E、G;数据文件S1),而DHPG调控的基因则参与纤毛组装、微管形成及呼吸系统发育(图S1F、H;数据文件S1)。总体而言,这些发现表明cAMP和mGluR1/5信号通路并不主要调控共同的基因集,而是引发独特的转录组特征。
为了进一步探究cAMP信号通路在培养海马神经元中的相关性,我们对海马切片在30、60和120分钟时间点经福斯高林诱导长时程增强(LTP)后的RNA测序数据进行了荟萃分析[14](图S2A)。通过比较LTP数据集与我们的福斯高林数据集之间的差异表达基因,我们观察到随时间推移重叠基因数量逐渐增加:30分钟LTP时有14个基因重叠(图S2B),60分钟时增至22个基因(图S2C),120分钟时达到67个基因(图S2D)。GO分析显示这67个重叠基因参与RNA聚合酶II相关转录因子活性,表明早期cAMP信号激活了基因表达的正反馈循环(图S2E)。
¶ 2. cAMP和mGluR1/5信号通路减弱特定mRNA的miRNA靶向作用
为了全面理解cAMP和mGluR1/5信号通路所调控的转录网络,我们随后聚焦于miRNA的表达分析。miRNA是一类内源性小分子非编码RNA,能通过与mRNA直接相互作用,经由RISC复合体介导其降解,从而抑制转录后过程[15]。已有研究表明这些miRNA参与大脑中的多种信号传导过程及认知功能[16,17]。我们推测特定miRNA可能介导了cAMP与mGluR1/5信号诱导的转录动态变化。为验证该假设,我们基于先前分析所用的同一批RNA样本,进行了差异miRNA表达谱分析。
研究结果显示,福斯高林处理导致32种miRNA上调和12种miRNA下调(图1F;数据文件S2)。类似地,DHPG处理引起46种miRNA上调和57种miRNA下调(图1G;数据文件S2)。为深入阐明差异上调最显著的miRNA与其靶标间的相互作用,我们通过整合starBase和TargetScan两个数据库[18,19],采用严格筛选方法:仅当靶标在这两个数据库中出现重叠时,才确认miRNA-mRNA相互作用关系。随后利用Cytoscape构建了可视化相互作用网络。在福斯高林处理上调的前5位miRNA中,我们鉴定出63个上调及26个下调的mRNA靶标(图1I);而在DHPG处理上调的前5位miRNA中,则发现20个下调及1个上调的mRNA靶标(图1H)。这些miRNA中存在大量共享靶标的现象,提示它们与靶标间存在经由福斯高林和DHPG诱导信号通路调控的复杂相互作用网络。
¶ 3. cAMP信号传导激活多种lncRNA和mRNA顺式表达模式
为深入阐明lncRNA在转录网络中的作用,我们将其表达模式与mRNA进行同步分析。哺乳动物基因组编码数千种lncRNA,这些RNA虽不参与翻译,却在细胞进程中发挥关键调控功能[20,21]。已有研究表明lncRNA与突触可塑性及学习过程密切相关[22]。多数lncRNA定位于细胞核内,作为转录调控因子发挥作用[23]。我们推测在所研究的信号通路中,lncRNA的表达模式可能与其转录位点邻近(顺式作用关系)的mRNA表达存在关联。
通过BiomaRt Bioconductor软件包与UCSC基因组浏览器,我们以100kb为范围对lncRNA与mRNA进行交叉参照。虽然未在mGluR1/5信号通路中发现顺式作用关系,但对cAMP数据集的分析揭示了多种顺式作用模式,包括双向、反义、汇聚、正义内含子及基因间共转录(图S3A-E)。此外,我们观察到两类干扰性顺式作用模式:基因间干扰与反义干扰(图S3F-G)。这些结果凸显了经福斯高林与DHPG处理的转录网络中存在的复杂相互作用。
¶ 4. cAMP-PKA信号传导依赖基因受其生物学功能共同调控
鉴于cAMP和mGluR1/5信号通路引发的独特转录特征,我们进一步研究了这些基因在共转录框架内的相互作用。为此,我们采用多尺度嵌入式基因共表达网络分析(MEGENA)算法[24]。该方法通过对RNA测序数据进行平面性测试,能够识别重叠的基因模块。MEGENA此前已被用于解析脑细胞类型[25]和衰老脑组织[26],揭示了有意义的共表达模式并识别出新的基因靶点。
对于cAMP调控基因,我们分析了880个上调基因的数据。其中592个基因通过平面性检验,最终识别出32个基因模块(图S4A、D;数据文件S3)。统计学意义最显著的模块之一C1_8包含两个枢纽基因Eif3j2和Atp11b(图S4D),分别编码翻译起始因子和ATP酶。在平面网络中包含最多cAMP调控基因的模块C1_5以Zfp182和Zcchc7两个枢纽基因为特征,它们编码的锌指蛋白此前尚未在cAMP信号传导背景中被研究。C1_5网络由mRNA、lncRNA和假基因共同构成,表明该模块内编码与非编码元件存在复杂相互作用(图S4B;数据文件S3)。值得注意的是,C1_5模块的GO分析显示该网络中的基因主要参与RNA加工与运输过程,这表明cAMP诱导的基因产物以精确协调的方式调控这些功能(图S4C;数据文件S3)。鉴于RNA加工与运输在学习相关信号通路中的重要性[27,28],这些发现提示cAMP信号传导协调调控参与这些过程的基因时序表达。该网络中两个未被表征的锌指蛋白的核心作用,凸显了它们对这些生物学功能的潜在重要性。
对于mGluR1/5信号通路,我们分析了41个上调基因的数据,其中35个通过平面性检验,最终形成两个独立模块(图S4E)。模块C1_2的核心枢纽基因Emd和Copg2分别编码细胞骨架结合蛋白和高尔基体至内质网转运蛋白。模块C1_3以Gm26493作为核心枢纽基因,该基因编码的snoRNA此前未发现与mGluR1/5信号通路相关(图S4F)。
¶ 5. lncRNAs在cAMP和mGluR1/5信号传导下与miRNAs竞争相同的靶mRNAs
我们观察到,福斯高林上调的前5位miRNA所对应的大部分mRNA靶标也出现上调(图1I、图S8A)。这表明通常会被这些miRNA下调的mRNA,可能通过cAMP信号通路得以挽救。学界公认胞质lncRNA可作为竞争性内源RNA(ceRNA),从而隔离miRNA与其靶标mRNA的结合[29]。为探究这一潜在机制,我们利用starBase和TargetScan数据库分析了差异表达的lncRNA及其相关miRNA靶标。
在cAMP条件下,我们鉴定出65个与表达模式相似的miRNA结合的差异表达lncRNA;在mGluR1/5信号通路中则发现8个此类lncRNA,其中2个为两条信号通路所共有(图2A)。我们构建了miRNA/lncRNA/mRNA互作网络,针对两种受DHPG调控的lncRNA(Gm38182和Pvt1)的分析显示,网络中大多数miRNA的mRNA靶标呈现下调趋势,表明这些lncRNA可能未在mGluR1/5信号通路中发挥ceRNA功能(图2B、C)。此外,我们分析了在cAMP和mGluR1/5信号通路中均上调表达的lncRNA MIRG,发现其潜在互作因子miR-3086-5p在两条通路中均显著上调(图2D)。该miRNA的16个已知mRNA靶标在cAMP信号通路中同样呈现上调,这表明尽管MIRG在两种信号环境中均被激活,但可能仅在cAMP信号通路中作为ceRNA发挥作用。
对63种仅由cAMP信号通路上调的lncRNA进一步分析发现,其中Gas5在cAMP信号作用下呈现显著上调(图S8B)。通过交叉检索starBase和TargetScan数据库,发现两个可与该lncRNA结合的miRNA:miR-26a-5p[30]和miR-9-3p[31],这两种miRNA均在大脑中富集并参与神经元及认知功能。值得注意的是,实验已证实Gas5可与miR-26a-5p结合[32]。与MIRG类似,我们观察到同时受Gas5及这些miRNA调控的多数mRNA在cAMP信号激活时同样出现上调(图2E、图S8A)。这表明Gas5可能在cAMP信号传导过程中作为ceRNA在海马神经元中发挥作用。
为深入阐明cAMP对Gas5的转录调控机制,我们检测了福斯高林处理后不同时间点的Gas5表达水平。分别以30分钟、1小时、3小时和6小时的时间点处理神经元后,发现Gas5表达在3小时达到峰值,6小时后恢复至接近基线水平(图3A、B;数据文件S3)。这些结果表明Gas5可能作为海马神经元中的即刻早期反应lncRNA发挥作用。
¶ 6. Gas5的树突定位由分子马达蛋白KIF1A介导
为评估Gas5的功能,我们检测了其亚细胞定位。采用DIG标记的核糖探针进行荧光原位杂交(FISH)分析,并结合MAP2(树突标志物)复染,结果显示Gas5同时存在于胞体和树突中(图S6C)。这种树突定位提示其可能参与调节突触功能,该发现与近期研究证实在恐惧条件反射后Gas5定位于树突棘的结果一致[67]。
为进一步阐明Gas5的亚细胞分布,我们设计了25个覆盖Gas5 lncRNA全长的冗余荧光探针。FISH与免疫细胞化学(ICC)联合检测显示,Gas5以点状信号形式分布于细胞核、胞体及远端突起(图3C)。点状信号定量分析表明,相较于远端突起和细胞核,Gas5在胞体中富集程度更高(图3D)。值得注意的是,Gas5点状信号与胞体的距离存在差异,多数位于1000μm范围内,但有些可延伸至4500μm(图3E)。这一观察到的树突定位促使我们深入研究Gas5亚细胞分布的分子机制。
我们先前的研究以及其他团队的工作均强调了特定驱动蛋白家族成员(KIFs)在介导神经元内RNA定位中的作用[51,65,66]。值得注意的是,我们已证实lncRNA ADEPTR的定位依赖于KIF2A[51],而SLAMR lncRNA的定位则需要KIF5C的参与[70]。因此,我们重点探究了KIFs是否介导Gas5的树突定位。
我们采用SMARTpool siRNA敲低原代海马神经元中的部分KIFs亚型(KIF1A、KIF2A、KIF5C和KIF16B),并检测突触小体中Gas5的丰度。转染48小时后,与乱序对照组(siNC)相比,KIF1A、KIF2A和KIF5C的siRNA均能有效敲低其靶标表达(图S7F;数据文件S8)。对分离突触小体中Gas5水平的后续分析显示,敲低KIF1A可显著降低Gas5丰度(图3F、G;数据文件S8)。为验证KIF1A在Gas5定位中的作用,我们通过FISH分析发现KIF1A敲低能显著减少细胞体与树突中Gas5斑点的数量(图3H、I;数据文件S3)。这些结果共同表明KIF1A对维持Gas5的正常亚细胞定位至关重要。
¶ 7. Gas5与miR-26a-5p相互作用,并对其靶标维持cAMP依赖性稳定性至关重要
我们接下来研究了miR-26a-5p和miR-9-3p及其靶mRNA的表达是否依赖于Gas5的表达。为探究这一问题,我们采用锁核酸缺口寡核苷酸(LNA gapmers)通过RNAse H特异性靶向降解Gas5。将这些缺口寡核苷酸单独或联合转染至神经元中72小时,同时设置乱序对照序列,随后评估cAMP依赖性基因表达变化。数据证实这些缺口寡核苷酸能有效抑制cAMP诱导的Gas5表达上调(图4A;数据文件S3)。
随后,我们重点关注了两组受福斯高林上调的基因:一组是miR-26a-5p的专属靶标(Klf4、Plp1、Ugt8a),另一组是miR-26a-5p与miR-9-3p的共同靶标(Hspa4、Cops2、Kcnh7)。Gas5敲除可抑制cAMP诱导的三分之二miR-26a-5p专属靶标(Plp1与Ugt8a)表达上升(图4B;数据文件S3)。与之相反,两种miRNA共同靶向的三个基因表达均未受Gas5敲除影响。这些发现表明Gas5对于cAMP依赖性增强miR-26a-5p靶标至关重要。我们还观察到Gas5敲除会降低即刻早期基因Arc的表达——该基因在我们的数据集中与任何cAMP调控的miRNA均无关联,提示Gas5可能通过不依赖miRNA的机制来稳定Arc表达。
转录本(lncRNA、mRNA和miRNA)的丰度是ceRNA功能的一个关键决定因素。对我们RNA-seq数据的重新分析表明,Gas5的基础水平和激活后转录水平(TPM)与cFos mRNA相当甚至更高(图S8A)。值得注意的是,基础Gas5水平比多种经过深入研究的lncRNAs(如Meg3、Neat1、Ube3a、Uchl1os和Paupar[29,86,97])更为丰富。独立验证实验进一步证实,基础Gas5的倍数变化(以18S rRNA标准化)超过了Arc mRNA(图S8B)。
为了进一步了解Gas5对miRNAs的调控机制,我们在福斯高林处理海马神经元30分钟后检测了成熟miR-26a-5p的水平,观察到miR-26a-5p表达上调(图4C;数据文件S3)。为深入探究miRNA调控机制,我们在神经元中瞬时过表达成熟miR-26a-5p模拟物,并在转染48小时后检测Gas5水平。尽管通过qPCR确认了miR-26a-5p的过表达,但发现Gas5水平无明显变化(图4D)。这一结果与Gas5充当miRNA海绵、将miRNA与其靶标分离的假说相一致。
为验证直接的miRNA-lncRNA相互作用,我们进行了荧光素酶报告实验。将成熟miR-26a结合的野生型Gas5区域(图4E)克隆至pGL3载体,并与miR-26a模拟物共表达。采用编码Gas5区域突变序列的载体作为对照。在miR-26a-5p缺失条件下,野生型与突变型载体之间的荧光强度差异无统计学意义,且仅野生型Gas5编码载体的荧光活性被miR-26a-5p模拟物抑制(图4F;数据文件S3),由此验证了该相互作用。
¶ 8. 海马神经元中Gas5相互作用伙伴的表征
为了深入了解Gas5的作用机制,我们利用RNA测序(RNA-seq)、miRNA测序(miRNA-seq)和蛋白质组学技术对其相互作用组进行了全面分析。我们采用全长Gas5转录本生物素标记诱饵[33],从成熟原代海马神经元中进行了Gas5下拉实验,反义探针作为阴性对照。从链霉亲和素-生物素复合物中分离的RNA进行了总RNA和小RNA测序分析。
基于欧几里得距离对总RNA样本进行层次聚类分析,结果显示三个正义链重复样本紧密聚集,与三个反义链重复样本明显分离(图4G)。差异表达分析鉴定出610种特异性富集Gas5的RNA(图4H;数据文件S4)。基因生物类型分析证实这些RNA包含多种编码和非编码RNA。值得注意的是,GO分析表明这些RNA主要与突触组织(如Camk2a、Syn1、Dlgap3)、细胞连接(如Rapgef1、Plec、Ajuba)及运输功能(如Kif5c、Kif5a、Kif1b)相关(图4I、图S5A;数据文件S4)。对这些复合物进行小RNA测序,发现8种特异性富集Gas5的miRNA(图4J;数据文件S4),但这些miRNA与我们预测的Gas5靶标并未出现重叠(图2E)。
与Gas5相关的RNA在远离胞体的过程中(如突触组织和细胞连接)占主导地位,加之其相互作用伙伴相对较少,表明Gas5是通过更大的核糖核蛋白复合物(RNP)发挥作用[34],而非通过反义相互作用。为鉴定相关蛋白,我们通过下拉Gas5(或反义探针对照)分离蛋白质复合物,并进行LC-MS/MS分析。差异分析显示,与反义对照相比,有58种蛋白在Gas5复合物中特异性富集(图4K;数据文件S4)。这些蛋白主要参与突触组织(如GSK-3β、TUBB5、APOE)、凋亡(如TPT1、PDIA3、CLU)和病毒过程(如HSPA8、RAB7、P4HB)(图4L、图S5B;数据文件S4)。
为验证这些发现,我们将数据与先前海马组织Gas5下拉蛋白质组学研究(Wang等, 2021)[33]进行比对,发现八个在RNA结合/剪接/翻译、磷酸化及细胞骨架构建中起作用的蛋白质存在重叠(图S5C)。质谱分析证实了数据的可靠性(图S5D)。为进一步验证,我们重点关注糖原合酶激酶-3β(GSK-3β),该蛋白在Gas5沉降复合物中富集(图S3)。通过cAMP刺激后使用Gas5探针进行沉降实验,我们验证了该相互作用(图5A)。在裂解和沉降前,用福斯高林或DMSO处理原代海马神经元30分钟。结果显示Gas5与总GSK-3β及磷酸化GSK-3β均存在结合,且福斯高林处理导致磷酸化与总GSK-3β比例升高(图5B-E)。
为进一步探究Gas5与GSK-3β的相互作用,我们在完成FISH和ICC分析后进行了超分辨率成像。典型图像(图5F)显示Gas5与GSK-3β在细胞体内空间相邻,并在远端突起的独立结构中存在共定位(图5F)。皮尔逊相关性与曼德尔重叠分析表明Gas5与GSK-3β具有强相关性(图5G)。线性强度分析进一步佐证了共定位特征(图S5D)。
使用开源算法[RNA相互作用组百科全书(ENCORI)]进行的计算机模拟分析表明,编码激酶GSK-3β的mRNA是miR-26a-5p的靶标(图S6A)。实验验证显示,瞬时过表达miR-26a-5p会导致GSK-3β在mRNA水平显著降低(图5H;数据文件S5)。此外,使用gapmer对Gas5进行瞬时敲低也引起GSK-3β编码mRNA表达下调(图5I)。与这些观察结果一致,我们的RNA-seq数据显示Gas5与GSK3B mRNA水平相当(图S8A)。鉴于GSK-3β在突触可塑性与神经退行性疾病中的作用[62,63],Gas5可能通过其与GSK-3β的相互作用调控这些过程。
¶ 9. Gas5及其互作因子的表达在阿尔茨海默病小鼠模型中受损
非编码RNA网络的调控失常,尤其是miRNA和lncRNA,在阿尔茨海默病(AD)中已有充分记录[56]。Gas5水平改变在AD中的影响仍是当前研究热点[57-58]。在AD小鼠模型和患者样本中均观察到miR-26a-5p水平升高[59-60]。鉴于我们发现cAMP信号传导(在神经退行性疾病中会出现紊乱[61])会促使Gas5富集,我们研究了阿尔茨海默病小鼠模型中Gas5及其相互作用组的表达水平。
为此,我们采用携带5个AD相关突变的人源APP和PSEN1转基因的5XFAD小鼠(APP基因的瑞典突变K670N/M671L和佛罗里达突变I716V,以及PSEN1基因的M146L和L286V突变),并设置同龄对照组。通过qRT-PCR检测海马组织中Gas5、GSK-3β和miR-26a-5p水平。在野生型小鼠中,Gas5丰度与miR-26a-5p(以U6 snRNA标准化)和GSK3β编码mRNA相当,这符合我们竞争性内源RNA假说的关键条件(图S8C)。
分析显示,与对照组相比,AD小鼠的Gas5水平显著下降(图5J、图S8C;数据文件S5)。相反,我们观察到AD小鼠中miR-26a-5p表达上调(图5K)。值得注意的是,AD小鼠中GSK-3β水平也出现上调,表明GSK-3β在AD中具有更为复杂的调控层面(图5L)。
¶ 10. cAMP信号通路的激活减弱了Gas5与其相关RNPs之间的相互作用
鉴于Gas5在海马神经元中与多种mRNA及非编码RNA存在相互作用,我们探究这些相互作用是否受cAMP信号通路调控。我们提出假说:Gas5能够响应cAMP信号形成包含多种RNA和蛋白质的多核糖核蛋白复合体。为确定Gas5中介导这些相互作用的关键区域,并评估cAMP信号是否会改变其相关RNP复合体的组成,我们对Gas5-RNP复合体进行了RNase保护实验。
我们合成了生物素标记的全长558 bp Gas5转录本,在固定前用福斯高林或DMSO处理30分钟的多聚甲醛固定原代海马神经元中进行拉降实验。通过RNase消化Gas5拉降复合体后,采用蔗糖垫超速离心法提取结合RNA片段,并对这些片段进行RNA测序(图6A)。
出人意料的是,福斯高林处理导致Gas5的核糖核酸酶可及性显著增加(图6B),并降低了几种mRNA的富集度(图6C)。通过整合基因组浏览器(IGV)对富集mRNA进行检测发现,Myh9和Jun mRNA的特定片段在DMSO条件下被特异性富集,但在福斯高林处理后则被隔离(图6D)。相反,伪基因Obox-ps27的表达在福斯高林条件下显著富集,且以某个特定片段为主(图6D)。这些发现通过qPCR分析得到了独立验证(图6E;数据文件S6)。综上所述,这些结果表明cAMP信号通路可诱导Gas5及其相互作用组的核糖核酸酶敏感性发生动态变化,从而调节其在树突中的隔离功能(图6F、G)。
¶ 11. Gas5介导cAMP而非代谢型谷氨酸受体1/5诱导的突触传递及网络活动变化
Gas5与多种已知影响突触可塑性的成分(如GSK-3β)相互作用,表明其在调节cAMP诱导的突触传递变化中可能发挥作用。为验证此假设,我们采用高密度微电极阵列(HD-MEA)技术,检测海马神经元中Gas5功能缺失后cAMP诱导的突触传递及网络活动变化。同时通过相同实验条件下测定已知mGluR1/5激动剂DHPG诱导的突触传递变化,进一步验证Gas5作用的特异性。
在体外培养第16天(DIV 16),将铺植于HD-MEA Accura芯片(3Brain AG)上的海马神经元分别转染Gas5特异性缺口寡核苷酸或乱序对照缺口寡核苷酸。48小时后,分别使用福斯高林或DHPG处理神经元以诱导cAMP或mGluR1/5信号通路,并设置DMSO处理作为对照(图7A)。在药理处理前通过多芯片电生理记录确定神经元的基线健康状态和自发活性(电影S1)。MEA芯片基线设定截止值为50μV以降低噪声,峰值检测阈值设为≥100μV。若电极显示每分钟>10个峰值则判定为活性电极,网络爆发定义为至少30个电极的活动(每个电极具有>10个峰电位,峰电位间隔为<100毫秒)。网络爆发频率的计算方式为爆发总次数除以分析时长。
MEA记录的代表性趋势图(图7B、D)显示,平均放电率(MFR)在28-29次/秒达到峰值,大多数超过15次/秒。Gas5基因敲低甚至在药理处理前就引发了放电行为的显著差异(图7B、数据文件S7及影片S2-S4)。具体而言,Gas5敲低导致放电强度和频率降低,且在福斯高林给药后效应更为显著。福斯高林在对照组神经元中诱导了强烈且一致的响应,其特征为更密集、更频繁的放电序列(图7B与影片S3)。相较之下,Gas5敲低神经元的放电序列均匀度降低,放电密度减弱(图7D与影片S5)。数据定量分析(图7C)显示,基础平均放电率与福斯高林处理前的MFR无显著差异,但显著低于福斯高林处理后的MFR。在Gas5敲低组中(图7E),基础平均放电率与福斯高林处理前存在差异,且两者均显著低于福斯高林处理后。这些结果表明,敲低Gas5基因在自发放电和cAMP诱发条件下均会削弱动作电位密度(图7F)。
我们还观察到Gas5基因敲低会影响神经元放电的峰值振幅。来自四个神经元的代表性轨迹(图7G)显示,在Gas5敲低组和对照组中,福斯高林均能引发强烈响应(≥±500μV),但定量分析(图7H)表明,无论是在福斯高林处理前还是处理后,Gas5敲低组的振幅均显著低于对照组。在放电间隔方面也观察到类似趋势(图7I),与Gas5敲低组相比,对照组在福斯高林处理前后的不应期持续时间更短。这些结果表明功能性Gas5的缺失会损害尖峰放电密度和动作电位强度对cAMP信号的反应。
随后我们评估了Gas5是否也介导mGluR1/5信号通路诱导的突触传递变化。激活mGluR1/5的DHPG处理导致网络活动减弱。代表性趋势图(图7J、K)显示,虽然对照组(NC组)和Gas5敲低组在DHPG处理前均表现出较强的平均放电频率,但经DHPG处理后放电活动几乎完全消失(影片S6和S7)。进一步分析显示,在未使用DHPG的组别间平均放电频率存在显著差异,但对DHPG的响应未见显著差异(图7L)。与对照组相比,DHPG处理也未影响Gas5敲低组神经元的峰峰值振幅(图S7C)。这些结果表明,尽管DHPG能显著抑制基础突触传递,但Gas5缺失并未改变DHPG诱导的效应。
最后,我们评估了Gas5功能缺失是否会影响由福斯高林或DHPG诱导的神经元网络表型。整个MEA的点阵图显示,对照组条件下网络突发呈现规律模式,经福斯高林处理后这些突发变得更为密集且持续时间延长(图S7A)。相比之下,Gas5敲除导致网络突发显著减少且密集度降低(图S7A)。进一步分析表明,与Gas5敲低组相比,对照组在福斯高林处理前后的爆发频率均显著更高(图S7D;数据文件S7)。在网络爆发持续时间方面也观察到相似趋势(图S7E)。另一方面,DHPG诱导的信号传导则显著减弱了NC组和Gas5敲低神经元的群体爆发活动(图S7B)。这些结果表明,Gas5 lncRNA选择性介导cAMP信号传导诱导的突触传递和神经网络活动变化。
¶ 12. Gas5功能缺失损害树突分枝和树突棘密度
我们的分子和电生理学数据表明,Gas5在维持神经元形态——特别是树突分枝和树突棘密度方面起着关键作用。为评估Gas5功能缺失对这些参数的影响,我们研究了海马神经元的树突分枝与树突棘形态。
使用gapmer敲低Gas5后,三级树突分枝数量(60至110μm)相较于对照组神经元显著减少(图8A、B;数据文件S8),但二级分枝(20至50μm)未见明显差异。此外,Gas5敲低神经元的树突棘密度、细小型与蘑菇型树突棘占比均显著降低(图8C-E;数据文件S8)。这些发现表明,正常的Gas5功能对维持海马神经元的树突分枝结构与树突棘形态至关重要。
为深入理解这些形态变化的分子基础,我们研究了Gas5功能缺失的转录组学效应。我们假设Gas5敲低可能影响神经元形态关键基因的表达。在使用gapmer进行Gas5敲低后,我们进行了全RNA测序(图8F)。差异表达转录本生物类型分析(图S5E)显示,在219个受干扰基因中,大多数(142个基因,占64.8%)为蛋白质编码基因,其次是加工假基因(43个基因,占19.6%)和lncRNA(34个基因,占15.5%)。显著下调的基因包括早期应答基因(如Egr1、Egr2和Arc)以及翻译因子编码基因Eif3e(图8G;数据文件S8)。此外,对神经元生理至关重要的基因(如Rheb和Cftr)也出现下调。Gas5敲低组中有多个lncRNA出现表达异常,包括Hotairm1、Macrod2os1及Gas5本身。值得注意的是,改变基因中有相当一部分是假基因。
为验证测序数据,我们针对5个候选基因(Arc、Egr1、Rheb、Cftr和Hotairm1)设计了特异性引物。后续qPCR数据显示,验证组中Arc、Egr1、Rheb和Cftr的表达确实下调,而Hotairm1表达升高(图S7G;数据文件S8)。GO分析表明这些RNA参与多种生物学过程,包括轴突导向(涉及Cdk5、Epha6、Rock2、Sema3e、Lrig和Srgap3)、cAMP信号通路(涉及Hcn4、Abcc4和Myl9)、肌动蛋白细胞骨架调控(涉及Arpc4、Egfr和Itga11),并与肌萎缩侧索硬化症和阿尔茨海默病等神经退行性疾病相关(涉及Frat1、Casp12、Adam10、Rtn3和Tuba1b)(图8H;数据文件S8)。
¶ 讨论
本研究探讨了cAMP和mGluR1/5信号——这两种对突触传递和神经元形态具有相反作用的通路——如何影响编码与非编码转录组。我们的分析发现lncRNA Gas5是cAMP诱导变化的关键中介因子,这些变化会影响兴奋性突触传递和神经元结构。
我们接下来分析了差异表达的miRNAs、lncRNAs和mRNAs之间的相互作用。在DHPG数据集中,上调的miRNAs与减少的靶标mRNAs相关。然而,在cAMP数据集中,许多miRNA靶标被矛盾地上调,表明存在竞争性内源RNA(ceRNA)机制。通常,miRNAs介导转录本抑制[40],但近乎完美的互补性可能引发miRNA降解[41]。生物信息学和功能实验证实,Gas5作为miR-26a-5p的ceRNA,保护了靶标Plp1和Ugt8a的表达,这些基因参与髓鞘形成——表明这种调控相互作用也可能发生在少突胶质细胞中。ceRNA组分的丰度是关键。我们的RNA-seq数据显示,Gas5的水平与GSK3B和cFos相当或超过它们,还超过了著名的lncRNAs(如Meg3、Neat1和Ube3a)。独立的qPCR验证证实,Gas5水平超过了Arc,并且其丰度与miR-26a-5p和GSK3B在海马神经元和AD模型小鼠组织中都相当。进一步的证据通过单一位点相互作用支持Gas5的ceRNA功能。
先前的研究显示,Gas5吸附多种miRNAs以调节基因表达,涉及肾损伤[88]、冠状动脉疾病[89]和动脉粥样硬化[90]。类似地,其他lncRNAs如SCAMP1[91]、NORAD[92]和KCNQ1OT1[93]在癌症模型中被证明能够隔离miR-26a-5p。这些研究支持了miR-26a-5p是lncRNA介导基因调控核心节点的观点。受此启发,我们分析了Gas5相互作用组,发现610种富集的RNA参与突触组织、运输和细胞粘附等关键过程——这些都是局部突触处的翻译过程[46,47]。八种miRNAs与Gas5相互作用,但无一与数据库中的预测靶标匹配,表明直接mRNA结合。先前的研究表明,Gas5与RNA结合蛋白如AGO2[45]和EIF4E[43]相关联。我们的蛋白质组学分析揭示了58种参与突触组织和细胞凋亡的蛋白。值得注意的是,编码可塑性关键调控因子GSK-3β的mRNA位列其中,cAMP刺激会增强其与Gas5的相互作用。功能实验证实了这一关联,支持了包含Gas5、miR-26a-5p和GSK-3β的调控轴。
本研究在海马体中鉴定出的8个Gas5相互作用蛋白与Wang等人[33]的发现存在重叠,表明Gas5是更大的核糖核蛋白复合体组成部分。这些动态、无膜结合的复合结构可调节突触可塑性,其功能紊乱可能导致神经退行性病变。鉴于Gas5的相互作用特征及树突定位特性,它很可能在突触部位的核糖核蛋白复合体中发挥功能。
基于这些发现,Gas5似乎在基因调控、突触传递和可塑性中发挥着重要作用——这些过程在阿尔茨海默病等神经退行性疾病中显著受损[61]。在我们的AD模型5XFAD小鼠中,Gas5水平降低,而miR-26a-5p水平升高。出乎意料的是,GSK3B水平有所增加,这表明在小鼠海马体中,其在AD中的调控可能不依赖于miRNA[71–72]。
为了精确定位Gas5中的相互作用区域,我们进行了RNA酶可及性图谱分析。在静息神经元中,Gas5大部分区域受到RNA酶保护,表明存在RNA或蛋白质相互作用。cAMP刺激后,部分区域变得对RNA酶敏感,提示其相互作用组发生动态重构以支持突触传递。这些结构变化延伸至Gas5的RNA相互作用组,后者也表现出cAMP依赖的RNA酶敏感性改变,表明Gas5可作为树突RNP复合物的可调节支架。这种可调节性可能涉及cAMP诱导的相关蛋白质或RNA的修饰。
由于强烈的转录组信号,我们进一步探究了Gas5是否在功能上介导突触变化。在MEA实验中,Gas5基因敲除削弱了福斯高林诱导的兴奋性突触活动增强,这支持了其在突触传递中的直接作用。尽管其他lncRNA(如Gm12371)也被发现与福斯高林反应相关,但其特异性尚不明确。在此研究中,Gas5作为通路特异性介导因子脱颖而出。
鉴于形态学与突触可塑性之间的紧密联系[64],我们同时评估了结构性效应。Gas5基因敲低会导致树突分枝减少。对照组神经元维持锥体形态结构,而Gas5缺陷神经元则呈现伸长形态,其三级分枝减少、树突棘密度降低,尤其是细丝状和蘑菇状树突棘。这些形态变化与即刻早期基因、ERG复合体组分及突触相关基因的表达下调相吻合[54,73],凸显了Gas5在维持树突结构与信号传导中的重要作用。由于Gas5在细胞核、胞体及树突中均有表达,后续研究需进一步明确其区域特异性功能。
总之,这些发现表明树突定位的Gas5对兴奋性突触功能与结构——这一学习记忆的核心进程——具有关键作用。该结论与多项研究相吻合,这些研究表明lncRNA在学习及长期记忆过程中发挥重要作用[67–70]。Liau等人[67]发现Gas5在突触中富集,并与RNA结合蛋白(RBPs)相互作用以调控RNA运输,其敲低会损害恐惧记忆消退。Meier等人[69]观察到海马体中Gas5水平与焦虑相关行为呈负相关,并在应激反应中升高。同样地,Banerjee等人[74]的研究表明,母性分离应激会上调Gas5表达,从而导致空间记忆缺陷。
我们的研究揭示了海马神经元中与cAMP和mGluR1/5信号传导相关的编码RNA和非编码RNA在基因表达层面的变化。此外,研究结果还揭示了lncRNAs(特别是Gas5)的选择性招募及其相互作用组的动态修饰在介导cAMP信号传导中的作用。理解调控lncRNA相互作用组稳定性及其区室特异性功能的机制,对于破译树突中lncRNA功能的分子基础至关重要。
¶ 材料与方法
¶ 1. 动物
CD1孕鼠(查尔斯河实验室)在12小时光照/12小时黑暗的循环光照条件下单独饲养,自由摄取食物和水。实验在昼夜周期的光照阶段进行。动物饲养、护理及实验程序均符合《实验室动物护理和使用指南》规范,并已获得沃特海姆UF斯克里普斯研究所动物护理与使用委员会的批准。
¶ 2. 原代海马神经元培养
从E18 CD1小鼠幼崽中分离出海马体,将其铺在聚-D-赖氨酸包被的培养板上,培养基为含有Glutamax、青霉素-链霉素和5%胎牛血清的Neurobasal培养基。神经元铺板密度根据各实验需求确定。铺板四小时后,更换为含Glutamax、青霉素-链霉素及2% B27补充剂(Invitrogen)的Neurobasal维持培养基,此后每4天更换一半培养基,实验全程在37°C、5% CO₂条件下培养直至实验时间点。
¶ 3. 定量实时PCR(qRT-PCR)
使用Trizol提取RNA,并采用qScript cDNA SuperMix(Quanta Bio)和/或TaqMan MicroRNA逆转录试剂盒(Thermofisher)将其逆转录为cDNA。在384孔板中使用SYBR Green预混液或TaqMan Fast Advanced Master Mix(Thermofisher)进行qRT-PCR,通过ABI 7900热循环仪(Applied Biosystems)检测。采用18S rRNA的Ct值计算dCT值进行标准化,随后通过2⁻ΔCT法进行相对定量。
对于突触小体制备后的qRT-PCR:将6孔汇集神经元在SynPER试剂中裂解,并按制造商说明分离突触小体沉淀。使用Trizol及Zymo Micro RNA试剂盒从沉淀中提取RNA。所有引物序列列于补充材料(数据文件S1)。
¶ 4. 总RNA和小RNA测序与分析
总RNA和小RNA测序均按照Wertheim UF Scripps研究所基因组学核心实验室的流程进行。
- 样本处理:总RNA样本经DNase I(NEB公司,伊普斯维奇市)处理,并通过PureLink RNA Micro试剂盒(Invitrogen公司,卡尔斯巴德市)纯化。随后使用Qubit 2.0荧光计(Invitrogen公司)进行定量,并在安捷伦2100生物分析仪RNA纳米芯片(安捷伦科技公司,圣克拉拉市)上进行质量评估(所有RNA样本的RNA完整性指数RIN>8.5)。
- 文库构建:RNA-seq文库使用Illumina TruSeq链状总RNA建库试剂盒(Illumina公司,圣地亚哥市),按制造商方案以每样本300ng输入RNA进行制备;小RNA-seq文库采用Illumina TruSeq小RNA建库试剂盒(Illumina公司),以1μg输入RNA构建。最终文库经生物分析仪DNA芯片验证后按等摩尔比例混合,小RNA混合池通过6%聚丙烯酰胺凝胶进行尺寸筛选(回收145bp至160bp产物)。
- 测序与数据分析:纯化后的文库以1.8pM终浓度上样至NextSeq 500测序流动槽(Illumina公司),采用2×40bp测序策略,平均每个样本生成2200-2700万条读长(总RNA-seq)和400-1400万条读长(小RNA-seq)。Fastq文件首先通过fastqc[75]进行质量评估,并在高性能计算机集群上使用Trim Galore进行修剪。随后使用Salmon v1.10.1[76]将Fastq读段比对至小家鼠转录组(基于Ensembl注释),生成原始计数和TPM数据。数据通过tximport[77] Bioconductor程序包导入R语言环境,采用R基础程序包/factoextra程序包进行欧氏距离层次聚类与主成分分析,结果通过ggplot或pheatmap绘图程序包可视化。差异表达分析使用DESeq2[78]进行:总RNA-seq中采用0.05的p-adj值将FDR控制在5%;小RNA测序因可用于多重检验校正的miRNA基因数量有限,仅使用0.05的p-value截断值。部分火山图未展示非差异表达基因,并将y轴标准化为平方根−log₁₀(p值或padj)以清晰呈现数据。GO通路分析采用clusterProfiler[79]软件包进行,基因生物类型通过biomaRt[80]包注释。
¶ 5. 多尺度网络分析
MEGENA[81]网络通过R包MEGENA构建,输入数据为DESeq2分析确定的福斯高林(FSK)vs DMSO或DHPG vs DMSO中的上调基因。对全部上调基因的TPM值进行平面性检验以构建平面过滤网络(PFN),随后对所得PFN进行多尺度聚类分析以识别共表达模块。筛选包含最多基因且显著性最强(由MEGENA判定)的模块,最终发现C1_5模块。所有网络图谱均采用Cytoscape[82]中的边加权力导向布局算法生成。
¶ 6. 揭示顺式长链非编码RNA/mRNA对
在福斯高林和DHPG数据集中,均采用显著差异表达(校正后p值<0.05)的lncRNA和mRNA进行分析。首先通过biomaRt按生物类型筛选lncRNA,随后利用biomaRt在lncRNA转录起始位点上下游100kb范围内检索所有显著性mRNA。所有匹配结果均通过UCSC基因组浏览器进行个体验证,以确定精确的顺式作用关系。
¶ 7. 构建miRNA/lncRNA/mRNA互作网络
一旦确定目标miRNA,通过TargetScan和starBase两个数据库筛选其预测靶标,并与全转录组测序数据集中具有统计学显著性的基因(包括mRNA、加工转录本、假基因和lincRNA)进行交叉比对。采用Cytoscape对miRNA-靶标相互作用网络进行可视化,红色和绿色分别代表下调和上调的靶标。
¶ 8. 质粒构建体、LNA缺口聚体和siRNA的转染
- 试剂来源:靶向Gas5的LNA缺口寡聚物由Exiqon(现为QIAGEN)生产;靶向Kif1a、Kif2a、Kif5c、Kif16b和siNC的SMARTPool siRNA库由Dharmacon公司生产。
- 转染方法:采用Lipofectamine RNAiMax(Invitrogen)进行转染。根据制造商指南,将缺口寡聚物或siRNA导入培养12至14天的原代海马神经元。
¶ 9. RNA荧光原位杂交(FISH)和免疫荧光(ICC)
- 探针制备:将Gas5 cDNA的两个300-400 bp片段亚克隆至PCRII TOPO载体中,通过体外转录制备地高辛标记的探针用于FISH实验。抗地高辛Fab片段抗体(罗氏)按1:4000浓度使用,酪胺信号放大试剂盒(Akoya Biosciences)参照制造商说明操作。此外,通过Stellaris设计软件设计25条靶向Gas5的20碱基冗余探针(偶联Quasar570染料),探针序列列于补充材料(数据文件S1)。
- 实验流程:FISH实验严格遵循制造商指南;免疫荧光实验根据需求与FISH联用或单独进行。样本分别在马克斯·普朗克佛罗里达研究所光学显微中心的蔡司LSM 880共聚焦显微镜及UF斯克里普斯生物医学研究影像核心的奥林巴斯IX81完成成像(所用抗体:GSK-3β(27C10-CST)、β-肌动蛋白(8H10D10-CST)及Alexa Fluor偶联二抗)。神经元以低密度铺板(24孔板每孔80,000细胞)以实现单神经元成像,减少相邻神经元信号干扰。
- 超分辨率成像:使用斯克里普斯佛罗里达影像中心配置的蔡司Elyra PS.1系统(德国卡尔蔡司),在SIM模式下采用63倍/1.4 NA油浸复消色差物镜,以1028×1028像素分辨率采集图像。对405、488和561通道采用5种图案旋转和3次平移偏移,每个图像采集20-25层z轴堆栈,通过3个通道(SIM光栅)采集,并经后处理以显示最大强度投影图像或单切片图像(使用Zen Black软件进行SIM重建)。
¶ 10. 蛋白质组学与分析
- 样本处理:蛋白质通过SDS-PAGE分离,用水冲洗后在端到端摇床上固定过夜(10%冰醋酸,30%乙醇)。质谱分析时,分别切出反义和正义探针组对应的条带,在凝胶内进行胰蛋白酶(Pierce Biotechnology,Rockford,IL)消化:先使用二硫苏糖醇和碘乙酰胺进行还原和烷基化处理,随后采用ProteaseMax™表面活性剂胰蛋白酶增强剂在37°C下消化3小时。提取的肽段经ZipTip(Millipore,Billerica,MA)C18柱(2毫克载量)净化。
- LC-MS/MS分析:使用Orbitrap Fusion Tribrid质谱仪进行分析。肽段从EASY PepMap™ RSLC C18色谱柱(2微米,100Å,75微米×50厘米,Thermo Scientific,San Jose,CA)洗脱进入质谱仪,采用梯度洗脱程序:90分钟内溶剂B(80/20乙腈/水,0.1%甲酸)从5%升至25%,随后30分钟内从25%升至44%,0.10分钟内从44%升至80%,维持80%溶剂B 10分钟,3分钟内降至5%并维持3分钟;后续延长梯度程序用于清洗色谱柱。所有流速均为250纳升/分钟,由nEasy-LC1000纳升液相系统(Thermo Fisher Scientific,San Jose,CA)输送(溶剂A为0.1%甲酸溶液)。离子通过EASY Spray源在45°C、2.3kV电压下生成。
- 数据采集与分析:数据依赖性扫描由Xcalibur v4.0.27.10软件执行:先在Orbitrap分析器中进行350-2000质荷比(m/z)的全扫描(分辨率120,000),随后对最强离子实施更高能量碰撞解离(HCD)串联质谱(MS/MS)分析(归一化碰撞能量30%,自动增益控制1.0E4,分辨率30,000)。动态排除设置为25秒内重复离子排除。串联质谱数据比对Uniprot(UP000000589,2020年3月3日下载)小鼠蛋白质组序列及Proteome Discoverer v2.5.0.400内置常见污染蛋白数据库进行检索。检索时设定完全胰蛋白酶酶切(最多允许2个漏切位点),可变修饰包括甲硫氨酸氧化(15.995 Da)、天冬酰胺和谷氨酰胺脱酰胺化(0.984 Da),半胱氨酸氨基甲酰甲基化(57.021 Da)为静态修饰。通过反向数据库检索确定XCorr评分截断值[83],以99%置信度鉴定蛋白质。采用Minora特征检测器节点检测色谱峰和特征。蛋白质与肽段鉴定结果通过Scaffold v5.0.0(Proteome Software公司,波特兰)可视化,接受通过至少两条肽段鉴定(肽段与蛋白质错误发现率均控制在1%以内)的蛋白质。采用经Benjamini-Hochberg校正的配对t检验,以(p<0.05)作为标准化谱图计数统计显著性的判定标准。
¶ 11. 蛋白质印迹法(免疫印迹)
为验证下拉蛋白质组学研究中Gas5的蛋白质相互作用,按上述方法用福斯高林或DMSO处理原代海马神经元。经过交联处理并使用Gas5正义链、反义链探针或对照IgG探针进行下拉实验后,用RIPA裂解液(50 mM Tris-HCl、150 mM NaCl、1.0% (v/v) NP-40、0.5% (w/v) 脱氧胆酸钠、1.0 mM EDTA、0.1% (w/v) SDS、0.01% (w/v) 叠氮化钠,pH 7.4)裂解神经元,通过BCA试剂盒测定蛋白浓度。取25-30 μg蛋白质进行Western印迹分析(所用抗体:GSK-3β [27C10, Cell Signaling Technology (CST)]、磷酸化GSK-3β (Ser9) (5B3, CST) 及β-肌动蛋白(8H10D10, CST))。采用1:5000稀释的抗兔HRP偶联二抗(#5127, CST)或抗小鼠HRP偶联二抗(#7076, CST)检测靶蛋白,最后通过化学发光法(Amersham Biosciences, Piscataway, NJ)显影。使用ImageJ软件对印迹条带进行分析。
¶ 12. 荧光素酶报告基因检测
将含有潜在miR-26a-5p结合位点的小鼠Gas5基因野生型(WT)及突变型(MUT)3′UTR序列,通过XbaI限制性酶切位点插入pGL3 Basic荧光素酶载体(Promega公司,美国)中Luc基因的紧下游位置,所得质粒分别命名为Gas5-WT与Gas5-MUT。
- Gas5-WT序列:5’-gtgagaactgcaaatgcttaaccgggaacctactccagaatacatgatgatctcacacaacttgaactctctcactgattacttgatgatagtaaaagatctgatgttctgtgttttaacagttaccatttaagttaaaattgtagaaaagtgtttaacagctaccttctgttggttgttgcag-3’
- Gas5-MUT序列:5’-gtgagaactgcaaatgcttaaccgggaacctactccagaatacatgatgatctcacacaacttgacatctctccagttaattcgttatgatagtaaaagatctgatgttctgtgttttaacagttaccatttaagttaaaattgtagaaaagtgtttaacagctaccttctgttggttgttgcag-3’
细胞分别与Gas5-WT、Gas5-MUT或“空”pGL3以及miR-26a# lncRNA Gas5是一种活动响应性支架,用于介导cAMP依赖性突触可塑性
考希克·钱达¹,#,埃迪·格林曼¹,#,凯琳·克拉克¹,阿布舍克·萨杜¹,宾杜·拉文德拉¹,苏普里亚·斯瓦卡¹,萨蒂亚纳拉亚南·V·普坦维蒂尔¹,*
¹神经科学系,斯克里普斯研究所,130斯克里普斯路,佛罗里达州朱庇特市,33458,美国
#这些作者贡献均等;*通讯作者:sputhanveettil@ufl.edu
¶ 摘要
转录组的变化对于塑造神经元的结构可塑性至关重要,这种可塑性是学习和长期记忆存储的基础。本研究探讨了两种相互对立的可塑性相关通路——cAMP第二信使信号通路与代谢型谷氨酸受体(mGluR1和mGluR5)信号通路——对海马神经元转录组的影响,以及这些通路如何以独特且协同的方式诱导结构变化。通过整合转录组数据和分子通路分析,我们发现了海马神经元中受cAMP和/或mGluR1/5快速诱导的核心“枢纽”基因,其中包括长链非编码RNA(lncRNA)Gas5。该lncRNA的表达特异性受cAMP诱导,并通过驱动蛋白KIF1A靶向树突。在树突中,Gas5与多种突触功能和可塑性相关的蛋白质、编码RNA及非编码RNA发生相互作用,且这些相互作用受cAMP信号调控。值得注意的是,Gas5与微RNA(miRNA)miR-26a-5p结合,使其与多个参与神经元功能的靶mRNA分离——这些mRNA的翻译过程受cAMP诱导。Gas5对cAMP诱导的兴奋性突触传递至关重要,但对mGluR1/5诱导的突触传递无影响。此外,Gas5缺失会损害树突分枝和突触形态,且在阿尔茨海默病(AD)小鼠模型的海马体中Gas5丰度降低。这些发现共同揭示了参与突触可塑性的转录网络,以及一个介导兴奋性突触传递和神经元树突结构局部调控的lncRNA相互作用组。
¶ 引言
由信号转导通路产生的转录网络对于决定神经元对激活的反应至关重要。这些网络会导致神经元结构和连接性的特定改变,对学习和记忆等认知过程产生持久影响[1–3]。广义而言,这些通路可分为兴奋性或抑制性的,反映神经元在各种学习形式中突触连接最终是增强还是减弱[4–6]。鉴于神经元的长期突触能力根本上由其转录网络塑造,理解这些网络如何影响兴奋性和抑制性信号传递相关基因,以及这些基因如何相互作用以调控突触可塑性至关重要。因此,深入了解这些转录网络的具体组成部分及其在突触可塑性中的作用十分必要。
高通量测序技术和功能分析方法的最新进展,通过揭示从微小RNA(miRNA)、核小RNA(snRNA)、核仁小RNA(snoRNA)到长链非编码RNA(lncRNA)及假基因等大量非编码RNA,拓展了我们对转录网络的理解。这些发现为转录调控的复杂性提供了更深刻的见解,将非编码RNA确立为转录网络的核心组成部分。许多非编码RNA被发现在学习、记忆及导致记忆障碍的疾病相关神经生物过程中发挥功能性和机制性作用[7,8]。因此,多种miRNA和lncRNA已被确认为基因表达的关键调控因子,能够增强或抑制蛋白编码基因的表达[9-11]。由此可见,在绘制受兴奋性和抑制性信号影响的基因网络时,必须充分考虑编码RNA与非编码RNA之间复杂的相互作用。
本研究考察了海马神经元对两种与学习和长期记忆存储相关信号通路的转录响应。具体而言,我们采用了兴奋性与抑制性信号的有效激活剂:福斯高林(forskolin)——可通过激活腺苷酸环化酶启动cAMP信号通路(该信号级联因与长时程增强及学习强化相关而广为熟知),以及二羟基苯基甘氨酸(DHPG)——I组代谢型谷氨酸受体(mGluR1与mGluR5)的高效激动剂,可诱导突触传递的长时程抑制[12,13]。通过分析cAMP和mGluR1/5信号条件下mRNA、lncRNA及miRNA的差异调控规律,我们揭示了转录组中编码与非编码元件之间复杂的相互作用网络。
我们进一步探究了lncRNA与mRNA顺式表达模式之间的关系,构建了差异表达基因的共表达网络以识别这些通路中的关键调控因子,并对相关体内数据集进行了荟萃分析。通过整合这些数据,我们揭示了cAMP和mGluR1/5条件下多个调控性RNA互作网络。随后我们通过沉默核心lncRNA——Gas5对这些网络之一进行功能验证,发现该lncRNA通过直接干扰脑组织富集的miR-26a-5p来维持cAMP介导的RNA表达。对Gas5复合物的转录组学与蛋白质组学分析表明,Gas5可作为参与突触功能的多种RNA及蛋白质因子的支架,且Gas5对兴奋性突触传递、树突分枝及突触形态形成至关重要。
¶ 结果
¶ 1. cAMP和mGluR1/5信号在海马神经元中引发独特的转录组特征
为探究不同学习相关信号通路是否在海马神经元中产生截然不同或存在重叠的转录变化,我们分析了cAMP与mGluR1/5信号通路诱导的编码和非编码转录组。具体而言,我们培养了源自CD1小鼠幼崽海马区的原代神经元。在体外培养第18天(DIV 18),分别使用福斯高林(forskolin)或DHPG处理这些神经元30分钟以激活cAMP或mGluR1/5信号通路,以DMSO作为对照。处理后从神经元中提取RNA,并对同一样本进行总RNA和小RNA测序(图1A)。
对批次校正数据的主成分分析显示,样本根据其药物治疗方案紧密聚集(图1B)。为验证RNA-seq结果,我们选取特征明确的即刻早期基因(IEGs)进行qRT-PCR验证。RNA-seq与qRT-PCR均证实福斯高林与DHPG对Arc、Egr2、cFos等IEGs表达的调控作用(图S1A-C;数据文件S1)。相比之下,Syt4表达在RNA-seq和qRT-PCR分析中均未见组间差异(图S1D),这凸显了不同实验方法间基因表达数据的高度可重复性。
此外,鉴于cAMP与mGluR1/5信号通路在已验证的即刻早期基因中存在重叠(图S1B-D),我们推测这些通路可能以不同强度抑制基本相同的基因集。差异表达分析显示,与DMSO相比,福斯高林处理导致1438个差异表达基因(占所有注释基因的2.89%;图1C及数据文件S1);而DHPG处理则产生239个差异表达基因(占全部基因的0.48%;图1D及数据文件S1)。值得注意的是,福斯高林与DHPG处理的对比分析识别出5857个差异表达基因(占全部基因的11.6%;图1E),其中仅有14个基因被福斯高林上调但被DHPG下调。此外,在检查相对于DMSO上调或下调的基因时,分别只有12个和9个基因重叠(图1E)。
基因本体(GO)分析表明,福斯高林主要调控的基因与突触功能、RNA加工及分解代谢过程相关(图S1E、G;数据文件S1),而DHPG调控的基因则参与纤毛组装、微管形成及呼吸系统发育(图S1F、H;数据文件S1)。总体而言,这些发现表明cAMP和mGluR1/5信号通路并不主要调控共同的基因集,而是引发独特的转录组特征。
为了进一步探究cAMP信号通路在培养海马神经元中的相关性,我们对海马切片在30、60和120分钟时间点经福斯高林诱导长时程增强(LTP)后的RNA测序数据进行了荟萃分析[14](图S2A)。通过比较LTP数据集与我们的福斯高林数据集之间的差异表达基因,我们观察到随时间推移重叠基因数量逐渐增加:30分钟LTP时有14个基因重叠(图S2B),60分钟时增至22个基因(图S2C),120分钟时达到67个基因(图S2D)。GO分析显示这67个重叠基因参与RNA聚合酶II相关转录因子活性,表明早期cAMP信号激活了基因表达的正反馈循环(图S2E)。
¶ 2. cAMP和mGluR1/5信号通路减弱特定mRNA的miRNA靶向作用
为了全面理解cAMP和mGluR1/5信号通路所调控的转录网络,我们随后聚焦于miRNA的表达分析。miRNA是一类内源性小分子非编码RNA,能通过与mRNA直接相互作用,经由RISC复合体介导其降解,从而抑制转录后过程[15]。已有研究表明这些miRNA参与大脑中的多种信号传导过程及认知功能[16,17]。我们推测特定miRNA可能介导了cAMP与mGluR1/5信号诱导的转录动态变化。为验证该假设,我们基于先前分析所用的同一批RNA样本,进行了差异miRNA表达谱分析。
研究结果显示,福斯高林处理导致32种miRNA上调和12种miRNA下调(图1F;数据文件S2)。类似地,DHPG处理引起46种miRNA上调和57种miRNA下调(图1G;数据文件S2)。为深入阐明差异上调最显著的miRNA与其靶标间的相互作用,我们通过整合starBase和TargetScan两个数据库[18,19],采用严格筛选方法:仅当靶标在这两个数据库中出现重叠时,才确认miRNA-mRNA相互作用关系。随后利用Cytoscape构建了可视化相互作用网络。在福斯高林处理上调的前5位miRNA中,我们鉴定出63个上调及26个下调的mRNA靶标(图1I);而在DHPG处理上调的前5位miRNA中,则发现20个下调及1个上调的mRNA靶标(图1H)。这些miRNA中存在大量共享靶标的现象,提示它们与靶标间存在经由福斯高林和DHPG诱导信号通路调控的复杂相互作用网络。
¶ 3. cAMP信号传导激活多种lncRNA和mRNA顺式表达模式
为深入阐明lncRNA在转录网络中的作用,我们将其表达模式与mRNA进行同步分析。哺乳动物基因组编码数千种lncRNA,这些RNA虽不参与翻译,却在细胞进程中发挥关键调控功能[20,21]。已有研究表明lncRNA与突触可塑性及学习过程密切相关[22]。多数lncRNA定位于细胞核内,作为转录调控因子发挥作用[23]。我们推测在所研究的信号通路中,lncRNA的表达模式可能与其转录位点邻近(顺式作用关系)的mRNA表达存在关联。
通过BiomaRt Bioconductor软件包与UCSC基因组浏览器,我们以100kb为范围对lncRNA与mRNA进行交叉参照。虽然未在mGluR1/5信号通路中发现顺式作用关系,但对cAMP数据集的分析揭示了多种顺式作用模式,包括双向、反义、汇聚、正义内含子及基因间共转录(图S3A-E)。此外,我们观察到两类干扰性顺式作用模式:基因间干扰与反义干扰(图S3F-G)。这些结果凸显了经福斯高林与DHPG处理的转录网络中存在的复杂相互作用。
¶ 4. cAMP-PKA信号传导依赖基因受其生物学功能共同调控
鉴于cAMP和mGluR1/5信号通路引发的独特转录特征,我们进一步研究了这些基因在共转录框架内的相互作用。为此,我们采用多尺度嵌入式基因共表达网络分析(MEGENA)算法[24]。该方法通过对RNA测序数据进行平面性测试,能够识别重叠的基因模块。MEGENA此前已被用于解析脑细胞类型[25]和衰老脑组织[26],揭示了有意义的共表达模式并识别出新的基因靶点。
对于cAMP调控基因,我们分析了880个上调基因的数据。其中592个基因通过平面性检验,最终识别出32个基因模块(图S4A、D;数据文件S3)。统计学意义最显著的模块之一C1_8包含两个枢纽基因Eif3j2和Atp11b(图S4D),分别编码翻译起始因子和ATP酶。在平面网络中包含最多cAMP调控基因的模块C1_5以Zfp182和Zcchc7两个枢纽基因为特征,它们编码的锌指蛋白此前尚未在cAMP信号传导背景中被研究。C1_5网络由mRNA、lncRNA和假基因共同构成,表明该模块内编码与非编码元件存在复杂相互作用(图S4B;数据文件S3)。值得注意的是,C1_5模块的GO分析显示该网络中的基因主要参与RNA加工与运输过程,这表明cAMP诱导的基因产物以精确协调的方式调控这些功能(图S4C;数据文件S3)。鉴于RNA加工与运输在学习相关信号通路中的重要性[27,28],这些发现提示cAMP信号传导协调调控参与这些过程的基因时序表达。该网络中两个未被表征的锌指蛋白的核心作用,凸显了它们对这些生物学功能的潜在重要性。
对于mGluR1/5信号通路,我们分析了41个上调基因的数据,其中35个通过平面性检验,最终形成两个独立模块(图S4E)。模块C1_2的核心枢纽基因Emd和Copg2分别编码细胞骨架结合蛋白和高尔基体至内质网转运蛋白。模块C1_3以Gm26493作为核心枢纽基因,该基因编码的snoRNA此前未发现与mGluR1/5信号通路相关(图S4F)。
¶ 5. lncRNAs在cAMP和mGluR1/5信号传导下与miRNAs竞争相同的靶mRNAs
我们观察到,福斯高林上调的前5位miRNA所对应的大部分mRNA靶标也出现上调(图1I、图S8A)。这表明通常会被这些miRNA下调的mRNA,可能通过cAMP信号通路得以挽救。学界公认胞质lncRNA可作为竞争性内源RNA(ceRNA),从而隔离miRNA与其靶标mRNA的结合[29]。为探究这一潜在机制,我们利用starBase和TargetScan数据库分析了差异表达的lncRNA及其相关miRNA靶标。
在cAMP条件下,我们鉴定出65个与表达模式相似的miRNA结合的差异表达lncRNA;在mGluR1/5信号通路中则发现8个此类lncRNA,其中2个为两条信号通路所共有(图2A)。我们构建了miRNA/lncRNA/mRNA互作网络,针对两种受DHPG调控的lncRNA(Gm38182和Pvt1)的分析显示,网络中大多数miRNA的mRNA靶标呈现下调趋势,表明这些lncRNA可能未在mGluR1/5信号通路中发挥ceRNA功能(图2B、C)。此外,我们分析了在cAMP和mGluR1/5信号通路中均上调表达的lncRNA MIRG,发现其潜在互作因子miR-3086-5p在两条通路中均显著上调(图2D)。该miRNA的16个已知mRNA靶标在cAMP信号通路中同样呈现上调,这表明尽管MIRG在两种信号环境中均被激活,但可能仅在cAMP信号通路中作为ceRNA发挥作用。
对63种仅由cAMP信号通路上调的lncRNA进一步分析发现,其中Gas5在cAMP信号作用下呈现显著上调(图S8B)。通过交叉检索starBase和TargetScan数据库,发现两个可与该lncRNA结合的miRNA:miR-26a-5p[30]和miR-9-3p[31],这两种miRNA均在大脑中富集并参与神经元及认知功能。值得注意的是,实验已证实Gas5可与miR-26a-5p结合[32]。与MIRG类似,我们观察到同时受Gas5及这些miRNA调控的多数mRNA在cAMP信号激活时同样出现上调(图2E、图S8A)。这表明Gas5可能在cAMP信号传导过程中作为ceRNA在海马神经元中发挥作用。
为深入阐明cAMP对Gas5的转录调控机制,我们检测了福斯高林处理后不同时间点的Gas5表达水平。分别以30分钟、1小时、3小时和6小时的时间点处理神经元后,发现Gas5表达在3小时达到峰值,6小时后恢复至接近基线水平(图3A、B;数据文件S3)。这些结果表明Gas5可能作为海马神经元中的即刻早期反应lncRNA发挥作用。
¶ 6. Gas5的树突定位由分子马达蛋白KIF1A介导
为评估Gas5的功能,我们检测了其亚细胞定位。采用DIG标记的核糖探针进行荧光原位杂交(FISH)分析,并结合MAP2(树突标志物)复染,结果显示Gas5同时存在于胞体和树突中(图S6C)。这种树突定位提示其可能参与调节突触功能,该发现与近期研究证实在恐惧条件反射后Gas5定位于树突棘的结果一致[67]。
为进一步阐明Gas5的亚细胞分布,我们设计了25个覆盖Gas5 lncRNA全长的冗余荧光探针。FISH与免疫细胞化学(ICC)联合检测显示,Gas5以点状信号形式分布于细胞核、胞体及远端突起(图3C)。点状信号定量分析表明,相较于远端突起和细胞核,Gas5在胞体中富集程度更高(图3D)。值得注意的是,Gas5点状信号与胞体的距离存在差异,多数位于1000μm范围内,但有些可延伸至4500μm(图3E)。这一观察到的树突定位促使我们深入研究Gas5亚细胞分布的分子机制。
我们先前的研究以及其他团队的工作均强调了特定驱动蛋白家族成员(KIFs)在介导神经元内RNA定位中的作用[51,65,66]。值得注意的是,我们已证实lncRNA ADEPTR的定位依赖于KIF2A[51],而SLAMR lncRNA的定位则需要KIF5C的参与[70]。因此,我们重点探究了KIFs是否介导Gas5的树突定位。
我们采用SMARTpool siRNA敲低原代海马神经元中的部分KIFs亚型(KIF1A、KIF2A、KIF5C和KIF16B),并检测突触小体中Gas5的丰度。转染48小时后,与乱序对照组(siNC)相比,KIF1A、KIF2A和KIF5C的siRNA均能有效敲低其靶标表达(图S7F;数据文件S8)。对分离突触小体中Gas5水平的后续分析显示,敲低KIF1A可显著降低Gas5丰度(图3F、G;数据文件S8)。为验证KIF1A在Gas5定位中的作用,我们通过FISH分析发现KIF1A敲低能显著减少细胞体与树突中Gas5斑点的数量(图3H、I;数据文件S3)。这些结果共同表明KIF1A对维持Gas5的正常亚细胞定位至关重要。
¶ 7. Gas5与miR-26a-5p相互作用,并对其靶标维持cAMP依赖性稳定性至关重要
我们接下来研究了miR-26a-5p和miR-9-3p及其靶mRNA的表达是否依赖于Gas5的表达。为探究这一问题,我们采用锁核酸缺口寡核苷酸(LNA gapmers)通过RNAse H特异性靶向降解Gas5。将这些缺口寡核苷酸单独或联合转染至神经元中72小时,同时设置乱序对照序列,随后评估cAMP依赖性基因表达变化。数据证实这些缺口寡核苷酸能有效抑制cAMP诱导的Gas5表达上调(图4A;数据文件S3)。
随后,我们重点关注了两组受福斯高林上调的基因:一组是miR-26a-5p的专属靶标(Klf4、Plp1、Ugt8a),另一组是miR-26a-5p与miR-9-3p的共同靶标(Hspa4、Cops2、Kcnh7)。Gas5敲除可抑制cAMP诱导的三分之二miR-26a-5p专属靶标(Plp1与Ugt8a)表达上升(图4B;数据文件S3)。与之相反,两种miRNA共同靶向的三个基因表达均未受Gas5敲除影响。这些发现表明Gas5对于cAMP依赖性增强miR-26a-5p靶标至关重要。我们还观察到Gas5敲除会降低即刻早期基因Arc的表达——该基因在我们的数据集中与任何cAMP调控的miRNA均无关联,提示Gas5可能通过不依赖miRNA的机制来稳定Arc表达。
转录本(lncRNA、mRNA和miRNA)的丰度是ceRNA功能的一个关键决定因素。对我们RNA-seq数据的重新分析表明,Gas5的基础水平和激活后转录水平(TPM)与cFos mRNA相当甚至更高(图S8A)。值得注意的是,基础Gas5水平比多种经过深入研究的lncRNAs(如Meg3、Neat1、Ube3a、Uchl1os和Paupar[29,86,97])更为丰富。独立验证实验进一步证实,基础Gas5的倍数变化(以18S rRNA标准化)超过了Arc mRNA(图S8B)。
为了进一步了解Gas5对miRNAs的调控机制,我们在福斯高林处理海马神经元30分钟后检测了成熟miR-26a-5p的水平,观察到miR-26a-5p表达上调(图4C;数据文件S3)。为深入探究miRNA调控机制,我们在神经元中瞬时过表达成熟miR-26a-5p模拟物,并在转染48小时后检测Gas5水平。尽管通过qPCR确认了miR-26a-5p的过表达,但发现Gas5水平无明显变化(图4D)。这一结果与Gas5充当miRNA海绵、将miRNA与其靶标分离的假说相一致。
为验证直接的miRNA-lncRNA相互作用,我们进行了荧光素酶报告实验。将成熟miR-26a结合的野生型Gas5区域(图4E)克隆至pGL3载体,并与miR-26a模拟物共表达。采用编码Gas5区域突变序列的载体作为对照。在miR-26a-5p缺失条件下,野生型与突变型载体之间的荧光强度差异无统计学意义,且仅野生型Gas5编码载体的荧光活性被miR-26a-5p模拟物抑制(图4F;数据文件S3),由此验证了该相互作用。
¶ 8. 海马神经元中Gas5相互作用伙伴的表征
为了深入了解Gas5的作用机制,我们利用RNA测序(RNA-seq)、miRNA测序(miRNA-seq)和蛋白质组学技术对其相互作用组进行了全面分析。我们采用全长Gas5转录本生物素标记诱饵[33],从成熟原代海马神经元中进行了Gas5下拉实验,反义探针作为阴性对照。从链霉亲和素-生物素复合物中分离的RNA进行了总RNA和小RNA测序分析。
基于欧几里得距离对总RNA样本进行层次聚类分析,结果显示三个正义链重复样本紧密聚集,与三个反义链重复样本明显分离(图4G)。差异表达分析鉴定出610种特异性富集Gas5的RNA(图4H;数据文件S4)。基因生物类型分析证实这些RNA包含多种编码和非编码RNA。值得注意的是,GO分析表明这些RNA主要与突触组织(如Camk2a、Syn1、Dlgap3)、细胞连接(如Rapgef1、Plec、Ajuba)及运输功能(如Kif5c、Kif5a、Kif1b)相关(图4I、图S5A;数据文件S4)。对这些复合物进行小RNA测序,发现8种特异性富集Gas5的miRNA(图4J;数据文件S4),但这些miRNA与我们预测的Gas5靶标并未出现重叠(图2E)。
与Gas5相关的RNA在远离胞体的过程中(如突触组织和细胞连接)占主导地位,加之其相互作用伙伴相对较少,表明Gas5是通过更大的核糖核蛋白复合物(RNP)发挥作用[34],而非通过反义相互作用。为鉴定相关蛋白,我们通过下拉Gas5(或反义探针对照)分离蛋白质复合物,并进行LC-MS/MS分析。差异分析显示,与反义对照相比,有58种蛋白在Gas5复合物中特异性富集(图4K;数据文件S4)。这些蛋白主要参与突触组织(如GSK-3β、TUBB5、APOE)、凋亡(如TPT1、PDIA3、CLU)和病毒过程(如HSPA8、RAB7、P4HB)(图4L、图S5B;数据文件S4)。
为验证这些发现,我们将数据与先前海马组织Gas5下拉蛋白质组学研究(Wang等, 2021)[33]进行比对,发现八个在RNA结合/剪接/翻译、磷酸化及细胞骨架构建中起作用的蛋白质存在重叠(图S5C)。质谱分析证实了数据的可靠性(图S5D)。为进一步验证,我们重点关注糖原合酶激酶-3β(GSK-3β),该蛋白在Gas5沉降复合物中富集(图S3)。通过cAMP刺激后使用Gas5探针进行沉降实验,我们验证了该相互作用(图5A)。在裂解和沉降前,用福斯高林或DMSO处理原代海马神经元30分钟。结果显示Gas5与总GSK-3β及磷酸化GSK-3β均存在结合,且福斯高林处理导致磷酸化与总GSK-3β比例升高(图5B-E)。
为进一步探究Gas5与GSK-3β的相互作用,我们在完成FISH和ICC分析后进行了超分辨率成像。典型图像(图5F)显示Gas5与GSK-3β在细胞体内空间相邻,并在远端突起的独立结构中存在共定位(图5F)。皮尔逊相关性与曼德尔重叠分析表明Gas5与GSK-3β具有强相关性(图5G)。线性强度分析进一步佐证了共定位特征(图S5D)。
使用开源算法[RNA相互作用组百科全书(ENCORI)]进行的计算机模拟分析表明,编码激酶GSK-3β的mRNA是miR-26a-5p的靶标(图S6A)。实验验证显示,瞬时过表达miR-26a-5p会导致GSK-3β在mRNA水平显著降低(图5H;数据文件S5)。此外,使用gapmer对Gas5进行瞬时敲低也引起GSK-3β编码mRNA表达下调(图5I)。与这些观察结果一致,我们的RNA-seq数据显示Gas5与GSK3B mRNA水平相当(图S8A)。鉴于GSK-3β在突触可塑性与神经退行性疾病中的作用[62,63],Gas5可能通过其与GSK-3β的相互作用调控这些过程。
¶ 9. Gas5及其互作因子的表达在阿尔茨海默病小鼠模型中受损
非编码RNA网络的调控失常,尤其是miRNA和lncRNA,在阿尔茨海默病(AD)中已有充分记录[56]。Gas5水平改变在AD中的影响仍是当前研究热点[57-58]。在AD小鼠模型和患者样本中均观察到miR-26a-5p水平升高[59-60]。鉴于我们发现cAMP信号传导(在神经退行性疾病中会出现紊乱[61])会促使Gas5富集,我们研究了阿尔茨海默病小鼠模型中Gas5及其相互作用组的表达水平。
为此,我们采用携带5个AD相关突变的人源APP和PSEN1转基因的5XFAD小鼠(APP基因的瑞典突变K670N/M671L和佛罗里达突变I716V,以及PSEN1基因的M146L和L286V突变),并设置同龄对照组。通过qRT-PCR检测海马组织中Gas5、GSK-3β和miR-26a-5p水平。在野生型小鼠中,Gas5丰度与miR-26a-5p(以U6 snRNA标准化)和GSK3β编码mRNA相当,这符合我们竞争性内源RNA假说的关键条件(图S8C)。
分析显示,与对照组相比,AD小鼠的Gas5水平显著下降(图5J、图S8C;数据文件S5)。相反,我们观察到AD小鼠中miR-26a-5p表达上调(图5K)。值得注意的是,AD小鼠中GSK-3β水平也出现上调,表明GSK-3β在AD中具有更为复杂的调控层面(图5L)。
¶ 10. cAMP信号通路的激活减弱了Gas5与其相关RNPs之间的相互作用
鉴于Gas5在海马神经元中与多种mRNA及非编码RNA存在相互作用,我们探究这些相互作用是否受cAMP信号通路调控。我们提出假说:Gas5能够响应cAMP信号形成包含多种RNA和蛋白质的多核糖核蛋白复合体。为确定Gas5中介导这些相互作用的关键区域,并评估cAMP信号是否会改变其相关RNP复合体的组成,我们对Gas5-RNP复合体进行了RNase保护实验。
我们合成了生物素标记的全长558 bp Gas5转录本,在固定前用福斯高林或DMSO处理30分钟的多聚甲醛固定原代海马神经元中进行拉降实验。通过RNase消化Gas5拉降复合体后,采用蔗糖垫超速离心法提取结合RNA片段,并对这些片段进行RNA测序(图6A)。
出人意料的是,福斯高林处理导致Gas5的核糖核酸酶可及性显著增加(图6B),并降低了几种mRNA的富集度(图6C)。通过整合基因组浏览器(IGV)对富集mRNA进行检测发现,Myh9和Jun mRNA的特定片段在DMSO条件下被特异性富集,但在福斯高林处理后则被隔离(图6D)。相反,伪基因Obox-ps27的表达在福斯高林条件下显著富集,且以某个特定片段为主(图6D)。这些发现通过qPCR分析得到了独立验证(图6E;数据文件S6)。综上所述,这些结果表明cAMP信号通路可诱导Gas5及其相互作用组的核糖核酸酶敏感性发生动态变化,从而调节其在树突中的隔离功能(图6F、G)。
¶ 11. Gas5介导cAMP而非代谢型谷氨酸受体1/5诱导的突触传递及网络活动变化
Gas5与多种已知影响突触可塑性的成分(如GSK-3β)相互作用,表明其在调节cAMP诱导的突触传递变化中可能发挥作用。为验证此假设,我们采用高密度微电极阵列(HD-MEA)技术,检测海马神经元中Gas5功能缺失后cAMP诱导的突触传递及网络活动变化。同时通过相同实验条件下测定已知mGluR1/5激动剂DHPG诱导的突触传递变化,进一步验证Gas5作用的特异性。
在体外培养第16天(DIV 16),将铺植于HD-MEA Accura芯片(3Brain AG)上的海马神经元分别转染Gas5特异性缺口寡核苷酸或乱序对照缺口寡核苷酸。48小时后,分别使用福斯高林或DHPG处理神经元以诱导cAMP或mGluR1/5信号通路,并设置DMSO处理作为对照(图7A)。在药理处理前通过多芯片电生理记录确定神经元的基线健康状态和自发活性(电影S1)。MEA芯片基线设定截止值为50μV以降低噪声,峰值检测阈值设为≥100μV。若电极显示每分钟>10个峰值则判定为活性电极,网络爆发定义为至少30个电极的活动(每个电极具有>10个峰电位,峰电位间隔为<100毫秒)。网络爆发频率的计算方式为爆发总次数除以分析时长。
MEA记录的代表性趋势图(图7B、D)显示,平均放电率(MFR)在28-29次/秒达到峰值,大多数超过15次/秒。Gas5基因敲低甚至在药理处理前就引发了放电行为的显著差异(图7B、数据文件S7及影片S2-S4)。具体而言,Gas5敲低导致放电强度和频率降低,且在福斯高林给药后效应更为显著。福斯高林在对照组神经元中诱导了强烈且一致的响应,其特征为更密集、更频繁的放电序列(图7B与影片S3)。相较之下,Gas5敲低神经元的放电序列均匀度降低,放电密度减弱(图7D与影片S5)。数据定量分析(图7C)显示,基础平均放电率与福斯高林处理前的MFR无显著差异,但显著低于福斯高林处理后的MFR。在Gas5敲低组中(图7E),基础平均放电率与福斯高林处理前存在差异,且两者均显著低于福斯高林处理后。这些结果表明,敲低Gas5基因在自发放电和cAMP诱发条件下均会削弱动作电位密度(图7F)。
我们还观察到Gas5基因敲低会影响神经元放电的峰值振幅。来自四个神经元的代表性轨迹(图7G)显示,在Gas5敲低组和对照组中,福斯高林均能引发强烈响应(≥±500μV),但定量分析(图7H)表明,无论是在福斯高林处理前还是处理后,Gas5敲低组的振幅均显著低于对照组。在放电间隔方面也观察到类似趋势(图7I),与Gas5敲低组相比,对照组在福斯高林处理前后的不应期持续时间更短。这些结果表明功能性Gas5的缺失会损害尖峰放电密度和动作电位强度对cAMP信号的反应。
随后我们评估了Gas5是否也介导mGluR1/5信号通路诱导的突触传递变化。激活mGluR1/5的DHPG处理导致网络活动减弱。代表性趋势图(图7J、K)显示,虽然对照组(NC组)和Gas5敲低组在DHPG处理前均表现出较强的平均放电频率,但经DHPG处理后放电活动几乎完全消失(影片S6和S7)。进一步分析显示,在未使用DHPG的组别间平均放电频率存在显著差异,但对DHPG的响应未见显著差异(图7L)。与对照组相比,DHPG处理也未影响Gas5敲低组神经元的峰峰值振幅(图S7C)。这些结果表明,尽管DHPG能显著抑制基础突触传递,但Gas5缺失并未改变DHPG诱导的效应。
最后,我们评估了Gas5功能缺失是否会影响由福斯高林或DHPG诱导的神经元网络表型。整个MEA的点阵图显示,对照组条件下网络突发呈现规律模式,经福斯高林处理后这些突发变得更为密集且持续时间延长(图S7A)。相比之下,Gas5敲除导致网络突发显著减少且密集度降低(图S7A)。进一步分析表明,与Gas5敲低组相比,对照组在福斯高林处理前后的爆发频率均显著更高(图S7D;数据文件S7)。在网络爆发持续时间方面也观察到相似趋势(图S7E)。另一方面,DHPG诱导的信号传导则显著减弱了NC组和Gas5敲低神经元的群体爆发活动(图S7B)。这些结果表明,Gas5 lncRNA选择性介导cAMP信号传导诱导的突触传递和神经网络活动变化。
¶ 12. Gas5功能缺失损害树突分枝和树突棘密度
我们的分子和电生理学数据表明,Gas5在维持神经元形态——特别是树突分枝和树突棘密度方面起着关键作用。为评估Gas5功能缺失对这些参数的影响,我们研究了海马神经元的树突分枝与树突棘形态。
使用gapmer敲低Gas5后,三级树突分枝数量(60至110μm)相较于对照组神经元显著减少(图8A、B;数据文件S8),但二级分枝(20至50μm)未见明显差异。此外,Gas5敲低神经元的树突棘密度、细小型与蘑菇型树突棘占比均显著降低(图8C-E;数据文件S8)。这些发现表明,正常的Gas5功能对维持海马神经元的树突分枝结构与树突棘形态至关重要。
为深入理解这些形态变化的分子基础,我们研究了Gas5功能缺失的转录组学效应。我们假设Gas5敲低可能影响神经元形态关键基因的表达。在使用gapmer进行Gas5敲低后,我们进行了全RNA测序(图8F)。差异表达转录本生物类型分析(图S5E)显示,在219个受干扰基因中,大多数(142个基因,占64.8%)为蛋白质编码基因,其次是加工假基因(43个基因,占19.6%)和lncRNA(34个基因,占15.5%)。显著下调的基因包括早期应答基因(如Egr1、Egr2和Arc)以及翻译因子编码基因Eif3e(图8G;数据文件S8)。此外,对神经元生理至关重要的基因(如Rheb和Cftr)也出现下调。Gas5敲低组中有多个lncRNA出现表达异常,包括Hotairm1、Macrod2os1及Gas5本身。值得注意的是,改变基因中有相当一部分是假基因。
为验证测序数据,我们针对5个候选基因(Arc、Egr1、Rheb、Cftr和Hotairm1)设计了特异性引物。后续qPCR数据显示,验证组中Arc、Egr1、Rheb和Cftr的表达确实下调,而Hotairm1表达升高(图S7G;数据文件S8)。GO分析表明这些RNA参与多种生物学过程,包括轴突导向(涉及Cdk5、Epha6、Rock2、Sema3e、Lrig和Srgap3)、cAMP信号通路(涉及Hcn4、Abcc4和Myl9)、肌动蛋白细胞骨架调控(涉及Arpc4、Egfr和Itga11),并与肌萎缩侧索硬化症和阿尔茨海默病等神经退行性疾病相关(涉及Frat1、Casp12、Adam10、Rtn3和Tuba1b)(图8H;数据文件S8)。
¶ 讨论
本研究探讨了cAMP和mGluR1/5信号——这两种对突触传递和神经元形态具有相反作用的通路——如何影响编码与非编码转录组。我们的分析发现lncRNA Gas5是cAMP诱导变化的关键中介因子,这些变化会影响兴奋性突触传递和神经元结构。
我们接下来分析了差异表达的miRNAs、lncRNAs和mRNAs之间的相互作用。在DHPG数据集中,上调的miRNAs与减少的靶标mRNAs相关。然而,在cAMP数据集中,许多miRNA靶标被矛盾地上调,表明存在竞争性内源RNA(ceRNA)机制。通常,miRNAs介导转录本抑制[40],但近乎完美的互补性可能引发miRNA降解[41]。生物信息学和功能实验证实,Gas5作为miR-26a-5p的ceRNA,保护了靶标Plp1和Ugt8a的表达,这些基因参与髓鞘形成——表明这种调控相互作用也可能发生在少突胶质细胞中。ceRNA组分的丰度是关键。我们的RNA-seq数据显示,Gas5的水平与GSK3B和cFos相当或超过它们,还超过了著名的lncRNAs(如Meg3、Neat1和Ube3a)。独立的qPCR验证证实,Gas5水平超过了Arc,并且其丰度与miR-26a-5p和GSK3B在海马神经元和AD模型小鼠组织中都相当。进一步的证据通过单一位点相互作用支持Gas5的ceRNA功能。
先前的研究显示,Gas5吸附多种miRNAs以调节基因表达,涉及肾损伤[88]、冠状动脉疾病[89]和动脉粥样硬化[90]。类似地,其他lncRNAs如SCAMP1[91]、NORAD[92]和KCNQ1OT1[93]在癌症模型中被证明能够隔离miR-26a-5p。这些研究支持了miR-26a-5p是lncRNA介导基因调控核心节点的观点。受此启发,我们分析了Gas5相互作用组,发现610种富集的RNA参与突触组织、运输和细胞粘附等关键过程——这些都是局部突触处的翻译过程[46,47]。八种miRNAs与Gas5相互作用,但无一与数据库中的预测靶标匹配,表明直接mRNA结合。先前的研究表明,Gas5与RNA结合蛋白如AGO2[45]和EIF4E[43]相关联。我们的蛋白质组学分析揭示了58种参与突触组织和细胞凋亡的蛋白。值得注意的是,编码可塑性关键调控因子GSK-3β的mRNA位列其中,cAMP刺激会增强其与Gas5的相互作用。功能实验证实了这一关联,支持了包含Gas5、miR-26a-5p和GSK-3β的调控轴。
本研究在海马体中鉴定出的8个Gas5相互作用蛋白与Wang等人[33]的发现存在重叠,表明Gas5是更大的核糖核蛋白复合体组成部分。这些动态、无膜结合的复合结构可调节突触可塑性,其功能紊乱可能导致神经退行性病变。鉴于Gas5的相互作用特征及树突定位特性,它很可能在突触部位的核糖核蛋白复合体中发挥功能。
基于这些发现,Gas5似乎在基因调控、突触传递和可塑性中发挥着重要作用——这些过程在阿尔茨海默病等神经退行性疾病中显著受损[61]。在我们的AD模型5XFAD小鼠中,Gas5水平降低,而miR-26a-5p水平升高。出乎意料的是,GSK3B水平有所增加,这表明在小鼠海马体中,其在AD中的调控可能不依赖于miRNA[71–72]。
为了精确定位Gas5中的相互作用区域,我们进行了RNA酶可及性图谱分析。在静息神经元中,Gas5大部分区域受到RNA酶保护,表明存在RNA或蛋白质相互作用。cAMP刺激后,部分区域变得对RNA酶敏感,提示其相互作用组发生动态重构以支持突触传递。这些结构变化延伸至Gas5的RNA相互作用组,后者也表现出cAMP依赖的RNA酶敏感性改变,表明Gas5可作为树突RNP复合物的可调节支架。这种可调节性可能涉及cAMP诱导的相关蛋白质或RNA的修饰。
由于强烈的转录组信号,我们进一步探究了Gas5是否在功能上介导突触变化。在MEA实验中,Gas5基因敲除削弱了福斯高林诱导的兴奋性突触活动增强,这支持了其在突触传递中的直接作用。尽管其他lncRNA(如Gm12371)也被发现与福斯高林反应相关,但其特异性尚不明确。在此研究中,Gas5作为通路特异性介导因子脱颖而出。
鉴于形态学与突触可塑性之间的紧密联系[64],我们同时评估了结构性效应。Gas5基因敲低会导致树突分枝减少。对照组神经元维持锥体形态结构,而Gas5缺陷神经元则呈现伸长形态,其三级分枝减少、树突棘密度降低,尤其是细丝状和蘑菇状树突棘。这些形态变化与即刻早期基因、ERG复合体组分及突触相关基因的表达下调相吻合[54,73],凸显了Gas5在维持树突结构与信号传导中的重要作用。由于Gas5在细胞核、胞体及树突中均有表达,后续研究需进一步明确其区域特异性功能。
总之,这些发现表明树突定位的Gas5对兴奋性突触功能与结构——这一学习记忆的核心进程——具有关键作用。该结论与多项研究相吻合,这些研究表明lncRNA在学习及长期记忆过程中发挥重要作用[67–70]。Liau等人[67]发现Gas5在突触中富集,并与RNA结合蛋白(RBPs)相互作用以调控RNA运输,其敲低会损害恐惧记忆消退。Meier等人[69]观察到海马体中Gas5水平与焦虑相关行为呈负相关,并在应激反应中升高。同样地,Banerjee等人[74]的研究表明,母性分离应激会上调Gas5表达,从而导致空间记忆缺陷。
我们的研究揭示了海马神经元中与cAMP和mGluR1/5信号传导相关的编码RNA和非编码RNA在基因表达层面的变化。此外,研究结果还揭示了lncRNAs(特别是Gas5)的选择性招募及其相互作用组的动态修饰在介导cAMP信号传导中的作用。理解调控lncRNA相互作用组稳定性及其区室特异性功能的机制,对于破译树突中lncRNA功能的分子基础至关重要。
¶ 材料与方法
¶ 1. 动物
CD1孕鼠(查尔斯河实验室)在12小时光照/12小时黑暗的循环光照条件下单独饲养,自由摄取食物和水。实验在昼夜周期的光照阶段进行。动物饲养、护理及实验程序均符合《实验室动物护理和使用指南》规范,并已获得沃特海姆UF斯克里普斯研究所动物护理与使用委员会的批准。
¶ 2. 原代海马神经元培养
从E18 CD1小鼠幼崽中分离出海马体,将其铺在聚-D-赖氨酸包被的培养板上,培养基为含有Glutamax、青霉素-链霉素和5%胎牛血清的Neurobasal培养基。神经元铺板密度根据各实验需求确定。铺板四小时后,更换为含Glutamax、青霉素-链霉素及2% B27补充剂(Invitrogen)的Neurobasal维持培养基,此后每4天更换一半培养基,实验全程在37°C、5% CO₂条件下培养直至实验时间点。
¶ 3. 定量实时PCR(qRT-PCR)
使用Trizol提取RNA,并采用qScript cDNA SuperMix(Quanta Bio)和/或TaqMan MicroRNA逆转录试剂盒(Thermofisher)将其逆转录为cDNA。在384孔板中使用SYBR Green预混液或TaqMan Fast Advanced Master Mix(Thermofisher)进行qRT-PCR,通过ABI 7900热循环仪(Applied Biosystems)检测。采用18S rRNA的Ct值计算dCT值进行标准化,随后通过2⁻ΔCT法进行相对定量。
对于突触小体制备后的qRT-PCR:将6孔汇集神经元在SynPER试剂中裂解,并按制造商说明分离突触小体沉淀。使用Trizol及Zymo Micro RNA试剂盒从沉淀中提取RNA。所有引物序列列于补充材料(数据文件S1)。
¶ 4. 总RNA和小RNA测序与分析
总RNA和小RNA测序均按照Wertheim UF Scripps研究所基因组学核心实验室的流程进行。
- 样本处理:总RNA样本经DNase I(NEB公司,伊普斯维奇市)处理,并通过PureLink RNA Micro试剂盒(Invitrogen公司,卡尔斯巴德市)纯化。随后使用Qubit 2.0荧光计(Invitrogen公司)进行定量,并在安捷伦2100生物分析仪RNA纳米芯片(安捷伦科技公司,圣克拉拉市)上进行质量评估(所有RNA样本的RNA完整性指数RIN>8.5)。
- 文库构建:RNA-seq文库使用Illumina TruSeq链状总RNA建库试剂盒(Illumina公司,圣地亚哥市),按制造商方案以每样本300ng输入RNA进行制备;小RNA-seq文库采用Illumina TruSeq小RNA建库试剂盒(Illumina公司),以1μg输入RNA构建。最终文库经生物分析仪DNA芯片验证后按等摩尔比例混合,小RNA混合池通过6%聚丙烯酰胺凝胶进行尺寸筛选(回收145bp至160bp产物)。
- 测序与数据分析:纯化后的文库以1.8pM终浓度上样至NextSeq 500测序流动槽(Illumina公司),采用2×40bp测序策略,平均每个样本生成2200-2700万条读长(总RNA-seq)和400-1400万条读长(小RNA-seq)。Fastq文件首先通过fastqc[75]进行质量评估,并在高性能计算机集群上使用Trim Galore进行修剪。随后使用Salmon v1.10.1[76]将Fastq读段比对至小家鼠转录组(基于Ensembl注释),生成原始计数和TPM数据。数据通过tximport[77] Bioconductor程序包导入R语言环境,采用R基础程序包/factoextra程序包进行欧氏距离层次聚类与主成分分析,结果通过ggplot或pheatmap绘图程序包可视化。差异表达分析使用DESeq2[78]进行:总RNA-seq中采用0.05的p-adj值将FDR控制在5%;小RNA测序因可用于多重检验校正的miRNA基因数量有限,仅使用0.05的p-value截断值。部分火山图未展示非差异表达基因,并将y轴标准化为平方根−log₁₀(p值或padj)以清晰呈现数据。GO通路分析采用clusterProfiler[79]软件包进行,基因生物类型通过biomaRt[80]包注释。
¶ 5. 多尺度网络分析
MEGENA[81]网络通过R包MEGENA构建,输入数据为DESeq2分析确定的福斯高林(FSK)vs DMSO或DHPG vs DMSO中的上调基因。对全部上调基因的TPM值进行平面性检验以构建平面过滤网络(PFN),随后对所得PFN进行多尺度聚类分析以识别共表达模块。筛选包含最多基因且显著性最强(由MEGENA判定)的模块,最终发现C1_5模块。所有网络图谱均采用Cytoscape[82]中的边加权力导向布局算法生成。
¶ 6. 揭示顺式长链非编码RNA/mRNA对
在福斯高林和DHPG数据集中,均采用显著差异表达(校正后p值<0.05)的lncRNA和mRNA进行分析。首先通过biomaRt按生物类型筛选lncRNA,随后利用biomaRt在lncRNA转录起始位点上下游100kb范围内检索所有显著性mRNA。所有匹配结果均通过UCSC基因组浏览器进行个体验证,以确定精确的顺式作用关系。
¶ 7. 构建miRNA/lncRNA/mRNA互作网络
一旦确定目标miRNA,通过TargetScan和starBase两个数据库筛选其预测靶标,并与全转录组测序数据集中具有统计学显著性的基因(包括mRNA、加工转录本、假基因和lincRNA)进行交叉比对。采用Cytoscape对miRNA-靶标相互作用网络进行可视化,红色和绿色分别代表下调和上调的靶标。
¶ 8. 质粒构建体、LNA缺口聚体和siRNA的转染
- 试剂来源:靶向Gas5的LNA缺口寡聚物由Exiqon(现为QIAGEN)生产;靶向Kif1a、Kif2a、Kif5c、Kif16b和siNC的SMARTPool siRNA库由Dharmacon公司生产。
- 转染方法:采用Lipofectamine RNAiMax(Invitrogen)进行转染。根据制造商指南,将缺口寡聚物或siRNA导入培养12至14天的原代海马神经元。
¶ 9. RNA荧光原位杂交(FISH)和免疫荧光(ICC)
- 探针制备:将Gas5 cDNA的两个300-400 bp片段亚克隆至PCRII TOPO载体中,通过体外转录制备地高辛标记的探针用于FISH实验。抗地高辛Fab片段抗体(罗氏)按1:4000浓度使用,酪胺信号放大试剂盒(Akoya Biosciences)参照制造商说明操作。此外,通过Stellaris设计软件设计25条靶向Gas5的20碱基冗余探针(偶联Quasar570染料),探针序列列于补充材料(数据文件S1)。
- 实验流程:FISH实验严格遵循制造商指南;免疫荧光实验根据需求与FISH联用或单独进行。样本分别在马克斯·普朗克佛罗里达研究所光学显微中心的蔡司LSM 880共聚焦显微镜及UF斯克里普斯生物医学研究影像核心的奥林巴斯IX81完成成像(所用抗体:GSK-3β(27C10-CST)、β-肌动蛋白(8H10D10-CST)及Alexa Fluor偶联二抗)。神经元以低密度铺板(24孔板每孔80,000细胞)以实现单神经元成像,减少相邻神经元信号干扰。
- 超分辨率成像:使用斯克里普斯佛罗里达影像中心配置的蔡司Elyra PS.1系统(德国卡尔蔡司),在SIM模式下采用63倍/1.4 NA油浸复消色差物镜,以1028×1028像素分辨率采集图像。对405、488和561通道采用5种图案旋转和3次平移偏移,每个图像采集20-25层z轴堆栈,通过3个通道(SIM光栅)采集,并经后处理以显示最大强度投影图像或单切片图像(使用Zen Black软件进行SIM重建)。
¶ 10. 蛋白质组学与分析
- 样本处理:蛋白质通过SDS-PAGE分离,用水冲洗后在端到端摇床上固定过夜(10%冰醋酸,30%乙醇)。质谱分析时,分别切出反义和正义探针组对应的条带,在凝胶内进行胰蛋白酶(Pierce Biotechnology,Rockford,IL)消化:先使用二硫苏糖醇和碘乙酰胺进行还原和烷基化处理,随后采用ProteaseMax™表面活性剂胰蛋白酶增强剂在37°C下消化3小时。提取的肽段经ZipTip(Millipore,Billerica,MA)C18柱(2毫克载量)净化。
- LC-MS/MS分析:使用Orbitrap Fusion Tribrid质谱仪进行分析。肽段从EASY PepMap™ RSLC C18色谱柱(2微米,100Å,75微米×50厘米,Thermo Scientific,San Jose,CA)洗脱进入质谱仪,采用梯度洗脱程序:90分钟内溶剂B(80/20乙腈/水,0.1%甲酸)从5%升至25%,随后30分钟内从25%升至44%,0.10分钟内从44%升至80%,维持80%溶剂B 10分钟,3分钟内降至5%并维持3分钟;后续延长梯度程序用于清洗色谱柱。所有流速均为250纳升/分钟,由nEasy-LC1000纳升液相系统(Thermo Fisher Scientific,San Jose,CA)输送(溶剂A为0.1%甲酸溶液)。离子通过EASY Spray源在45°C、2.3kV电压下生成。
- 数据采集与分析:数据依赖性扫描由Xcalibur v4.0.27.10软件执行:先在Orbitrap分析器中进行350-2000质荷比(m/z)的全扫描(分辨率120,000),随后对最强离子实施更高能量碰撞解离(HCD)串联质谱(MS/MS)分析(归一化碰撞能量30%,自动增益控制1.0E4,分辨率30,000)。动态排除设置为25秒内重复离子排除。串联质谱数据比对Uniprot(UP000000589,2020年3月3日下载)小鼠蛋白质组序列及Proteome Discoverer v2.5.0.400内置常见污染蛋白数据库进行检索。检索时设定完全胰蛋白酶酶切(最多允许2个漏切位点),可变修饰包括甲硫氨酸氧化(15.995 Da)、天冬酰胺和谷氨酰胺脱酰胺化(0.984 Da),半胱氨酸氨基甲酰甲基化(57.021 Da)为静态修饰。通过反向数据库检索确定XCorr评分截断值[83],以99%置信度鉴定蛋白质。采用Minora特征检测器节点检测色谱峰和特征。蛋白质与肽段鉴定结果通过Scaffold v5.0.0(Proteome Software公司,波特兰)可视化,接受通过至少两条肽段鉴定(肽段与蛋白质错误发现率均控制在1%以内)的蛋白质。采用经Benjamini-Hochberg校正的配对t检验,以(p<0.05)作为标准化谱图计数统计显著性的判定标准。
¶ 11. 蛋白质印迹法(免疫印迹)
为验证下拉蛋白质组学研究中Gas5的蛋白质相互作用,按上述方法用福斯高林或DMSO处理原代海马神经元。经过交联处理并使用Gas5正义链、反义链探针或对照IgG探针进行下拉实验后,用RIPA裂解液(50 mM Tris-HCl、150 mM NaCl、1.0% (v/v) NP-40、0.5% (w/v) 脱氧胆酸钠、1.0 mM EDTA、0.1% (w/v) SDS、0.01% (w/v) 叠氮化钠,pH 7.4)裂解神经元,通过BCA试剂盒测定蛋白浓度。取25-30 μg蛋白质进行Western印迹分析(所用抗体:GSK-3β [27C10, Cell Signaling Technology (CST)]、磷酸化GSK-3β (Ser9) (5B3, CST) 及β-肌动蛋白(8H10D10, CST))。采用1:5000稀释的抗兔HRP偶联二抗(#5127, CST)或抗小鼠HRP偶联二抗(#7076, CST)检测靶蛋白,最后通过化学发光法(Amersham Biosciences, Piscataway, NJ)显影。使用ImageJ软件对印迹条带进行分析。
¶ 12. 荧光素酶报告基因检测
将含有潜在miR-26a-5p结合位点的小鼠Gas5基因野生型(WT)及突变型(MUT)3′UTR序列,通过XbaI限制性酶切位点插入pGL3 Basic荧光素酶载体(Promega公司,美国)中Luc基因的紧下游位置,所得质粒分别命名为Gas5-WT与Gas5-MUT。
- Gas5-WT序列:5’-gtgagaactgcaaatgcttaaccgggaacctactccagaatacatgatgatctcacacaacttgaactctctcactgattacttgatgatagtaaaagatctgatgttctgtgttttaacagttaccatttaagttaaaattgtagaaaagtgtttaacagctaccttctgttggttgttgcag-3’
- Gas5-MUT序列:5’-gtgagaactgcaaatgcttaaccgggaacctactccagaatacatgatgatctcacacaacttgacatctctccagttaattcgttatgatagtaaaagatctgatgttctgtgttttaacagttaccatttaagttaaaattgtagaaaagtgtttaacagctaccttctgttggttgttgcag-3’
细胞分别与Gas5-WT、Gas5-MUT或“空”pGL3以及miR-26a# lncRNA Gas5是一种活动响应性支架,用于介导cAMP依赖性突触可塑性
考希克·钱达¹,#,埃迪·格林曼¹,#,凯琳·克拉克¹,阿布舍克·萨杜¹,宾杜·拉文德拉¹,苏普里亚·斯瓦卡¹,萨蒂亚纳拉亚南·V·普坦维蒂尔¹,*
¹神经科学系,斯克里普斯研究所,130斯克里普斯路,佛罗里达州朱庇特市,33458,美国
#这些作者贡献均等;*通讯作者:sputhanveettil@ufl.edu
¶ 摘要
转录组的变化对于塑造神经元的结构可塑性至关重要,这种可塑性是学习和长期记忆存储的基础。本研究探讨了两种相互对立的可塑性相关通路——cAMP第二信使信号通路与代谢型谷氨酸受体(mGluR1和mGluR5)信号通路——对海马神经元转录组的影响,以及这些通路如何以独特且协同的方式诱导结构变化。通过整合转录组数据和分子通路分析,我们发现了海马神经元中受cAMP和/或mGluR1/5快速诱导的核心“枢纽”基因,其中包括长链非编码RNA(lncRNA)Gas5。该lncRNA的表达特异性受cAMP诱导,并通过驱动蛋白KIF1A靶向树突。在树突中,Gas5与多种突触功能和可塑性相关的蛋白质、编码RNA及非编码RNA发生相互作用,且这些相互作用受cAMP信号调控。值得注意的是,Gas5与微RNA(miRNA)miR-26a-5p结合,使其与多个参与神经元功能的靶mRNA分离——这些mRNA的翻译过程受cAMP诱导。Gas5对cAMP诱导的兴奋性突触传递至关重要,但对mGluR1/5诱导的突触传递无影响。此外,Gas5缺失会损害树突分枝和突触形态,且在阿尔茨海默病(AD)小鼠模型的海马体中Gas5丰度降低。这些发现共同揭示了参与突触可塑性的转录网络,以及一个介导兴奋性突触传递和神经元树突结构局部调控的lncRNA相互作用组。
¶ 引言
由信号转导通路产生的转录网络对于决定神经元对激活的反应至关重要。这些网络会导致神经元结构和连接性的特定改变,对学习和记忆等认知过程产生持久影响[1–3]。广义而言,这些通路可分为兴奋性或抑制性的,反映神经元在各种学习形式中突触连接最终是增强还是减弱[4–6]。鉴于神经元的长期突触能力根本上由其转录网络塑造,理解这些网络如何影响兴奋性和抑制性信号传递相关基因,以及这些基因如何相互作用以调控突触可塑性至关重要。因此,深入了解这些转录网络的具体组成部分及其在突触可塑性中的作用十分必要。
高通量测序技术和功能分析方法的最新进展,通过揭示从微小RNA(miRNA)、核小RNA(snRNA)、核仁小RNA(snoRNA)到长链非编码RNA(lncRNA)及假基因等大量非编码RNA,拓展了我们对转录网络的理解。这些发现为转录调控的复杂性提供了更深刻的见解,将非编码RNA确立为转录网络的核心组成部分。许多非编码RNA被发现在学习、记忆及导致记忆障碍的疾病相关神经生物过程中发挥功能性和机制性作用[7,8]。因此,多种miRNA和lncRNA已被确认为基因表达的关键调控因子,能够增强或抑制蛋白编码基因的表达[9-11]。由此可见,在绘制受兴奋性和抑制性信号影响的基因网络时,必须充分考虑编码RNA与非编码RNA之间复杂的相互作用。
本研究考察了海马神经元对两种与学习和长期记忆存储相关信号通路的转录响应。具体而言,我们采用了兴奋性与抑制性信号的有效激活剂:福斯高林(forskolin)——可通过激活腺苷酸环化酶启动cAMP信号通路(该信号级联因与长时程增强及学习强化相关而广为熟知),以及二羟基苯基甘氨酸(DHPG)——I组代谢型谷氨酸受体(mGluR1与mGluR5)的高效激动剂,可诱导突触传递的长时程抑制[12,13]。通过分析cAMP和mGluR1/5信号条件下mRNA、lncRNA及miRNA的差异调控规律,我们揭示了转录组中编码与非编码元件之间复杂的相互作用网络。
我们进一步探究了lncRNA与mRNA顺式表达模式之间的关系,构建了差异表达基因的共表达网络以识别这些通路中的关键调控因子,并对相关体内数据集进行了荟萃分析。通过整合这些数据,我们揭示了cAMP和mGluR1/5条件下多个调控性RNA互作网络。随后我们通过沉默核心lncRNA——Gas5对这些网络之一进行功能验证,发现该lncRNA通过直接干扰脑组织富集的miR-26a-5p来维持cAMP介导的RNA表达。对Gas5复合物的转录组学与蛋白质组学分析表明,Gas5可作为参与突触功能的多种RNA及蛋白质因子的支架,且Gas5对兴奋性突触传递、树突分枝及突触形态形成至关重要。
¶ 结果
¶ 1. cAMP和mGluR1/5信号在海马神经元中引发独特的转录组特征
为探究不同学习相关信号通路是否在海马神经元中产生截然不同或存在重叠的转录变化,我们分析了cAMP与mGluR1/5信号通路诱导的编码和非编码转录组。具体而言,我们培养了源自CD1小鼠幼崽海马区的原代神经元。在体外培养第18天(DIV 18),分别使用福斯高林(forskolin)或DHPG处理这些神经元30分钟以激活cAMP或mGluR1/5信号通路,以DMSO作为对照。处理后从神经元中提取RNA,并对同一样本进行总RNA和小RNA测序(图1A)。
对批次校正数据的主成分分析显示,样本根据其药物治疗方案紧密聚集(图1B)。为验证RNA-seq结果,我们选取特征明确的即刻早期基因(IEGs)进行qRT-PCR验证。RNA-seq与qRT-PCR均证实福斯高林与DHPG对Arc、Egr2、cFos等IEGs表达的调控作用(图S1A-C;数据文件S1)。相比之下,Syt4表达在RNA-seq和qRT-PCR分析中均未见组间差异(图S1D),这凸显了不同实验方法间基因表达数据的高度可重复性。
此外,鉴于cAMP与mGluR1/5信号通路在已验证的即刻早期基因中存在重叠(图S1B-D),我们推测这些通路可能以不同强度抑制基本相同的基因集。差异表达分析显示,与DMSO相比,福斯高林处理导致1438个差异表达基因(占所有注释基因的2.89%;图1C及数据文件S1);而DHPG处理则产生239个差异表达基因(占全部基因的0.48%;图1D及数据文件S1)。值得注意的是,福斯高林与DHPG处理的对比分析识别出5857个差异表达基因(占全部基因的11.6%;图1E),其中仅有14个基因被福斯高林上调但被DHPG下调。此外,在检查相对于DMSO上调或下调的基因时,分别只有12个和9个基因重叠(图1E)。
基因本体(GO)分析表明,福斯高林主要调控的基因与突触功能、RNA加工及分解代谢过程相关(图S1E、G;数据文件S1),而DHPG调控的基因则参与纤毛组装、微管形成及呼吸系统发育(图S1F、H;数据文件S1)。总体而言,这些发现表明cAMP和mGluR1/5信号通路并不主要调控共同的基因集,而是引发独特的转录组特征。
为了进一步探究cAMP信号通路在培养海马神经元中的相关性,我们对海马切片在30、60和120分钟时间点经福斯高林诱导长时程增强(LTP)后的RNA测序数据进行了荟萃分析[14](图S2A)。通过比较LTP数据集与我们的福斯高林数据集之间的差异表达基因,我们观察到随时间推移重叠基因数量逐渐增加:30分钟LTP时有14个基因重叠(图S2B),60分钟时增至22个基因(图S2C),120分钟时达到67个基因(图S2D)。GO分析显示这67个重叠基因参与RNA聚合酶II相关转录因子活性,表明早期cAMP信号激活了基因表达的正反馈循环(图S2E)。
¶ 2. cAMP和mGluR1/5信号通路减弱特定mRNA的miRNA靶向作用
为了全面理解cAMP和mGluR1/5信号通路所调控的转录网络,我们随后聚焦于miRNA的表达分析。miRNA是一类内源性小分子非编码RNA,能通过与mRNA直接相互作用,经由RISC复合体介导其降解,从而抑制转录后过程[15]。已有研究表明这些miRNA参与大脑中的多种信号传导过程及认知功能[16,17]。我们推测特定miRNA可能介导了cAMP与mGluR1/5信号诱导的转录动态变化。为验证该假设,我们基于先前分析所用的同一批RNA样本,进行了差异miRNA表达谱分析。
研究结果显示,福斯高林处理导致32种miRNA上调和12种miRNA下调(图1F;数据文件S2)。类似地,DHPG处理引起46种miRNA上调和57种miRNA下调(图1G;数据文件S2)。为深入阐明差异上调最显著的miRNA与其靶标间的相互作用,我们通过整合starBase和TargetScan两个数据库[18,19],采用严格筛选方法:仅当靶标在这两个数据库中出现重叠时,才确认miRNA-mRNA相互作用关系。随后利用Cytoscape构建了可视化相互作用网络。在福斯高林处理上调的前5位miRNA中,我们鉴定出63个上调及26个下调的mRNA靶标(图1I);而在DHPG处理上调的前5位miRNA中,则发现20个下调及1个上调的mRNA靶标(图1H)。这些miRNA中存在大量共享靶标的现象,提示它们与靶标间存在经由福斯高林和DHPG诱导信号通路调控的复杂相互作用网络。
¶ 3. cAMP信号传导激活多种lncRNA和mRNA顺式表达模式
为深入阐明lncRNA在转录网络中的作用,我们将其表达模式与mRNA进行同步分析。哺乳动物基因组编码数千种lncRNA,这些RNA虽不参与翻译,却在细胞进程中发挥关键调控功能[20,21]。已有研究表明lncRNA与突触可塑性及学习过程密切相关[22]。多数lncRNA定位于细胞核内,作为转录调控因子发挥作用[23]。我们推测在所研究的信号通路中,lncRNA的表达模式可能与其转录位点邻近(顺式作用关系)的mRNA表达存在关联。
通过BiomaRt Bioconductor软件包与UCSC基因组浏览器,我们以100kb为范围对lncRNA与mRNA进行交叉参照。虽然未在mGluR1/5信号通路中发现顺式作用关系,但对cAMP数据集的分析揭示了多种顺式作用模式,包括双向、反义、汇聚、正义内含子及基因间共转录(图S3A-E)。此外,我们观察到两类干扰性顺式作用模式:基因间干扰与反义干扰(图S3F-G)。这些结果凸显了经福斯高林与DHPG处理的转录网络中存在的复杂相互作用。
¶ 4. cAMP-PKA信号传导依赖基因受其生物学功能共同调控
鉴于cAMP和mGluR1/5信号通路引发的独特转录特征,我们进一步研究了这些基因在共转录框架内的相互作用。为此,我们采用多尺度嵌入式基因共表达网络分析(MEGENA)算法[24]。该方法通过对RNA测序数据进行平面性测试,能够识别重叠的基因模块。MEGENA此前已被用于解析脑细胞类型[25]和衰老脑组织[26],揭示了有意义的共表达模式并识别出新的基因靶点。
对于cAMP调控基因,我们分析了880个上调基因的数据。其中592个基因通过平面性检验,最终识别出32个基因模块(图S4A、D;数据文件S3)。统计学意义最显著的模块之一C1_8包含两个枢纽基因Eif3j2和Atp11b(图S4D),分别编码翻译起始因子和ATP酶。在平面网络中包含最多cAMP调控基因的模块C1_5以Zfp182和Zcchc7两个枢纽基因为特征,它们编码的锌指蛋白此前尚未在cAMP信号传导背景中被研究。C1_5网络由mRNA、lncRNA和假基因共同构成,表明该模块内编码与非编码元件存在复杂相互作用(图S4B;数据文件S3)。值得注意的是,C1_5模块的GO分析显示该网络中的基因主要参与RNA加工与运输过程,这表明cAMP诱导的基因产物以精确协调的方式调控这些功能(图S4C;数据文件S3)。鉴于RNA加工与运输在学习相关信号通路中的重要性[27,28],这些发现提示cAMP信号传导协调调控参与这些过程的基因时序表达。该网络中两个未被表征的锌指蛋白的核心作用,凸显了它们对这些生物学功能的潜在重要性。
对于mGluR1/5信号通路,我们分析了41个上调基因的数据,其中35个通过平面性检验,最终形成两个独立模块(图S4E)。模块C1_2的核心枢纽基因Emd和Copg2分别编码细胞骨架结合蛋白和高尔基体至内质网转运蛋白。模块C1_3以Gm26493作为核心枢纽基因,该基因编码的snoRNA此前未发现与mGluR1/5信号通路相关(图S4F)。
¶ 5. lncRNAs在cAMP和mGluR1/5信号传导下与miRNAs竞争相同的靶mRNAs
我们观察到,福斯高林上调的前5位miRNA所对应的大部分mRNA靶标也出现上调(图1I、图S8A)。这表明通常会被这些miRNA下调的mRNA,可能通过cAMP信号通路得以挽救。学界公认胞质lncRNA可作为竞争性内源RNA(ceRNA),从而隔离miRNA与其靶标mRNA的结合[29]。为探究这一潜在机制,我们利用starBase和TargetScan数据库分析了差异表达的lncRNA及其相关miRNA靶标。
在cAMP条件下,我们鉴定出65个与表达模式相似的miRNA结合的差异表达lncRNA;在mGluR1/5信号通路中则发现8个此类lncRNA,其中2个为两条信号通路所共有(图2A)。我们构建了miRNA/lncRNA/mRNA互作网络,针对两种受DHPG调控的lncRNA(Gm38182和Pvt1)的分析显示,网络中大多数miRNA的mRNA靶标呈现下调趋势,表明这些lncRNA可能未在mGluR1/5信号通路中发挥ceRNA功能(图2B、C)。此外,我们分析了在cAMP和mGluR1/5信号通路中均上调表达的lncRNA MIRG,发现其潜在互作因子miR-3086-5p在两条通路中均显著上调(图2D)。该miRNA的16个已知mRNA靶标在cAMP信号通路中同样呈现上调,这表明尽管MIRG在两种信号环境中均被激活,但可能仅在cAMP信号通路中作为ceRNA发挥作用。
对63种仅由cAMP信号通路上调的lncRNA进一步分析发现,其中Gas5在cAMP信号作用下呈现显著上调(图S8B)。通过交叉检索starBase和TargetScan数据库,发现两个可与该lncRNA结合的miRNA:miR-26a-5p[30]和miR-9-3p[31],这两种miRNA均在大脑中富集并参与神经元及认知功能。值得注意的是,实验已证实Gas5可与miR-26a-5p结合[32]。与MIRG类似,我们观察到同时受Gas5及这些miRNA调控的多数mRNA在cAMP信号激活时同样出现上调(图2E、图S8A)。这表明Gas5可能在cAMP信号传导过程中作为ceRNA在海马神经元中发挥作用。
为深入阐明cAMP对Gas5的转录调控机制,我们检测了福斯高林处理后不同时间点的Gas5表达水平。分别以30分钟、1小时、3小时和6小时的时间点处理神经元后,发现Gas5表达在3小时达到峰值,6小时后恢复至接近基线水平(图3A、B;数据文件S3)。这些结果表明Gas5可能作为海马神经元中的即刻早期反应lncRNA发挥作用。
¶ 6. Gas5的树突定位由分子马达蛋白KIF1A介导
为评估Gas5的功能,我们检测了其亚细胞定位。采用DIG标记的核糖探针进行荧光原位杂交(FISH)分析,并结合MAP2(树突标志物)复染,结果显示Gas5同时存在于胞体和树突中(图S6C)。这种树突定位提示其可能参与调节突触功能,该发现与近期研究证实在恐惧条件反射后Gas5定位于树突棘的结果一致[67]。
为进一步阐明Gas5的亚细胞分布,我们设计了25个覆盖Gas5 lncRNA全长的冗余荧光探针。FISH与免疫细胞化学(ICC)联合检测显示,Gas5以点状信号形式分布于细胞核、胞体及远端突起(图3C)。点状信号定量分析表明,相较于远端突起和细胞核,Gas5在胞体中富集程度更高(图3D)。值得注意的是,Gas5点状信号与胞体的距离存在差异,多数位于1000μm范围内,但有些可延伸至4500μm(图3E)。这一观察到的树突定位促使我们深入研究Gas5亚细胞分布的分子机制。
我们先前的研究以及其他团队的工作均强调了特定驱动蛋白家族成员(KIFs)在介导神经元内RNA定位中的作用[51,65,66]。值得注意的是,我们已证实lncRNA ADEPTR的定位依赖于KIF2A[51],而SLAMR lncRNA的定位则需要KIF5C的参与[70]。因此,我们重点探究了KIFs是否介导Gas5的树突定位。
我们采用SMARTpool siRNA敲低原代海马神经元中的部分KIFs亚型(KIF1A、KIF2A、KIF5C和KIF16B),并检测突触小体中Gas5的丰度。转染48小时后,与乱序对照组(siNC)相比,KIF1A、KIF2A和KIF5C的siRNA均能有效敲低其靶标表达(图S7F;数据文件S8)。对分离突触小体中Gas5水平的后续分析显示,敲低KIF1A可显著降低Gas5丰度(图3F、G;数据文件S8)。为验证KIF1A在Gas5定位中的作用,我们通过FISH分析发现KIF1A敲低能显著减少细胞体与树突中Gas5斑点的数量(图3H、I;数据文件S3)。这些结果共同表明KIF1A对维持Gas5的正常亚细胞定位至关重要。
¶ 7. Gas5与miR-26a-5p相互作用,并对其靶标维持cAMP依赖性稳定性至关重要
我们接下来研究了miR-26a-5p和miR-9-3p及其靶mRNA的表达是否依赖于Gas5的表达。为探究这一问题,我们采用锁核酸缺口寡核苷酸(LNA gapmers)通过RNAse H特异性靶向降解Gas5。将这些缺口寡核苷酸单独或联合转染至神经元中72小时,同时设置乱序对照序列,随后评估cAMP依赖性基因表达变化。数据证实这些缺口寡核苷酸能有效抑制cAMP诱导的Gas5表达上调(图4A;数据文件S3)。
随后,我们重点关注了两组受福斯高林上调的基因:一组是miR-26a-5p的专属靶标(Klf4、Plp1、Ugt8a),另一组是miR-26a-5p与miR-9-3p的共同靶标(Hspa4、Cops2、Kcnh7)。Gas5敲除可抑制cAMP诱导的三分之二miR-26a-5p专属靶标(Plp1与Ugt8a)表达上升(图4B;数据文件S3)。与之相反,两种miRNA共同靶向的三个基因表达均未受Gas5敲除影响。这些发现表明Gas5对于cAMP依赖性增强miR-26a-5p靶标至关重要。我们还观察到Gas5敲除会降低即刻早期基因Arc的表达——该基因在我们的数据集中与任何cAMP调控的miRNA均无关联,提示Gas5可能通过不依赖miRNA的机制来稳定Arc表达。
转录本(lncRNA、mRNA和miRNA)的丰度是ceRNA功能的一个关键决定因素。对我们RNA-seq数据的重新分析表明,Gas5的基础水平和激活后转录水平(TPM)与cFos mRNA相当甚至更高(图S8A)。值得注意的是,基础Gas5水平比多种经过深入研究的lncRNAs(如Meg3、Neat1、Ube3a、Uchl1os和Paupar[29,86,97])更为丰富。独立验证实验进一步证实,基础Gas5的倍数变化(以18S rRNA标准化)超过了Arc mRNA(图S8B)。
为了进一步了解Gas5对miRNAs的调控机制,我们在福斯高林处理海马神经元30分钟后检测了成熟miR-26a-5p的水平,观察到miR-26a-5p表达上调(图4C;数据文件S3)。为深入探究miRNA调控机制,我们在神经元中瞬时过表达成熟miR-26a-5p模拟物,并在转染48小时后检测Gas5水平。尽管通过qPCR确认了miR-26a-5p的过表达,但发现Gas5水平无明显变化(图4D)。这一结果与Gas5充当miRNA海绵、将miRNA与其靶标分离的假说相一致。
为验证直接的miRNA-lncRNA相互作用,我们进行了荧光素酶报告实验。将成熟miR-26a结合的野生型Gas5区域(图4E)克隆至pGL3载体,并与miR-26a模拟物共表达。采用编码Gas5区域突变序列的载体作为对照。在miR-26a-5p缺失条件下,野生型与突变型载体之间的荧光强度差异无统计学意义,且仅野生型Gas5编码载体的荧光活性被miR-26a-5p模拟物抑制(图4F;数据文件S3),由此验证了该相互作用。
¶ 8. 海马神经元中Gas5相互作用伙伴的表征
为了深入了解Gas5的作用机制,我们利用RNA测序(RNA-seq)、miRNA测序(miRNA-seq)和蛋白质组学技术对其相互作用组进行了全面分析。我们采用全长Gas5转录本生物素标记诱饵[33],从成熟原代海马神经元中进行了Gas5下拉实验,反义探针作为阴性对照。从链霉亲和素-生物素复合物中分离的RNA进行了总RNA和小RNA测序分析。
基于欧几里得距离对总RNA样本进行层次聚类分析,结果显示三个正义链重复样本紧密聚集,与三个反义链重复样本明显分离(图4G)。差异表达分析鉴定出610种特异性富集Gas5的RNA(图4H;数据文件S4)。基因生物类型分析证实这些RNA包含多种编码和非编码RNA。值得注意的是,GO分析表明这些RNA主要与突触组织(如Camk2a、Syn1、Dlgap3)、细胞连接(如Rapgef1、Plec、Ajuba)及运输功能(如Kif5c、Kif5a、Kif1b)相关(图4I、图S5A;数据文件S4)。对这些复合物进行小RNA测序,发现8种特异性富集Gas5的miRNA(图4J;数据文件S4),但这些miRNA与我们预测的Gas5靶标并未出现重叠(图2E)。
与Gas5相关的RNA在远离胞体的过程中(如突触组织和细胞连接)占主导地位,加之其相互作用伙伴相对较少,表明Gas5是通过更大的核糖核蛋白复合物(RNP)发挥作用[34],而非通过反义相互作用。为鉴定相关蛋白,我们通过下拉Gas5(或反义探针对照)分离蛋白质复合物,并进行LC-MS/MS分析。差异分析显示,与反义对照相比,有58种蛋白在Gas5复合物中特异性富集(图4K;数据文件S4)。这些蛋白主要参与突触组织(如GSK-3β、TUBB5、APOE)、凋亡(如TPT1、PDIA3、CLU)和病毒过程(如HSPA8、RAB7、P4HB)(图4L、图S5B;数据文件S4)。
为验证这些发现,我们将数据与先前海马组织Gas5下拉蛋白质组学研究(Wang等, 2021)[33]进行比对,发现八个在RNA结合/剪接/翻译、磷酸化及细胞骨架构建中起作用的蛋白质存在重叠(图S5C)。质谱分析证实了数据的可靠性(图S5D)。为进一步验证,我们重点关注糖原合酶激酶-3β(GSK-3β),该蛋白在Gas5沉降复合物中富集(图S3)。通过cAMP刺激后使用Gas5探针进行沉降实验,我们验证了该相互作用(图5A)。在裂解和沉降前,用福斯高林或DMSO处理原代海马神经元30分钟。结果显示Gas5与总GSK-3β及磷酸化GSK-3β均存在结合,且福斯高林处理导致磷酸化与总GSK-3β比例升高(图5B-E)。
为进一步探究Gas5与GSK-3β的相互作用,我们在完成FISH和ICC分析后进行了超分辨率成像。典型图像(图5F)显示Gas5与GSK-3β在细胞体内空间相邻,并在远端突起的独立结构中存在共定位(图5F)。皮尔逊相关性与曼德尔重叠分析表明Gas5与GSK-3β具有强相关性(图5G)。线性强度分析进一步佐证了共定位特征(图S5D)。
使用开源算法[RNA相互作用组百科全书(ENCORI)]进行的计算机模拟分析表明,编码激酶GSK-3β的mRNA是miR-26a-5p的靶标(图S6A)。实验验证显示,瞬时过表达miR-26a-5p会导致GSK-3β在mRNA水平显著降低(图5H;数据文件S5)。此外,使用gapmer对Gas5进行瞬时敲低也引起GSK-3β编码mRNA表达下调(图5I)。与这些观察结果一致,我们的RNA-seq数据显示Gas5与GSK3B mRNA水平相当(图S8A)。鉴于GSK-3β在突触可塑性与神经退行性疾病中的作用[62,63],Gas5可能通过其与GSK-3β的相互作用调控这些过程。
¶ 9. Gas5及其互作因子的表达在阿尔茨海默病小鼠模型中受损
非编码RNA网络的调控失常,尤其是miRNA和lncRNA,在阿尔茨海默病(AD)中已有充分记录[56]。Gas5水平改变在AD中的影响仍是当前研究热点[57-58]。在AD小鼠模型和患者样本中均观察到miR-26a-5p水平升高[59-60]。鉴于我们发现cAMP信号传导(在神经退行性疾病中会出现紊乱[61])会促使Gas5富集,我们研究了阿尔茨海默病小鼠模型中Gas5及其相互作用组的表达水平。
为此,我们采用携带5个AD相关突变的人源APP和PSEN1转基因的5XFAD小鼠(APP基因的瑞典突变K670N/M671L和佛罗里达突变I716V,以及PSEN1基因的M146L和L286V突变),并设置同龄对照组。通过qRT-PCR检测海马组织中Gas5、GSK-3β和miR-26a-5p水平。在野生型小鼠中,Gas5丰度与miR-26a-5p(以U6 snRNA标准化)和GSK3β编码mRNA相当,这符合我们竞争性内源RNA假说的关键条件(图S8C)。
分析显示,与对照组相比,AD小鼠的Gas5水平显著下降(图5J、图S8C;数据文件S5)。相反,我们观察到AD小鼠中miR-26a-5p表达上调(图5K)。值得注意的是,AD小鼠中GSK-3β水平也出现上调,表明GSK-3β在AD中具有更为复杂的调控层面(图5L)。
¶ 10. cAMP信号通路的激活减弱了Gas5与其相关RNPs之间的相互作用
鉴于Gas5在海马神经元中与多种mRNA及非编码RNA存在相互作用,我们探究这些相互作用是否受cAMP信号通路调控。我们提出假说:Gas5能够响应cAMP信号形成包含多种RNA和蛋白质的多核糖核蛋白复合体。为确定Gas5中介导这些相互作用的关键区域,并评估cAMP信号是否会改变其相关RNP复合体的组成,我们对Gas5-RNP复合体进行了RNase保护实验。
我们合成了生物素标记的全长558 bp Gas5转录本,在固定前用福斯高林或DMSO处理30分钟的多聚甲醛固定原代海马神经元中进行拉降实验。通过RNase消化Gas5拉降复合体后,采用蔗糖垫超速离心法提取结合RNA片段,并对这些片段进行RNA测序(图6A)。
出人意料的是,福斯高林处理导致Gas5的核糖核酸酶可及性显著增加(图6B),并降低了几种mRNA的富集度(图6C)。通过整合基因组浏览器(IGV)对富集mRNA进行检测发现,Myh9和Jun mRNA的特定片段在DMSO条件下被特异性富集,但在福斯高林处理后则被隔离(图6D)。相反,伪基因Obox-ps27的表达在福斯高林条件下显著富集,且以某个特定片段为主(图6D)。这些发现通过qPCR分析得到了独立验证(图6E;数据文件S6)。综上所述,这些结果表明cAMP信号通路可诱导Gas5及其相互作用组的核糖核酸酶敏感性发生动态变化,从而调节其在树突中的隔离功能(图6F、G)。
¶ 11. Gas5介导cAMP而非代谢型谷氨酸受体1/5诱导的突触传递及网络活动变化
Gas5与多种已知影响突触可塑性的成分(如GSK-3β)相互作用,表明其在调节cAMP诱导的突触传递变化中可能发挥作用。为验证此假设,我们采用高密度微电极阵列(HD-MEA)技术,检测海马神经元中Gas5功能缺失后cAMP诱导的突触传递及网络活动变化。同时通过相同实验条件下测定已知mGluR1/5激动剂DHPG诱导的突触传递变化,进一步验证Gas5作用的特异性。
在体外培养第16天(DIV 16),将铺植于HD-MEA Accura芯片(3Brain AG)上的海马神经元分别转染Gas5特异性缺口寡核苷酸或乱序对照缺口寡核苷酸。48小时后,分别使用福斯高林或DHPG处理神经元以诱导cAMP或mGluR1/5信号通路,并设置DMSO处理作为对照(图7A)。在药理处理前通过多芯片电生理记录确定神经元的基线健康状态和自发活性(电影S1)。MEA芯片基线设定截止值为50μV以降低噪声,峰值检测阈值设为≥100μV。若电极显示每分钟>10个峰值则判定为活性电极,网络爆发定义为至少30个电极的活动(每个电极具有>10个峰电位,峰电位间隔为<100毫秒)。网络爆发频率的计算方式为爆发总次数除以分析时长。
MEA记录的代表性趋势图(图7B、D)显示,平均放电率(MFR)在28-29次/秒达到峰值,大多数超过15次/秒。Gas5基因敲低甚至在药理处理前就引发了放电行为的显著差异(图7B、数据文件S7及影片S2-S4)。具体而言,Gas5敲低导致放电强度和频率降低,且在福斯高林给药后效应更为显著。福斯高林在对照组神经元中诱导了强烈且一致的响应,其特征为更密集、更频繁的放电序列(图7B与影片S3)。相较之下,Gas5敲低神经元的放电序列均匀度降低,放电密度减弱(图7D与影片S5)。数据定量分析(图7C)显示,基础平均放电率与福斯高林处理前的MFR无显著差异,但显著低于福斯高林处理后的MFR。在Gas5敲低组中(图7E),基础平均放电率与福斯高林处理前存在差异,且两者均显著低于福斯高林处理后。这些结果表明,敲低Gas5基因在自发放电和cAMP诱发条件下均会削弱动作电位密度(图7F)。
我们还观察到Gas5基因敲低会影响神经元放电的峰值振幅。来自四个神经元的代表性轨迹(图7G)显示,在Gas5敲低组和对照组中,福斯高林均能引发强烈响应(≥±500μV),但定量分析(图7H)表明,无论是在福斯高林处理前还是处理后,Gas5敲低组的振幅均显著低于对照组。在放电间隔方面也观察到类似趋势(图7I),与Gas5敲低组相比,对照组在福斯高林处理前后的不应期持续时间更短。这些结果表明功能性Gas5的缺失会损害尖峰放电密度和动作电位强度对cAMP信号的反应。
随后我们评估了Gas5是否也介导mGluR1/5信号通路诱导的突触传递变化。激活mGluR1/5的DHPG处理导致网络活动减弱。代表性趋势图(图7J、K)显示,虽然对照组(NC组)和Gas5敲低组在DHPG处理前均表现出较强的平均放电频率,但经DHPG处理后放电活动几乎完全消失(影片S6和S7)。进一步分析显示,在未使用DHPG的组别间平均放电频率存在显著差异,但对DHPG的响应未见显著差异(图7L)。与对照组相比,DHPG处理也未影响Gas5敲低组神经元的峰峰值振幅(图S7C)。这些结果表明,尽管DHPG能显著抑制基础突触传递,但Gas5缺失并未改变DHPG诱导的效应。
最后,我们评估了Gas5功能缺失是否会影响由福斯高林或DHPG诱导的神经元网络表型。整个MEA的点阵图显示,对照组条件下网络突发呈现规律模式,经福斯高林处理后这些突发变得更为密集且持续时间延长(图S7A)。相比之下,Gas5敲除导致网络突发显著减少且密集度降低(图S7A)。进一步分析表明,与Gas5敲低组相比,对照组在福斯高林处理前后的爆发频率均显著更高(图S7D;数据文件S7)。在网络爆发持续时间方面也观察到相似趋势(图S7E)。另一方面,DHPG诱导的信号传导则显著减弱了NC组和Gas5敲低神经元的群体爆发活动(图S7B)。这些结果表明,Gas5 lncRNA选择性介导cAMP信号传导诱导的突触传递和神经网络活动变化。
¶ 12. Gas5功能缺失损害树突分枝和树突棘密度
我们的分子和电生理学数据表明,Gas5在维持神经元形态——特别是树突分枝和树突棘密度方面起着关键作用。为评估Gas5功能缺失对这些参数的影响,我们研究了海马神经元的树突分枝与树突棘形态。
使用gapmer敲低Gas5后,三级树突分枝数量(60至110μm)相较于对照组神经元显著减少(图8A、B;数据文件S8),但二级分枝(20至50μm)未见明显差异。此外,Gas5敲低神经元的树突棘密度、细小型与蘑菇型树突棘占比均显著降低(图8C-E;数据文件S8)。这些发现表明,正常的Gas5功能对维持海马神经元的树突分枝结构与树突棘形态至关重要。
为深入理解这些形态变化的分子基础,我们研究了Gas5功能缺失的转录组学效应。我们假设Gas5敲低可能影响神经元形态关键基因的表达。在使用gapmer进行Gas5敲低后,我们进行了全RNA测序(图8F)。差异表达转录本生物类型分析(图S5E)显示,在219个受干扰基因中,大多数(142个基因,占64.8%)为蛋白质编码基因,其次是加工假基因(43个基因,占19.6%)和lncRNA(34个基因,占15.5%)。显著下调的基因包括早期应答基因(如Egr1、Egr2和Arc)以及翻译因子编码基因Eif3e(图8G;数据文件S8)。此外,对神经元生理至关重要的基因(如Rheb和Cftr)也出现下调。Gas5敲低组中有多个lncRNA出现表达异常,包括Hotairm1、Macrod2os1及Gas5本身。值得注意的是,改变基因中有相当一部分是假基因。
为验证测序数据,我们针对5个候选基因(Arc、Egr1、Rheb、Cftr和Hotairm1)设计了特异性引物。后续qPCR数据显示,验证组中Arc、Egr1、Rheb和Cftr的表达确实下调,而Hotairm1表达升高(图S7G;数据文件S8)。GO分析表明这些RNA参与多种生物学过程,包括轴突导向(涉及Cdk5、Epha6、Rock2、Sema3e、Lrig和Srgap3)、cAMP信号通路(涉及Hcn4、Abcc4和Myl9)、肌动蛋白细胞骨架调控(涉及Arpc4、Egfr和Itga11),并与肌萎缩侧索硬化症和阿尔茨海默病等神经退行性疾病相关(涉及Frat1、Casp12、Adam10、Rtn3和Tuba1b)(图8H;数据文件S8)。
¶ 讨论
本研究探讨了cAMP和mGluR1/5信号——这两种对突触传递和神经元形态具有相反作用的通路——如何影响编码与非编码转录组。我们的分析发现lncRNA Gas5是cAMP诱导变化的关键中介因子,这些变化会影响兴奋性突触传递和神经元结构。
我们接下来分析了差异表达的miRNAs、lncRNAs和mRNAs之间的相互作用。在DHPG数据集中,上调的miRNAs与减少的靶标mRNAs相关。然而,在cAMP数据集中,许多miRNA靶标被矛盾地上调,表明存在竞争性内源RNA(ceRNA)机制。通常,miRNAs介导转录本抑制[40],但近乎完美的互补性可能引发miRNA降解[41]。生物信息学和功能实验证实,Gas5作为miR-26a-5p的ceRNA,保护了靶标Plp1和Ugt8a的表达,这些基因参与髓鞘形成——表明这种调控相互作用也可能发生在少突胶质细胞中。ceRNA组分的丰度是关键。我们的RNA-seq数据显示,Gas5的水平与GSK3B和cFos相当或超过它们,还超过了著名的lncRNAs(如Meg3、Neat1和Ube3a)。独立的qPCR验证证实,Gas5水平超过了Arc,并且其丰度与miR-26a-5p和GSK3B在海马神经元和AD模型小鼠组织中都相当。进一步的证据通过单一位点相互作用支持Gas5的ceRNA功能。
先前的研究显示,Gas5吸附多种miRNAs以调节基因表达,涉及肾损伤[88]、冠状动脉疾病[89]和动脉粥样硬化[90]。类似地,其他lncRNAs如SCAMP1[91]、NORAD[92]和KCNQ1OT1[93]在癌症模型中被证明能够隔离miR-26a-5p。这些研究支持了miR-26a-5p是lncRNA介导基因调控核心节点的观点。受此启发,我们分析了Gas5相互作用组,发现610种富集的RNA参与突触组织、运输和细胞粘附等关键过程——这些都是局部突触处的翻译过程[46,47]。八种miRNAs与Gas5相互作用,但无一与数据库中的预测靶标匹配,表明直接mRNA结合。先前的研究表明,Gas5与RNA结合蛋白如AGO2[45]和EIF4E[43]相关联。我们的蛋白质组学分析揭示了58种参与突触组织和细胞凋亡的蛋白。值得注意的是,编码可塑性关键调控因子GSK-3β的mRNA位列其中,cAMP刺激会增强其与Gas5的相互作用。功能实验证实了这一关联,支持了包含Gas5、miR-26a-5p和GSK-3β的调控轴。
本研究在海马体中鉴定出的8个Gas5相互作用蛋白与Wang等人[33]的发现存在重叠,表明Gas5是更大的核糖核蛋白复合体组成部分。这些动态、无膜结合的复合结构可调节突触可塑性,其功能紊乱可能导致神经退行性病变。鉴于Gas5的相互作用特征及树突定位特性,它很可能在突触部位的核糖核蛋白复合体中发挥功能。
基于这些发现,Gas5似乎在基因调控、突触传递和可塑性中发挥着重要作用——这些过程在阿尔茨海默病等神经退行性疾病中显著受损[61]。在我们的AD模型5XFAD小鼠中,Gas5水平降低,而miR-26a-5p水平升高。出乎意料的是,GSK3B水平有所增加,这表明在小鼠海马体中,其在AD中的调控可能不依赖于miRNA[71–72]。
为了精确定位Gas5中的相互作用区域,我们进行了RNA酶可及性图谱分析。在静息神经元中,Gas5大部分区域受到RNA酶保护,表明存在RNA或蛋白质相互作用。cAMP刺激后,部分区域变得对RNA酶敏感,提示其相互作用组发生动态重构以支持突触传递。这些结构变化延伸至Gas5的RNA相互作用组,后者也表现出cAMP依赖的RNA酶敏感性改变,表明Gas5可作为树突RNP复合物的可调节支架。这种可调节性可能涉及cAMP诱导的相关蛋白质或RNA的修饰。
由于强烈的转录组信号,我们进一步探究了Gas5是否在功能上介导突触变化。在MEA实验中,Gas5基因敲除削弱了福斯高林诱导的兴奋性突触活动增强,这支持了其在突触传递中的直接作用。尽管其他lncRNA(如Gm12371)也被发现与福斯高林反应相关,但其特异性尚不明确。在此研究中,Gas5作为通路特异性介导因子脱颖而出。
鉴于形态学与突触可塑性之间的紧密联系[64],我们同时评估了结构性效应。Gas5基因敲低会导致树突分枝减少。对照组神经元维持锥体形态结构,而Gas5缺陷神经元则呈现伸长形态,其三级分枝减少、树突棘密度降低,尤其是细丝状和蘑菇状树突棘。这些形态变化与即刻早期基因、ERG复合体组分及突触相关基因的表达下调相吻合[54,73],凸显了Gas5在维持树突结构与信号传导中的重要作用。由于Gas5在细胞核、胞体及树突中均有表达,后续研究需进一步明确其区域特异性功能。
总之,这些发现表明树突定位的Gas5对兴奋性突触功能与结构——这一学习记忆的核心进程——具有关键作用。该结论与多项研究相吻合,这些研究表明lncRNA在学习及长期记忆过程中发挥重要作用[67–70]。Liau等人[67]发现Gas5在突触中富集,并与RNA结合蛋白(RBPs)相互作用以调控RNA运输,其敲低会损害恐惧记忆消退。Meier等人[69]观察到海马体中Gas5水平与焦虑相关行为呈负相关,并在应激反应中升高。同样地,Banerjee等人[74]的研究表明,母性分离应激会上调Gas5表达,从而导致空间记忆缺陷。
我们的研究揭示了海马神经元中与cAMP和mGluR1/5信号传导相关的编码RNA和非编码RNA在基因表达层面的变化。此外,研究结果还揭示了lncRNAs(特别是Gas5)的选择性招募及其相互作用组的动态修饰在介导cAMP信号传导中的作用。理解调控lncRNA相互作用组稳定性及其区室特异性功能的机制,对于破译树突中lncRNA功能的分子基础至关重要。
¶ 材料与方法
¶ 1. 动物
CD1孕鼠(查尔斯河实验室)在12小时光照/12小时黑暗的循环光照条件下单独饲养,自由摄取食物和水。实验在昼夜周期的光照阶段进行。动物饲养、护理及实验程序均符合《实验室动物护理和使用指南》规范,并已获得沃特海姆UF斯克里普斯研究所动物护理与使用委员会的批准。
¶ 2. 原代海马神经元培养
从E18 CD1小鼠幼崽中分离出海马体,将其铺在聚-D-赖氨酸包被的培养板上,培养基为含有Glutamax、青霉素-链霉素和5%胎牛血清的Neurobasal培养基。神经元铺板密度根据各实验需求确定。铺板四小时后,更换为含Glutamax、青霉素-链霉素及2% B27补充剂(Invitrogen)的Neurobasal维持培养基,此后每4天更换一半培养基,实验全程在37°C、5% CO₂条件下培养直至实验时间点。
¶ 3. 定量实时PCR(qRT-PCR)
使用Trizol提取RNA,并采用qScript cDNA SuperMix(Quanta Bio)和/或TaqMan MicroRNA逆转录试剂盒(Thermofisher)将其逆转录为cDNA。在384孔板中使用SYBR Green预混液或TaqMan Fast Advanced Master Mix(Thermofisher)进行qRT-PCR,通过ABI 7900热循环仪(Applied Biosystems)检测。采用18S rRNA的Ct值计算dCT值进行标准化,随后通过2⁻ΔCT法进行相对定量。
对于突触小体制备后的qRT-PCR:将6孔汇集神经元在SynPER试剂中裂解,并按制造商说明分离突触小体沉淀。使用Trizol及Zymo Micro RNA试剂盒从沉淀中提取RNA。所有引物序列列于补充材料(数据文件S1)。
¶ 4. 总RNA和小RNA测序与分析
总RNA和小RNA测序均按照Wertheim UF Scripps研究所基因组学核心实验室的流程进行。
- 样本处理:总RNA样本经DNase I(NEB公司,伊普斯维奇市)处理,并通过PureLink RNA Micro试剂盒(Invitrogen公司,卡尔斯巴德市)纯化。随后使用Qubit 2.0荧光计(Invitrogen公司)进行定量,并在安捷伦2100生物分析仪RNA纳米芯片(安捷伦科技公司,圣克拉拉市)上进行质量评估(所有RNA样本的RNA完整性指数RIN>8.5)。
- 文库构建:RNA-seq文库使用Illumina TruSeq链状总RNA建库试剂盒(Illumina公司,圣地亚哥市),按制造商方案以每样本300ng输入RNA进行制备;小RNA-seq文库采用Illumina TruSeq小RNA建库试剂盒(Illumina公司),以1μg输入RNA构建。最终文库经生物分析仪DNA芯片验证后按等摩尔比例混合,小RNA混合池通过6%聚丙烯酰胺凝胶进行尺寸筛选(回收145bp至160bp产物)。
- 测序与数据分析:纯化后的文库以1.8pM终浓度上样至NextSeq 500测序流动槽(Illumina公司),采用2×40bp测序策略,平均每个样本生成2200-2700万条读长(总RNA-seq)和400-1400万条读长(小RNA-seq)。Fastq文件首先通过fastqc[75]进行质量评估,并在高性能计算机集群上使用Trim Galore进行修剪。随后使用Salmon v1.10.1[76]将Fastq读段比对至小家鼠转录组(基于Ensembl注释),生成原始计数和TPM数据。数据通过tximport[77] Bioconductor程序包导入R语言环境,采用R基础程序包/factoextra程序包进行欧氏距离层次聚类与主成分分析,结果通过ggplot或pheatmap绘图程序包可视化。差异表达分析使用DESeq2[78]进行:总RNA-seq中采用0.05的p-adj值将FDR控制在5%;小RNA测序因可用于多重检验校正的miRNA基因数量有限,仅使用0.05的p-value截断值。部分火山图未展示非差异表达基因,并将y轴标准化为平方根−log₁₀(p值或padj)以清晰呈现数据。GO通路分析采用clusterProfiler[79]软件包进行,基因生物类型通过biomaRt[80]包注释。
¶ 5. 多尺度网络分析
MEGENA[81]网络通过R包MEGENA构建,输入数据为DESeq2分析确定的福斯高林(FSK)vs DMSO或DHPG vs DMSO中的上调基因。对全部上调基因的TPM值进行平面性检验以构建平面过滤网络(PFN),随后对所得PFN进行多尺度聚类分析以识别共表达模块。筛选包含最多基因且显著性最强(由MEGENA判定)的模块,最终发现C1_5模块。所有网络图谱均采用Cytoscape[82]中的边加权力导向布局算法生成。
¶ 6. 揭示顺式长链非编码RNA/mRNA对
在福斯高林和DHPG数据集中,均采用显著差异表达(校正后p值<0.05)的lncRNA和mRNA进行分析。首先通过biomaRt按生物类型筛选lncRNA,随后利用biomaRt在lncRNA转录起始位点上下游100kb范围内检索所有显著性mRNA。所有匹配结果均通过UCSC基因组浏览器进行个体验证,以确定精确的顺式作用关系。
¶ 7. 构建miRNA/lncRNA/mRNA互作网络
一旦确定目标miRNA,通过TargetScan和starBase两个数据库筛选其预测靶标,并与全转录组测序数据集中具有统计学显著性的基因(包括mRNA、加工转录本、假基因和lincRNA)进行交叉比对。采用Cytoscape对miRNA-靶标相互作用网络进行可视化,红色和绿色分别代表下调和上调的靶标。
¶ 8. 质粒构建体、LNA缺口聚体和siRNA的转染
- 试剂来源:靶向Gas5的LNA缺口寡聚物由Exiqon(现为QIAGEN)生产;靶向Kif1a、Kif2a、Kif5c、Kif16b和siNC的SMARTPool siRNA库由Dharmacon公司生产。
- 转染方法:采用Lipofectamine RNAiMax(Invitrogen)进行转染。根据制造商指南,将缺口寡聚物或siRNA导入培养12至14天的原代海马神经元。
¶ 9. RNA荧光原位杂交(FISH)和免疫荧光(ICC)
- 探针制备:将Gas5 cDNA的两个300-400 bp片段亚克隆至PCRII TOPO载体中,通过体外转录制备地高辛标记的探针用于FISH实验。抗地高辛Fab片段抗体(罗氏)按1:4000浓度使用,酪胺信号放大试剂盒(Akoya Biosciences)参照制造商说明操作。此外,通过Stellaris设计软件设计25条靶向Gas5的20碱基冗余探针(偶联Quasar570染料),探针序列列于补充材料(数据文件S1)。
- 实验流程:FISH实验严格遵循制造商指南;免疫荧光实验根据需求与FISH联用或单独进行。样本分别在马克斯·普朗克佛罗里达研究所光学显微中心的蔡司LSM 880共聚焦显微镜及UF斯克里普斯生物医学研究影像核心的奥林巴斯IX81完成成像(所用抗体:GSK-3β(27C10-CST)、β-肌动蛋白(8H10D10-CST)及Alexa Fluor偶联二抗)。神经元以低密度铺板(24孔板每孔80,000细胞)以实现单神经元成像,减少相邻神经元信号干扰。
- 超分辨率成像:使用斯克里普斯佛罗里达影像中心配置的蔡司Elyra PS.1系统(德国卡尔蔡司),在SIM模式下采用63倍/1.4 NA油浸复消色差物镜,以1028×1028像素分辨率采集图像。对405、488和561通道采用5种图案旋转和3次平移偏移,每个图像采集20-25层z轴堆栈,通过3个通道(SIM光栅)采集,并经后处理以显示最大强度投影图像或单切片图像(使用Zen Black软件进行SIM重建)。
¶ 10. 蛋白质组学与分析
- 样本处理:蛋白质通过SDS-PAGE分离,用水冲洗后在端到端摇床上固定过夜(10%冰醋酸,30%乙醇)。质谱分析时,分别切出反义和正义探针组对应的条带,在凝胶内进行胰蛋白酶(Pierce Biotechnology,Rockford,IL)消化:先使用二硫苏糖醇和碘乙酰胺进行还原和烷基化处理,随后采用ProteaseMax™表面活性剂胰蛋白酶增强剂在37°C下消化3小时。提取的肽段经ZipTip(Millipore,Billerica,MA)C18柱(2毫克载量)净化。
- LC-MS/MS分析:使用Orbitrap Fusion Tribrid质谱仪进行分析。肽段从EASY PepMap™ RSLC C18色谱柱(2微米,100Å,75微米×50厘米,Thermo Scientific,San Jose,CA)洗脱进入质谱仪,采用梯度洗脱程序:90分钟内溶剂B(80/20乙腈/水,0.1%甲酸)从5%升至25%,随后30分钟内从25%升至44%,0.10分钟内从44%升至80%,维持80%溶剂B 10分钟,3分钟内降至5%并维持3分钟;后续延长梯度程序用于清洗色谱柱。所有流速均为250纳升/分钟,由nEasy-LC1000纳升液相系统(Thermo Fisher Scientific,San Jose,CA)输送(溶剂A为0.1%甲酸溶液)。离子通过EASY Spray源在45°C、2.3kV电压下生成。
- 数据采集与分析:数据依赖性扫描由Xcalibur v4.0.27.10软件执行:先在Orbitrap分析器中进行350-2000质荷比(m/z)的全扫描(分辨率120,000),随后对最强离子实施更高能量碰撞解离(HCD)串联质谱(MS/MS)分析(归一化碰撞能量30%,自动增益控制1.0E4,分辨率30,000)。动态排除设置为25秒内重复离子排除。串联质谱数据比对Uniprot(UP000000589,2020年3月3日下载)小鼠蛋白质组序列及Proteome Discoverer v2.5.0.400内置常见污染蛋白数据库进行检索。检索时设定完全胰蛋白酶酶切(最多允许2个漏切位点),可变修饰包括甲硫氨酸氧化(15.995 Da)、天冬酰胺和谷氨酰胺脱酰胺化(0.984 Da),半胱氨酸氨基甲酰甲基化(57.021 Da)为静态修饰。通过反向数据库检索确定XCorr评分截断值[83],以99%置信度鉴定蛋白质。采用Minora特征检测器节点检测色谱峰和特征。蛋白质与肽段鉴定结果通过Scaffold v5.0.0(Proteome Software公司,波特兰)可视化,接受通过至少两条肽段鉴定(肽段与蛋白质错误发现率均控制在1%以内)的蛋白质。采用经Benjamini-Hochberg校正的配对t检验,以(p<0.05)作为标准化谱图计数统计显著性的判定标准。
¶ 11. 蛋白质印迹法(免疫印迹)
为验证下拉蛋白质组学研究中Gas5的蛋白质相互作用,按上述方法用福斯高林或DMSO处理原代海马神经元。经过交联处理并使用Gas5正义链、反义链探针或对照IgG探针进行下拉实验后,用RIPA裂解液(50 mM Tris-HCl、150 mM NaCl、1.0% (v/v) NP-40、0.5% (w/v) 脱氧胆酸钠、1.0 mM EDTA、0.1% (w/v) SDS、0.01% (w/v) 叠氮化钠,pH 7.4)裂解神经元,通过BCA试剂盒测定蛋白浓度。取25-30 μg蛋白质进行Western印迹分析(所用抗体:GSK-3β [27C10, Cell Signaling Technology (CST)]、磷酸化GSK-3β (Ser9) (5B3, CST) 及β-肌动蛋白(8H10D10, CST))。采用1:5000稀释的抗兔HRP偶联二抗(#5127, CST)或抗小鼠HRP偶联二抗(#7076, CST)检测靶蛋白,最后通过化学发光法(Amersham Biosciences, Piscataway, NJ)显影。使用ImageJ软件对印迹条带进行分析。
¶ 12. 荧光素酶报告基因检测
将含有潜在miR-26a-5p结合位点的小鼠Gas5基因野生型(WT)及突变型(MUT)3′UTR序列,通过XbaI限制性酶切位点插入pGL3 Basic荧光素酶载体(Promega公司,美国)中Luc基因的紧下游位置,所得质粒分别命名为Gas5-WT与Gas5-MUT。
- Gas5-WT序列:5’-gtgagaactgcaaatgcttaaccgggaacctactccagaatacatgatgatctcacacaacttgaactctctcactgattacttgatgatagtaaaagatctgatgttctgtgttttaacagttaccatttaagttaaaattgtagaaaagtgtttaacagctaccttctgttggttgttgcag-3’
- Gas5-MUT序列:5’-gtgagaactgcaaatgcttaaccgggaacctactccagaatacatgatgatctcacacaacttgacatctctccagttaattcgttatgatagtaaaagatctgatgttctgtgttttaacagttaccatttaagttaaaattgtagaaaagtgtttaacagctaccttctgttggttgttgcag-3’
细胞分别与Gas5-WT、Gas5-MUT或“空”pGL3以及miR-26a-5p模拟物或阴性对照共转染,使用Lipofectamine 2000(美国Thermo Fisher Scientific)按照制造商的协议进行。荧光素酶活性在48小时后使用Bright-Glo荧光素酶报告基因检测试剂盒(美国Promega公司,麦迪逊,威斯康星州)测量,同样按照制造商的说明进行。简要地,在检测前,96孔板中的转染细胞被平衡至室温。向每个孔中加入100 μL Bright-Glo试剂(添加到100 μL生长培养基中),充分混匀后允许细胞裂解5分钟,随后使用PHERAstar FSX微孔板读数仪测量荧光强度。将每个构建体的标准化萤火虫荧光素酶活性与pGL3空载体对照组进行比较。每次转染实验的荧光素酶活性数据均取自八个生物学重复的平均值。
¶ 13. 电生理记录与分析
将原代小鼠海马神经元铺植在3Brain公司生产的基于CMOS(互补金属氧化物半导体)技术的高密度微电极阵列(HD-MEA)——BioChip HD-MEA Accura上。该芯片包含4096个记录通道(呈64×64网格排列;面积3.8 mm × 3.8 mm,电极间距60μm),每个微电极尺寸为21μm × 21μm。
- 芯片预处理:Accura芯片经70%乙醇消毒20分钟后,用无菌双蒸水彻底冲洗,在超净工作台下风干。随后将芯片在37°C下用神经基础培养基预处理过夜(增加亲水性),再于37°C用聚D-赖氨酸(50μg/mL)包被过夜,双蒸水彻底冲洗后用于神经元接种。
- 细胞接种与培养:细胞解离后浓度稀释至1000细胞/μL,取100μL悬液(含90,000-110,000个细胞)滴加至HD-MEA芯片。静置3-4小时后加入1.5 mL神经基础培养液,置于37°C、5% CO₂培养箱中培养,每3-4天更换半数培养液。
- 记录与分析:使用4096微电极高通量CMOS微电极阵列系统(BioCam X, 3Brain)在不同天数进行多次5分钟记录采样,采样频率17.8 kHz/电极,并通过集成Brainwave 5软件进行分析。
¶ 14. 神经元形态评估
将小鼠原代海马神经元分别转染靶向Gas5的gapmer或阴性对照,72小时后在UF Scripps生物医学研究中心的光学显微镜平台上使用共聚焦显微镜(FV1000;奥林巴斯;Apo N 60X/1.49油镜)于Hibernate-E培养基(Brainbits)中采集树突图像。
- 树突分枝分析:通过Fluoview1000(64位)软件(奥林巴斯)获取Z轴堆叠图像,并在FIJI(ImageJ, NIH)中转换为最大投影强度图像。使用FIJI中的Sholl分析插件对树突乔木进行量化分析:以胞体中心作为同心半径的中点及原点,从该点延伸至胞体最长轴。分析参数设置为:起始半径20μm,终止半径100μm,半径步长10μm。计算反映树突乔木中最高进程/分支数量的采样交点的最大值,并绘制交点数量与距离的关系曲线。数据采用双因素方差分析进行处理。
- 树突棘形态分析:使用马克斯·普朗克佛罗里达研究所光学显微镜实验室自主开发的MATLAB[85]脚本。该软件基于几何学方法,可自动检测并量化Z-栈共聚焦图像中选定次级树突分支(100μm长度)的树突棘结构。通过分析树突棘头部、颈部和杆部等结构元件的差异,软件将检测到的树突棘自动归类为三种形态学类型(细长型、粗短型或蘑菇型)。采用学生t检验评估组间统计学差异。
¶ 15. RNA pull-down实验(结合蛋白质组学、转录组学和保护片段分析)
将全长正义链Gas5 RNA序列从模板(Thermo Fisher Scientific)克隆至pCR-II-TOPO载体,经线性化处理并通过体外转录进行5’端生物素标记(Roche)——正义链使用SP6 RNA聚合酶,反义链使用T7聚合酶作为对照。
- 细胞处理与裂解:小鼠原代神经元以每孔15万的密度接种于6孔板,培养至DIV 17后,分别用福斯高林(50 μM)、DHPG(50 μM)或DMSO对照进行处理30分钟。处理后用4%多聚甲醛固定样本15分钟,再用预冷1× PBS清洗3次,随后加入600 μL裂解缓冲液I(50mM Tris-HCl、150mM NaCl、0.5M EDTA、10% NP-40、100×蛋白酶抑制剂cocktail、100×磷酸酶抑制剂2、100×磷酸酶抑制剂3、50μL RNA酶抑制剂、100× BSA及1mM DTT),4°C以1200×g离心20分钟,弃去沉淀。
- 磁珠处理与探针孵育:用裂解缓冲液I清洗链霉亲和素磁珠两次(每次2分钟),并用酵母tRNA与糖原(0.2 mg/ml)封闭过夜。将探针于72°C线性化15分钟后置冰上冷却,取2 μL探针加入裂解液(各条件样本约500 μL),于4°C旋转混合2小时;期间用裂解缓冲液I清洗磁珠一次以解除封闭。探针孵育后,每样本加入10 μL磁珠继续4°C孵育1小时。
- 复合物分离:移除裂解液,用裂解缓冲液I清洗磁珠3次(每次2分钟),再用高严格性缓冲液(裂解缓冲液II——不含BSA,含600mM NaCl)清洗3次。随后加入40 μL LB缓冲液通过95°C加热10分钟分离蛋白质,或用Trizol稀释后旋转孵育40分钟。最后使用Direct-zol RNA微量提取试剂盒(Zymo)按说明书分离样本RNA,经RNA-seq处理后由Wertheim UF Scripps Institute基因组学核心进行分析。
¶ 16. RNA-seq分析RNA酶保护片段
保护片段研究按照RNA-蛋白质相互作用的Pull-down方案进行。经RNA酶A孵育(30 μL Tris缓冲液含0.15% SDS及1μL RNA酶A,37℃孵育1小时)后,样品用PBS稀释。通过蔗糖垫超速离心(70,000 RPM,4小时)对保护片段进行纯化与富集。去除上清液后,将RNA片段沉淀溶于Trizol试剂,采用Trizol-氯仿RNA纯化法进行提纯。最终样本由沃特海姆UF斯克里普斯研究所基因组学中心按上述“总RNA和小RNA测序与分析”方案完成测序。
¶ 17. 统计分析
统计分析在R Studio 1.2.1335版本和Prism 8中完成。数据以均值±SEM表示。非组学实验中的所有结果变量均假定符合正态分布:
- 对于无重复测量的实验设计,采用非配对双尾t检验、单因素方差分析或双因素方差分析进行统计;
- 对于在同一样本不同时间点或不同处理条件下进行测量的实验设计,采用配对t检验和混合模型方差分析方法。
事后检验方法根据GraphPad Prism推荐程序选择,具体检验方法已在图注和补充材料中注明。除特别说明外,N代表每个实验的独立样本数量。设定p值临界值为0.05,并在图中进行相应标注。
¶ 补充材料
请参考PubMed Central上的网络版本获取补充材料。
¶ 致谢
我们感谢Wertheim UF Scripps研究所的R. Davis提供5XFAD小鼠,感谢Scripps佛罗里达基因组学核心部门的P. Karunadharma和R. M. Witwicki制备RNA测序文库,感谢Wertheim UF Scripps研究所蛋白质组学核心部门的G. Tsaprailis进行Gas5相互作用蛋白质的质谱分析和生物信息学处理,感谢Wertheim UF Scripps研究所先进光学显微镜核心部门的A. Velong就FISH和SIM成像提供关键建议,并感谢G. Crynen对本稿件统计方法、分析与报告部分的审阅工作。
¶ 资金
我们感谢美国国立卫生研究院(NIH项目号1R01MH119541-01A1)提供的资助支持,使得这项工作得以顺利开展。
¶ 数据和材料可用性
- RNA测序数据已存入NCBI Gene Expression Omnibus数据库,登录号为GSE161071(图1)和GSE180503(图7);
- 质谱蛋白质组学数据通过PRIDE[55]合作存储库提交至ProteomeXchange联盟,数据集标识符为PXD027453和10.6019/PXD027453;
- 论文中评估结论所需的其他所有数据均可在正文及补充材料中获取。此外,根据合理要求,作者可提供相关数据。
¶ 参考文献和注释
- Lipovich L 等, 《活动依赖性的人脑编码/非编码基因调控网络》. 《遗传学》, 2012年. 192(3): 第1133–48页. [PubMed: 22960213]
- Grooms SY 等, 《活动双向调节海马神经元树突中AMPA受体mRNA的丰度》. 《神经科学杂志》, 2006年. 26(32): 第8339–51页. [PubMed: 16899729]
- Kandel E, 《记忆存储的分子生物学——基因与突触的对话》. 2001年.
- Fortin DA 等, 《长时程增强依赖的树突棘增大需要由CaM激酶I招募的突触Ca²⁺可渗透性AMPA受体》. 《神经科学杂志》, 2010年. 30(35): 第11565–75页. [PubMed: 20810878]
- Lebeau G 等, 《Staufen 2调控海马神经元中mGluR长时程抑制及Map1b mRNA的分布》. 《学习与记忆》, 2011年. 18(5): 第314–26页. [PubMed: 21508097]
- West AE 与 Greenberg ME, 《突触发育与认知功能中神经元活动调节的基因转录》. 《冷泉港生物学视角》, 2011年. 3(6).
- Grinman E, Espadas I 与 Puthanveettil SV, 《长链非编码RNA在学习、记忆及相关疾病中的新兴作用》. 《神经生物学学习与记忆》, 2019年. 163: 第107034页. [PubMed: 31176693]
- Issler O 与 Chen A, 《确定微RNA在精神疾病中的作用》. 《自然评论神经科学》, 2015年. 16(4): 第201–12页. [PubMed: 25790865]
- Kleaveland B 等, 哺乳动物大脑中非编码调控RNA网络的作用. 细胞, 2018. 174(2): 第350–362页 e17. [PubMed: 29887379]
- Butler AA 等, 长链非编码RNA NEAT1介导神经元组蛋白甲基化与年龄相关记忆损伤. 科学信号, 2019. 12(588).
- Gu QH 等, miR-26a与miR-384-5p是维持LTP和树突棘增大所必需的. 自然通讯, 2015. 6: 第6789页. [PubMed: 25858512]
- Otmakhov N 等, 海马CA1区福斯高林诱导的LTP依赖NMDA受体. 神经生理学杂志, 2004. 91(5): 第1955–62页. [PubMed: 14702333]
- Blaabjerg M 等, I组代谢型谷氨酸受体神经保护性激活后海马基因表达的变化. 分子脑研究, 2003. 117(2): 第196–205页. [PubMed: 14559154]
- Chen PB 等, 海马晚期长时程增强期间兴奋性神经元基因表达图谱. 分子神经科学前沿, 2017. 10: 第39页. [PubMed: 28275336]
- Pratt AJ 与 MacRae IJ, RNA诱导沉默复合体:多功能基因沉默机器. 生物化学杂志, 2009. 284(27): 第17897–901页. [PubMed: 19342379]
- Bavamian S 等, miR-34a失调将神经元发育与双相情感障碍遗传风险因素相关联. 分子精神病学, 2015. 20(5): 第573–84页. [PubMed: 25623948]
- Dias C 等, β-连环蛋白通过Dicer1/微RNA调控介导应激韧性. 自然, 2014. 516(7529): 第51–5页. [PubMed: 25383518]
- Li JH 等, starBase v2.0:基于大规模CLIP-Seq数据解码miRNA-ceRNA、miRNA-ncRNA及蛋白质-RNA相互作用网络. 核酸研究, 2014. 42(数据库issue): 第D92–7页. [PubMed: 24297251]
- Agarwal V 等, 预测哺乳动物mRNA中有效的微RNA靶点. 生命, 2015. 4.
- Guttman M 等, 染色质特征揭示哺乳动物中存在上千种高度保守的长链非编码RNA. 自然, 2009. 458(7235): 第223–7页. [PubMed: 19182780]
- Khalil AM 等, 人类大量基因间长链非编码RNA与染色质修饰复合物结合并影响基因表达. 美国国家科学院院刊, 2009. 106(28): 第11667–72页. [PubMed: 19571010]
- Li D 等, 活性依赖性LoNA通过协调rRNA转录与甲基化调控翻译. 自然通讯, 2018. 9(1): 第1726页. [PubMed: 29712923]
- Raveendra BL 等, 长链非编码RNA GM12371作为突触功能的转录调控因子. 美国国家科学院院刊, 2018.
- Song WM 与 Zhang B, 多尺度嵌入式基因共表达网络分析. 公共科学图书馆·计算生物学, 2015. 11(11): 第e1004574页. [PubMed: 26618778]
- McKenzie AT 等, 脑细胞类型特异性基因表达与共表达网络结构. 科学报告, 2018. 8(1): 第8868页. [PubMed: 29892006]
- Kim S 与 Martin KC, 全神经元RNA运输与神经导向蛋白介导的局部翻译协同调控突触蛋白质组空间分布. 生命, 2015. 4.
- Puthanveettil SV 等, 突触可塑性的新组成部分:鳃撤回反射神经元中驱动蛋白的上调. 细胞, 2008. 135(5): 第960–73页. [PubMed: 19041756]
- Valluy J 等, 选择性Ube3a转录本在神经元发育中的非编码功能. 自然神经科学, 2015. 18(5): 第666–73页. [PubMed: 25867122]
- Lucci C 等, miRNA-26a对GSK3β水平的时空调控控制皮层神经元轴突发育. 发育, 2020. 147(3).
- Sim SE 等, 脑富集微RNA miR-9-3p调控突触可塑性与记忆. 神经科学杂志, 2016. 36(33): 第8641–52页. [PubMed: 27535911]
- Liang W 等, 敲低生长停滞特异性转录本5通过上调人内皮细胞中miR-26a修复氧化低密度脂蛋白诱导的自噬流损伤. 欧洲药理学杂志, 2019. 843: 第154–161页. [PubMed: 30468731]
- Wang S 等, 长链非编码RNA生长停滞特异性转录本5及其相互作用蛋白在衰老中的功能网络. 遗传学前沿, 2021. 12: 第615340页. [PubMed: 33777096]
- Eliscovich C 与 Singer RH, 《细胞生物学中的RNP运输:漫长而曲折的道路》. 当前细胞生物学观点, 2017年. 45卷: 第38–46页. [PubMed: 28258033]
- Rao-Ruiz P 等, 《情境记忆巩固的印迹特异性转录组分析》. 自然通讯, 2019年. 10(1): 第2232页. [PubMed: 31110186]
- Kim TK 等, 《神经元活动调控增强子中的广泛转录现象》. 自然, 2010年. 465(7295): 第182–7页. [PubMed: 20393465]
- Coba MP 等, 《激酶网络整合海马区N-甲基-D-天冬氨酸受体介导的基因表达谱》. 生物化学杂志, 2008年. 283(49): 第34101–7页. [PubMed: 18815127]
- Modarresi F 等, 《体内抑制天然反义转录本导致基因特异性转录上调》. 自然生物技术, 2012年. 30(5): 第453–9页. [PubMed: 22446693]
- Bagot Rosemary C. 等, 《全环路转录谱分析揭示调控抑郁易感性的大脑区域特异性基因网络》. 神经元, 2016年. 90(5): 第969–983页. [PubMed: 27181059]
- Xu J 等, 《由miRNA介导的广泛ceRNA-ceRNA互作网络调控多个恒河猴组织的发育》. 核酸研究, 2016年. 44(19): 第9438–9451页. [PubMed: 27365046]
- Bitetti A 等, 《保守靶RNA调控microRNA降解影响动物行为》. 自然结构与分子生物学, 2018年. 25(3): 第244–251页. [PubMed: 29483647]
- Luo G 等, 《长链非编码RNA GAS5通过靶向P27 Kip1抑制细胞增殖》. 分子癌症研究, 2017年. 15(7): 第789–799页. [PubMed: 28396462]
- Hu G, Lou Z 与 Gupta M, 《长链非编码RNA GAS5与真核翻译起始因子4E协同调控c-Myc翻译》. 公共科学图书馆·综合, 2014年. 9(9): 第e107016页. [PubMed: 25197831]
- Kino T 等, 《非编码RNA Gas5是糖皮质激素受体的生长停滞与饥饿相关抑制因子》. 科学信号, 2010年. 3(107).
- Zhang Z 等, 《miR-21对长链非编码RNA GAS5的负向调控》. 细胞死亡与分化, 2013年. 20(11): 第1558–1568页. [PubMed: 23933812]
- Swarnkar S 等, 《分子马达蛋白KIF5C通过限制局部翻译介导结构可塑性与长时程记忆》. 细胞报告, 2021年. 36(2): 第109369页. [PubMed: 34260917]
- Hafner AS 等, 《局部蛋白质合成是神经元突触前与突触后隔室的普遍特征》. 科学, 2019年. 364(6441).
- Van Treeck B 与 Parker R, 《RNA分子间相互作用在RNP组装中的新兴功能》. 细胞, 2018年. 174(4): 第791–802页. [PubMed: 30096311]
- Ferrari F 等, 《脆性X智力低下蛋白-RNP颗粒显示代谢型谷氨酸受体依赖的突触后棘定位》. 分子细胞神经科学, 2007年. 34(3): 第343–54页. [PubMed: 17254795]
- Bakthavachalu B 等, 《通过Ataxin-2无序结构域组装的RNP颗粒是长时程记忆与神经退行病变所必需的》. 神经元, 2018年. 98(4): 第754–766页e4. [PubMed: 29772202]
- Grinman E 等, 《活动调控的长链非编码RNA ADEPTR突触靶向通过定位Sptn1与AnkB至树突介导结构可塑性》. 科学进展, 2021年. 7(16).
- Zalfa F 等, 《脆性X综合征蛋白FMRP与BC1 RNA结合并调控突触特定mRNA的翻译》. 细胞, 2003年. 112(3): 第317–327页. [PubMed: 12581522]
- Menard C 与 Quirion R, 《第1组代谢型谷氨酸受体功能及其在衰老大脑中对学习记忆的调控》. 药理学前沿, 2012年. 3: 第182页. [PubMed: 23091460]
- Abraham WC 等, 《与海马异突触长时程抑制持续相关的即时早期基因表达》. 美国国家科学院院刊, 1994年. 91(21): 第10049–53页. [PubMed: 7937835]
- Perez-Riverol Y 等, 《2019年PRIDE数据库及相关工具资源:增强定量数据支持》. 核酸研究, 2019年. 47(D1): 第D442–D450页. [PubMed: 30395289]
- Schmitz SU, Grote P 与 Herrmann BG (2016). 长链非编码RNA在发育和疾病中功能的分子机制. 细胞分子生命科学. 73, 2491–2509. [PubMed: 27007508]
- 陈晓,任刚,李岩等. LncRNA GAS5水平与海马体积关联阿尔茨海默病进展. 临床干预老龄化. 2022年5月9日;17:745–753. [PubMed: 35592641]
- Patel RS, Lui A, Hudson C 等. 靶向长链非编码RNA GAS5的小分子鼻内给药可改善老年小鼠模型的神经元胰岛素信号并减少神经炎症. 科学报告 13, 317 (2023). [PubMed: 36609440]
- Chanda K, Jana NR, Mukhopadhyay D. 长链非编码RNA MALAT1通过调控受体酪氨酸激酶EPHA2表达抵抗Aβ1-42诱导的毒性,其机制为淬灭阿尔茨海默病中的miR-200a/26a/26b. 生命科学. 2022年5月19日;302:120652. [PubMed: 35598655]
- 谢婷,裴莹,单平等. 阿尔茨海默病表达谱中miRNA-mRNA配对鉴定及miR-26a-5p/PTGS2对淀粉样蛋白-β诱导神经毒性的作用研究. 衰老神经科学前沿. 2022年6月15日;14:909222. [PubMed: 35783137]
- Prieto GA, Trieu BH, Dang CT 等. 阿尔茨海默病突触长时程增强的药理学挽救. 神经科学杂志. 2017年2月1日;37(5):1197–1212. [PubMed: 27986924]
- 蔡卓,赵阳,赵斌. 糖原合酶激酶3在阿尔茨海默病中的作用. 阿尔茨海默病当前研究. 2012年9月;9(7):864–79. doi: 10.2174/156720512802455386. [PubMed: 22272620]
- Lauretti E, Dincer O, Praticò D. 阿尔茨海默病中糖原合酶激酶-3信号通路. 生物化学与生物物理学报分子细胞研究. 2020年5月;1867(5):118664. doi: 10.1016/j.bbamcr.2020.118664. [PubMed: 32006534]
- Nakahata Y, Yasuda R. 树突棘结构可塑性:局部信号、翻译与细胞骨架重组. 突触神经科学前沿. 2018年8月29日;10:29. [PubMed: 30210329]
- Swarnkar S, Avchalumov Y, Raveendra BL 等. 驱动蛋白家族成员Kif11与Kif21B通过不同机制抑制兴奋性突触传递. 科学报告 8, 17419 (2018). [PubMed: 30479371]
- Swarnkar S, Avchalumov Y, Espadas I 等. 运动蛋白KIF5C通过限制局部翻译介导结构可塑性与长时程记忆. 细胞报告. 2021年7月13日;36(2):109369. [PubMed: 34260917]
- Liau WS, Zhao Q, Bademosi A 等. 恐惧消退受突触长链非编码RNA活性调控. 自然通讯. 2023年11月22日;14(1):7616. [PubMed: 37993455]
- Wei W, Zhao Q, Wang Z 等. ADRAM是通过与伴侣蛋白14-3-3直接相互作用驱动恐惧消退的经验依赖性长链非编码RNA. 细胞报告. 2022年3月22日;38(12):110546. [PubMed: 35320727]
- Meier I, Fellini L, Jakovcevski M 等. snoRNA宿主基因gas5在海马中的表达受年龄和心理应激上调并与C57BL/6小鼠新奇诱导行为减少相关. 海马. 2010;20(9):1027–1036. [PubMed: 19739230]
- Espadas I, Wingfield JL, Nakahata Y 等. 突触靶向长链非编码RNA SLAMR通过增强翻译与CaMKII活性促进结构可塑性. 自然通讯. 2024年3月27日;15(1):2694. [PubMed: 38538603]
- Hooper C, Killick R, Lovestone S. 阿尔茨海默病的GSK3假说. 神经化学杂志. 2008年3月;104(6):1433–9. [PubMed: 18088381]
- Lauretti E, Dincer O, Praticò D. 糖原合酶激酶-3信号在阿尔茨海默病中的作用. 《生物化学与生物物理学报分子细胞研究》. 2020年5月;1867(5):118664. [PubMed: 32006534]
- Gallo FT, Katche C, Morici JF, Medina JH, Weisstaub NV. 即刻早期基因、记忆与精神疾病:聚焦c-Fos、Egr1与Arc. 《行为神经科学前沿》. 2018年4月25日;12:79. [PubMed: 29755331]
- Banerjee D, Sultana S, Banerjee S. Gas5调控早年应激诱发的焦虑与空间记忆. 《神经化学杂志》. 2024年7月3日. doi: 10.1111/jnc.16167.
- Andrews S (2010). FastQC:高通量测序数据质量控工具[在线]. 访问地址: http://www.bioinformatics.babraham.ac.uk/projects/fastqc/.
- Patro R, Duggal G, Love MI, Irizarry RA, Kingsford C. Salmon提供快速且偏差感知的转录本表达定量. 《自然方法》. 2017年4月;14(4):417–419. doi: 10.1038/nmeth.4197. [PubMed: 28263959]
- Soneson C, Love MI, Robinson MD (2015). “RNA-seq差异分析:转录本水平估计提升基因水平推断.” 《F1000研究》, 4. doi:10.12688/f1000research.7563.1.
- Love MI, Huber W, Anders S (2014). “DESeq2对RNA-seq数据折叠变化与离散度的稳健估计.” 《基因组生物学》, 15, 550. doi:10.1186/s13059-014-0550-8. [PubMed: 25516281]
- Wu T, Hu E, Xu S等 (2021). “clusterProfiler 4.0:解读组学数据的通用富集工具.” 《创新》, 2(3), 100141. doi:10.1016/j.xinn.2021.100141. [PubMed: 34557778]
- Durinck S, Spellman P, Birney E等 (2009). “使用R/Bioconductor包biomaRt整合基因组数据集的标识符映射.” 《自然实验手册》, 4, 1184–1191. [PubMed: 19617889]
- Song W-M, Zhang B (2015) 多尺度嵌入式基因共表达网络分析. 《公共科学图书馆·计算生物学》11(11): e1004574. doi: 10.1371/journal.pcbi.1004574. [PubMed: 26618778]
- Shannon P, Markiel A, Ozier O等. Cytoscape:生物分子相互作用网络整合模型软件环境. 《基因组研究》. 2003年11月;13(11):2498–504. doi: 10.1101/gr.1239303. [PubMed: 14597658]
- Qian WJ, Liu T, Monroe ME等. 基于概率的肽段和蛋白质鉴定评估:串联质谱与SEQUEST分析的人类蛋白质组. 《蛋白质组研究杂志》, 4 (2005), 第53–62页.DOI: 10.1021/pr0498638. [PubMed: 15707357]
- Keller A, Nesvizhskii AI, Kolker E等. 通过MS/MS和数据库搜索评估肽段鉴定准确性的经验统计模型. 《分析化学》, 74 (2002), 第5383–5392页.10.1021/ac025747h. [PubMed: 12403597]
- The MathWorks Inc. (2022). MATLAB版本: 9.13.0 (R2022b), 马萨诸塞州内蒂克市: The MathWorks Inc. https://www.mathworks.com
- Carrieri C, Cimatti L, Biagioli M等. 长链非编码反义RNA通过嵌入的SINEB2重复序列调控Uchl1翻译. 《自然》. 2012年11月15日;491(7424):454–7. doi: 10.1038/nature11508. [PubMed: 23064229]
- Vance KW, Sansom SN, Lee S等. 长链非编码RNA Paupar调控局部及远端基因表达. 《EMBO杂志》. 2014年2月18日;33(4):296–311. doi: 10.1002/embj.201386225. [PubMed: 24488179]
- Geng X, Song N, Zhao S等. LncRNA GAS5通过血小板反应蛋白1作为miR-21的竞争性内源RNA促进缺血性急性肾损伤细胞凋亡. 《细胞死亡发现》. 2020年4月2日;6:19. doi: 10.1038/s41420-020-0253-8. [PubMed: 32257391]
- Liu YL, Hu XL, Song PY等. GAS5/微小RNA-223-3p/P2Y12轴对冠心病患者氯吡格雷反应性的影响. 《美国心脏协会杂志》. 2021年11月2日;10(21):e021129. doi: 10.1161/JAHA.121.021129. [PubMed: 34713722]
- Li Y, Geng Y, Zhou B等. 长链非编码RNA GAS5加重冠状动脉粥样硬化通过MicroRNA-194-3p/TXNIP轴调节机制. 《分子神经生物学》2021年7月;58(7):3198-3207. doi: 10.1007/s12035-021-02332-x. [PubMed: 33638792]
- 李睿、陈哲、周颖、买买提热夏提·古丽、严倩、李杨、买买提伊明·阿布都拉、周晨、任杰、刘畅、买尼克·阿不都、周鹏、丁莉. 长链非编码RNA SCAMP1通过破坏miR-26a-5p与ZEB2之间的平衡促进骨肉瘤细胞活力和侵袭. 《肿瘤学前沿》. 2022年8月3日;12:967000. doi: 10.3389/fonc.2022.967000. [PubMed: 35992869]
- Hu W, Zhao Y, Su L, Wu Z, Jiang W, Jiang X, Liu M. 沉默lncRNA NORAD通过miR26a5p抑制头颈部鳞状细胞癌干细胞的上皮-间质转化. 《分子医学报告》. 2021年11月;24(5):743. doi: 10.3892/mmr.2021.12383. [PubMed: 34435652]
- Li J, Tong Y, Zhou Y, Han Z, Wang X, Ding T, Qu Y, Zhang Z, Chang C, Zhang X, Qiu C. LncRNA KCNQ1OT1作为miR-26a-5p的海绵调节ATG12介导的心肌细胞自噬并加重心肌梗死. 《国际心脏病学杂志》. 2021年9月1日;338:14–23. doi: 10.1016/j.ijcard.2021.05.053. [PubMed: 34089766]
¶ 图表说明(节选)
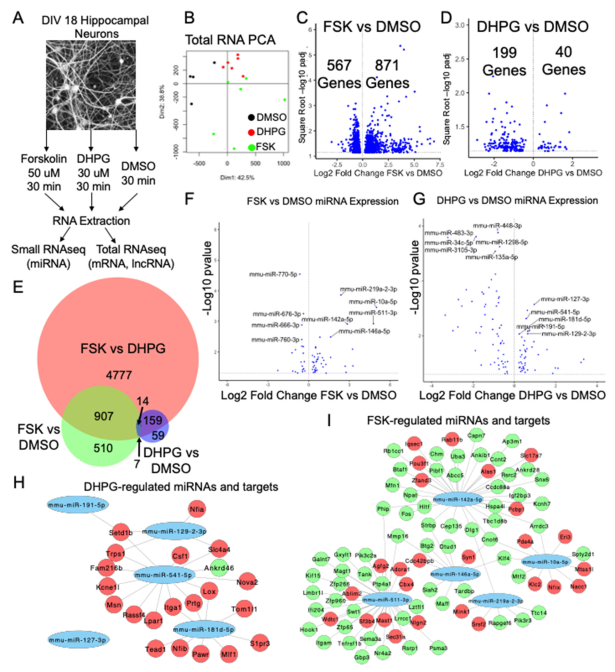
¶ 图1: cAMP 和 mGluR1/5 信号在海马神经元中产生不同的分子特征
(A) 小鼠原代海马神经元RNA制备及测序实验流程示意图(图示代表性图像为Map2染色)。(B) 各处理组全RNA-seq TPM值的主成分分析(FSK:福斯高林)。(C、D) 火山图显示福斯高林与DMSO处理神经元(C)及DHPG与DMSO处理神经元(D)中经DESeq2鉴定具有显著差异的基因(每组(N=4-6),两次独立实验,(padj <0.05))。(E至G) 韦恩图显示指定比较中重叠基因(E)和miRNA(F与G)的数量((p值<0.05),DESeq2分析)。(H和I) 通过starBase和TargetScan确定的排名前5的DHPG上调(H)和FSK上调(I)miRNA及其推定靶标的网络图(蓝色:miRNA名称;绿色/红色:靶标显著上调/下调)。
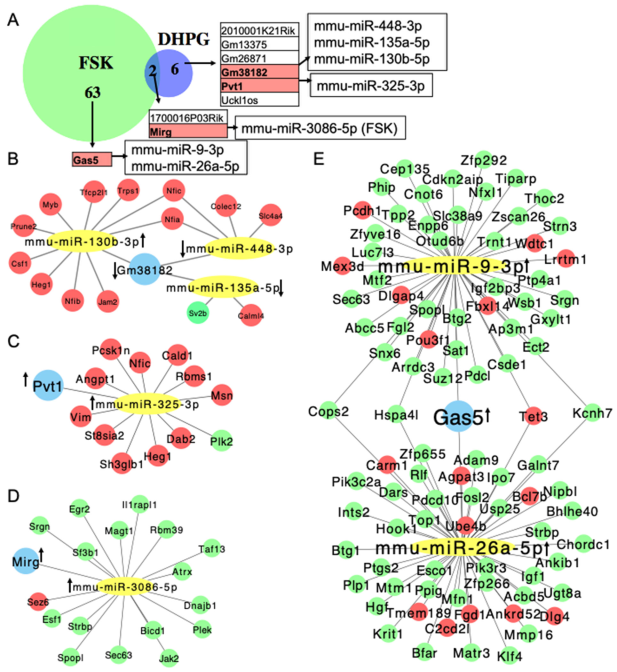
¶ 图2: 在cAMP和mGluR1/5信号传导下,lncRNA与miRNAs竞争同一靶mRNA
(A) 韦恩图显示在福斯高林或DHPG处理的小鼠原代海马神经元中,靶向各自数据集内差异表达miRNA的差异表达lncRNA(通过starBase和TargetScan数据库共同鉴定)。(B和C) mGluR1/5信号通路下Gm38182(B)和Pvt1(C)的lncRNA/miRNA/mRNA调控网络。(D和E) cAMP信号通路下Mirg(D)和Gas5(E)的lncRNA/miRNA/mRNA调控网络(Cytoscape可视化,红色:下调基因,绿色:上调基因;箭头表示miRNA/lncRNA调控方向)。
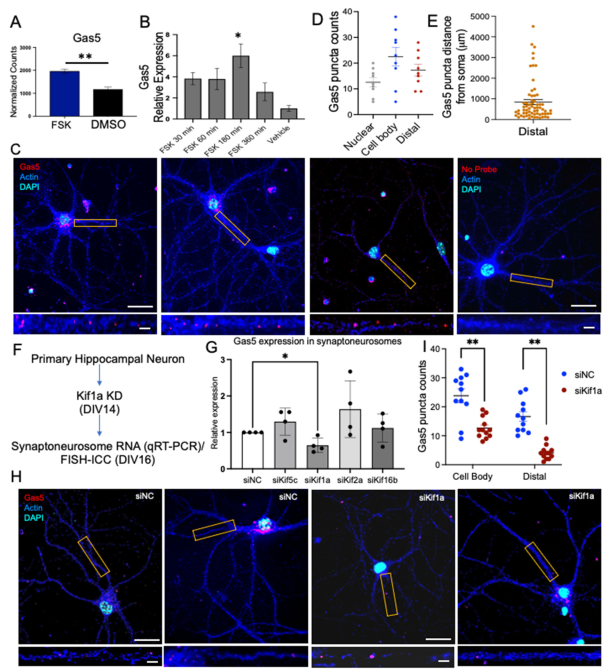
¶ 图3: lncRNA Gas5受cAMP信号激活并定位于树突
(A) DESeq2生成的Gas5表达归一化计数(福斯高林与DMSO处理的小鼠原代海马神经元)。(B) qRT-PCR检测的福斯高林依赖性Gas5表达时间进程(每组(N=4-6)个神经元,三次独立实验,(*p<0.05),单因素方差分析+Dunnett检验)。© DIV 16海马神经元FISH-ICC联合检测(Quasar荧光标记Gas5探针,肌动蛋白染色标记突起,DAPI显影细胞核;每组(N=12-15)个神经元,两次独立实验,比例尺:10μm,插图3μm)。(D) Gas5斑点在细胞核、胞体、远端突起中的分布量化(散点图)。(E) Gas5斑点在远端突起中距胞体距离的量化(散点图,每组(N=11-15)个神经元,三次独立实验)。(F) KIF1A敲低后突触小体中Gas5检测实验示意图。(G) 敲低指定KIF后突触小体中Gas5相对表达量(柱状图,每组(N=4),两次独立实验,非配对学生t检验,(*p<0.05))。(H) KIF1A敲低后DIV 16海马神经元FISH-ICC图像(比例尺:10μm,插图3μm)。(I) Gas5斑点在胞体和远端突起中的分布量化(散点图,每组(N=12-15)个神经元,两次独立实验,双因素方差分析+Dunnett检验,(**p<0.01))。
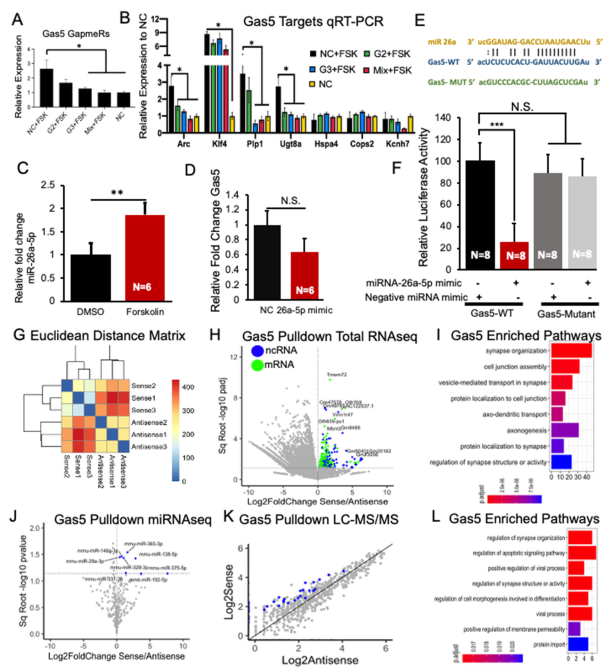
¶ 图4: Gas5与参与突触功能的RNA及蛋白质存在相互作用
(A) Gas5 gapmer有效性验证:小鼠原代海马神经元分别转染乱序序列及3种靶向Gas5的gapmer,qRT-PCR检测Gas5表达(数据来自两次独立实验,每组(N=3)个培养孔,单因素方差分析+Dunnett检验,(*p<0.05))。
(B) Gas5敲低对cAMP靶基因的影响:转染gapmer 72小时后用福斯高林处理30分钟,qRT-PCR检测miR-26a-5p专属靶标(Klf4、Plp1、Ugt8a)及共靶标(Hspa4、Cops2、Kcnh7)的表达(三次独立实验,每组(N=3)个培养孔,单因素方差分析+Dunnett检验)。
© 福斯高林对miR-26a-5p水平的影响:福斯高林处理神经元30分钟后,茎环qRT-PCR定量成熟miR-26a-5p(两次独立实验,每组(N=5)个孔,配对学生t检验,(p<0.01)。
(D) miR-26a-5p过表达对Gas5的影响:转染miR-26a-5p模拟物48小时后,qRT-PCR检测Gas5水平(三次独立实验,每组(N=3)个孔,配对学生t检验,ns:无显著性)。
(E) 荧光素酶报告实验设计:示意图展示miR-26a-5p与Gas5的野生型(WT)、突变型(MUT)结合区域序列。
(F) 荧光素酶活性检测:Gas5-WT与miR-26a-5p模拟物共转染后荧光活性显著降低,突变型无影响(两次独立实验,每组(N=8)个孔,双因素方差分析+Tukey多重比较检验,(****p<0.005);ns:无显著性)。
(G) Gas5 pull-down样本的欧几里得距离矩阵:正义链重复样本紧密聚集,与反义链样本明显分离。
(H) Gas5富集RNA的火山图:相对于反义探针组,正义探针组中显著富集的RNA((padj<0.05),DESeq2分析,两次独立实验,每组(N=3)个孔)。
(I) 富集RNA的GO分析(生物过程):主要涉及突触定位、突触结构调控等(ClusterProfiler分析,(padj<0.05))。
(J) Gas5富集miRNA的火山图:8种特异性富集的miRNA((p<0.05),DESeq2分析,两次独立实验,每组(N=3)个孔)。
(K) Gas5富集蛋白的标准化光谱计数:58种特异性富集蛋白(蓝色标注,两次独立实验,每组(N=3)个孔,Benjamini-Hochberg校正配对t检验,(p<0.05))。
(L) 富集蛋白的GO分析(生物过程):主要涉及突触组织、细胞凋亡等((padj<0.05))。
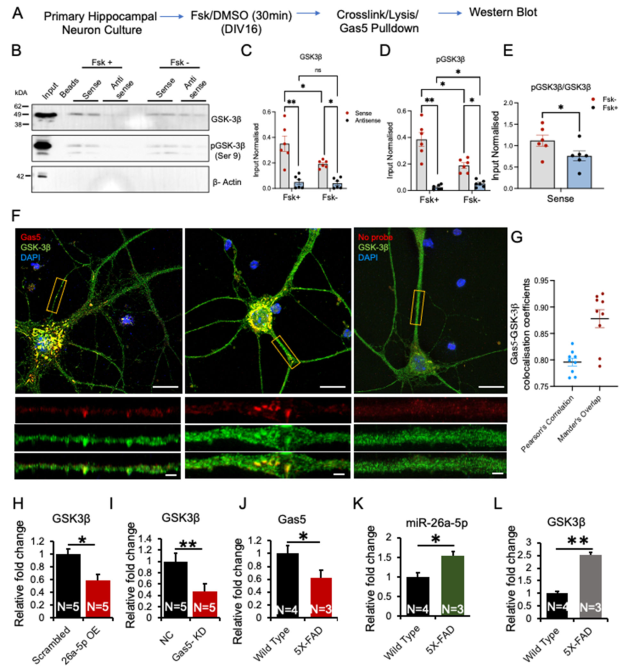
¶ 图5: GSK-3β与Gas5相互作用
(A) Gas5 pull-down结合Western Blot实验示意图。
(B-E) 福斯高林对Gas5-GSK-3β相互作用的影响:福斯高林(Fsk+)或DMSO(Fsk-)处理神经元30分钟后,pull-down裂解液中总GSK-3β(B、C)及磷酸化GSK-3β(Ser9位点;D、E)的免疫印迹分析(三次独立实验,每组(N=6)个培养孔,双因素方差分析+Sidak/Tukey多重比较检验,(*p<0.05),(p<0.01;ns:无显著性)。
(F) Gas5与GSK-3β的超分辨率成像:DIV 16神经元FISH-ICC联合检测(Quasar荧光标记Gas5探针,GSK-3β免疫染色,DAPI显影细胞核;SIM单层切片,每组(N=12-15)个神经元,三次独立实验,比例尺:10μm,插图3μm)。
(G) 共定位量化:Gas5与GSK-3β的皮尔逊系数和曼德尔系数(散点图,每组(N=12-15)个神经元,三次独立实验)。
(H) miR-26a-5p过表达对GSK-3β mRNA的影响:柱状图显示过表达miR-26a-5p后GSK-3β mRNA显著下调(两次独立实验,每组(N=5)个孔,配对学生t检验,(*p<0.05))。
(I) Gas5敲低对GSK-3β mRNA的影响:柱状图显示Gas5敲低后GSK-3β mRNA显著下调(两次独立实验,每组(N=5)个孔,配对学生t检验,(*p<0.01))。
(J-L) 5XFAD小鼠中Gas5、miR-26a-5p及GSK-3β的表达:与野生型小鼠相比,AD模型小鼠Gas5显著下调(J)、miR-26a-5p显著上调(K)、GSK-3β显著上调(L)(每组(N=3-4)只小鼠,两次独立实验,非配对学生t检验,(*p<0.05),(p<0.01)。
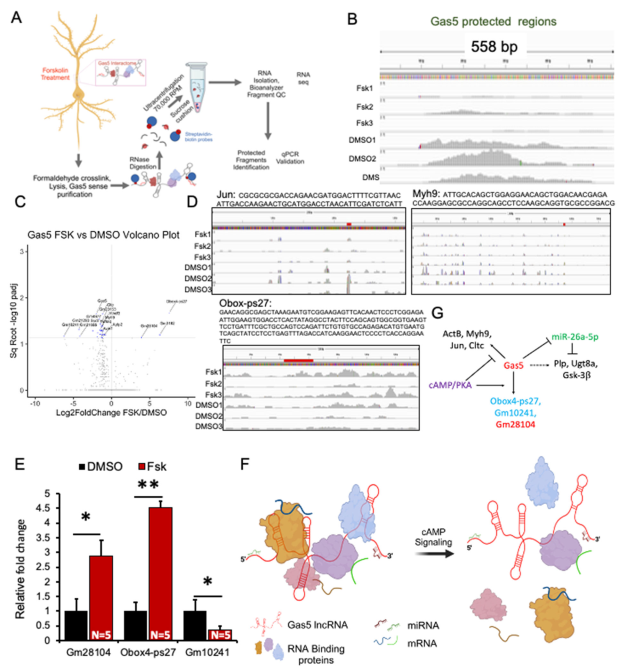
¶ 图6: cAMP诱导的Gas5相互作用组变化
(A) 实验策略示意图:福斯高林/DMSO处理后,用生物素标记Gas5探针pull-down复合物,经RNase消化、蔗糖垫超速离心纯化保护片段,再通过RNA-seq鉴定。
(B) Gas5转录本的IGV堆积图:福斯高林(Fsk)处理后Gas5的核糖核酸酶可及性显著增加(红色箭头标注敏感区域)。
© 福斯高林vs DMSO的差异富集转录本火山图:显著富集的转录本(每组(N=3)个生物学重复,两次独立实验,(p<0.05),DESeq2分析)。
(D) 代表性转录本的IGV图:Myh9、Jun mRNA在DMSO条件下富集,福斯高林处理后被隔离;伪基因Obox-ps27在福斯高林条件下显著富集。
(E) qPCR验证:柱状图显示福斯高林处理后指定基因(Myh9、Jun、Obox-ps27等)的相对富集变化(每组(N=5)个神经元,配对学生t检验,(*p<0.05),(p<0.01)。
(F) cAMP诱导Gas5相互作用组动态变化示意图:cAMP信号触发Gas5与RNA/蛋白质相互作用的重构。
(G) Gas5调控网络模型:lncRNA(红色)、假基因(蓝色)、mRNA(黑色)、miRNA(绿色)、Gas5调节因子(紫色)的相互作用关系。
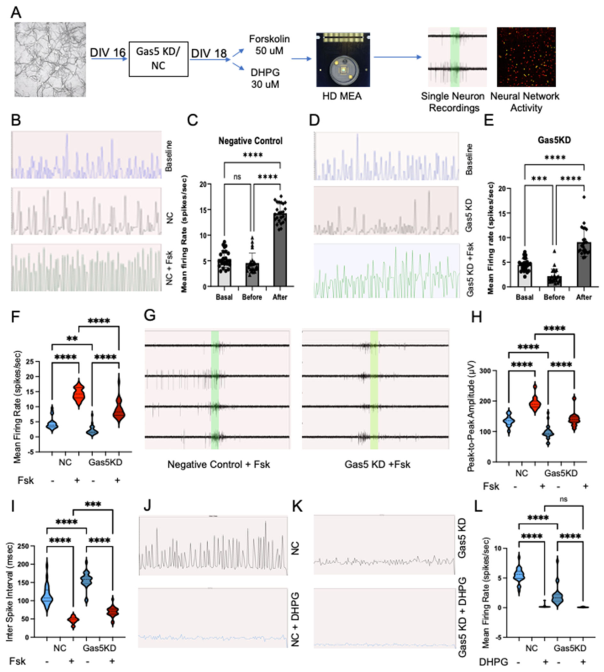
¶ 图7: Gas5介导cAMP而非mGluR1/5依赖的突触传递变化
(A) 实验范式示意图:DIV 16神经元转染Gas5 gapmer或对照,48小时后用福斯高林/DHPG/DMSO处理,通过HD-MEA记录突触活动。
(B-E) 福斯高林对神经元放电的影响:代表性趋势图(B、D)显示对照/Gas5敲低神经元的平均放电频率(MFR,单位:spikes/秒);柱状图(C、E)量化MFR(每组(N=23-24)个神经元,三次独立实验,混合模型方差分析+Tukey检验,(*p<0.05),(***p<0.001))。
(F) MFR小提琴图:Gas5敲低显著降低福斯高林诱导的放电频率升高(混合模型方差分析+Tukey检验,(p<0.01,(***p<0.001))。
(G) 放电振幅原始轨迹:4个神经元的代表性轨迹显示福斯高林诱导的响应强度(≥±500μV)。
(H-I) 放电振幅与间隔量化:小提琴图显示Gas5敲低组的峰值振幅显著降低(H)、不应期显著延长(I)(每组(N=23-24)个神经元,混合模型方差分析+Tukey检验,(p<0.01,(****p<0.001))。
(J-L) DHPG对神经元放电的影响:代表性趋势图(J、K)显示DHPG处理后放电活动几乎消失;小提琴图(L)量化MFR,两组对DHPG的响应无显著差异(每组(N=23-24)个神经元,混合模型方差分析+Tukey检验,(***p<0.001);ns:无显著性)。
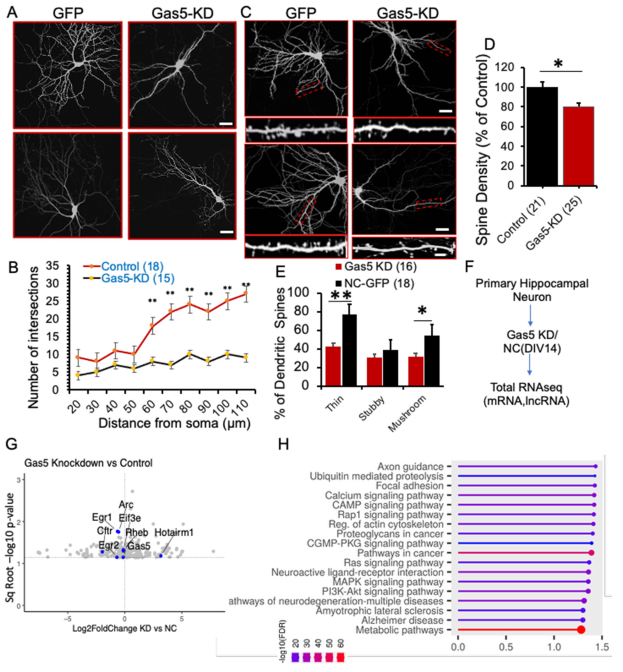
¶ 图8: Gas5功能缺失损害树突分枝和树突棘密度
(A-B) 树突分枝分析:代表性共聚焦最大强度投影图像(A,比例尺:30μm);Sholl分析量化三级树突分枝数量(60-110μm),Gas5敲低组显著减少(B,每组(N=15-18)个神经元,三次独立实验,非配对学生t检验,(p<0.01)。
(C-E) 树突棘形态分析:代表性共聚焦图像(C,红色矩形标注分析区域,全图标尺:30μm,插图标尺:2μm);Gas5敲低组树突棘密度显著降低(D),细小型、蘑菇型树突棘占比显著减少(E)(每组(N=16-25)个神经元,三次独立实验,配对/非配对学生t检验,(*p<0.05),(p<0.01)。
(F) Gas5敲低后总RNA-seq实验示意图:DIV 14神经元转染gapmer或对照,72小时后测序。
(G) 差异表达基因火山图:DESeq2鉴定的显著差异基因((padj<0.05),四组独立实验,每组(N=4)个培养孔),包括下调的即刻早期基因(Arc、Egr1/2)和翻译因子(Eif3e)。
(H) 差异基因GO分析(生物过程):节点大小代表基因数量,颜色梯度表示(-log_{10}FDR),主要涉及轴突导向、cAMP信号、神经退行性疾病相关通路。