¶ 唐氏综合征脑类器官中的脉络丛缺陷增强 SARS-CoV-2 的神经嗜性
¶ Choroid plexus defects in Down syndrome brain organoids enhance neurotropism of SARS-CoV-2
原文下载:2023.06.12.544552.full_类脑.pdf
穆罕默德·R·沙克尔 、安德烈·斯隆查克3†、巴哈·阿尔姆哈纳维1、肖恩·D·莫里森1、朱利安·D·J·桑3、贾斯汀·库珀-怀特1,2,4、亚历山大·A·赫罗米赫、厄恩斯特·J·沃尔维唐‡ t
1澳大利亚昆士兰大学生物工程与纳米技术研究所,布里斯班昆士兰州 。
2昆士兰大学干细胞工程与再生工程中心(UQ StemCARE),布里斯班昆士兰州 。
3昆士兰大学化学与分子生物科学学院,圣卢西亚校区,布里斯班昆士兰州 。
4昆士兰大学化学工程学院,布里斯班昆士兰州 。5全球病毒网络卓越中心,澳大利亚传染病研究中心,布里斯班昆士兰州。
*通讯作者。邮箱:m.shaker@uq.edu.au (M.R.S.);e.wolvetang@uq.edu.au (E.J.W.)†这些作者对这项工作贡献均等。‡这些作者对这项工作贡献均等。
为何唐氏综合征(DS)患者更易感染SARS-CoV-2诱导的神经病理改变,其机制尚不明确。脉络丛(ChP)在屏障功能和免疫调节中起关键作用,同时表达ACE2受体和染色体21编码的TMPRSS2蛋白酶,这提示其在建立脑内SARS-CoV-2感染过程中具有重要作用。为探究该机制,我们利用DS患者及同基因二倍体iPSC构建了脑类器官(ChPCOs),该模型由功能性皮质神经元核心与功能性脉络丛样上皮外围构成。DS-ChPCOs重现了DS异常的皮质发育过程,并揭示脉络丛样上皮在纤毛发生和上皮细胞极性方面的缺陷。研究进一步证明,脉络丛样上皮会促进SARS-CoV-2在皮质神经元中的感染与复制,且该现象在DS模型中更为显著。抑制TMPRSS2和弗林蛋白酶活性可使DS-ChPCOs中的病毒复制降至二倍体水平。该模型为解析脉络丛在嗜神经病毒感染及二倍体前脑发育中的作用提供了平台,并为筛选治疗SARS-CoV-2诱导的神经病理改变的药物创造了条件。
¶ 引言
脉络丛(ChP)是一种高度血管化的分泌组织,位于脊椎动物大脑的各个脑室内(1)。在成人大脑中,ChP通过每日产生高达 的脑脊液(CSF)来支撑中枢神经系统(CNS),同时阻止免疫细胞浸润至CNS(1);在发育过程中,它还能产生多种信号因子,协调皮层发育和神经发生。早期发育阶段,侧脑室(LV)ChP(LVChP)原基与直接相邻的重要脑组织中心——500 毫升 K+,ll)(II)皮质缘共同特化,两者皆能分泌并对形态发生素(如Notch、WNT和骨形态发生蛋白(BMP))产生响应(2)。这种发育路径确保ChP始终与大脑皮层紧密相邻,且这种解剖学上的毗邻关系终身保持(3)。人类侧脑室、第三脑室和第四脑室中的ChP具有转录异质性,其中第四脑室ChP似乎比其他ChP更早完成分化(4)。通过获取紧密连接、离子通道(如 电压门控通道)和转运蛋白,人类ChP在发育2周后即具备屏障、分泌和运输功能,这些组件会随发育过程动态变化(5)。迄今哺乳动物ChP发育研究主要基于动物模型(6–8),这些发育过程在人类中的保守程度仍不明确。人诱导多能干细胞(hiPSC)衍生的三维(3D)模型为探究ChP在发育及神经退行性疾病中的作用提供了新途径。为模拟人类ChP,研究者已开发出多种3D类器官模型,可从人胚胎干细胞(hESC)起始在体外生成ChP样结构(9, 10)。这两种ChP类器官模型均随时间推移逐渐成熟,变得与成人ChP组织愈发相似。Pellegrini等开发的模型(9)报道在第46天存在神经祖细胞和神经元,但与端脑类器官相反,这些细胞随ChP类器官成熟逐渐减少。这些模型对研究SARS-CoV-2感染对人脑的影响至关重要:研究证明SARS-CoV-2可有效感染并损伤ChP上皮,导致血脑屏障泄漏,感染SARS-CoV-2的ChP类器官表现出细胞死亡增加和炎症基因上调 唐氏综合征(DS)是一种基因组疾病,发病率为每700至1000名活产婴儿中约有1例(12),其病因是存在额外的21号染色体(HSA21)。HSA21的额外拷贝(21三体)会导致神经病理学改变,包括皮质层状结构紊乱(13)、小脑组织与功能改变(14)以及海马齿状回细胞减少(15)。DS大脑皮层还表现出兴奋性神经元减少(16)、星形胶质细胞和抑制性神经元生成增加(17),以及少突胶质细胞分化和髓鞘形成缺陷(18)。发育中的DS大脑及DS小鼠模型(19)进一步显示脑室扩大,这与涉及纤毛功能的HSA21基因PCNT和PCP4剂量增加有关,此前已有研究报道人类DS成纤维细胞存在纤毛缺陷(20)。既往研究发现,源自DS诱导多能干细胞的大脑类器官可重现DS大脑发育异常的多个方面(21),包括皮质神经元生成缺陷(22)和阿尔茨海默病(AD)样病理改变(23)。累积临床证据表明,与二倍体人群相比,DS患者感染SARS-CoV-2后住院风险增加4倍、死亡风险增加10倍(24, 25),这无法完全用合并症解释。据推测,COVID-19病理易感性增加的部分原因可能是HSA21染色体上干扰素(IFN)通路基因的剂量增加引发过度干扰素反应,另一部分原因可能是全身免疫系统功能缺陷(26, 27)——此前研究已发现该缺陷与DS患者细菌和病毒感染风险增加相关(28–30)。跨膜丝氨酸蛋白酶2(TMPRSS2)的基因剂量增加可能也起到作用,该HSA21基因编码的蛋白酶可促进SARS-CoV-2刺突蛋白与血管紧张素转换酶2(ACE2)受体相互作用(31)。学界日益认识到SARS-CoV-2的嗜神经性可能是长期认知和感觉障碍(新冠长期症状)的驱动因素(32)。然而,由于DS患者本身存在一系列进行性、个体间差异极大的认知缺陷,且早发性阿尔茨海默样疾病风险显著升高,这种长术语SARS-CoV-2感染对唐氏综合征患者认知功能的影响难以量化。此外,SARS-CoV-2从母体垂直传播至胎儿对脑发育的干扰程度尚待确定,且这种影响是否会对唐氏综合征患者的脑发育造成更严重损害仍需进一步研究。
在此,我们报道了人类皮质脑类器官的生成,这些类器官不仅被功能性脉络丛样上皮包围,还包含发育中的皮质细胞类型(ChPCOs)。研究表明,这些ChPCOs表现出唐氏综合征(DS)的典型神经病理变化,如少突胶质前体细胞减少。我们进一步发现DS ChPCOs存在纤毛发生异常和脉络丛样上皮极性缺陷。引人注目的是,ChPCOs的脉络丛样上皮结构会显著促进SARS-CoV-2的神经侵袭和神经嗜性,且在DS中这种作用更为突出。我们还证实,使用美国食品药品监督管理局批准的TMPRSS2抑制剂、弗林蛋白酶抑制剂及瑞德西韦进行治疗,可将DS类器官中的SARS-CoV-2复制水平降至与整倍体组相当,提示DS脉络丛样上皮中TMPRSS2基因剂量增加可能参与其中,同时表明ChPCOs是筛选可减轻SARS-CoV-2对成熟及发育中中枢神经系统影响药物的理想模型。
¶ 结果
¶ 脉络丛类器官的自组装重现了胚胎发育过程
人神经外胚层(hNEct)细胞具有定向发育为前体组织的能力(33),其背侧注定形成皮层,腹侧形成皮层隔膜,后者随后分化为脉络丛。因此,我们推测hNEct细胞可作为生成自组织皮层类器官(COs)的理想起始群体,这类类器官将被源自脉络丛样上皮的心室结构所包绕(此处称为ChPCOs)。通过使用SB和LDN对人ES和iPSC细胞系(图S1A)(包括H9(34)、WTC(35)和G22(35))进行双重SMAD抑制处理3天,我们高效获得了能产生神经干细胞的hNEct细胞,这些干细胞具有SOX2和NESTIN表达特征(图S1B)。随后将hNEct细胞悬浮培养于超低吸附六孔板中,在添加碱性成纤维细胞生长因子(bFGF)的N2培养基内形成3D聚集体,最终形成具有神经上皮层的球体(图1A,第7天),其中心存在多个表达SOX2的玫瑰花结结构(图S1C)。为模拟体内皮层隔膜通过分泌BMP4和WNT信号引导背侧皮层隔膜分化为脉络丛的过程(36),我们用BMP4和CHIR99021处理这些球体以促进脉络丛形成(图1A和图S1C)。鉴于BMP4信号强度已知会以牺牲神经谱系为代价促进脉络丛谱系分化(9,10),我们在ChPCO方案的最初4天内让hNEct细胞接触梯度浓度的BMP4。低剂量BMP4以由外向内方式降低了早期类器官中SOX2阳性细胞比例,该浓度被确定为最佳条件(图S1D),而提高BMP4剂量则如预期般进一步减少了SOX2阳性细胞(图S1D)。通过定量聚合酶链反应(qPCR)对皮层隔膜标志基因(MSX1/2)和脉络丛基因(AQP1、TTR和KLOTHO)mRNA水平进行量化显示,经21天CHIR99021和BMP4处理后MSX1/2表达显著诱导,但在第28至84天期间急剧下降(图1C),提示皮层隔膜被成功诱导。与此一致,类器官切片显示第14天时折叠上皮细胞中共表达皮层隔膜标志蛋白MSX1/2和LMX1A(图1D)。在第21-28天期间,我们观察到类器官周围出现薄层上皮结构(图1A),qPCR检测到脉络丛标志物AQP1、TTR和KLOTHO同步上调(图1C)。免疫染色证实这些上皮层表达确定性脉络丛标志蛋白TTR和LMX1A(图1D)。类器官体积在前28天逐渐增大(图1B),核心平均直径达到(图1B),第56和120天时最终直径分别为(图1B)。高分辨率3D成像显示单个类器官可产生多个脉络丛样上皮结构,通过紧密连接标志物ZO1可见完整的上皮包被(图1E)。这些细胞还强效表达KLOTHO(一种已知在小鼠脉络丛中表达的抗衰老蛋白)(34),证实KLOTHO在脉络丛样上皮中的表达具有进化保守性,提示可用这些人源脉络丛类器官研究该蛋白在细胞中的功能。为验证该系统的可重复性,我们使用不同hiPSC细胞系生成ChPCOs(图S2A-B),发现超过(比例)的类器官均呈现典型薄层上皮包被特征,且不受细胞系、克隆或批次影响(图S2C)。我们还发现这些类器官能长期存活(目前已在体外培养1年)且无退化迹象。综上所述,我们的研究证明该方案重现了皮层隔膜模式化和脉络丛样上皮形成的体内发育过程,并建立了快速生成具有脉络丛样上皮包被的人脑类器官的标准化方案。
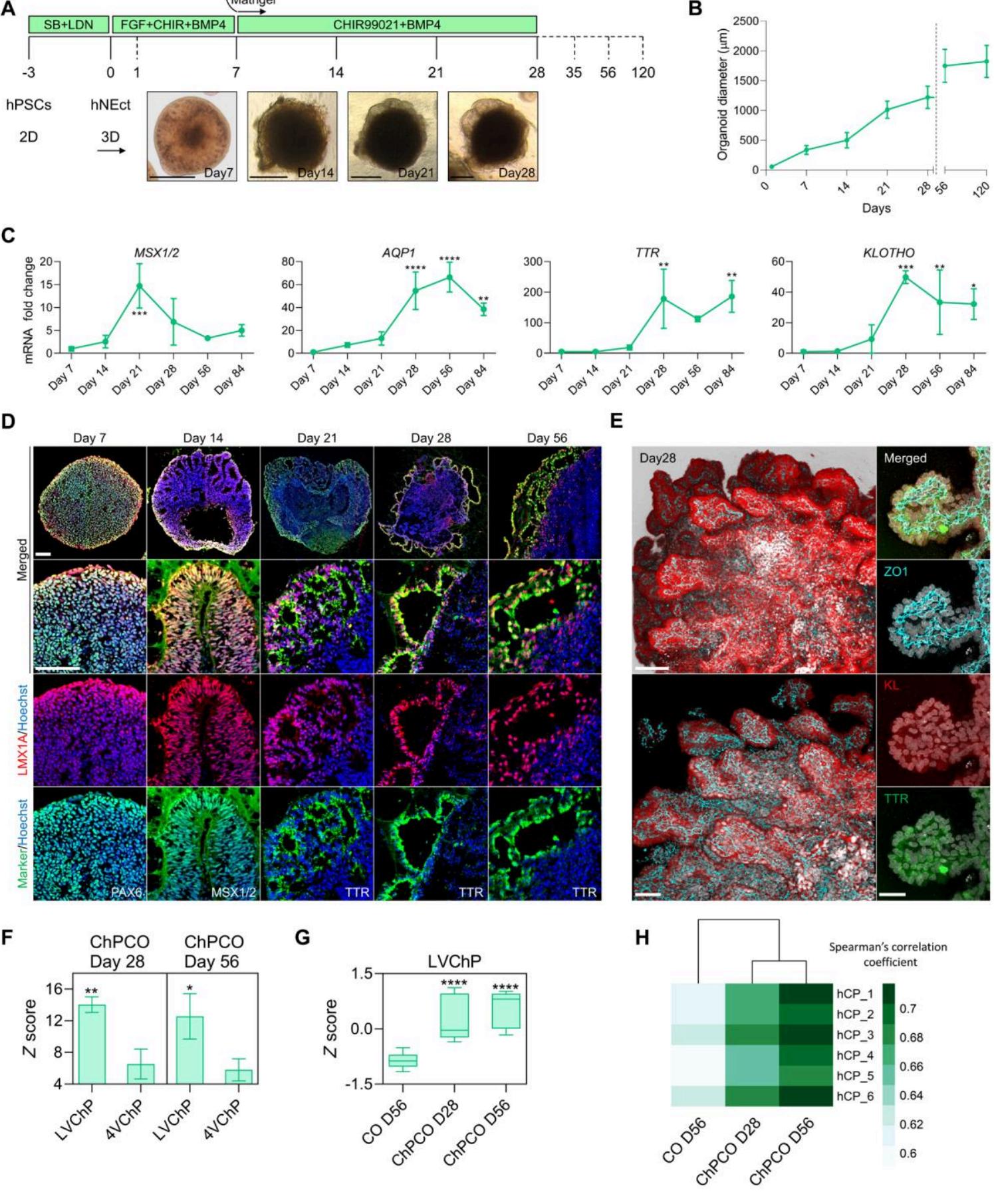
图1. 从神经外胚层生成人类自组织多ChPCOs的3D过程。(A) 从hPSCs生成ChPCOs的策略示意图。下方明场图像显示ChPCO在体外随时间的发展阶段。比例尺, 。(B) 显示体外生长 的图表。数据以均值 表示;总器官样结构 总结在表S8中。© MSX1/2、 、TTR和KLOTHO的qRT-PCR分析。数值归一化到GAPDH水平,并相对于第7天的值表达。数据为均值 ,通过单因素方差分析(ANOVA)。(D) 切片器官样结构的免疫染色显示PAX6(绿色)、LMX1A(红色)、MSX1/2(绿色)、LMX1A(红色)、TTR(绿色)和LMX1A(红色)的蛋白表达,并用Hoechst 33342(蓝色)复染。比例尺, 。(E) 分化第42天ChPCO的整体免疫染色。左侧图像显示多个ChPCO 500μ微米。ChPCO ±标准差 13 156 AQP 1 ±标准差; 4. ∗P < 0.05 ∗∗P < 0.01 ∗ ∗ ∗P < 0.001 ∗∗∗∗∗P < 0.0001 72μ微米
如图显示KLOTH O(红色)和ZO1(青色)染色的类上皮组织,比例尺为。右侧图像为ZO1(青色)、KLOTH O(红色)和TT R(绿色)三重染色的单个脉络丛样上皮组织的110μ米。100× 30μ米 ±标差。P <∗ 0.05 P <∗∗ 0.01放大视图,比例尺为。(F)基于批量RNA-seq数据,展示LVC hP与4VC hP基因分布情况的每列平均z值分布图(三组重复合并数据)。数据以均值±标准差表示,采用学生t检∗ ∗ ∗ ∗ P < 0.0001验进行统计分析。(G)箱形图显示通过脉络丛类器官与大脑类器官批量RNA-seq获得的LVC hP标志基因分布。数据以最小值至最大值呈现,采用单因素方差分析进行统计。所用具体基因参见图S2E。(H)热图对比脉络丛类器官、大脑类器官的批量RNA-seq与44-70岁捐赠者成人脉络丛样本的斯皮尔曼相关系数(104)。
我们接下来将第28天和第56天的脉络丛类器官(ChPCOs)与(未经BMP4和CHIR99021处理的)大脑类器官(COs)进行了批量RNA转录组比较。结果显示,第28天和第56天ChPCOs中皮质缘和脉络丛标志物的表达总体随时间增加,表明脉络丛样上皮的发育在体外培养28天后仍在持续进展,且其表达水平显著高于第56天的COs(图S2D)。这些数据与我们观察到的现象一致:第56天ChPCOs中的脉络丛样上皮由薄层褶皱上皮构成,并延伸出表达脉络丛标志物及LMX1A+的立方上皮细胞(图1D),这种特征在人类胎儿脉络丛上皮中亦有发现(1)。在体内环境中,BMP与音猬因子(SHH)的浓度梯度沿神经管背轴分别塑造侧脑室脉络丛(LVChP)与第四脑室脉络丛(4VChP),从而形成(TTR+具有独特转录组特征的脉络丛组织(37)。在第28天与第56天,我们的ChPCOs显示出与LVChP而非4VChP相关基因的显著富集(图1F和图S2E),这与实验方案中使用BMP4而未添加SHH的处理方式相符,且这些基因在ChPCOs中的表达水平再次高于第56天的COs(图1G)。在全转录组层面,ChPCOs(而非COs)与成人脉络丛组织呈现高度相关性(图1H和图S2F),这与已发表的脉络丛类器官模型研究结果一致(9, 10)。
¶ ChPCOs中类ChP上皮的渐进式成熟
为确定这些脉络丛类器官(ChPCOs)中自组织形成的类脉络丛上皮层是否具备与体内脉络丛相似的特性,我们后续检测了上皮极性建立、线粒体丰度、纤毛发生及脑脊液分泌情况(38)。我们首先评估了类脉络丛上皮中由紧密连接、缝隙连接、粘附连接和基底膜调控的上皮极性建立(图2A)。与其他脉络丛类器官模型一致(9),批量RNA测序数据显示,与普通类器官(COs)相比,ChPCOs中与这些结构相关的基因随时间推移呈现渐进性富集(图2B、C和图S3A)。qPCR分析显示选定紧密连接基因(如CLDN11和CLDN12)逐渐增加(图S3B),尽管CLDN2仅在28天时显著上升(图2D)。类似地,缝隙连接基因GJB2与粘附连接基因CDH5、PCDH18的mRNA水平也逐步升高(图2D和图S3B),这与紧密连接标志物ZO1在类脉络丛上皮层中广泛连续的表达模式相符(图S3C)。紧密连接的建立对脉络丛分化为特定基底组分至关重要(39),因此我们检测了ChPCOs的类脉络丛上皮细胞是否呈现对正常脉络丛上皮细胞功能关键的膜蛋白顶基底极性。通过分别标记在极化类脉络丛上皮顶侧和基底侧富集的ZO1与层粘连蛋白,揭示了基底膜的正确形成与顶极极性(图2F)。我们推断,ChPCOs中类脉络丛上皮极性的建立——作为脉络丛稳态、脑脊液分泌、神经营养因子运输及屏障功能的基础——表明该类上皮具备产生脑脊液和形成有效屏障的潜力。RNA-seq分析证实,与56天的COs相比,28天ChPCOs中编码脉络丛分泌蛋白的基因显著富集(图2G),且其表达量随ChPCOs发育进一步大幅提升(图2G,56天ChPCOs)。我们检测到已知在脑脊液中分泌并能刺激室管膜神经干细胞增殖的生长因子IGF2(40)、参与血液蛋白摄取与向脑脊液递送的细胞外基质基因(如SPARC)(41),以及多种参与脑脊液生成与分泌的酶类、分泌蛋白和膜蛋白的表达(图2H)。与既往研究一致(9),染色显示参与脑脊液分泌的水通道蛋白AQP1在28天ChPCOs的类脉络丛上皮中呈现正确的顶膜定位(图2I)。我们随后采用多重酶联免疫吸附测定法分析培养液中ChPCOs的分泌组,发现相较于COs,ChPCOs的CST3和B2M分泌显著增加(图2J),这与脉络丛类器官分泌人脑脊液蛋白的能力相符(9)。然而,ChPCOs与COs的APP分泌量并无显著差异(图2J)。
脉络丛(ChP)中的初级纤毛对于调节脑脊液(CSF)的流动和运输至关重要,可根据其长度、运动性和每个细胞的纤毛数量进行表征(42)。在体内,脉络丛主要由多纤毛的上皮细胞组成,每簇纤毛数量为4至8根,但也包含一小部分与化学和/或渗透感受相关的脉络丛细胞,这些细胞会向脑脊液中伸出一根初级纤毛(43)。这些细胞类型在人类胚胎中如何及何时特化仍不清楚。由于脉络丛类器官(ChPCOs)的生成过程高度模拟了体内正常脉络丛发育的渐进性时间形态发生序列(图1),且透射电子显微镜(TEM)在脉络丛类器官外围识别出微绒毛结构(图2E),我们检测了培养14、21、28和56天的人类脉络丛类器官的纤毛发生过程。批量RNA-seq数据证实,与对照组类器官(COs)相比,脉络丛类器官中纤毛相关基因呈现显著且逐渐富集的趋势(图3A)。使用ARL13B抗体对纤毛进行免疫染色表明,脉络丛类器官中的人类脉络丛样上皮细胞具有纤毛结构(图3B),且纤毛长度随时间显著增加,在第14、21、28和56天的平均长度分别为0.7、1.6、2.3和{值}微米(图3C)。第14天时,发育中的脉络丛含有几乎等量的单纤毛与多纤毛甲状腺素运载蛋白(TTR)表达细胞,随后多纤毛细胞逐步增加至第21天的{百分比}、第28天的{百分比}及第56天的{百分比},同时单纤毛脉络丛样上皮细胞相应减少(图3D)。据报道,哺乳动物脉络丛样上皮细胞的纤毛数量存在差异,大鼠为每细胞4-8根,蝾螈可达每细胞50根(1)。我们的数据显示,在培养第14天至第56天期间,人类脉络丛类器官中脉络丛样上皮细胞的单细胞纤毛数量呈现明显变化,最终有{百分比}的脉络丛样上皮细胞每细胞携带5至9根纤毛(图3E)。批量RNA-seq数据显示,与纤毛回收相关基因随时3μ米 66% 82% 95.4% >50%间未发生显著改变(图S3E)。这些发现共同表明,自组装的脉络丛类器官重现了体内脉络丛纤毛发生的关键特征,提示脉络丛类器官或可为研究唐氏综合征(19)和Bardet-Biedl综合征(44)等疾病提供有效模型——这些疾病中初级纤毛功能缺陷被认为分别导致脑室扩大和脑积水。
¶ 皮质组织中出现特殊功能性细胞区室
除上述脉络丛组分外,ChPCO类器官还具备其他神经区室。在胚胎发育过程中,NEct来源的头端神经管背侧形成端脑背内侧的脉络丛和皮质板(33)。我们通过检测已知在COs中表达的不同皮质神经元标志物,探究这些皮质板层的关键细胞区室是否与脉络丛样上皮细胞同步出现于类器官中(图4A)。发现PAX6 mRNA随时间推移逐渐减少(图4B)同时分别通过TBR1、CTIP2、SATB2和CUX1/2的表达检测到第VI、V、IV及II/III层神经元标志物相应增加(图4B)。对中线切面类器官进行这些神经元蛋白染色,结果显示在第28天即可观察到皮质 与 神经元的分化(图4C和图S4A),而 与 神经元直到类器官成熟第56天才被检测到(图4C)。皮质层特化发生在脉络丛样上皮细胞形成的脑室样结构邻近区域(图4C和图S4A)。在分化第56天的ChPCOs和COs中,也观察到胶质纤维酸性蛋白(GFAP)标记的星形胶质细胞特化(图4D),但第28天的ChPCOs中未见该现TBR1+象(图S4C),这与星形胶质细胞生成约始于第50天的观点相符(45)。此外,我们在第56天检测到PDGFRA和CNPase标记的少突胶质细胞(图S3D),并在第150天的成熟类CTIP2+ SATB2+ CUX1+器官中观察到髓鞘碱性蛋白(MBP)与神经丝蛋白共定位(图4E),提示髓鞘形成开始。为进一步解析ChPCO模型的空间结构,我们对第28天(图4F、G)和第56天(图4H)的ChPCOs连续切片进行SOX2、DCX、TBR2和SATB2染色,分别标记神经祖细胞、早期特化神经元祖细胞、深层中间神经祖细胞以及表层皮质神经元层。分别如图4 F至H所示。我们发现部分细胞更靠近脉络丛样组织表面,而其他细胞则位于内部且远离脉络丛样组织(图4 F至I)。同样地,在脉络丛类器官中,皮质神经元遍布SOX2+整个皮质组织(图4 G至I)。
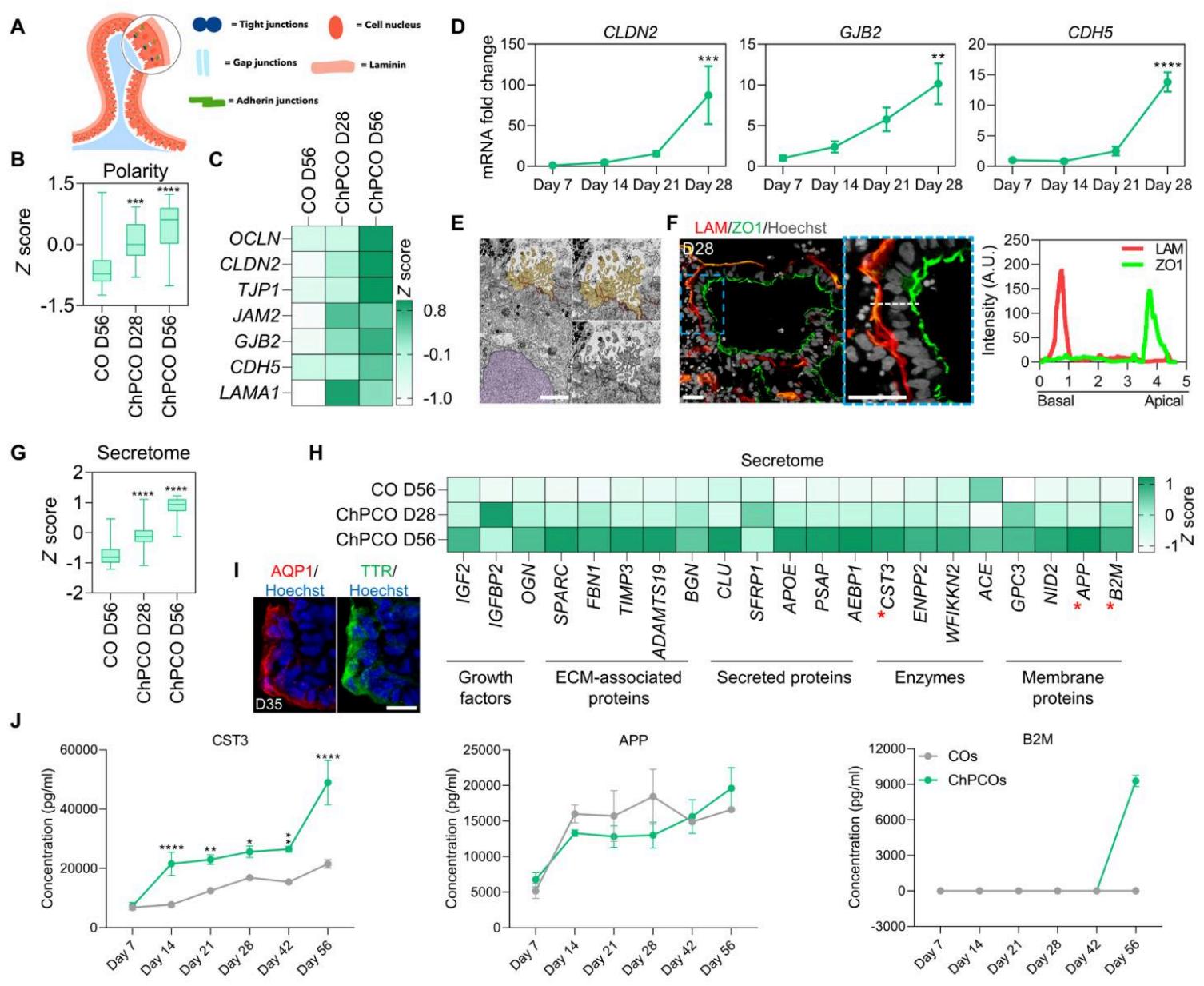
图2. 脉络丛类器官中脉络丛样上皮的发育与功能分析。(A) 脉络丛顶基底极性示意图。(B) 显示通过批量RNA-seq获得的极性基因[列于©和图S3A]分布的箱形图。数据范围为最小值至最大值。通过单因素方差分析。© 批量RNA-seq中代表性顶基底极性基因的热图。数值以z分数显示。(D) 脉络丛类器官中顶基底极性基因的qRT-PCR分析。所有数值均∗ ∗ ∗P < 0.001 ∗ ∗ ∗ ∗ P < 0.0001 ±标准差以GAPDH为内参进行标准化,并相对于第7天数值表示。数据表示为平均值。通过单因素方差分析。(E) 第28天脉络丛类器官的透射电镜图像,显示高密度线粒体、顶侧紧密连∗ ∗ P < 0.01 ∗ ∗ ∗P < 0.001 ∗ ∗ ∗ ∗ P < 0.0001 N = 3 250nm 20μm ∗ ∗ ∗ ∗ P < 0.0001 20μm ±标准差 N = 3 ∗P < 0.05 ∗ ∗ P < 0.01 ∗ ∗ ∗ ∗ P <接、微绒毛(浅棕色)和细胞核(浅紫色)。比例尺:。(F) 脉络丛类器官切片经层粘连蛋白(红色)和ZO1蛋白(绿色)染色,并用Hoechst 33342复染。比例尺:。白色虚线0.0001表示图表中绘制的脉络丛样上皮顶基底方向上层粘连蛋白和ZO1表达的平均强度。(G) 显示通过批量RNA-seq获得的脑脊液分泌组基因[列于(H)]分布的箱形图。数据呈现为最小值至最大值。通过单因素方差分析。(H) 批量RNA-seq获得的脑脊液分泌组基因热图。数值为z分数。红色星号代表(J)中ELISA实验所选基因。(I) 脉络丛类器官切片在脉络丛样上皮中用水通道蛋白1(AQP1,红色)和TTR(绿色)进行免疫染色,并用Hoechst 33342复染。比例尺:。(J) Luminex多重检测/ELISA显示脉络丛类器官培养基中的脑脊液分泌组蛋白标志物。数据表示为平均值;通过单因素方差分析。
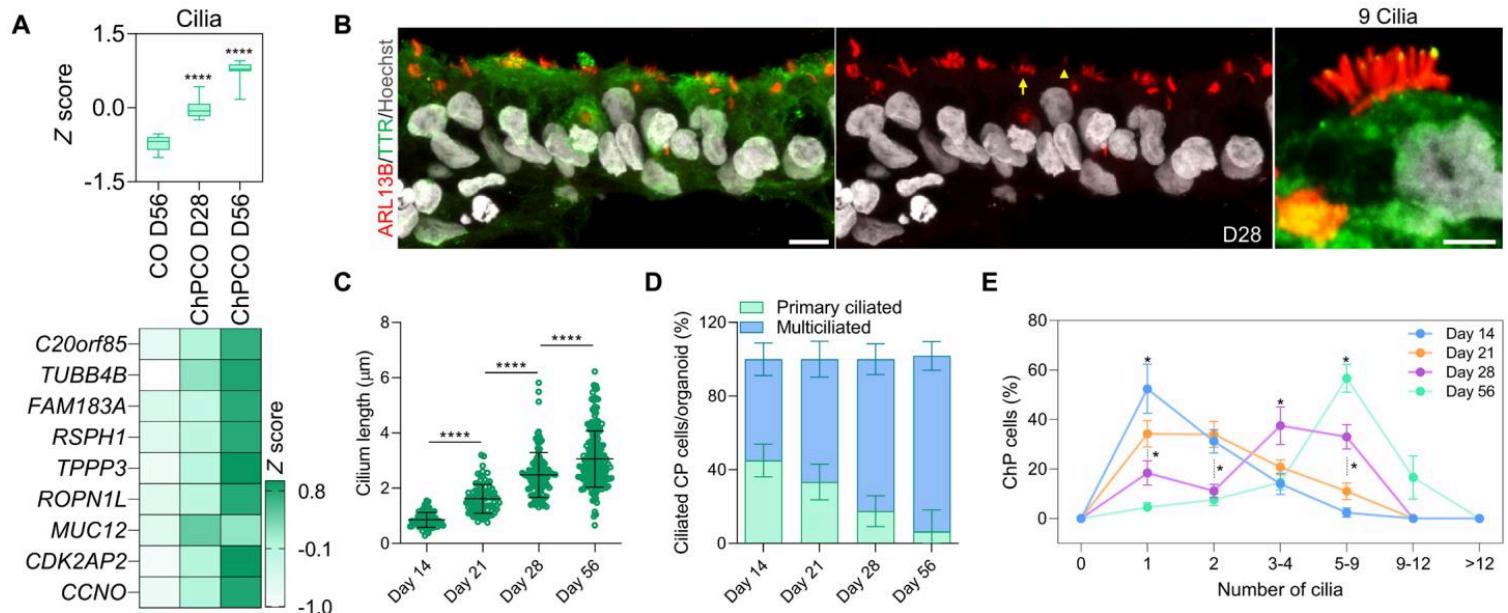
图3. 脉络丛样上皮纤毛发生的发育与功能分析。(A) 箱形图显示第28天和第56天ChPCOs以及第56天COs的批量RNA-seq获得的纤毛相关标记基因(热图下方列出)分布。数据以最小值至最大值呈现,缺口以中位数为中心。通过单因素方差分析进行统计。下方热图显示纤毛相关标记基因表达量,数值以得分表示。(B) 第28天免疫染色ChPCO切片分析,显示脉络丛样上皮(以TTR绿色标记)纤毛中ARL13B(红色)蛋白表达。切片用Hoechst 33342复染。比例尺为,放大图比例尺为。黄色箭头指示多纤毛细胞;黄色箭头指示单纤毛细胞。© 分化第1、21、28和56天ChPCOs纤毛长度量化。数据以均值±SEM呈现;通过单因素方差分析进行统计。独立实验次数为。每个点代表单个纤毛长度。(D) 堆叠条形图显示分化第7、21、28和56天ChPCOs中人脉络丛样上皮细胞中单纤毛与多纤毛细胞百分比。数据以均值±SEM呈现。独立实验次数为。(E) 培养第14、21、28和56天ChPCOs纤毛数量分布。数据以具有单根初级纤毛或多纤毛的脉络丛细胞百分比呈现。每个时间点最少分析数量为。总实验次数16;总分析类器官数量为。数据以均值±SEM呈现,Kolmogorov-Smirnov检验。各时间点分析的类器官数量和实验次数总结见表S8。
为了评估皮层神经元的功能特性,我们首先确认成熟神经元分别表达突触前标记物SYT1和突触后标记物HOMER1,且二者相邻分布(图5A),以此作为突触接触的形态学证据。随后,我们使用高密度多电极阵列(MEA)对关键电生理参数进行表征(图5B)。MEA分析检测到从第28天开始,ChIPCOs中出现自发电活动(第56天的轨迹示例见图5B)。随着时间推移,神经元自发放电率逐渐增加(图5C至F)。值得注意的是,在第56天放电率显著增加,此时在ChIPCOs中观察到GFAP⁺细胞(图4D)。然而,与CoGs相比,ChIPCOs在第56天的爆发率未显著增加(图5D)。我们推测这种差异可能是由于这两种类器官中存在的神经元亚型比例不同所致。我们注意到,56天的ChIPCOs包含谷氨酸能(GLUR3⁺)和γ-氨基丁酸能(GABA⁺)神经元,且二者彼此相邻(图5G),这与体内皮层发育过程中GABA能抑制性神经元的分化情况一致。用GABA受体激动剂巴氯芬(50μM)处理后,ChIPCOs的放电率显著增加(图5H和图S4E),证实存在抑制性突触传递;而急性谷氨酸(200μM)和N₆-甲基-d-天冬氨酸(NMDA)(50μM)处理则显著提高了放电率(图5H和图S4E),表明存在有活性的谷氨酸能和GABA能神经元。综上,这些数据表明,在第56天的ChIPCOs中,已很好地建立了具有兴奋性和抑制性神经环路的神经网络。
¶ 唐氏综合征脉络丛类器官重现了唐氏综合征脑部病理的关键方面。
唐氏综合征由21号染色体三体引起,导致发育迟缓和智力缺陷(47)。人类发育中的DS大脑和Ts65Dn DS小鼠模型均进一步显示出少突胶质细胞分化和髓鞘形成缺陷(18)。此外,21三体成纤维细胞表现出纤毛形成和功能减少(20),使得DS大脑成为在ChPCO中建模的特别有趣的病理模型。因此,我们利用源自DS患者(DS18)的iPSC系及其同基因二倍体对照iPSC系(EU79)生成了ChPCO类器官(48)(图6A)。DS ChPCO类器官的尺寸与二倍体类器官相当(图S5A),表明两者具有相似的生长速率。对EU79和DS18细胞系生成的至少三批不同ChPCO类器官中脉络丛样上皮和皮质组织细胞群比例的量化显示,二倍体和DS系的ChPCO均能稳定形成脉络丛样上皮和皮质组织区域,且不同批次间细胞比例相似(图6B和C)。为更详细表征同基因DS与二倍体ChPCO,我们在第28天对类器官进行RNA-seq分析(每个重复三个类器官)(图6D、图S5B和表S1)。分析显示二倍体与DS类器官呈现差异转录谱(图S5B),与同基因二倍体类器官相比,DS类器官中有962个基因表达上调,997个基因表达下调(图6D和表S1)。位于HSA21上的22个基因位列差异表达基因前500位(图S5D),其中四个基因(MX2、TMPRSS2、ADAMTS5和RUNX1)与病毒感染相关(图S5D)。DS类器官上调基因的富集分析显示多个功能类别显著富集,包括神经系统发育、纤毛运动与移动、细胞粘附及基底膜基因(图6E)。但脉络丛或分泌组相关基因未观察到变化(图S5C)。免疫印迹数据证实,与二倍体类器官相比,DS ChPCO中非基质胶组分的细胞外基质蛋白增加(图S6K)。值得注意的是,与二倍体组相比,DS类器官中离子转运相关基因显著上调(图S6J)。DS类器官显示部分n = 3 (9.7%) β纤毛发生标志物表达显著增加(图7A)。然而,ARL13B抗体对纤毛的免疫染色结果显示,56天龄DS ChPCO类器官中的脉络丛样上皮细胞主要呈单纤毛形态(图7B和C),且纤毛化脉络丛样上皮细胞数量显著少于对应二倍体ChPCO(图7D),尽管两组平均纤毛长度相当(图S6F)。出乎意料的是,我们还检测到DS类器官中顶端-基底极性标志基因β(图S6A)和蛋白(图S6C)的显著改变。为深入探究细胞极性缺陷,对二倍体和DS类器官进行ZO1、E-钙黏蛋白(与上皮细胞顶基底极性相关的蛋白)(49)以及β-连环蛋白(已知在人类脉络丛细胞膜中表达的蛋白)(50)染色(图7E和F)。在二倍体类器官中,这些蛋白按预期正确分布于脉络丛样上皮的相应区室(图7E和F)。但在DS18和G21系来源的DS类器官中,ZO1常错误定位于非顶端区域,并与β-连环蛋白在基底外侧区共定位(图7E和图S5G)。此外,DS脉络丛样上皮中的E-钙黏蛋白分布模式与二倍体组不同(图7F)。尽管E-钙黏蛋白在整倍体类脉络丛上皮细胞中,E-钙黏蛋白在最顶端区域富集并向基底外侧域延伸;而在DS组中,在更广泛的区域观察到显著的E-钙黏蛋白染色,其顶端域与ZO1重叠处呈现明显富集(图7F)。这些观察结果表明DS类器官中类脉络丛上皮的顶基极性被破坏。我们量化了类脉络丛上皮细胞基底外侧域中ZO1与β-连环蛋白的重叠百分比(49)。我们发现,在整倍体 EU79 和 G22 系的 ChPCOs 中,分别有 12.5% 和 12.25% 的脉络丛样上皮细胞中 ZO1 与基底外侧域共定位(图 7G);然而,在唐氏综合征 DS18 和 G21 系的 ChPCOs 中,分别有 74% 和 44.7% 的脉络丛样上皮细胞中 ZO1 仍与基底外侧域共定位(图 7G)。
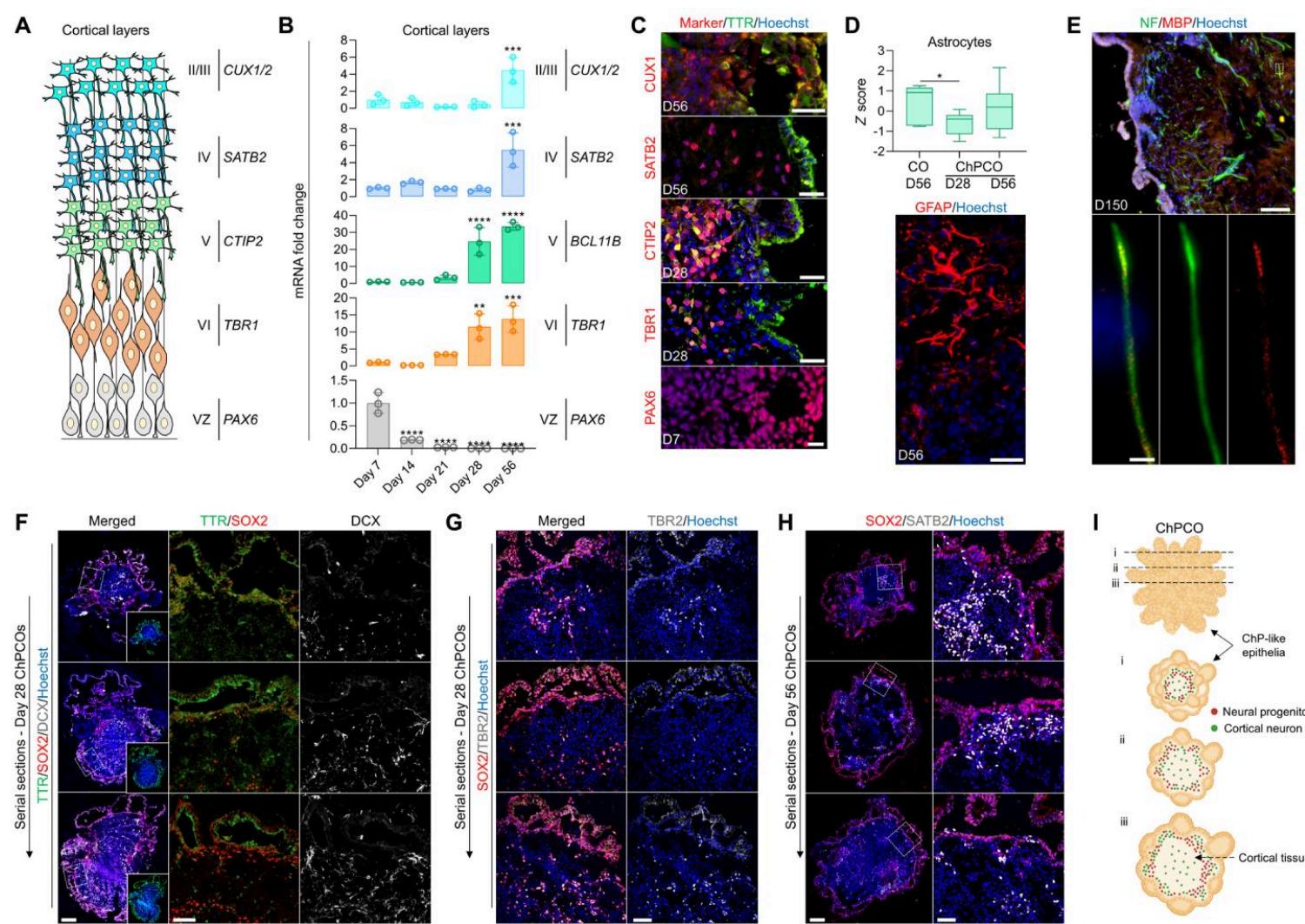
图 4. ChPCOs 含有随培养时间进展而逐渐成熟的皮层神经元(A) 皮层板层发育示意图。VZ 为脑室区。(B) 脑室区基因 PAX6 和皮层神经元层基因(TBR1、CTP2、SATB2 及 CUX1)的 qRT-PCR 分析。所有数值均以 GAPDH 为内参进行标准化,并以第 7 天的数值为参照进行相对定量。数据以均值 ± 标准差表示。* P < 0.01,*** P < 0.001。© ChPCO 切片的免疫染色,显示 PAX6(红色)、TBR1(红色)、CTP2(红色)、SATB2(红色)和 CUX1(红色),并用 Hoechst 33342 复染。比例尺:PAX6 为 10μm,TBR1、CTP2 和 SATB2 为 20μm,CUX1 为 30μm。(D) 箱线图显示从批量 RNA-seq 获得的星形胶质细胞基因(列于图 S4B)的分布。数据以最小值到最大值呈现。* P < 0.05;单因素方差分析。(E) ChPCO 切片的免疫染色,显示 ChPCO 星形胶质细胞的 GFAP(红色)染色,并用 Hoechst 33342 复染。比例尺,30μm。(F) ChPCO 连续切片的免疫染色,显示 DCX(灰色)、SOX2(红色)和 TTR(绿色)。比例尺,200μm。带点的白色方框表示放大图像,比例尺 = 50μm。(G) ChPCO 连续切片的免疫染色,显示 SATB2(灰色)和 SOX2(红色)。比例尺,200μm。带点的白色方框表示放大图像,比例尺 = 50μm。(H) 概述具有神经区室的 ChPCO 架构结构的示意图。
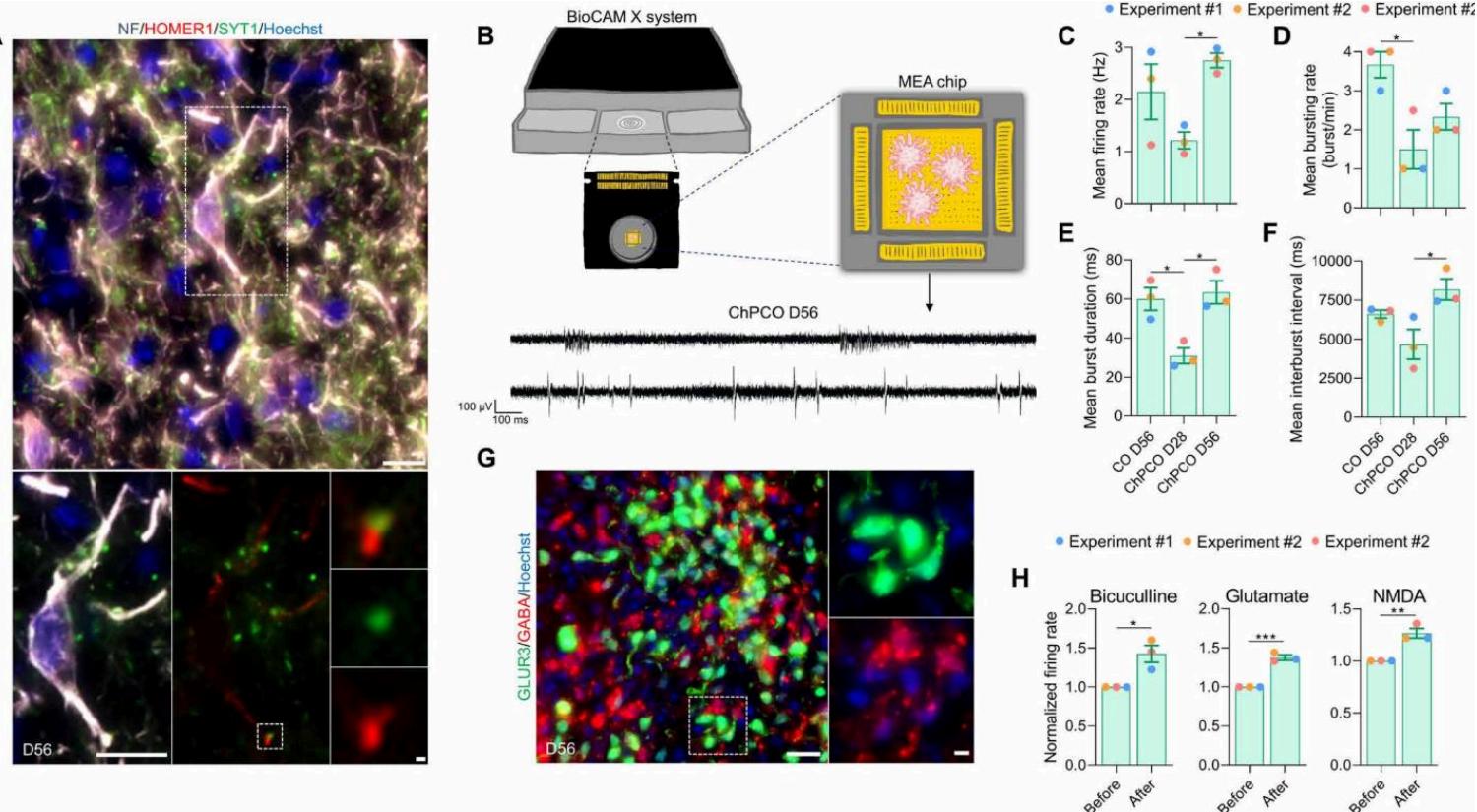
图 5. ChPCOs 中皮层神经元的功能分析(A) 第 56 天 ChPCO 切片的免疫染色分析,显示带有突触后标记物 HOMER1(红色)和突触前标记物 SYNT1(绿色)的神经元。比例尺,10μm。带点的矩形白色方框指示下方放大的神经元图像,比例尺 = 1μm。共定位的突触前和突触后标记物表明存在连接的突触。(B) 多电极阵列(MEA)上 ChPCOs 神经元活动记录的示意图。下方为第 56 天 ChPCOs 神经活动的代表性瞬态图。比例尺:水平方向 100 ms,垂直方向 100μV。(C~F) 柱状图显示与第 56 天相比,第 28 天和第 56 天神经元活动的平均放电率 ©、平均爆发率 (D)、平均爆发时程 (E) 和平均爆发间期 (F) 的变化。*P < 0.05,采用单因素方差分析。柱状图代表均值 ± 标准差。每个时间点分析的类器官数量和每个时间点的实验次数汇总于表 S8。(G) 第 56 天 ChPCOs 切片的放大图像,显示谷氨酸能(GLUR3⁺)和 γ- 氨基丁酸能(GABA⁺)神经元的免疫染色。所有图像均用 Hoechst 33342(蓝色)复染。比例尺,20μm;放大图像比例尺 = 10μm。(H) 柱状图显示药物处理前后平均放电率模式的变化。使用的药物为:50μM 谷氨酸、10μM N - 甲基 - d - 天冬氨酸(NMDA)和 50μM 荷包牡丹碱。*P < 0.05,**P < 0.01,***P < 0.001,采用 Student’s t 检验。
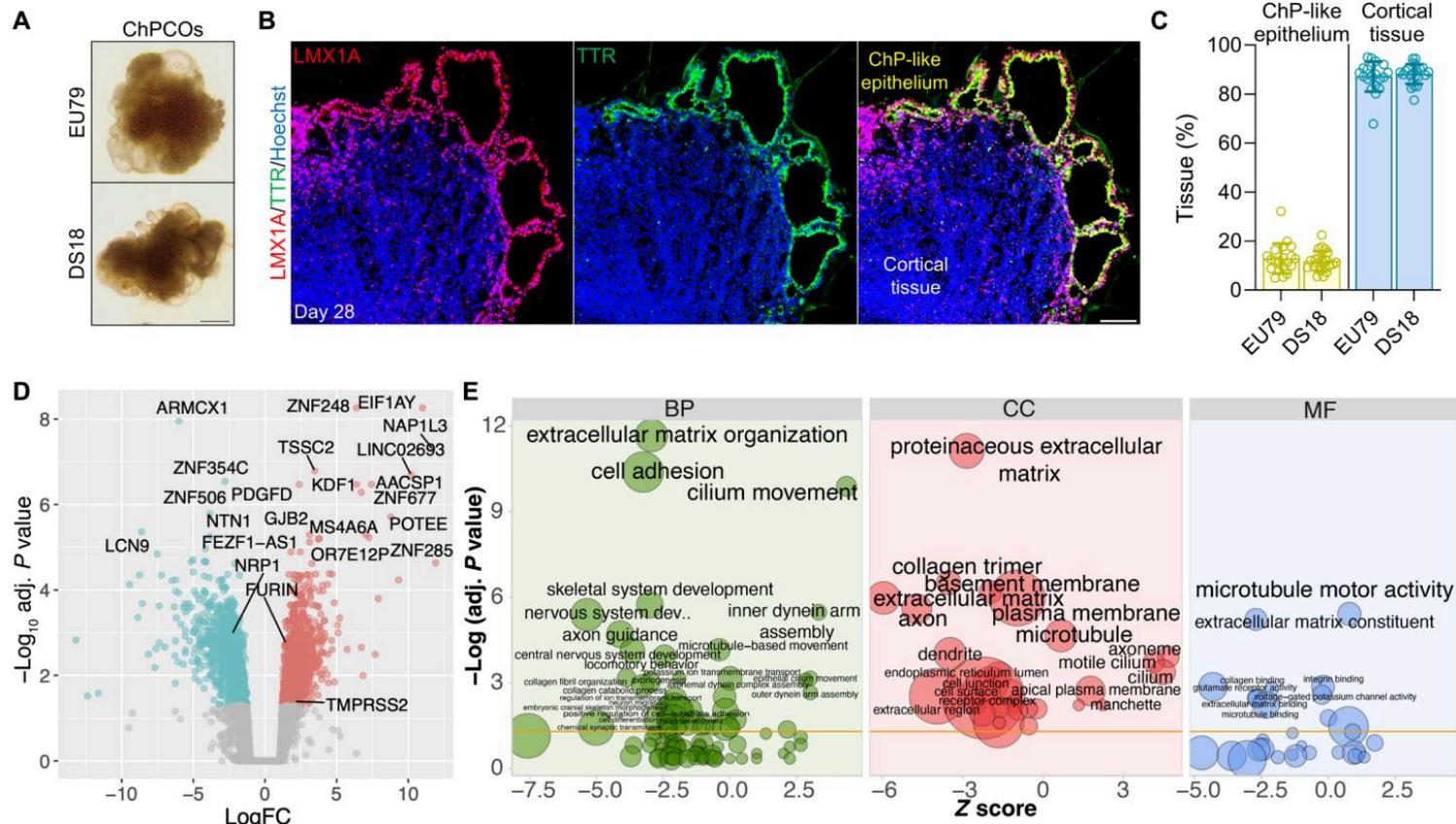
图 6. 模拟唐氏综合征(DS)的 ChPCO 转录谱分析(A) 第 28 天,整倍体和唐氏综合征诱导多能干细胞(DS-iPSC)来源的 ChPCOs 的代表性明场图像。比例尺,500μm。(B) 第 28 天整倍体 iPSC 来源的 ChPCOs 的代表性图像,用 LMX1A(红色)和 TTR(绿色)免疫染色。切片用 Hoechst 33342(蓝色)复染。比例尺,100μm。© 对至少三种不同的整倍体(EU79)和 DS(DS18)iPSC 来源的 ChPCOs 中脉络丛样上皮和皮层组织区室的定量分析。单个点代表一个类器官。实验总数 = 8;分析的类器官总数 = 29。每个时间点分析的类器官数量和实验次数汇总于表 S8。(D) 火山图突出显示第 28 天整倍体和 DS ChPCOs 中的差异表达基因(DEGs)。显著上调的基因以红色显示,下调的基因以青色显示。标记了最显著的 DEGs 以及 TMEM85、FURIN 和 NRP1 基因。(E) 与整倍体类器官相比,DS ChPCOs 中差异表达基因(DEGs)的基因本体(GO)富集分析。Z 值表示与每个条目相关的基因表达的累积增减。气泡大小与各 GO 条目相关的 DEGs 数量成正比。BP,生物学过程;CC,细胞组分;MF,分子功能。
我们进一步注意到,少突胶质前体细胞(OPCs)的所有标记基因在培养28天的DS类器官中均出现下调(图S6B),这一现象通过蛋白质印迹法在蛋白质水平得到证实(图S6C)。类器官切片的免疫荧光染色显示,在整倍体ChPCOs的皮质组织区域细胞内存在清晰的SOX10蛋白表达(图S6D),定量分析表明DS ChPCOs中表达SOX10的细胞数量较整倍体对照组显著减少(图S6E)。这促使我们检测HSA21基因OLIG2的表达——该基因在发育中的前脑背侧寡突胶质细胞生成过程中发挥作用(51),但发现该基因在DS ChPCOs中的mRNA水平表达不足(图S5D)。随后通过蛋白质印迹和类器官切片免疫荧光染色分别证实,与整倍体类器官相比,DS ChPCOs中OLIG2蛋白表达量降低且表达该蛋白的细胞数量减少(图S5E和S5F)。这些发现共同表明,DS ChPCOs重现了DS脑病理的关键特征。
¶ SARS-CoV-2 生产性感染 DS ChPCOs
鉴于唐氏综合征(DS)个体对SARS-CoV-2更易感(24, 25),我们接下来希望评估ChPCOs在模拟SARS-CoV-2感染人类中枢神经系统(CNS)中的应用价值。我们首先检测了未感染整倍体和DS ChPCOs的RNA-seq数据集中决定SARS-CoV-2细胞侵入的宿主基因表达。SARS-CoV-2可通过内体进入途径穿透易感细胞,该途径需要病毒结合受体ACE2,并经由蛋白酶弗林(furin)对病毒刺突蛋白的切割而促进。此外,病毒也可通过细胞表面途径(直接融合)进入细胞,该途径还需跨膜丝氨酸蛋白酶2(TMPRSS2)对刺突蛋白的切割(52)。我们的RNA-seq数据显示,DS类器官中ACE2基因表达水平稳健,与整倍体类器官中观察到的水平相当(图8A)。正如预期,对于位于HSA21上的基因,TMPRSS2在DS类器官中的表达显著高于整倍体类器官(图8A)。我们进一步发现,尽管FURIN基因不位于HSA21上,但DS类器官中FURIN的表达相较于整倍体类器官增加了三倍(图5A)。蛋白质印迹分析证实,与整倍体类器官相比,DS类器官中TMPRSS2和FURIN的丰度更高(图8B)。免疫染色同样证实,在ChP样上皮中ACE2、TMPRSS2和FURIN的表达水平远高于ChPCO类器官的皮质组织部分(图8C和图S6G)。因此,这些数据表明我们的ChPCOs表达了SARS-CoV-2感染所需的受体和蛋白酶,可能构成研究DS个体中SARS-CoV-2中枢神经系统感染的合适实验模型。这也提示,ChP样上皮可能促进病毒进入中枢神经系统,因其表达比神经元更高水平的TMPRSS2和FURIN。
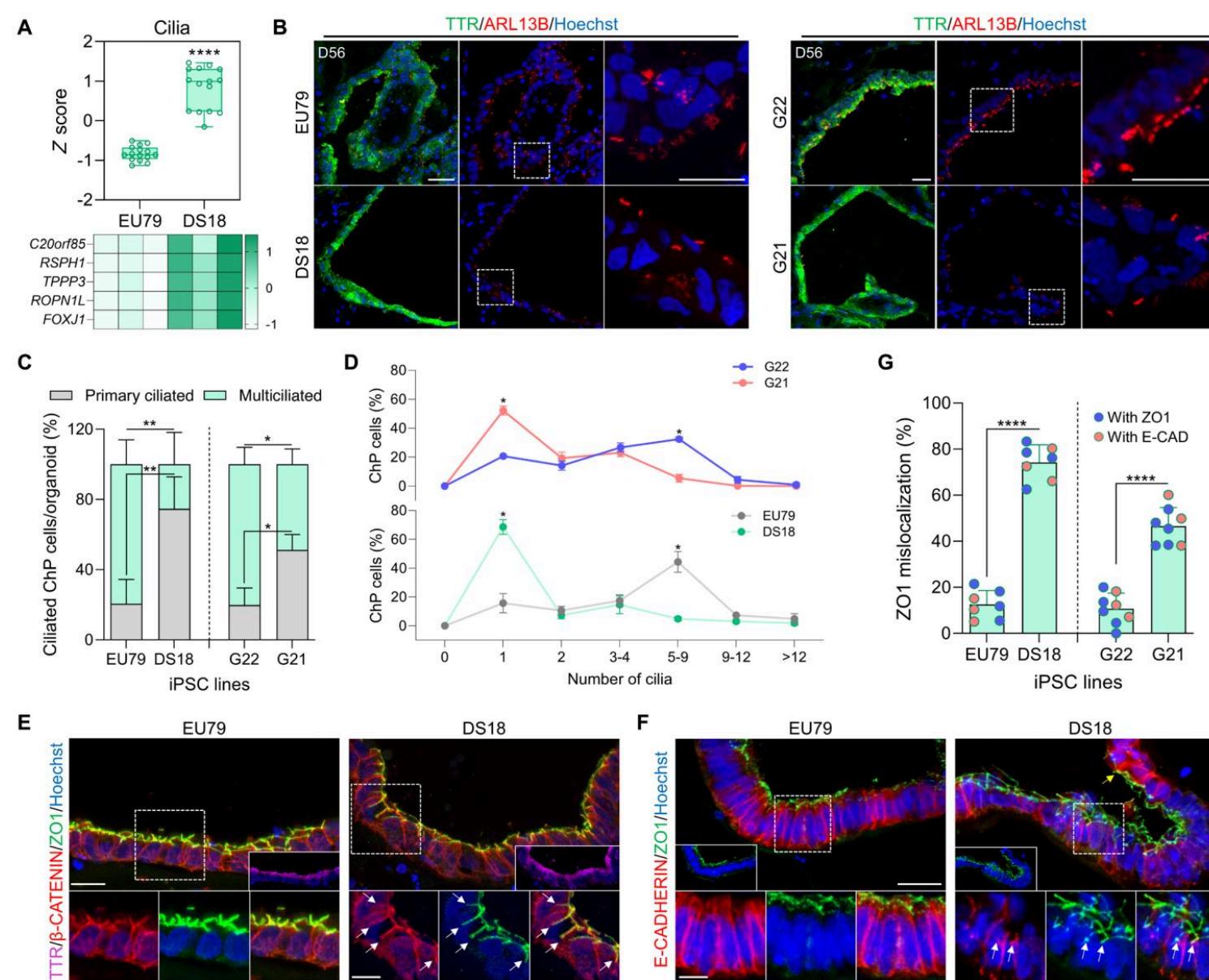
图 7. 唐氏综合征(DS)来源 ChPCO 中纤毛发生和顶 - 基底极性的分析(A) 箱线图显示第 56 天 ChPCOs 批量 RNA 测序获得的纤毛基因(列于热图)的分布。数据范围为最小值到最大值。P < 0.0001,采用单因素方差分析。热图下方为纤毛基因的 z 分数值。
(B) 第 56 天 ChPCOs 用 ARL13B(红色)和 TTR(绿色)免疫染色,并用 Hoechst 33342 复染。比例尺,20μm。带点的白色方框表示放大区域。堆积柱状图显示 ChPCO 中脉络丛样上皮细胞中具有单纤毛和多纤毛的细胞百分比。数据以均值 ± 标准差表示。N = 3。 P < 0.05; P < 0.01,采用单因素方差分析。实验总数 = 13;分析的类器官总数 = 35,汇总于表 S8。
© ChPCO 中纤毛数量的分布。实验总数 = 14;分析的类器官总数 = 29,汇总于表 S8。数据以均值 ± 标准差表示。Kolmogorov-Smirnov 检验, P < 0.05。(D) 第 56 天 ChPCO 切片用 β- 连环蛋白(红色)、ZO1(绿色)和 TTR(品红)免疫染色,并用 Hoechst 33342(蓝色)复染。比例尺,20μm。带点的白色方框表示放大区域。白色箭头指示 ZO1 在基底外侧域的分布。比例尺,10μm。(E) 第 56 天 ChPCOs 用 E - 钙粘蛋白(红色)和 ZO1(绿色)免疫染色,并用 Hoechst 33342(蓝色)复染。比例尺,25μm。带点的白色方框表示放大区域。比例尺,10μm。白色箭头指示 ZO1 在基底外侧域的分布。黄色箭头指示 E - 钙粘蛋白在顶端域的富集。(F) 图示第 56 天 ChPCO 中脉络丛样上皮中 ZO1 错误定位的百分比。数据以均值 ± 标准差表示。**** P < 0.0001,采用 Student’s t 检验。N = 3。
为了评估脉络丛样上皮对脑类器官感染 SARS-CoV-2 易感性的影响,我们用 SARS-CoV-2 的空斑形成单位(FFUs)感染第 28 天的整倍体和唐氏综合征(DS)ChPCOs,持续 72 小时(图 8D 和图 S9D),并通过定量逆转录 PCR(RT-PCR)对 SARS-CoV-2 核衣壳、RdRp(图 8E)、包膜和刺突基因(图 S6H)的表达进行定量。结果显示,与 ChPCOs 相比,COs 被 SARS-CoV-2 感染的程度较低,且 DS ChPCOs 中病毒基因的表达显著高于整倍体 ChPCOs。
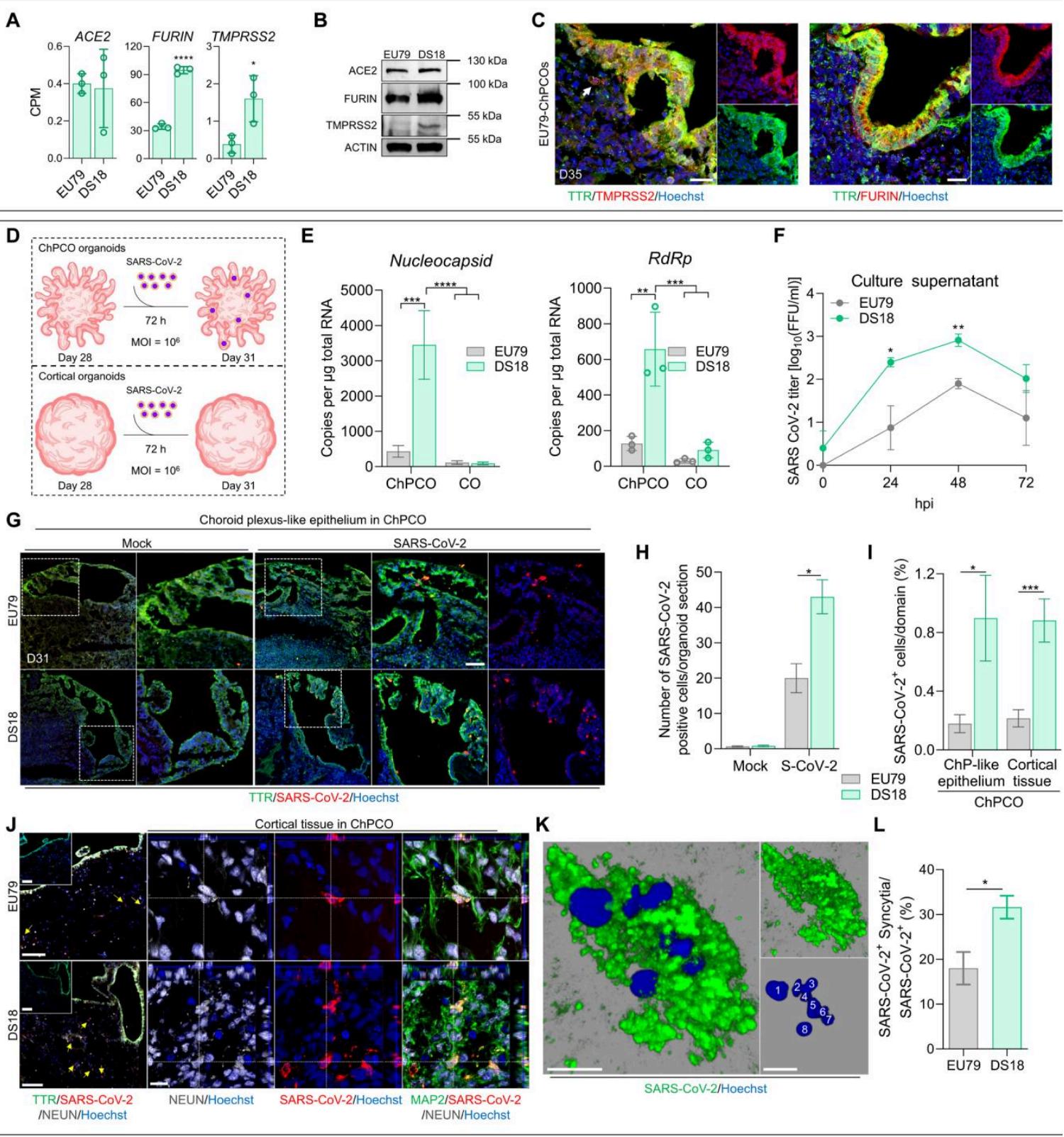
图 8. SARS-CoV-2 可在 ChPCO 中高效感染但在 CO 类器官中不感染(A、B) 第 31 天 ChPCO 中 ACE2、FURIN 和 TMPRSS2 相关 RNA-seq 读数的丰度。数据以均值 ± 标准差表示。* P < 0.05,**** P < 0.0001,采用 Student’s t 检验。N = 3。© Western 印迹显示第 31 天 ChPCO 中 ACE2、FURIN 和 TMPRSS2 的水平。数据以均值 ± 标准差表示。* P < 0.05,**** P < 0.0001,采用 Student’s t 检验。N = 3。(D) 整倍体 ChPCO 切片用 TMPRSS2(红色)、FURIN(红色)和 TTR(绿色)免疫染色,并用 Hoechst 33342 复染。比例尺,20μm。(E) SARS-CoV-2 感染流程示意图。(F) 图示 SARS-CoV-2(10⁴ FFUs)处理后 ChPCO 中 SARS-CoV-2 核衣壳和 RdRp 的表达情况。数据以均值 ± 标准误表示。* P < 0.01,*** P < 0.001,**** P < 0.0001,采用双向方差分析。N = 3。(G) 第 31 天类器官经 SARS-CoV-2(10⁴ FFUs)或模拟感染(SARS-CoV-2 为 10⁴ FFUs)后,ChPCO 切片用 TTR(绿色)和 SARS-CoV-2 刺突蛋白(红色)免疫染色,并用 Hoechst 33342 复染。比例尺,60μm。(H) 图示 ChPCO 中 SARS-CoV-2 阳性细胞情况。数据以均值 ± 标准误表示。* P < 0.05,采用 Student’s t 检验。n = 3,共 15 个 ChPCO 切片。(I) 图示 ChPCO 内 SARS-CoV-2 阳性细胞的百分比。数据以均值 ± 标准误表示。* P < 0.05,*** P < 0.001,采用 Student’s t 检验。n = 3,共 15 个 ChPCO 切片。(J) ChPCO 切片用 TTR(绿色)、SARS-CoV-2 刺突蛋白(红色)和 NEUN(灰色)免疫染色。比例尺,100μm。正交投影为 n = 3 的共聚焦 z 堆叠图像。(K) ChPCO 切片用 TTR(绿色)、SARS-CoV-2 核衣壳(红色)和 NEUN(灰色)免疫染色,并用 Hoechst 33342 复染。比例尺,10μm。黄色箭头指示受感染的神经元。(L) SARS-CoV-2 阳性合胞体的 3D 重建图(最大 Z 平面投影)。白色数字标记单个细胞核。比例尺,10μm。(M) 图示感染后 72 小时(hpi)SARS-CoV-2 阳性合胞体的百分比。数据以均值 ± 标准误表示。* P < 0.05,采用 Student’s t 检验。n = 3,共 15 个 ChPCO 切片。
为确认SARS-CoV-2的增殖性感染,我们在感染后0、24、48和72小时检测了培养上清液中的病毒滴度,发现DS组在24小时和72小时的感染性病毒滴度显著高于二倍体组(图8F)。接着我们研究了ChPCOs中SARS-CoV-2感染细胞的空间分布。SARS-CoV-2感染后,DS类器官中表达SARS-CoV-2刺突蛋白的细胞比例显著高于二倍体类器官(图8G、H)48 小时感染后,这与较高的病毒RNA水平相符(图8E和图S6H)。对EU79和DS18来源COs的免疫染色进一步证实存在少量感染SARS-CoV-2的皮质细胞(图S9C),这与先前研究显示具有脉络丛样组织的类器官比脑类器官具有更高SARS-CoV-2感染性的结果一致(10, 11)。我们进一步量化了SARS-CoV-2实验期间ChPCOs中脉络丛样上皮细胞与皮质组织的占比。与上述数据类似(图6C),各组细胞比例相近(图S8C、D),感染SARS-CoV-2的EU79类器官中脉络丛样上皮细胞仅出现不显著增加。这些发现表明DS ChPCOs中SARS-CoV-2感染增强并非源于脉络丛细胞数量的增加。鉴于ChPCOs同时包含脉络丛样上皮组织与皮质组织,且SARS-CoV-2相关受体和蛋白酶在脉络丛样上皮中的表达高于皮质组织(图8C和图S6G),我们随后比较了ChPCOs内这两类组织对SARS-CoV-2的细胞易感性。结果一致显示,DS类器官的脉络丛样上皮与皮质组织中SARS-CoV-2刺突蛋白阳性细胞数均显著高于二倍体类器官(图8I)。采用全神经元标记物(NEUN)对这些类器官进行染色后,发现皮质组织中大量皮质神经元已被SARS-CoV-2感染(图8J,黄色箭头)。我们观察到许多受感染神经元出现核碎裂现象(图S7D、E),表明SARS-CoV-2感染会诱导神经元死亡。
随后,我们研究了SARS-CoV-2感染ChPCOs的细胞学效应。我们在受感染的细胞中观察到合胞体存在(图8K和图S6I),且唐氏综合征组比整倍体ChPCOs的合胞体数量显著增加(图8L)。值得注意的是,所有合胞体均出现在DS ChPCOs的皮质组织感染细胞中(图8K、8L及图S6I),而脉络丛样上皮细胞中未见明显合胞体。通过分析单个共聚焦平面,我们在单个受感染的DS皮质细胞中最多识别出八个细胞核(图8K)。总体而言,本研究通过将ChPCOs作为三维人体细胞模型,成功揭示了SARS-CoV-2对脉络丛样上皮细胞Z的显著趋向性,这种趋向性导致皮质组织细胞发生有效感染,并在DS组中形成更多合胞体——这可能通过脑内细胞间融合作用促进病毒传播。72 感染后小时
¶ SARS-CoV-2 感染下 DS ChPCOs 的转录失调
为深入了解脉络丛类器官(ChPCOs)对SARS-CoV-2感染的细胞应答,我们对经72小时病毒暴露的第31天整倍体与21三体ChPCOs进行了RNA测序。通过分析比对至SARS-CoV-2基因组的读数,发现DS ChPCOs中的病毒RNA载量显著高于整倍体类器官(图9A)。大部分病毒来源读数定位在病毒基因组3’末端区域,该区域代表活性转录亚基因组RNA的集合,进一步证实感染细胞中存在病毒RNA复制(图9B)。主成分分析显示不同组内生物学重复具有良好的聚类特征,样本在第一维度按基因型分离,在第二维度按病毒感染3′端状态区分(图9C)。该分析还揭示整倍体与21三体SARS-CoV-2阳性类器官的转录谱在两组中均区别于未感染类器官(图9C)。采用斯皮尔曼秩相关对前500个高变基因进行层次聚类分析表明,整倍体与DS组中SARS-CoV-2阳性类器官的转录特征与其他两个病毒阴性组存在差异(图S7A)。与感染SARS-CoV-2的整倍体类器官相比,我们证实了TMPRSS2和FURIN的显著上调(图S7B),而ACE2在两组间表达水平相当(图S7B)。对比病毒感染与未感染的DS ChPCOs发现1058个上调基因和215个下调基因(图9D和表S2)。在病毒感染与未感染整倍体ChPCOs的比较中则发现1118个上调基因和758个下调基因(图9E和表S3),表明SARS-CoV-2感染会引发大规模转录失调。
我们接下来研究了在DS中发挥作用但在整倍体类器官中不起作用的独特SARS-CoV-2应答基因。我们识别出392个上调基因和219个下调基因(图9F和表S4)。值得注意的是,这些基因分布在整个基因组中,仅有七个位于21号染色体(图9G和J)。对已识别差异表达基因进行的基因本体和通路富集分析显示,DS18脉络丛类器官在细胞增殖负调控、凋亡过程正调控、细胞周期阻滞以及磷脂酰肌醇3-激酶(PI3K)-Akt信号通路相关过程中表现出显著更强的激活(图9H、I和图S7C),这与先前显示SARS-CoV-2增加脉络丛类器官细胞死亡的数据一致(10)。值得注意的是,在SARS-CoV-2感染的类器官中未观察到干扰素通路的明显激活,同时干扰素刺激基因(ISGs)的表达也无差异(图9H和表S4)。
考虑到受感染类器官中促凋亡途径的激活(图9H和表S4),72 hpi时SARS-CoV-2病毒滴度的快速下降(图8F)最可能是通过程序性细胞死亡快速清除许可细胞所致,而非通过先天免疫机制实现病毒清除。为验证这一点,我们进一步检测了促凋亡基因的表达(表S5),并评估了SARS-CoV-2感染前后的细胞死亡率。在SARS-CoV-2感染前,DS类器官显示出与凋亡过程相关基因的低表达(图S8A),这与先前认为DS细胞对凋亡敏感性较低的报告一致(53)。然而,DS类器官暴露于SARS-CoV-2后显著改变了促凋亡基因的表达(图S8A)。免疫染色进一步证明,与二倍体类器官相比,DS类器官在SARS-CoV-2感染后caspase-3裂解阳性细胞显著增加(图S8B)。与细胞粘附和ECM重塑相关的多个基因上调(图9F和H)表明,ChPCOs中受感染的脉络丛样上皮细胞可能通过信号传导促进SARS-CoV-2突破脑脊液屏障(54, 55)。总体而言,这些转录组分析结果与以下观点相符:SARS-CoV-2能有效感染DS脉络丛类器官,导致病毒侵入、细胞周期与增殖缺陷,并增加皮质神经元的细胞死亡率。
¶ TMPRSS2抑制剂降低SARS-CoV-2对唐氏综合征类器官的感染
唐氏综合征中由HSA21三倍体引起的转录失调可能导致更严重COVID-19的高风险,这至少部分归因于TMPRSS2产量增加(31)。鉴于我们在DS类器官中检测到TMPRSS2表达量增加三倍(图8 A和B),我们随后评估了TMPRSS2抑制剂avoralstat、camostat和nafamostat对SARS-CoV-2有效感染的影响(图10A)。根据既往研究建议(56, 57),DS脉络丛类器官在SARS-CoV-2感染前用有效剂量抑制剂预处理6小时,并在后续72小时持续给药。我们将24与48小时感染后的病毒滴度与未接受抑制剂处理的二倍体及DS18类器官进行对比。所有抑制剂均能显著降低DS脉络丛类器官上清液中的病毒滴度,使其在24和48小时感染后达到与感染SARS-CoV-2的二倍体类器官相当的水平(图10B)。与avoralstat或camostat相比,nafamostat在DS类器官中对SARS-CoV-2感染的抑制效果最强(图10B),这导致类器官中的感染性病毒被完全清除(图10B)。值得注意的是,三种TMPRSS2抑制剂中的任一种均能完全阻断二倍体类器官中的病毒复制(图S8E)。这些结果共同表明,TMPRSS2介导的病毒途径(直接膜融合)是SARS-CoV-2感染脑组织的主要入侵方式。� �进一步地,我们旨在测试经nafamostat预处理的类器官在SARS-CoV-2感染后是否表现出细胞死亡减少。类器官切片免疫染色显示二倍体与DS脉络丛类器官中SARS-CoV-2阳48 感染后小时性细胞显著减少(图S9A)。此外,通过切割型caspase-3标记发现细胞死亡显著降低(图S9B)。该现象与nafamostat的功能相符:其通过干扰刺突蛋白的活化来阻碍病毒复制与体内传播,而非阻止SARS-CoV-2的初始感染。
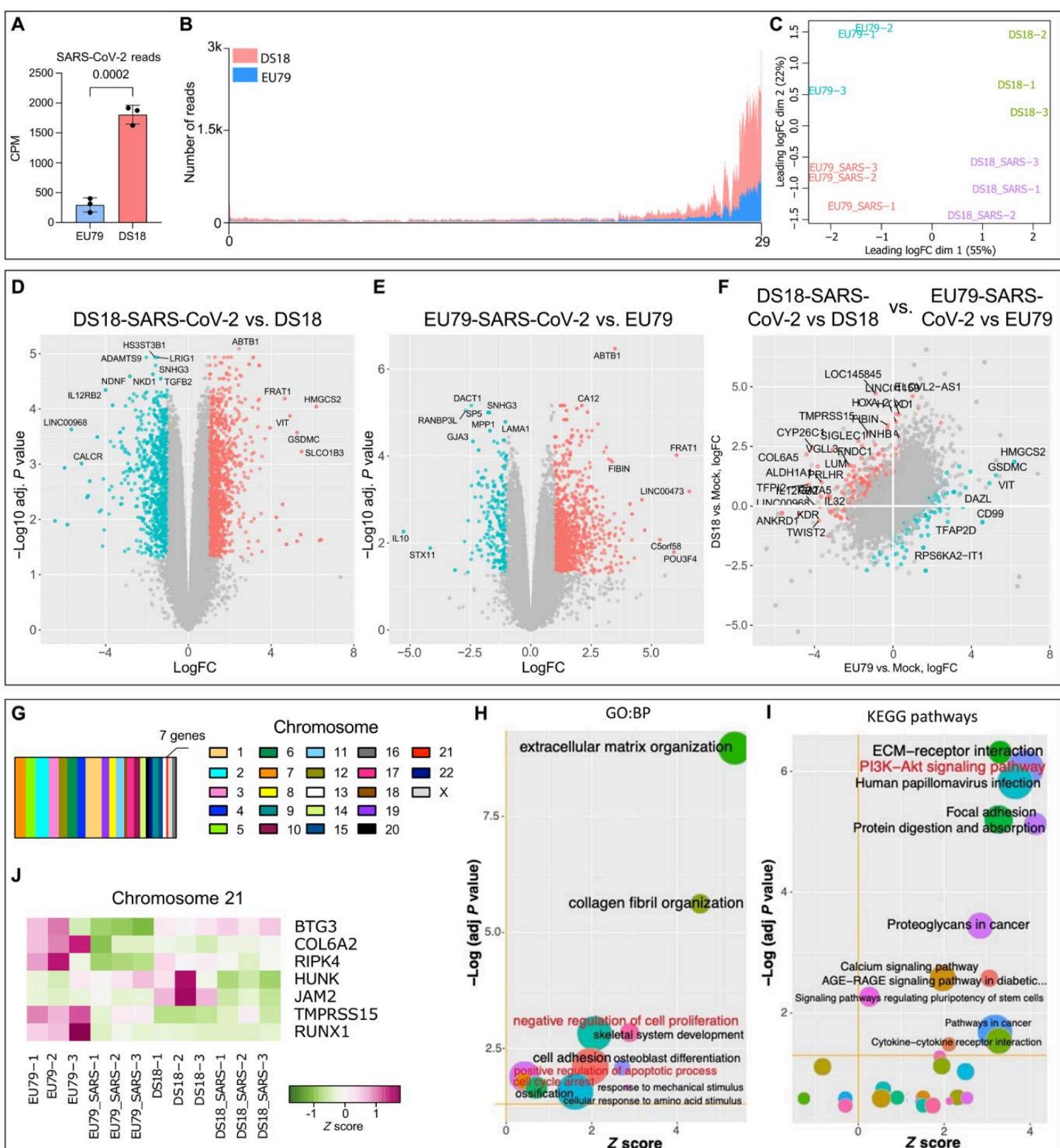
图9. SARS-CoV-2感染后整倍体与21三体脉络膜丛类器官的转录组分析。(A)整倍体(EU79)与唐氏综合征(DS18)ChPCOs中SARS-CoV-2来源的RNA-seq读数丰度。读数计数经文库大小标准化。误差线表示标准差。统计学分析采用Student t检验。(B)SARS-CoV-2来源的RNA-seq读数在病毒基因组上的分布。红色代表DS(DS18)ChPCOs,蓝色代表整倍体(EU79)ChPCOs。(C)未感染与SARS-CoV-2感染人ChPCOs(整倍体EU79与DS18)RNA-seq读数计数的多维尺度分析。(D-E)火山图分别突出显示SARS-CoV-2感染DS(D)与整倍体(E)ChPCOs相较模拟感染的差异表达基因。(F)散点图展示DS18与EU79 ChPCOs在SARS-CoV-2诱导基因表达变化中的差异。图(D)至(F)中,经FDR校正且表达水平至少发生两倍变化的显著上调/下调基因分别用红色和青色标示,多数差异表达基因已标注。(G)基于(F)识别的SARS-CoV-2响应差异表达基因在各染色体上的分布。(H)GO富集分析与(I)KEGG通路富集分析(基于F中差异表达基因)。Z值反映各条目关联基因表达的整体上调或下调程度。气泡大小与对应GO条目关联的P < 0.05差异表达基因数量成正比。(J)(F)中鉴定的21号染色体相关基因在SARS-CoV-2感染/未感染DS18及整倍体(EU79)ChPCOs中的表达情况。
考虑到唐氏综合征大脑类器官也表现出比二倍体对照组更高的弗林蛋白酶水平(图8,A至D),我们随后评估了弗林蛋白酶抑制剂decanoyl-RVKR-CMK在唐氏综合征和二倍体类器官中对病毒复制的影响。刺突蛋白的弗林蛋白酶切割并非SARS-CoV-2侵入细胞的先决条件,但能显著增强病毒感染性(58)。弗林抑制剂处理完全阻断了SARS-CoV-2在整倍体类器官中的复制(图10,C和E),这表明在脑组织中弗林蛋白酶活性对SARS-CoV-2通过膜融合入侵至关重要。使用FDA批准的新冠药物瑞德西韦处理后也观察到相同效应(图10,C和E)。然而弗林抑制剂对唐氏综合征类器官中病毒复制的抑制效果较弱:虽然十酰基-RVKR-CMK在感染后24小时和48小时使病毒滴度显著降低10倍,但未能完全清除病毒,而瑞德西韦则实现了完全清除(图10,D和E)。这可通过DS脉络丛类器官中更高的TMPRSS2和弗林蛋白酶表达量来解释(图8,A至C)。另一方面,不断进化的奥密克戎变异株被弗林蛋白酶切割的效率较低,但对TMPRSS2抑制剂更敏感(59)。这促使我们评估弗林抑制剂对奥密克戎BA.5在DS与整倍体类器官中复制的影响。那法莫司他和瑞德西韦处理均能完全抑制奥密克戎BA.5在两类器官中的病毒复制(图10,F至H)。尽管弗林抑制剂能显著降低两组的病毒复制水平(图10,F和G),但与那法莫司他和瑞德西韦不同,它未能完全清除奥密克戎BA.5(图10,F至H)。这些实验共同验证了脉络丛类器官可作为模型平台,用于筛选在特定遗传背景(本例为21三体综合征)中抑制SARS-CoV-2神经病理学的药物。
¶ 讨论
先天性障碍涵盖多种脉络丛病理改变,例如脉络丛囊肿、弥漫性绒毛增生、脂肪瘤以及斯特奇-韦伯综合征(60)。举例而言,脉络丛囊肿常见于18三体综合征和艾卡迪综合征的胎儿,这类囊肿会因脑脊液积聚引发脑积水(61)。多数脉络丛异常与大脑其他结构畸形相关,包括皮质发育异常。因此开发能探究此类疾病细胞分子机制的人体外模型具有重要价值,特别是针对脉络丛早期发育及功能受损的病症,这类模型有望推动治疗策略的研发,以减轻发育期或成年后脉络丛功能紊乱的影响。本研究建立了快速高效的技术方案,可生成具有多脉络丛样上皮的类器官,这些上皮形成包裹发育中功能性皮质神经细胞的脑室结构。我们发现环绕类器官的脉络丛样上皮层在细胞和分子层面均展现出与体内成熟脉络丛相同的典型特征。此类脉络丛-皮质类器官中的皮质细胞(祖细胞与神经元)和脉络丛样上皮细胞均源自共同祖细胞——人神经外胚层细胞,该细胞易于扩增并能通过CRISPR进行基因操作以构建多种疾病模型。
代表多个脑区的类器官已被成功构建(62, 63),包括脉络丛(ChP)类器官(9, 10)。Pellegrini 等人(9)通过单细胞 RNA 测序证实,其脉络丛类器官中存在皮层神经元;随后这类脉络丛类器官被用于证实脉络丛样上皮对 SARS-CoV-2 病理过程的易感性(10, 11)。已知 BMP4 信号通路可诱导神经上皮分化为脉络丛(36),但会牺牲神经谱系(9, 10)。近期研究使用高浓度骨形态发生蛋白(BMPs),生成了几乎完全由脉络丛样上皮细胞组成的类器官(9, 10)。相比之下,我们使用了约低 10 倍浓度的 BMP4,以支持神经谱系定型并进一步分化为皮层神经细胞,同时仍能让 ChPCOs 中形成脉络丛样上皮。与这一思路一致(图 S1D),我们证实不同浓度的 BMP4 会改变神经祖细胞的含量。近期,利用人类多能干细胞(hPSCs)体外生成人类神经外胚层组织(hNEct),已在传统单层培养和三维类器官模型中成功用于产生前脑细胞(35, 64, 65)。本研究中,我们利用 hNEct 片层的发育潜能,构建了复杂的三维 ChPCO 模型。在该模型中,皮层神经元和脉络丛样上皮这两个不同脑区,由可自组织的共同 hNEct 祖细胞平行发育而来,并通过相互作用促进脑室样结构的形成。我们使用了不同的人类多能干细胞系来生成 ChPCOs,证实了该方案的可重复性。ChPCOs 包含体内成熟脉络丛的关键成分,包括顶 - 基底极性的建立。ChPCOs 的时序转录组数据表明其具有产生脑脊液(CSF)的能力,而我们对 ChPCO 培养基中半胱氨酸蛋白酶抑制剂 C(CST3)、淀粉样前体蛋白(APP)和 β2 - 微球蛋白(B2M)的多重酶联免疫吸附试验(ELISA)分析,证实了这些脑脊液蛋白的分泌。我们还发现,进化上保守的抗衰老蛋白 KLOTHO 在 ChPCOs 的人类脉络丛中表达。已知 KLOTHO 蛋白可保护机体免受多种神经和心理疾病的影响(34)。我们进一步证实,ChPCOs 中的人类脉络丛样上皮细胞在分化过程中,每个细胞可伸出多达 9 根纤毛,且存在从单纤毛向多纤毛的显著转变,纤毛平均长度从 0.8μm 逐渐增加。这一发现与近期一项研究一致,该研究报道体内脉络丛细胞会随时间增加多纤毛细胞的比例,并延长纤毛长度(66)。此外,该研究还发现脉络丛纤毛在整个生命周期中均能维持结构,而轴丝纤毛在断奶后会逐渐消失。但我们的数据显示,与纤毛吸收相关的基因并未随时间发生显著变化。鉴于结纤毛通常存在于胚胎发育阶段,对决定身体左右对称性至关重要,而轴丝纤毛参与多种组织器官中细胞表面的运动和液体流动,这些数据表明 ChPCOs 与人类胎儿脉络丛高度相关,因此可能同时含有结纤毛和轴丝纤毛,且轴丝纤毛不会退化。还需进一步研究确定这些纤毛亚型属于运动型轴丝纤毛、非运动型轴丝纤毛还是运动型结样纤毛。本文描述的 ChPCOs 可为探索人类脉络丛样上皮细胞亚群中轴丝的组织形式和多样性提供宝贵模型,这可能有助于阐明它们在脉络丛功能、皮层发育以及脑积水等人类脑缺陷发生过程中的各自作用。
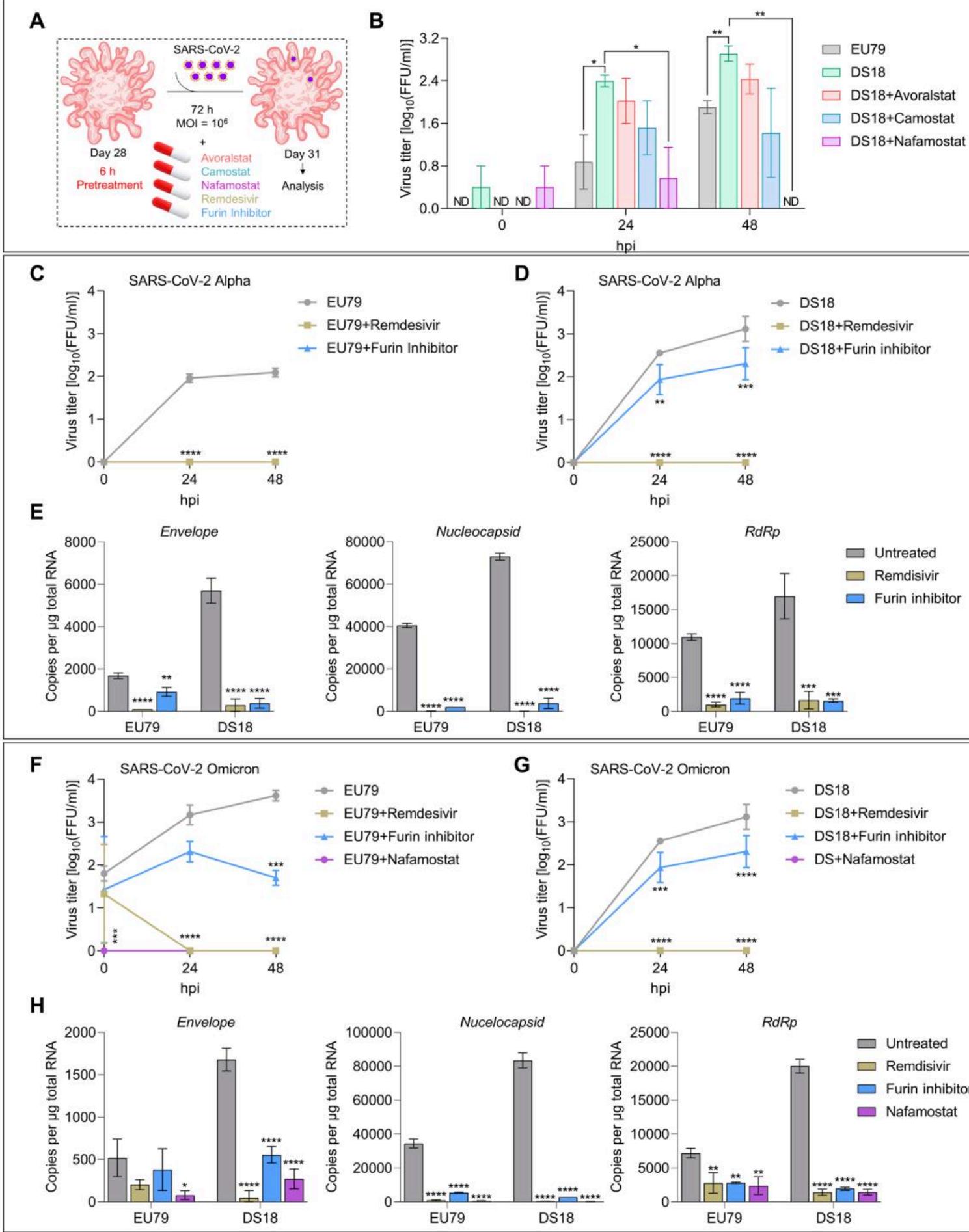
图 10. 针对 ChPCOs 中 TMPRSS2 活性的 FDA 批准抑制剂的药物筛选(A) SARS-CoV-2 感染流程示意图。感染期间在感染后立即加入瑞德西韦,持续 72 小时。(B) 经 100μM TMPRSS2 抑制剂处理的感染 ChPCO 上清液中病毒滴度的定量分析。数据以均值 ± 标准误表示。*P < 0.05,**P < 0.01,采用 Student’s t 检验。N = 20;类器官数量 = 60,汇总于表 S8。© 经 50μM 弗林蛋白酶(furin)抑制剂和 100μM 瑞德西韦处理的感染 ChPCO 上清液中病毒滴度的定量分析。数据以均值 ± 标准误表示。N = 3,汇总于表 S8。***P < 0.0001,采用双向方差分析。(D) 经 50μM 弗林蛋白酶抑制剂、50μM 瑞德西韦和 100μM 瑞德西韦处理的感染 ChPCO 上清液中病毒滴度的定量分析。数据以均值 ± 标准误表示。N = 3,汇总于表 S8。**P < 0.01,***P < 0.0001,****P < 0.0001,采用双向方差分析。(E) 第 31 天 ChPCO 中 SARS-CoV-2 包膜(Envelope)、核衣壳(nucleocapsid)和 RdRp 的表达情况图。数据以均值 ± 标准差表示。*P < 0.05,***P < 0.0001,采用单因素方差分析。N = 3,汇总于表 S8。(F) 经 50μM 弗林蛋白酶抑制剂、100μM 瑞德西韦和 100μM 萘莫司他(nafamostat)处理的感染 ChPCO 上清液中病毒滴度的定量分析。数据以均值 ± 标准误表示。N = 3,汇总于表 S8。**P < 0.0001,***P < 0.0001,采用双向方差分析。(G) 经 50μM 弗林蛋白酶抑制剂、100μM 瑞德西韦和 100μM 萘莫司他处理后,感染 SARS-CoV-2 奥密克戎 - 10⁶ FFUs 的 ChPCO 上清液中病毒滴度的定量分析。数据以均值 ± 标准误表示。N = 3,汇总于表 S8。***P < 0.0001,****P < 0.0001,采用双向方差分析。(H) 第 31 天 EU79 和 DS18 ChPCO 中感染 SARS-CoV-2 奥密克戎 - 10⁶ FFUs 后,奥密克戎病毒包膜、核衣壳和 RdRp 基因的表达情况图。数据以均值 ± 标准差表示。*P < 0.05,**P < 0.01,****P < 0.0001,采用单因素方差分析。N = 3,汇总于表 S8。
在ChPCOs的皮质组织中,SOX2阳性细胞呈散在分布,既出现在脉络丛样上皮附近,也存在于相对远离该上皮的区域。这些SOX2阳性细胞在分化过程中参与形成不同的皮质神经元层。因此,这些皮质神经元并未呈现与内源性大脑类似的模式或分层结构。这一发现凸显了关于类器官内皮质组织架构的重要观察结果。可以明显看出,类器官中皮质组织的模式化并未复现发育中大脑内源性皮质组织所呈现的复杂精密结构(图4I)。数据表明,虽然类器官成功模拟了大脑结构的某些方面,但此局限性揭示了一个需要进一步研究的关键领域,这可能为改进类器官技术提供方向。ChPCOs中发育中的功能性皮质细胞与脉络丛样上皮细胞毗邻存在的独特优势在于,它使得利用患者特异性iPSC系或基因组编辑对照iPSC研究脉络丛介导的神经发育缺陷(如DS中的脑室扩大和Bardet-Biedl综合征中的脑积水)成为可能。由于这类神经发育缺陷可能发生在胚胎发育极早期阶段,在人类环境中难以开展相关研究,而我们的模型为揭示新型疾病进程及评估旨在挽救脉络丛畸形、促进正常皮质大脑发育的药物干预措施效果提供了独特机遇。未来的挑战在于控制hNEct来源的脉络丛样上皮的前后轴身份特征,同时维持皮质神经元的成熟度。近期研究已实现利用类器官系统融合大脑不同区域的技术,并借此分析复杂神经发育缺陷(67, 68)。同样地,通过建立具有侧脑室的ChPCOs——例如通过精准调控音猬因子激活——将有望构建包含海马体的第四脑室脉络丛模型,这可能为在未来全脑体外3D模型中建立并研究具有复杂网络的前后轴身份特征提供契机。
我们成功利用多种人 pluripotent stem cell (hPSC) 系和一种iPSC系培育出ChPCOs,证明该方案在不同实验条件下均能有效诱导ChP(图S2C)。此外,这些ChPCOs能够长期培养并进一步成熟,目前最长可维持1年。ChPCOs包含前脑组织必需的功能性元件(图4和图5)。这些特性使ChPCOs成为研究ChP在神经发育异常和神经炎症过程中作用的理想模型系统。
在发育中的前脑,Olig2最初在腹侧神经干细胞中表达,随后在背侧发育过程中表达并产生少突胶质细胞(51)。OLIG2是HSA21基因,近期研究表明其在DS iPSCs来源的腹侧前脑类器官的神经干细胞群体中过度表达(21)。与此相反,本研究发现相较于整倍体类器官,DS iPSCs来源的ChPCOs在基因和蛋白水平均呈现OLIG2下调。这种差异很可能源于本研究生成的ChPCOs具有背侧前脑特性,我们推测DS ChPCOs中OLIG2的下调可能是该模型中OPC标志物(SOX10与PDGFRA)表达降低的内在机制。我们进一步发现DS细胞系来源的ChPCOs存在纤毛形成缺陷及脉络丛样上皮极性破坏。与既往研究(69)一致,CSF生成相关基因在DS与整倍体类器官间未见显著改变。因此DS类器官中脉络丛样上皮的极性缺陷可能导致离子转运相关基因表达变化。研究发现不同DS iPSCs系来源的ChPCOs表现出不同程度的DS病理外显率,这与先前关于DS个体疾病外显率存在差异的研究(70)相符,进一步支持DS表型严重程度受遗传背景影响的观点。DS胎儿、二维神经元培养物及DS hiPSCs来源的皮质脑类器官均显示星形胶质细胞生成增加(16, 71),但本研究的RNA-seq数据分析(前500个变异最大基因)未检测到星形胶质细胞相关基因表达水平变化(表S1)。我们推测ChPCOs未能重现DS大脑发育这一特征的原因可能在于:该培养方案需长期暴露于BMP4(图1A),而BMP4已知可促进星形胶质细胞分化(72),这或许掩盖了DS与整倍体组间星形胶质细胞生成的内在差异。在DS ChPCOs中观察到细胞黏附与ECM重塑上调现象,无论是否感染SARS-CoV-2均显著存在(感染组见图9F、H和图S6K,未感染组见图6E)。这与既往研究相吻合:DS细胞(包括心肌细胞(73)、皮肤成纤维细胞(74)和脐带细胞(75))中涉及细胞黏附和ECM组成的分子广泛失调,这种现象被认为对DS个体某些癌症类型具有保护作用(76)。在大脑中,DS神经细胞(含星形胶质细胞(77)和神经元(78, 79))呈现细胞黏附与ECM相关基因失调,而神经祖细胞(77)则无此现象。这表明细胞黏附与ECM重塑的改变可能在DS大脑中全局发生,潜在影响DS个体的大脑发育与功能。
产前获得的病毒感染可能对发育中的胎儿大脑产生破坏性影响 。多项关于妊娠期感染SARS-CoV-2女性所生婴儿的临床报告显示,12月龄婴儿存在发育迟缓现象(81, 82)。值得注意的是,这种神经发育病变与早产无关,提示SARS-CoV-2存在特定的嗜神经机制,而非单纯导致妊娠并发症(83)。体外实验表明,SARS-CoV-2对人类脉络丛(10)、神经元(百分之十84)和星形胶质细胞(85)具有神经侵袭性和嗜神经性,预示其影响早期大脑发育的潜力。鉴于TMPRSS2基因位于21号染色体,且流行病学研究显示唐氏综合征人群对SARS-CoV-2具有特殊易感性——其COVID-19相关住院风险增加4倍、死亡风险增加10倍(24, 25),我们采用DS脉络丛类器官模型研究SARS-CoV-2感染。在暴露于SARS-CoV-2后,我们观察到DS iPSCs来源的ChPCO中脉络丛样上皮细胞被大量感染,并随之侵袭皮质组织。由于皮质类器官感染程度较轻,ChPCO中的脉络丛样上皮细胞很可能作为病毒"复制中枢",支持病毒侵袭并扩散至其他皮质细胞,这与既往研究指出的尸检大脑中COVID-19神经症状与脉络丛屏障细胞功能紊乱相关的结果一致(86)。我们证实在此模型中,TMPRSS2和FURIN(而非ACE2和NRP1)在DS ChPCO的脉络丛样上皮中显著上调。如前所述,DS ChPCO还表现出脉络丛上皮极性缺陷。脉络丛上皮极性中的紧密连接本是抵御入侵者的屏障,能阻碍病毒内吞作用。因此,DS类器官脉络丛样上皮中TMPRSS2剂量增加与紧密连接缺陷可能共同促进SARS-CoV-2侵入及后续神经病理变化。基因表达研究显示DS个体、DS iPSCs和DS Ts65D小鼠模型存在全基因组转录组失调(87)。DS患者在病毒性呼吸道感染期间会出现过度免疫反应等严重并发症(29)。最新研究表明脉络丛中I型干扰素表达具有年龄依赖性,并对大脑功能产生负面影响(88)。人类脉络丛中也发现类似IFN-I表达谱(88)。这些数据揭示了脉络丛中慢性衰老诱导的IFN-I特征,该特征常与抗病毒反应相关(8 。另一方面,DS个体因免疫应答受损而在病毒感染期间出现严重并发症(53)。在无任何可检测感染的情况下,DS个体表现出慢性过度活跃的IFN应答(89),以及多种已知在IFN信号下游起作用的细胞因子和趋化因子水平升高(90)。这部分源于IFN受体由HSA21编码(89)。虽然我们发现多个与病毒感染相关的HSA21基因(MX2、TMPRSS2、ADAMTS5和RUNX1)在ChPCO中表达,但未检测到IFN受体和IFN信号通路分子失调,且在31日龄ChPCO及SARS-CoV-2感染的ChPCO中普遍缺乏IFN相关基因表达。相反,我们观察到感染ChPCO细胞中凋亡通路的激活和细胞死亡(图S8,A和B)。然而需要重点指出的是,脉络丛具有唐氏综合征脑类器官中的脉络丛缺陷增强SARS-CoV-2的神经嗜性| 生物王国w关于 SARS-CoV-2感染后,炎症基因在多种IFN相关通路中上调 。因此,使用空间转录组学或分离星皮质期四 来自第31天ChPCOs的AL和ChP样切片可能揭示特定的炎症基因集是否仅在DS ChP样组件中富集。
我们进一步发现,使用FDA批准药物(avoralstat、camostat、nafamostat)抑制TMPRSS2可显著降低所有类器官中的SARS-CoV-2复制,表明在EU和DS脉络丛类器官中病毒进入细胞需要TMPRSS2的参与。与既往报道一致(91),我们发现那法莫司他对SARS-CoV-2感染和复制的抑制效力高于avoralstat和camostat。既往研究报道人类神经元低表达ACE2且不表达TMPRSS2 。本研究发现脉络丛样上皮细胞高表达TMPRSS2和弗林蛋白酶,且在DS类器官中表达进一步增加(图8 A和B)。我们的数据表明抑制TMPRSS2会强烈影响病毒感染与复制,这进一步凸显该受体在SARS-CoV-2感染脉络丛类器官中的关键作用,并为表达TMPRSS2的脉络丛样上皮细胞是SARS-CoV-2感染和传播主要储存库的观点提供了新证据。抑制弗林蛋白酶同样能显著减少DS脉络丛类器官中的病毒复制,并在整倍体脉络丛类器官中完全清除病毒。鉴于已知弗林蛋白酶对病毒刺突蛋白的切割能促进病毒入侵(但非绝对必需),这些数据表明DS脉络丛类器官可能含有足量TMPRSS2,可在弗林蛋白酶活性缺失时介导病毒入侵;然而在TMPRSS2含量较低的整倍体类器官中,弗林蛋白酶可能是SARS-CoV-2感染性的绝对必需因素。此外,我们发现采用FDA批准的新冠药物瑞德西韦治疗可完全清除整倍体和DS脉络丛类器官中的病毒,这与该药物对抗SARS-CoV-2的高效性相符 。
我们的研究结果显示,唐氏综合征脉络丛类器官对SARS-CoV-2的易感性升高,这与临床研究中报道的唐氏综合征患者对重症COVID-19具有医疗脆弱性的结论一致(25, 94)。唐氏综合征患者对SARS-CoV-2感染的高度易感性,可能与其既有的健康脆弱性密切相关。例如,唐氏综合征患者通常存在免疫系统缺陷,这可能削弱机体对病毒建立有效防御的能力,从而导致病毒如本研究所见可能侵入大脑。此外,唐氏综合征患者常见的心脏缺陷和呼吸系统问题会进一步加剧其对SARS-CoV-2的易感性。具体而言:伴有心脏缺陷的唐氏综合征患者可能出现心血管功能受损,导致重要器官供氧不足;SARS-CoV-2主要攻击的呼吸系统在唐氏综合征患者中因结构异常本就功能受限;受损的心血管功能可能加重心脏负荷,导致SARS-CoV-2感染期间出现更严重的临床结局。这些因素的相互作用揭示了基础健康问题与唐氏综合征患者感染SARS-CoV-2后出现重症风险之间的复杂关联。这些健康挑战可能共同放大SARS-CoV-2对神经系统的影响,强调在评估这一脆弱人群病毒感染风险及后果时,必须综合考虑其整体健康状况。
总之,我们的研究强调了ChPCOs对唐氏综合征等神经发育疾病建模及(冠状病毒)病毒研究的相关性,并表明蛋白酶蛋白(TMPRSS2、FURIN)作为抑制SARS-CoV-2神经侵袭性的有吸引力的治疗靶点的重要性。ChPCOs应进一步证明有助于识别和筛选针对未来新兴病毒的治疗方法,以及用于模拟涉及脉络丛功能障碍的先天性疾病。
¶ 材料与方法
¶ 人类胚胎干细胞培养和CO生成
hESC H9(源自威斯康星国际干细胞库WiCell研究所的WA09细胞)、WTC iPSC(由B. Conklin馈赠)、G22、DS18及EU79 iPSC细胞系(本实验室保藏)均参照STEMCELL Technologies操作方案(详见https://www.stemcell.com/maintenance-of-humanpluripotent-stem- cells-in-mtesr-1.html )进行培养。如我们近期报道(95)所述,细胞在Matrigel基质胶(STEMCELL Technologies,目录号354277)上使用无饲养层hESC培养基,并于mTeSR培养基(STEMCELL Technologies,目录号85851)中维持培养。
¶ 脉络丛CO生成
将人类多能干细胞(hPSC)集落以 20%~30% 的密度接种到六孔板中的人胚胎干细胞(hESC)合格基底膜基质上(STEMCELL Technologies 公司,产品目录号 354277)(96)。在神经外胚层组织(NEct)诱导前,用 mTeSR 培养基培养 hPSC 集落 1 天。为制备 NEct 集落,将 hPSC 集落置于 N2 培养基中培养 3 天。N2 培养基组分如下:杜尔贝科改良伊格尔培养基(DMEM/F12,Gibco 公司,产品目录号 11320-33)、2% B-27 添加剂(Gibco 公司,产品目录号 17504044)、1% N-2 添加剂(Gibco 公司,产品目录号 17502-048)、1% MEM 非必需氨基酸(Gibco 公司,产品目录号 11140-050)、1% 青霉素 / 链霉素(Gibco 公司,产品目录号 15140148)、0.1% β- 巯基乙醇(Gibco 公司,产品目录号 21985-023),并添加双重 SMAD 抑制剂 SB-431542(10μM)和 LDN 193189(100nM)。每天更换含抑制剂的新鲜 N2 培养基。第 4 天,按照我们近期报道的方法(35),用分散酶(2.4 U/ml)消化分离诱导后的 NEct 集落,形成神经球。接下来的 4 天,将这些神经球置于添加了碱性成纤维细胞生长因子(bFGF,40 ng/ml;R&D Systems 公司,产品目录号 233-FB-01M)、2μM CHIR99021(Sigma-Aldrich 公司,产品目录号 SML1046-5MG)和骨形态发生蛋白 4(BMP4,2 ng/ml;Thermo Fisher Scientific 公司,产品目录号 PHC9391)的 N2 培养基中培养,每日补加上述因子。随后,将模式化的神经球包埋到基质胶(Matrigel,STEMCELL Technologies 公司,产品目录号 354277)中,换用终末分化培养基培养。终末分化培养基组分如下:DMEM-F12 培养基(Gibco 公司,产品目录号 11320-33)与神经基底培养基(Gibco 公司,产品目录号 A35829-01)混合液、0.5% N-2 添加剂(Gibco 公司,产品目录号 17502-048)、50ml 培养基中加入 12.5μl 胰岛素(Sigma-Aldrich 公司)、1% GlutaMAX 添加剂、1% MEM 非必需氨基酸(Gibco 公司,产品目录号 11140-050)、1% 青霉素 / 链霉素(Gibco 公司,产品目录号 15140148)、50ml 培养基中加入 17.5μl β- 巯基乙醇(Gibco 公司,产品目录号 21985-023)、1% B-27 添加剂(Gibco 公司,产品目录号 17504044),并添加 3μM CHIR99021 和 BMP4(5 ng/ml)。每周更换 3 次新鲜培养基。
¶ 定量RT-PCR
按照先前描述的方法(97)从类器官中提取总RNA。对于qPCR,使用分离的RNA通过第一链cDNA合成试剂盒(Thermo Fisher Scientific,目录号K1612)生成互补DNA(cDNA)1 1μ g 3 μl。采用SYBR Green(Applied Biosystem,目录号A25742),根据制造商说明设置PCR标准反应条件。病毒RNA定量分析中,使用总RNA通过qScript cDNA SuperMix(Quanta BioCt, 目录号95548)进行逆转录。将cDNA稀释10倍后,取该溶液作为qRT-PCR模板。在Applied Biosystem QuantStudio 6仪器上使用QuantiNova SYBR Green PCR试剂盒(Qiagen,目录号208056)进行qPCR。通过将样品Ct值与终点RT-PCR使用相同引物组扩增DNA标准品获得的标准曲线进行比较,确定RNA拷贝数。PCR引物通过美国国家生物技术信息中心(NCBI)免费在线系统设计,所有RT-qPCR引物列于表S6。所有实验均设置生物学三重重复,表达值以各样本的甘油醛-3-磷酸脱氢酶(GAPDH)表达值为内参进行标准化。使用GraphPad Prism 9计算并绘制平均值和标准差。
¶ 免疫组织化学
组织处理与免疫组织化学(IHC)操作流程如(98)所述。简言之,将类器官在室温下用多聚甲醛(PFA)固定,随后用磷酸盐缓冲盐水(PBS)在室温下清洗三次。固定后的4% 60 分钟 1× 10 分钟 30% 4摄氏度 ∘类器官浸入PBS配制的蔗糖溶液中,待其沉降后,置于干冰上并用含有O.C.T.包埋剂与蔗糖以3:2比例混合的包埋剂进行包埋。随后将固定组织进行 厚度的连续切片,并收集到Superfrost载玻片(Thermo Fisher Scientific,产品编号SF41296)上。进行免疫组化实验时,先将切片类器官用 在室温下清洗三14−μm1 × PBS 10分钟 3% 0.1% 1× 4摄氏度 ∘ 10分钟 4% 1 × PBS 10分钟 1 × PBS 488次,每次 ,随后用 PBS配制的 牛血清白蛋白(BSA,Sigma-Aldrich产品编号A9418-50G)与 Triton X-100混合液封闭1小时。一抗于 条件下孵育过夜,之后用PBS在室温下清− 546−洗三次,每次 。对于免疫细胞化学实验(99),细胞经 PFA于 室温固定 ,随后在室温下用 清洗三次,再按上述方法进行封闭和一抗孵育。组织与细胞随后与相应二抗在室温下孵育1小时,最后进行封片及成像。整体封片操作参照既往方法(100)。所有样本均采用Hoechst 33342(Invitrogen,产品编号H3570)进行复染。图像均通过昆士兰大学生物医学科学学院影像平台的共聚焦显微镜(Leica TCS SP8)采集。本研究使用的一抗信息列于表S7。Alexa Fluor 、Alexa Fluor 及Alexa Fluor 633标记的二抗均购自Jackson ImmunoResearch Laboratory。
¶ RNA测序
使用TRI Reagent(Sigma-Aldrich,美国)按照先前所述方法(101)从三个独立类器官池中分离RNA。采用TapeStation 4200(Agilent,美国)分析RNA完整性,选取 的样本使用TrueSeq RNA Library Preparation Kit v2, Set A(Illumina,美国)进行文库构建。经条形码标记的cDNA文库合并后,通过Illumina NextSeq 500测序仪配合NextSeq 500/550 林 > 8High Output 75 Cycles Kit v2.5(Illumina,美国)进行测序。图像采集、处理和fastq解复用均按先前描述(102)采用仪器内置软件完成。
¶ 差异基因表达分析
使用FastQC软件v.0.72对原始测序数据进行质量控制。随后采用Trimmomatic软件v.0.36.6进行序列修剪,参数设置为:ILLUMINACLIP : , LEADING 32 TRAILING 32, SLIDINGWINDOW : 4 : 20, MINLEN : 16。使用Bowtie2 v.2.4.4将修剪后的序列比对至SARS-CoV-2基因组(GISAID登录号:EPI_ISL_944644)。通过Integrative Genomic Viewer v.2.13.1TruSeq3 − 单端 : 2 : 30 : 10(美国博德研究所)对比对序列进行可视化和定量分析。人类源序列使用HISAT2 v.2.2.1比对至hg38基因组组装。采用featureCounts v2.0.1进行特征计数,设置计数模式为"Union",链特异性为"Unstranded",特征类型为"exon",ID属性为Gene_ID。
使用 edgeR v.4.2 进行差异基因表达分析。从数据集中移除低丰度读数(每百万计数(cpm)< 1),并采用M 值修剪均值(TMM)法对文库大小和组成偏差进行数据标准化。对标准化后的数据进行多维尺度分析,并用于构建拟似然负二项广义线性模型。随后,对 ChP-DN、DS18.ChP-EU79.ChP、SARS_DS18-Mock.DS18 和 SARS_EU79-Mock.EU79 这些对比组应用Treat 检验(glmTreat),以鉴定组间至少存在 1 个 log₂差异表达的基因。对(SARS_DS18-Mock.DS18)-(SARS_EU79-Mock.EU79)对比组应用拟似然 F 检验(glmQLFTest),以鉴定在 DS18 类器官中受感染特异性影响的基因。若错误发现率(FDR)校正后的 P 值 < 0.05,则认为基因存在差异表达。使用 ggplot2 v3.3.2 绘制基因表达数据。使用基因注释、可视化和综合发现数据库(DAVID)v6.8进行 ** 基因本体(GO)和京都基因与基因组百科全书(KEGG)** 通路富集分析。随后将富集数据与表达值结合,使用 GOplot v.1.0.2 R 包计算 z 分数,并通过 ggplot2 v3.3.2 绘图。
¶ 透射电子显微镜
将类器官置于含 2.5% 戊二醛和 2% 多聚甲醛的 0.1M 二甲胂酸钠缓冲液(用双蒸水配制)中,4℃过夜。类器官先在室温下用 0.1M 二甲胂酸钠缓冲液洗涤 3 次,每次 10 分钟;随后浸入 2% 四氧化锇溶液(由 4% 四氧化锇 2ml 与 0.2M 二甲胂酸钠缓冲液 2ml 混合而成),室温处理 90 分钟。之后将染色缓冲液替换为 2.5% 铁氰化钾溶液(由 0.2M 二甲胂酸钠缓冲液 4.8ml 与 6% 铁氰化钾 4ml 混合而成),室温处理 90 分钟。接着在室温下将类器官洗涤 3 至 5 次,直至水完全澄清;随后将类器官浸入硫代 carbohydrazide 溶液(0.1g 硫代 carbohydrazide 溶于 10ml 水,置于带锁橱柜中),40℃处理 45 分钟。为去除背景染色,类器官在室温下用水洗涤 4 至 5 次,再浸入含 2% 四氧化锇的 0.1M 二甲胂酸钠缓冲液,室温处理 30 分钟。类器官再次用水洗涤以去除黑色背景;之后浸入 1% 醋酸铀溶液,4℃过夜;随后在 0.03M 镁酸溶液中 60℃孵育 30 分钟,孵育后的类器官在室温下洗涤 3 次,每次 30 分钟。包埋时,类器官依次用 20%、50%、60%、70%、80%、90% 和 100% 乙醇在室温下脱水,每次 30 分钟;随后用 Durcupan 树脂在室温下渗透 12 小时;包埋后的类器官在 60℃下孵育 48 小时,之后进行修块和成像。
¶ 多重ELISA
用于研究脑脊液生物标志物(CST3、APP 和 B2M)水平的类器官培养基在第7、14、21、28、42和56天被收集。收集的培养基中 CST3、APP 和 B2M 的水平使用 Human Magntic Luminex Assays (R&D Systems,目录号 LXSAHM-03) 根据制造商的说明进行检测,并在 MAGPIX 仪器 (Luminex Corp.) 上读取。
¶ MEA记录与分析
将在终末分化培养基中培养的完整类器官,在记录前转移至 MEA 板 [3Brain 公司产品,大面积(最大 5.1×5.1 mm²)范围内含 4096 个细胞分辨率(20 μm)通道,单通道采样频率 18 kHz],并在 BioCAM X 系统(3Brain 公司)中进行记录。吸除每个孔中的培养基,仅保留薄层培养基,使类器官在 37℃、5% CO₂条件下附着于电极网格。记录过程中,向预热的培养基中加入 50 μM 谷氨酸(Sigma-Aldrich 公司,产品目录号 G1251-100G)或 10 μM N - 甲基 - d - 天冬氨酸(NMDA,Sigma-Aldrich 公司,产品目录号 M3262-25MG),以刺激类器官中的神经元活动。为记录药物对 ChPCOs 的抑制作用,向培养基中加入 50 μM 荷包牡丹碱(Sigma-Aldrich 公司,产品目录号 14340-25MG)。同时记录无药物作用下的基线活动。数据以.csv 文件格式导出,使用 BrainWave 软件进行分析。计算平均放电率时,采用精确计时峰电位检测(PTSD)算法,阈值设为背景噪声标准差的 8 倍,每个检测到的峰电位后设置 2 毫秒的峰寿命期和 2 毫秒的不应期。峰电位爆发的检测标准为:最大峰电位间隔 2 毫秒,最小峰电位数量 5 个。
¶ Western印迹
简要来说,使用含蛋白酶和磷酸酶抑制剂混合物(Roche)的 Pierce RIPA 缓冲液(Thermo Fisher Scientific 公司,产品目录号 89900)裂解类器官。使用超声仪对类器官进行超声处理,按照制造商说明,使用 Pierce 二辛可宁酸(BCA)蛋白测定试剂盒(Thermo Fisher Scientific 公司,产品目录号 23227)定量蛋白质浓度。提取的蛋白质在加载前于 100℃加热 10 分钟。上样等量蛋白质,使用 Mini-PROTEAN TGX 无染色凝胶(Bio-Rad 公司,产品目录号 4568044)进行分离。用 iBlot 2 PVDF 迷你转印堆叠(Invitrogen 公司,产品目录号 IB24002)转移分离的蛋白质。用含 5% 脱脂牛奶的 TBST [20 mM Tris-HCl(pH 7.6)、136 mM NaCl 和 0.1% 吐温 20] 在室温下封闭膜 1 小时,随后将用 5% 牛血清白蛋白稀释的一抗在 4℃下孵育 12 小时。本实验使用的一抗列于表 S6。孵育后的膜在室温下用 1× TBST 洗涤 3 次,每次 10 分钟,随后用在含 5% 脱脂牛奶的 1× TBST 中按 1:5000 稀释的二抗在室温下孵育 1 小时。最后,孵育后的膜在室温下用 1× TBST 再次洗涤 3 次,每次 10 分钟,并用 Clarity Western ECL 底物(Bio-Rad 公司,产品目录号 170-5060)显影。
¶ SARS-CoV-2感染脉络丛类器官
SARS-CoV-2 分离株 QLD1517/2021(阿尔法变异株,GISAID 登录号 EPI_ISL_944644),传代 2 次,从一名感染者的鼻咽抽吸物中分离得到,由昆士兰州卫生部下属的昆士兰卫生法医与科学服务部提供。将获得的分离株在 Vero E6-TMPRSS2 细胞上扩增,以制备病毒储备液。通过 Vero E6 细胞的免疫荧光空斑形成试验测定病毒滴度。类器官在含 10⁶空斑形成单位(FFUs)病毒的 500μl 培养基中,于 37℃孵育 6 小时;随后移除接种物,将类器官洗涤 3 次,再置于 1ml 新鲜培养基中培养。分别在感染后 0、24、48 和 72 小时(hpi)采集培养液样本,以监测病毒复制情况。类器官在含 100μM TMPRSS2 抑制剂(阿伏拉司他、卡莫司他或萘莫司他)或 50μM 弗林蛋白酶抑制剂 D-RVKR-CMK 的培养基中预孵育 6 小时。药物处理后,类器官以每个类器官 10⁶ FFUs 的剂量与 SARS-CoV-2 过夜感染。在 SARS-CoV-2 感染后立即加入 100μM 瑞德西韦。随后移除接种物,将类器官洗涤 3 次,置于含相同浓度相应药物的培养基中。
¶ 免疫荧光焦点形成测定
在添加 2% 胎牛血清(FBS)的杜尔贝科改良伊格尔培养基(DMEM)中,对细胞培养液进行 10 倍系列稀释。取各稀释度的培养液 25μl,感染预先接种在 96 孔板中的 2×10⁴个 Vero E6 细胞。将接种物与细胞在 37℃孵育 1 小时后,向每个孔中加入 175μl 覆盖培养基。该覆盖培养基由 M199 培养基与 2% 羧甲基纤维素(Sigma-Aldrich 公司,美国)按 1:1 比例混合而成;其中 M199 培养基添加了 5% 胎牛血清、100 微克 / 毫升链霉素、100 单位 / 毫升青霉素和 2.2 克 / 升碳酸氢钠(NaHCO₃)。
感染后 1 天,移除覆盖培养基,将细胞浸入预冷的 80% 丙酮(用 1× 磷酸盐缓冲液(PBS)稀释)中,于 - 20℃固定 1 小时。后续所有操作均在二级生物安全实验室(PC2)中进行。将细胞单层干燥后,用透明牛奶封闭液(每孔 150μl,Pierce 公司,美国)封闭 60 分钟。加入按 1:1000 稀释的 CR3022 小鼠单克隆抗体(每孔 50μl),孵育 1 小时以检测病毒刺突蛋白;随后用含 0.05% 吐温 20 的磷酸盐缓冲液(PBST)洗涤 5 次,再加入按 1:1000 稀释的山羊抗小鼠 IRDye 800CW 二抗(每孔 50μl,LI-COR 公司,美国),孵育 1 小时,之后用 PBST 再洗涤 5 次。所有抗体均用透明牛奶封闭液(Pierce 公司,美国)稀释,孵育过程均在 37℃下进行。随后使用 Odyssey CLx 成像系统(LI-COR 公司)扫描培养板,设置参数如下:通道 = 800 和 700、强度 = 自动、分辨率 = 42μm、质量 = 中等、焦距 = 3.0mm。最后计数病毒复制空斑,计算病毒滴度。
¶ 统计分析
正态分布数据以独立实验的均值表示。非正态分布数据采用中位数表示。生物学重复次数及样本量均在图注中注明。Student’s检验以及单因素或双因素方差分析(ANOVA)分±标准差 ± 标准差 t P < 0.05别用于两组及多组间比较。Tukey事后检验用于多组与单一对照组的比较。Kolmogorov-Smirnov检验用于评估分布差异。统计分析使用GraphPad Prism 9软件完成。最小统计学显著性定义为。
¶ 补充材料
本PDF文件包括:图S1至S9和表S1至S8的图例
本文的其他补充材料包括:表 S1 至 S8
¶ 致谢
经费资助:M.R.S.获儿童医院基金会资助(项目编号PCC 0252021)。E.J.W.获医学研究未来基金白质营养不良旗舰计划——Massimo的使命资助(项目编号EPCD 000034)。A.S.获国家健康与医学研究理事会创新基金资助(项目编号2021272)。A.A.K.获国家健康与医学研究理事会创新基金(项目编号2012883)及澳大利亚传染病研究中心种子基金资助。本研究由昆士兰大学干细胞工程与再生工程中心资助。B. Conklin(格莱斯顿心血管研究所医学部
作者衷心感谢威尔康奈尔医学院iPSC资源中心提供的WTC iPSC细胞系。同时,作者感谢昆士兰大学显微成像与显微分析中心澳大利亚显微成像平台提供的设施支持与科学技术协助。感谢Z.L. Hunter完成MEA实验记录并提供示意图。感谢昆士兰州卫生局法医与科学服务部提供SARS-CoV-2毒株。新一代测序由ACE测序中心(昆士兰大学SCMB)完成,NGS试剂的采购得到Illumina COVID匹配资助计划的支持。我们特别感谢智利南方大学的A.R. Fernandez与昆士兰大学SCMB的A. Amarilla提供针对SARS-CoV-2刺突蛋白的W25纳米抗体。� 作者贡献:M.R.S.构思、实施、分析并设计实验,解读结果并撰写论文;A.S.进行SARS相关实验的设计、实施与分析,解读结果并撰写论文;B.A.、S.D.M.和J.D.J.S.完成补充实验;J.C.-W.参与研究构思;A.A.K.参与实验设计,解读结果并撰写论文;E.J.W.构思并指导研究,解读结果并撰写论文。所有作者均审阅并认可论文最终版本利益冲突声明:作者声明不存在任何利益冲突。��数据与材料可用性:评估论文结论所需的所有数据均存在于论文及补充材料中。支持本研究发现的类器官与脉络丛类器官量RNA-seq数据已存入GEO-NCBI数据库,主要登录代码分别为GSE208575和GSE208440。