¶ Cell
¶ 多腔心脏类器官揭示人类心脏发育与心脏缺陷
¶ 原文下载:https://fb.biokingdom.top/f/c59cc70ab23445af9655/
¶ 图形摘要
¶ 简而言之
代表人类胚胎心脏所有主要腔室的多腔心形器官被开发出来,用于研究腔室间的电生理信号传导,并剖析人类心脏缺陷的遗传和致畸成因。
¶ 亮点
- 中胚层诱导与模式化信号指定aSHF、pSHF及FHF祖细胞
- 祖细胞在多腔心脏类器官中进行分选、协同发育并建立功能连接
- 多腔心脏类器官协调收缩传导并共享腔室结构
- 多腔平台系统解析遗传性、致畸性及生理性缺陷
¶ 多腔心脏类器官揭示人类心脏发育与心脏缺陷
克拉拉·施密特,1,7,8 艾莉森·德耶特,1,7,8 托比亚斯·伊尔默,1,5 西蒙·亨德勒,2,7 阿兰克萨·托雷斯·卡瓦列罗,1 玛丽亚·诺瓦奇科娃,6迈克尔·A·内策尔,3 拉维尼娅·切奇·吉尼斯特雷利,1,7 埃斯特拉·曼切诺·洪科萨,1,7 塔尼什塔·巴塔查里亚,1 阿姆拉·穆贾季奇,1 洛凯什·平帕莱,4 斯特凡·M·雅内尔,1 玛蒂娜·奇里利亚诺,1 丹尼尔·罗伊曼,1,7 卡塔琳娜·塔韦尼尼,1,7 诺拉·帕派,1,7 斯特芬·赫林,3 巴勃罗·霍夫鲍尔,4 和萨沙·门詹1,9,*
1.奥地利科学院分子生物技术研究所(IMBA),地址:维也纳1030,玻尔博士巷3号
2.维也纳综合生物信息学中心,马克斯·佩鲁茨实验室,维也纳大学,维也纳医科大学,地址:维也纳1030
3.药理学与毒理学系,维也纳大学,约瑟夫-霍劳贝克广场2号,1090 维也纳,奥地利
4.HeartBeat.bio AG,博士玻尔巷7号,1030 维也纳,奥地利
5.FH Campus Wien,法沃里滕大街226号,1100 维也纳,奥地利
6.分子病理学研究所 (IMP),维也纳生物中心校区,1030 维也纳,奥地利
7.维也纳生物中心博士项目,维也纳大学博士学院,和维也纳医科大学,1030 维也纳,奥地利
8.这些作者贡献相同
9.主要联系人 *通讯作者:sasha.mendjan@imba.oeaw.ac.at https://doi.org/10.1016/j.cell.2023.10.030
¶ 摘要
人类胎儿死亡的首要原因是心脏发育缺陷。由于人类胚胎心脏难以直接研究,且突变、药物及环境因素对不同心腔特异功能的影响无法通过体外模型完整呈现,追溯根本病因十分困难。本研究建立了可重现所有主要胚胎心腔发育过程的人源心源性类器官平台,涵盖左右心室、心房、流出道及房室管。通过结合二维与三维分化技术,我们高效培育出具有不同第一心场、前部及后部第二心场特征的祖细胞亚群。这一突破实现了具备腔室特异性体内样基因表达谱、形态结构与功能的心源性类器官的可重复生成。利用该平台,我们揭示了相互作用心腔间信号传导与收缩传播的个体发育规律,并解析了突变、致畸剂及药物如何导致发育中人类心脏出现腔室特异性缺陷。
¶ 引言
先天性心脏病是人类最常见的发育性出生缺陷,也是导致胚胎和胎儿死亡的最普遍原因。1,2 先心病最常累及胚胎心脏的特定区域,例如流出道、心房、房室管和右心室。3 约 的确诊先心病病例病因未明,推测源于尚未发现的基因突变、环境因素或两者共同作用。4 为确定潜在病因和预防措施,我们需要能够涵盖人类心脏发育全过程所有腔室的模型。
先天性心脏病发生在胚胎发育早期,这使得疾病病因的表征尤其困难。5,6 由于人类胚胎发育期间难以控制遗传背景与环境因素之间的相互作用,这些困难变得更加复杂。4 仅通过动物模型来理解先天性心脏病的病因是不可行的,考虑到组织复杂性、发育速度、不可接近性以及物种特异性差异。7 这些差异包括人类胚胎的盘状形状、胚胎外组织和植入的分歧、妊娠时间和增殖速率,以及一些心脏转录因子(TFs)、结构蛋白和离子通道的独特表达,导致特定的电生理特性和疾病易感性。对于其中一些差异,我们没有人类体内参考数据,因为在受精后19至28天(dpf)的关键心脏发育期间没有分子和生理数据。然而,心脏发育的一般原则,如信号传导、细胞类型、谱系结构和功能的作用,是保守的。受到体内心脏发生的启发和指导,最近报道的人类自组织心脏类器官是重要且互补的,因为这些代表了人类心脏发育的实验模型,从而允许在高通量下进行还原论的机制剖析,获得具有高统计学显著性的结果。8,9 然而,目前这些系统尚不允许对代表人类胚胎心脏所有相互作用腔室(流出道、房室管、心房、右心室和左心室)的缺陷进行机制性研究。
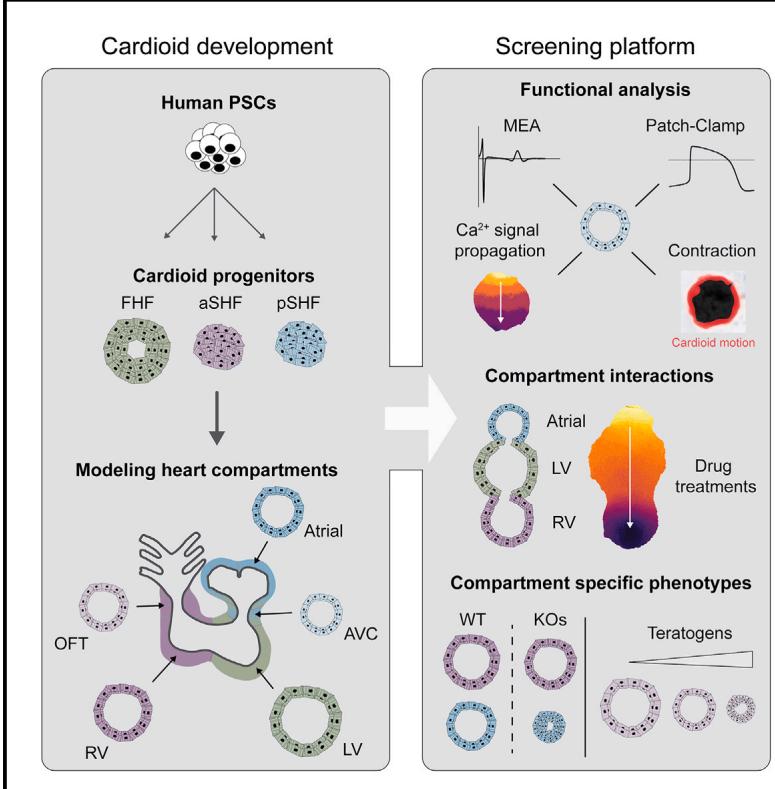
¶ 图1 前第二生心区祖细胞与后第二生心区祖细胞表达特异性标志物并形成功能性心脏类器官
(A)向三种主要心脏谱系的分化方案:第一生心区(FHF)、前第二生心区(aSHF)、后第二生心区(pSHF)。其中,WNT激活剂为CHIR99021;LY代表LY 294002;B代表骨形态发生蛋白4(BMP4);F代表成纤维细胞生长因子2(FGF2);I代表胰岛素;WNT抑制剂为C59或XAV-939;转化生长因子β抑制剂为SB 431542;RA代表维甲酸(括号内数字单位为μM)。
(B)不同培养体系下FHF/aSHF祖细胞的标志物实时荧光定量PCR检测:涵盖二维(2D)、三维(3D)及二维转三维()培养方案。
(C)与3D分化体系中aSHF心脏类器官冰冻切片的RNA原位杂交标志物染色。后续实验均采用二维转三维分化方案。
(D)不同条件下差异表达基因的RNA测序火山图。
(E)谱系特异性心脏中胚层转录因子的RNA测序表达热图。
(F)指定标志物的RNA原位杂交染色结果。
(G) 心脏类器官的标志物免疫荧光染色(G、)及定量分析():生物学重复数,技术重复数。
(H)不同心脏祖细胞中共有上调基因的RNA测序韦恩图。
(I) TNNI1-GFP-人多能干细胞来源心脏类器官的代表性整装成像结果(含生物学重复与技术重复)。比例尺为。
(J) MYL7-GFP-人多能干细胞来源不同亚型心脏类器官的冰冻切片。
(K) TNNI1-GFP/野生型人多能干细胞来源心肌细胞的代表性流式细胞术检测图。标注检测天数(D)。除特殊标注外,比例尺均为。
实验用干细胞系:H9人胚胎干细胞系、WTC11诱导多能干细胞系。
柱状图数据表示:平均值标准差(SD)。
统计学方法:单因素方差分析(one-way ANOVA)。
显著性标识:;;;;表示无统计学差异。
注释: = 生物学重复数; = 技术重复数。
另见:图S1。
为了构建能模拟人类心脏发育的受控体外系统,必须运用体内调控所有谱系共同构建心脏的基本原则。10,11 心脏结构主要源自三个祖细胞群,它们分化形成特定的心肌细胞谱系:第一心场主要形成发育中的左心室,前部第二心场形成发育中的右心室和大部分流出道,后部第二心场则形成大部分心房及部分房室管。这些结构的发育具有精确的时序调控——第一心场衍生的心肌细胞首先形成心管和左心室,而前部与后部第二心场则以延迟渐进的模式分化形成其余心腔。这一复杂动态过程由WNT、Nodal/Activin、BMP等发育信号通路在特定阶段协同调控。12 这些信号通路通过调控下游关键区室特异性转录因子(如TBX1、TBX5和IRX4),指导祖细胞特化、形态发生和生理功能建立。13 尽管对这些核心网络组分已有较多认知,我们仍缺乏能够从机制层面解析突变或环境因素如何导致先天性心脏病或胎儿死亡的人类模型。
在此,我们建立了一个多腔室类心脏平台,该平台揭示了相互作用的心腔如何协调收缩,以及基因突变、药物和环境因素如何影响发育中人类心脏的特定区域。
¶ 结果
¶ 心形线从前第二心区(aSHF)和后第二心区(pSHF)祖细胞的生成
为获得第二生心区(SHF)祖细胞,我们首先提出假设:前第二生心区(aSHF)处于 WNT 和 Nodal 信号通路受抑制的微环境中,这与胚胎其他前部及背部区域(神经外胚层和头部中胚层)的信号环境相似14,15。因此,我们通过以下步骤诱导 aSHF 谱系来源的心脏类器官16:先诱导中胚层形成,随后在第一阶段模式化(patterning-1 stage)中采用 WNT 和 Nodal / 激活素(Activin)信号通路双重抑制策略(图 1A)。研究证实,WNT 与 Nodal / 激活素信号的协同抑制是 aSHF 谱系早期标志物(TBX1 和 FOXC2)上调的必要条件,而任何 Nodal / 激活素信号的异常调控都会干扰第一生心区(FHF)的分化(图 S1D、S1F)。与体内发育过程一致10,第一阶段模式化过程中存在的骨形态发生蛋白(BMP)信号会阻碍 aSHF 的谱系特化(图 S1E)。在三维(3D)分化培养 3.5 天后,我们观察到 aSHF 祖细胞与 FHF/pSHF 祖细胞(TBX5 阳性)的异质性,并追溯其起源至更早的诱导阶段(第 1.5 天):此时中胚层标志物 EOMES 仅在心脏类器官表面表达,而多能性及神经外胚层标志物 SOX2 则定位于类器官核心区域(图 1B、1C、S1A、S1B)。据此我们推测,二维(2D)培养体系中细胞可更均匀地接收诱导信号,从而实现多能性的同步退出与分化;而三维(3D)培养体系中中胚层的诱导过程存在异质性。为验证该假设,我们调整分化策略:先在二维(2D)环境中诱导中胚层形成,仅在第一阶段模式化(第 1.5 天)时转入三维(3D)培养。结果显示,该策略可使细胞高效退出多能性状态(图 S1B),TBX1 和 FOXC2 的表达水平显著升高(蛋白水平阳性率达 67%),而仅少量细胞表达 TBX5(图 1B、1C、S1A、S1D、S1G、S1H)。此外,头部中胚层标志物的表达未被检测到(图 S1C)17,这表明二维 - 三维分步分化策略能够获得均一性更高的祖细胞群体。
与aSHF相反,pSHF在体内暴露于视黄酸(RA)信号传导环境18,这种信号会激活pSHF调节因子(HOXB1、HOXA1和TBX5)并抑制aSHF表达特征。我们一致观察到,在aSHF模式化1阶段添加RA可促进pSHF特性(图1A、1E-1G0和S1E),而操控其他信号通路(SHH、WNT和FGF)则收效甚微甚至无效(图S1E)19。与体内情况类似20,中胚层诱导过程中不同强度的Nodal/Activin和WNT信号通路会促进aSHF和pSHF相对于FHF谱系的发育(图S1G)。通过RNA测序技术分析这三种祖细胞亚型时,我们发现FHF、aSHF和pSHF标记基因均属于差异最显著的表达基因(图1D和1E)。谱系特异性标记物的互斥表达进一步印证了祖细胞群体的特异性和同质性(图1D-1H和S1H)。不过所有群体均对心脏祖细胞标记物NKX2-5呈阳性,而对SOX2大多呈阴性(图S1I)。总体而言,这些数据表明在类心脏系统中,我们能够高效且均质地生成所有三种主要心脏祖细胞。
第一心区(FHF)、前第二心区(aSHF)和后第二心区(pSHF)在胚胎中产生多种不同心脏细胞类型,包括心肌细胞(CM)和内皮细胞(EC)。我们此前研究表明,第一心区祖细胞主要形成左心室含有心肌细胞和内皮细胞的类腔室收缩性心脏器(左心室心脏器)。16 采用该方法,我们在持续抑制WNT信号通路的同时,用BMP、FGF、胰岛素和视黄酸(模式化-2阶段)处理前/后第二心区祖细胞(图1A),从而实现了高通量条件下含收缩腔心脏器的可重复形成(图1I、1J)。与第一心区来源的心脏器相比,前/后第二心区来源的心脏器在此阶段需要更高剂量的视黄酸。高效的前第二心区分化还需在中胚层诱导阶段采用较低接种密度(图S1K、S1L),因为高密度会导致类器官核心区域出现心肌细胞分化效率低下及神经标志物表达(图S1K与S1K)。在模式化-1阶段聚集体形成前进行精确细胞计数对稳健的心脏器形成至关重要(图S1L)。最终,超过 的心脏器细胞表达心肌标志物TNNI1(图1K、S1M),并低水平表达SOX2、内胚层标志物(FOXA2)和成纤维细胞标志物(COL1A1)(图S1J)。此外,前/后第二心区祖细胞在二维培养中经过模式化-1阶段后,暴露于VEGF和毛喉素可高效分化成PECAM1 阳性内皮细胞(图S1N、S1O)。综上所述,通过应用类体内信号环境和细胞数量优化,前/后第二心区祖细胞能在心脏器系统中高效分化为心肌细胞和内皮细胞谱系。
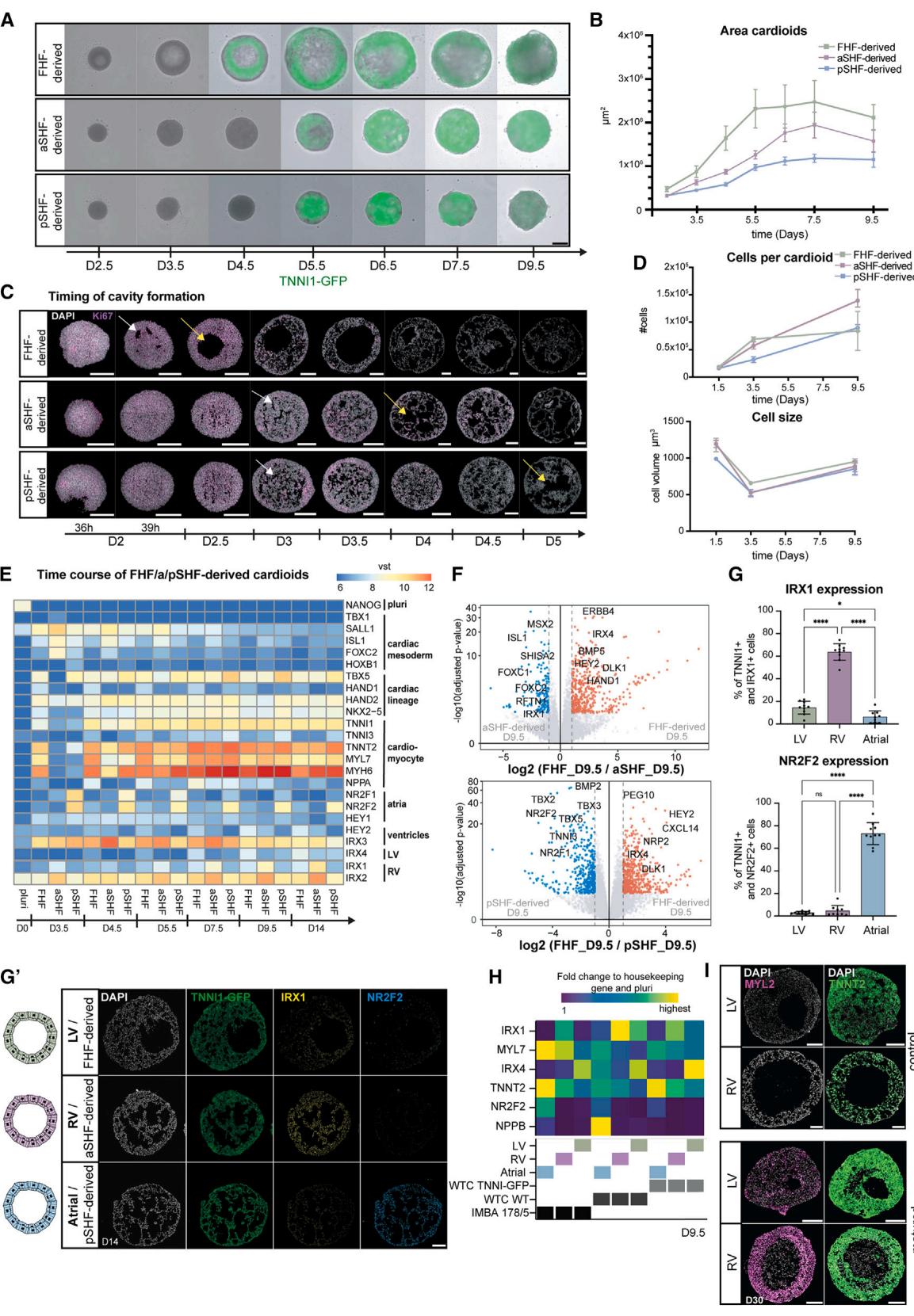
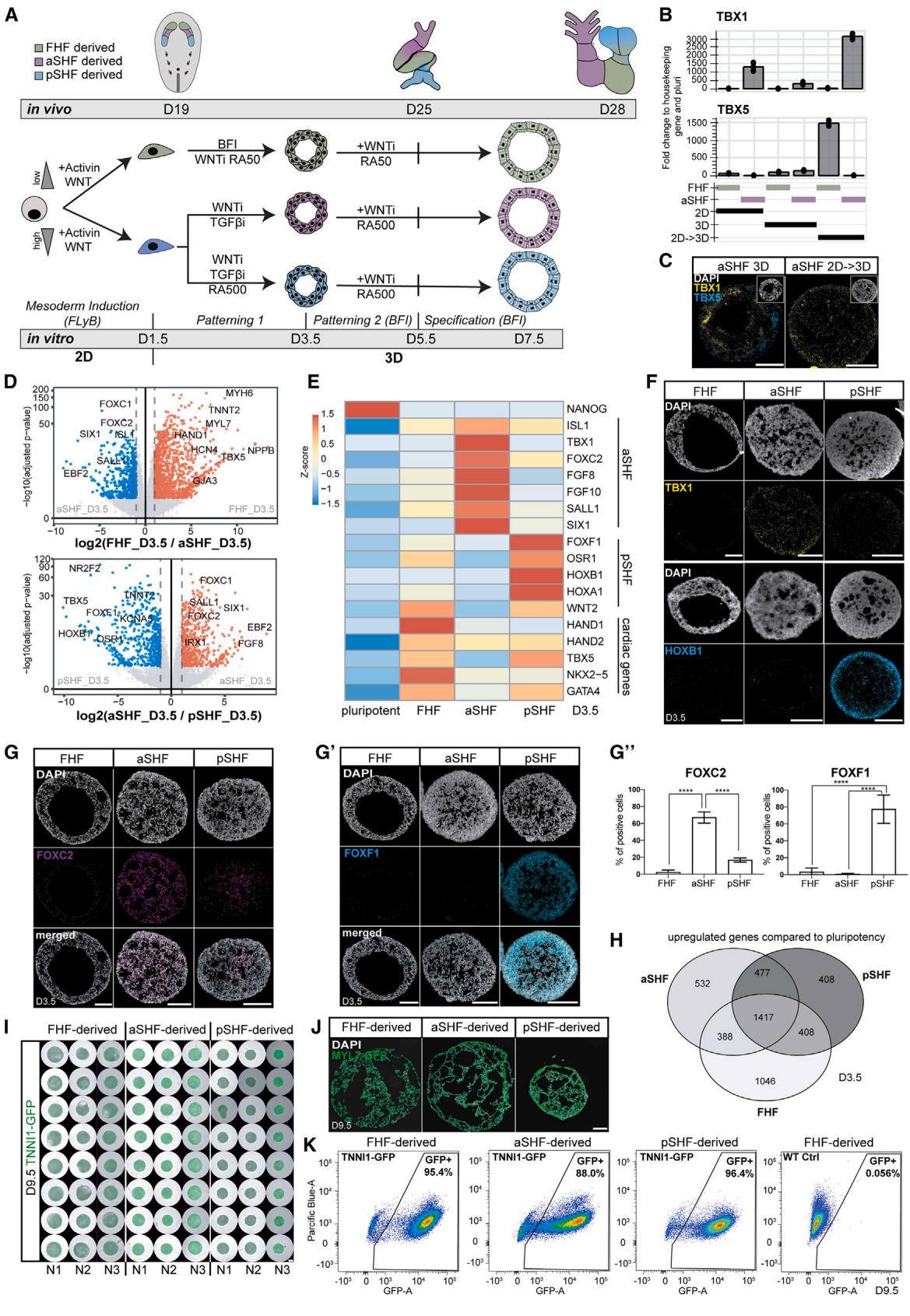
图2. aSHF/pSHF来源的心腔体呈现类体内形态发生延迟及基因表达特征 (A) TNNI1-GFP-hPSC来源心腔体亚型的时序代表性整体标本图像。比例尺为500毫米。 (B) 对应(A)图中分化过程心腔体面积变化的量化分析(每个时间点N , 96)。### (C)心脏类器官冰冻切片的Ki67免疫染色结果
显示腔室形成起始延迟(白色箭头)及腔室扩张异常(黄色箭头)。
(D)分化过程中心脏类器官的细胞总数与细胞大小代表性量化分析
生物学重复数 ,每个时间点技术重复数 。
(E)谱系特异性与区域特异性基因的RNA测序表达热图
(F)不同条件下差异表达基因的RNA测序火山图
(G)指定谱系的特异性免疫染色(G⁰)及量化分析(G)
生物学重复数 ,技术重复数 。
(H)不同细胞系来源心脏类器官的心室特异性标志物实时荧光定量PCR表达热图
(I)成熟左心室/右心室(LV/RV)心脏类器官的MYL2免疫染色结果
标注检测天数(D)。除特殊标注外,比例尺均为 (原文“mm”为笔误,根据上下文修正)。
- 柱状图与散点图数据表示:平均值标准差(SD)
- 统计学方法:单因素方差分析(one-way ANOVA)
- 数据转换:vst = 方差稳定转换计数(variance-stabilized transformed counts)
- 显著性标识:;;;; 表示无统计学差异
- 注释: = 生物学重复数; = 技术重复数
另见附图S2。
衍生心形结构。在体内,FHF产生左心室和一小部分心房心肌细胞,而aSHF和pSHF则分别产生右心室和心房11。为探究此问题,我们通过调节RA浓度比较了aSHF/pSHF/FHF祖细胞的分化潜能。发现aSHF祖细胞形成早期右心室样特征( 、 、I 与NPPA ),而pSHF祖细胞分化为早期心房心肌细胞(HE 、NR2F1 及NR2F2+)(图2E–2G)。在第9.5天的全局基因表达比较中,aSHF心形结构上调最显著的基因包括ISL1、IRX1、HEY2和RFTN1(图2F与S2D),这些基因与心室特性及生理功能相关。相反,pSHF心形结构中TBX5、NR2F2和NR2F1表达上调,符合早期心房特征(图2F与S2D)。这些发现在IRX1、NR2F2和HEY2的蛋白水平得到证实(图2G、2G与S2E)。利用H9人胚胎干细胞、不同WTC人诱导多能干细胞亚系及另一独立hiPSC系也成功实现了心肌细胞亚型的定向分化(图2H与S2F–S2H)。综上,aSHF祖细胞定向分化为右心室样心形结构(右室心形结构),pSHF祖细胞形成心房心形结构(心房心形结构),表明祖细胞的早期编程对于发育心脏中获得不同腔室身份至关重要。
¶ 右心室与心房心脏类器官的形成
发育过程中,FHF祖细胞分化为形成心管的心肌细胞,而aSHF祖细胞先进行增殖,随后在较晚发育阶段与pSHF祖细胞共同分化10。与此一致的是,详细时序分析显示SHF类心脏中心肌细胞的特化与形态发生存在延迟(图2A-2C和S2A),而aSHF祖细胞的增殖速率和Ki67表达量在第4.5天前持续偏高(图2C、2D和S2B)。此外,aSHF祖细胞表现出更强的上皮特性,具体体现为CDH1表达升高和CDH2表达降低,这与体内观察结果相似19,21。aSHF/pSHF类心脏的体积也小于FHF类心脏,且TNNI1表达出现延迟(图2A、2B和S2A)。尽管FHF类心脏所含细胞数量少于aSHF类心脏且单个细胞尺寸相近,但其体积更大,这表明细胞间隙是造成观察差异的原因(图2D和S2A)。全基因表达谱证实SHF类心脏中结构性心肌基因表达延迟(图2E和S2C),同时我们观察到腔室形成滞后(图2C)。由此可见,SHF与FHF类心脏的错时分化过程与体内发育时序和形态发生机制保持一致。
接下来,我们探究了腔室身份的获得是否也遵循aSHF/pSHF衍生的心形细胞的发育轨迹。在体内,FHF分化形成左心室及少量心房心肌细胞,而aSHF和pSHF则分别分化形成右心室和心房。¹¹为探究此问题,我们通过调节RA浓度比较了aSHF/pSHF/FHF祖细胞的分化潜能。发现aSHF祖细胞形成早期右心室样特征(IRX1+、IRX2+、IRX3+与NPPA+),而pSHF祖细胞分化为早期心房心肌细胞(HEY1+、NR2F1+及NR2F2+)(图2E–2G0)。在第9.5天的全局基因表达比较中,aSHF心形结构上调最显著的基因包括ISL1、IRX1、HEY2和RFTN1(图2F与S2D),这些基因与心室特性及生理功能相关。相反,pSHF心形结构中TBX5、NR2F2和NR2F1表达上调,符合早期心房特征(图2F与S2D)。这些发现在IRX1、NR2F2和HEY2的蛋白水平得到证实(图2G、2G0与S2E)。利用H9人胚胎干细胞、不同WTC人诱导多能干细胞亚系及另一独立hiPSC系也成功实现了心肌细胞亚型的定向分化(图2H与S2F–S2H)。综上,aSHF祖细胞定向分化为右心室样心形结构(右室心形结构),pSHF祖细胞形成心房心形结构(心房心形结构),表明祖细胞的早期编程对于发育心脏中获得不同腔室身份至关重要。
为实现进一步的心室特化和成熟,我们测试了近期发表的多种心室心肌细胞信号与代谢调控方案(图S2I)。22–24 在这些条件的适应性组合中,左/右心室类器官上调了关键心室结构蛋白MYL2、心室腔标志物NPPA与NPPB,并呈现典型的MYH7/MYH6表达比例成熟性转变(图2I、S2J-S2M),最终形成清晰的肌节结构和更高的收缩幅度(图S2L、S2N)。然而由于该方法会干扰心房分化,我们进一步探索了促进心房腔成熟的因子组合(图S2I)。研究发现,FGF与RA通路激活、NOTCH与BMP信号抑制联合代谢成熟方案可促进心房程序基因表达( 、NPPB+、N 、IRX4 及MYL2 ),同时显著下调心管及房室管特异性转录本TBX2与TBX3(图S2O)。综上,我们成功验证了类器官可被特化分化为胚胎心脏中存在的三种心腔类型。
¶ OFT与AVC心脏线规范、
除右心室外,aSHF祖细胞还会分化形成动脉干,进而发育成主动脉和肺动脉的瓣膜与血管结构10。动脉干衍生物的异常是常见的先天性心脏病。3我们观察到较高剂量的RA促进aSHF向右心室特性分化(图3A和S3A),而缺乏外源性RA则促进流出道标记物(WNT5A、ISL1、HAND2和RSPO3)的表达,但不影响心室标记物(图3B-3D、S3B和S3C)。19与右心室类心脏相比,流出道类心脏更呈现间充质样特征(图S3E)、分化延迟(图3B)且体积更小(图3I)。进一步优化发现,C59(抑制经典和非经典WNT通路)能促使右心室类心脏中心室标记物表达升高,而XAV-939(仅抑制经典WNT通路)则促进流出道基因上调(图S3D)。流出道类心脏主要包含TNNI 心肌细胞,极少显示成纤维细胞或内皮细胞标记物表达(图S3G)。功能验证表明,与体内通常不产生平滑肌细胞的FHF相比,流出道类心脏表现出更高效的平滑肌细胞分化倾向(ACTA2 和TNNT2 )(图S3F和S3F )。 -。25它们还能在VEGF刺激下形成内皮细胞内层,并在EMT促进因子转化生长因子β和FGF2处理后出现SOX9 阳性间充质细胞(图S3E)。因此,aSHF祖细胞可被诱导分化为具有平滑肌细胞和内皮间质转化潜能的流出道类心脏,重现早期瓣膜与大血管发育特征。
图3 流出道/房室管心脏类器官的谱系特化及单细胞RNA测序体内对照分析
(A)右心室/流出道(RV/OFT)心脏类器官分化方案,重点标注处理差异。
(B)发育过程中RV/OFT心脏类器官标志物的RNA测序表达热图时间序列。
(C)RV与OFT心脏类器官基因表达差异的RNA测序火山图。
(D)MYL7-GFP-人多能干细胞(hPSC)来源RV/OFT心脏类器官的冰冻切片原位杂交链反应结果。
(E)心房/房室管(A/AVC)心脏类器官分化方案,重点标注处理差异。
(F)指定条件下差异表达基因的RNA测序火山图。
(G)A/AVC心脏类器官冰冻切片的TBX2(G)和TBX3(G⁰)免疫染色结果。
(H)发育过程中AVC心脏类器官的RNA测序表达热图时间序列。MC = 间充质细胞(Mesenchymal Cell)。
(I)TNNI1-GFP-hPSC来源RV/OFT/A/AVC心脏类器官的整装成像结果(生物学重复数 )。比例尺为 。
(J–N)不同分化方案的单细胞RNA测序(scRNA-seq)对比分析(;心房类器官:,技术重复数 ):
- (J)scRNA-seq UMAP降维分析图,显示不同细胞集群;V.prol = 增殖型心室细胞(ventricular proliferating cell)。
- (K)S评分(增殖细胞)、OFT、AVC及心房基因模块的表达水平。
- (L)散点图,展示各心肌细胞(CM)集群中高表达基因。
- (M)前第二生心区(aSHF)和后第二生心区(pSHF)基因模块的表达水平。
- (N)与Asp等人26的体外单细胞RNA测序数据集整合后的UMAP图:样本随机降采样至3000个细胞;标注检测天数(D)。
数据说明与统计规范 - 数据转换:vst = 方差稳定转换计数(variance-stabilized transformed counts)
- 比例尺:除特殊标注外,均为 \boldsymbol
- 基因模块列表:详见附表S2
- 生物学重复数 ;技术重复数
显著性标识
;;;; 表示无统计学差异
另见附图S3。
在体内,pSHF来源的心肌细胞构成了心房的大部分,并参与房室管(AVC)的形成——这是瓣膜和起搏器元件发育的关键区域。小鼠研究表明,pSHF前体细胞位于不同的原条区域,并会在不同时间点迁出(AVC较早,心房较晚)20,27,28。因此我们推测,这两种pSHF群体的中胚层诱导条件会存在差异。确实发现,在中胚层诱导阶段采用中等浓度Activin与低强度WNT激活方案,可在第1.5天使原条标志物表达升高(图3E和S3H),进而导致第9.5天AVC特异性基因(TBX2和TBX3)上调而心房基因下调(图S3I)。两种pSHF群体在第3.5天均保持了pSHF特征标记(图S3I)。体内AVC与心房发育的另一差异在于AVC区域持续暴露于高浓度BMP配体。正如假设,在模式形成阶段添加BMP4可上调早期AVC标记物(图S3I),而优化诱导与模式形成(图3E)则推动pSHF向AVC身份分化(图3F–3H)。AVC心形结构较心房更小(图3I),且仅有少量细胞呈PECAM1+或COL1A1+(图S3G)。总体而言,后第二心区祖细胞向心房或房室管类心脏的亚群特化早在中胚层诱导阶段就已开始,这反映了后第二心区的发育可塑性。
¶ 类器官单细胞RNA测序分析与体内比较
人类胚胎在受精后19至28天期间的心脏发生过程无法获取且特征不明,而现有的单细胞RNA测序数据集通常对应较晚的发育阶段。因此,我们旨在通过单细胞RNA测序分析比较全部五种类心脏亚型,并探索早期人类心脏分区中超越已确立动物标记物的特异性差异。我们对左心室(第7.5天)、右心室、房室管、流出道和心房类心脏(第9.5天)进行了单细胞RNA测序,这些样本均匹配于其结构性心肌细胞分化阶段(见图2A-2C)。质控过滤仅需去除 的细胞,均匀流形近似与投影聚类分析成功分离了不同细胞类型及分区特异性心肌细胞(图3J)。聚类结果显示出少量非心肌细胞群(内皮细胞和内胚层)、高效的心肌细胞分化以及生物重复样本的可复现聚类排列(图S4A和S4B)。与发育过程一致,许多早期心室心肌细胞具有增殖性转录组特征和高S期评分(图3J-3L)。分区特异性心肌细胞聚类呈现分化趋势,包括右心室与左心室(图S3J-3L和S4C),并表达经文献整理的基因模块(图3L、3M和S3J-S3L)。多数差异表达基因是已知标记物,但亦存在首次被揭示的基因,如PDGFRA(心房)、CD24(右心室)、TMEM88(流出道)和TRH(房室管)(图3L和S3J),这为探索人类隐藏发育阶段提供了宝贵资源窗口。随后我们将这些对应人类心脏发生约25-28天受精后的数据,与两个源自解剖人类胚胎心室、心房26和流出道(30-50天受精后)29的单细胞RNA测序数据集,采用相同参数进行比较。为促进与体内细胞数量的整合而进行的随机降采样显示,心室与心房心肌细胞聚类存在显著重叠(图3N和S3N)。由于体内样本代表更晚发育阶段,其成纤维细胞群体预期更为庞大,且更成熟但类似的流出道标志。总体而言,心脏类器官亚型scRNA-seq分析证实了区室特异性心肌细胞身份,为揭示人类发育隐晦阶段的早期特化机制提供了宝贵资源。
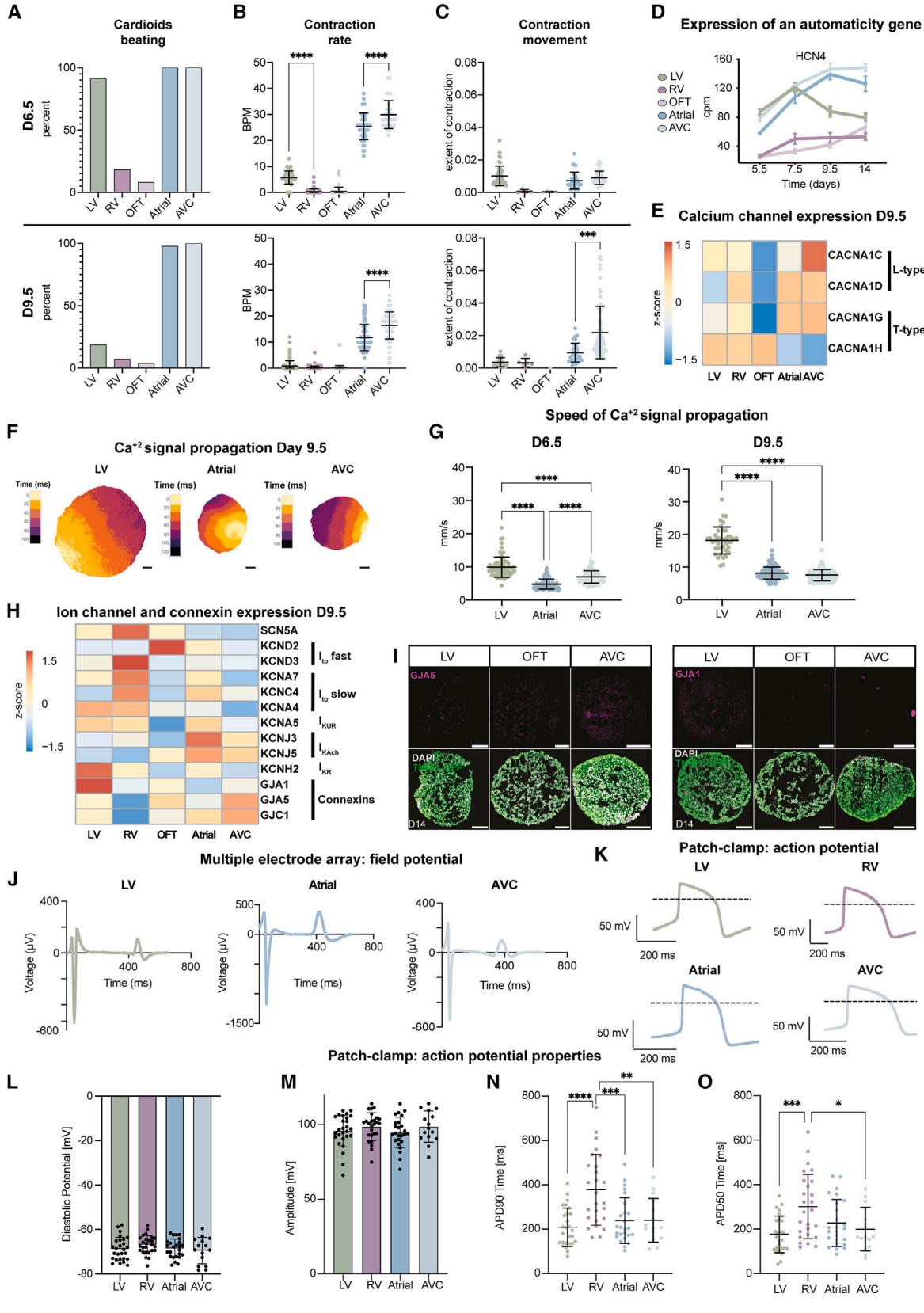
图4 心脏类器官亚型的功能表征
(A–C)实验设计:左心室(LV)、右心室(RV)、流出道(OFT)、心房(atrial)及房室管(AVC)心脏类器官的生物学重复数 ,技术重复数分别为 、、、、;所有实验均采用WTC11人多能干细胞(hPSC)。
- (A)记录1分钟内自发收缩的心脏类器官百分比量化。
- (B)每分钟搏动次数(BPM)量化。
- (C)收缩幅度量化;排除无搏动的心脏类器官。
(D)HCN4基因表达的RNA测序时序定量分析:每个数据点代表平均值标准差(SD);cpm = 每百万读数(counts per million)。
(E)指定基因的RNA测序表达热图。
(F)TNNT2-GCaMP6f-hPSC来源LV/心房/AVC心脏类器官的单次搏动代表性钙信号传导图像:下方为距离比例尺,(原文“mm”为笔误,根据上下文修正)。
(G)TNNT2-GCaMP6f-hPSC来源不同亚型心脏类器官的信号传导速度量化:每个数据点代表单个心脏类器官所有搏动的平均速度;LV:(第6.5天 ;第9.5天 );心房:,;AVC:,。
(H)指定基因的RNA测序表达热图。
(I)LV/OFT/AVC心脏类器官冰冻切片的免疫染色结果。
(J)LV/心房/AVC心脏类器官的代表性微电极阵列场电位(MEA FP)曲线:MEA = 微电极阵列(Microelectrode Array);FP = 场电位(Field Potential)。
(K–O)WTC11-hPSC来源心脏类器官分离的单个心肌细胞(CM)膜片钳分析:每个数据点代表单个细胞15–20个连续动作电位(AP)的平均值;,技术重复数:LV 、RV 、心房 、AVC 。
- (K)代表性动作电位(AP)曲线。
- (L)舒张电位。
- (M)动作电位振幅。
- (N)动作电位时程(APD90,90%复极化时程)。
- (O)动作电位时程(APD50,50%复极化时程)。
数据说明与统计规范
- 标注检测天数(D);除特殊标注外,比例尺均为 \boldsymbol
- 图表数据表示:平均值标准差(SD)
- 统计学方法:单因素方差分析(one-way ANOVA)
- 显著性标识:;;;; 表示无统计学差异
- 注释: = 生物学重复数; = 技术重复数
另见附图S4。
¶ 五种心形亚型的功能表征
心脏必须在发育过程中发挥作用;因此,理解胚胎心脏腔室形成过程中的早期心脏活动至关重要。我们假设,在缺乏人类体内数据的情况下,心脏类器官平台可用于研究不同腔室之间的功能发育差异。第6.5天的心脏类器官亚型收缩行为显示, 的左心室、心房和房室管类器官具有自发收缩(自动性),且收缩程度更大。相比之下,仅 的右心室类器官能自发收缩, 的心流出道类器官表现出较低收缩程度(图4A、4C和S4B;视频S1)。至第9.5天,心房/房室管类器官仍保持自动性,而左心室、右心室与心流出道类器官的收缩频率均有所下降(图4A–4C;视频S1)。与体内情况相似,30
自动性的丧失与起搏器中发现的HCN4钾/钠通道表达下调相关(图4D)。这些观察结果在技术和生物学重复以及细胞系中均具有可重复性(图4A–4C和图S4A)。为了进一步了解类心脏中的信号传播,我们构建了GCaMP6f报告基因系以追踪钙2+瞬变(图S4C),发现每种类心脏亚型都有其独特的钙2+波动模式;A型、房室通道型和左室型类心脏跳动非常规律( 搏动),而右室型类心脏往往不收缩,但表现出持续以长时程爆发形式传递信号的钙2+波(“折返”, )(图S4C;视频S2)。
当我们研究 在整个类心脏器官中的传播情况时,与心房和房室沟组织相比,左室类心脏器官表现出更持久的钙瞬变,这与体内研究报告一致31。信号在类心脏器官中的传播速度因亚型与分化阶段而异:左室类心脏器官的 瞬变从第6.5天起进一步增强,至第9.5天时传播速度已超越心房/房室沟类心脏器官(图4F与4G)。这与GJA1(CX43)的上调相一致,尤其在具有高导电性的左心室心形结构中表现明显;同时GJC1(CX45)在上调于具有低导电性特征的房室结心形结构中也得到验证(图4H和4I)。32 在同一类心脏内,信号传播的起源会随每次搏动而变化(视频S2)。我们还观察到不同类心脏亚型之间的差异,这反映在T型和L型钙2+通道的表达差异上(图4E)。总体而言,在这些早期胚胎阶段,分区特异性类心脏具有独特的收缩和信号传播特征,这些特征在人类中难以获取。
在心脏发育早期,离子通道表达相对均匀,但到后期阶段会出现心室特异性基因表达谱和物种特异性动作电位形态——这些通常通过场电位或AP时程进行测量。33 到第9.5天时,类心脏器官亚型也形成了独特的离子通道表达模式(图4H)。由于表征早期人类心肌细胞亚型在3D类心脏器官、类器官衍生的2D单层细胞以及单颗2D心肌细胞中FP与AP的差异至关重要,我们采用了多电极阵列、电压敏感染料成像和手动膜片钳技术。将完整类心脏器官置于 电极网格上,以高空间分辨率测量FP。我们观察到不同类心脏器官亚型间的FP多样性(图4J和图S4H–S4L),其中单个左心室类心脏器官表现出比A/AVC类心脏器官更均匀的信号传播FP分布(图S4I–S4L)。在2D单层细胞中使用FluoVolt染料时,发现LV/RV心肌细胞的APD长于心房心肌细胞(图S4M–S4P)。单细胞膜片钳分析显示心房/AVC的APD短于RV心肌细胞,这证实了单层细胞的趋势,且与人类原代心肌细胞数据一致(图4K、4N、4O、S4Q–S4U)。舒张电位约为 (图4L),AP的上冲速度(图S4S)和振幅(图4M)与最先进的体外模型相似34,重要的是特定心肌细胞在电生理上呈现均质性。综上所述,类心脏器官亚型的电化学信号具有多样性且呈现胎儿样特征,为研究早期人类心脏发生的功能机制提供了平台。
¶ 多腔室整合心形器官亚型
胚胎心脏祖细胞在相邻区域特化并通过自我分选形成独立区域,11 但研究胚胎中分选机制的分子基础具有挑战性。为检验aSHF/pSHF/FHF祖细胞是否具有与体内对应细胞相同的自我分选潜能,我们解离了源自H2B-GFP或LMNB1-RFP-hPSCs的第3.5天类心脏亚型,将其混合(图5A),并在24小时内观察到自我分选现象,同时这些细胞维持心肌细胞特性直至第7.5天(图5B-5D、S5A和S5B)。相反,相同亚型的祖细胞混合后往往不会发生分选(图5B、5C和S5A)。这种分选行为与不同祖细胞中特定的钙粘蛋白和转录因子表达特征相一致,令人联想到体内情况(图5D、5E、5E和S5C)21。各分区保持了相应的心腔命运(图S5D),证实分化前两个阶段决定谱系身份,且从第3.5天起可实现共分化。
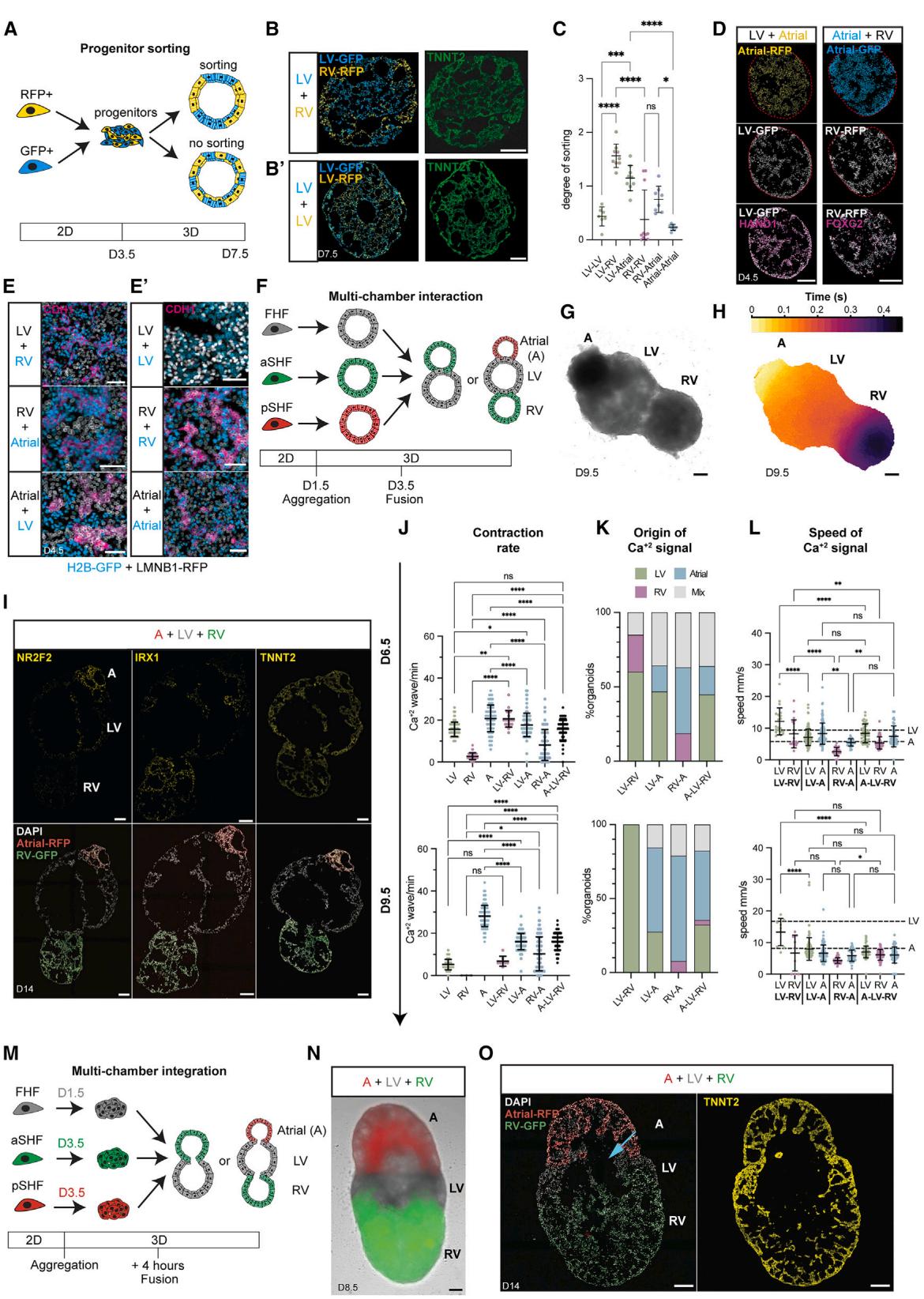
图5. 心形器官亚型的多腔室整合
(A) 分选实验示意图(B 与 B0) 源自(B)不同或(B0)相同祖细胞的人多能干细胞-H2B-EGFP/人多能干细胞-LMNB1-RFP心形器官代表性冷冻切片
© H2B-GFP 与LMNB1-RFP 祖细胞的分选定量分析;样本批次数= 2–3,样本总数= 7–11
(D)混合后的免疫染色结果
红色线条标注心脏类器官边缘。
(E、E⁰)混合后心脏类器官的免疫染色放大图像
(第4.5天):(E)不同混合祖细胞;(E⁰)对照组。
(F)多腔室心脏类器官分化方案示意图
采用H2B-EGFP/LMNB1-RFP标记不同结构域(H2B-EGFP:组蛋白H2B-增强型绿色荧光蛋白;LMNB1-RFP:核纤层蛋白B1-红色荧光蛋白)。
(G)心房-左心室-维甲酸(A-LV-RA)多腔室心脏类器官的代表性明场图像
(H)三腔室心脏类器官单次搏动的钙信号(Ca²⁺)传导代表性图像
每个像素点显示峰值强度的50%。
(I)多腔室心脏类器官的免疫染色冰冻切片
心房区域(A,RFP阳性)、左心室(LV,未标记)、右心室(RV,EGFP阳性)。
(J)不同多腔室亚型心脏类器官的每分钟钙波次数
(K)多腔室心脏类器官的钙信号起源分析
颜色标注搏动起始亚结构域;“Mix”表示>10%的搏动由不同亚结构域共同起始。
(L)多腔室心脏类器官各亚结构域的钙信号传导速度
虚线表示左心室/心房(LV/A)心脏类器官的平均传导速度。
(I–K)实验参数
生物学重复数 ,每个亚型技术重复数 ;排除标准:详见附表S3。
(M)共享管腔多腔室心脏类器官分化方案示意图
(N)采用(M)中方案构建的多腔室心脏类器官代表性明场图像
(O)采用(M)中方案构建的三腔室心脏类器官免疫染色冰冻切片
箭头标注共享腔室;标注检测天数(D)。
数据说明与统计规范
- 比例尺:均为 (原文“mm”为笔误,根据上下文修正)
- 图表数据表示:平均值标准差(SD)
- 统计学方法:单因素方差分析(one-way ANOVA)
- 显著性标识:;;;; 表示无统计学差异
- 注释: = 生物学重复数; = 技术重复数
另见附图S5。
在体内,心脏各腔室协同发育、无缝衔接;然而,我们缺乏多腔室模型来研究这一关键阶段及心脏形态发生的复杂过程。由于祖细胞在第3.5天已实现定向分化与空间排布,我们推测协同发育的心源性类器官在此阶段也将保持独立,但会共同经历形态发生。当我们在第3.5天将不同心源性类器官亚型共培养时(图5F),它们经过24小时协同发育形成了结构连接(图S5E和S5F),但仍保持各自独特的身份标识与腔室分区(图5G和5I)。相比之下,若在第5.5天进行亚型共培养,则直至第9.5天仍无法建立连接(图S5E)。仅当在第3.5天组合培养时,心源性类器官才能实现协同发育,于第6.5天建立电化学连接并呈现协调收缩(图5H和S5G;视频S3),证明其存在功能性互动。当我们在空腔形成前组合祖细胞(图5M)(第1.5天FHF/LV;第3.5天aSHF/RV和pSHF/A),发现它们在保持心肌细胞身份的同时共享管腔结构(图5M–5O、S5Q和S5R)。此后我们将这些结构称为多腔室心源性类器官。多腔室心源性类器官在所有组合中均能协同发育,使我们能够按照胚胎心脏发育的天然顺序或通过实验重排方案(图S5J和S5K;视频S3),研究双腔室或三腔室心源性类器官(心房、左心室与右心室融合体;图5G–5I和S5G;视频S3)的相互作用。
早期心脏发生过程中,电化学信号传播的方向性逐渐确立,最初尚未形成起搏器、瓣膜和隔膜。然而,这一过程在人类胚胎中的发展尚未被追踪。³⁵ 在小鼠和鸡中,FHF来源的心管和早期左心室区域首先开始收缩,但随着成熟会丧失自动节律性。36,37 相比之下,发育中的心房和房室管较晚开始搏动,并维持自动节律性直至心脏起搏器形成,确保信号和血流沿心房 左心室 右心室 流出道的单向运动。32 为探究多腔心脏类器官系统是否重现这一过程,我们测量了完整类器官及其分区的钙2+信号传导与动作电位。发现每次搏动通常起源于某个分区,随后传遍整个多腔心脏类器官(图5H与S5K;视频S3),在A-LV-RV类器官中形成单向信号与动作电位传导。第6.5天时,多数钙2+信号源自左心室区域(图5K),并传导至无法独立搏动的右心室区域(图4A、S5G与S5H)。我们通过实验验证:第6.5天由左心室区域起搏的多腔类器官,其搏动频率与左心室类器官相当(图5J)。从第6.5天至9.5天,心房类器官收缩频率逐渐增加,而左心室类器官收缩频率降低,这与心房区域逐渐主导双腔/三腔类器官起搏的现象一致(图5J)。相应地,随着多腔类器官发育至第9.5天,所有组合中的钙2+信号与动作电位主要起源于心房区域,信号传导速度受心房调控,各子分区呈现均质的动作电位波形(图5H、5J、5K与S5K–S5P;视频S3)。值得注意的是,分区间相互作用会特异性降低左心室区域及整体多腔类器官的信号传导速度(图5L与S5I)。由此,我们的综合分析平台揭示了多腔心脏类器官及其子分区电化学信号传导的个体发育规律,以及分区间相互作用如何影响共发育的独立腔室。
¶ 突变导致类心脏器官出现区室特异性缺陷
编码心脏转录因子的基因突变会导致区域特异性先天性缺陷,其中自主与非自主效应难以区分。此外,物种特定的转录因子表达和功能变异正变得越来越显著。38 为了从遗传学角度验证人类心腔区平台的特异性,我们针对重要的转录因子ISL1和TBX5以及研究较少的FOXF1,成功培育了基因敲除(KO)-hPSCs(图S6A、S6G和S6J)。
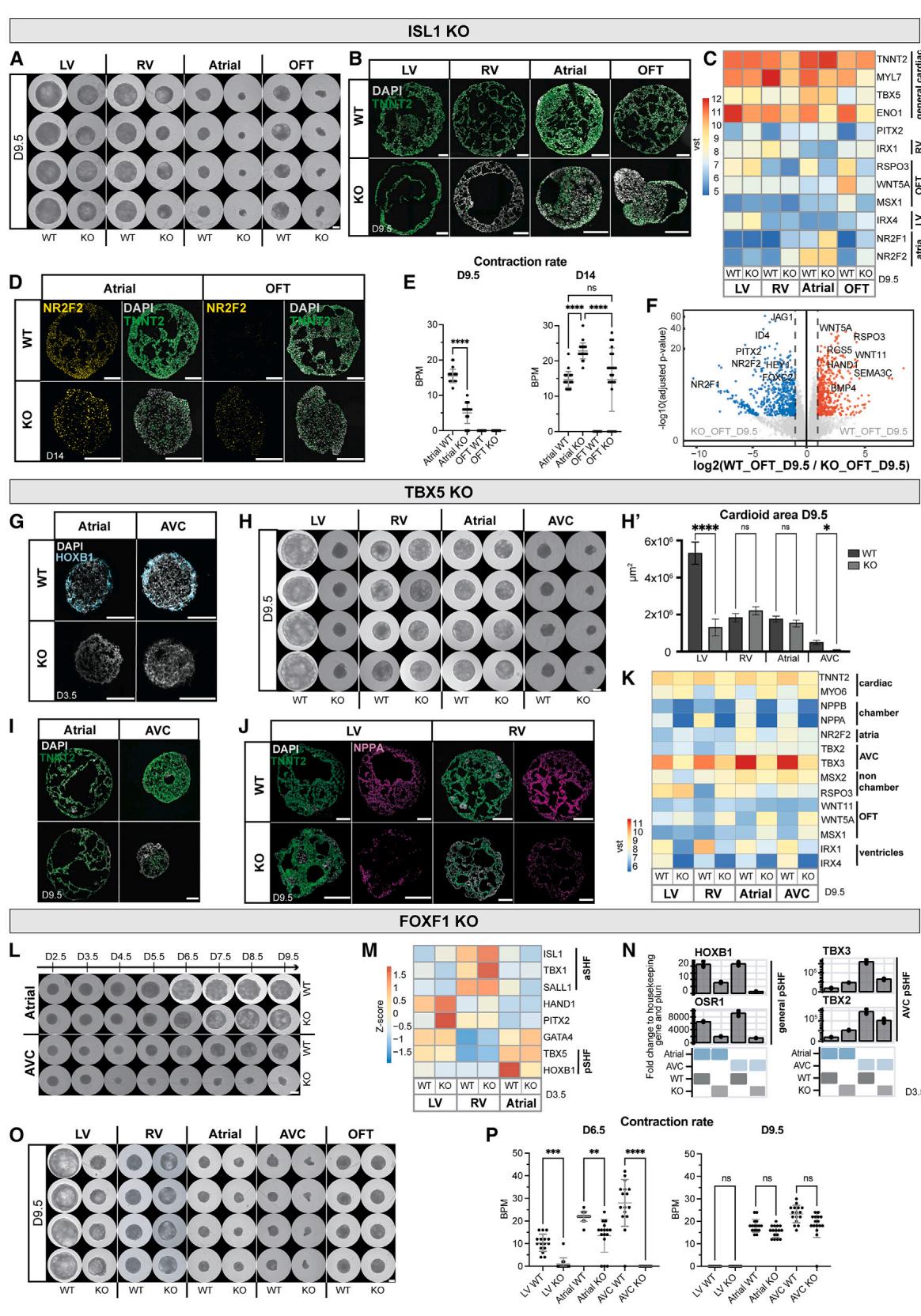
图6. 突变导致心脏类器官出现腔室特异性缺陷
(A) 使用指定方案获得的野生型与ISL1敲除心脏类器官整体标本图像;刻度尺,500毫米
(B) 指定条件下的免疫染色冷冻切片
(C)RNA测序表达热图,显示ISL1基因敲除(ISL1-KO)心脏类器官与野生型(WT)相比的表达异常基因。
(D)野生型(WT)与ISL1-KO心房/流出道(A/OFT)心脏类器官的免疫染色结果
(E)A/OFT WT与ISL1-KO心脏类器官的收缩功能分析
生物学重复数 ,技术重复数 。
(F)指定条件下全局基因表达差异的RNA测序火山图
(G)指定标志物的RNA原位杂交(RNA-scope)染色结果
(H、H⁰)TBX5基因敲除(TBX5-KO)与WT心脏类器官分析
(H)代表性整装成像结果;(H⁰)面积量化分析(,)。比例尺为 (原文“500 mL”为笔误,根据上下文修正)。
(I、J)指定类型心脏类器官的免疫染色冰冻切片结果
(K)指定发育相关差异表达基因的RNA测序表达热图
(L、O)指定条件下的时序整装成像结果
比例尺为 (原文“mm”为笔误,根据上下文修正)。
(M)指定标志物基因表达异常的RNA测序表达热图
(N)指定条件下的代表性实时荧光定量PCR(RT-qPCR)结果
(P)指定类型的收缩功能分析
,;标注检测天数(D)。
数据说明与统计规范
- 数据转换:vst = 方差稳定转换计数(variance-stabilized transformed counts)
- 比例尺:除特殊标注外,均为 \boldsymbol
- 柱状图数据表示:平均值标准差(SD)
- 统计学方法:单因素方差分析(one-way ANOVA)
- 显著性标识:;;;; 表示无统计学差异
- 注释: = 生物学重复数; = 技术重复数
另见附图S6。
已知ISL1基因突变会导致小鼠流出道和右心室严重心脏畸形、心房部分缺损,并在胚胎期10.5天致死39。在2.5至9.5天的时间序列分析中,我们观察到ISL1敲除类心脏器官在5.5天时出现流出道/心房类心脏器官的腔形态发生和尺寸严重受损,而对右心室类心脏器官的影响较为轻微(图S6D)。至9.5天时,敲除组与野生型在所有类心脏器官亚型中均呈现显著尺寸差异(图6A和S6E)。基因表达在3.5天即已受影响,表现为MEF2C和MYOCD水平降低,提示分化进程异常(图S6B)40。流出道类心脏器官显示出最显著的基因表达变化,HAND2与BMP4下调而TBX5上调(图S6B)39。心房类心脏器官中pSHF标志物HOXB1表达下调(图S6B),而NR2F2、RSPO3、WNT5A和MYL7在9.5天时所有亚型中均出现表达紊乱(图6C)。敲除右心室类心脏器官的心肌分化效率严重受损,心房/流出道类心脏器官明显降低,左心室受影响较小(图6B)。虽然心房类心脏器官仍保持其身份特征,但存在分化延迟和收缩启动滞后(图6B-6D和S6C),而流出道类心脏器官则整体向心房身份特征( 、HEY 和WNT5A )发生基-因表达转变(图6D、6F和S6F)41,42。与基因表达分析一致,多数ISL1敲除流出道类心脏器官在14天时启动搏动,其频率与心房类心脏器官相近(图6E)。由此可见,类心脏器官平台成功模拟了体内ISL1敲除的区室特异性缺陷,为在更高分辨率下开展人类特异性自主机制研究提供了条件。
TBX5, 另一个重要的心脏转录因子,是FHF和pSHF祖细胞中的关键调节因子,负责驱动心室基因表达程序。43,44 TBX5的突变导致心房和心室间隔缺损以及传导障碍,并与Holt-Oram综合征患者相关。43 当我们分化TBX5-KO心脏类器官时,第3.5天的全局基因表达分析显示,aSHF标记在TBX5-KO A/AVC心脏类器官中上调,而pSHF特异性基因HOXB1表达下调,与体内研究结果一致(图6G和S6H )44。TBX5基因敲除左心室类心脏器官中HAND2与FGF10表达上调,NKX2-5和GATA4表达下调(图S6H)。相比之下,敲除右心室类器官除第3.5天出现FOXC2上调外未见主要异常(图S6H)。至第9.5天,我们观察到左心室/房室沟类器官出现严重的形态发生缺陷(图6H、6H及S6H),其中房室沟心肌细胞未能正常分化(图6I)。TBX5敲除的左心室/右心室/心房类器官主要表现为心肌细胞分化效率低下,伴随TNNT2及腔室特异性标志物NPPA的表达下调(图6I-6K)。所有TBX5敲除类心脏器官亚型均出现心室腔室标志物表达显著缺陷,其中敲除右心室/左心室类器官中非腔室标志物TBX2与WNT5A表达上调(图6K),这与体内实验现象相似45。此外,TBX5敲除类器官在所有亚型和时间点均丧失自发收缩功能(图S6I)。总体而言,TBX5敲除在不同阶段呈现特异性表型:左心室/心房/房室沟类器官在祖细胞阶段已受影响,而右心室类器官则在心肌细胞特化阶段呈现轻微表型。
最后,FOXF1是pSHF谱系的特异性调节因子;其突变会导致心房分隔缺陷,而基因敲除(KO)小鼠因胚外中胚层缺陷在E8.0早期死亡,阻碍了对心脏表型的进一步研究46,47。当我们分析FOXF1-KO类心脏亚型时,观察到第3.5天A类心脏出现更早的空腔形态发生(图S6J,黄色箭头)。相比之下,KO-AVC类心脏未能形成完整空腔(图6L和S6L)。主要pSHF标记物(HOXB1和OSR1)及AVC标记物(TBX2和TBX3)在FOXF1-KO类心脏中表达下调(图6M和6N),这与pSHF特化失败相一致。在KO-LV/RV类心脏中仅少数基因在第3.5天出现异常调控,包括PITX2和TBX1分别上调(图6M)。至第9.5天,KO-LV/AVC类心脏体积较小(图6O和S6K)。值得注意的是,KO-A类心脏获得了更多心室特性并形成更发达的空腔,而KO-AVC类心脏则未能有效分化(图S6L–S6N)。正如预期,除所有亚型中NPPA表达下调外,我们在KO-RV/OFT类心脏中未观察到严重表型(图6O、S6L和S6M)。KO-LV类心脏表型较轻,其中参与心脏收缩的基因(ENO1)表达下调(图S6M),导致搏动频率降低(图6P)。KO-A类心脏同样显示较低搏动频率,而KO-AVC心形细胞在第6.5天未发生收缩(图6P)。这些结果表明FOXF1具有区域特异性作用,尤其在pSHF谱系中,在A区与AVC类心脏组织中展现出差异性效应。总体而言,类心脏平台可用于解析人类心脏在特定发育阶段、特定区域中关于细胞定向、形态发生和功能方面的遗传缺陷,且不受胚胎中代偿机制的影响。
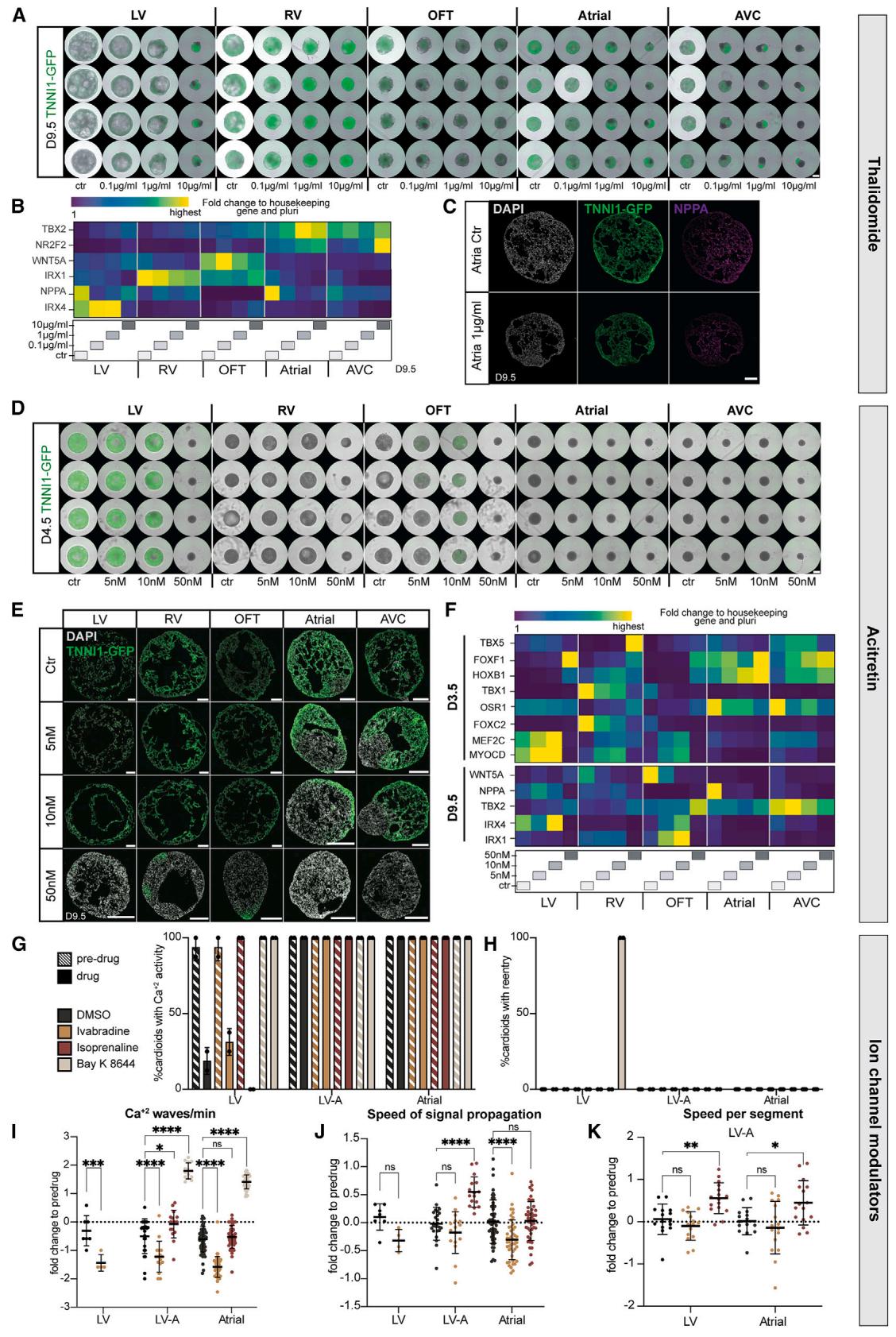
图7 用于筛选致畸剂/药物诱导心脏缺陷的多腔室心脏类器官平台
(A–F)致畸剂处理实验:所有心脏类器官从第0天开始接受致畸剂处理至第9.5天。Ctr = 对照组(control)。
- (A)人多能干细胞(hPSC)-TNNI1-绿色荧光蛋白(GFP)来源心脏类器官在指定条件下的代表性整装成像结果。比例尺为 (原文“mm”为笔误,根据上下文修正)。
- (B)沙利度胺(thalidomide)处理后心脏类器官的代表性实时荧光定量PCR(RT-qPCR)结果,展示谱系特异性基因表达。
- (C)沙利度胺处理的心房(A)心脏类器官冰冻切片免疫染色结果。
- (D)阿维A酯(acitretin)处理的hPSC-TNNI1-GFP来源不同亚型心脏类器官代表性整装成像结果。比例尺为 。
- (E)阿维A酯处理的hPSC-TNNI1-GFP来源不同亚型心脏类器官冰冻切片结果。
- (F)阿维A酯处理后心脏类器官的代表性RT-qPCR结果。
(G–K)指定心脏类器官亚型的钙信号(Ca²⁺)分析:第9.5天分别检测给药前(pre-drug)和给药后(drug)的信号变化,药物包括二甲基亚砜(DMSO,对照组)、伊伐布雷定(ivabradine)、异丙肾上腺素(isoprenaline)和Bay K 8644;生物学重复数 ,技术重复数 ;传导速度分析排除标准详见附表S3。
- (G)具有钙活性的心脏类器官百分比;数据点代表生物学重复(N)。
- (H)出现钙重入现象的心脏类器官百分比;数据点代表生物学重复(N)。
- (I)每分钟钙波次数相对于给药前的倍数变化;数据点代表技术重复(n)。
- (J)信号传导速度相对于给药前的倍数变化;数据点代表技术重复(n)。
- (K)各节段传导速度相对于给药前的倍数变化;数据点代表技术重复(n)。
实验参数与统计规范
- 所用干细胞系:WTC11人多能干细胞
- 标注检测天数(D)
- 比例尺:除特殊标注外,均为 \boldsymbol
- 柱状图数据表示:平均值标准差(SD)
- 统计学方法:单因素方差分析(one-way ANOVA)
- 显著性标识:;;;; 表示无统计学差异
- 注释: = 生物学重复数; = 技术重复数
另见附图S7。
¶ 致畸剂与药物效应综合筛选平台
除遗传起源外,先天性心脏缺陷也可能由致畸剂(如药物、毒素、代谢物)引起。48 目前我们仍缺乏能够以高通量且易于量化的方式研究致畸剂是否导致特定心脏区室缺陷的人类研究体系。49我们首先证实非致畸性药物阿司匹林不会引起任何形态学或显著的基因表达差异(图S7A和S7B)。49,50 接着我们测试了沙利度胺——这种对人类(而非啮齿类)具有明确致畸性、会干扰TBX5功能并引发严重心脏与肢体缺陷的化合物。51,52 利用类心脏平台,我们解析了沙利度胺在人体血浆浓度范围内的作用53,首次观察到其对房室沟区室的显著影响、左/右心室类心脏的中间表型,以及对心房/流出道类心脏的细微作用(图7A与S7G)。基因表达谱与免疫染色显示,除右心室和流出道外,所有细胞谱系中TBX5靶标NPPA均下调,并发现区室标识标记物NR2F2、IRX1和IRX4出现剂量特异性失调(图7B与7C)。
接下来,我们研究了维甲酸衍生物——这类用于治疗白血病、银屑病和痤疮的化合物,它们也是已知会诱发先天性缺陷(特别是房室通道和流出道衍生物畸形)的另一类物质。由于视黄酸在心脏发育过程中起着关键作用,我们预计类心脏器官平台能够帮助解析其潜在的阶段特异性机制。当我们测试阿维A和异维A酸时(数据未显示),发现极低剂量就会引发严重的区室特异性和阶段特异性效应。经阿维A处理后,流出道/心房/房室通道类心脏器官在特化、模式形成和形态发生方面均出现缺陷(图7D、7E、S7C和S7C)。出乎意料的是,在使用反式视黄醇时,我们仅在OFT心形细胞中观察到显著的形态学效应,而其他所有亚型均未受影响(图S7E和S7E0)。在OFT心形细胞中,视黄醇类化合物导致OFT基因下调,同时上调心室基因(而非心房基因)(图7F和S7F)。此外,经类视黄醇处理的流出道心脏类器官更早分化为心肌细胞(图7D和S7D)。这些数据表明,心脏类器官系统对不同类视黄醇化合物的敏感性令人惊讶,呈现出药物特异性及区域特异性的效应。
最后,我们考虑该多腔室平台可用于测试药物对单个或相互作用的类心脏组织的影响,因为目前这类研究方法有限,尽管迫切需要预防发育中胎儿因药物引起的电化学扰动。首先,我们确认MEA三腔室类心脏分析原则上可用于检测钾通道调节剂4AP处理后延长的场电位(图S7H和S7I)。为提高通量,我们重点测量了经不同电生理调节剂(如伊伐布雷定(HCN4通道阻滞剂)、异丙肾上腺素(刺激β-肾上腺素能受体)和Bay K 8644(刺激L型钙通道))处理的A腔、LV腔及双腔LV-A类心脏的 信号传导。虽然LV类心脏的 活性受药物溶剂DMSO影响,并在BayK 8644存在下出现异常的 信号再进入现象,但A/LV-A类心脏未受此类影响(图7G和7H)。相反,Bay K 8644能同时刺激A和LV-A类心脏的搏动,而伊伐布雷定可降低所有亚型的搏动频率(图7I)。值得注意的是,异丙肾上腺素能提高LV-A类心脏两个亚区域的 信号传导速度,但对单腔类心脏无此效果(图7J和7K)。伊伐布雷定则呈现相反效应:单个A类心脏受影响而LV-A类心脏不受影响。因此,该平台使我们能够在单个类心脏、相互作用的亚区域以及整个多腔室类心脏中筛选特定药物效应。
综上所述,这些结果验证了我们在人类多分区心脏平台中能够识别突变的早期发育效应、已知致畸性和致心律失常性药物及治疗剂的作用,并将其与临床观察到的心脏缺陷相关联。因此,我们的研究对从治疗开发到环境研究等不同背景下的人类心脏生物学效应研究具有广泛意义。
¶ 讨论
近期,已有数种自组装人源心脏模型被报道,包括心脏类器官和心内胚层类器官。54–58 由于早期研究未能明确其与前心外膜侧板(aSHF)、后心外膜侧板(pSHF)及第一心区(FHF)谱系的关联,导致心脏细胞类型的身份认定与生理功能始终存疑。因此,不同心肌细胞亚型的比例、异质性及其体外形成结构的可控性难以保障,也无法与活体心脏建立有效关联。为补充胚胎金标准模型的不足,我们验证了该平台具有多功能性、高效性、可重复性及多细胞系兼容性特点,并可通过单腔室或多腔室心脏类器官实现多种读数指标的高通量筛选(包括钙瞬变2+、收缩影像、FluoVolt电压传感、微电极阵列、形态学及基因表达)。
多份报告描述了从hPSCs分化的心房和心室心肌细胞,但这些细胞究竟来源于FHF、aSHF还是pSHF谱系尚未明确41,59。在体内环境中,信号分子的剂量与作用时机相互协调,在中胚层诱导阶段驱动谱系特异性分化——随着中胚层细胞在不同时间点迁移,它们会在心场中占据特定位置。我们发现,Activin/Nodal、WNT、BMP和RA信号通路的阶段特异性表达水平,能够指导细胞分化为与胚胎前部区域信号环境一致的特定SHF、AVC和FHF祖细胞,该结论也与近期体外研究结果相吻合14,15,60。特别值得注意的是,抑制Activin/Nodal信号通路对决定SHF谱系命运选择至关重要,这一点在既往体内外研究中均未得到重视。我们还发现RA信号通路在剂量与时间维度上的作用机制比以往认知更为复杂41,59:外源性RA信号缺失对初始aSHF特化和后期OFT分化至关重要,低浓度RA促进左心室特化,高浓度RA则分别调控早期心房和后期右心室特化。因此,唯有采用高度特异性的中胚层诱导与模式信号组合,才能模拟发育中心脏谱系的身份特征、(形态发生的)动态过程及后期功能,从而实现对祖细胞分选及心腔相互作用机制的控制与解析。
在心脏发育的最初阶段,包括心脏中胚层特化、形态发生和功能分化过程中,心脏谱系间的相互作用 notoriously难以分析,且在人类胚胎中难以观察。此外,对人类胚胎发育的研究揭示了关键发育与功能基因表达模式存在日益增多的物种间差异。38,61,62这些方面对于理解突变和致畸剂对人类早期心脏发育的特异性影响及其导致胚胎衰竭的机制至关重要。我们工作的重大进展在于采用深度综合表型分析技术,系统探索了心脏发生早期阶段收缩信号传导、分化速度、特化方向、效率及形态发生的本体论。这对于解明某些胚胎性心脏衰竭病例尤为重要——这些病例以往被归因于特化与形态发生异常,但实际可能是心腔间早期收缩信号传导缺陷所致。
总之,尽管经过数十年的实验与临床研究,大多数心脏缺陷的根本原因仍不明确。潜在的罪魁祸首包括尚未识别的突变调控元件,如增强子;环境因素,如污染物;以及遗传因素与环境因素之间更复杂的相互作用,包括药物和饮食。过去,我们缺乏一个能在人类背景下高通量测试所有这些选项的系统,且涵盖所有心脏腔室。而多腔心形平台将使我们能够填补这一空白。
¶ 研究的局限性
尽管心形系统具有实用性,但在当前发展阶段仍存在若干局限。本研究重点关注人类胚胎心脏早期特化、形态发生及信号收缩传播的综合建模。然而,我们尚未对诸如前/后第二心区祖细胞迁移、心脏环化等过程进行建模,也未涉及与内胚层的相互作用—对于这些环节,其他互补性体外系统可能更适合与胚胎进行比对研究。54,57,63
心脏发育的后期阶段和过程尚未在心脏类器官中再现,包括瓣膜形成、分隔、起搏器发育、心室肌小梁形成与球囊样扩张、冠状血管系统与循环建立,以及心脏的整体生长与成熟24。因此,目前多腔平台主要通过对影响早期发育阶段的突变和致畸剂进行验证,同时为后续发展奠定坚实基础。
¶ STAR+方法
本文在线版本提供了详细方法,包括以下内容:
关键资源表
d 资源可用性
B 主要联系人
B 材料可用性
B 数据和代码可用性
d 实验模型与研究参与者详情
B 人多能干细胞系 方法详情
B hPSC培养
B ISL1、TBX5和FOXF1基因敲除hPSCs的构建
B 类心脏器官生成
B 类心脏器官亚型分化
B 心房腔室特化方案
B 心室成熟方案
B 二维内皮细胞分化
B 使用EMT促进因子处理流出道类心脏器官
B 平滑肌细胞分化
B 祖细胞混合
B 多腔室类心脏器官的构建
B 多腔室类心脏器官模具
B 类心脏器官总细胞数与细胞大小分析
B 冰冻切片
B 免疫染色
B RNAscope与原位杂交链式反应
B 图像采集与分析
B 流式细胞术
B RNA提取与批量RNA-seq样本制备
B 实时定量聚合酶链反应
B 单细胞RNA-seq样本制备
B 收缩力分析
B 钙瞬变– 细胞系构建与成像
B 单心肌细胞膜片钳记录
B 光学动作电位
B 多电极阵列(MEA)
¶ 包容与多样性
我们通过细胞系的选择来确保实验样本的多样性。在引用与本工作科学相关的参考文献时,也积极推动参考文献列表中的性别均衡。
收到日期:2022年7月12日
修订日期:2023年7月31日
接受日期:2023年10月30日
发布日期:2023年11月28日
d 量化与统计分析
B 排序量化程度
B 批量RNA-seq分析
B 单细胞RNA-seq分析
B 单细胞RNA-seq与体内心脏胚胎腔室数据集整合
B 单细胞RNA-seq与体内OFT数据集整合
B 钙离子 瞬变量化 BMEA数据分析
B 统计学分析
¶ 补充信息
补充信息可在 https://doi.org/10.1016/j.cell.2023.10.030 在线获取。
¶ 参考文献
-
van der Linde, D., Konings, E.E.M., Slager, M.A., Witsenburg, M., Helbing, W.A., Takkenberg, J.J.M., & Roos-Hesselink, J.W. (2011). 全球先天性心脏病出生患病率:系统回顾与荟萃分析. 美国心脏病学会杂志 (Journal of the American College of Cardiology), 58, 2241–2247. https://doi.org/10.1016/j.jacc.2011.08.025.
-
Jin, S.C., Homsy, J., Zaidi, S., Lu, Q., Morton, S., DePalma, S.R., Zeng, X., Qi, H., Chang, W., Sierant, M.C., et al. (2017). 2,871名先天性心脏病先证者中罕见遗传性与新生变异的贡献分析. 自然·遗传学 (Nature Genetics), 49(1), 25–33. https://doi.org/10.1038/ng.3970.
-
Fahed, A.C., Gelb, B.D., Seidman, J.G., & Seidman, C.E. (2013). 先天性心脏病的遗传学:半空的玻璃杯. 循环研究 (Circulation Research), 112, 707–720. https://doi.org/10.1161/CIRCRESAHA.112.300853.
-
Zaidi, S., & Brueckner, M. (2017). 先天性心脏病的遗传学与基因组学研究. 循环研究 (Circulation Research), 120, 923–940. https://doi.org/10.1161/CIRCRESAHA.116.309140.
-
González-Tran, B., Pitman, M., Felix, F., Thomas, R., Richmond-Bucala, D., Hüttner, R., Chaudhry, K., Moroni, E., Costa, M.W., Huang, Y., et al. (2022). 转录因子蛋白互作组揭示心脏病的遗传决定因素. 细胞 (Cell), 185, 794–814.e30. https://doi.org/10.1016/j.cell.2022.01.021.
-
Kathiresan, S., & Srivastava, D. (2012). 人类心血管疾病的遗传学. 细胞 (Cell), 148, 1242–1257. https://doi.org/10.1016/j.cell.2012.03.001.
-
Srivastava, D. (2021). 利用类器官构建人类心脏腔室模型. 新英格兰医学杂志 (The New England Journal of Medicine), 385, 847–849. https://doi.org/10.1056/NEJMcibr2108627.
-
Hofbauer, P., Jahnel, S.M., & Mendjan, S. (2021). 人类心脏的体外模型. 发育 (Development), 148, dev199672. https://doi.org/10.1242/dev.199672.
-
Kim, H., Kamm, R.D., Vunjak-Novakovic, G., & Wu, J.C. (2022). 多细胞人类心脏类器官在临床应用中的进展. 细胞·干细胞 (Cell Stem Cell), 29, 503–514. https://doi.org/10.1016/j.stem.2022.03.012.
-
Kelly, R.G., Buckingham, M.E., & Moorman, A.F. (2014). 心脏场与心脏形态发生. 冷泉港医学展望 (Cold Spring Harbor Perspectives in Medicine), 4, a015750. https://doi.org/10.1101/cshperspect.a015750.
-
Meilhac, S.M., & Buckingham, M.E. (2018). 哺乳动物心脏形成过程中细胞谱系的部署. 自然综述:心脏病学 (Nature Reviews Cardiology), 15, 705–724. https://doi.org/10.1038/s41569-018-0086-9.
-
Bruneau, B.G. (2013). 心脏发育和再生中的信号传导与转录网络. 冷泉港生物学展望 (Cold Spring Harbor Perspectives in Biology), 5, a008292. https://doi.org/10.1101/cshperspect.a008292.
-
Christoffels, V.M., & Jensen, B. (2020). 心脏形态发生:四腔室心脏的特化机制. 冷泉港生物学观点 (Cold Spring Harbor Perspectives in Biology), 12, a037143. https://doi.org/10.1101/cshperspect.a037143.
-
Arkell, R.M., & Tam, P.P.L. (2012). 启动小鼠胚胎头部发育:信号传导与转录活动的整合. 开放生物学 (Open Biology), 2, 120030. https://doi.org/10.1098/rsob.120030.
-
Nandkishore, N., Vyas, B., Javali, A., Ghosh, S., & Sambasivan, R. (2018). 早期中胚层特化的差异性决定脊椎动物头颈部与躯干肌肉程序的独特性. 发育 (Development), 145, dev160945. https://doi.org/10.1242/dev.160945.
-
Hofbauer, P., Jahnel, S.M., Papai, N., Giesshammer, M., Deyett, A., Schmidt, C., Penc, M., Tavernini, K., Grdseloff, N., Meledeth, C., et al. (2021). 心脏类器官揭示人类心脏发生的自组织原理. 细胞 (Cell), 184, 3299–3317.e22. https://doi.org/10.1016/j.cell.2021.04.034.
-
Bothe, I., Tenin, G., Oseni, A., & Dietrich, S. (2011). 头部中胚层模式形成的动态调控. 发育 (Development), 138, 2807–2821. https://doi.org/10.1242/dev.062737.
-
Ghyselinck, N.B., & Duester, G. (2019). 视黄酸信号通路. 发育 (Development), 146, dev167502. https://doi.org/10.1242/dev.167502.
-
Schmidt, C., Deyett, A., Ilmer, T., Caballero, A.T., Haendeler, S., Pimpale, L., Netzer, M.A., Ginistrelli, L.C., Cirigliano, M., Mancheno, E.J., et al. (2022). 多腔室心脏类器官揭示人类心脏发育与心脏缺陷. bioRxiv. https://doi.org/10.1101/2022.07.14.499699.
-
Ivanovitch, K., Soro-Barrio, P., Chakravarty, P., Jones, R.A., Bell, D.M., Gharavy, S.N.M., Stamataki, D., Delile, J., Smith, J.C., & Briscoe, J. (2021). 心室、心房与流出道心脏祖细胞起源于原始条纹在空间和分子上不同的区域. bioRxiv, 489–497. https://doi.org/10.1101/2020.07.12.198994.
-
Cortes, C., Francou, A., De Bono, C., & Kelly, R.G. (2018). 第二心区的上皮特性. 循环研究 (Circulation Research), 122, 142–154. https://doi.org/10.1161/CIRCRESAHA.117.310838.
-
Feyen, D.A.M., McKeithan, W.L., Bruyneel, A.A.N., Spiering, S., Hörmann, L., Ulmer, B., Zhang, H., Briganti, F., Schweizer, M., Hegyi, B., et al. (2020). 代谢成熟培养基改善人iPSC来源心肌细胞的生理功能. 细胞报告 (Cell Reports), 32, 107925. https://doi.org/10.1016/j.celrep.2020.107925.
-
Garay, B.I., Givens, S., Abreu, P., Liu, M., Yücel, D., Baik, J., Stanis, N., Rothermel, T.M., Magli, A., Abrahante, J.E., et al. (2022). 双重抑制MAPK和PI3K/AKT通路可增强人iPSC来源心肌细胞的成熟度. 干细胞报告 (Stem Cell Reports), 17, 2005–2022. https://doi.org/10.1016/j.stemcr.2022.07.003.
-
Karbassi, E., Fenix, A., Marchiano, S., Muraoka, N., Nakamura, K., Yang, X., & Murry, C.E. (2020). 心肌细胞成熟:认知进展与再生医学意义. 自然·心脏病学综述 (Nature Reviews Cardiology), 17, 1–19. https://doi.org/10.1038/s41569-019-0331-x.
-
Majesky, M.W. (2007). 血管平滑肌多样性的发育基础. 动脉硬化、血栓与血管生物学 (Arteriosclerosis, Thrombosis, and Vascular Biology), 27, 1248–1258. https://doi.org/10.1161/ATVBAHA.107.141069.
-
Asp, M., Giacomello, S., Larsson, L., Wu, C., Fürth, D., Qian, X., Wärdell, E., Custodio, J., Reimegård, J., Salmén, F., et al. (2019). 发育中人类心脏的时空全器官基因表达与细胞图谱. 细胞 (Cell), 179, 1647–1660.e19. https://doi.org/10.1016/j.cell.2019.11.025.
-
Lawson, K.A., Meneses, J.J., & Pedersen, R.A. (1991). 小鼠胚胎胚层形成期间上胚层命运的克隆分析. 发育 (Development), 113, 891–911.
-
Tam, P.P., Parameswaran, M., Kinder, S.J., & Weinberger, R.P. (1997). 上胚层细胞向胚胎心脏及其他中胚层谱系的分配:原肠形成过程中内迁与组织运动的作用. 发育 (Development), 124, 1631–1642. https://doi.org/10.1242/dev.124.9.1631.
-
Sahara, M., Santoro, F., Sohlmér, J., Zhou, C., Witman, N., Leung, C.Y., Mononen, M., Bylund, K., Gruber, P., & Chien, K.R. (2019). 人类心脏发生的群体与单细胞分析揭示胚胎流出道中独特的LGR5心室祖细胞. 发育细胞 (Developmental Cell), 48, 475–490.e7. https://doi.org/10.1016/j.devcel.2019.01.005.
-
van Weerd, J.H., & Christoffels, V.M. (2016). 心脏传导系统的形成与功能. 发育 (Development), 143, 197–210. https://doi.org/10.1242/dev.124883.
-
Koopman, C.D., De Angelis, J., Iyer, S.P., Verkerk, A.O., Da Silva, J., Berecki, G., Jeanes, A., Baillie, G.J., Paterson, S., Uribe, V., et al. (2021). 斑马鱼grime突变体揭示Tmem161b在心律控制中的进化保守作用. 美国国家科学院院刊 (Proceedings of the National Academy of Sciences of the United States of America), 118, e2018220118. https://doi.org/10.1073/pnas.2018220118.
-
Christoffels, V.M., Smits, G.J., Kispert, A., & Moorman, A.F.M. (2010). 心脏起搏器组织的发育. 循环研究 (Circulation Research), 106, 240–254. https://doi.org/10.1161/CIRCRESAHA.109.205419.
-
Christoffels, V.M., & Moorman, A.F.M. (2009). 心脏传导系统的发育:为何心脏某些区域更易发生心律失常? 循环:心律失常与电生理学 (Circulation: Arrhythmia and Electrophysiology), 2, 195–207. https://doi.org/10.1161/CIRCEP.108.829341.
-
Verkerk, A.O., Marshall, G.A., Zeegers, J.G., Kawasaki, M., Driessen, A.H.G., Remme, C.A., De Groot, J.R., & Wilders, R. (2021). 人心房肌细胞动作电位的膜片钳记录:通过动态钳技术实现优化. 药理学前沿 (Frontiers in Pharmacology), 12, 649414. https://doi.org/10.3389/fphar.2021.649414.
-
Watanabe, M., Rawlins, A.M., Polo-Parada, L., Ma, P., Gu, S., & Jenkins, M.W. (2016). 发育中心脏电生理特性研究. 心血管发育与疾病杂志 (Journal of Cardiovascular Development and Disease), 3, 10. https://doi.org/10.3390/jcdd3010010.
-
Tyser, R.C.V., & Srinivas, S. (2020). 首次心跳的起源:心脏收缩活动. 冷泉港生物学展望 (Cold Spring Harbor Perspectives in Biology), 12, a037135. https://doi.org/10.1101/cshperspect.a037135.
-
Tyser, R.C., Miranda, A.M., Chen, C.-M., Davidson, S.M., Srinivas, S., & Riley, P.R. (2016). 钙信号调控先于心脏分化并触发首次心跳. eLife, 5, e17113. https://doi.org/10.7554/eLife.17113.
-
Rossant, J., & Tam, P.P.L. (2022). 人类早期胚胎发育:从囊胚形成至原肠胚形成. 发育细胞 (Developmental Cell), 57, 152–165. https://doi.org/10.1016/j.devcel.2021.12.022.
-
Cai, C.-L., Liang, X., Shi, Y., Chu, P.-H., Pfaff, S.L., Chen, J., & Evans, S. (2003). Isl1鉴定了一个心脏祖细胞群体,该群体在分化前增殖,并为心脏提供了大部分细胞. 发育细胞 (Developmental Cell), 5, 877–889. https://doi.org/10.1016/s1534-5807(03)0029
-
Gao, R., Liang, X., Chedipudi, S., Cordero, J., Jiang, X., Zhang, Q., Caputo, L., Gunter, S., Kune, C., Ren, Y., et al. (2019). Isl1在心肌细胞命运表观遗传调控中的先驱功能. 细胞研究 (Cell Research), 29, 486–501. https://doi.org/10.1038/s41422-019-0168-1.
-
Devalla, H.D., Schwach, V., Ford, J.W., Milnes, J.T., El-Haou, S., Jackson, C., Gkatzis, K., Elliott, D.A., Chuva de Sousa Lopes, S.M., Mummery, C.L., et al. (2015). 源自人多能干细胞的心房样心肌细胞是评估心房选择性药理作用的稳健临床前模型. EMBO分子医学 (EMBO Molecular Medicine), 7, 394–410. https://doi.org/10.15252/emmm.201404757.
-
Quaranta, R., Fair, J., Rühle, F., Rao, J., Piccini, I., Araúzo-Bravo, M.J., Falk, A.O., Stölzl, M., & Greber, B. (2018). 在基于人类胚胎干细胞的模型中对ISL1在人类心腔规格中的修订作用. eLife, 7, e31706. https://doi.org/10.7554/eLife.31706.
-
Bruneau, B.G., Nemer, G., Schmitt, J.P., Charron, F., Robitaille, L., Caron, S., Conner, D.A., Gessler, M., Nemer, M., Seidman, C.E., et al. (2001). 霍尔特-奥拉姆综合征小鼠模型揭示T-box转录因子Tbx5在心脏发育与疾病中的作用. 细胞 (Cell), 106, 709–721. https://doi.org/10.1016/S0092-8674(01)00460-8.
-
Xie, L., Burnicka-Turek, O., Friedland-Little, J.M., Zhang, K., & Moskowitz, I.P. (2012). Tbx5-hedgehog分子网络在第二心场中对心房分隔是必需的. 发育细胞 (Developmental Cell), 23, 280–291. https://doi.org/10.1016/j.devcel.2012.06.006.
-
Bruneau, B.G., Logan, M., Davis, N., Levi, T., Tabin, C.J., Seidman, J.G., & Seidman, C.E. (1999). Tbx5的心腔特异性心脏表达与霍尔特-奥拉姆综合征的心脏缺陷. 发育生物学 (Developmental Biology), 211, 100–108. https://doi.org/10.1006/dbio.1999.9298.
-
Hoffmann, A.D., Yang, X.H., Burnicka-Turek, O., Bosman, J.D., Ren, X., Steimle, J.D., Vokes, S.A., McMahon, A.P., Kalinichenko, V.V., & Moskowitz, I.P. (2014). Foxf基因在第二心脏区整合Tbx5与hedgehog信号通路参与心脏隔膜形成. 公共科学图书馆·遗传学 (PLOS Genetics), 10, e1004604. https://doi.org/10.1371/journal.pgen.1004604.
-
Kang, J., Nathan, E., Xu, S.M., Tzahor, E., & Black, B.L. (2009). Isl1是第二心脏来源中胚层中Forkhead转录因子的直接转录靶标. 发育生物学 (Developmental Biology), 334, 513–522. https://doi.org/10.1016/j.ydbio.2009.06.041.
-
Kalisch-Smith, J.I., Ved, N., & Sparrow, D.B. (2020). 先天性心脏病的环境风险因素. 冷泉港生物学展望 (Cold Spring Harbor Perspectives in Biology), 12, a037234. https://doi.org/10.1101/cshperspect.a037234.
-
Mantziou, V., Baillie-Benson, P., Jaklin, M., Kustermann, S., Arias, A.M., & Moris, N. (2021). 利用3D类胚胎胃育系统进行体外致畸性测试. 生殖毒理学 (Reproductive Toxicology), 105, 72–90. https://doi.org/10.1016/j.reprotox.2021.08.003.
-
van Meer, B.J., Krotenberg, A., Sala, L., Davis, R.P., Eschenhagen, T., Denning, C., Tertoolen, L.G.J., & Mummery, C.L. (2019). 兴奋-收缩偶联参数同步测量鉴定hiPSC来源心肌细胞收缩反应机制. 自然通讯 (Nature Communications), 10, 4325. https://doi.org/10.1038/s41467-019-12354-8.
-
Yamanaka, S., Murai, H., Saito, D., Abe, G., Tokunaga, E., Iwasaki, T., Takahashi, H., Takeda, H., Suzuki, T., Shibata, N., et al. (2021). 沙利度胺及其代谢物5-羟基沙利度胺通过cereblon新底物PLZF诱导致畸性. EMBO杂志 (The EMBO Journal), 40, e105375. https://doi.org/10.15252/embj.2020105375.
-
Khalil, A., Tanos, R., El-Hachem, N., Kurban, M., Bouvagnet, P., Bitar, F., & Nemer, G. (2017). HAND与TBX5相互作用揭示沙利度胺与心脏疾病的关联. 科学报告 (Scientific Reports), 7, 1416. https://doi.org/10.1038/s41598-017-01641-3.
-
Bai, N., Cui, X.-Y., Wang, J., Sun, C.-G., Mei, H.-K., Liang, B.-B., Cai, Y., Song, X.-J., Gu, J.-K., & Wang, R. (2013). 液相色谱-串联质谱法测定人血浆中沙利度胺浓度. 实验与治疗医学 (Experimental and Therapeutic Medicine), 5, 626–630. https://doi.org/10.3892/etm.2012.847.
-
Drakhlis, L., Biswanath, S., Farr, C.-M., Lupanow, V., Teske, J., Ritzenhoff, K., Franke, A., Manstein, F., Bolesani, E., Kempf, H., et al. (2021). 人类心脏形成类器官重现早期心脏与前肠发育. 自然生物技术 (Nature Biotechnology), 40, 210–246. https://doi.org/10.1038/s41587-021-00815-9.
-
Feng, W., Schriever, H., Jiang, S., Bais, A., Wu, H., Kostka, D., & Li, G. (2022). hiPSC来源心脏类器官的计算分析揭示NKX2-5缺陷相关的心腔异常. 通讯生物学 (Communications Biology), 5, 399. https://doi.org/10.1038/s42003-022-03346-4.
-
Lewis-Israeli, Y.R., Wasserman, A.H., Gabalski, M.A., Volmert, B.D., Ming, Y., Ball, K.A., Yang, W., Zou, J., Ni, G., Pajares, N., et al. (2021). 自组装人类心脏类器官用于心脏发育与先天性心脏病建模. 自然通讯 (Nature Communications), 12, 5142. https://doi.org/10.1038/s41467-021-25329-5.
-
Silva, A.C., Matthys, O.B., Joy, D.A., Kauss, M.A., Natarajan, V., Lai, M.H., Turaga, D., Alexanian, M., Bruneau, B.G., & McDevitt, T.C. (2020). 人类iPSC来源类器官模拟心脏与肠道组织的协同发育. bioRxiv. https://doi.org/10.1101/2020.04.30.071472.
-
Meier, A.B., Zawada, D., De Angelis, M.T., Martens, L.D., Santamaria, G., Zengerle, S., Nowak-Imialek, M., Kornherr, J., Zhang, F., Tian, Q., et al. (2023). 心外膜类器官单细胞基因组学揭示人类心外膜在心脏发育与疾病中的生物学规律. 自然-生物技术 (Nature Biotechnology), 41, 1–14. https://doi.org/10.1038/s41587-023-01718-7.
-
Lee, J.H., Protze, S.I., Laksman, Z., Backx, P.H., & Keller, G.M. (2017). 人类多能干细胞分化的心房和心室心肌细胞来源于不同的中胚层群体. 干细胞 (Stem Cells), 35, 179–194.e4. https://doi.org/10.1016/j.stem.2017.07.003.(注:原文期刊标注为“干细胞 21”,根据DOI修正为卷35,2017年对应卷期)
-
Yang, D., Gomez-Garcia, J., Funakoshi-Yamamoto, S., Tran, T., Fernandes, I., Bader, G.D., Laflamme, M.A., & Keller, G.M. (2022). 利用多能干细胞模拟人多谱系心区发育. 细胞干细胞 (Cell Stem Cell), 29, 1382–1401.e8. https://doi.org/10.1016/j.stem.2022.08.007.
-
Cui, Y., Zheng, Y., Liu, X., Yan, L., Fan, X., Yong, J., Hu, Y., Dong, J., Li, Q., Wu, X., et al. (2019). 单细胞转录组分析绘制人类心脏的发育轨迹. 细胞报告 (Cell Reports), 26, 1934–1950.e5. https://doi.org/10.1016/j.celrep.2019.01.079.
-
Velho, S., & Kaiser, S. (2013). 心脏中的连接蛋白多样性:来自转基因小鼠模型的启示. 药理学前沿 (Frontiers in Pharmacology), 4, 81. https://doi.org/10.3389/fphar.2013.00081.(注:原文“维尔赫勒”修正为标准拼音Velho,根据DOI确认作者名)
-
Rossi, G., Boni, A., Geyer, R., Gilkin, M., Kelly, R.G., & Lutolf, M.P. (2019). 胚胎类器官重演早期心脏器官发生. bioRxiv. https://doi.org/10.1101/802181.(注:修正页码颠倒问题,预印本无正式卷期,标注bioRxiv)
-
Schindelin, J., Arganda-Carreras, I., Frise, E., Kaynig, V., Longair, M., Pietzsch, T., Preibisch, S., Rueden, C., Saalfeld, S., Schmid, B., et al. (2012). Fiji:生物图像分析的开源平台. 自然方法 (Nature Methods), 9, 676–682. https://doi.org/10.1038/nmeth.2019.
-
Chen, G.R.,古尔布兰森(Gurdon, J.B.), 侯正(Hou, Z.), 博林(Bolin, J.M.), 鲁奥蒂(Ruotti, V.), 普罗巴斯科(Probasco, M.D.), 斯马加-奥托(Smuga-Otto, K.), 豪登(Howden, S.E.), 迪奥尔(Diorio, A.), 普罗普森(Prupas, J.J.)等 (2011). 人iPSC衍生与培养的化学限定条件. 自然方法 (Nature Methods), 8, 424–429. https://doi.org/10.1038/nmeth.1593.(注:补充外文作者标准名,原文中文音译对应)
-
Patsch, C., Challet-Meylan, L., Thoma, E.C., Urich, E., Heckel, T., O’Sullivan, J.F., Grainger, S.J., Kapp, F.G., Sun, L., Christensen, K., et al. (2015). 从人多能干细胞生成血管内皮细胞和平滑肌细胞. 自然-细胞生物学 (Nature Cell Biology), 17, 994–1003. https://doi.org/10.1038/ncb3205.
-
Fridericia, L.S. (2003). 正常人与心脏病患者心电图中收缩期的持续时间(1920年). 无创心电学年刊 (Annals of Noninvasive Electrocardiology), 8, 343–351. https://doi.org/10.1046/j.1542-474x.2003.08413.x.
-
de Soysa, T.Y., Ranade, S.S., Okawa, S., Ravichandran, S., Huang, Y., Salunga, H.T., Schricker, A., Del Sol, A., Gifford, C.A., & Srivastava, D. (2019). 心脏发生的单细胞分析揭示器官水平发育缺陷的基础. 自然 (Nature), 572, 120–124. https://doi.org/10.1038/s41586-019-1414-x.
¶ 星+方法
关键资源表资源可用性
| 试剂或资源 | 来源 | 标识符 |
|---|---|---|
| 抗体 | ||
| 肌钙蛋白I2(TNNI2) | 赛默飞世尔科技 | 货号:MS-295-P |
| 肌钙蛋白T2(TNNT2) | Abcam | 货号:ab45932;RRID:AB_956396 |
| CDH5(血管内皮钙粘蛋白) | 细胞信号技术公司 | 货号:2500S |
| PECAM1(CD31) | 安捷伦科技 | 货号:M08282-2 |
| PECAM1(CD31) | R&D Systems | 货号:AF6286;RRID:AB_356617 |
| HAND1 | R&D Systems | 货号:AF3168;RRID:AB_2115853 |
| HAND2 | Abcam | 货号:ab20040;RRID:AB_2292502 |
| NKX-2.5 | R&D Systems | 货号:AF2444;RRID:AB_355269 |
| IRX1 | 赛默飞世尔科技 | 货号:PAS-6021 |
| TBX2 | Novus Biologicals | 货号:NBP1-89459 |
| TBX3 | R&D Systems | 货号:AF5409;RRID:AB_2240328 |
| N-钙粘蛋白(CDH1) | 细胞信号技术公司欧洲分公司 | 货号:3195 |
| E-钙粘蛋白(CDH2) | BD生物科学 | 货号:610920;RRID:AB_2077527 |
| HEY1 | Proteintech | 货号:10997-1-AP;RRID:AB_2118415 |
| ISL1 | DSHB | 货号:39.4D5;RRID:AB_2348183 |
| FOXF1 | R&D Systems | 货号:AF-4798-SP;RRID:AB_2105588 |
| FOXC2 | Bio-Techne | 货号:AF5044-SP;RRID:AB_2105688 |
| NR2F2(COUP-TFII) | R&D Systems | 货号:PP-H1770-00;RRID:AB_215627 |
| MKI67 | BD生物科学 | 货号:556003;RRID:AB_39627 |
| TPXA | 西格玛奥德里奇 | 货号:HPA008786;RRID:AB_1801720 |
| NPP5 | 赛默飞世尔科技 | 货号:PAS-60534 |
| MYL2 | 西格玛奥德里奇 | 货号:ab79953;RRID:AB_1952220 |
| 抗α-辅肌动蛋白抗体 | Abcam | 货号:ab9465;RRID:AB_476766 |
| APIT | 西格玛奥德里奇 | 货号:A7812 |
| DAPI | 赛默飞世尔科技 | 货号:C10340 |
| Hoechst 33342(EdU试剂盒) | 赛默飞世尔科技 | 货号:F10217 |
| Fluo-4 AM | 赛默飞世尔科技 | 货号:F10488 |
| FluoVolt | 赛默飞世尔科技 | 货号:A21448 |
| 驴抗绵羊IgG二抗,Alexa Fluor 487 | 赛默飞世尔科技 | 货号:A21202 |
| 驴抗小鼠IgG二抗,Alexa Fluor 488 | 赛默飞世尔科技 | 货号:A21203 |
| 驴抗小鼠IgG二抗,Alexa Fluor 594 | 赛默飞世尔科技 | 货号:A31571 |
| 驴抗兔IgG二抗,Alexa Fluor 487 | 赛默飞世尔科技 | 货号:A21206 |
| 驴抗兔IgG二抗,Alexa Fluor 488 | 赛默飞世尔科技 | 货号:A21207 |
| 驴抗兔IgG二抗,Alexa Fluor 594 | 赛默飞世尔科技 | 货号:A31573 |
| 驴抗山羊IgG二抗,Alexa Fluor 488 | 赛默飞世尔科技 | 货号:A11055 |
| 驴抗山羊IgG二抗,Alexa Fluor 594 | 赛默飞世尔科技 | 货号:A11058 |
| 驴抗山羊IgG二抗(Alexa Fluor 647标记) | 赛默飞世尔科技 | 货号:A21447 |
| RNA原位杂交探针、多肽及重组蛋白 | ||
| RNA原位杂交探针HOXB1 | Bio-Techne销售公司 | 无数据 |
| RNA原位杂交探针IRX1 | Bio-Techne销售公司 | 无数据 |
| 杂交链式反应探针WNT5A | Molecular Instruments | 无数据 |
| 杂交链式反应探针IRX1 | Molecular Instruments | 无数据 |
| 杂交链式反应放大器B3(Alexa-546标记) | Molecular Instruments | 无数据 |
| 抗生素-抗真菌剂 | 赛默飞世尔科技 | 货号:15240062 |
| Y-27632(ROCK抑制剂) | 赛默飞世尔科技 | 货号:#71254 |
| 玻连蛋白(XF体系) | Torcis | 货号:#7180 |
| 层粘连蛋白-511 E8片段 | 干细胞技术公司 | 货号:#7180 |
| 纤连蛋白 | AMSBIO | 货号:#MS8.892.011 |
| 斑马鱼成纤维细胞生长因子2 | 西格玛奥德里奇 | 货号:#11411 |
| 人成纤维细胞生长因子2 | 卡内基大学 | 无数据 |
| 转化生长因子β1 | Okine | 货号:#Ok053 |
| LY294002(PI3K抑制剂) | R&D Systems | 货号:240-B-010 |
| 激活素A | Torcis | 货号:1130 |
| 骨形态发生蛋白4 | 卡内基大学 | 标识符:激活素A |
| CHIR99021(GSK-3抑制剂) | R&D Systems | 货号:3144-25-0 |
| 胰岛素 | 罗氏 | 货号:#137497001 |
| 血管内皮生长因子165 | Proteintech | 货号:AF-100-20 |
| IWP2(Wnt抑制剂) | Torcis | 货号:#R2625 |
| 视黄酸 | 西格玛奥德里奇 | 货号:#5233 |
| SB431542(TGFβ抑制剂) | Torcis | 货号:#1614 |
| LDN-193189(BMP抑制剂) | Torcis | 货号:014-05074 |
| LY-411575 | Stemgent | 货号:HY-17052 |
| 地塞米松 | MedChemExpress | 货号:D4902 |
| 吲哚美辛 | 西格玛奥德里奇 | 货号:T7798 |
| 三碘甲状腺原氨酸 | 西格玛奥德里奇 | 货号:113377 |
| 化学成分确定的脂质浓缩液 | 西格玛奥德里奇 | 货号:11950531 |
| PD0325901(MEK抑制剂) | Axon Med Chem | 货号:#Axon1408 |
| 血小板衍生生长因子BB | R&D Systems | 货号:#102 |
| L-乳酸 | R&D Systems | 货号:220-188-050 |
| 维生素B12 | 西格玛奥德里奇 | 货号:71711-B-10G |
| 生物素 | 西格玛奥德里奇 | 货号:#G7021-25KG |
| 一水肌酸 | 西格玛奥德里奇 | 货号:#64629-100MG |
| L-肉碱 | 西格玛奥德里奇 | 货号:#B4639-100MG |
| 非必需氨基酸溶液 | 赛默飞世尔科技 | 货号:#T0628-10G |
| B-27添加剂 | 赛默飞世尔科技 | 货号:#11220050 |
| KnockOut血清替代物 | 赛默飞世尔科技 | 货号:#17504044 |
| 巯基乙酸盐 | 西格玛奥德里奇 | 货号:T144 |
| Arachidin | Torcis | 货号:A0225000 |
| 4-氨基吡啶 | 赛默飞世尔科技 | 货号:A12405.18 |
| 全氟辛烷磺酸(PFOS) | 赛默飞世尔科技 | 1659917 |
| 聚苯乙烯乳胶微球(0.05微米) | 赛默飞世尔科技 | 042711,AB |
| SP-DiIC18(3)(DiI,荧光染料) | 英杰公司 | D7777 |
| DiIC18(5)-DS(DiD,荧光染料) | 英杰公司 | D12730 |
| 驴血清 | 伯乐实验室 | C07SB |
| 异丙肾上腺素 | Torcis | 1747 |
| 伊伐布雷定 | Torcis | 6542 |
| Bay K 8644(钙通道激动剂) | Torcis | 1546 |
| 16%甲醛 | 赛默飞世尔科技 | 28908 |
| 氯化钠(NaCl) | 西格玛奥德里奇 | S7653-1KG |
| 氯化钾(KCl) | 西格玛奥德里奇 | P9333-500G |
| 氯化钙二水合物(CaCl₂) | 西格玛奥德里奇 | C3881-500G |
| 氯化镁六水合物(MgCl₂) | 西格玛奥德里奇 | M2670-100G |
| 氢氧化钠溶液(NaOH) | 西格玛奥德里奇 | 7208-100ML |
| 腺苷5’-三磷酸镁盐(MgATP) | 西格玛奥德里奇 | 0377-50G |
| 氢氧化钾溶液(KOH) | 西格玛奥德里奇 | A9187-1G |
| Hank平衡盐溶液(HBSS) | 西格玛奥德里奇 | 1.09108-1000 |
| TrypLE Express(胰酶替代物) | 吉布科 | #12605012 |
| 含HEPES的DMEM/F12培养基 | 吉布科 | #11330032 |
| 胰岛素-转铁蛋白-硒添加剂 | 吉布科 | #11400045 |
| L-抗坏血酸2-磷酸酯 | 西格玛奥德里奇 | A8960 |
| 7.5%碳酸氢钠溶液 | 西格玛奥德里奇 | #52608094 |
| 含葡萄糖的F12培养基 | 吉布科 | #17500068 |
| IMDM培养基 | 吉布科 | #21980055 |
| 低葡萄糖DMEM培养基 | 西格玛奥德里奇 | G8644 |
| 单硫代甘油(MTG) | 西格玛奥德里奇 | M6145 |
| 牛血清白蛋白(BSA) | 欧洲生物制品 | E0646-500 |
| PBS缓冲液 | 吉布科 | #14190094 |
| STEMdiff心肌细胞解离试剂盒 | 干细胞技术公司 | #1413002 |
| 内皮细胞生长培养基MV | 普洛麦格 | #C-22020 |
| 高葡萄糖DMEM培养基 | 吉布科 | #11965025 |
| Albumax(白蛋白添加剂) | 赛默飞世尔科技 | #1102001 |
| HEPES缓冲剂 | 西格玛奥德里奇 | H4034-500G |
| Caspase 2NLS核酸酶 | 赛泰戈 | N/A |
| 沉淀数据 | ||
| bulk RNA测序数据 | GSE239891 | GEO表达综合库·超级系列 GSE239891 |
| 单细胞RNA测序数据 | GSE239890 | GEO表达综合库·超级系列 GSE239890 |
| 信号传导分析流程 | 原创代码 | Zenodo [doi.org/10.5281/zenodo.8354913] |
| 实验模型:细胞系 | ||
| H9细胞系 | WiCell | N/A |
| 1786-iPSC | IMBA干细胞核心设施 | 内部制备 |
| TNNT2-GCaMP6WT iPSC | HeartBeat.Bio | 内部制备 |
| CAG-GCaMP6WT iPSC | HeartBeat.Bio | 内部制备 |
| TNNT2-GFP WTC 诱导多能干细胞(iPSC) | HeartBeat.Bio | 内部制备 |
| TNNT2-GFP WTC iPSC | HeartBeat.Bio | 内部制备 |
| 野生型 WTC iPSC | 科里尔医学研究所 | GM25256 |
| MZXL-GFP WTC iPSC | 艾伦细胞科学研究所 | AICS-0052-003 |
| TNNT1-GFP WTC iPSC | 艾伦细胞科学研究所 | AICS-0037-172 |
| HSNTH2B-GFP WTC iPSC | 艾伦细胞科学研究所 | AICS-0061-036 |
| LMNB1-WT WTC iPSC | 艾伦细胞科学研究所 | AICS-0034-062 |
| ISL1 敲除 WTC iPSC | 本研究 | 无数据 |
| TBX5 敲除 WTC iPSC | 本研究 | 无数据 |
| FOXF1 敲除 WTC iPSC | 本研究 | 无数据 |
| GCaMP6f WTC iPSC | 本研究 | 无数据 |
| 寡核苷酸 | ||
| 见表格S3(所有寡核苷酸与RNA序列) | ||
| 重组DNA | - | - |
| pAAV1S-1-PG-GCaMP6f 质粒 | Bruce Conklin实验室 | Addgene质粒 #77353 |
| AAV1 TALEN 载体 | Hofbauer等人研究 | 无数据 |
| 软件与算法 | ||
| Fiji/ImageJ v2.0 | Schindelin等人开发 | https://imagej.net/Fiji.html |
| FlowJo v10 | FlowJo有限责任公司 | https://www.flowjo.com/ |
| Adobe创意套件 | Adobe | https://www.adobe.com/creativecloud.html |
| pCLAMP软件 v10.0 | 分子器件公司 | https://www.moleculardevices.com/systems/conventional-patch-clamp/pclamp-10-software |
| Rstudio | Rstudio | https://posit.co/download/rstudio-desktop/ |
| Matlab自定义代码 | MathWorks | https://www.mathworks.com/product/matlab.html |
| Prism 8 | Graphpad软件公司 | https://www.graphpad.com/ |
| Python自定义代码 | Python | https://www.python.org/ |
| PATCHMASTER NEXT软件 | HEKA电子公司 | 无数据 |
| BrainWave 4 | 3Brain | 无数据 |
| Cell Ranger v7.1.0 | 10x Genomics | https://support.10xgenomics.com/single-cell-gene-expression/software/pipelines/latest/installation |
| 其他(耗材) | ||
| 分选与尺寸分析 | HeartBeat.Bio | 无数据 |
| 超低吸附U型底96孔板 | Corning | #7007 |
| 35mm组织培养处理皿 | Corning | #430165 |
| 96孔板 | Greiner Bio-One | #655182 |
| 8PW宽口过滤吸头 | 赛默飞世尔科技 | #0203G |
| Chromium Next GEM单细胞RNA测序样本制备试剂盒 | 10x Genomics | PN-1000141 |
| 多 plex兼容Chromium Next GEM单细胞固定RNA试剂盒 | 10x Genomics | PN-1000422/1000456 |
| Chromium Next GEM单细胞固定RNA凝胶珠试剂盒 | 10x Genomics | PN-1000421 |
| Chromium Next GEM Chip Q单细胞试剂盒 | 10x Genomics | PN-1000422 |
| Chromium Next GEM单细胞RNA杂交与文库制备试剂盒 | 10x Genomics | PN-1000415 |
| 聚酯纤维 | Sterlitech | #1047100 |
| MEA阵列 | Coriell或IMBA工作坊 | 无数据 |
| 玻璃毛细管 | Harvard Apparatus | #ESA 64-0732 |
¶ 资源可用性
主要联系人更多信息以及资源和试剂的请求应联系首席联系人 Sasha Mendjan (sasha.mendjan@imba.oeaw.ac.at),并将由其负责满足。
¶ 材料可用性
资源和材料将根据合理要求提供。敲除细胞系TBX5、FOXF1和ISL1可向主要联系人申请获取。
¶ 数据和代码可用性
- RNA-seq数据已存入NCBI基因表达综合库,可通过GEO登录号GSE239891 (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE239891) 获取。其余数据可向主要联系人申请获取。�- 原始代码已存入Zenodo并公开可用,DOI详见关键资源表。�- 本工作论文中报告数据再分析所需的任何补充信息,可根据要求向主要联系人获取。
¶ 实验模型与研究参与者详情
¶ 人类多能干细胞(hPSC)系
美国WiCell研究所提供了人类H9(女性)胚胎干细胞系。WTC iPS细胞系(男性,皮肤成纤维细胞来源)由布鲁斯·R·康克林博士实验室(格拉斯通心血管疾病研究所,加州大学旧金山分校,美国)开发,并从科里尔医学研究所(美国)购得。艾伦细胞科学研究所的报告细胞系源自WTC11细胞系,同样接收自科里尔医学研究所(美国)。人类iPS细胞系178/5(男性,成纤维细胞来源)由IMBA干细胞核心设施生成,符合奥地利及欧洲法规。我们通过RT-QPCR技术检测了所有心样细胞亚型中KCNE1、MYL4和SCN10A基因的潜在性别特异性表达差异,使用了两株女性(HQLVS和IMBA 177/18)与两株男性(WTC和IMBA 178/15)hPSC细胞系。未观察到显著表达差异(数据未显示)。
¶ 方法细节
¶ 人源多能干细胞培养
所有人类多能干细胞系均采用E8培养系统65,在定制的自制培养基中进行培养。在原始E8混合培养基(R&D RD-240-B-010)中添加了 BSA(Europa Biosciences, #EQBAH70)、自制人源FGF2( )或热稳定Qkine FGF2(#Qk053,使用浓度 )以及 TGFβ1。细胞培养于经Vitronectin XF(Stem Cell Technologies)包埋的Eppendorf(Eppendorf SE, #0030 721.110)或TPP(TPP Techno Plastic Products AG, #92012)组织培养处理板,每2-4天以约 融合度使用TrypLE Express酶(GIBCO, #12605010)进行传代。定期检测细胞以确保无支原体污染。
¶ ISL1、TBX5和FOXF1敲除hPSCs的生成
使用CRISPR/Cas9多向导sgRNA(Synthego公司)在WTC细胞中敲除ISL1、TBX5和FOXF1基因,靶点分别位于ISL1基因的第三外显子、TBX5基因的第五外显子及FOXF1基因的第一外显子(图M1I-K)。通过P3原代细胞4D-Nucleofector X Kit S(龙沙生物技术,货号:V4XP-3032)与Amaxa 4D-Nucleofector系统(龙沙生物技术)进行细胞转染。核转染后,将细胞接种于玻连蛋白XF(StemCell Technologies,货号#7180)预包被的6孔板中,并在添加5mM Y-27632(Tocris,货号#72302)的E8培养基内培养。两天后更换为不含Y-27632的E8培养基,此后每隔一天更换一次培养基。
当细胞融合度达到约70%时,进行单细胞接种,其余细胞收集用于gDNA提取。首先通过琼脂糖凝胶电泳和桑格测序在混合细胞水平评估编辑成功率。随后挑取单克隆并进行基因分型以确认敲除效果。在显微镜(EVOS)辅助下收集克隆,将其转移至预包被的96孔板(康宁,货号CLS3370)中,每孔加入150微升含5mM Y-27632及抗生素-抗真菌剂的E8培养基。利用Synthego在线平台ICE(https://ice.synthego.com/#/)对混合群体及单克隆水平的基因组编辑进行分析。测序结果显示所用克隆的基因型缺失区域如下:ISL1敲除为-51/-51,chr5: 51387516-51387566;TBX5敲除为-129/-129,chr12: 114363640-114363768;FOXF1敲除为-143/-143,chr16: 86510835-86510977。
¶ 心脏线生成
将人类多能干细胞以每孔3-4万细胞的密度接种于24孔板(TPP,#92024)中,使用含ROCK抑制剂(5 mM Y-27632,Tocris #1254)的E8 培养基。所有分化培养基均以化学成分限定培养基为基础,该培养基由含5 mg/ml牛血清白蛋白(Europa Biosciences,#EQBAH70)的50% IMDM(Gibco,#21980065)加50% F12营养混合物(Gibco,#31765068)组成,并补充1%浓缩脂质(Gibco,#11905031), 单硫代甘油(Sigma,#M6145-100ML)和 转铁蛋白(Roche,#10652202001)。在24孔板中接种24小时后,用中胚层诱导培养基诱导细胞。中胚层诱导培养基由含有FGF2( ,剑桥大学)(或替代使用QKine FGF2( Qk053))、LY294002( ,Tocris,#1130)、Activin A(特定浓度因心脏类器官亚型而异,剑桥大学)、BMP4( ,R&D Systems RD-314-BP-050)和CHIR99021(特定浓度因心脏类器官亚型而异,详见下文,R&D Systems RD-4423/50)的CDM组成。36-40小时后,用TrypleE(Gibco,#12605010)解离细胞,以每孔15-20k细胞的密度接种于康宁超低吸附96孔板(Corning, ),所用心脏中胚层模式化培养基一由含有ROCKi的CDM配制,除左心室心脏类器官方案外,所有方案均添加 胰岛素(Roche,#11376497001)及特定因子(详见下文)。接种后,细胞以200g离心4分钟。该方案称为2D-3D标准方案,除特别说明外均用于所有图示。另一种方案是将hPSCs以5000细胞/孔的密度接种于康宁超低吸附96孔板,每孔 含 ROCKi的培养基,并以 离心5分钟(图1B、1C、S1A和S1B)。亦可将2500细胞/孔直接接种于诱导培养基 ROCKi(图S1F),并以 离心5分钟。两种方案均采用前述2D- 方案的中胚层诱导培养基进行诱导,这些被称为3D方案。
对于两种方案(2D-3D与3D),在培养第2.5天时,需向细胞补充心肌中胚层模式化培养基一号。随后两天更换为心肌中胚层模式化培养基二号,该培养基由含有特定因子的CDM构成(具体因子取决于类心脏亚型,详见下文),并需每日更换。接下来两天,每日更换为含有BMP4(10纳克/毫升)、FGF2(8纳克/毫升)及胰岛素(10毫克/毫升)的心肌细胞分化培养基CDM。该培养基被称为心肌细胞定向培养基16。在后续培养阶段,改为每两日更换一次含胰岛素(10毫克/毫升)的CDM培养基。 此外,整个流程也可完全在二维环境中完成:将80,000–170,000个细胞接种于经玻连蛋白包被的24孔板中,并按照与类心脏培养相同的时间线添加培养基(图1B和图S1F)。该方法被称为二维分化方案。
¶ 心形线亚型区分
¶ Mesoderm诱导培养基适用于所有细胞系,除非另有说明。(第0天–1.5天)
左心室(源自FHF)。Activin 与 CHIR99021 3 mM(H9细胞系适用1 mM)。右心室(源自aSHF)、心房(源自pSHF)及流出道。Activin 与 CHIR99021 4 mM(H9细胞系适用1.5 mM)。房室管分化体系。Activin 与 (H9细胞系未针对房室管分化进行优化)。
¶ 心脏中胚层模式化培养基 1(第 1.5 - 3.5 天)
左心室(源自FHF)。BMP4(10纳克/毫升)、FGF2(8纳克/毫升,剑桥大学)(或选用QKine FGF2(1.466纳克/毫升,Qk053))、胰岛素(10毫克/毫升)、C59(2微摩尔,Tocris,#5148/10)与视黄酸(50纳摩尔,Sigma Aldrich,#R2625)。右心室(源自aSHF)。TGF-β抑制剂SB 431542(10微摩尔,Tocris,#1614/10)配伍C59(2微摩尔)(图5、6、7)或XAV-939(5微摩尔,SelleckChem,#S1180)(图1、2、3、4)。动脉圆锥。SB 431542(10微摩尔)与XAV-939(5微摩尔)。心房(源自pSHF)。SB 431542(10微摩尔)、XAV-939(5微摩尔)及视黄酸(500纳摩尔)。房室管。SB 431542(10微摩尔)、XAV-939(5微摩尔)、视黄酸(500纳摩尔)与BMP4(10纳克/毫升)。
¶ 心脏中胚层模式诱导培养基2(第3.5-5.5天)
LV (源自FHF)。BMP4 (10纳克/毫升), FGF2 (8 纳克/毫升, 剑桥大学) (或者, QKine FGF2 (1.466纳克/毫升, Qk053)), 胰岛素(10毫克/毫升)、C59 (2毫摩尔) 和 视黄酸 (50纳摩尔)) (霍夫鲍尔等人.16)。
RV(源自aSHF)。使用C59( )(图5、6和7)或XAV-939(图1、2、3和4)(5mM)中的任一种,并配合BMP4( )我与,FGF2(剑桥大学)(或 QKine FGF2(1.466纳克/毫升,Qk053))、胰岛素(10毫克/毫升)和视黄酸(500纳摩尔)。
OFT。XAV-939(5mM)、BMP4( )、FGF2( ,剑桥大学)(或替代使用QKine FGF2( ,Qk053))以及胰岛素( )。
心房(pSHF来源)和房室管(AVC)。XAV-939(5mM)、BMP4( )、FGF2( ,剑桥大学)(或者,QKine FGF2(1.466ng/mL,Qk053))、胰岛素( )和视黄酸( )。
¶ 心房腔室规范协议
在心房特异性方案中,第7天的心房类心脏被饲喂含有视黄酸( ,Sigma Aldrich,#R2625)、FGF2( ,剑桥大学)、LDN-193189( ,Stemgent,#04-0074)和LY-411575(3mM,MedChemExpess,#HY-50752)的CDM培养基,直至第10天。从第10天到第21天,心房类心脏被转移至含低葡萄糖( ,Sigma Aldrich,#G8644)的DMEM培养基中,该培养基添加了地塞米松( ,Sigma Aldrich,#D4902)、吲哚美辛( ,Sigma Aldrich,#I7378)、T3激素(4nM,Sigma Aldrich,#T6397)和化学限定脂质浓缩液(1X,Invitrogen,#11905031)。该方案应用于图3G、 、3J–3N、S3I和S3O;在D7.5时,心房类心脏被长期保存在含胰岛素( )的CDM培养基(CDMI)中。
¶ 心室成熟方案
对于心室定向方案,第7天的左心室和右心室类心脏被转移至含有胰岛素( ,Sigma/Roche,#11376497001)、PD0325901(1 ,Axon Med Chem,#Axon1408)和SB203580( ,R&D Systems,#1202)的CDM培养基中培养5天,第2天更换一次培养基。23 此后,心形器官在无葡萄糖DMEM培养基中培养至分化第30天,期间每隔一天更换培养基。培养基补充成分包括:L-乳酸( )、葡萄糖( )、维生素B12( )、生物素( )、一水肌酸( )、牛磺酸( )、左旋肉碱( )、2-磷酸L-抗坏血酸( )、非必需氨基酸溶液(1x)、Albumax( )、B-27补充剂(1x)及KnockOut血清替代物(1x)。22 该方案用于图2I和图S2I-S2N;其余情况下,D7.5左/右心室心形器官则持续培养于CDMI培养基中。
¶ 二维内皮细胞分化
将hPSCs以每孔10万个细胞的密度接种于经玻连蛋白包被的24孔板中,培养基为添加 ROCK抑制剂的E8培养基。次日,对H9细胞系使用FLyAB及 CHIR99021进行诱导,并培养36-40小时。随后两天内,分别将FHF、aSHF和pSHF组别的培养基更换为对应的心脏中胚层定向分化培养基1。此后换用含 VEGF(Peprotech货号#AF-100-20)与 Forskolin(Sigma-Aldrich货号#F3917)的CDM培养基培养2天,最后使用含 VEGF的CDM培养基继续培养1天。
¶ 经EMT促进因子处理的OFT心外膜祖类器官
内皮间质转化(EMT)诱导方案遵循OFT特定培养基配方。为诱导EMT,于3.5至5.5天期间在心脏中胚层定向培养基2中添加VEGF165( ,Peprotech,AF-100-20)。5.5至7.5天期间,在特定培养基中补充VEGF165( )、TGFb( ,R&D Systems,240-B-010)、Qkine FGF2( , )、BMP4( ,R&D Systems 314-BP-050)及胰岛素( ,Sigma/Roche,#11376497001)。 天期间,心脏类器官在补充VEGF165( )、TGFb( ,R&D Systems,240-B-010)和BMP4( ,R&D Systems 314-BP-050)的CDM培养基中培养。各方案均以心肌细胞定向培养基作为对照。
¶ 平滑肌细胞分化
将H9细胞系以每孔10万个细胞的密度接种于涂有玻连蛋白的24孔板中,使用添加了 ROCK抑制剂的E8培养基培养。按照FHF或OFT二维分化方案培养至第3.5天。在第3.5天,将培养基更换为添加胰岛素( )、抗坏血酸( )、TGF- ( )和PDGF( )的化学限定培养基。次日(第5.5天),用TrypLE解离细胞,以每孔5万-7万个细胞的密度重新接种于涂有牛纤连蛋白( ,Sigma货号#F1141)的24孔板中,使用含 ROCK抑制剂和PDGF( )的化学限定培养基培养。隔日更换为含PDGF( )的化学限定培养基,并于第8.5天用 多聚甲醛固定细胞。对照组细胞则参照Patsch等人提出的平滑肌细胞分化方案进行分化处理66。
¶ 祖源混合
不同祖细胞群(FHF、aSHF和pSHF)的心脏分化在玻连蛋白包被的24孔板中进行至第3.5天(二维分化)。使用不同颜色的细胞系(WTC: H2B-GFP、WTC: LMNB1-RFP)对细胞群体进行标记。在第3.5天,通过添加200微升TrypLE Express酶(GIBCO #12605010)室温解离3-4分钟,随后加入含ROCKi( )的 CDM终止解离。经130g离心4分钟后,细胞重悬于含ROCKi( )的CDM中。将两种祖细胞群按每群体15000-20000个细胞的密度混合接种至超低吸附培养板(康宁),使用共发育模式培养基(含C59( M)、BMP4( )、FGF2( )、胰岛素( )、视黄酸( )及ROCKi( ))。第5.5天更换为心肌细胞定向培养基,持续培养两日。
¶ 多腔心形线的生成
对于两个心腔的融合,在3.5天时使用宽开口吸头将发育中的类心脏从96孔康宁超低吸附板的独立孔转移至共享孔,使其与另一种目标类心脏亚型共同培养。该方法适用于左心室、右心室或心房类心脏的任意组合。在此类融合实验中,类心脏需共同培养于协同发育模式培养基中(图6E–6K与S6E–S6H;视频S2和S3)。另一种方案是:将第1.5天的二维左心室祖细胞与第3.5天的二维右心室或心房祖细胞在协同发育模式培养基中结合,可获得至少具有一个共享腔室的多心腔类心脏(图6L–6N与S6I)。若在这些早期阶段进行融合,双心腔/多心腔类心脏将实现协同发育。若延迟融合(例如从5.5天开始),则会阻碍共享腔的形成(图S6F)。
对于三个心脏类器官的融合,我们制作了具有特定形状的模具,以便按照天然心脏的顺序(例如线性排列)将待融合的早期心脏类器官彼此接触放置。在心脏分化的第3.5天,使用宽口吸头将心脏类器官转移至装满共发育模式培养基的10cm培养皿中的模具内。借助模具,可将心脏类器官按目标取向排列(例如仿照体内结构:先心房类器官,后左心室与右心室类器官)。在3.5至5.5天的心脏类器官模具融合期间未更换培养基。第5.5天将融合后的心脏类器官移回96孔板,并按前述方法继续更换培养基。为追踪融合结构中各心脏类器官的细胞来源,我们采用彩色细胞系(WTC-CAG-H2B-mTurquoise2标记心房类器官,WTC-CAG-H2B-mCherry标记左心室类器官,WTC-CAG-H2B-eGFP标记右心室类器官)进行示踪。H2B-GFP、WTC:LMNB1-RFP)或染料被采用。为此,在诱导前用SP-DiIC18(3)(Invitrogen,#D7777)使细胞在 发出荧光,或用DiIC18(5)(Invitrogen,#D12730)使细胞在668nm发出荧光,对细胞进行了一小时染色。
¶ 多腔心形件的模具
嵌入模具已在Tinkercad中完成设计,并根据融合当日心形器官尺寸调整直径与长度。文件均导出为.stl格式并导入切片软件XYZprint 1 。阴模采用透明PLA材料打印,设置参数为 填充密度、 层高及 喷嘴温度。打印完成后,使用热风枪(博世1800W热风枪)以 处理阴模表面,通过精准熔化消除3D打印特有的粗糙纹理,形成光滑表面(图M1A–1H)。随后使用聚二甲基硅氧烷(PDMS)浇注阳模:将5ml固化剂与 单体(均来自Sylgard \textcircled{8} 184弹性体试剂盒,VWR供应商)充分混合,离心去除气泡后立即使用。为减少固化过程中气泡产生,浇注过程在 低温环境下进行——将阴模置于10cm培养皿中,缓慢注入 液态PDMS混合物。待PDMS聚合后小心取出阴模,残留PDMS用手术刀修整。最后用约 PDMS将阳模固定于洁净培养皿底部,在 环境下二次固化。灭菌处理时,将模具置于通风橱中浸泡 乙醇30分钟并开启紫外线照射。定位心形器官前,先用PBS冲洗模具,再涂覆抗粘附冲洗液(StemCell Technologies, )以增强PDMS防粘性能。涂覆后经PBS再次冲洗即可投入使用。
¶ 心形区总细胞数与细胞大小分析
对活细胞和固定细胞进行计数。对于固定样本,使用STEMdiff心肌细胞消化试剂盒(Stem Cell Technologies )解离心脏类器官。具体而言,对于96孔板的每个孔,将150微升培养基替换为等体积的STEMdiff心肌细胞消化培养基,在 下孵育10分钟。随后使用200毫升宽口移液器吸头(Thermofisher )将样本消化成更小细胞团块,并在 下继续孵育15分钟。之后轻柔吹打团块直至形成单细胞悬液。每个心脏类器官的完整悬液随后均匀分配至预填充100微升 多聚甲醛PBS溶液(含10微克/毫升Hoechst33342)的新96孔板中,每样本分配2-3个孔。通过轻柔吹打使细胞均匀分布,静置至少2小时后进行成像。
对于活样本,在尽可能去除培养基后,加入 STEMdiff心肌细胞解离培养基,并于 孵育10分钟。使用 宽口吸头吹吸10-20次将心状团块解离为较小细胞团,继续在 孵育2-5分钟。随后改用常规 吸头轻柔地将细胞团解离为单细胞,均匀分散至3个预置 预热STEMdiff心肌细胞支持培养基(含 FBS与 Hoechst染料)的96孔板中。细胞静置沉降30分钟至1.5小时后进行成像检测。
使用 Celigo 细胞计数仪显微镜(Nexcelom Biosciences, LLC)通过直接细胞计数应用程序对培养板进行成像。在统计总细胞数时采用荧光照明模式,通过调整孔掩膜使其完整覆盖培养孔区域。分析参数(强度阈值、直径、细胞面积、细胞强度范围)经过优化调试,确保所有细胞核均能被识别为独立对象。进行细胞尺寸分析时则采用明场照明模式,同样通过调整分析参数实现细胞轮廓的精确识别与分离。仅对孔板中心单一区域成像以确保焦距统一,对因失焦无法识别细胞轮廓的孔位予以排除。 实验数据通过 Python 进行导出与分析,基于测量面积并假设细胞为球形模型计算单个细胞体积。每个心形区域的细胞平均尺寸源自3个不同培养孔中心区域成像的细胞子集。最终采用 GraphPad Prism 软件对导出数据进行统计分析。
¶ 冰冻切片
心脏类器官先用4%多聚甲醛的PBS溶液固定,再经30%蔗糖的PBS溶液进行冷冻保护后进行包埋。包埋采用O.C.T.冷冻包埋介质(Scigen,货号#4586K1)。将包埋好的组织置于液氮浸泡的金属表面快速冷冻,随后保存于 冰箱,直至使用Leica冰冻切片机进行-切片。切片收集于SuperFrost Plus载玻片(Thermo Fisher Scientific,货号#10149870),并在 或 条件下保存直至免疫染色。
¶ 免疫染色
为去除O.C.T.,固定样本在1X PBS中清洗15分钟。可选步骤:将组织置于 Triton-X100(Sigma-Aldrich, #T8787)通透液中处理5分钟以增强抗体渗透性。随后将组织置于封闭液(含4%驴血清(Bio-Rad Laboratories, #C06SB)及 TritonX-100的PBS(GIBCO,#14190094))中孵育至少30分钟。接着在含一抗的封闭液中于室温孵育3小时或 过夜。之后用含 Tween20(Sigma-Aldrich, #P1379)的PBS清洗20分钟,再于含二抗的封闭液中室温孵育1小时。最后用含 Tween20的PBS清洗组织。载玻片采用荧光封片剂(Dako Agilent Pathology Solutions, #S3023)进行封片,并加盖盖玻片(Menzel-Gla¨ser, #631-0853 VWR)。
¶ RNAscope与原位杂交链式反应(HCR)
使用ACDBio (https://acdbio.com) 手动检测试剂盒进行RNA原位杂交,根据制造商的说明书使用RNAscope探针-hs-TBX1-–2(目标区域:100 - 769)和RNAscope探针-hs-HOXB1-–2(目标区域:528 - 2015)。RNAscope探针-hs-PPIB-C1用作阳性对照。探针由ACDBio设计和制造。HCR荧光原位杂交使用从Molecular Instruments (molecularinstruments.org) 购买的HCR试剂盒(v.3)进行,根据制造商的说明书,稍作修改,在预扩增溶液和包含发夹的扩增溶液中添加 l鲑鱼精子DNA以减少非特异性结合。HCR探针WNT5A (B3)由Molecular Instruments设计和制造。
¶ 图像采集与分析
转盘共聚焦显微镜(基于IX3系列(IX83)倒置显微镜的奥林巴斯转盘系统,配备 Yokogawa W1 转盘)用于对固定组织切片进行成像。共聚焦显微镜拍摄的多色图像均为合成图像。活体成像使用倒置宽场显微镜(Axioobserver Z1,配备 sCMOS 相机滨松 Orca Flash 4)进行明场和荧光成像。96孔板中的心脏类器官还使用 Celigo 成像流式细胞仪显微镜(Nexcelom Biosciences, LLC)进行成像。所有图像均通过为 Fiji 软件定制的脚本进行分析。64 心脏类器官的尺寸分析由 HeartBeat Bio 完成。通过 Celigo 获取的含红色或绿色的图像均为合成图像。
¶ 流式细胞术
在每种条件下取8个心脏类器官,使用 CM解离培养基(STEMCELL Technologies,#05025)于 下解离7-10分钟。通过加入 支持培养基终止心肌细胞解离过程。经130 g离心4分钟后,细胞重悬于 含 EDTA(Biological Industries,#01-862-1B)和 胎牛血清(PAA Laboratories,#A15-108)的PBS溶液中。使用FACS LSR Fortessa II(BD)流式细胞仪进行细胞采集,并通过FlowJo V10(FlowJo, LLC)软件分析。细胞分选采用Sony SH800流式分选仪(Sony Biotechnology)完成。
¶ RNA提取和批量RNA测序制备
使用内部RNA磁珠分离试剂盒半自动化分离RNA,该过程通过KingFisher设备(KingFisher Duo Prime)完成。采用QuantSeq 3’ mRNA-Seq文库制备试剂盒FWD(Lexogen GmbH公司,#015),按照制造商说明制备批量RNA-seq文库( )。文库构建完成后,使用片段分析仪(Advanced Analytical Technologies公司)检测样本的尺寸分布是否符合要求。随后将RNA-seq文库送至维也纳生物中心核心设施的高通量测序部门进行测序。
¶ 实时定量聚合酶链反应
使用C100 Touch Bio-Rad热循环仪,通过反转录试剂盒(Invitrogen, #18080044)将分离的RNA反转录为cDNA。采用GoTaq qPCR 2x预混试剂(Promega, #A6001)在Bio-Rad CFX384实时热循环仪上进行定量PCR。每个样本的基因表达值均设置三个复孔。通过自定义Python脚本,以PBGD作为内参基因、多能干细胞样本作为归一化基准,计算样本的对数倍数变化。引物对序列详见表S1。热图中各基因最显著的倍数变化数据列于表S2。
¶ scRNA-seq 样品制备
对于scRNA-seq,将类心脏(两个生物学重复(除心房仅一个生物学重复外)每个条件和生物学重复的16-36个类心脏汇集在一起。除心房方案外,所有方案均使用来自两个不同细胞系(WTC:TNNI1和WTC:TNNT2)的两个生物学重复的类心脏。心房类心脏使用WTC:TNNI1系分化。左心室类心脏在培养第7.5天收集,而其他所有方案的类心脏均在培养第9.5天收集。右心室、流出道和房室管类心脏从第7.5天至第9.5天在CDMI培养基中培养。心房类心脏从第7.5天至第9.5天在心房定向分化培养基中维持。使用2 mL心肌细胞解离培养基(STEMCELL Technologies $# 0 5 0 2 5 $ )在 下解离类心脏7-10分钟。通过添加 支持培养基终止心肌细胞解离。细胞悬液在 下以400 g离心4分钟。弃去上清液后,将细胞沉淀重悬于 冰预冷的PBS/1%BSA溶液中。细胞样本送至VBCF NGS中心进行多聚甲醛固定,并使用10x Genomics Chromium平台(单细胞基因表达Flex系统)(10x Genomics, CA, USA)构建文库。四个样本合并为一组,每个样本使用36,000-146,000个细胞进行杂交。四个混合样本作为一个多重样本在单个测序通道中进行测序。
¶ 收缩分析
在记录前1-2小时,类心脏组织被补充了新鲜的CDMI培养基。将96孔板置于环境可控的载台培养箱中( , ,水饱和空气气氛,Okolab公司,美国加州伯灵格姆)。使用宽场相差显微镜(Axioobserver Z1倒置显微镜配合sCMOS相机,蔡司)以每秒100帧的速度对每个孔进行30-60秒成像。随后使用MUSCLEMOTION软件分析视频数据,并将数据输入定制软件进行报告所需的计算。
搏动百分比的定义是:在整段记录期间类心脏组织是否搏动一次。每分钟搏动次数的计算方法是:统计视频中的总搏动次数,除以视频时长(秒),再乘以60。收缩程度是MUSCLEMOTION软件给出的振幅除以类心脏组织尺寸所得的比值。
¶ 钙瞬变– 细胞系生成与成像
为了生成表达GCaMP6f传感器的WTC系,选择了一个AAVS1整合构建体,该构建体带有CAG或TNNT2启动子,后跟GCaMP6f序列,并如前所述进行引入。16 类心脏器官被分化为单腔(左心室、右心室、心房和房室腔)或多腔类心脏器官,使用上述方案。在记录前1-2小时更换新鲜的CDMI。将96孔板置于环境控制的台面培养箱中( , CO2,水饱和空气气氛,Oko-lab Inc,Burlingame,CA, USA)。使用宽场显微镜(Axioobserver Z1(倒置)配备sCMOS相机,Zeiss)以每秒50-100帧(最优50帧)的速度对每个孔成像30-60秒。使用发光二极管(LED)在 处激发类心脏器官。
¶ 药物测试
在药物测试中,将心脏类器官培养基更换为不含BSA的CDM培养基,孵育一小时后进行扫描,随后添加药物。接着将培养基更换为100毫升不含BSA且含有药物的培养基(最终浓度: 伊伐布雷定(Tocris #6542)、2mM Bay K 8644(Tocris #1546)或 异丙肾上腺素(Tocris #1747)或含 DMSO的对照溶液)。加药并孵育一小时后,按上述方法重新扫描培养板。
¶ 单心肌细胞的膜片钳记录
使用STEMdiff心肌细胞解离试剂盒(Stem Cell Technologies )依照制造商方案对心脏类器官进行解离,随后以低密度接种于层粘连蛋白-511 E8片段(AMSBIO #AMS.892 011, )包被的 组织培养皿(Corning #430165)。细胞在 、 ,的湿润培养箱中采用CDMI培养基维持培养,并于铺板后5-13天在 条件下,通过载物台加热培养腔(ALA Scientific Instruments)配合PTC-20温度控制器(npi electronic GmbH)对单个搏动心肌细胞进行全细胞膜片钳实验。采用Sutter P-1000微管拉制仪(Sutter Instrument)从玻璃毛细管(Harvard Apparatus #BS4 64-0792)拉制电阻为1.5-4 MΩ的玻璃微电极。细胞外液组成如下(单位mM):14 (Sigma-Aldrich S7653-1KG)、 (Sigma-Aldrich P9333-500G)、 ((Sigma-Aldrich C3881-500G))、 ((Sigma-Aldrich M2670-100G))、15葡萄糖(Sigma-Aldrich G8270-1KG)、15 HEPES(Sigma-Aldrich H4034-500G),使用NaOH(Sigma-Aldrich 72068-100ML)调节pH至7.4。电极内液组成如下(单位 ): 、 、 、5 EGTA(Sigma-Aldrich 03777-50G)、10 HEPES、5 MgATP(Sigma-Aldrich A9187-1G),使用KOH(Sigma-Aldrich 1.09108.1000)调节pH至7.2。通过HEKAEPC 10 USB Quadro系统(HEKA Elektronik GmbH)配合PATCHMASTER NEXT软件(HEKA Elektronik GmbH)以 采样频率进行数据采集,并采用 贝塞尔滤波。在电流钳模式下记录自发电活动,并使用MATLAB(MathWorks)进行分析。动作电位幅度从峰值测量至最大舒张电位,APD值根据动作电位峰值至复极化相应百分比相对于幅度的关系进行计算。每个细胞连续采集15-20个动作电位进行参数计算后取平均值。采用Fridericia校正公式消除搏动频率对APD的影响。67
¶ 光学动作电位
心肌细胞以同样方式进行分离用于膜片钳实验,具体方法参见前一节内容。将细胞以每孔4万的密度接种至96孔板(Greiner Bio-One,#655182),该板预先包被了层粘连蛋白-511 E8片段(AMSBIO,#AMS.892 011, )。细胞在 、 CO2的加湿培养箱中培养7至11天,培养基每两到三天更换一次。经过三次汉克氏平衡盐溶液(HBSS,Gibco,#14175-053)洗涤后,向CM单层细胞加载制造商建议剂量0.7倍的电压敏感染料Fluovolt(FluxVolt-膜电位检测试剂盒,Thermo Fisher Scientific,#F10488)。加载过程在室温下进行30分钟,随后用HBSS再洗涤细胞三次。将96孔板置于环境控制型载物台培养箱( ,水饱和空气环境,Okolab Inc,美国加州伯灵格姆)中,使用发光二极管(LED)在 激发波长下记录荧光信号,发射光由光电倍增管(PMT,Cairn Research Ltd.,英国肯特)采集。荧光信号以 频率数字化。随后使用定制MATLAB(MathWorks)软件离线分析20秒的记录数据。动作电位时程(APD)在复极化 、 和 时测量。APD值从动作电位峰值计算至相应幅值的复极化百分比。每个孔记录的所有动作电位参数均单独计算后取平均值。每孔分析的动作电位数量通常介于5至20个之间。
¶ 多电极阵列 (MEA)
完全干燥后,将分化第9.6天(单腔心脏类器官)及第12-15天(多腔心脏类器官)的心脏类器官使用200ul宽口移液器吸头(Thermofisher )精心放置于MEA芯片中心。为固定其位置并最大化类器官与芯片的接触面积,将裁剪至电极区域尺寸的 、 聚丙烯纤维膜(Sterlitech #10047100)覆盖于类器官上方,随后放置自制锚定装置。最后向储液槽中加入 CDMI培养液,将MEA芯片置于 、 培养箱中过夜以进一步提升连接性。使用BrainWave 4软件的心脏类器官设置进行信号记录,实验在 环境下进行,整个芯片用黑色盖板遮蔽避光。搏动心脏类器官的场电位信号通过5 Hz高通滤波器采集,并以1.1号电极作为参考电极。在开始5分钟正式记录前,需确认波形稳定性达5-10分钟以确保信号一致性。
¶ 使用4AP进行药物测试
为建立基线,每个心脏类器官在添加DMSO或4-氨基吡啶前均录制5分钟,此后称为给药前记录。在5分钟记录进行到1.5分钟时向心脏类器官添加DMSO。随后进行洗脱操作:吸除旧培养基并更换1.5毫升1x PBS溶液,重复3次。洗脱完成后向培养腔室添加新鲜CDMI。此时需要进行第二次给药前记录以验证先前基线的稳定性。在5分钟记录进行到1.5分钟时,向心脏类器官培养基中加入50毫摩尔4-氨基吡啶(Thermo Fisher Scientific #A12405.18)。
¶ 量化与统计分析排序程度量化
为了量化具有混合祖细胞(通过WTC:H2B-GFP或WTC:LMNB1-RFP细胞系标记)的心形器官的排序程度,我们分析了其横截面。为确保全面覆盖类器官中的所有细胞,我们采用最大强度投影叠加了GFP和RFP信号。基于最大强度投影,我们估算了细胞中心及其在类器官中的位置。随后以每个细胞为中心计算半径为100像素的圆形区域内细胞总数,该圆形区域作为细胞计数的感兴趣区域。针对每个细胞量化其ROI内GFP阳性与RFP阳性细胞的数量,通过计算所有细胞GFP阳性/RFP阳性比值的平均值,可揭示心形器官内细胞群体的混合模式。比值为1表示完全混合群体,偏离1则提示存在不同程度的分离或空间组织。排序程度的计算方式是将该比值减去1,因此0代表无排序,大于0的数值均表示存在排序现象。本分析由HeartBeat Bio完成。
¶ 批量RNA-seq分析
使用 umi2index (Lexogen) 对 reads 进行预处理,将 UMI 序列添加到读段标识符中,并使用 BBDuk $\mathrm { v } 3 8 . 0 6 $ (参考 polyA.fa.gz,truseq.fa. useshortkmer ) 进行修整。通过 bowtie2 v2.3.4.1 比对去除了映射至 iGenomes NCBI GRCh38 参考序列中包含的富集序列的读段。使用来自 Homo sapiens Ensembl 94 版的 GRCh38 组装基因组和基因注释对剩余读段进行分析。采用 star v2.6.0c 将读段比对至基因组,并通过 featureCounts (subread v1.6.2) 使用链特异性读段计数(-s 1)进行基因内读段计数。利用 DESeq2 v1.18.1 对原始计数进行差异基因表达分析,并对方差稳定化转换后的计数数据进行主成分分析。数据集已提交至基因表达综合数据库:SuperSeries GSE239891。
¶ 单细胞RNA测序分析
单细胞RNA测序读段使用cellranger v7.1.0 (10X Genomics)处理,采用预构建的10X GRCh38-2020-A参考和人类转录组探针集v1.0.1 (Chromium_Human_Transcriptome_Probe_Set_v1.0.1_GRCh38-2020-A.csv)。单细胞RNA测序数据的进一步处理在R软件v4.2.2中使用Seuratv4.3.0进行。我们对13218个左心室WTC:TNNI1细胞、9901个左心室WTC:TNNT2细胞、9221个右心室WTC:TNNI1细胞、10920个右心室WTC:TNNT2细胞、8687个心房WTC:TNNI1细胞、11986个流出道WTC:TNNI1细胞、13004个流出道WTC:TNNT2细胞、7979个房室管WTC:TNNI1细胞、11550个房室管WTC:TNNT2细胞的转录组进行了测序。如果细胞的线粒体含量低于 ,且基因数量指标高于自适应样本特异性阈值( 中位数绝对偏差用于对数转换的表达基因数量),则保留细胞。质量过滤导致去除了 的测序细胞,我们分析了12150个左心室WTC:TNNI1细胞、9422个左心室WTC:TNNT2细胞、8163个右心室WTC:TNNI1细胞、9916个右心室WTC:TNNT2细胞、8012个心房WTC:TNNI1细胞、11007个流出道WTC:TNNI1细胞、12187个流出道WTC:TNNT2细胞、7613个房室管WTC:TNNI1细胞、10936个房室管WTC:TNNT2细胞。在10个或更多细胞中检测到的基因被保留,而线粒体和核糖体蛋白基因被忽略。使用快速互最近邻(MNN)整合跨细胞系(WTC:TNNI1和WTC:TNNT2)的细胞。数据使用computeSumFactors进行对数标准化,随后使用multiBatchNorm进行每批次缩放标准化。数据集使用SeuratWrappers的fastMNN实现与对数标准化批次调整表达值以及2000个整合特征进行对齐(batchelor v1.14.1, SeuratWrappers v0.3.1)。然后使用MNN低维坐标通过UMAP(20维)进行聚类和可视化。对于模块评分,基于de Soysa等人2019年、68 Asp等人、26 Cui等人、61 和Sahara等人29 (表S2),生成了每个心脏亚型的选定基因列表。每个模块的所有基因表达通过UMAP可视化。数据集在Gene Expression Omnibus上提供:超级系列GSE239891。
¶ Cell Resource
¶ scRNA-seq与体内心脏胚胎心室数据集的整合
与Asp等人的scRNA-seq整合26按以下步骤进行:从https://data.mendeley.com/datasets/mbvhhf8m62/2获取PMID:31835037的过滤scRNA-seq计数矩阵和元数据表,将细胞亚群限定至相关细胞类型(心房细胞、心室细胞、成纤维样细胞、内皮细胞)。图3J所示预处理scRNA-seq数据(89,406个细胞)被进一步限定为内皮细胞和心肌细胞类型(剔除祖细胞、内胚层细胞及其他不表达TNNI1的细胞)(88,247/89,406个细胞)。在两个数据集中,仅保留双方实验共同表达的基因用于后续分析。将本数据集细胞数量随机降采样至3000个。采用fastMNN进行跨实验和细胞系整合(方法同前),使用1000个整合特征和10个MNN低维坐标作为UMAP可视化与聚类分析的输入参数。
¶ scRNA-seq与体内OFT数据集的整合
与Sahara等人29的单细胞RNA测序数据整合流程如下:PRJNA510181项目的单细胞原始读数通过前述分析流程进行处理,以获取智人Ensembl 94版本的每基因读数计数数据(使用trim-galore 进行修切、bowtie2 v2.3.4.1进行污染物过滤、star v2.6.0c进行比对、featureCounts subread v1.6.2进行统计汇总)。经过伪批量相似性分析后,我们排除了以下异常条件下的细胞:5.0周_V(主要为祖细胞)、6.5周_A(仅2个细胞)、8.0周_OFT(过于成熟无法与体外衍生的OFT比较)、8.5周_OFT(过于成熟无法与体外衍生的OFT比较)、7.5周_A(应激状态)。此外,我们还从单细胞RNA测序数据中排除了属于EC、AVC和内胚层簇的细胞,并去除了TNNI1 的CM祖细胞。仅保留在两个实验中均检测到的基因,对于PRJNA510181项目,仅将检测到8000个以上共享基因的高质量细胞纳入后续分析。如前述采用fastMNN整合不同实验的细胞,使用1000个整合特征和10个MNN低维坐标作为均匀流形逼近与投影(UMAP)的输入参数。
¶ 钙 瞬变量化
随后使用定制软件对视频进行分析。亮场图像用于识别哪些像素属于心形区域。计算像素强度分布f,若存在心形区域则呈现双峰分布。为识别双峰特性,我们通过计算 ; fi)和 ; fI)来定位分布中的波谷,继而找到使 --fi最小化的强度值。所有强度低于I的像素均被识别为心形区域。
钙信号 在心形 的每个像素上被平均。基线首先通过将离散小波变换中对应于高频的系数设为零来估计,并且峰值首先通过减去基线并找到高于1.5倍标准差的区域来检测。
基线估计和识别的峰值随后通过贝叶斯方法进行优化。
方差和相应的精度(方差的倒数)是从信号减去基线中为所有时间点估计的。不称为峰值。
基线变化估计为一阶有限差分 \mathbf { b d } _ { t } \ = \mathbf { s } _ { t + 1 } . . . \mathbf { s } _
基线的变化通过一阶有限差分 进行估计。
此前的基线变化通过加权和 进行整合,其中 是无峰值时一阶有限差分的精度,,且 ——这对应最大后验概率(MAP)估计,其中每个数据点会随 衰减。
相应地,此前的基线通过 进行整合,其中 是无峰值时信号的精度,,且 。若信号与估计基线显著偏离(满足 ),则判定为一个峰值;此时不整合该数据点,令 、,且精度的衰减因子由 替换为 ,即: 且 。
对于每个峰值,计算信号传播速度并识别搏动起源点。针对心脏形区域的每个像素点,计算信号随时间变化的方差 ,其方差阈值计算方式与明场图像像素强度分布的处理方法相同。仅考虑方差超过阈值的像素点。计算每个像素点的强度值并归化至最大值1,记录像素点达到峰值强度 时的对应帧。当超过30个像素点同时达到 最大强度的首帧被定义为起始帧,而除最多30个像素点外其余像素均达到 最大强度的末帧被定义为结束帧。将最先达到峰值强度 的最大连通像素群的平均位置视作信号传播起源点。通过计算各像素点与起源点的空间距离,以及该像素达到 峰值强度的帧与起源帧的时间差,得出所有其他像素点的信号传播速度。对所有像素点的速度值进行跨帧跨搏动的平均计算,最终确定心脏形区域的信号传播速度。采用相同技术生成信号传播图像,并根据帧差对像素进行颜色编码。存在以下五种情况的心脏形区域被排除在分析之外:(1)无搏动现象(2)出现折返现象(3)明场图像质量较差(4)存在荧光渗漏或荧光图像质量不佳(5)算法未能正确识别所有峰值。被排除样本的详细列表见表S3。
¶ 微电极阵列数据分析
峰值检测和初始参数由BrainWave 4通过心电场电位检测模块确定,设置参数如下:小波滤波等级6,硬阈值-200,峰前波持续时间50毫秒,峰后波持续时间700毫秒,Q波检测起始点20毫秒,T波检测起始点75毫秒,不应期40毫秒。噪声电极已被剔除。通过该分析平台提取了R波振幅、S波振幅、T波振幅(R/S/T振幅数据见图M1)、心电场电位频率(cFPR)、RT间期和ST间期。由于程序在未检测到T波时会随机定义T波位点,我们进一步过滤数据以排除:T波振幅小于60的电极、T波振幅标准差大于150的电极。同时排除RT间期超出全部电极RT间期总体均值3个标准差的电极。此外,任何记录到心电场电位频率低于9次/分钟的电极也被排除。随后使用Fridericia校正公式计算cRT与cST:cRT RT秒/((cFPR秒)-1)0.33)。在药物测试中,计算类器官各节段各项特征参数的均值,并通过对数倍变化标准化为给药前心形节段均值(ΔcRT间期)。最终数据导出并使用Prism软件进行分析。
¶ 统计学
实验中使用的统计信息可在图注中找到,例如N(生物学重复,使用不同传代次数的细胞批次进行)、n(技术学重复,使用相同传代次数的同一细胞批次进行)的数量、使用的统计检验方法以及变异度量指标。在进行假定正态分布的单因素方差分析前,我们对所有数据集进行了正态性检验和异常值检验。其他统计细节详见相应的定量方法部分。
补充图表
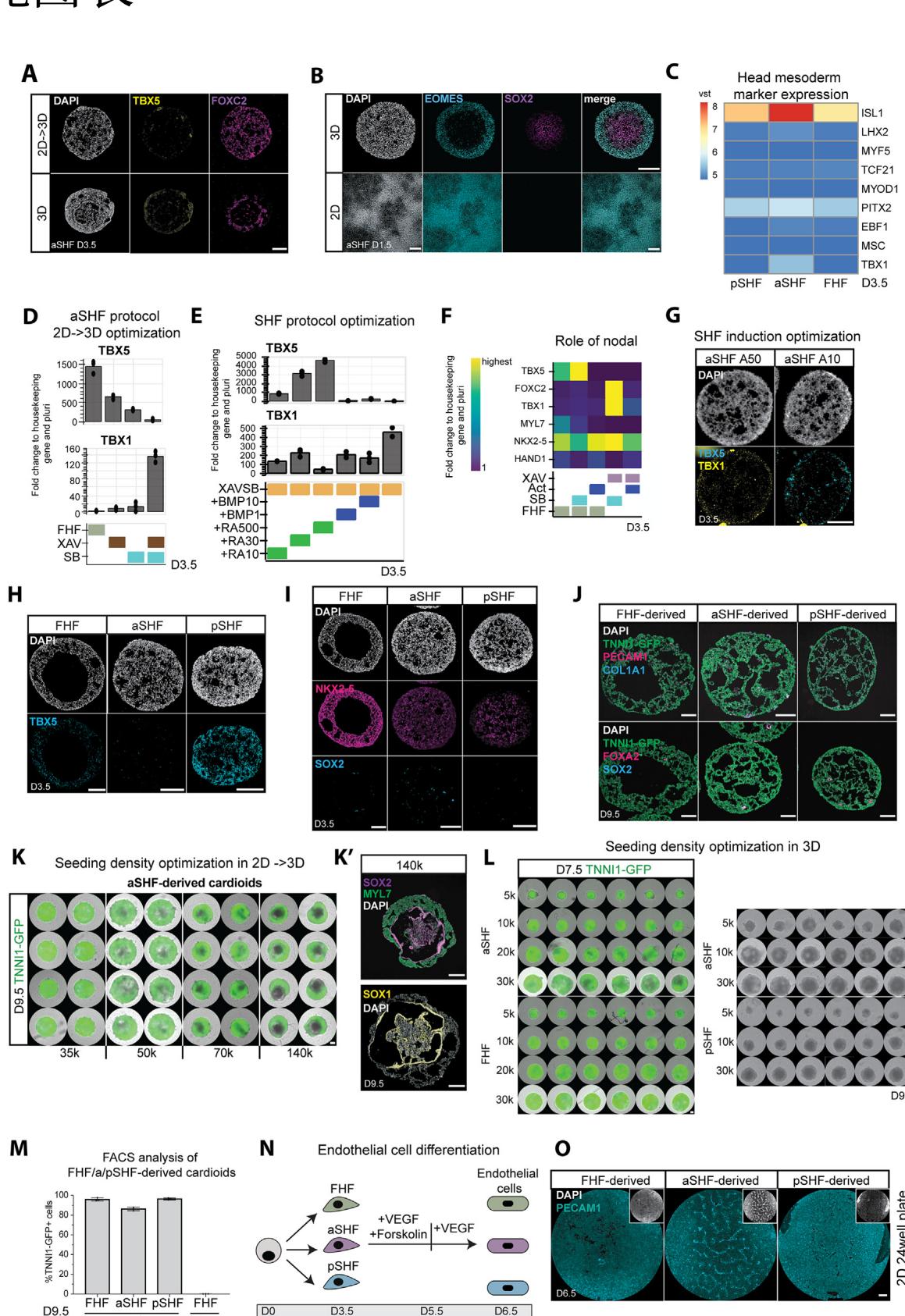
¶ 图S1. 心房第二心区/心室第二心区方案的优化及心房/心室第二心区来源类心脏体的表征(与图1相关)
(A) 采用3D与2D方案时,第3.5天心房第二心区(aSHF)细胞中TBX5与FOXC2的免疫染色结果。
(B) 2D与3D方案下,第二心区中胚层诱导(第1.5天)后的SOX2与EOMES染色结果。
© 第3.5天头部中胚层标志物的批量RNA测序分析热图。
(D) 在2D→3D方案中,心房第二心区模式化培养基1(第1.5天–第3.5天)条件的优化。第3.5天TBX1与TBX5水平的实时荧光定量PCR(RT-qPCR)结果。
(E) 通过在模式化阶段1测试不同浓度的BMP(单位:ng/mL)与视黄酸(RA,单位:nM)来优化心房/心室第二心区方案,所有条件均包含XAV-939与SB431542,结果通过实时荧光定量PCR检测。
(F) 实时荧光定量PCR结果显示,在心脏中胚层模式化培养基1处理至第3.5天期间,SB431542(10μM)与激活素(10ng/mL)对心房第二心区与第一心区(FHF)方案的影响。
(G) 不同激活素浓度诱导的心房第二心区祖细胞在第3.5天的横截面中,TBX1与TBX5的RNA原位杂交(RNA-scope)染色结果。
(H) 第3.5天所有三种祖细胞横截面的TBX5染色结果。
(I) 第3.5天第一心区、心房第二心区及心室第二心区类心脏体横截面上NKX2-5与SOX2的免疫染色结果。
(J) 所有类心脏体亚型中PECAM1(内皮细胞)、FOXA2(内胚层)、COL1A1(成纤维细胞)与SOX2(神经外胚层)的免疫染色结果。
(K) 针对2D→3D方案,在24孔板中优化心房第二心区来源类心脏体的接种密度(第9.5天,源自TNNI1-GFP报告基因细胞系的类心脏体)。(K0) 以高接种密度起始的心房第二心区类心脏体在第9.5天的SOX1/2+核心(神经标志物)免疫染色分析结果。
(L) 在96孔板中优化3D形成的接种密度。左图:第7.5天源自TNNI1-GFP报告基因细胞系的心房第二心区与第一心区来源类心脏体;右图:第9.5天WTC野生型细胞系中心房第二心区与心室第二心区来源的类心脏体。
(M) 通过流式细胞术定量第9.5天第一心区、心房第二心区及心室第二心区来源类心脏体中TNNI1-GFP+细胞的比例(N=3,n=24)。
(N) 三种祖细胞群分化为内皮细胞的方案示意图。
(O) 在24孔板中,三种祖细胞群分化为内皮细胞后的PECAM1免疫染色结果。
实时荧光定量PCR:以管家基因(PBGD)与多能性状态为对照的倍数变化。vst:方差稳定转换计数。
本图中所有比例尺长度均为200μm。所有实时荧光定量PCR结果均以管家基因(PBGD)与多能性状态为对照计算倍数变化,热图中每个基因的最高值见表格S1。本图所用细胞系:WTC与H9。所有柱状图均显示平均值±标准差(SD)。
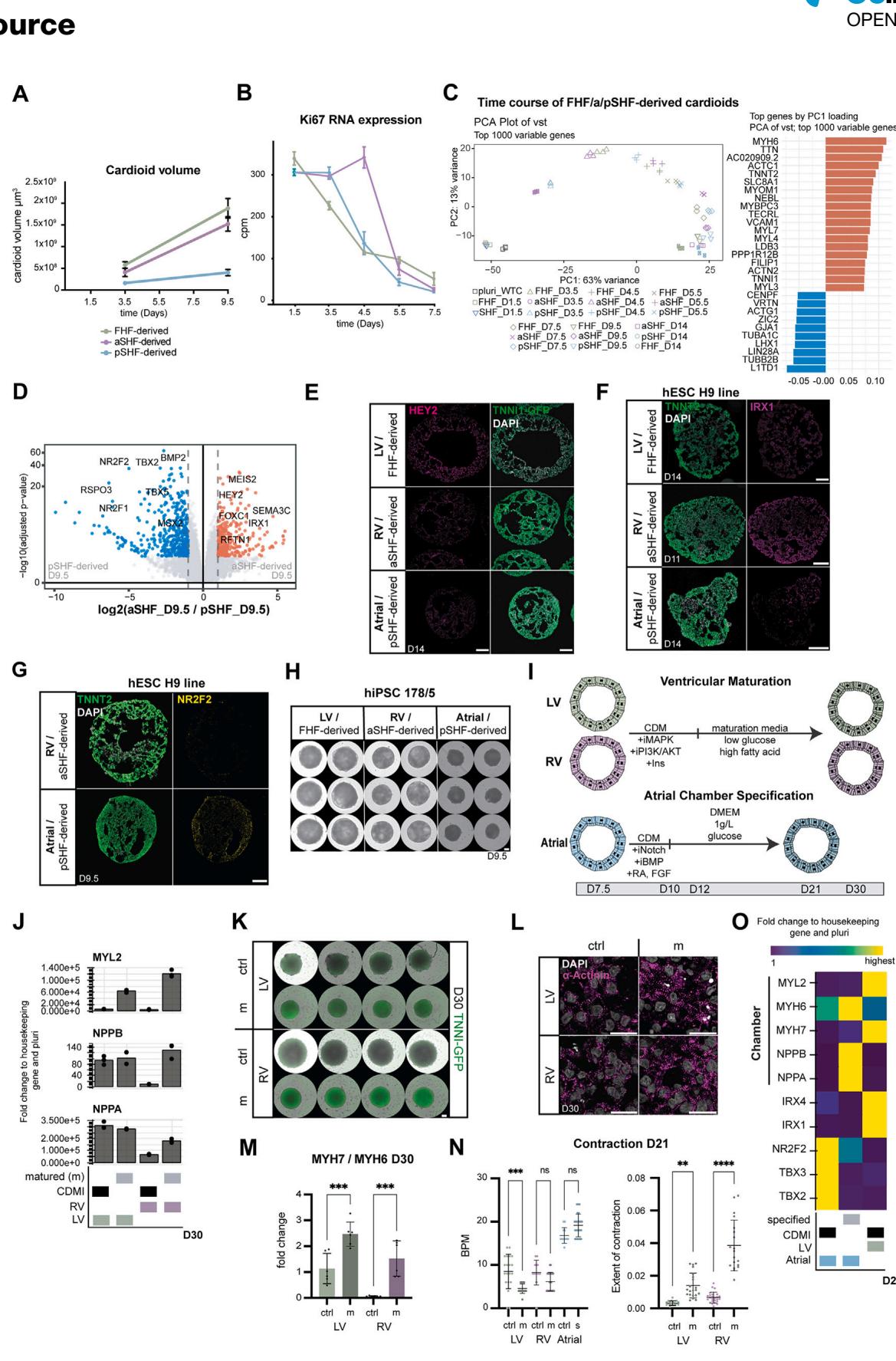
¶ 图S2. 第一心区(FHF)、心房第二心区(aSHF)及心室第二心区(pSHF)来源类心脏体的表征(与图2相关)
(A) 类心脏体体积随时间的测量结果(数据与图2D一致),代表性生物学重复(共3个生物学重复),每个时间点每个生物学重复包含8个技术重复(N=1时n=8)。
(B) 通过批量RNA测序定量增殖标志物Ki67随时间的mRNA表达水平(N=3,n=8)。每个点代表平均值±标准差(SD)。cpm:每百万读数。
© 使用前1000个可变基因的方差稳定转换(vst)数据绘制的主成分分析(PCA)图。
(D) 火山图显示第9.5天心房第二心区与心室第二心区来源类心脏体的差异表达基因。
(E) 第一心区、心房第二心区及心室第二心区来源类心脏体横截面上,谱系特异性标志物HEY2(左心室标志物)的染色结果。
(F) H9细胞系中,左心室(LV)、右心室(RV)及心房类心脏体中TNNT2与IRX1的免疫染色结果。
(G) H9细胞系中,左心室、右心室及心房类心脏体中TNNT2与NR2F2的免疫染色结果。
(H) 人诱导多能干细胞(hiPSC)178/5细胞系中,第9.5天左心室、右心室及心房类心脏体的整体相差成像图。
(I) 心腔特化程序示意图。
(J) 代表性实时荧光定量PCR(RT-qPCR)结果显示,心室心腔特化方案相较于对照组(CDMI培养基)的效果。
(K) WTC:TNNI标记细胞系中,第30天左心室和右心室类心脏体的整体相差成像与荧光成像图。m:成熟组;crtl:对照组(CDMI培养基)。
(L) 成熟组与对照组类心脏体中α-辅肌动蛋白(α-Actinin)的免疫染色结果。比例尺:20微米。
(M) 实时荧光定量PCR检测左心室和右心室成熟组与对照组类心脏体中MYH7/MYH6的RNA表达比值(N=2,每组包含6个混合类心脏体)。
(N) 成熟组(m)或特化组(s)左心室、右心室及心房类心脏体的收缩功能分析:左图为心率(BPM,次/分钟),右图为收缩幅度(N=2,n=18–26)。
(O) 代表性实时荧光定量PCR结果显示,心房心腔特化方案相较于对照组(CDMI培养基)的效果。
本图中所有比例尺长度均为200微米,特殊标注除外。所有实时荧光定量PCR结果均以管家基因(PBGD)与多能性状态(pluri)为对照计算倍数变化,热图中每个基因的最高值见表格S1。本图所用细胞系:WTC与H9。
(A和A0) 源自H2B-GFP或LMNB1-RFP人多能干细胞(hPSC)报告基因系的心脏祖细胞在第3.5天分选后混合。类心脏体的横截面图像及示意图显示:(A) 不同祖细胞群来源心肌细胞的分选结果;(A0) 相同祖细胞混合形成的类心脏体。TNNT2染色显示心肌细胞(CM)分化效率极高。比例尺:200微米。
(B) 混合后1天(第4.5天)心脏祖细胞分选的整体成像图。比例尺:500微米。
© 采用常规2D→3D方案(非混合祖细胞)生成的类心脏体,钙粘蛋白(Cadherin)基因随时间的差异表达批量RNA测序分析热图。
(D) 不同祖细胞群混合形成的类心脏体横截面,右心室特异性标志物(IRX1)与心房特异性标志物(NR2F2)的染色结果。
(E) 第3.5天或第5.5天融合的类心脏体整体成像图(成像时间为第9.5天)。比例尺:1000微米。
(F) 融合后1天(第4.5天)的类心脏体。比例尺:1000微米。
(G–I) (G) 第6.5天和第9.5天,不同融合类型类心脏体的钙活动阳性率(点代表生物学重复N);(H) 第6.5天和第9.5天,不同融合类型类心脏体的钙折返活动阳性率(点代表生物学重复N);(I) 第6.5天和第9.5天,不同融合类型类心脏体的钙信号传导速度(点代表技术重复n)。(G–I) N=2–5,每个亚型n=41–160,排除标准见表格S3。
(J) 宽场显微镜观察心腔排列异常的多心腔类心脏体(心房位于中央):蓝色标记心房细胞,品红色标记右心室细胞。
(K) (J)中类心脏体单次心跳的代表性钙信号传导图(颜色标记每个像素达到峰值强度50%的时间)。
(L–P) 分化第14天三心腔类心脏体的微电极阵列(MEA)参数(N=3,n=5):(L) 心脏场电位频率;(M) RT间期;(N) Fridericia校正RT间期;(O) ST间期;§ Fridericia校正ST间期。
(Q) 双心腔类心脏体的谱系特异性染色(NR2F2与IRX1)结果。
® 采用图5M所示方案制备的多心腔类心脏体(含两个不同腔室)在第14天的冰冻切片:多心腔类心脏体共享部分腔室(蓝色箭头指示),且表达TNNT2。
vst:方差稳定转换计数。本图中所有比例尺长度均为200微米,特殊标注除外。所有图表均显示平均值±标准差(SD)。采用单因素方差分析(one-way ANOVA)进行统计分析:∗p<0.05,∗∗p<0.01,∗∗∗p<0.001,∗∗∗∗p<0.0001;ns:无统计学差异。

¶ 图S3. 流出道(OFT)和房室瓣(AVC)方案的优化及流出道/房室瓣类心脏体的表征(与图3相关)
(A) 通过批量RNA测序优化模式化阶段2的视黄酸(RA)浓度,以检测流出道(OFT)和右心室(RV)标志物的表达。
(B) 第9.5天右心室和流出道类心脏体中流出道标志物ISL1的荧光冰冻切片图像。
© H9细胞系中,第9.5天流出道和右心室类心脏体横截面的WNT5A染色结果。
(D) 通过批量RNA测序优化用于右心室和流出道标志物检测的Wnt激活剂(iWNT)类型。
(E) 上皮间质转化(EMT)启动的分化方案示意图。
(F) 分别在第6.5天和第8.5天,Patsch对照组、左心室(LV)及流出道类心脏体中心肌肌钙蛋白T(cTnT)和α-平滑肌肌动蛋白(α-SMA)的免疫染色结果。
(F0) 第8.5天流出道类心脏体中SM22和钙调蛋白(calponin)的染色结果。
(G) 第9.5天流出道和房室瓣类心脏体横截面的COL1A1(成纤维细胞标志物)与CD31(内皮细胞标志物)染色结果。
(H) 通过批量RNA测序优化心室第二心区(pSHF)中胚层诱导条件,测试不同浓度的激活素(Activin)和CHIR99021。
(I) 批量RNA测序热图显示,第3.5天和第9.5天心房及房室瓣相关基因的骨形态发生蛋白(BMP)浓度优化结果。
(J) (J) UMAP图显示NR2F2和PFGRA的表达;(J0) UMAP图显示MSX2、HEY1、WNT5A、MSX1、TBX3、TBX2标志物的表达。(注:UMAP为统一流形逼近与投影,保留缩写)
(K) 心室心肌细胞(CM)亚群中心室(左心室、心室增殖群、右心室)基因模块的表达情况。
(L) UMAP图显示心室心肌细胞亚群中IRX4和IRX1的表达。
(M) 点图显示心室(左心室、心室增殖群、右心室)、内皮细胞(EC)和内胚层集群中表达最高的基因。
(N) 与Sahara等人[29]的转录组数据集整合分析,显示细胞类型集群的重叠情况(样本随机降采样至1000个细胞)。
vst:方差稳定转换计数。本图中所有比例尺长度均为200微米(原文“mm”为笔误,根据生物学实验常规修正)。单细胞RNA测序(scRNA-seq):生物学重复N=1-2,技术重复n=16-72,模块基因列表见表格S2。
(E) 两个生物学重复(N1和N2)的UMAP图,显示各集群来源于哪种类心脏体亚型。
(F) CDH5和TNNI1基因的表达情况。
(G) 细胞周期S期模块评分的表达情况。
(H和I) 与Asp等人[26]的转录组数据集整合分析,显示(H) 细胞的重叠情况;(I) 细胞类型集群的重叠情况(输入参数为1000个整合特征和10个相互最近邻(MNN)低维坐标)。
(J) 两个生物学重复的心室心肌细胞亚群UMAP图。
(K) 点图显示心肌细胞、内皮细胞和内胚层标志物基因的表达情况。
本图中所有比例尺长度均为200微米。所有图表均显示平均值±标准差(SD)。
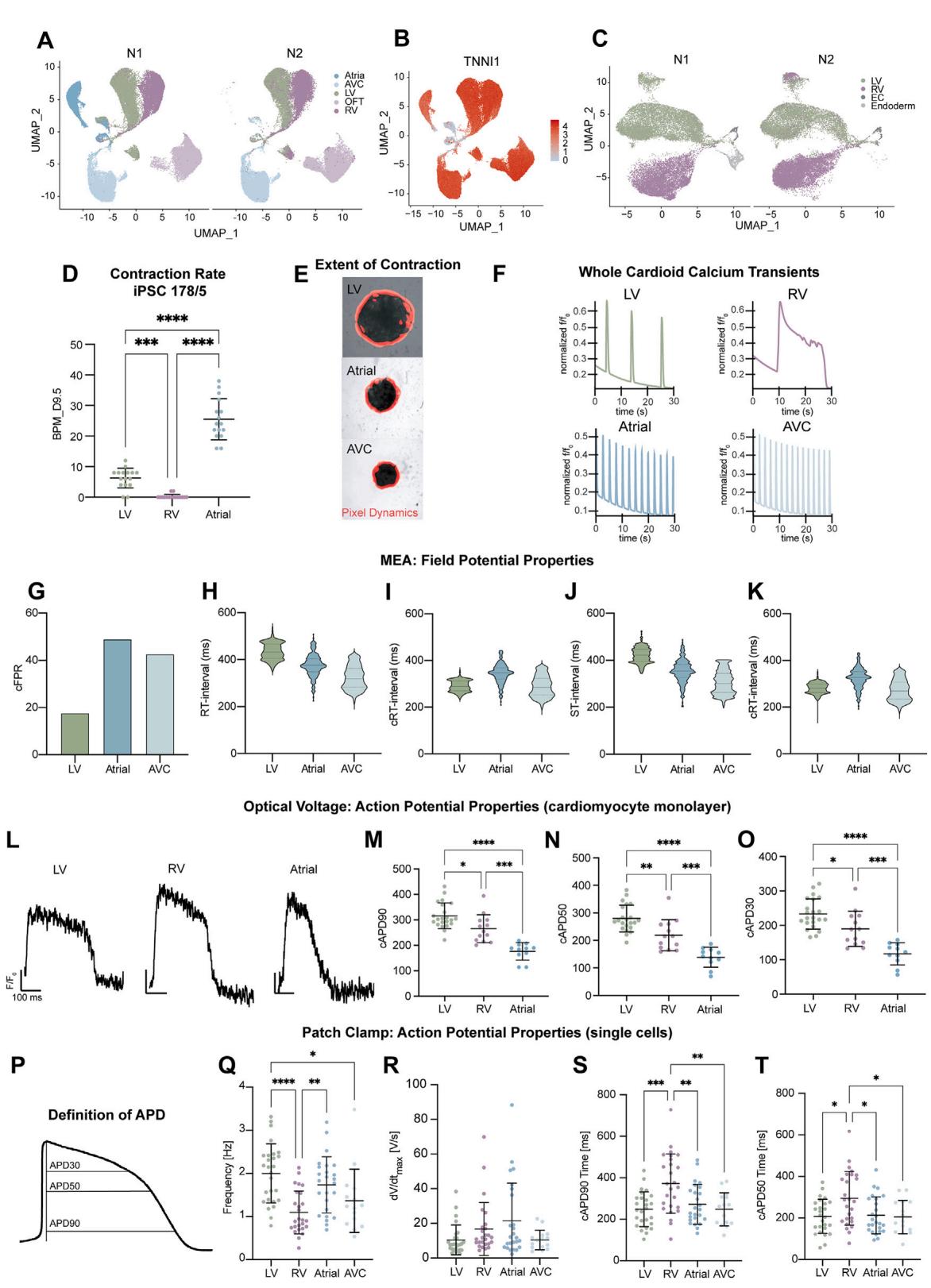
¶ 图S4. 利用钙瞬变和电压敏感染料对类心脏体亚型进行功能表征(与图4相关)
(A) 收缩功能分析:人诱导多能干细胞(iPSC)178/5细胞系的心率(BPM,次/分钟),生物学重复N=1,技术重复n=16。
(B) 不同亚型类心脏体的收缩幅度代表性图像(红色标记收缩区域)。
© 从整个类心脏体区域记录30秒内的钙轨迹,显示荧光强度相对变化(f/f₀);所用细胞系为WTC、TNNT2-GCaMP6f。
(D) 子图(E)-(G)的参数定义。
(E–G) 整个类心脏体钙瞬变的定量分析:(E) 90-90间期(相邻两个峰值90%强度之间的时间);(F) 达到最大强度的时间;(G) 舒张时间。数据采集于第9.5天。所有数据点代表每个类心脏体所有记录搏动的平均值。左心室(LV)和心房(AT)的生物学重复N=4、技术重复n=64,房室瓣(AVC)的生物学重复N=1、技术重复n=24。排除所有未搏动的类心脏体,最终左心室、心房和房室瓣的有效重复数分别为n=25、43和24;所用细胞系为WTC、CAG-GCaMP6f。
(H–L) 多电极阵列(MEA)分析:生物学重复N=1,技术重复n=1,电极数量如文献[19]所述,数据点代表单个电极的检测结果;所用细胞系为WTC。(H) cFPR:心脏场电位频率;(I) RT间期;(J) Fridericia校正RT间期(cRT间期);(K) ST间期;(L) Fridericia校正ST间期。
(M) 源自解离类心脏体的左心室、右心室(RV)和心房心肌细胞单层的光学电压成像代表性曲线。Y轴表示相对强度变化,X轴表示100毫秒(ms)。
(N–P) (N) Fridericia校正动作电位时程(APD₉₀);(O) APD₅₀;§ 二维FluoVolt成像数据的APD₃₀。左心室记录25孔,右心室26孔,心房13孔。每个数据点代表单孔内所有动作电位(AP)的平均值。
(Q) 示意图显示膜片钳和FluoVolt实验中APD的计算方法。
(R–U) 图4K和4L中膜片钳实验的补充数据:® 自发搏动频率;(S) 最大上升速度;(T) Fridericia校正APD₉₀值;(U) Fridericia校正APD₅₀值。
所有图表均显示平均值±标准差(SD)。采用单因素方差分析(one-way ANOVA)进行统计检验:*p<0.05,**p<0.01,***p<0.001,****p<0.0001;ns:无统计学差异。
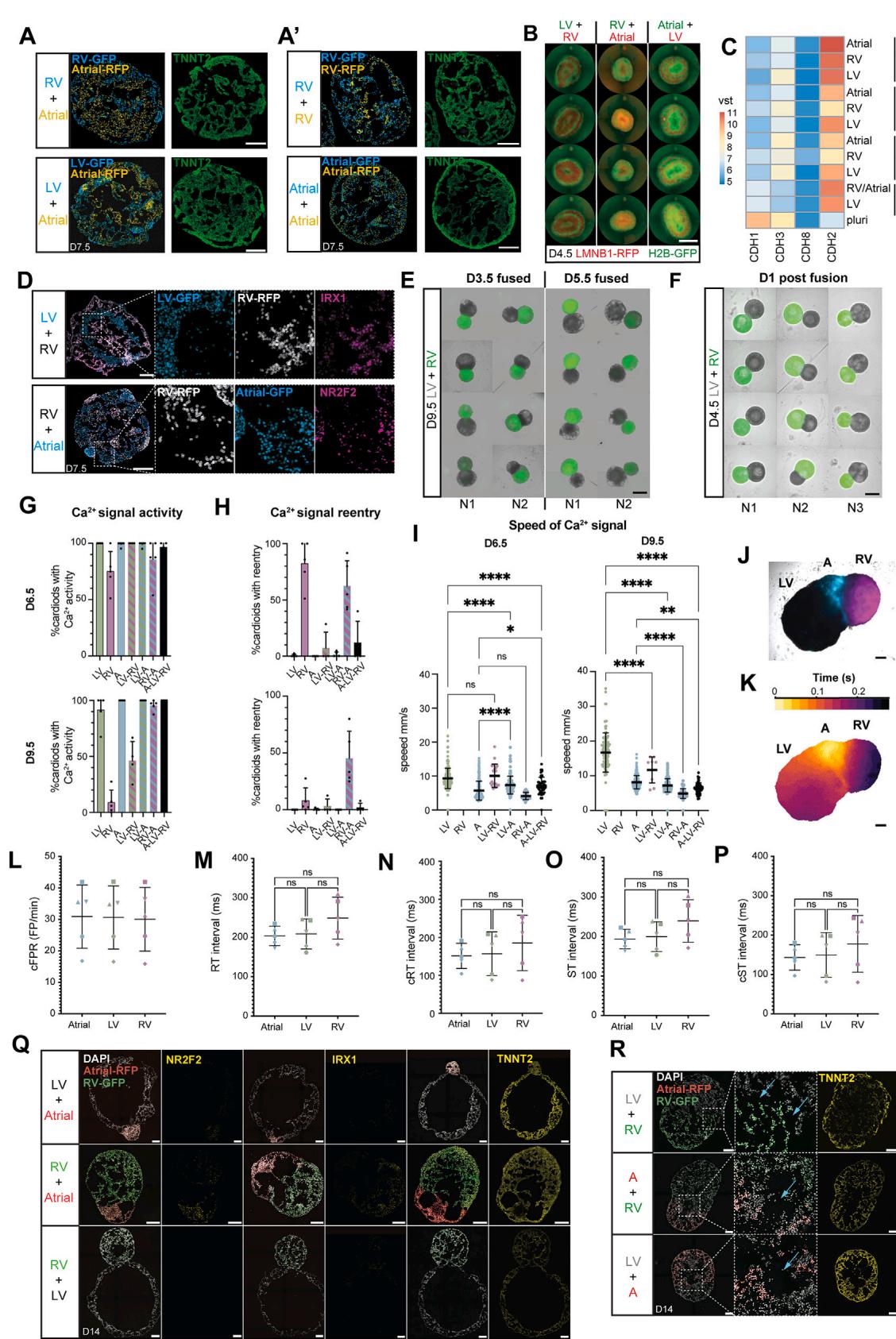
¶ 图S5. 祖细胞分选及多心腔类心脏体的构建(与图5相关)
(A和A0) 源自H2B-GFP或LMNB1-RFP人多能干细胞(hPSC)报告基因系的心脏祖细胞,在第3.5天分选后混合。类心脏体的横截面图像及示意图显示:(A) 不同祖细胞群来源心肌细胞的分选结果;(A0) 相同祖细胞混合形成的类心脏体。心肌肌钙蛋白T(TNNT2)染色显示心肌细胞(CM)分化效率极高。比例尺:200微米(原文“mm”为笔误,根据实验常规修正)。
(B) 混合后1天(第4.5天)心脏祖细胞分选的整体成像图。比例尺:500微米。
© 采用常规2D→3D方案(非混合祖细胞)生成的类心脏体,钙粘蛋白(Cadherin)基因随时间的差异表达批量RNA测序分析热图。
(D) 不同祖细胞群混合形成的类心脏体横截面,右心室(RV)特异性标志物(IRX1)与心房特异性标志物(NR2F2)的染色结果。
(E) 第3.5天或第5.5天融合的类心脏体整体成像图(成像时间为第9.5天)。比例尺:1000微米。
(F) 融合后1天(第4.5天)的类心脏体。比例尺:1000微米。
(G–I) (G) 第6.5天和第9.5天,不同融合类型类心脏体的钙活动阳性率(数据点代表生物学重复N);(H) 第6.5天和第9.5天,不同融合类型类心脏体的钙折返活动阳性率(数据点代表生物学重复N);(I) 第6.5天和第9.5天,不同融合类型类心脏体的钙信号传导速度(数据点代表技术重复n)。(G–I) 生物学重复N=2–5,每个亚型技术重复n=41–160,排除标准见表格S3。
(J) 宽场显微镜观察心腔排列异常的多心腔类心脏体(心房位于中央):蓝色标记心房细胞,品红色标记右心室细胞。
(K) (J)中类心脏体单次心跳的代表性钙信号传导图(颜色标记每个像素达到峰值强度50%的时间)。
(L–P) 分化第14天三心腔类心脏体的微电极阵列(MEA)参数(生物学重复N=3,技术重复n=5):(L) 心脏场电位频率;(M) RT间期;(N) Fridericia校正RT间期;(O) ST间期;§ Fridericia校正ST间期。
(Q) 双心腔类心脏体的谱系特异性染色(NR2F2与IRX1)结果。
® 采用图5M所示方案制备的多心腔类心脏体(含两个不同腔室)在第14天的冰冻切片:多心腔类心脏体共享部分腔室(蓝色箭头指示),且表达TNNT2。
vst:方差稳定转换计数。本图中所有比例尺长度均为200微米,特殊标注除外。所有图表均显示平均值±标准差(SD)。采用单因素方差分析(one-way ANOVA)进行统计检验:*p<0.05,**p<0.01,***p<0.001,****p<0.0001;ns:无统计学差异。
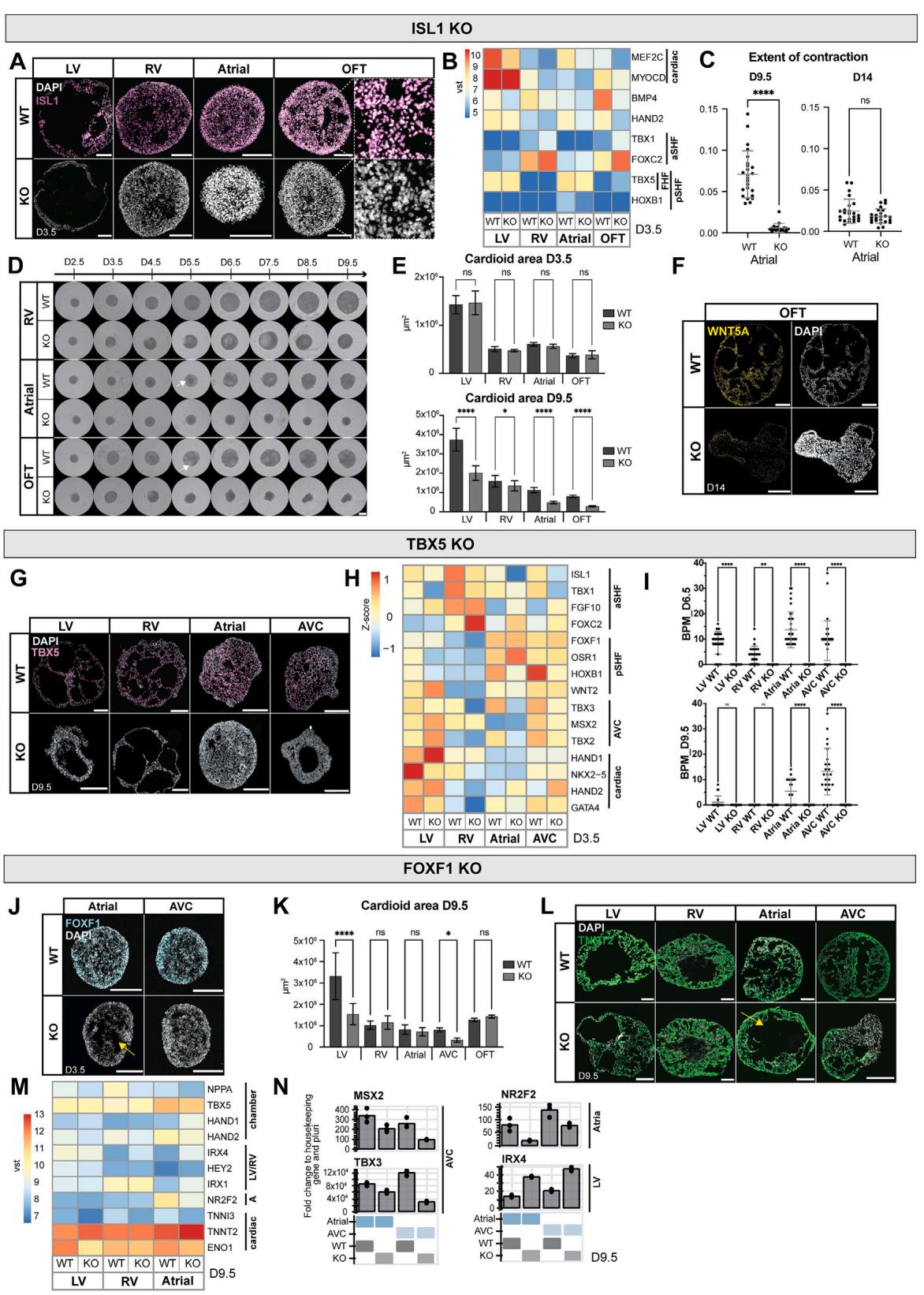
¶ 图S6. 转录因子突变类心脏体的腔室特异性缺陷(与图6相关)
(A) 通过免疫染色验证第3.5天所有方案中ISL1基因敲除(KO)细胞系的有效性。
(B) 批量RNA测序分析显示,第3.5天ISL1-KO与野生型(WT)类心脏体的腔室特异性基因表达差异。
© 第9.5天和第14天,心房ISL1-KO类心脏体与野生型(WT)的收缩幅度比较(N=1,n=24)。
(D) 利用ISL1-KO和野生型(WT)细胞系观察右心室(RV)、心房及流出道(OFT)类心脏体形成的时间进程。箭头指示野生型(WT)类心脏体的腔室形成。比例尺:500微米(原文“mm”为笔误,根据实验常规修正)。
(E) 第3.5天(N=4,n=48)和第9.5天(N=2,n=32)ISL1-KO与野生型(WT)类心脏体的面积定量分析。
(F) 第14天,流出道(OFT)ISL1-KO类心脏体与野生型(WT)中流出道标志物WNT5A的杂交链式反应(HCR)检测结果。
(G) 通过免疫染色验证第9.5天左心室(LV)、右心室(RV)、心房及房室瓣(AVC)类心脏体中TBX5基因敲除(KO)细胞系的有效性。
(H) TBX5-KO与野生型(WT)类心脏体的批量RNA测序分析,显示第3.5天心房第二心区(aSHF)、心室第二心区(pSHF)及房室瓣(AVC)特异性基因的表达差异。
(I) 第6.5天和第9.5天,左心室(LV)、右心室(RV)、心房及房室瓣(AVC)类心脏体的心率(BPM,次/分钟)比较(野生型vs基因敲除型,N=3,n=36)。
(J) 第3.5天,心房及房室瓣(AVC)类心脏体中FOXF1基因敲除(KO)细胞系的有效性验证。黄色箭头指示心房FOXF1-KO类心脏体中增强的腔室形成。
(K) 第9.5天,所有亚型类心脏体的FOXF1-KO与野生型(WT)面积分析(左心室、右心室、心房、房室瓣:N=3–4,n=24–37;流出道:N=1,n=16)。
(L) 第9.5天,FOXF1野生型(WT)与基因敲除型(KO)类心脏体中TNNT2的表达。黄色箭头指示与野生型相比,FOXF1-KO心房类心脏体的腔室增大。
(M) 批量RNA测序分析显示,第9.5天FOXF1-KO与野生型(WT)细胞系中左心室(LV)、右心室(RV)及心房类心脏体的腔室特异性基因表达差异。
(N) 心房及房室瓣(AVC)类心脏体中FOXF1-KO与野生型(WT)的代表性实时荧光定量PCR(RT-qPCR)结果。
本图中所有比例尺长度均为200微米,特殊标注除外。实时荧光定量PCR(RT-qPCR):以管家基因(PBGD)与多能性状态为对照计算倍数变化。vst:方差稳定转换计数。所有柱状图均显示平均值±标准差(SD)。采用单因素方差分析(one-way ANOVA)进行统计检验:*p<0.05,**p<0.01,***p<0.001,****p<0.0001;ns:无统计学差异。
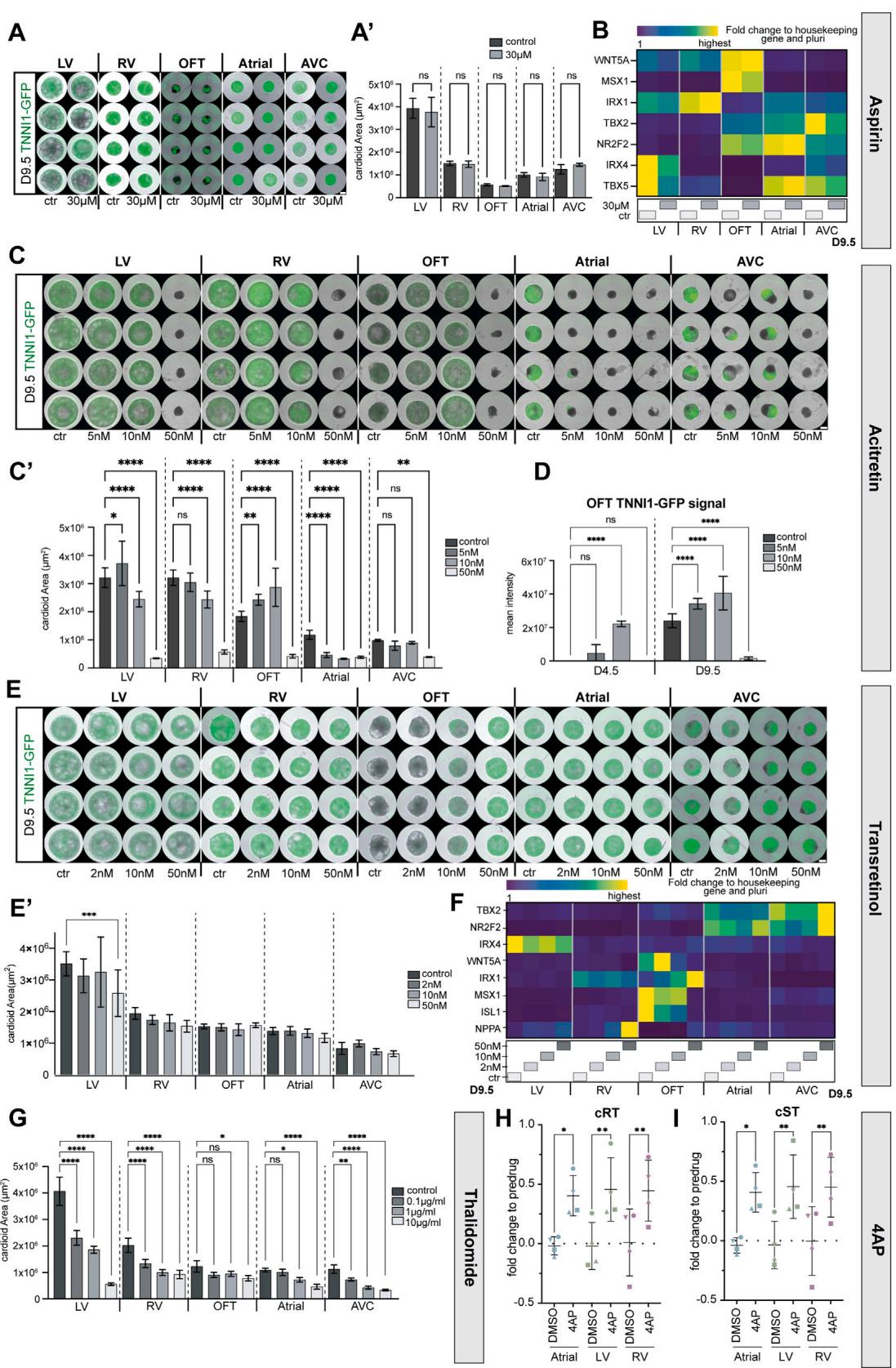
¶ 图S7. 致畸剂诱导类心脏体腔室特异性缺陷的表征(与图7相关)
(A–G) 所有类心脏体均从中胚层诱导阶段(第0天)开始接受致畸剂处理,持续至第9.5天。实验采用不同浓度的致畸剂进行多次重复。(A) 阿司匹林(Aspirin)处理组与未处理组(对照组)的TNNI1-GFP报告基因系类心脏体代表性整体成像图;(A0) 类心脏体面积的代表性定量分析(第9.5天,N=1,n=8)。Ctr:对照组。(B) 阿司匹林处理组与对照组类心脏体的实时荧光定量PCR(RT-qPCR)结果。© 不同浓度阿维A酯(acitretin)处理组类心脏体的代表性整体成像图;(C0) 第9.5天类心脏体面积的代表性定量分析(N=1,n=8)。(D) 第4.5天和第9.5天,阿维A酯处理组与未处理组流出道(OFT)类心脏体中TNNI1-GFP报告基因信号的定量分析(N=1,n=8)。(E) 全反式视黄醇(trans-retinol)处理组与对照组的TNNI1-GFP报告基因系类心脏体代表性整体成像图及面积定量分析(E0,第9.5天,N=1,n=8)。(F) 实时荧光定量PCR结果显示,第9.5天全反式视黄醇处理后所有类心脏体亚型的腔室特异性基因表达情况。(G) 不同浓度沙利度胺(thalidomide)处理组与对照组(Ctr)的TNNI1-GFP报告基因系类心脏体大小定量分析(第9.5天,N=1,n=8)。
(H和I) 第14天,三心腔类心脏体(心房-左心室-右心室有序排列)经二甲基亚砜(DMSO,溶剂对照)和4-氨基吡啶(4AP)处理后的多电极阵列(MEA)分析(N=3,n=4)。(H) 相对于给药前的Fridericia校正RT间期倍数变化(数据点代表技术重复n);(I) 相对于给药前的Fridericia校正ST间期倍数变化(数据点代表技术重复n)。
本图中所有比例尺长度均为500微米(原文“mm”为笔误,根据实验常规修正)。实时荧光定量PCR(RT-qPCR):以管家基因(PBGD)与多能性状态为对照计算倍数变化。所有柱状图均显示平均值±标准差(SD)。采用单因素方差分析(one-way ANOVA)进行统计检验:*p<0.05,**p<0.01,***p<0.001,****p<0.0001;ns:无统计学差异。