¶ 生成具有功能性nbM-皮层胆碱能投射的人源基底核类器官于移植组合体中
¶ 发表期刊:Cell Stem Cell
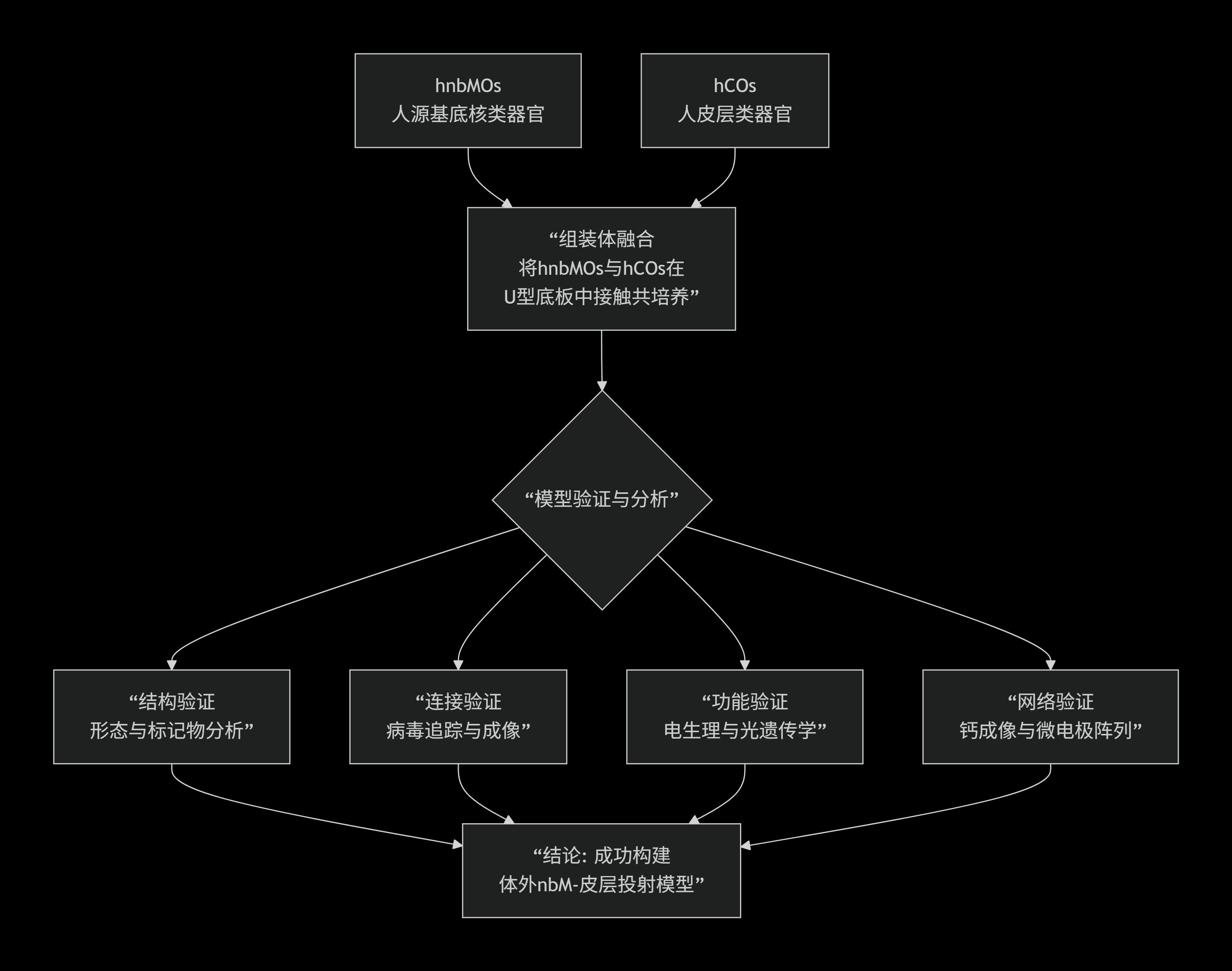
图片摘要
 |
¶ 内容解读:¶ 基底核(nbM)相关细胞的分化与功能研究
¶ 下半部分:类器官组装体的应用(体外、体内与疾病模型)“组装体(Assembloid)” ,组装体是指将不同类型的类器官(或细胞群体)结合,模拟更复杂的神经环路。 Assembloid in vitro(体外组装体):从hPSCs分别诱导出人脑皮层类器官(hCO)和hnbMO,再将两者结合形成nbM - 皮质组装体。通过这种体外模型,研究同步化神经网络(Synchronized network) —— 即基底核与皮层之间的神经环路如何产生同步的电活动(如图中不同颜色的电生理波形)。 Assembloid in vivo(体内组装体):将 hCO 和 hnbMO 移植到动物模型中,研究功能性连接(Functional connectivity) —— 即移植后的组装体能否在体内形成有功能的神经环路,比如电生理信号的传递。 Disease modeling(疾病模型):以唐氏综合征(Trisomy 21,即 21 三体综合征) 为例,对比唐氏综合征(DS) 与整倍体(Euploid,正常染色体组) 的 nbM - 皮质组装体,研究其投射缺陷(Projection defects) —— 即疾病状态下神经投射的异常,从而揭示唐氏综合征的神经环路病变机制。 ¶ 整体核心这张图展示了从干细胞分化到类器官构建,再到神经环路模拟与疾病建模的完整研究链条,目的是解析基底核 - 皮层通路的发育、功能及其在疾病(如唐氏综合征)中的异常,为神经科学基础研究和疾病机制探索提供工具与方法。基底核功能障碍是21三体综合征在大脑发育上造成的一个重要后果,并直接解释了该疾病的一部分核心症状。 |

迈内特基底核(nbM)负责调节皮层功能与认知。刘及其团队报告了一种方法,可用于创建包含胆碱能投射神经元的人源nbM类器官(hnbMOs),这些神经元能与皮层建立功能性连接。该研究为探索神经系统疾病中的nbM神经环路和胆碱能功能障碍提供了一个模型。
¶ 研究亮点
- 由hPSCs生成的人源nbM类器官(hnbMOs)重现了基底核的特有身份特征
- hnbMOs在体外与人皮层类器官(hCOs)建立了长程投射与功能性连接
- 移植的组合体形成了功能性的nbM-皮层胆碱能通路
- nbM-皮层组合体模拟了唐氏综合征中的投射缺陷
¶ 作者
Da Wang,1,2,7 Xinyue Zhang,2,7 Xiao-Yan Tang,1,7 Yixia Gan,3,7 Hanwen Yu,1,7 Shanshan Wu,1,2 Yuan Hong,1 Mengdan Tao,1 Chu Chu,1 Xiaoxuan Qi,4 Hao Hu,2 Yimin Zhu,1 Wanying Zhu,1 Xiao Han,1 Min Xu,1 Yi Dong,3, * Qing Cheng,4, * Xing Guo,2,5, * and Yan Liu1,2,6,8, *
1南京医科大学药学院,干细胞与神经再生研究所,南京 211166,中国
2南京医科大学,生殖医学与子代健康全国重点实验室,南京 211166,中国
3华东师范大学,教育部青少年健康评价与运动干预重点实验室,上海 200241,中国
4南京医科大学附属妇产医院(南京市妇女儿童保健院),妇产科,南京 210004,中国
5南京医科大学基础医学院,神经生物学系,南京 211166,中国
6江苏省类脑智能技术创新中心,南京 210029,中国
7这些作者对工作贡献相同
8联系人
*通讯作者:ydong@tyxx.ecnu.edu.cn , chengq@njmu.edu.cn , guox@njmu.edu.cn , yanliu@njmu.edu.cn
https://doi.org/10.1016/j.stem.2025.10.004
¶ 摘要
迈内特基底核(nbM)作为基底前脑的主要胆碱能输出核团,负责调节皮层调控、学习与记忆功能。nbM-皮层胆碱能通路的功能失调与多种神经退行性和神经发育性疾病相关,包括阿尔茨海默病(AD)与唐氏综合征(DS)。本研究利用人多能干细胞(hPSCs)成功生成了包含功能性胆碱能投射神经元的人源nbM类器官(hnbMOs)。随后,我们通过将hnbMOs与人胎儿脑组织共培养,并将其移植到免疫缺陷小鼠体内,重建了从nbM到皮层的长距离胆碱能投射。我们进一步通过融合hnbMOs与人皮层类器官(hCOs),构建了nbM-皮层组合体系统,并在移植组合体中建立了人特异性的胆碱能投射系统。借助病毒示踪和功能分析技术,我们验证了胆碱能神经元可向hCOs内发出投射并形成突触连接。此外,我们在DS来源的组合体中成功捕捉到了投射缺陷,这证明了该模型在研究nbM相关神经环路与神经系统疾病中的应用价值。
¶ 引言
基底核,亦称迈内特基底核(nbM),主要起源于内侧神经节隆起(MGE),被认为是基底前脑的主要胆碱能输出核团之一。研究表明,该核团能够动态调节皮层活动,并在学习与记忆过程中发挥关键作用[1,2]。从基底前脑至皮层的胆碱能通路功能失调,与阿尔茨海默病、唐氏综合征(DS)等伴随认知障碍的神经系统疾病密切相关[3-5]。人多能干细胞(hPSCs)分化产生的人胆碱能神经元(CHNs),为研究胆碱能神经元相关疾病及细胞治疗提供了有力工具[6-8]。既往研究虽成功制备了二维(2D)培养的人基底前脑胆碱能神经元(BFCNs),但该模型难以准确模拟不同脑区间的空间结构、细胞多样性及交互作用。
基于hPSCs的三维(3D)培养脑类器官技术,能够重现人脑的发育过程与生理功能[9-12]。已有研究成功构建了包括大脑皮层、丘脑(TH)、小脑等特定脑区类器官[13-15]。随后,通过融合不同区域特异性类器官形成的组合体,成为研究不同脑区间体外交互作用的新模型[16-19]。同时,移植人脑类器官的动物模型,为探究人类神经细胞的独特特性及体内神经环路病理生理机制提供了重要平台[20,21]。尽管目前已建立多种特定核团类器官[22-24],但尚未见成功构建含BFCNs的类器官或组合体的报道。因此,亟需开发能更好模拟人基底核及nbM-皮层通路胆碱能投射的优化模型。
本研究开发了一种将hPSCs定向分化为nbM类器官的新方法,该器官在体外和体内均包含功能性CHNs。我们进一步将人nbM类器官(hnbMOs)与人皮层类器官(hCOs)融合,构建出nbM-皮层组合体,并验证了其中CHNs能向hCOs发出投射并形成功能性连接。通过创新性地建立双重移植策略,将相应类器官分别移植至皮层与nbM区域,成功构建了完整的人源胆碱能投射系统。此外,我们在DS诱导多能干细胞(iPSCs)来源的组合体中,识别出CHNs的投射缺陷。本研究成果为研究nbM-皮层胆碱能神经元环路相关神经系统疾病提供了全新的研究范式。
¶ 结果
¶ 从hPSCs生成hnbMOs
为在体外生成hnbMOs,我们基于先前报道的2D BFCNs培养策略[6],建立并优化了一套分化方案(图1A)。在分化早期使用高浓度音猬因子(SHH)并结合SHH通路激动剂嘌呤吗啡胺(Pur),成功诱导生成可发育为基底核的MGE祖细胞[25,26]。为促进基底核内CHNs的进一步分化,后续添加了神经生长因子(NGF)[2]。为确定hnbMOs的最佳分化条件,我们进行了SHH剂量依赖性实验,以在神经上皮期(第10天)对神经管进行腹侧化诱导。结果显示,类器官中MGE祖细胞标志物NKX2.1的表达量随SHH浓度增加而升高(图S1A)[28-31]。当使用750 ng/mL SHH处理时,类器官在第36天显示出NKX2.1阳性细胞占总细胞的最高比例(92.72% ± 0.766%),并在第63天显示NEUN+细胞中CHN标志物CHAT的最高表达比例(38.13% ± 1.62%)(图S1B;视频S1)。我们在第63天的hnbMOs中还检测到前脑标志物FOXG1(92% ± 1.168%)和神经元标志物TUJ1的丰富表达(图1B和S1C)。此外,我们还验证了典型CHN标志物——负责将乙酰胆碱(ACh)包装进入囊泡的囊泡乙酰胆碱转运体(VACHT)的表达,结果显示91.6%的CHAT+神经元表达VACHT(图1B, S1D和S1E)。
为验证hnbMOs的区域特征和谱系特异性,我们对源自人胚胎干细胞(hESCs)(H9系)两个分化时间点(第36天和第63天)以及源自iPSCs(IMR90-4系)第63天的hnbMOs进行了单细胞RNA测序(scRNA-seq),共捕获14,245个细胞。均匀流形近似与投影(UMAP)分析鉴定出6种细胞类型:分裂中的放射状胶质细胞(RG-div)、放射状胶质细胞(RGCs)、中间祖细胞(IPCs)、未成熟神经元(IMs)、GABA能神经元(GABAs)和胆碱能神经元(CHNs)(图1C, S1F和S1G)。CHN标志基因CHAT在CHNs中特异性高表达(图1D)。从第36天到第63天,细胞类型丰度分析显示,祖细胞(RG-div、RGCs和IPCs)的比例从63.5%下降至20.5%,而GABA和CHN细胞群的比例从25.4%增加至49.6%,表明存在从增殖性祖细胞向分化的GABAs和CHNs的发育转变(图1E和S1H)。通过CHAT或SLC18A3表达鉴定的CHNs,以及通过GAD2标记的GABAs,是hnbMOs中两种主要的神经元类型(图1D和S1I)。伪时间轨迹分析表明这两个群体可能遵循不同的分化路径(图S1J和S1K)。值得注意的是,对H9来源hnbMOs的scRNA-seq分析显示,在第63天,有40.39%的细胞表达CHN标志物CHAT,同时有78.62%的细胞表达成熟神经元标志物RBFOX3(图S1L)。源自人iPSC(hiPSC)系IMR90-4的hnbMOs表现出相似的谱系发育进程,并富集产生NKX2.1+和CHAT+细胞,表明hnbMO的生成在不同hPSC系间具有可靠性(图1E, S1M和S1N)。为验证hnbMOs的区域特性,我们应用VoxHunt[32]将hnbMOs的scRNA-seq数据映射到艾伦脑图谱的小鼠原位杂交数据上,发现与其他区域相比,hnbMOs与小鼠前脑的腹侧端脑具有更高的相关性。进一步分析不同细胞类型对应的图谱时,我们发现hnbMOs中的RGCs与小鼠MGE的脑室区(VZ)显示出高度相关性(图1F)。接下来,我们使用"发育中人脑BrainSpan图谱"[33]将hnbMOs的转录组特征与人胎儿脑区进行了比较。值得注意的是,在第36天,hnbMOs与受孕后8-9周(PCW)的人胎儿脑MGE区域显示出最高的相关性(图S1O)。此外,转录组分析显示,第63天hnbMOs的CHN和GABA细胞群与21 PCW人胎儿脑nbM区域具有最高的转录组相似性,而与其它MGE来源的核团,如内侧隔核(MS)和布罗卡斜角带(DBB)的相似性则低得多(图1G)。而且,我们将hnbMO scRNA-seq数据中的CHN和GABA细胞群映射到人孕16周(GW)胎儿脑的空间转录组数据集和成年小鼠脑的多重误差鲁棒荧光原位杂交(MERFISH)数据上[34,35]。这些结果证明,这两个细胞群在人和小鼠脑中均与nbM区域特异性高度相似(图1H和S1P)。
为在转录层面进一步验证hnbMOs具有基底核的特性,我们观察到其祖细胞显著表达NKX2-1、OLIG2和ISL1,这些是对基底前脑CHNs发育至关重要的关键转录因子[25,30,36-38]。相比之下,这些细胞几乎不表达主要与脊髓运动神经元和纹状体胆碱能前体相关的NKX6-1和GBX2(图1I)[39–41]。ZIC4,一种特异性表达于内侧隔核而非nbM的转录因子[42,43],在hnbMOs的前体细胞中几乎检测不到(图1I),表明hnbMOs在区域特性上区别于内侧隔核。此外,hnbMOs中的成熟CHNs几乎不表达脊髓CHNs的特征性转录因子MNX1和PHOX2B(图1I)[44,45]。这些结果在转录水平表明了hnbMOs具有特定的MGE谱系特征和nbM身份。
¶ hnbMOs的形态与功能成熟
为评估hnbMOs的形态与功能成熟度,我们首先致力于建立一种可靠的方法,用于特异性鉴定hPSCs来源的CHNs。为此,我们通过将荧光蛋白tdTomato插入CHAT基因位点,构建了CHAT报告细胞系(CHAT-tdT hPSCs)(图2A)。我们利用抗mCherry抗体来标记红色荧光蛋白tdTomato(因其与mCherry具有高度序列同源性)。将CHAT-tdT hPSCs分化为hnbMOs后,我们观察到90%的mCherry+细胞为CHAT+的CHNs(图2B和2C)。鉴于基底前脑胆碱能神经元(BFCNs)利用其大量的神经突起分支支配大脑皮层的广泛区域[46],我们观察到在第100天时,CHNs展现出典型的投射神经元形态,具有长的神经突和树突棘(图2D)。

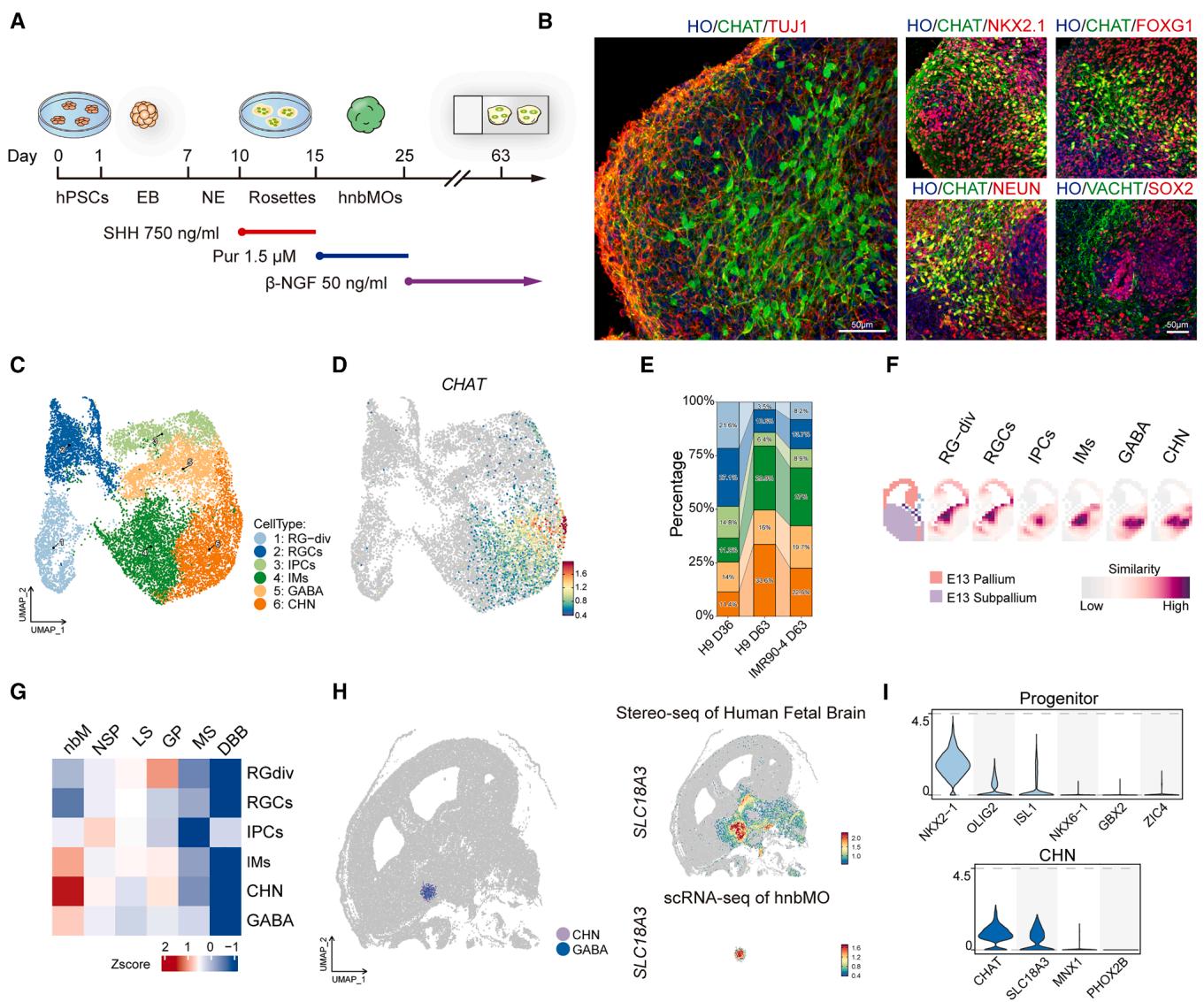
图1. 利用hPSCs生成hnbMOs
(A)hnbMOs分化条件示意图。hPSCs:人多能干细胞;EB:拟胚体;NE:神经上皮细胞;SHH:音猬因子;Pur:嘌呤吗啡胺;β-NGF:β-神经生长因子。
(B)第63天hnbMOs中CHAT、TUJ1、NKX2.1、FOXG1、NEUN、SOX2及VACHT的免疫荧光染色结果(比例尺:50μm)。
(C)来自H9(第36天、第63天)及IMR90-4(第63天)hnbMOs细胞类型的UMAP可视化分析。
(D)特征表达图显示hnbMOs中CHAT基因的表达分布。
(E)scRNA-seq数据中hnbMOs各分组所有细胞类型的百分比统计。
(F)hnbMOs细胞簇在E13小鼠脑(艾伦脑图谱)中的VoxHunt空间映射分析。
(G)人MGE来源不同核团(21 PCW)与hnbMOs各细胞类型之间基因集评分分析的热图。nbM:迈内特基底核;NSP:豆状核下核;LS:外侧隔核;GP:苍白球;MS:内侧隔核;DBB:布罗卡斜角带。
(H)hnbMOs来源的CHN与GABA神经元在人GW16胎儿脑Stereo-seq空间转录组图谱中的投射定位(左图)。SLC18A3基因在人胎儿脑Stereo-seq数据(右上)及hnbMOs scRNA-seq数据(右下)中的空间表达特征。
(I)hnbMOs祖细胞(第36天)与CHN集群(第63天)中标志基因的小提琴图。
另见图S1、表S1及视频S1。
为评估hnbMOs的生理功能,我们在第63天检测了其电生理活性。实验记录到了去极化诱发的钠电流与快速钾电流,并同时观测到诱发性和自发性动作电位,证实了该类器官具备电生理活性(图2E、2F)。乙酰胆碱(ACh)递质的释放是胆碱能神经元(CHNs)的关键生理过程;因此,我们采用既往报道的ACh生物传感器(ACh3.0)[47]进行检测。活细胞成像分析显示,在hnbMOs分化的神经元中可检测到通过GFP表达指示的ACh3.0传感器信号(图2G)。在KCl刺激下,GFP信号强度显著增强,证明hnbMOs中具有功能性ACh释放(图2G、2H)。

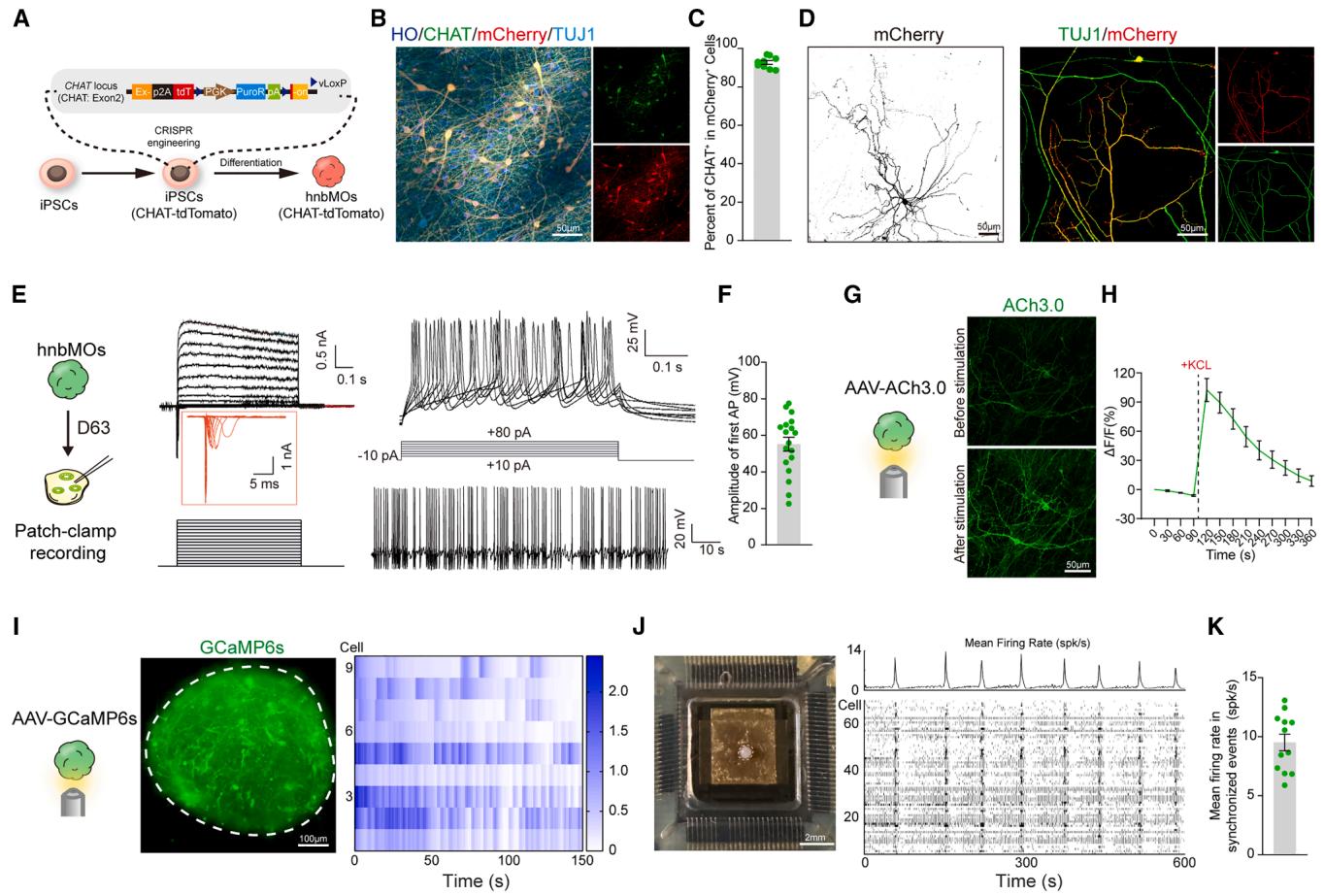
图2. hnbMO中胆碱能神经元的形态与功能成熟
(A)构建CHAT报告基因细胞系的实验设计示意图
(B)第45天由CHAT报告细胞系分化的hnbMOs中CHAT与mCherry的代表性图像(比例尺:50微米)
(C)CHAT报告hnbMOs中mCherry阳性细胞中CHAT阳性细胞的定量散点图(比例尺:50微米)
(D)第100天CHAT报告hnbMOs来源胆碱能神经元中mCherry与TUJ1标记的神经突起免疫荧光染色(比例尺:50微米)
(E)第63天hnbMOs中CHAT-tdTomato神经元的全细胞膜片钳记录及钠离子、钾离子电流峰值与动作电位的代表性膜响应
(F)hnbMOs中首个动作电位幅度的散点图统计(数据来自3次独立生物学实验,6个类器官中的18个细胞;平均值±标准误)
(G)第60天hnbMOs在添加40 mM KCl前后ACh3.0表达的代表性图像(比例尺:50微米)
(H)添加40 mM KCl前后hnbMOs中ACh3.0荧光响应的ΔF/F变化轨迹(数据来自3次独立生物学实验,12个类器官;平均值±标准误)
(I)第80分化日表达钙指示剂GCaMP6s的hnbMOs神经元钙成像,热图显示9个细胞的GCaMP6s信号ΔF/F0变化(3次独立分化实验均获相似结果,比例尺:100微米)
(J)第120天hnbMOs的微电极阵列分析:采用高清微电极芯片培养的hnbMOs明场图像(比例尺:2毫米,左图),hnbMOs区域平均放电频率及74个细胞神经网络活动的点阵图(右图)
(K)hnbMOs同步事件中平均放电频率的散点图统计(数据来自3次独立生物学实验,13个类器官;平均值±标准误)
另见视频S2与S3。
神经网络同步活动被视为类器官成熟的标志特征。为评估网络活动,我们在第80天对表达GCaMP6s的hnbMOs进行成像,观察到多次同步化的自发性钙事件(图2I;视频S2)。通过高密度三维微电极阵列(HD-MEA)在第120天进行记录,检测到hnbMOs中自发性放电活动及网络水平的同步化现象(图2J、2K;视频S3)。综上,钙成像与微电极阵列(MEA)记录结果共同证明了hnbMOs具备神经同步化功能。
这些研究数据充分表明,hnbMOs在形态特征与功能成熟度方面均展现出基底前脑胆碱能神经元的典型特性。
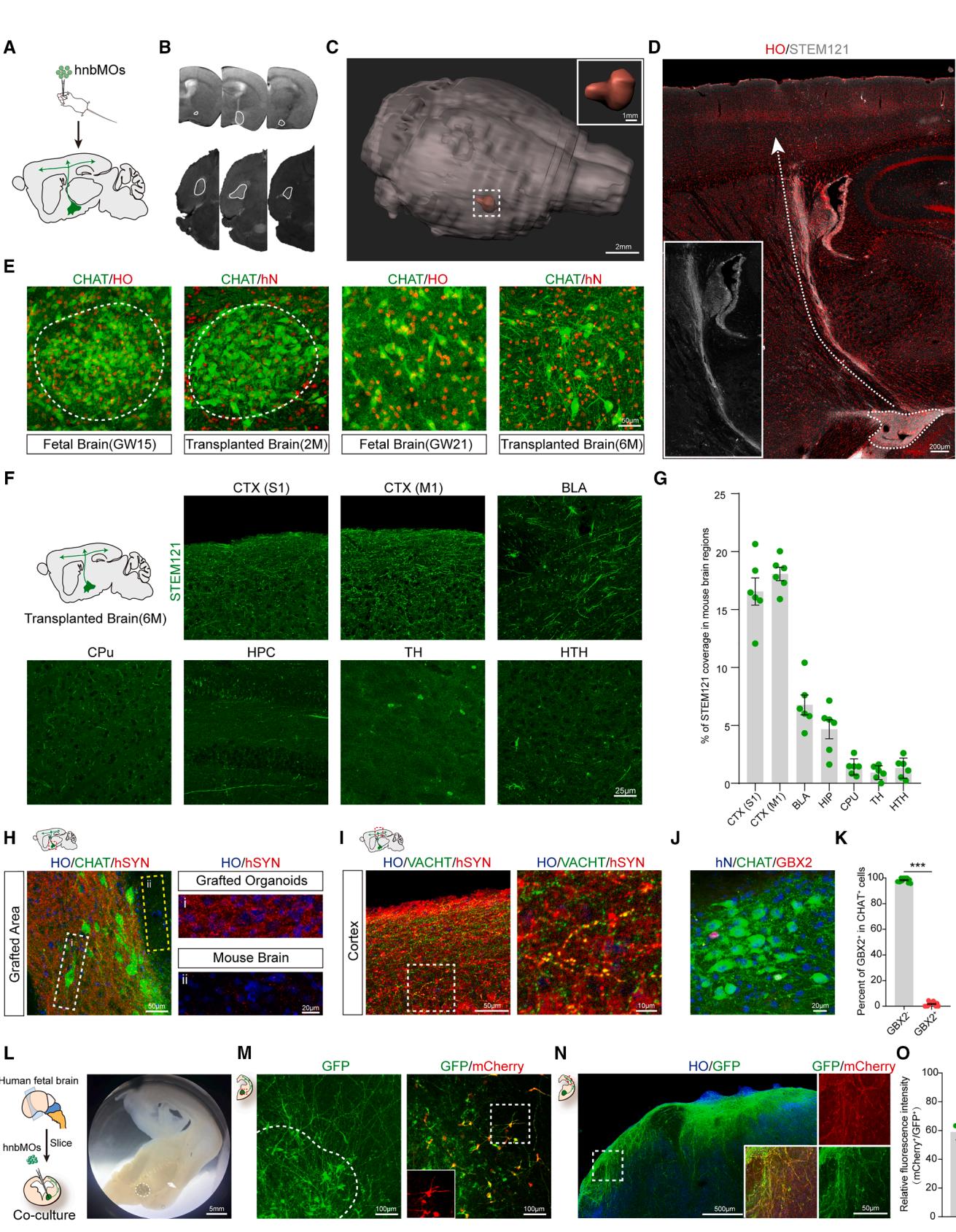

图3. hnbMOs中胆碱能投射的特征分析
(A) 移植鉴定实验设计示意图。在分化第37天将hnbMOs移植至SCID米色小鼠的无名质(nbM)。
(B) 移植后2个月冠状位及水平位T2加权MRI图像,显示nbM区域移植的hnbMOs。
(C) 移植后2个月小鼠脑部MRI三维体积重建(比例尺:2mm)。
(D) 移植后6个月小鼠脑中移植hnbMOs的投射通路全景图(比例尺:200 μm)。
(E) GW15人胎儿脑、GW21人胎儿脑及移植后2个月、6个月nbM区域CHAT+神经元的免疫荧光染色(比例尺:50 μm)。
(F) 矢状切面中移植hnbMOs的投射追踪示意图。移植后6个月多个脑区STEM121⁺投射的代表性图像:初级体感皮层(S1)、初级运动皮层(M1)、基底外侧杏仁核(BLA)、尾壳核(CPu)、海马体(HPC)、丘脑(TH)和下丘脑区域(HRH)(比例尺:25 μm)。
(G) 移植小鼠脑中STEM121荧光覆盖率的量化分析。数据来自3次独立生物学实验(n=6只小鼠;均值±标准误)。
(H) 移植hnbMOs及周围小鼠脑组织中CHAT与hSYN的代表性图像:(左)Gi为移植类器官,Gii为小鼠脑组织(左比例尺50 μm,右20 μm)。
(I) 小鼠皮层中VACHT与hSYN的代表性图像(左比例尺50 μm,右10 μm)。
(J) 移植后2个月hnbMOs的CHAT+神经元中GBX2与hN共染代表性图像(比例尺20 μm)。
(K) 移植hnbMOs的CHAT+神经元中GBX2⁻与GBX2⁺细胞占比散点图。数据来自3次独立生物学实验(n=6只小鼠,每鼠取2个随机切片;双尾非配对t检验;均值±标准误;***p<0.001)。
(L-M) hnbMOs与人胎儿脑片共培养的明场图像(比例尺5 mm)及共培养hnbMOs中mCherry+胆碱能神经元与GFP共染代表性图像(比例尺100 μm)。
(N) 胎儿脑片皮层区域mCherry+胆碱能投射与GFP共染代表性图像(左比例尺500 μm,右50 μm)。
(O) 人胎儿皮层相对荧光强度(mCherry+/GFP+)占比散点图。数据来自3次独立生物学实验(n=3个胎儿脑的6个切片,每个脑取2个切片;均值±标准误)。
另见图S2。
¶ 移植小鼠及共培养脑切片中hnbMOs投射的特征研究
基底核胆碱能投射神经元通过长距离、高度分支且结构精细的轴突树丛支配皮层[48]。本研究证实hnbMOs中的胆碱能神经元展现出典型投射神经元形态。然而,体外培养的类器官因缺乏机械结构和信号传导等特异性因子,限制了胆碱能神经元的定向轴突生长。类器官移植技术可突破这些局限,为体内人类神经环路的成熟及轴突导向研究提供模型[20,21,49]。为在体内构建人源nbM-皮层胆碱能通路,我们将hnbMOs移植至重症联合免疫缺陷(SCID)米色小鼠的基底核区(图3A)。通过移植后2个月的T2加权MRI成像,我们活体观测到类器官的定位情况(图3B)。三维重建显示移植类器官精确定位于宿主脑部的基底核(图3C)。
移植后2个月的免疫荧光检测进一步评估了类器官的细胞身份特征。通过hN与STEM121表达可识别移植的人源细胞(图3D、3E、S2A-S2D)。免疫染色显示移植人源细胞共表达hN与以下标记物:CHAT(36.38%)、FOXG1(92.66%)、NKX2.1(78.25%)及OLIG2(21.73%)(图S2B)。至移植后6个月,我们观察到长约3.5毫米的背外侧通路投射束从移植类器官延伸至宿主皮层(图3D)。在初级体感皮层(S1)、初级运动皮层(M1)和基底外侧杏仁核(BLA)中可见丰富的人源纤维,而在尾壳核(CPu)和海马体(HPC)中仅见稀疏投射,丘脑(TH)和下丘脑区域(HRH)信号微弱(图3F、3G)。这些结果表明移植hnbMOs在宿主脑中建立了具体内基底核特征性胆碱能投射模式的人源神经连接[50]。
我们进一步分析了移植后2-6个月胆碱能神经元的发育动态(图3E)。移植后2个月,类器官内胆碱能神经元呈巢状聚集模式,与妊娠15周人胎儿脑中原始胆碱能神经元形态相似。至移植后6个月,巢状结构中的原始胆碱能神经元逐渐分散,形成更丰富的投射神经元,此现象与既往关于人胎儿脑中内侧神经节隆起发育的研究一致[51]。同时我们观察到移植类器官中富集的人源突触表达(图3H)。共聚焦显微镜分析显示大量STEM121⁺纤维投射至小鼠皮层,与小鼠锥体神经元突起紧密毗邻,并表达人源特异性突触素(SYP)(图3I)。
为验证移植hnbMOs的细胞特性,我们发现在移植区域中,人源核标记hN在Hoechst⁺细胞核中的表达率为65.19%,hN⁺细胞中乙酰胆碱受体表达率达72.88%(图S2E、S2F)。此外还检测到人源GABA能神经元,包括钙视网膜蛋白标记的抑制性神经元亚型(图S2G)。值得注意的是,移植hnbMOs中近全部胆碱能神经元均为GBX2⁻(图3J、3K),排除了胆碱能中间神经元的存在,证明移植类器官中的胆碱能神经元保持投射神经元特性,并向皮层进行长距离投射。
为深入探究胆碱能神经元的投射特性,我们将经AAV-hSYN-GFP预标记的CHAT报告基因hnbMOs与妊娠15周人脑切片基底核区共培养(图3L、S2H)。共培养2周后,hnbMOs来源的胆碱能神经元不仅存活良好,更延伸出具有分支的长神经突,其GFP⁺纤维在胎儿皮层中的投射距离超过2厘米(图3M-3O)。
本研究系统阐明了hnbMOs中胆碱能神经元在小鼠脑及人胎儿脑切片中向目标区域投射的核心特征。
¶ 体外构建nbM-皮层组装体
基底核(nbM)通过其皮层投射对认知功能起关键作用(图4A)[52-54]。通过将hnbMOs与人类皮层类器官(hCOs)融合,我们在体外成功构建了nbM-皮层组装体(图4B)。融合后hCOs的扩张速度明显快于hnbMOs(图S3A、S3B),这与人类大脑发育过程中皮层的快速扩张特性相符。为可视化神经投射,我们在融合前用AAV-hSYN-GFP标记hnbMOs。融合后20天,hCO与hnbMOs均保持其区域特异性标记(图S3C、S3D),其中约90%的GFP⁺细胞表达NKX2.1,超过40%表达CHAT(图S3E、S3F)。同时在组装体的hCO区域观察到大量源自hnbMOs的GFP⁺投射纤维束(图4C)。值得注意的是,GFP⁺向hCO的投射随时间推移显著增加(从6.06%至22.51%),且这些投射会特异性避开hCO的脑室区(VZ)(图4C-4E),符合正常生理特征。通过分别用mCherry标记hCOs、GFP标记hnbMOs,发现在融合20天后,hCO向hnbMO的mCherry⁺投射稀少,而hnbMO向hCO的GFP⁺投射极为丰富,证实了其定向投射特性(图S3G、S3H)。进一步利用CHAT报告基因细胞系构建nbM-皮层组装体,活细胞成像显示hCO中tdTomato⁺胆碱能投射随时间持续增强,并伴随生长锥的动态运动(图S3I-S3K;视频S4)。
为验证hnbMO来源胆碱能神经元与hCO间突触连接,我们采用狂犬病毒逆行标记技术(图4F)。分别用RV-ΔG-CremCherry/AAV-EF1a::G感染hCOs,AAV-DIO-eGFP感染hnbMOs。融合10天后在hCO中观察到广泛mCherry表达,且在hnbMO侧发现GFP与mCherry双阳性细胞,其中近60%为CHAT⁺胆碱能神经元(图4G),证明hnbMO来源胆碱能神经元与hCOs形成突触连接。免疫组化分析进一步显示,从hnbMO向hCO的投射中存在突触前标记物SYP与突触后标记物PSD95的共定位(图S4A)。通过TBR1和STAB2染色鉴定出hCO中的深层与浅层皮层神经元,确认GFP⁺神经突已延伸至皮层区域(图S4B)。为评估组装体功能连接,将经光遗传病毒预标记的hnbMOs与hCOs融合。融合20天后,对hnbMO侧施加470nm光刺激可在hCO神经元中记录到平均振幅约40 pA的兴奋性突触后电流(EPSCs)及神经元放电(图4H、4I、S4C),证实了hnbMO与hCO间的功能性突触连接。
通过钙成像技术观察组装体网络特性,发现hnbMOs与hCOs之间存在同步钙活动(图4J)。使用乙酰胆碱受体拮抗剂丁溴东莨菪碱处理后,hCO细胞的钙活动被显著抑制(图4K),而烟碱受体拮抗剂美加明处理影响微弱(图S4D、S4E),表明皮层钙信号主要通过毒蕈碱受体受胆碱能输入调控。单独培养的hCOs不受丁溴东莨菪碱影响(图S4F、S4G),进一步证明hnbMOs中胆碱能神经元对组装体钙信号的调控作用。采用高密度微电极阵列检测发现,在静息状态下hnbMO侧有更多电信号发送器,而hCO侧有更多接收器(图4L、4M)。对hnbMO区域进行局部电刺激可引发hCO侧的动作电位(图4L、S4H),证实了双向功能连接。光遗传场电位记录显示,刺激AAV-ChR2-GFP标记的hnbMOs可在hCO中引发出0.0374±0.0017 mV的场电位(图S4I、S4J),这些结果共同证明nbM-皮层组装体形成了具有同步化网络信号的有效神经投射连接。
为检测组装体中乙酰胆碱释放,我们用ACh3.0传感器标记hnbMOs。融合7天后,GFP⁺投射纤维已延伸至hCO,氯化钾刺激后这些纤维表现出荧光强度增强及突触小泡数量增加(图4N、4O),证实了乙酰胆碱向hCO的动态释放。通过共聚焦显微镜观察发现,融合后hCO中M型乙酰胆碱受体表达显著上升(图S4K、S4L),表明含胆碱能神经元的hnbMOs可释放乙酰胆碱,进而增强hCO中乙酰胆碱受体的表达。
¶ 在移植组装体中构建nbM-皮层投射通路
为在体内重建人源nbM-皮层通路,我们创新性地将相应类器官分别移植至小鼠皮层与nbM区域,构建出移植组装体。移植6个月后,移植的mCherry⁺ hCOs与GFP⁺ hnbMOs均呈现良好存活状态(图5A)。值得注意的是,在移植后可观察到hnbMOs来源的胆碱能神经纤维在hCOs内广泛投射(图5B-5D)。双移植模型中胆碱能神经元的整体投射偏好与此前描述的移植nbMOs投射模式高度相似。同时,移植的hCOs向宿主大脑多个区域发出丰富投射,这些投射遵循体内皮层投射规律(图5E、5F)。尤为显著的是,可观察到成束的mCherry⁺神经突穿过移植的hnbMOs区域并与之分离(图5B)。
为验证体内功能性突触连接,我们在移植前对hnbMOs进行光遗传病毒载体预标记。移植4个月后,对移植hnbMOs区域进行470nm光刺激,可在mCherry标记的hCO神经元中记录到约20 pA的光遗传兴奋性突触后电流(oEPSCs),证实移植hnbMOs与hCOs之间形成了功能性突触连接(图5G、5H)。
上述结果共同证实,我们成功在小鼠模型中建立了人源nbM-皮层胆碱能投射系统,且移植的hCOs能够向宿主深部脑区发出神经投射。
¶ 唐氏综合征nbM-皮层通路胆碱能投射缺陷建模
最后我们探究了nbM-皮层组装体能否用于模拟神经发育障碍相关的胆碱能投射缺陷。唐氏综合征(DS)作为一种由21号染色体额外拷贝引起的遗传性疾病,常伴随智力障碍。既往研究表明DS患者存在淀粉样前体蛋白(APP)相关神经病理改变及乙酰胆碱活性降低[55,56],提示异常的胆碱能连接可能是DS认知障碍的内在机制。通过检测妊娠中期胎儿脑及小鼠脑皮层中CHAT表达,我们发现DS皮层中CHAT表达较对照组显著降低(图6A、6B、S5A-S5D),表明DS皮层存在胆碱能神经投射减少。然而,DS患者来源组装体能否重现nbM-皮层通路缺陷尚未可知。
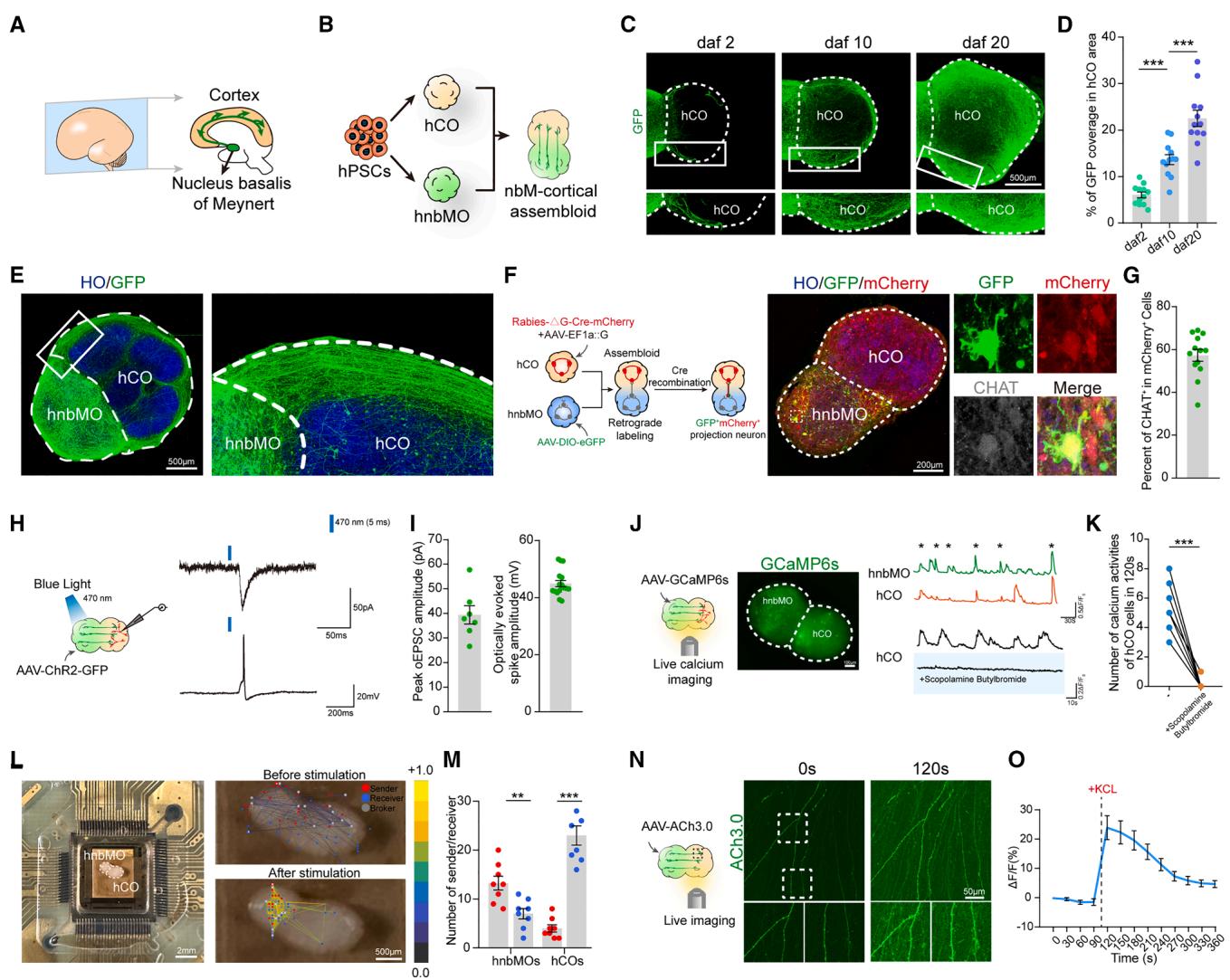

图4. nbM-皮层组装体的特征分析
(A) 妊娠中期人前脑nbM-皮层投射示意图
(B) 基于hPSCs来源组装体的nbM-皮层投射体外模型
(C) 融合后第2、10、20天nbM-皮层组装体中GFP⁺神经突延伸的代表性图像(比例尺:500 μm)
(D) 显示融合后第2、10、20天hCO侧单位面积GFP⁺覆盖率百分比的散点图。数据来自3次独立生物学实验(每组n=12个组装体;单因素方差分析及Tukey多重比较检验;均值±标准误;*p < 0.001)
(E) 融合后20天nbM-皮层组装体中hnbMO来源hSYN-GFP投射的代表性图像(比例尺:500 μm)
(F) nbM-皮层组装体逆行病毒追踪实验示意图及融合后10天组装体代表性图像,显示hnbMO侧GFP、mCherry与CHAT共表达(比例尺:200 μm)
(G) 显示mCherry⁺细胞中CHAT⁺细胞百分比的散点图。数据来自3次独立生物学实验(n=9个组装体;每个类器官取1-2个随机切片;均值±标准误)
(H) 融合后20天组装体光遗传EPSCs与神经元放电记录示意图(采用LED光刺激)
(I) 显示融合后20天组装体光遗传EPSC峰值振幅与光诱发峰电位振幅的散点图。数据来自3次独立生物学实验(n=7个组装体;均值±标准误)
(J) 组装体自发活细胞钙成像示意图(表达GCaMP6s的nbM-皮层组装体)及细胞ΔF/F₀曲线示例。代表性ΔF/F₀轨迹显示丁溴东莨菪碱对hCO细胞自发钙活动的阻断作用(比例尺:100 μm)
(K) 显示基线期与丁溴东莨菪碱处理120秒后钙活动次数的散点图。数据来自3次独立生物学实验(n=4个组装体的7个细胞;双尾配对t检验;*p < 0.001)
(L) 融合后20天nbM-皮层组装体使用HD-MEA Accura芯片记录的代表性图像(右)。电刺激前(上)与刺激后(下)神经活动功能连接图谱(左比例尺:2 mm,右比例尺:500 μm)
(M) 显示nbM-皮层组装体中发送节点与接收节点数量的散点图。数据来自3次独立生物学实验(n=8个组装体;双尾配对t检验;均值±标准误;p < 0.01,*p < 0.001)
(N) KCl(40 mM)处理下ACh3.0荧光的时序变化(比例尺:50 μm)
(O) 显示添加KCl(40 mM)前后细胞ACh3.0荧光反应的ΔF/F代表性轨迹。数据来自3次独立生物学实验(n=10个组装体;均值±标准误)


图5. 组装体移植模型中nbM-皮层投射通路的建立
(A) 双移植实验设计示意图(左),移植后6个月移植小鼠脑中mCherry与STEM121的代表性图像(右)(比例尺:500 μm)
(B) 移植hCOs中VACHT与GFP,以及移植hnbMOs中mCherry与hN的代表性图像(上图比例尺:10 μm;下图比例尺:50 μm)
(C) 显示移植后6个月hCO区域内GFP⁺覆盖率百分比的散点图。数据来自3次独立生物学实验(n=6只小鼠;均值±标准误)
(D) 移植后6个月移植hCOs中GFP、mCherry与STEM121的代表性图像(比例尺:200 μm)
(E) hnbMOs与hCOs双移植实验中投射追踪示意图。中间为移植后6个月多个脑区中移植hnbMOs来源的GFP⁺投射代表性图像,右侧为移植hCOs来源的mCherry⁺投射代表性图像。基底外侧杏仁核(BLA)、尾壳核(CPu)、海马体(HPC)、丘脑(TH)及大脑脚(CP)(比例尺:25 μm)
(F) GFP与mCherry荧光覆盖率的量化分析。数据来自3次独立生物学实验(n=6只小鼠;均值±标准误)
(G) 双移植脑切片全细胞膜片钳记录示意图及明场与mCherry荧光下的代表性图像(比例尺:10 μm),以及移植后4个月光遗传EPSCs记录示意图
(H) 显示双移植脑切片中oEPSC振幅的散点图。数据来自3次独立生物学实验(n=6只小鼠的20个细胞;均值±标准误)
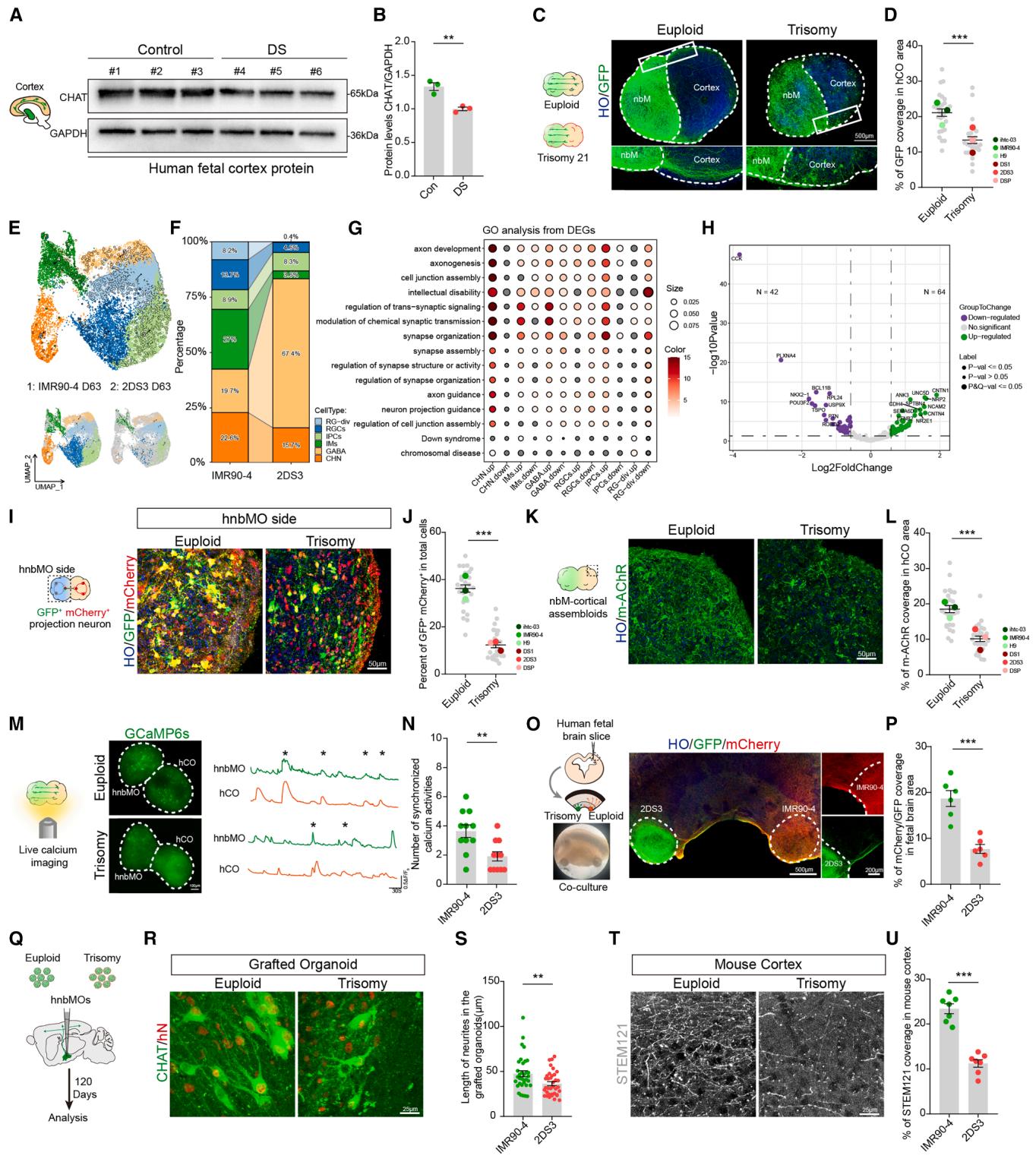

图6. DS患者来源nbM-皮层组装体的投射缺陷建模
(A) 妊娠18周对照组与DS人胎儿皮层中CHAT水平的代表性蛋白质印迹
(B) 对照组与DS人胎儿皮层CHAT水平的相对定量分析。数据来自3次独立生物学实验(每组n=3个胎儿脑;双尾配对t检验;均值±标准误;p < 0.01)
(C) 整倍体与21三体nbM-皮层组装体示意图及融合后20天GFP免疫荧光染色(比例尺:500 μm)
(D) 显示hCO侧单位面积GFP覆盖率的散点图。数据来自3次独立生物学实验(每组n=3个细胞系的27个组装体;双尾非配对t检验;均值±标准误;*p < 0.001)
(E) 第63天整倍体与21三体hnbMOs中检测到细胞类型的UMAP图谱
(F) 按组别划分的单细胞RNA测序数据中各细胞类型占比
(G) 按细胞簇分组分析的21三体与整倍体类器官差异基因GO功能分析
(H) 整倍体与21三体hnbMOs轴突发育相关差异基因火山图
(I) 融合后20天整倍体与21三体组装体hnbMO侧单突触连接GFP⁺/mCherry⁺投射神经元代表性图像(比例尺:50 μm)
(J) 显示hnbMO侧总细胞中GFP⁺ mCherry⁺细胞百分比的散点图。数据来自3次独立生物学实验(每组n=3个细胞系的27个组装体;双尾非配对t检验;均值±标准误;*p < 0.001)
(K) 融合后20天整倍体与21三体组装体hCO侧M型乙酰胆碱受体代表性图像(比例尺:50 μm)
(L) 显示hCO侧单位面积M型乙酰胆碱受体荧光覆盖率定量分析的散点图。数据来自3次独立生物学实验(每组n=3个细胞系的27个组装体;双尾非配对t检验;均值±标准误;*p < 0.001)
(M) 整倍体与21三体组装体自发活细胞钙成像示意图(表达GCaMP6s的nbM-皮层组装体)及细胞ΔF/F₀轨迹示例(比例尺:100 μm)
(N) 整倍体与21三体组装体钙活动次数定量分析。数据来自3次独立生物学实验(每组n=6个组装体的11个细胞;双尾非配对t检验;均值±标准误;p < 0.01)
(O) 整倍体与21三体hnbMOs与人胎儿皮层切片共培养示意图。表达mCherry的整倍体hnbMOs与表达GFP的21三体hnbMOs在第37天与人胎儿脑片共培养(左上)。共培养系统明场图像(左下)。共培养系统中GFP与mCherry共染代表性图像(中)(左比例尺500 μm,右200 μm)
(P) 胎儿脑区mCherry与GFP荧光覆盖率定量分析。数据来自3次独立生物学实验(n=3个胎儿脑的6个共培养切片;双尾非配对t检验;均值±标准误;*p < 0.001)
(Q) 整倍体与21三体hnbMOs移植实验设计示意图
(R) 移植后120天小鼠体内整倍体与21三体移植hnbMOs中CHAT与hN共染代表性图像(比例尺:25 μm)
(S) 整倍体与21三体移植hnbMOs神经突长度定量分析。数据来自3次独立生物学实验(每组n=7只小鼠的34个细胞;每个脑取5-6个随机切片;双尾非配对t检验;均值±标准误;p < 0.01)
(T) 移植后120天整倍体与21三体hnbMOs移植小鼠皮层中STEM121免疫荧光染色代表性图像(比例尺:25 μm)
(U) 整倍体与21三体hnbMOs移植小鼠皮层中STEM121覆盖率定量分析。数据来自3次独立生物学实验(每组n=7只小鼠;双尾非配对t检验;均值±标准误;*p < 0.001)
另见图S5。
为探究能否建立DS的nbM-皮层投射缺陷模型,我们将DS患者来源的hiPSCs分化为hnbMOs。这些hnbMOs表达FOXG1与NKX2.1,并能产生CHAT⁺NEUN⁺神经元(图S5E),证明其具备基底核特性。通过分化三株对照hPSC系与三株DS iPSC系19,发现DS hnbMOs中MGE祖细胞(NKX2.1)与胆碱能神经元(CHAT)比例显著降低(NKX2.1:88.29%±1.485% vs 79.42%±1.569%;CHAT:34.97%±1.22% vs 25.83%±1.35%)(图S5F-S5I),这与DS病理表型相符[3,5]。蛋白质印迹分析进一步证实三个独立DS来源hnbMOs中CHAT蛋白水平均下降(图S5J、S5K)。随后我们分别使用DS来源与对照来源类器官构建nbM-皮层组装体以检测神经投射。融合后20天,DS来源组装体的hCO区域中hnbMO来源的GFP⁺神经纤维数量显著少于对照组(图6C、6D),表明DS存在投射缺陷。
为系统解析DS nbM-皮层组装体的神经投射异常,我们对DS与对照hiPSCs分化63天的hnbMOs进行单细胞RNA测序(n=11,011个细胞)(图6E)。转录组分析显示DS hnbMOs中胆碱能神经元减少(图6F)。差异基因GO功能分析发现轴突形成与发育相关通路显著富集,其中胆碱能神经元变化最为明显(图6G)。火山图可视化展示了DS与对照hnbMOs间轴突发育相关差异基因(图6H)。在这些轴突发育相关差异基因中,既往研究已证实ANK3和NCAM2与DS神经发育障碍相关[57,58]。DS hnbMOs转录组特征与投射缺陷通路的显著关联,使该体外平台成为研究发育异常的可验证体系。
为验证DS来源组装体是否存在连接缺陷,我们进行狂犬病毒逆行示踪实验。免疫染色显示DS组装体hnbMO侧GFP与mCherry双阳性细胞比例显著降低(图6I、6J),表明DS组装体中与hCO形成突触连接的投射神经元减少。DS组装体hCO区域的乙酰胆碱受体表达也随胆碱能投射缺陷相应下降(图6K、6L)。活细胞钙成像显示DS组装体hnbMO与hCO间的同步钙活动较对照组显著减弱,提示神经网络功能受损(图6M、6N)。为追踪缺陷投射的起源,我们将GFP预标记的DS hnbMOs与mCherry预标记的对照hnbMOs共同与人胎儿皮层切片共培养(图6O)。共培养2周后,DS hnbMOs的GFP⁺纤维数量显著少于对照组mCherry⁺纤维(图6P),证明投射缺陷主要源于DS hnbMOs的神经元异常而非目标hCO。
通过深入分析胆碱能神经元缺陷,发现DS hnbMOs及胎儿脑组织中神经突长度均缩短(图S5H、S5I、S5L、S5M)。活细胞成像显示DS胆碱能神经元神经突生长速率减缓(图S5N、S5O)。微电极阵列分析表明DS hnbMOs放电次数减少(图S5P、S5Q),提示功能受损。这些发现说明胆碱能神经元的发育缺陷是其向hCO投射受损的关键因素。为在体内验证上述发现,我们将对照组与DS hnbMOs移植到小鼠脑中(图6Q)。移植3个月后,两组hnbMOs在小鼠nbM区均存活良好(图6R)。免疫染色显示DS移植hnbMOs中CHAT⁺hN⁺神经元的最长神经突短于对照组(图6S)。且DS hnbMOs移植小鼠皮层中的人源神经突数量更少(图6T、6U),这与组装体中的投射缺陷表现一致。
本研究成功证明hnbMOs与nbM-皮层组装体能有效模拟DS的疾病相关投射缺陷及神经活动异常。
¶ 讨论
基底核(nbM)作为基底前脑的关键核团,以其富含胆碱能神经元(CHNs)为特征,其功能障碍对神经与精神疾病具有重要影响[59-63]。本研究成功构建了具有高比例功能性胆碱能神经元的hnbMOs。值得注意的是,相较于主要产生中间神经元群体的传统MGE类器官方案,我们通过增强SHH信号通路并联合β-NGF补充,获得了富含胆碱能神经元的hnbMOs,实现了与传统MGE模型不同的谱系输出(表S1)[6,16,64,65]。
鉴于多个核团均起源于MGE,明确nbM的身份特征至关重要。我们的转录组数据显示,hnbMOs与人和小鼠脑中的nbM区域高度匹配,而与其他MGE来源核团相似性较低。尽管nbM具有重要功能,目前尚无其胆碱能通路的体外模型。因此,我们构建的nbM-皮层组装体成功重现了胆碱能投射及与皮层神经元形成突触连接等关键特征。
本研究的核心创新点在于双移植模型的建立。传统单区域移植无法完全模拟人类神经元通路,因为通路的起源与终止区常存在异源性[20,21,49]。通过双移植策略,我们首次在小鼠体内建立了具有同源投射起始与终止区域的完整人源神经通路。该方法为研究涉及脑区互作的神经精神疾病提供了更精准的模型。后续研究可重点关注这些移植类器官连接如何调控宿主神经活动与行为。
现有DS研究模型因难以完全复制人类特异性三体基因表达而面临挑战[66]。患者来源类器官与组装体为研究DS神经通路功能障碍提供了新平台。我们的数据表明,胆碱能神经元生成减少可能导致胆碱能投射减弱,hnbMOs成功重现了DS胎儿脑组织中的这一关键病理特征。单细胞RNA测序分析进一步揭示,DS hnbMOs中轴突投射异常可能与ANK3、NCAM2等轴突相关分子失调有关。ANK3剪接异常(对轴突起始段完整性和神经元极性至关重要[57])在DS中存在报道,这可能是本研究中DS类器官轴突发育受损的原因。同时,NCAM2作为21号染色体编码的神经黏附分子(参与神经突生长与极性调控[58])在DS类器官中过度表达,可能破坏细胞骨架组织并导致轴突导向错误或回缩。这些发现表明神经元数量减少与投射能力受损共同导致投射缺陷。后续工作可深入解析这些分子改变如何影响DS神经元复杂性、轴突发育及网络功能障碍。
除投射缺陷外,我们观察到DS iPSCs来源nbM类器官中GABA能神经元比例显著增加,这与既往研究一致[20,67]。此类神经元亚型组成的改变可能破坏兴奋/抑制平衡。这种失衡很可能损害神经网络的关键功能特性[68]。微电极阵列记录确实显示DS nbMOs神经元兴奋性降低,峰电位活动及簇发峰电位活动减少。这些数据表明GABA能/胆碱能比例改变可能导致DS网络水平的功能缺陷。后续研究可着重解析其内在机制并探索恢复兴奋/抑制平衡的潜在治疗策略。
值得注意的是,Sun等人报道基底前脑胆碱能神经元可快速整合至胶质母细胞瘤并促进肿瘤生长[69],揭示了基底前脑胆碱能神经元在肿瘤生物学中未被认知的功能。然而目前仍缺乏能稳定输出乙酰胆碱的3D人源基底前脑胆碱能神经元模型。我们的hnbMOs模型能提供乙酰胆碱输出,可能为研究神经元-癌症相互作用提供更精细的体外模型。总之,本研究为模拟人基底核开辟了新途径,并为nbM-皮层通路相关神经元障碍研究提供了开创性见解。
¶ 研究局限性
尽管本研究取得重要进展,仍存在若干局限。类器官的成熟度仍逊于体内组织,这可能影响胆碱能神经元功能与连接的重建精度。通过引入血管化等策略优化类器官培养体系,将更好模拟生理环境并促进更高程度成熟,这对未来研究至关重要。此外,本研究聚焦于hnbMOs及其投射的构建与研究,未涉及nbM的信号输入调控。后续研究应整合上游脑区类器官与hnbMOs、hCOs,以阐明调控机制及其对疾病表型的潜在贡献。
¶ 资源可用性
¶ 主要联系人
有关资源与试剂的进一步信息和需求,请直接联系主要联系人刘妍(yanliu@njmu.edu.cn)。
¶ 材料可用性
本研究未产生新型独特试剂。
¶ 数据与代码可用性
测序数据已存储于Gene Expression Omnibus数据库(GEO: GSE286235),自论文发表之日起公开。本文分析的已发表数据集编号列于关键资源表。本研究未涉及原始算法开发。重新分析本文报告数据所需的其他信息,可向主要联系人索取。
¶ 致谢
本研究获得以下基金项目支持:国家自然科学基金(82325015、82530038、82171528、82371260、U23A20429、22274079、5203302);国家重点研发计划(2021YFA1101803、2021YFA1101802、2025YFC3408902、2022YFA1104800、2023YFF1203600);长三角科技创新共同体联合攻关项目(2024CSJZN0600);江苏省自然科学基金(BK20240131、BK20240520);中国博士后科学基金(2024M761478);江苏省研究生科研创新计划(KYCX24_2008);江苏省基础研究计划——江苏省脑机类智能技术创新中心专项(BM2024001)。
¶ 作者贡献
D.W.、X.Z.、X.G.与Y.L.共同设计实验;D.W.、X.Z.、X.-Y.T.与Y.L.撰写论文;D.W.与X.Z.在X.-Y.T.、S.W.、M.T.、C.C.、H.H.、Y.Z.、W.Z.、X.H.、M.X.、Y.D.与X.G.的技术协助下完成实验;X.Q.与Q.C.收集人类组织样本;H.Y.与Y.H.进行单细胞RNA测序分析;Y.G.与X.Z.完成光遗传膜片钳实验;D.W.与X.Z.进行补充数据分析;Y.L.统筹指导项目。
¶ 利益声明
所有作者声明无利益冲突。
¶ STAR★方法
本文在线版本提供详细实验方法,包括以下部分:
• 关键资源表
• 实验模型与研究参与者信息
○ 细胞系
○ 人原代脑组织
○ 实验动物
¶ 实验方法详情
○ hnbMOs的构建
○ hCOs的构建
○ 基于CRISPR-Cas9基因组编辑的CHAT-tdTomato hiPSC系构建
○ nbM-皮层组装体的构建
○ 人胎儿脑组织与类器官共培养
○ 类器官解离进行二维培养
○ 冰冻切片与免疫细胞化学
○ 脑类器官组织透明化与三维重建
○ 病毒标记
○ 活细胞成像
○ nbM-皮层组装体的逆行狂犬病毒追踪
○ 单细胞RNA测序与分析
○ 蛋白质印迹
○ 全细胞膜片钳记录
○ 光遗传刺激
○ 微电极阵列检测
○ nbM-皮层组装体的电刺激与记录
○ 类器官移植
○ 移植小鼠磁共振成像
¶ 量化与统计分析
○ 统计分析
○ 荧光强度定量
○ 神经投射定量
○ 移植hnbMOs神经突生长量化
¶ 补充信息
补充信息请访问:https://doi.org/10.1016/j.stem.2025.10.004
收稿日期:2025年3月3日
修回日期:2025年8月22日
接受日期:2025年10月5日
¶ 参考文献
- Woolf, N.J. (1991). Cholinergic systems in mammalian brain and spinal cord. Prog. Neurobiol. 37, 475–524. https://doi.org/10.1016/0301-0082 (91)90006-m.
- Ballinger, E.C., Ananth, M., Talmage, D.A., and Role, L.W. (2016). Basal Forebrain Cholinergic Circuits and Signaling in Cognition and Cognitive Decline. Neuron 91, 1199–1218. https://doi.org/10.1016/j.neuron.2016. 09.006.
- Yates, C.M., Simpson, J., Maloney, A.F., Gordon, A., and Reid, A.H. (1980). Alzheimer-like cholinergic deficiency in Down syndrome. Lancet 2, 979. https://doi.org/10.1016/s0140-6736(80)92137-6.
- Baker-Nigh, A., Vahedi, S., Davis, E.G., Weintraub, S., Bigio, E.H., Klein, W.L., and Geula, C. (2015). Neuronal amyloid- ⋅β⋅β accumulation within cholinergic basal forebrain in ageing and Alzheimer’s disease. Brain 138, 1722–1737. https://doi.org/10.1093/brain/awv024.
- Casanova, M.F., Walker, L.C., Whitehouse, P.J., and Price, D.L. (1985). Abnormalities of the nucleus basalis in Down’s syndrome. Ann. Neurol. 18, 310–313. https://doi.org/10.1002/ana.410180306.
- Liu, Y., Weick, J.P., Liu, H., Krencik, R., Zhang, X., Ma, L., Zhou, G.M., Ayala, M., and Zhang, S.C. (2013). Medial ganglionic eminence-like cells derived from human embryonic stem cells correct learning and memory deficits. Nat. Biotechnol. 31, 440–447. https://doi.org/10. 1038/nbt.2565.
- Hu, Y., Qu, Z.Y., Cao, S.Y., Li, Q., Ma, L., Krencik, R., Xu, M., and Liu, Y. (2016). Directed differentiation of basal forebrain cholinergic neurons from human pluripotent stem cells. J. Neurosci. Methods 266, 42–49. https://doi.org/10.1016/j.jneumeth.2016.03.017.
- Yue, W., Li, Y., Zhang, T., Jiang, M., Qian, Y., Zhang, M., Sheng, N., Feng, S., Tang, K., Yu, X., et al. (2015). ESC-Derived Basal Forebrain Cholinergic Neurons Ameliorate the Cognitive Symptoms Associated with Alzheimer’s Disease in Mouse Models. Stem Cell Rep. 5, 776–790. https://doi.org/10. 1016/j.stemcr.2015.09.010.
- Amin, N.D., and Pas‚ca, S.P. (2018). Building Models of Brain Disorders with Three-Dimensional Organoids. Neuron 100, 389–405. https://doi. org/10.1016/j.neuron.2018.10.007.
- Lancaster, M.A., Renner, M., Martin, C.A., Wenzel, D., Bicknell, L.S., Hurles, M.E., Homfray, T., Penninger, J.M., Jackson, A.P., and Knoblich, J.A. (2013). Cerebral organoids model human brain development and microcephaly. Nature 501, 373–379. https://doi.org/10.1038/nature12517.
- Pas‚ ca, A.M., Sloan, S.A., Clarke, L.E., Tian, Y., Makinson, C.D., Huber, N., Kim, C.H., Park, J.Y., O’Rourke, N.A., Nguyen, K.D., et al. (2015). Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nat. Methods 12, 671–678. https://doi.org/10.1038/ nmeth.3415.
- Qian, X., Nguyen, H.N., Song, M.M., Hadiono, C., Ogden, S.C., Hammack, C., Yao, B., Hamersky, G.R., Jacob, F., Zhong, C., et al. (2016). BrainRegion-Specific Organoids Using Mini-bioreactors for Modeling ZIKV Exposure. Cell 165, 1238–1254. https://doi.org/10.1016/j.cell.2016.04.032.
- Kadoshima, T., Sakaguchi, H., Nakano, T., Soen, M., Ando, S., Eiraku, M., and Sasai, Y. (2013). Self-organization of axial polarity, inside-out layer pattern, and species-specific progenitor dynamics in human ES cellderived neocortex. Proc. Natl. Acad. Sci. USA 110, 20284–20289. https://doi.org/10.1073/pnas.1315710110.
- Xiang, Y., Tanaka, Y., Cakir, B., Patterson, B., Kim, K.Y., Sun, P., Kang, Y.J., Zhong, M., Liu, X., Patra, P., et al. (2019). hESC-Derived Thalamic Organoids Form Reciprocal Projections When Fused with Cortical Organoids. Cell Stem Cell 24, 487–497. https://doi.org/10.1016/j.stem. 2018.12.015.
- Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., and Sasai, Y. (2015). Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. Cell Rep. 10, 537–550. https://doi.org/10. 1016/j.celrep.2014.12.051.
- Xiang, Y., Tanaka, Y., Patterson, B., Kang, Y.J., Govindaiah, G., Roselaar, N., Cakir, B., Kim, K.Y., Lombroso, A.P., Hwang, S.M., et al. (2017). Fusion of Regionally Specified hPSC-Derived Organoids Models Human Brain Development and Interneuron Migration. Cell Stem Cell 21, 383–398. https://doi.org/10.1016/j.stem.2017.07.007.
- Miura, Y., Li, M.Y., Birey, F., Ikeda, K., Revah, O., Thete, M.V., Park, J.Y., Puno, A., Lee, S.H., Porteus, M.H., and Pașca, S.P. (2020). Generation of human striatal organoids and cortico-striatal assembloids from human pluripotent stem cells. Nat. Biotechnol. 38, 1421–1430. https://doi.org/ 10.1038/s41587-020-00763-w.
- Andersen, J., Revah, O., Miura, Y., Thom, N., Amin, N.D., Kelley, K.W., Singh, M., Chen, X., Thete, M.V., Walczak, E.M., et al. (2020). Generation of Functional Human 3D Cortico-Motor Assembloids. Cell 183, 1913–1929. https://doi.org/10.1016/j.cell.2020.11.017.
- Tang, X.Y., Xu, L., Wang, J., Hong, Y., Wang, Y., Zhu, Q., Wang, D., Zhang, X.Y., Liu, C.Y., Fang, K.H., et al. (2021). DSCAM/PAK1 pathway suppression reverses neurogenesis deficits in iPSC-derived cerebral organoids from patients with Down syndrome. J. Clin. Invest. 131, e135763. https://doi.org/10.1172/JCI135763.
- Xu, R., Brawner, A.T., Li, S., Liu, J.J., Kim, H., Xue, H., Pang, Z.P., Kim, W.Y., Hart, R.P., Liu, Y., and Jiang, P. (2019). OLIG2 Drives Abnormal Neurodevelopmental Phenotypes in Human iPSC-Based Organoid and Chimeric Mouse Models of Down Syndrome. Cell Stem Cell 24, 908–926. https://doi.org/10.1016/j.stem.2019.04.014.
- Revah, O., Gore, F., Kelley, K.W., Andersen, J., Sakai, N., Chen, X., Li, M. Y., Birey, F., Yang, X., Saw, N.L., et al. (2022). Maturation and circuit integration of transplanted human cortical organoids. Nature 610, 319–326. https://doi.org/10.1038/s41586-022-05277-w.
- Huang, W.K., Wong, S.Z.H., Pather, S.R., Nguyen, P.T.T., Zhang, F., Zhang, D.Y., Zhang, Z., Lu, L., Fang, W., Chen, L., et al. (2021). Generation of hypothalamic arcuate organoids from human induced pluripotent stem cells. Cell Stem Cell 28, 1657–1670. https://doi.org/10. 1016/j.stem.2021.04.006.
- Kiral, F.R., Cakir, B., Tanaka, Y., Kim, J., Yang, W.S., Wehbe, F., Kang, Y.J., Zhong, M., Sancer, G., Lee, S.H., et al. (2023). Generation of ventralized human thalamic organoids with thalamic reticular nucleus. Cell Stem Cell 30, 677–688. https://doi.org/10.1016/j.stem.2023.03.007.
- Pang, W., Zhu, J., Yang, K., Zhu, X., Zhou, W., Jiang, L., Zhuang, X., Liu, Y., Wei, J., Lu, X., et al. (2024). Generation of human region-specific brain organoids with medullary spinal trigeminal nuclei. Cell Stem Cell 31, 1501– 1512. https://doi.org/10.1016/j.stem.2024.08.004.
- Sussel, L., Marin, O., Kimura, S., and Rubenstein, J.L. (1999). Loss of Nkx2.1 homeobox gene function results in a ventral to dorsal molecular respecification within the basal telencephalon: evidence for a transformation of the pallidum into the striatum. Development 126, 3359–3370. https:// doi.org/10.1242/dev.126.15.3359.
- Allaway, K.C., Mun˜ oz, W., Tremblay, R., Sherer, M., Herron, J., Rudy, B., Machold, R., and Fishell, G. (2020). Cellular birthdate predicts laminar and regional cholinergic projection topography in the forebrain. eLife 9, e63249. https://doi.org/10.7554/eLife.63249.
- Reilly, J.O., Karavanova, I.D., Williams, K.P., Mahanthappa, N.K., and Allendoerfer, K.L. (2002). Cooperative effects of Sonic Hedgehog and NGF on basal forebrain cholinergic neurons. Mol. Cell. Neurosci. 19, 88–96. https://doi.org/10.1006/mcne.2001.1063.
- Rubenstein, J.L., Shimamura, K., Martinez, S., and Puelles, L. (1998). Regionalization of the prosencephalic neural plate. Annu. Rev. Neurosci. 21, 445–477. https://doi.org/10.1146/annurev.neuro.21.1.445.
- Wilson, S.W., and Rubenstein, J.L. (2000). Induction and dorsoventral patterning of the telencephalon. Neuron 28, 641–651. https://doi.org/10. 1016/s0896-6273(00)00171-9.
- Magno, L., Kretz, O., Bert, B., Erso¨ zlu¨ , S., Vogt, J., Fink, H., Kimura, S., Vogt, A., Monyer, H., Nitsch, R., and Naumann, T. (2011). The integrity of cholinergic basal forebrain neurons depends on expression of Nkx2- 1. Eur. J. Neurosci. 34, 1767–1782. https://doi.org/10.1111/j.1460-9568. 2011.07890.x.
- Scuderi, S., Kang, T.Y., Jourdon, A., Nelson, A., Yang, L., Wu, F., Anderson, G.M., Mariani, J., Tomasini, L., Sarangi, V., et al. (2025). Specification of human brain regions with orthogonal gradients of WNT and SHH in organoids reveals patterning variations across cell lines. Cell Stem Cell 32, 970–989. https://doi.org/10.1016/j.stem.2025.04.006.
- Fleck, J.S., Sanchı´s-Calleja, F., He, Z., Santel, M., Boyle, M.J., Camp, J.G., and Treutlein, B. (2021). Resolving organoid brain region identities by mapping single-cell genomic data to reference atlases. Cell Stem Cell 28, 1148–1159. https://doi.org/10.1016/j.stem.2021.02.015.
- Hawrylycz, M.J., Lein, E.S., Guillozet-Bongaarts, A.L., Shen, E.H., Ng, L., Miller, J.A., van de Lagemaat, L.N., Smith, K.A., Ebbert, A., Riley, Z.L., et al. (2012). An anatomically comprehensive atlas of the adult human brain transcriptome. Nature 489, 391–399. https://doi.org/10.1038/ nature11405.
- Li, Y., Li, Z., Wang, C., Yang, M., He, Z., Wang, F., Zhang, Y., Li, R., Gong, Y., Wang, B., et al. (2023). Spatiotemporal transcriptome atlas reveals the regional specification of the developing human brain. Cell 186, 5892–5909. https://doi.org/10.1016/j.cell.2023.11.016.
- Yao, Z., van Velthoven, C.T.J., Kunst, M., Zhang, M., McMillen, D., Lee, C., Jung, W., Goldy, J., Abdelhak, A., Aitken, M., et al. (2023). A high-resolution transcriptomic and spatial atlas of cell types in the whole mouse brain. Nature 624, 317–332. https://doi.org/10.1038/s41586-023-06812-z.
- Elshatory, Y., and Gan, L. (2008). The LIM-homeobox gene Islet-1 is required for the development of restricted forebrain cholinergic neurons. J. Neurosci. 28, 3291–3297. https://doi.org/10.1523/JNEUROSCI.5730- 07.2008.
- Furusho, M., Ono, K., Takebayashi, H., Masahira, N., Kagawa, T., Ikeda, K., and Ikenaka, K. (2006). Involvement of the Olig2 transcription factor in cholinergic neuron development of the basal forebrain. Dev. Biol. 293, 348–357. https://doi.org/10.1016/j.ydbio.2006.01.031.
- Cho, H.H., Cargnin, F., Kim, Y., Lee, B., Kwon, R.J., Nam, H., Shen, R., Barnes, A.P., Lee, J.W., Lee, S., and Lee, S.K. (2014). Isl1 directly controls a cholinergic neuronal identity in the developing forebrain and spinal cord by forming cell type-specific complexes. PLoS Genet. 10, e1004280. https://doi.org/10.1371/journal.pgen.1004280.
- Sander, M., Paydar, S., Ericson, J., Briscoe, J., Berber, E., German, M., Jessell, T.M., and Rubenstein, J.L. (2000). Ventral neural patterning by Nkx homeobox genes: Nkx6.1 controls somatic motor neuron and ventral interneuron fates. Genes Dev. 14, 2134–2139. https://doi.org/10.1101/ gad.820400.
- Guthrie, S. (2007). Patterning and axon guidance of cranial motor neurons. Nat. Rev. Neurosci. 8, 859–871. https://doi.org/10.1038/nrn2254.
- Chen, L., Chatterjee, M., and Li, J.Y.H. (2010). The mouse homeobox gene Gbx2 is required for the development of cholinergic interneurons in the striatum. J. Neurosci. 30, 14824–14834. https://doi.org/10.1523/ JNEUROSCI.3742-10.2010.
- Magno, L., Asgarian, Z., Apanaviciute, M., Milner, Y., Bengoa-Vergniory, N., Rubin, A.N., and Kessaris, N. (2022). Fate mapping reveals mixed embryonic origin and unique developmental codes of mouse forebrain septal neurons. Commun. Biol. 5, 1137. https://doi.org/10.1038/s42003-022- 04066-5. 43. Magno, L., Barry, C., Schmidt-Hieber, C., Theodotou, P., Ha¨ usser, M., and Kessaris, N. (2017). NKX2-1 Is Required in the Embryonic Septum for Cholinergic System Development, Learning, and Memory. Cell Rep. 20, 1572–1584. https://doi.org/10.1016/j.celrep.2017.07.053.
- Arber, S., Han, B., Mendelsohn, M., Smith, M., Jessell, T.M., and Sockanathan, S. (1999). Requirement for the homeobox gene Hb9 in the consolidation of motor neuron identity. Neuron 23, 659–674. https://doi. org/10.1016/s0896-6273(01)80026-x.
- Pattyn, A., Hirsch, M., Goridis, C., and Brunet, J.F. (2000). Control of hindbrain motor neuron differentiation by the homeobox gene Phox2b. Development 127, 1349–1358. https://doi.org/10.1242/dev.127.7.1349.
- Zaborszky, L., Csordas, A., Mosca, K., Kim, J., Gielow, M.R., Vadasz, C., and Nadasdy, Z. (2015). Neurons in the basal forebrain project to the cortex in a complex topographic organization that reflects corticocortical connectivity patterns: an experimental study based on retrograde tracing and 3D reconstruction. Cereb. Cortex 25, 118–137. https://doi.org/10. 1093/cercor/bht210.
- Jing, M., Li, Y., Zeng, J., Huang, P., Skirzewski, M., Kljakic, O., Peng, W., Qian, T., Tan, K., Zou, J., et al. (2020). An optimized acetylcholine sensor for monitoring in vivo cholinergic activity. Nat. Methods 17, 1139–1146. https://doi.org/10.1038/s41592-020-0953-2.
- Wu, H., Williams, J., and Nathans, J. (2014). Complete morphologies of basal forebrain cholinergic neurons in the mouse. eLife 3, e02444. https://doi.org/10.7554/eLife.02444.
- Schafer, S.T., Mansour, A.A., Schlachetzki, J.C.M., Pena, M., Ghassemzadeh, S., Mitchell, L., Mar, A., Quang, D., Stumpf, S., Ortiz, I.S., et al. (2023). An in vivo neuroimmune organoid model to study human microglia phenotypes. Cell 186, 2111–2126. https://doi.org/10.1016/j.cell. 2023.04.022.
- Chen, Z.Y., Yang, Y.L., Li, M., Gao, L., Qu, W.M., Huang, Z.L., and Yuan, X.S. (2023). Whole-brain neural connectivity to cholinergic neurons in the nucleus basalis of Meynert. J. Neurochem. 166, 233–247. https://doi.org/ 10.1111/jnc.15873.
- Paredes, M.F., Mora, C., Flores-Ramirez, Q., Cebrian-Silla, A., Del Dosso, A., Larimer, P., Chen, J., Kang, G., Gonzalez Granero, S., Garcia, E., et al. (2022). Nests of dividing neuroblasts sustain interneuron production for the developing human brain. Science 375, eabk2346. https://doi.org/10. 1126/science.abk2346.
- Williams, S.R., and Fletcher, L.N. (2019). A Dendritic Substrate for the Cholinergic Control of Neocortical Output Neurons. Neuron 101, 486–499. https://doi.org/10.1016/j.neuron.2018.11.035.
- Mei, F., Zhao, C., Li, S., Xue, Z., Zhao, Y., Xu, Y., Ye, R., You, H., Yu, P., Han, X., et al. (2024). Ngfr+ cholinergic projection from SI/nBM to mPFC selectively regulates temporal order recognition memory. Nat. Commun. 15, 7342. https://doi.org/10.1038/s41467-024-51707-w.
- Gulledge, A.T., Bucci, D.J., Zhang, S.S., Matsui, M., and Yeh, H.H. (2009). M1 receptors mediate cholinergic modulation of excitability in neocortical pyramidal neurons. J. Neurosci. 29, 9888–9902. https://doi.org/10.1523/ JNEUROSCI.1366-09.2009.
- Weijerman, M.E., van Furth, A.M., Vonk Noordegraaf, A., van Wouwe, J.P., Broers, C.J.M., and Gemke, R.J.B.J. (2008). Prevalence, neonatal characteristics, and first-year mortality of Down syndrome: a national study. J. Pediatr. 152, 15–19. https://doi.org/10.1016/j.jpeds.2007. 09.045.
- Canfield, M.A., Honein, M.A., Yuskiv, N., Xing, J., Mai, C.T., Collins, J.S., Devine, O., Petrini, J., Ramadhani, T.A., Hobbs, C.A., and Kirby, R.S. (2006). National estimates and race/ethnic-specific variation of selected birth defects in the United States, 1999–2001. Birth Defects Res. A Clin. Mol. Teratol. 76, 747–756. https://doi.org/10.1002/bdra.20294.
- Rastogi, M., Bartolucci, M., Nanni, M., Aloisio, M., Vozzi, D., Petretto, A., Contestabile, A., and Cancedda, L. (2024). Integrative multi-omic analysis reveals conserved cell-projection deficits in human Down syndrome brains. Neuron 112, 2503–2523. https://doi.org/10.1016/j.neuron.2024. 05.002.
- Parcerisas, A., Pujadas, L., Ortega-Gasco´ , A., Perello´ -Amoro´ s, B., Viais, R., Hino, K., Figueiro-Silva, J., La Torre, A., Trulla´ s, R., Simo´ , S., et al. (2020). NCAM2 Regulates Dendritic and Axonal Differentiation through the Cytoskeletal Proteins MAP2 and 14-3-3. Cereb. Cortex 30, 3781– 3799. https://doi.org/10.1093/cercor/bhz342.
- Shafiee, N., Fonov, V., Dadar, M., Spreng, R.N., and Collins, D.L. (2024). Degeneration in Nucleus basalis of Meynert signals earliest stage of Alzheimer’s disease progression. Neurobiol. Aging 139, 54–63. https:// doi.org/10.1016/j.neurobiolaging.2024.03.003.
- Hall, H., Reyes, S., Landeck, N., Bye, C., Leanza, G., Double, K., Thompson, L., Halliday, G., and Kirik, D. (2014). Hippocampal Lewy pathology and cholinergic dysfunction are associated with dementia in Parkinson’s disease. Brain 137, 2493–2508. https://doi.org/10.1093/ brain/awu193.
- Perry, E.K., Lee, M.L., Martin-Ruiz, C.M., Court, J.A., Volsen, S.G., Merrit, J., Folly, E., Iversen, P.E., Bauman, M.L., Perry, R.H., and Wenk, G.L. (2001). Cholinergic activity in autism: abnormalities in the cerebral cortex and basal forebrain. Am. J. Psychiatry 158, 1058–1066. https://doi.org/ 10.1176/appi.ajp.158.7.1058.
- Cheng, L., Xu, C., Wang, L., An, D., Jiang, L., Zheng, Y., Xu, Y., Wang, Y., Wang, Y., Zhang, K., et al. (2021). Histamine H1 receptor deletion in cholinergic neurons induces sensorimotor gating ability deficit and social impairments in mice. Nat. Commun. 12, 1142. https://doi.org/10.1038/s41467- 021-21476-x.
- Wenk, G.L. (1997). Rett syndrome: neurobiological changes underlying specific symptoms. Prog. Neurobiol. 51, 383–391. https://doi.org/10. 1016/s0301-0082(96)00059-7.
- Birey, F., Andersen, J., Makinson, C.D., Islam, S., Wei, W., Huber, N., Fan, H.C., Metzler, K.R.C., Panagiotakos, G., Thom, N., et al. (2017). Assembly of functionally integrated human forebrain spheroids. Nature 545, 54–59. https://doi.org/10.1038/nature22330.
- Nicholas, C.R., Chen, J., Tang, Y., Southwell, D.G., Chalmers, N., Vogt, D., Arnold, C.M., Chen, Y.J.J., Stanley, E.G., Elefanty, A.G., et al. (2013). Functional maturation of hPSC-derived forebrain interneurons requires an extended timeline and mimics human neural development. Cell Stem Cell 12, 573–586. https://doi.org/10.1016/j.stem.2013.04.005.
- Zhao, X., and Bhattacharyya, A. (2018). Human Models Are Needed for Studying Human Neurodevelopmental Disorders. Am. J. Hum. Genet. 103, 829–857. https://doi.org/10.1016/j.ajhg.2018.10.009.
- Chakrabarti, L., Best, T.K., Cramer, N.P., Carney, R.S.E., Isaac, J.T.R., Galdzicki, Z., and Haydar, T.F. (2010). Olig1 and Olig2 triplication causes developmental brain defects in Down syndrome. Nat. Neurosci. 13, 927–934. https://doi.org/10.1038/nn.2600.
- Kleschevnikov, A.M., Belichenko, P.V., Gall, J., George, L., Nosheny, R., Maloney, M.T., Salehi, A., and Mobley, W.C. (2012). Increased efficiency of the GABAA and GABAB receptor-mediated neurotransmission in the Ts65Dn mouse model of Down syndrome. Neurobiol. Dis. 45, 683–691. https://doi.org/10.1016/j.nbd.2011.10.009.
- Sun, Y., Wang, X., Zhang, D.Y., Zhang, Z., Bhattarai, J.P., Wang, Y., Park, K.H., Dong, W., Hung, Y.F., Yang, Q., et al. (2025). Brain-wide neuronal circuit connectome of human glioblastoma. Nature 641, 222–231. https:// doi.org/10.1038/s41586-025-08634-7.
- Hao, Y., Hao, S., Andersen-Nissen, E., Mauck, W.M., 3rd, Zheng, S., Butler, A., Lee, M.J., Wilk, A.J., Darby, C., Zager, M., et al. (2021). Integrated analysis of multimodal single-cell data. Cell 184, 3573–3587. https://doi.org/10.1016/j.cell.2021.04.048.
KEY RESOURCES TABLE
| REAGENT or RESOURCE | SOURCE | IDENTIFIER |
| Antibodies | ||
| CHAT | Mililpore | Cat# AB144P; RRID:AB_2079751 |
| CHAT | ABclonal | Cat# A19031; RRID:AB_2862523 |
| TUJ1 | Sigma-Aldrich | Cat# T8660; RRID:AB_477590 |
| TUJ1 | Covance | Cat# PRB-435P; RRID:AB_291637 |
| NKX2.1 | Santa Cru | Cat# sc-13040; RRID:AB_793532 |
| FOXG1 | Abcam | Cat# AB18259; RRID:AB_732415 |
| NEUN | Arigo | Cat# ARG52283; N/A (RRID not available) |
| SOX2 | R&D | Cat# AF2018; RRID:AB_355110 |
| VACHT | Synaptic system | Cat#139103; RRID:AB_887864 |
| mCherry | Abcam | Cat#AB167453; RRID:AB_2571870 |
| mCherry | Abcam | Cat#AB125096; RRID:AB_11133266 |
| GFP | Sigma-Aldrich | Cat# AB3080; RRID: AB_91337 |
| Human Nuclei | Chemicon | Cat# MAB1281; RRID:AB_94090 |
| STEM121 | Takara | Cat# Y40410; RRID:AB_2801314 |
| hSYN | Calbiochem | Cat# 574777; RRID:AB_2200124 |
| GBX2 | Thermo Fisher | Cat# PA5-77984; RRID:AB_2735826 |
| NESTIN | Santa Cruz | Cat# sc-21247; RRID:AB_650014 |
| OLIG2 | Santa Cruz | Cat# sc-19969; RRID:AB_2236477 |
| GABA | Sigma-Aldrich | Cat# A2052; RRID:AB_477652 |
| Calretinin | Swant | Cat# CR7697; RRID:AB_2619710 |
| mAChR | Synaptic system | Cat# 223 017; RRID:AB_2238208 |
| TBR1 | Abcam | Cat# AB31940; RRID:AB_2200219 |
| PKC-入 | BD | Cat# 610207; RRID:AB_397606 |
| PAX6 | Biolegend | Cat# 862001; RRID:AB_2801237 |
| Synaptophysin | Abcam | Cat# AB16659; RRID:AB_443419 |
| PSD95 | Cell Signal Technology | Cat# 2507; RRID:AB_561221 |
| Hoechst33258 | Thermo Fisher | Cat# H3569; RRID:AB_2651133 |
| GAPDH | Peprotech | Cat# 60004-1-Ig; RRID:AB_2107436 |
| Bacterial and virus strains | ||
| RV-CVS-ENVA-N2C(△G)-mCherry-2A-Cre | BrainVTA | R05003 |
| rAAV-EF1a-DIO-EGFP-WPRE-hGH pA | BrainVTA | PT-0795 |
| rAAV-EF1a-RVG-WPRE-poly A | BrainVTA | PT-4870 |
| rAAVCAG-GCaMp6s-WPRE-hGH polyA | BrainVTA | https://www.brainvta.ltd/ |
| rAAV-CAG-ACh3.0-WPREs | BrainVTA | https://www.brainvta.litd/ |
| pAAV-hSYN-EGFP-3xFLAG-WPRE | OBiO | https://www.obiosh.com/ |
| pAAV-hSYN-hChR2 (H134R) -EYFP | OBiO | https://www.obiosh.com/ |
| PAAV-hSYN-MCS-mCherry-3FLAG | OBiO | https://www.obiosh.com/ |
| Chemicals,peptides,and recombinantproteins | ||
| Essential 8 | Life technology | Cat# A14666SA |
| DMEM/F-12 | Thermo Fisher | Cat# C11330500BT |
| N2 Supplement | Thermo Fisher | Cat# 17502-048 |
| NEAA | Gibco | Cat# 11140035 |
| SB431542 | R&D | Cat# 1614/10 |
| DMH1 | R&D | Cat# 4126/10 |
| REAGENT or RESOURCE | SOURCE | IDENTIFIER |
| B27 Supplement | Thermo Fisher | Cat# 12587010 |
| Dispase | Gibco | Cat# 17105041 |
| Gentle Cell Disociation Reagent | Stemcell | Cat# 100-0485 |
| Matrigel | Corming | Cat# 354230 |
| P/S antibiotic | Gibco | Cat# 15140122 |
| ROC inhibitor | Stem Cell | Cat# 72304 |
| Vitronectin | Life technology | Cat# A31804 |
| FBS | Life technology | Cat# 10099141 |
| TrypLE | Thermo Fisher | Cat# 12604013 |
| DPBS | Gibco | Cat# 14190136 |
| β-NGF | Peprotech | Cat# 450-1-250 |
| Purmorphamine | Stemgent | Cat# 04-0009 |
| SHH-C24 | R&D system | Cat# 1845-SH |
| SHH-C25 | R&D system | Cat# 464-SH |
| BDNF | Peprotech | Cat# 450-02-100 |
| CAMP | Sigma | Cat# D0260 |
| BrainPhys Neuronal Medium | Stem Cell | Cat# 05790 |
| Penilli/Streptomycin | Life technology | Cat# 15140-122 |
| PFA | Sigma | Cat# 158127 |
| O.C.T compound | SAKURA | Cat# 4583 |
| PBS tablets | Medicago | Cat# 09-9400-100 |
| Donkey serum | Millipore | Cat# S30-KC |
| Triton X-100 | Amresco | Cat# 0694 |
| Scopolamine Butylbromide | AbMole | Cat# M3590 |
| Mecamylamine hydrochloride | AbMole | Cat# M7940 |
| TBST 10X | Sangon | Cat# C006161 |
| RIPA | Thermo Fisher | Cat# 89901 |
| Cocktail | Beyotime | Cat# P1005 |
| NON-Fat Powdered Milk | Sangon | Cat# A600669 |
| CaCI2 | sigma | Cat# 21097-250g |
| KCI | SCR | Cat# 10016318 |
| Nacl | Sigma | Cat# 7647-14-5 |
| HEPES | Sigma | Cat# H3375 |
| NaHCO3 | SCR | Cat# 10018960 |
| MgS04 | SCR | Cat# 10013018 |
| EGTA | Sigma | Cat# 67-42-5 |
| Critical commercial assays | ||
| SCALEVIEW0-S4 | FUJIFILM | Cat# 194-18561 |
| Deposited data | ||
| Raw and processed RNA-seq and scRNA-seq | This paper | GEO: GSE286235 |
| Experimental models: Cellines | ||
| DS1 | WiCell | UWWC1-DS1 |
| 2DS3 | WiCell | UWWC1-2DS3 |
| WiCell | WC-24-02-DS-P | |
| wiCell | WA09 | |
| IMR90-4 | WiCell | CCL-186 |
| CHAT-tdTomato | This paper | N/A |
| Ihtc-03 | Yan Liu Lab | N/A |
| REAGENT or RESOURCE | SOURCE | IDENTIFIER |
| Experimental models: Organisms/strains | ||
| Mouse: SCID Beige | Charles river | Cat# 250 |
| Mouse: Dp16 | The Jackson Laboratory | Cat# 013530 |
| Human mid-fetal brain issue | Nanjing Women and Children's Healthcare Hospital | N/A |
| Software and algorithms | ||
| Maestro pro MEA system | Axion Biosystems | https://www.axionbiosystems.com/ |
| Fij | N/A | https:/fj.sc |
| ZEISS ZEN | ZEISS | https://www.zeiss.com/microscopy/en/products/ software/zeiss-zen.html |
| Imaris | Oxford instruments | https://maris.oxinst.com |
| Graphpad Prism | GraphPad | https://www.graphpad.com/ |
| Cell Ranger (v3.1) | N/A | https://www.10xgenomics.com/support/software/ cell-ranger |
| Seurat (v4.0.4) | Hao et al.70 | https://satijalab.org/seurat/ |
| Axon Clampex | Molecular Devices | https://www.moleculardevices.com/products/ axon-patch-clamp-system |
| BioCAM DupleX | 3Brain | https://www.3brain.com/products/single-well/ biocam-duplex |
| Brainwave5 | 3Brain | https://www.3brain.com/products/software/ brainwave5 |
| Other | ||
| U-bottom ultra-low-attachment 96-well plate | Costar | Cat# 7007 |
| Cell Culture Insert 0.4um | FALCON | Cat# 353090 |
| CytoView MEA plate (24-well) | Axion Biosystems | Cat# M384-tMEA-24W |
| 24-well glass bottom plates | Cellvis | Cat# P24-1.5H-N |
| Next Generation Micropipette Puller | Sutter Instrument | Cat# P-1000 |
¶ 实验模型与研究参与者信息
¶ 细胞系
研究使用三株DS人iPSC系(2DS3、DSP、DS1)、三株对照人iPSC系(IMR90-4、CHAT-tdTomato、IHTC-03)及一株对照人EPSC系(H9)。所有细胞均在无饲养层培养条件下维持,使用玻连蛋白包被的6孔板及Essential 8培养基,每5-7天以EDTA进行传代(详见关键资源表)。细胞培养环境为37°C、5%二氧化碳恒温培养箱。CHAT-tdTomato hiPSC系中tdTomato与CHAT蛋白的组成型表达可用于胆碱能神经元身份验证。
¶ 人原代脑组织
人脑组织的收集与研究经南京市妇幼保健院(2022KY072)和南京医科大学([2022]第810号)伦理委员会批准。所有脑组织标本(孕周15-21周)均在捐赠者签署知情同意书后获取,严格执行南京市妇幼保健院与南京医科大学的法律法规及伦理规范。
¶ 实验动物
所有动物实验均严格遵守南京医科大学动物护理与使用委员会(IACUC-2111059)制定的伦理准则。小鼠在机构动物饲养设施内群居饲养,自由获取食物饮水,光照周期为12小时明暗交替。
¶ 实验方法详情
¶ 人Meynert基底核类器官(hnbMOs)的构建
为构建hnbMOs,首先用分散酶解离hPSCs,重悬于DMEM/F12培养基。将细胞转移至培养瓶,使用神经诱导培养基(98% DMEM/F12、1% N2补充剂、1%非必需氨基酸)形成拟胚体。第1天在培养基中添加SB431542和DMH1,之后每日更换半数培养基。第7天将拟胚体接种于6孔板(含90% NIM与10% FBS)。第8天完全更换为NIM。第10天在添加750纳克/毫升音猬因子(SHH)的NIM中获得神经玫瑰花环结构。第16天轻柔吹下玫瑰花环,转移至含2% B27、1.5μM Purmorphamine的培养瓶中继续培养10天。第25天将类器官置于含SHH(50纳克/毫升)、β-NGF(50纳克/毫升)、BDNF(10纳克/毫升)及cAMP(1μM)的NIM中培养,每两日更换半数培养基。hnbMOs构建方法与其他研究的对比见表S1A。
¶ 人皮层类器官(hCOs)的构建
参照既往方法构建hCOs[19]。用分散酶解离hPSCs,重悬于DMEM/F12后转移至培养瓶形成拟胚体。在含SB431542与DMH1的NIM中培养7天后,将拟胚体接种于6孔板(含90% NIM与10% FBS)。第8天完全更换为NIM。第16天收集玫瑰花环结构,转移至含2% B27的NIM中培养,隔日更换半数培养基。
¶ 基于CRISPR-Cas9基因组编辑构建CHAT-tdTomato hiPSC系
为构建该细胞系,通过Zhang实验室平台设计靶向z'同源臂首100 bp的向导RNA。供体质粒结构包含:(a)5'同源臂(CHAT末外显子终止密码子前约1000 bp);(b)在CHAT终止密码子前框内插入P2A与tdTomato编码序列;(c)插入人GH polyA、小鼠PGK启动子、嘌呤霉素抗性基因及polyA序列;(d)z'同源臂(含终止密码子及相邻1000 bp片段)。用TrypLE解离IMR90-4 hPSC系,取200万细胞与30μg供体质粒、15μg sgRNA质粒共电转。每孔接种15万细胞于6孔板。电转24小时后用0.5μg/毫升嘌呤霉素筛选3天。存活细胞转入Essential 8培养基隔日喂养。1-2周后挑取单克隆接种于24孔板(每孔1个克隆),3-5天后提取基因组DNA进行基因分型与测序。
¶ nbM-皮层组装体的构建
分别培养hCOs与hnbMOs至第50天进行融合。将1个hCO与1个hnbMO共置于96孔U型底板中孵育过夜,次日将融合组装体转移至24孔板,使用含2% B27、β-NGF(50纳克/毫升)、BDNF(10纳克/毫升)及cAMP(1μM)的NIM培养,每5日更换培养基。
¶ 人胎儿脑组织与类器官共培养
使用莱卡VT1200 S切片机制备全脑与皮层切片。将300微米脑切片转移至细胞培养插入器,使用添加2% B27、1%青霉素-链霉素及BDNF(10纳克/毫升)的BrainPhys神经元培养基。为观察hnbMOs投射能力,在共培养第1天将AAV-hSYN-GFP标记的hnbMOs置于全脑切片基底核区,共培养2周。为比较整倍体与三体hnbMOs投射能力,将AAV-hSYN-mCherry标记的整倍体hnbMO与AAV-hSYN-GFP标记的三体hnbMO分别置于皮层切片两端,共培养2周后收取切片进行免疫荧光染色。
¶ 类器官解离进行二维培养
随机选取2-3个hnbMOs,用1毫升TrypLE消化,37°C孵育7分钟。用F12培养基轻柔冲洗后,使用P200移液器小心吹散。约30万细胞接种于基质胶包被过夜的15毫米玻片上,使用含2% B27的NIM培养,隔日换液。通常于第7天收取玻片,长期培养则于第14天或更晚收取。
¶ 冰冻切片与免疫细胞化学
所有类器官与组装体用4%多聚甲醛4°C固定4小时,小鼠脑与人胎儿脑组织固定24小时。PBS漂洗3次后,依次在20%蔗糖/PBS中脱水1天、30%蔗糖/PBS中过渡。用OCT包埋组织,切片厚度20-40微米,冻存于-20°C。
免疫染色时,切片用PBS漂洗3次(每次10分钟),用含10%驴血清与1% Triton X-100的PBS封闭1小时。加入含5%驴血清与0.2% Triton X-100的一抗4°C孵育过夜。次日PBS漂洗(3×8分钟)后,室温避光孵育二抗与Hoechst 33258 1小时,再次漂洗(3×8分钟)。使用蔡司LSM-800采集图像,抗体列表详见关键资源表。
¶ 脑类器官组织透明化与三维重建.
取第50天hnbMOs,4% PFA 4°C固定3天。依次在SCALEVIEW-S0、SCALEVIEW-A2、8M尿素溶液、SCALEVIEW-A2中37°C各孵育4小时。PBS漂洗6次(每次1小时),随后用含1% Triton X-100与5%驴血清的封闭液处理2小时。一抗(含0.2% Triton X-100与5%驴血清)孵育2天,PBS漂洗3次(每次1小时)。二抗孵育4小时后再次漂洗,最后在SCALEVIEWC-S4中37°C孵育4小时。使用蔡司LSM-800进行层扫成像,并通过Imaris软件进行三维重建。
¶ 病毒标记
在类器官培养第35-40天进行病毒标记。本研究使用的病毒包括:AAV-hSYN-GFP、AAV-ChR2-GFP、AAV-hSYN-mCherry、AAV-CAG-ACh3.0、AAV-CAG-GCaMP6s、RV-ΔG-Cre-mCherry、AAV-DIO-eGFP、AAV-EF1a::G。将待标记类器官转移至600微升离心管,加入5微升病毒悬液孵育30分钟,随后移至48孔板过夜培养。次日转移至24孔板,每2日更换培养基。
¶ 活细胞成像
乙酰胆碱传感器荧光成像:使用莱卡TCS SP8共聚焦显微镜对AAV-CAG-ACh3.0标记的hnbMOs进行成像。通过施加40 mM KCl记录细胞外乙酰胆碱水平变化,荧光强度变化量化为ΔF/F₀ = (Ft - F₀)/F₀,采用Fiji软件(v1.53q)进行数据分析。
钙成像:将表达AAV-CAG-GCaMP6s的hnbMO及nbM-皮层组装体置于共聚焦培养皿,使用莱卡TCS SP8共聚焦显微镜以14.7帧/秒速率采集图像。采用10μM丁溴东莨菪碱进行阻断实验,通过Fiji分析荧光强度ΔF/F变化。
神经突生长成像:将EGFP+ hnbMOs解离后接种于玻璃底24孔板,使用蔡司Celldiscoverer 7系统20倍物镜以每小时1帧速率持续采集。
投射成像:将nbM-皮层组装体置于玻璃底24孔板,使用蔡司Celldiscoverer 7系统10倍物镜采集图像,通过Fiji软件量化hCOs中tdTomato覆盖面积。
¶ 逆行狂犬病毒追踪
在nbM-皮层组装体中进行逆行神经追踪实验时,采用RV-ΔG-CremCherry与AAV-EF1a::G标记hCOs,AAV-DIO-eGFP标记hnbMOs。病毒感染3天后进行组装体构建,每4天更换培养基。培养10天后,使用4% PFA 4°C固定过夜,进行免疫染色。使用蔡司LSM-800显微镜采集图像,Fiji软件分析。
¶ 单细胞RNA测序与分析
对hPSCs来源hnbMOs在第36天和第63天进行单细胞RNA测序。类器官经TrypLE解离后37°C消化40分钟,DPBS清洗后轻柔吹打获得单细胞悬液。使用10x Genomics Chromium单细胞控制器进行测序,通过Single Cell 3' Library和 Gel Bead Kit V3构建测序文库。FASTQ文件使用Cell Ranger(v3.1)处理,基因表达矩阵采用Seurat包(v4.0.4)进行下游分析[70]。使用VoxHunt包进行无偏单细胞转录组空间映射[32]。通过Allen Brain人脑微阵列数据集(21 PCW)评估hnbMOs与不同人MGE来源核团的转录组相似性[33],选取各核团相对于其他核团的Top 20差异基因(p<0.05)作为基因特征(表S1B)。利用人GW16胎儿脑空间转录组数据集和成年小鼠脑MERFISH数据[34,35]进行hnbMOs与人胎儿脑及小鼠脑的空间映射。通过Enrichr在线平台进行KEGG和GO富集分析,P值小于0.05的通路视为显著改变。
¶ 蛋白质印迹
胎儿脑组织样品使用含蛋白酶抑制剂的RIPA裂解液处理。蛋白质经凝胶电泳分离后转至PVDF膜1小时。牛奶封闭后,一抗4°C孵育过夜。次日用1×TBST洗涤3次(每次8分钟),二抗孵育1小时。最后通过ECL系统检测蛋白条带。
¶ 全细胞膜片钳记录
玻片浸没于含145 mM NaCl、5 mM KCl、1 mM CaCl₂、1 mM MgCl₂、5 mM HEPES和5 mM葡萄糖的细胞外液(pH 7.3,渗透压280 mOsm)。电极内液含130 mM葡萄糖酸钾、10 mM KCl、10 mM EGTA、2 mM MgCl₂、0.3 mM Na-GTP、2 mM Na-ATP和10 mM HEPES(pH 7.3,280 mOsm)。在奥林巴斯BX51WI正置显微镜下使用60倍水浸物镜观察类器官中神经元(第45-60天)。通过Axon MultiClamp 700B放大器采集数据,Digidata 1550B系统进行数字化。采用Sutter Instruments拉制仪制备硼硅玻璃电极(电阻9-13 MΩ)。钠钾电流检测在-70 mV保持电位下进行,施加电压阶跃(从-80 mV至60 mV,16个阶跃,步长10 mV)。电流钳实验中,通过从-70 mV起始、以10 pA递增的10步电流序列诱发动作电位。使用pClamp软件(版本9)采集分析电压与电流记录。
¶ 光遗传刺激
为记录nbM-皮层组装体在光遗传刺激下的局部场电位、光遗传兴奋性突触后电流(oEPSC)及神经元放电,采用470纳米波长、5毫秒时长的LED光进行刺激。随机选择组装体hCO侧不表达GFP的神经元进行记录。在双移植小鼠移植后4个月进行oEPSC记录时,使用莱卡VT1200S振动切片机制备300微米脑切片,记录前在31°C人工脑脊液(含126 mM NaCl、2.5 mM KCl、1.25 mM NaH₂PO₄、1 mM MgSO₄、2 mM CaCl₂、26 mM NaHCO₃及10 mM D-葡萄糖)中平衡30分钟。随机选择双移植脑切片皮层区域的mCherry标记神经元进行记录,同时对GFP标记的nbM区域施加470纳米波长、5毫秒时长的LED光刺激。
¶ 微电极阵列检测
使用基质胶(1:50稀释)预包被过夜的24孔微电极阵列板检测电生理信号。将培养60天的hnbMOs接种于含1毫升NIM的孔板,记录前预培养2天。采用Maestro Pro MEA系统(Axion Biosystems)进行信号采集,通过AxIS Navigator软件基于系统标准神经设置进行数据分析。电极阵列检测的类器官活动通过Neural Metric Tool(Axion Software)可视化。锋电位检测阈值设为标准差的6倍,采用动态跨阈值法进行识别。爆发式放电通过ISI阈值判定,要求连续至少5个锋电位且间隔低于100毫秒。
¶ 组装体电刺激与记录
将nbM-皮层组装体培养于覆盖半透明聚酯膜滤膜的4096通道3D高密度微电极阵列(HD-MEA)上。组装体静置20分钟后,使用配备3Brain GmbH公司HD-MEA Accura芯片的BioCam Duplex MEA系统进行记录。电刺激采用hnbMO区域电极(21μm×21μm),刺激时两个相邻电极为正极,另两个电极为负极,极间间隔一个电极位点。刺激参数为50毫秒时长、65μA电流强度,共施加10个刺激周期,周期间隔10秒。采用BrainWave 5软件分析数据,信号经100Hz高通滤波后进行锋电位检测与分类,提取hCO区域电极的放电数据进行分析。
¶ 类器官移植
移植前7天,用巴斯德吸管剪切类器官获得150-250微米片段,在添加5% B27的NIM悬浮培养基中预培养。将6-8周龄重症联合免疫缺陷(SCID)小鼠用1.5%异氟烷混合氧气麻醉后固定于立体定位注射仪平台。hnbMOs移植时,采用玻璃电极将小片段hnbMOs注射至Meynert基底核(定位坐标:AP=-0.7mm;ML=±1.8mm;DV=-4.0mm)。双移植时先按上述方法注射hnbMOs,再将hCOs片段注射至皮层(定位坐标:AP=+0.5mm;ML=±1.8mm;DV=-1.3mm)。术后将动物置于预热平台维持体温至恢复自主活动后放回饲养笼。
¶ 移植小鼠磁共振成像
移植后2个月,小鼠初始用5%异氟烷麻醉,成像期间维持1-3%异氟烷。采用布鲁克Biospec 7T/20扫描仪,配备AVANCE III电子系统、IECO驱动器和120毫米梯度线圈(600mT/m,1000T/m/s)。系统集成八通道多线圈射频装置与Paravision 6.0.1平台。信号检测采用86毫米内径主动去耦体积射频线圈联合四通道低温接收线圈。成像使用轴向二维TurboRARE序列:重复时间2500毫秒,回波时间33毫秒,2次信号平均。采集16层切片(厚度0.6-0.8毫米),分辨率256×256。采用2厘米内径正交射频线圈(Rapid MR International)接收信号,通过Imaris内置表面重建工具进行三维体积渲染与分析。
¶ 量化与统计分析
¶ 统计分析
数据分析采用Student t检验、方差分析及Tukey多重比较检验。所有图表数据均以均值±标准误表示。每个实验至少使用三个独立生物样本进行重复。统计学显著性判定标准如下:p < 0.05,p < 0.01,p < 0.001。
¶ 荧光强度定量
使用Fiji软件的Plot Profile功能测量荧光强度。每个类器官随机选取1-2个切片进行量化分析。
¶ 投射量化
通过Fiji软件对hnbMOs的AAV-hSYN-EGFP投射进行量化分析。在共聚焦最大投影图像中,通过手动勾勒感兴趣区域(ROIs)覆盖目标hCOs或hnbMOs区域。ROIs划分基于荧光信号与明场成像结果,荧光覆盖率通过信号阳性区域与总投射类器官面积的比值进行标准化。每个类器官随机选取1-2个切片进行量化。
¶ 移植hnbMOs神经突生长量化
在含移植hnbMOs的35微米矢状脑切片中评估神经突长度。随机选取切片,通过hN⁺与CHAT共表达鉴定人源胆碱能神经元。采集共聚焦z-stack图像并转换为最大强度投影,使用ImageJ手动测量每个CHAT⁺/hN⁺神经元延伸的最长神经突。每个类器官分析1-2个切片,比较整倍体与三体移植条件下的神经突生长差异。
¶ 文献综合分析
¶ 1.实验内容结构