¶ 记录与分析CMOS集成高密度微电极阵列上的多模态大规模神经元集群动态
布雷特·艾迪生·埃默里*,1,沙鲁克·坎扎达*,1,胡鑫*,1,戴安娜·克吕奇1,海德尔·阿明1,2,3
1 “生物混合神经电子学(BIONICS)”研究组,德国神经退行性疾病中心(DZNE)
2 德累斯顿工业大学卡尔·古斯塔夫·卡鲁斯医学院
3 德累斯顿智能材料中心(DCIM),德累斯顿工业大学 *这些作者贡献均等
¶ 摘要
大规模神经元网络及其复杂的分布式微电路对于产生时空神经元活动模式所涌现的感知、认知和行为至关重要。这些从相互连接的神经元群功能组中涌现的动态模式,促进了处理和编码多尺度神经信息的精确计算,从而驱动更高级脑功能。为探究这种复杂性背后的神经动力学计算原理,并研究生物过程在健康与疾病中的多尺度影响,大规模同步记录已成为关键工具。本文采用高密度微电极阵列(HD-MEA)研究两种神经动力学模态——来自ex-vivo 小鼠脑切片的海马体与嗅球回路,以及来自in-vitro人诱导多能干细胞(iPSC)培养的神经元网络。该具备4096个微电极的HD-MEA平台能够以高时空分辨率同步无创、多位点、无标记地记录数千个神经元群的细胞外放电模式。该方法可表征多种全网络电生理特征,包括单/多单元放电活动模式和局部场电位振荡。为深入分析这些多维神经数据,我们开发了多种融合机器学习算法、自动事件检测与分类、图论及其他先进分析方法的计算工具。通过将该计算流程与本平台相结合,我们提供了从细胞集群到网络层面研究大规模、多尺度、多模态动力学的方法论,这将有望推动我们对健康与疾病状态下复杂脑功能及认知过程的理解。对开放科学的承诺与对大规模计算神经动力学的洞见加强类脑建模、神经形态计算和神经网络学习算法的研究。此外,理解受损的大规模神经计算及其相互连接的微电路动态的内在机制,有助于识别特定生物标志物,为神经系统疾病开发更精准的诊断工具和靶向治疗方法铺平道路。
¶ 引言
神经元集群,通常称为细胞集群,在神经编码中起着关键作用,它们通过复杂的计算处理多尺度神经信息{1,2,3}。这些集群构成了庞大神经元网络及其精密微环路的基础{4}。此类网络及其振荡模式驱动着包括感知与认知在内的高级大脑功能。尽管现有研究已深入探索特定神经元类型与突触通路,但对于神经元如何协同形成细胞集群,并如何影响跨环路与网络的时空信息处理机制,仍缺乏深刻认知{5}。
急性ex-vivo脑切片是研究完整神经回路的关键电生理工具,它通过受控环境探测神经功能的振荡活动模式、突触传递与连接性,对药理学测试和疾病建模具有重要意义6,7,8。本实验方案重点研究两个关键脑回路:参与学习记忆过程的海马-皮层回路9,10,以及负责气味识别的嗅球回路11,12,13。在哺乳动物大脑中,这两个区域通过成体神经发生过程终身持续产生新的功能神经元14。这两种回路均展现出多维动态神经活动模式与内在可塑性,既能参与现有神经网络的重构,又能在需要时促成替代性信息处理策略15,16。
急性ex-vivo脑切片模型对于在微电路层面深入探究大脑功能及理解疾病机制不可或缺。然而,源于人诱导多能干细胞(iPSCs)神经元网络的in-vitro细胞培养体系,为转化研究提供了充满前景的途径——它能将动物实验发现与潜在的人类临床治疗无缝衔接[17,18]。这些以人类为核心的in-vitro检测平台可作为评估药物毒性的可靠载体,既能实现精准药物筛选,又能推动创新型细胞治疗策略的研究[19,20]。认识到iPSC神经元模型的关键作用,我们已在本方案研究的第三模块中着力探究其衍生网络的功能特性,并优化相关细胞培养方案。
这些电活性神经模块通常通过钙成像( )、膜片钳记录和低密度微电极阵列(LD-MEA)等技术进行研究。虽然Ca2+成像能提供单细胞活动图谱,但这种基于细胞标记的方法受限于较低的时间分辨率及长期记录面临的挑战。LD-MEA缺乏空间精度,而膜片钳作为侵入式单点记录技术操作繁琐,成功率通常较低21,22,23。为应对这些挑战并有效探测全网络活动,大型-大规模同步神经记录已成为理解支撑大脑复杂性的神经动力学计算原理及其在健康和疾病中影响的关键方法24,25。
在本JoVE实验方案中,我们展示了一种基于高密度微电极阵列(HD-MEA)的大规模神经记录方法,用于捕获跨脑区模型的时空神经元活动。该方法适用于ex-vivo小鼠脑急性切片中的海马体和嗅球回路(图1A-C),以及我们团队与其他同事26,27,28,29,30,31,32,33,34,35曾报道的in-vitro人源iPSC衍生神经元网络(图1D-E)。该HD-MEA采用互补金属氧化物半导体(CMOS)技术构建,具备片上电路与信号放大功能,可在7平方毫米的阵列范围内实现亚毫秒级精度记录36。这种非侵入式方法通过4096个微电极,以高时空分辨率同步捕获数千个神经元集群的多位点、无标记胞外放电模式,揭示了局部场电位(LFP)与多单元放电活动(MUA)的复杂动态特性26,29。
鉴于该方法生成的数据规模庞大,构建精密的分析框架至关重要,但同时也带来诸多挑战³ 。我们已开发出涵盖自动事件检测、分类、图论、机器学习及其他先进技术的计算工具(图1F)² ,² ,³ ,³ 。通过将高密度微电极阵列与这些分析工具相集成,我们设计出综合性策略,用以探究从单个细胞集群到跨模态神经网络的复杂动态特性。这种整合方法不仅深化了我们对正常脑功能中计算动态特性的理解,更为神经异常机制的研究提供了新的视角。
在病理条件28下存在。此外,这种方法的见解能够推动脑启发建模、神经形态计算和神经网络学习算法的发展。最终,该方法有望揭示神经网络紊乱背后的核心机制,可能识别生物标志物,并指导针对神经系统疾病的精准诊断工具和靶向治疗的开发。
¶ 协议
¶ 高密度微电极阵列(HD-MEA)神经记录实验详细步骤
所有实验均按照适用的欧洲和国家法规(动物保护法)进行,并得到了地方当局(萨克森州地方当局;25-5131/476/14)的批准。
¶ 1. Ex-vivo 来自海马 - 皮层和嗅球回路的脑切片在 HD-MEA 上
¶ 1.1 实验切割和记录溶液的制备 (图 2A)
-
在实验当天,准备 0.5 升的高蔗糖切割溶液和 1 升的人工脑脊液 (aCSF) 记录溶液 (表 1A,B)。
-
将所有固体化学品加入干燥的容量瓶中,然后使用双蒸水部分填充至刻度。
-
加入来自 1 M 母液的 MgCl₂和 CaCl₂,随后用双蒸水补足剩余体积。开始用磁力搅拌器持续搅拌,直至可见固体完全溶解~5 分钟。
-
使用冰点渗透压计验证渗透压在 350-360 mOsm 之间对于高 - 蔗糖切割液和 315-325 mOsm 的 aCSF 记录液。
-
使用 pH 计验证高蔗糖切割液的 pH 值在 7.3-7.4 之间,以及 aCSF 记录液的 pH 值在 7.25-7.35 之间。开始持续通入 95% O₂和 5% CO₂进行鼓泡。
-
将高蔗糖切割液置于冰上至少 30 分钟后开始切片,并持续通入 95% O₂与 5% CO₂的混合气体。
-
碳化处理 10 分钟后,将 30 mL 切割溶液倒入 50 mL 烧杯中,并将其存放在冷冻箱中(-20℃)20-30 分钟或直至部分冻结。
- 注意:所有溶液应在每次实验时新鲜制备。这里使用的去离子水是经过高压灭菌的超纯水,储存在室温(RT)下。制备的溶液量应根据具体研究问题进行调整。
¶ 1.2 脑切片工作区的准备 (图 2A)
- 将动物带入实验室。
- 注意:本方案中,如先前文献所述 26,29,32,使用的是 8-16 周龄 C57BL/J6 雌性小鼠。动物运输后应至少适应 30 分钟。应避免在实验当天进行长距离转运(如跨机构转运)。动物的年龄、性别和品系需根据具体研究问题确定。
-
在动物适应环境且高蔗糖溶液冷却期间,将所需工具放置于每个指定工作区(参见材料表)。
-
准备脑切片恢复和维护工作区。将切片恢复腔室充满充碳酸气的人工脑脊液记录溶液,并将腔室放入设定为 32℃ 的水浴中。在整个实验过程中保持连续充碳酸气。
-
准备脑切片制备工作区。安装振动切片机 —— 将刀片放入振动切片机刀架中,并将振动切片机校准至正确设置(刀片行进速度:0.20 毫米 / 秒,振动幅度:95 微米,刀片角度:45°)。向振动切片机冰槽加注冰块,缓冲槽注入高蔗糖切割溶液,并开始对缓冲槽中的溶液进行碳合处理。
-
准备脑组织制备工作区。向 150 毫米玻璃培养皿中装入冰块,内置一个铺有滤纸的 90 毫米塑料培养皿。在塑料培养皿中注入高蔗糖浓度的切片液并开始充入碳合气。将一滴强力胶滴在预冷的标本板上,固定琼脂糖模具。
- 注意:琼脂糖模具需至少提前一天准备,使用 3% 琼脂糖水溶液在定制的小鼠脑模具中制作。
- 最后,准备脑组织提取工作区。用纸巾覆盖铝箔,取回装有高蔗糖切割溶液碎屑的 50 毫升烧杯,并向麻醉室添加异氟烷。
- 注意:在放入动物前 1 分钟,麻醉室中将预先注入麻醉剂。准备盛有 30 毫升高蔗糖切割液的 50 毫升烧杯。半融雪将在断头前 2 分钟从 - 20℃ 冷冻室中取出。
¶ 1.3 小鼠大脑的提取和切片
- 注意:整个操作过程应尽可能快速完成,以避免大脑缺氧。从断头到浸入高蔗糖切割溶液冰泥中,取脑过程仅需 1-2 分钟。
-
使用适当剂量的异氟烷(0.5 毫升 / 1 升麻醉室)对动物进行麻醉。通过捏爪测试评估麻醉深度;在继续操作前,需确认无爪部退缩反射。
-
将实验动物转移至脑部提取工作区的组织纸上,用手术剪进行断头处理。
-
将虹膜剪插入脑干,使剪刀底部与颅骨保持齐平。沿矢状缝剪开直至触及冠状缝。将虹膜剪置于眼眶中,剪开额缝。用弯镊将颅骨两侧向下按压,完整暴露全脑。
- 注意:使用虹膜剪和镊子时需格外小心,避免在剪开骨缝时刺伤脑组织。
-
用弯钳的钝边将大脑滑入含有 30 mL 高蔗糖切割溶液浆的 50 mL 烧杯中。让其停留 1 分钟。
-
将大脑转移至脑部制备工作区内装有低温充氧切割液的 90 毫米塑料培养皿中。调整大脑方向以便在琼脂糖模具中定位。
-
在琼脂模具的吻端添加一小点强力胶。用刮铲将大脑放入模具中。确保大脑背侧朝下放置,用于水平切片。
- 注意:模具中胶水的涂抹位置会根据感兴趣区域(ROI)而变化。对于海马 - 皮层(HC)和嗅球(OB)切片,需确保 OB 固定稳定,且大脑侧面不沾染胶水。过多胶水会影响切片质量,并在振动切片过程中导致组织撕裂。
-
将标本板移入缓冲托盘,将刀片调整至正确角度就位,并升高缓冲托盘使刀片尽可能贴近脑组织。
-
以 0.20 毫米 / 秒的速度对 HC 和 OB 组织进行 300 微米间隔切片,随后每完成一轮切片即用玻璃巴斯德吸管收集样本。
-
将切片留在充满 aCSF 的恢复室中,置于 32℃ 水浴中 45 分钟,随后在室温下放置 1 小时。确保切片不重叠,并完全暴露于充氧溶液中。
- 注意:务必对所有溶液以及任何提到的含有该溶液的腔室进行连续碳合气充入。可以使用压力调节器来维持碳合气充入的一致性。
¶ 2. In-vitro 基于人类 iPSC 的神经元网络在 HD-MEA 上
- 注意:本研究中使用的所有 iPSC 神经元均通过商业渠道获得(参见材料表)。这些人源细胞区别于从人类外周血或成纤维细胞中提取的稳定 iPS 细胞系。
¶ 2.1 HD-MEA 芯片的涂层,用于 in-vitro 人类 iPSC 细胞培养(图 2B)
- 将高密度微电极阵列芯片置于采集记录平台上,在储液槽中注入 PBS 溶液,并在包被前测试芯片性能。启动 Brainwave 软件,选择文件 > 新建记录会话。设置记录参数:记录频率 50 Hz ,采样频率 18 kHz / 电极。调整放大器偏移量以校准芯片。故障排除建议参见表 2。
- 注意:记录频率与采样频率参数将取决于数据类型及具体系统要求。
-
对 HD-MEA 进行消毒和预处理。
-
在超净工作台下,用蘸取 96% 乙醇(EtOH)的擦拭布清洁芯片与玻璃环,随后将每个器件放入无菌的 100 毫米 ×20 毫米培养皿中,并向 MEA 储液槽注入 70% EtOH 溶液浸泡 20 分钟。
-
吸去乙醇,用无菌过滤双蒸水清洗储液槽三次。加入 1 mL 预处理培养基,于 37℃ 、5% CO₂条件下培养过夜。
-
- 注意:预处理介质需为盐基溶液,以使高密度微电极阵列表面更具亲水性。这可包括预先制备的 BrainPhys(BP)完全培养基(保存期不超过 3 个月)(表 1C)。
-
涂层高密度微电极阵列。第二天,吸出预调节培养基。添加 1 mL 0.1 mg/mL 聚 - DL - 鸟氨酸(PDLO)覆盖整个活性区域,在 37℃ 培养箱中过夜孵育。
-
准备并将培养基预热至室温。这里的方案利用了来自两个商业来源的功能性人类 iPSC 神经元;因此,每个供应商的培养基成分各不相同。一个方案在(表 1C,D)中描述。
-
吸去 PDLO,用双蒸水清洗 3 次,并将芯片在通风橱下干燥 10 分钟。
-
在 35 毫米 x10 毫米培养皿中注入无菌过滤双蒸水,并将其置于芯片旁以维持适宜湿度,避免后续步骤中接种的细胞发生蒸发。
¶ 2.2 人 iPSC 神经元在 HD-MEAs 中的铺板与维持(图 2B)
-
解冻并稀释细胞,以达到所需的每微升细胞浓度(例如,1000 细胞 /μL ,以在 HD-MEA 上的 50 μL 液滴中获得 50,000 细胞密度)(表 1C)。
-
使用高黏连蛋白点样培养基,将细胞悬液移液到芯片活性区域的表面(表 1D)。
-
在 37℃、5% CO₂条件下孵育 45-60 分钟。
-
在 HD-MEA 储液槽中轻柔注入 2 mL 培养基(表 1C)。
-
接种后第 1 天(DIV1)使用室温培养基进行 100% 培养基更换(表 1C)。每 3-4 天更换 50% 培养基。整个实验过程中保持 HD-MEA 在 37℃、5% CO₂条件下孵育。
- 注意:移液时动作轻柔以避免细胞脱落。观察培养基颜色判断是否发生污染。培养基更换的间隔和量可以根据个别研究问题或细胞需求 / 规格来确定。
- 可选:在用 >70% 乙醇清洁载物台后,使用直立式微分干涉差 (DIC) 显微镜检查 DIV4 到 DIV8 期间细胞培养生长的进展。
¶ 3. Ex-vivo 和 in-vitro 使用高密度微电极阵列的大规模神经记录
¶ 3.1 脑切片记录工作区的准备 (图 2A)
- 在脑切片恢复期间,将所需工具放置在每个指定工作区(参见材料表)。
- 注意:必须在脑切片实验日之前对主系统设置进行充分优化和测试。需将灌流系统(包括进水管道、泵出水管路、导管及接地线)与记录平台上的高清微电极阵列一同使用 PBS 或人工脑脊液进行测试,以确保信号纯净、提高信噪比并消除灌流噪声。
-
在 HD-MEA 芯片表面涂覆 0.1 mg/mL 的 PDLO 以增强组织 - 芯片耦合,并于 37℃ 下孵育 20 分钟。
-
芯片孵育期间,用记录用人工脑脊液填充重力灌注系统及管路。确保灌注系统持续进行碳合气处理。设定流速为 4.5 毫升 / 分钟,温度维持在 37℃。
-
将高密度微电极阵列芯片放置在采集记录平台上,在储液槽中注入人工脑脊液,测试灌注系统,并排查并解决残留的系统噪声。
-
通过房间照明系统或光学台上的遮光笼确保记录区域保持黑暗。
-
将体视显微镜与高清微电极阵列芯片的储液池及活性区域对齐,以进行图像采集。
-
将锚定器放入芯片储液槽中平衡。
- 注:锚定器为定制铂金框架,采用极简线材设计以促进充氧;但目前也有商用型号可选。
- 将药理学化合物添加到适当的灌注管中。
- 注意:本方案中,自发性及 100 μM 4 - 氨基吡啶药理诱导记录均按前述方法获取。药理化合物可根据具体研究问题进行调整。
- 在脑片制备工作区中,将新的 90 毫米塑料培养皿置于 150 毫米玻璃培养皿内。加入人工脑脊液并开始通入碳合气。
¶ 3.2 使用高密度微电极阵列对海马体和嗅球切片进行全电路记录
- 注意:切片耦合应尽快执行,以避免切片缺氧。从将显微切割切片放置在芯片活性区域到最终灌注系统启动,耦合过程应仅耗时~1 分钟。
-
用玻璃移液器从脑切片复苏室中取出切片,将其置于持续通入碳合气的 90 毫米塑料培养皿中。使用显微切割工具从周围脑切片组织中分离海马体或嗅球。
-
用玻璃移液器将分离的海马体或嗅球急性切片移至高清微电极阵列储液槽中。用细刷将切片轻柔对齐至微电极阵列活性区域。使用抽吸系统吸除高清微电极阵列芯片槽中的所有溶液。
-
用镊子将锚定器轻置于切片上方。
- 注意:放置锚定器时应避免切片移动,防止耦合失效。
- 向芯片储液槽轻柔添加溶液并启动灌注系统。
- 注意:确保从灌注入口至泵出口形成层流,以获得最佳记录参数。
-
通过室内照明系统或在光学平台上加装遮光罩,确保记录区域光线充分减弱。
-
开始记录或进行额外药理调节前,让切片适应 10 分钟。
-
启动 Brainwave 软件。选择文件 > 新建记录会话。将记录参数设置为记录频率 1 赫兹,并采样频率为 14 kHz / 电极。更改放大器偏移以校准芯片。
- 注意:如前面第 3.1.4.1 节所述,在执行系统测试时,确保应用这些相同的记录参数。
-
按下 “记录” 键,以预设实验条件开始采集。
-
最终记录完成后立即对急性脑切片进行荧光成像。将切片移回切片恢复室,用刷子清除芯片上附着的任何有机物质,并继续处理下一个切片。按照第 3.4 节所述方法清洁高密度微电极阵列。
¶ 3.3 人源 iPSC 记录工作区的准备及 HD-MEA 全网络记录(图 2B)
- 注:培养基更换应在记录前一天或人源 iPSC 记录后立即进行(表 1C)。在使用功能性神经元的研究中,每 4 天更换一次培养基,并于第 4、8、16、24 天在 iPSC 记录后立即更换培养基。
-
使用 >70% 乙醇清洁高清微电极阵列采集平台,确保无菌工作环境。
-
轻轻将一个基于聚二甲基硅氧烷(PDMS)的带有参考的盖子放置在通风橱下的 HD-MEA 环上。将 HD-MEA 芯片移动到 iPSC 记录工作区,并将 HD-MEA 芯片连接到采集平台。
-
通过室内照明系统或光学平台上的遮光罩,确保记录区域被充分调暗。
-
在开始记录或进行额外的药理学调制之前,让 HD-MEA 芯片平衡 10 分钟。
-
启动脑电波软件。选择文件 > 新建录制会话。将录制参数设置为 50 Hz 的录制频率和 18 kHz / 电极的采样频率。更改放大器偏移以校准芯片。
- 注意:如第 2.1.1 节中所述,在进行涂层和电镀之前的系统测试时,请确保应用这些相同的记录参数。
- 按照实验方案(即第 4、8、16、24 天体外培养天数),每日记录人源 iPSC 神经网络的自发放电活动或药物诱导反应。
- 注意:请勿将芯片置于培养箱外超过 30 分钟,以维持稳定的温湿度环境,避免对细胞造成温度冲击。
-
在实验过程中,将 HD-MEA 置于 37℃、5% CO₂条件下进行孵育。
-
实验结束后,如步骤 3.4 所述,固定芯片上的神经元网络并染色以进行进一步光学成像,或直接清洁高密度微电极阵列。
¶ 3.4 高密度微电极阵列芯片的清洁
-
实验结束后,请按照规范废液处理方式弃置溶液,并用双蒸水冲洗。
-
取适量所选清洁剂,用棉签擦拭活性区域及整个储液槽后弃置。重新注入清洁剂,静置 20 分钟后弃去。
-
使用实验室级纯水彻底冲洗,随后用双蒸水重复冲洗 3-4 次。
-
使用气压将高密度微电极阵列芯片彻底干燥。
¶ 4. 高密度微电极阵列的大规模神经记录分析
- 注意:虽然步骤 4.1 是 Brainwave 软件特有的,但步骤 4.2 可根据每位用户采用的商用高密度微电极阵列设备类型进行调整。
¶ 4.1 原始数据预处理与事件检测
- 在 Brainwave 软件中打开一个记录的原始数据文件 (.brw)。选择分析 > 局部场电位检测或尖峰检测。
- 注意:LFP 检测采用 IIR 滤波,使用四阶巴特沃斯低通滤波器( 1-100 Hz )。硬阈值算法包括 150 μV 的高阈值、 -150 μV 的低阈值、 70-120 ms 的能量窗口、10ms 的不应期以及 1 s 的最大事件持续时间。单单元与多单元放电检测采用 IIR 滤波,使用四阶巴特沃斯高通滤波器( 300-3500 Hz )。应用 PTSD 算法,标准差因子为 8,峰值生存周期为 2 ms ,不应期为 1 ms 。
-
对于 HC 和 OB 回路记录,请在检测到的事件文件 (.bxr) 中添加高级工作区选项,以导入从立体显微镜获取的结构光图像。在检查大规模 HC 回路时,创建包含齿状回 (DG)、门区、海马角 1 区 (CA1)、海马角 3 区 (CA3)、内嗅皮层 (EC) 及嗅周皮层 (PC) 的结构层。在检查大规模 OB 回路时,创建包含嗅神经层 (ONL)、小球层 (GL)、外丛状层的结构层 (EPL)、僧帽细胞层(MCL)和颗粒细胞层(GCL)。将 EPL 与 MCL 视为投射层(PL),其中包含嗅皮质(OCx)。
-
使用自定义Python计算流程进行数据处理
¶ 4.2 去噪
-
使用自定义 Python 脚本 26,29,32 及 h5py 3.6.0 python 包读取.bxr 文件。
-
提取与 iPSC 网络记录相关的尖峰序列,以及与 HC 和 OB 脑切片回路记录相关的局部场电位事件序列。
-
将以下情况判定为随机事件并予以剔除:活动电极总数低于平均事件中平均活动电极数 0 . 1 % 或 1 0 % 的事件,或检测到的事件超出统计学合理发放率范围的事件。同时施加振幅和事件持续时间阈值。
- 注:发放率范围设定为 0.1-15 次 / 秒(尖峰)和 0.1-60 次 / 分钟(局部场电位事件)。这些是分析数据集时使用的示例阈值,实际速率、振幅和持续时间阈值需根据具体数据确定。
- 将最终事件序列数据及其伴随的时空信息以.npy 文件格式保存。
¶ 4.3 光栅图
-
读取过滤后的事件 .npy 和 .bxr 文件,并使用 Matplotlib 生成光栅图 pyplot 函数 (https://matplotlib.org/3.5.3/api/_as_gen/matplotlib.pyplot.html)。
-
此外,对于具有层特异性的脑切片记录,请根据步骤 4.1.2 中生成的层次对电极 ID 进行排序和分组。
¶ 4.4 平均放电活动
-
处理来自 .bxr 文件的时间序列数据,计算每个电极的平均放电率(事件数 / 记录时间)。
-
构建数据矩阵,其中行与列代表高密度微电极阵列 6 4 {\times} 6 4 的电极坐标,每个矩阵值表示平均放电率。
-
使用 Python 中的绘图库(如 Matplotlib 的 imshow 或 Seaborn 的热力图函数)。
-
此处采用 ‘hot’ 色彩映射,生成能够直观呈现电极阵列上平均放电率空间分布的信息化热力图。
¶ 4.5 代表性波形轨迹
-
从.brw 文件中读取时间序列数据,并使用 Matplotlib 的 pyplot 函数生成波形轨迹。(https://matplotlib.org/3.5.3/api/ _as_gen/matplotlib.pyplot.html)
-
输入目标电极 ID、时间仓和频段以生成代表性波形轨迹。本分析定义的频段包括:低频局部场电位振荡( 1 - 1 0 0 : Hz , ),含 δ、θ、β 和 γ 带通滤波频段;锐波涟漪( 1 4 0 - 2 2 0 Hz );以及高频单和 MUA(300-3500 赫兹)。频段 δ、θ、β 和 γ 分别为 1-4 赫兹、5-12 赫兹、13-35 赫兹和 35-100 赫兹。
¶ 4.6 功率谱密度
-
从.brw 文件中读取时间序列数据,并计算周期图以识别每个时间序列中振荡活动背后的主导频率。
-
构建频率 - 时间动态的伪彩色声谱图。
- 注:频谱计算采用韦尔奇方法,通过记录局部场电位的快速傅里叶变换来估算频谱功率密度⁴¹。
- 输入所需的电极 ID、时间箱和频带,用于谱密度图。在这些分析中定义的频带包括步骤 4.2.4 中描述的那些。
¶ 4.7 功能连接性
-
对于脑切片电路记录,遵循步骤 4.2.6.2 至 4.2.6.4。
-
从.brw 文件中读取时间序列数据,并使用皮尔逊相关系数 (PCC) 42 计算 6 4 × 6 4 阵列中活跃电极对之间的互协方差。
-
使用多元格兰杰因果关系将向量自回归模型拟合到时间序列,以量化一个时间序列对另一个的影响。
-
应用定向传递函数 (DTF) 来评估相关链接内的定向信息流。
- 注意:多层网络中的功能连接是通过设定相关性阈值建立的,该阈值基于所有互协方差值的均值加两倍标准差之上 [43,44]。
-
对于 iPSC 记录,请按照步骤 4.2.6.6-4.2.6.8 操作。
-
从.bxr 文件读取脉冲序列数据,并使用 spike_train_correlation 函数(https://elephant.readthedocs.io/en/v0.7.0/reference/spike_train_correlation.html)计算所有分箱脉冲序列组合间的 64x64 PCC 相关系数矩阵。
- 注意:多层网络中的功能连接是通过设定相关性阈值建立的,该阈值基于所有互协方差值的均值加两倍标准差之上。
-
进一步在连接矩阵上实施时空滤波器(STF)和距离依赖延迟阈值(DdLT)过滤程序,以消除可能超过最大传播速度(设定为 400 毫米 / 秒)的配对连接 [45]。
-
通过滤波和阈值操作从所得互相关矩阵中提取负峰值,使用滤波归一化互相关直方图(FNCCH)算法识别抑制性连接 [45]。
-
将每个连接矩阵转换为动态图文件(.gexf 格式)。
¶ 4.8 网络连接图
-
在 Gephi 9.2 版本程序 (https://gephi.org) 中打开数据实验室,用于动态图绘制特定时间区间。
-
在布局窗口中应用 Geo 布局以进行空间映射。
-
在度范围和边权重上设置参数约束以进行比较。
-
分配节点颜色、边大小和度大小以便更好地可视化。
¶ 代表性结果
¶ 多模型时空映射及振荡放电特征提取
为量化源自动态神经元集群的全网络场电位与锋电位活动,我们研究了海马与嗅球回路以及人iPSC网络中的同步大规模放电模式。根据实验方案步骤4.1-4.2,对步骤3.2记录的脑切片回路和步骤3.3记录的iPSC网络进行分析。首先对所有记录数据集进行事件检测与去噪处理,并依据回路特征进行区域解析。随后绘制了平均大规模场电位与锋电位放电模式的地形伪彩色空间映射图、检测事件的点阵图以及滤波波形的代表性5秒轨迹图(图3A-I)。将大规模场电位和锋电位发放率模式的地形伪彩色映射分别叠加在显微镜采集的海马(图3A)、嗅球(图3B)和人iPSC神经元网络(图3C)的光学图像上,借此可探究个体回路与基于网络的振荡模式及响应。海马与嗅球点阵图包含按齿状回、门区、CA3、CA1、内嗅皮层和梨状皮层分层排列的检测场电位事件计数。
HC 回路与嗅球网络的 ONL、OCx、GL、PL 和 GCL 层在 60秒时间单元内的活动(图 3D,E)。人 iPSC 点阵图展示了互连培养网络在 20 秒时间单元内检测到的同步放电事件(图 3G)。随后,来自大规模高密度微电极阵列记录位点的 5 秒代表性事件轨迹显示:海马回路(即 CA3 区选定电极)(图 3G)与嗅球回路(即 GL 区选定电极)(图 3H)中记录到一系列振荡频率,并在人 iPSC 网络中通过阵列内四个选定活性电极记录到多单元脉冲簇发活动(图 3I)。这些典型信号显示出包括低频局部场电位振荡( )与带通滤波的δ、θ、β、γ频段;尖波涟漪( );以及高频单单元与多单元活动( )在内的生物信号特征。最后采用功率谱密度分析,同步量化了通过高密度微电极阵列记录的互连海马-嗅球回路中特定振荡频段的功率强度(图 3J,K)。
¶ 多模态全网络功能连接组
为了从同时活跃的神经元集群的同步放电模式推断多层神经网络的大尺度连接性,我们根据协议步骤4.2.6计算了检测事件中各对活性电极间的互协方差。此处,相关系数基于海马体和嗅球回路中的层级进行排序(在iPSC网络中则不作排序),随后存储于对称矩阵中。通过应用多元格兰杰因果律和定向传递函数,量化一个时间序列对另一个时间序列的影响,并评估不同网络相关连接内的定向信息流,从而生成海马体与嗅球回路的功能性连接组。海马体(图4A)与嗅球(图4B)的连接组映射及网络可视化结果
使用 Gephi 程序 9.2 版本 (https://gephi.org) 进行操作。对功能链接设置相似的参数约束以比较 HC 和 OB 脑切片回路,并展示检测到的 LFP 事件在 100 秒内的功能连接性。节点按度强度进行缩放,节点颜色表示层级,链接颜色标识层内与层间连接。人 iPSC 网络的功能连接组是通过应用
采用时空滤波器(STF)和距离依赖延迟阈值(DdLT),通过滤波归一化互相关直方图(FNCCH)分析增强重要连接的选择能力,优化有意义连接的识别精度。在整个高密度微电极阵列芯片上绘制人iPSC网络的连接组图谱(图4C),使用Gephi进行可视化。节点颜色表示兴奋性或抑制性输入,连接线颜色标识神经连接关系。
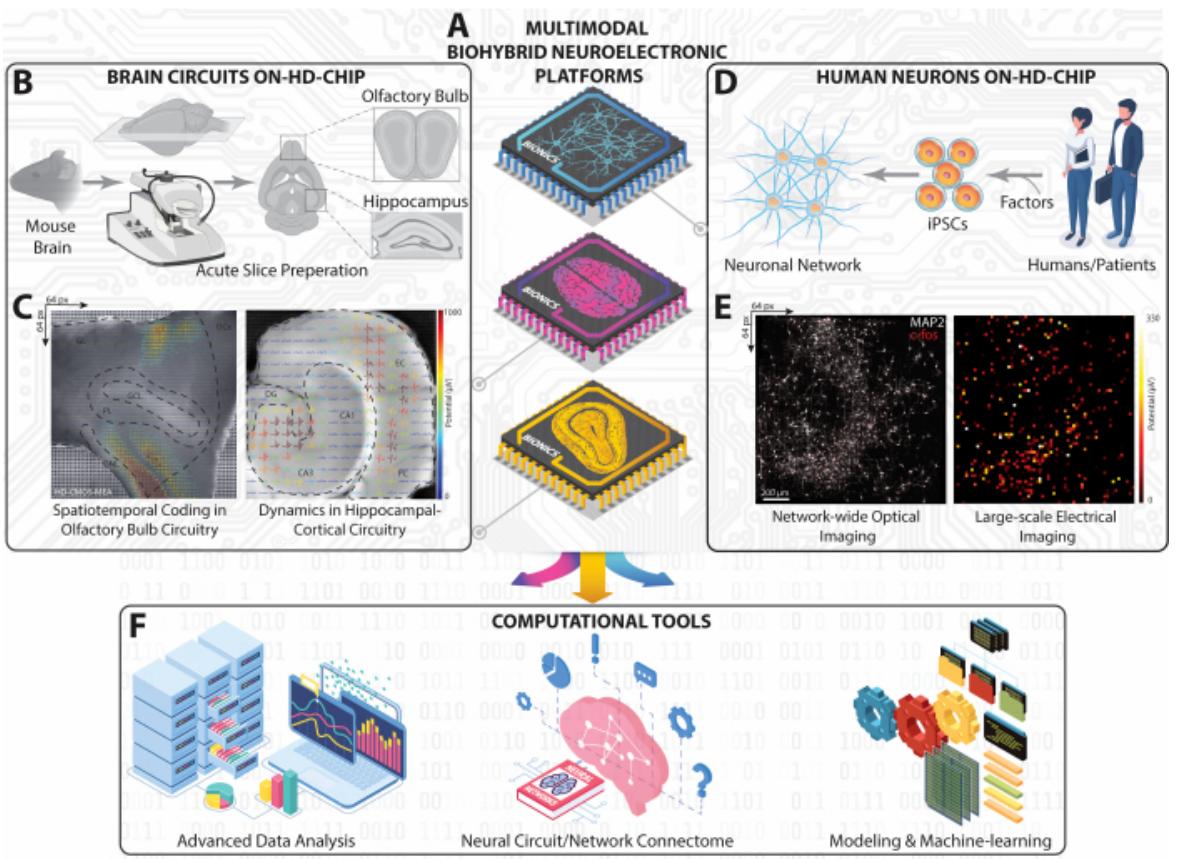
图1:大规模高密度微电极阵列实验与计算平台概览。(A) 采用CMOS高密度微电极阵列实现的多模式生物混合神经电子平台等距示意图,用于捕捉海马体、嗅球及人源iPSC神经元回路与网络的神经动力学活动。(B) 小鼠脑切片制备及其工作流程示意图,用于获取海马体与嗅球切片。© 从完整海马体与嗅球切片同步记录的大规模放电活动地形图,其中提取的细胞外波形与切片光学影像叠加呈现。(D) 人源iPSC神经元网络构建示意图。(E) 荧光显微图像
显示HD-MEA芯片上整个人类神经元网络的细胞c-fos与树突/胞体MAP-2表达(left),及其对应的整体平均放电活动图谱(right)。(F) 包含先进数据分析、连接图谱绘制和人工智能-机器学习工具的计算框架,用于分析通过HD-MEA大规模记录获取的多维神经数据。请点击此处查看大尺寸图片。

图2:ex-vivo脑切片与in-vitro人源iPSC培养制备及记录工作区布局图。(A)示意图工作流程展示了制备HC和OB切片的实验设置,各工作区均配备必要工具与设备。(B)人体iPSC培养制备的示意图,包含所需工具与装置。完整材料清单详见步骤1.2.2、2.1、2.2、3.1.1、3.3及材料表。请点击此处查看大尺寸版本图表。

图3:网络动态的时空模式映射与提取。(A-C) 基于五分钟记录计算得出的平均局部场电位与放电频率空间图谱,叠加在显微镜光学图像上。(D-F) 点阵图展示60秒数据子样本中经过去噪处理的LFP事件及20秒数据子样本中的放电事件。(G-I) 从点阵图数据子样本中提取的5秒代表性波形轨迹(点阵图中红色高亮部分),显示为原始LFP振荡频带( ):δ( )、θ( )、 ( )及γ( )频段;SWR( );以及高频单单元与多单元放电活动(300-350 )。(J,K) 功率谱快速和慢速振荡局部场电位( )与锐波涟漪( )的密度图。请点击此处查看大尺寸版本此图的
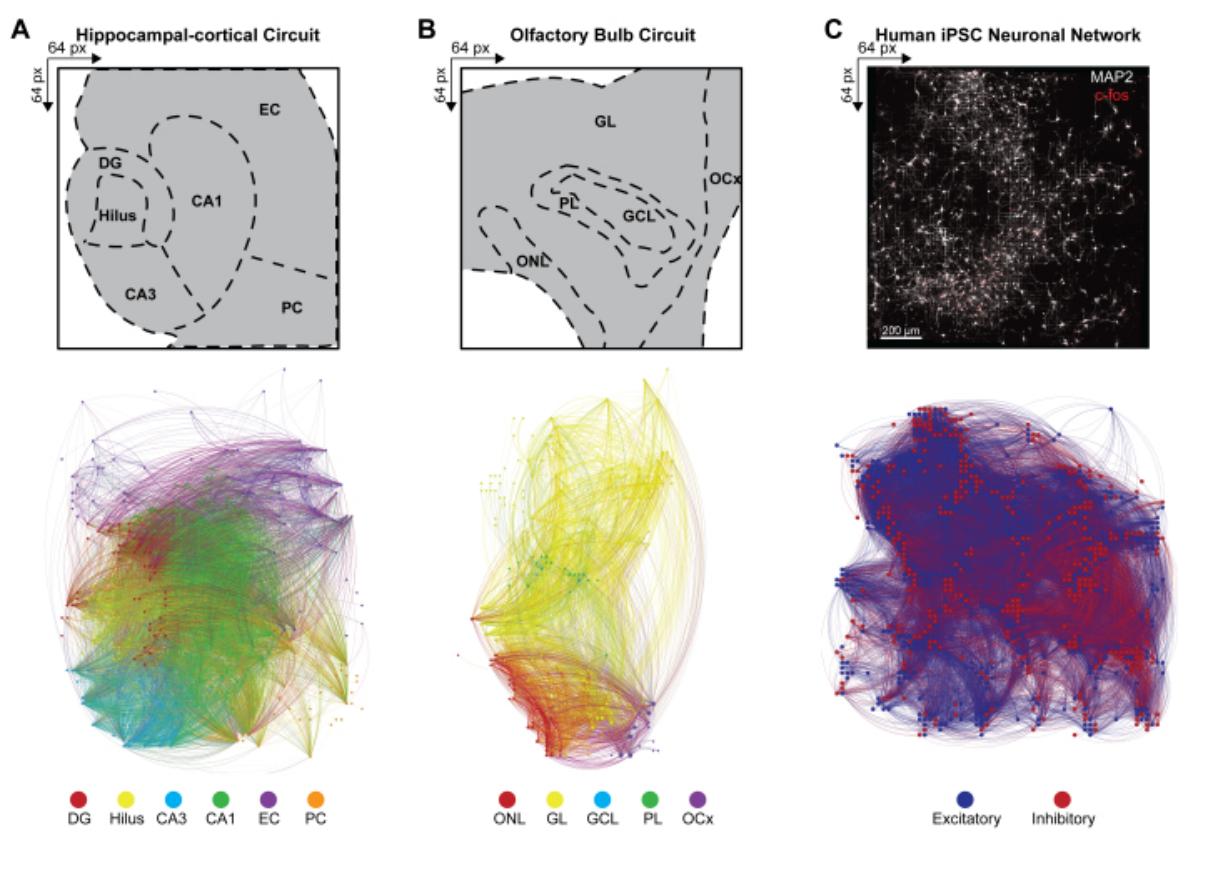
图4:多模态全网络功能连接组的组织结构。(A-C) 展示节点 的Gephi图谱功能连接图中,节点对应示例颜色条图例(below)之一,而连接线(或边)则根据相连节点的颜色进行着色。图中展示了(A)HC层、(B)OB层和©iPSC层的示例图例,这些图例均基于 阵列显示。为优化可视化效果,HC层与OB层采用100秒时间窗口进行绘制,以有效减少可见节点与连接线的数量。请点击此处查看大尺寸版本图片。
表1:脑片制备与iPSC神经元培养液配方。(A) 适用于ex-vivo脑片制备的高蔗糖切割液。(B) 适用于ex-vivo脑片制备与记录的aCSF记录液。(C-D) 人源神经元iPSC培养基方案,其中©为BrainPhys完全培养基,用于细胞复苏、高密度微电极阵列芯片包被及培养中的高密度微电极阵列系统维持和 (D) 用于 HD-MEA 细胞铺板的点样介质。请点击此处下载此表格。
表2:常见高密度微电极阵列记录采集问题故障排除。本列表涉及高密度微电极阵列芯片、记录平台、系统噪声及软件的常见问题、潜在原因与解决方案。请点击此处下载该表格。
¶ 讨论
时空神经元活动错综复杂的动态特性,源于相互连接的神经元集群,长期以来一直是神经科学领域引人入胜的研究主题。传统研究方法如膜片钳技术、标准微电极阵列和钙离子+成像,为理解大脑复杂性提供了宝贵见解。然而这些技术往往难以捕捉全网络层面的综合计算动态21,22,23。本《JoVE可视化实验》期刊详述的高密度微电极阵列平台技术方案实现了重大突破,能够以全景视角观测从细胞集群到广域网络(包括急性ex-vivo小鼠脑切片与in-vitro 人类iPSC网络)的多模态神经动态26,29,30,32。
急性ex-vivo小鼠脑切片一直是神经元研究的基础工具,有助于分子和环路水平的探索6,7。然而维持组织活性始终是亟待解决的瓶颈问题。本研究提出的方案通过关键改良手段,在保持高清微电极阵列平台优势的同时,有效优化了脑切片的质量与存活时长。该方案重点强调:i) 实现切片均匀性——相较于组织斩切机,振动切片机凭借更高精度和更小组织损伤成为优选,虽需承担更长切片耗时;ii) 从取材到记录全程保持碳合通气,确保持续组织活性;iii) 精确调控温度并预留充足恢复时间再行记录;iv) 采用琼脂糖块固定脑组织,防止撕裂并减少胶粘剂接触;v) 维持高清微电极阵列槽内碳合人工脑脊液的最佳流速,在保障切片活性的同时避免信号解耦、噪声干扰及基线漂移等问题(表2)。
对于小鼠脑切片和人iPSC样本而言,增强电极-组织界面耦合至关重要30,46,47。我们的方案特别强调使用促粘附分子多聚-dl-鸟氨酸(PDLO)。该分子不仅能扩大电信号探测的表面积,还可提升导电性能46。通过这种方式,它促进细胞粘附、生长及功能性网络特性的发展。此类优化对提升高密度微电极阵列(HD-MEA)平台效能具有关键作用,进而确保对微观ex-vivo和in-vitro 连接组及其时空放电序列进行精准稳定的分析。值得注意的是,在神经元培养中,PDLO在促进自发放电活动及电刺激响应方面已被证明优于聚乙烯亚胺(PEI)和聚-l-鸟氨酸(PLO)等其他基质。此外,PDLO已应用于HD-MEA表面功能化处理,研究显示其能增强电极-切片耦合界面,并同步提升嗅球(OB)和海马(HC)切片的信噪比26,29。定制铂金锚件的加装进一步强化了电极-切片界面耦合,最终获得更高信噪比的记录数据。
利用高密度微电极阵列(HD-MEA)同时记录ex-vivo小鼠脑切片与in-vitro人类iPSC网络的方法,为探索广泛、多尺度和多模态的动态过程引入了全新手段。然而这种创新方法也带来了巨大挑战,尤其在数据管理方面48,49,50,51——以 电极的采样频率获取的单个HD-MEA记录会产生高达155 MB/s的数据流。当涉及多个脑切片、不同药理条件或长时间记录时,数据量将急剧攀升。这种信息洪流要求建立强大的存储基础设施和先进的计算处理能力用于简化处理的工具。HD-MEA平台能够同时从数千个神经元集群采集数据,这既是优势也是障碍。它为大脑功能的计算动力学提供了卓越的洞察,但也需要完善的分析框架。在本JoVE实验指南中,我们提供了包括大规模事件检测、分类、图论、频率分析和机器学习在内的计算策略示例。这些方法彰显了为应对复杂神经数据分析挑战所付出的巨大努力。然而,开发更先进的计算工具来分析这些多维神经数据集仍存在相当大的空间。借助合适的工具和方法,HD-MEA平台的潜力将得到放大,从而为健康与病理状态下大脑功能的复杂性提供深刻见解。
本质上,当高密度微电极阵列平台与讨论的详细方案及计算工具结合时,它为理解大脑复杂运作提供了一种变革性研究方法。通过捕捉大规模、多尺度和多模态的动态活动,该平台为学习、记忆及信息处理等过程提供了宝贵见解。此外,其在人类iPSC体外神经网络中的应用有望彻底改变药物筛选和个性化医疗模式。尽管该平台代表了神经科学研究的重要进步,但必须认识并应对其固有的技术挑战。随着持续改进与先进计算工具的整合,高密度微电极阵列平台将引领神经疾病精准诊断工具、特异性生物标志物识别及靶向治疗的新纪元。
¶ 参考文献
- 赫布,D. O. 《行为的组织:一种神经心理学理论》. 威利出版社,纽约(1949年)。
- Cossart, R., Garel, S. 逐步构建:具有多功能特性的细胞在皮层环路组装中的作用。Nat Rev Neurosci. 23, 395-410(2022年)。
- Carrillo-Reid, L., Yuste, R. 用皮层「弹钢琴」:神经元集群与模式补全在感知和行为中的作用。Curr Opin Neurobiol. 64, 89-95(2020年)。
- 布扎基,G. 神经元群体的大规模记录。Nat Neurosci. 7, 446-451 (2004).
- 布扎基,G.《神经句法:细胞集群、突触集群与解读器》Neuron. 第68卷(第3期),362-385页(2010年)。
- 黄Y., 威廉姆斯J.C., 约翰逊S.M. 芯片上的脑切片:应用的机会与挑战 微流控技术应用于完整组织。Lab Chip. 12 (12), 2103-2117 (2012).
- Cho, S., Wood, A., Bowlby, M. 脑切片作为神经退行性疾病模型及筛选新型治疗药物的平台。Curr Neuropharmacol. 5 (1), 19-33 (2007).
- 布利斯,T. V. P.,科林德里奇,G. L. 记忆的突触模型:海马体中的长时程增强。Nature. 361, 31-39 (1993).
- Anderson, P., Morris, R., Amaral, D., Bliss, T., O’Keefe, L. The Hippocampus Book. 牛津大学出版社,纽约(2006)。
- 埃斯普尼-卡马乔, I. 等. 源自人类多能干细胞的金字塔神经元在体内有效整合入小鼠大脑回路. Neuron. 77 (3), 440-456 (2013).
- 利什曼等人。《观点:海马体如何促进记忆、导航与认知》。Nat Neurosci. 第 20 卷,第 1434-1447 页(2017 年)。
- 森、K.、长尾、H.、吉原、Y. 嗅球:气味分子信息的编码与处理。Science. 286卷(5440期), 711-715页 (1999年).
- Buck, L., Axel, R. 一个可能编码气味受体的新型多基因家族:气味识别的分子基础。《细胞》Cell. 65 (1), 175-187 (1991).
- Bushdid, C., Magnasco, M. O., Vosshall, L. B., Keller, A. 人类能区分超过1万亿种嗅觉刺激。《科学》Science. 343卷(6177期), 1370-1372页 (2014年).
- 肯珀曼 G. 为什么有新神经元?成人海马体神经发生的可能功能. J Neurosci. 23(3), 635-638 (2003).
- 艾莫内 J. B., 怀尔斯 J., 盖奇 F. H. 成人神经发生对记忆编码的计算影响. Neuron. 第61卷第2期,第187-202页(2009年).
- 尼西阿南萨拉贾,J.,汉南,A. J. 丰富环境、经验依赖性可塑性及
- 高桥和志等. 通过限定因子从成人成纤维细胞诱导多能干细胞. Cell. 第13卷 第5期, 861-872页 (2007年).
- 拉贾莫汉, D. 等. 人类多能干细胞中药物筛选和疾病建模的现状. Bioessays. 35(3), 281-298 (2013).
- 海尔克、特劳布、莱因哈特、舍勒、斯特内克特。用于药物发现的iPS细胞来源神经元细胞。Trends Pharmacol Sci.35(10), 510-519 (2014)。
- 赵守仁,蒙德哈尔-帕雷尼奥,李东,沈明,吴继成。微电极阵列与膜片钳技术在人类诱导多能干细胞分化心肌细胞中的技术应用。《J Vis Exp.》186卷,e64265(2022年)
- Hamill, O. P., McBride, D. W. 《诱导性膜低/高机械敏感性:膜片钳记录的技术局限》Annu Rev Physiol. 59卷, 621-631页 (1997年).
- Manz, K. M., Siemann, J. K., McMahon, D. G., Grueter, B. A. 膜片钳和多电极阵列电生理分析在急性小鼠脑切片中。STAR Protoc. 2 (2), 100442 (2021)。
- Lee, C. H., Park, Y. K., Lee, K. 神经动力学观测在更大规模与更广范围的最新策略. Biosens Bioelectron. 240, 115638 (2023).
- Urai, A. E., Doiron, B., Leifer, A. M., Churchland, A. K. 大规模神经记录呼唤新见解以连接大脑与行为。Nat Neurosci. 25 (1), 11-19 (2022).
- 胡旭、汗扎达·S、克吕奇·D、卡莱加里·F、阿明 H。在高密度CMOS芯片上实现生物混合嗅球以揭示大规模时空回路信息。Biosens Bioelectron. 198, 113834 (2022)。
- Amin, H., Marinaro, F., Tonelli, D. D. P., Berdondini, L. 发育过程中兴奋性向抑制性GABA极性转换在22q11.2缺失综合征中被破坏:临床治疗学的潜在靶点。Sci Rep. 7 (1), 15752 (2017).
- Amin, H., Nieus, T., Lonardoni, D., Maccione, A., Berdondini, L. 基于CMOS-MEA的高分辨率生物电成像技术研究Aβ诱导网络功能障碍在神经毒性及干预修复中的应用。Sci Rep.第7卷第1期,2460页(2017)。
- Emery, B. A., Hu, X., Khanzada, S., Kempermann, G., Amin, H. 高分辨率基于CMOS的生物传感器用于评估经验依赖性可塑性中的海马体回路动力学。Biosens Bioelectron. 237, 115471 (2023年)。
- Amin, H. 等人。利用4096电极阵列培养3个月的人类iPS衍生神经元网络的电响应及自发活动特性研究。Front Neurosci.10, 121 (2016).
- Lonardoni, D. 等. 循环连接和局部神经元群落引发神经元网络中协调的自发活动。PLoS Comput Biol. 第13卷第7期, e1005672 (2017年).
- Emery, B. A. 等. 在高密度神经芯片上的大规模多模态记录 :嗅球和海马体网络. 2022 44th Annual International Conference of the IEEE Engineering in Medicine & Biology Society (EMBC), Glasgow, Scotland, United Kingdom. 3111-3114 (2022).
- 罗西、L.、埃默里、B. A.、坎扎达、S.、胡、X.、阿明、H. 利用大规模生物传感器实现嗅球药理学及电诱导全网络激活。2023 IEEE BioSensors Conference(BioSensors), London, United Kingdom. 1-4 (2023).
- 埃默里,B. A. 等人。在大规模生物传感器上记录海马网络中的网络突触传递与长时程增强现象。2023 IEEE BioSensors Conference (BioSensors), London, United Kingdom. 1-4 (2023)。
- Hierlemann, A., Frey, U., Hafizovic, S., Heer, F. 在微电子芯片上培养细胞:在体外与基于CMOS的微电极阵列接口的电生成细胞。Proceedings of the IEEE. 99 (2), 252-284 (2011)。
- Berdondini, L. 等人。用于从单细胞到大规模神经元网络的高时空分辨率电生理记录的有源像素传感器阵列。Lab Chip.9, 2644-2651 (2009)。
- 西格尔, J. H., 黑尔, G. J., 纽曼, J. P., 沃伊茨, J. 神经集群社区:面向大规模电生理学研究的开源硬件方案. Curr Opin Neurobiol. 32, 53-59 (2015).
- 阿明、马乔内、佐丹、尼乌斯、贝尔东迪尼。高密度微电极阵列揭示神经元网络中短期与长期记录呈现对数正态发放模式。刊于2015 7th International IEEE/EMBS Conference on Neural Engineering (NER), Montpellier, France.1000-1003 (2015年).
- Altuntac, E. 等人. 自下而上的神经发生启发式计算模型. 发表于2023 IEEE BioSensors Conference (BioSensors), London, United Kingdom. 1-4 (2023年).
- Maccione, A. 等人. 一种用于精确识别细胞外记录神经元信号中尖峰的新算法. J Neurosci Methods. 177 (1), 241-249 (2009年).
- Welch, P. D. 基于快速傅里叶变换的功率谱估计方法:一种基于短时段修正周期图时间平均的技术. IEEE Transactions on Audio and Electroacoustics. 15 (2), 70-73(1967年).
- Eggermont, J. J., Munguia, R., Pienkowski, M., Shaw, G. 猫初级听觉皮层中基于局部场电位和基于尖峰的频谱-时间感受野及互相关性的比较. PLoS One. 6 (5), e20046 (2011年).
- Damos, P. 运用多元互相关、格兰杰因果性与图模型量化害虫种群间的时空同步性与因果性. BMC Ecol. 16, 33 (2016年).
- Kaminski, M. J., Blinowska, K. J. 一种描述脑结构信息流的新方法. Biol Cybern. 65, 203-210 (1991年).
- Pastore, V. P., Massobrio, P., Godjoski, A., Martinoia, S. 基于多电极记录的大规模神经元集群中兴奋-抑制连接与网络拓扑结构的识别. PLoS Comput Biol. 14 (8), e1006381 (2018年).
- 阿明、迪帕洛、德安杰利斯、贝尔东迪尼。生物功能化三维纳米柱阵列引导细胞定向,促进神经网络中突触稳定性与神经元活性。《ACS Appl Mater Interfaces.》第10卷第17期,15207-15215页(2018年)。
- 沃佩尔、杨强、崔晓婷。神经电极-组织接口的最新进展。《Curr Opin Biomed Eng.》第4卷,21-31页(2017年)。
- 斯坦梅茨、科赫、哈里斯、卡兰迪尼。Neuropixels探针在大规模电生理学中的挑战与机遇。《Curr Opin Neurobiol.》第50卷,92-100页(2018年)。
- 西格尔、黑尔、纽曼、沃伊茨。神经集群社区:大规模电生理学硬件的开源解决方案。《Curr Opin Neurobiol.》第32卷,53-59页(2015年)。
- 弗里曼, J. 面向大规模神经科学的开源工具. Curr Opin Neurobiol. 32, 156-163 (2015).
- Stevenson, I. H., Kording, K. P. 神经记录技术的进步如何影响数据分析. Nat Neurosci.14(2), 139-142 (2011).