¶ 神经元微环路内静态与动态二维电流源密度的高分辨率检测
扎普费, K.W.P.*1,罗梅罗-马尔多纳多, I.*1,2,古铁雷斯, R.1
原文下载:https://fb.biokingdom.top/f/03fbab977ba34cdc96c6/
- 国立理工学院高级研究中心药理生物学系。地址:Tenorios大道235号,Coapa农场区,邮编14330。
- 墨西哥国立自治大学神经科学部细胞生理学研究所,墨西哥城04510, 墨西哥。
通讯作者:
R. Gutierrez
墨西哥国立理工学院高级研究与教育中心药理生物学系
特诺里奥斯大道235号,科阿帕农场区 邮编14330
电话/传真:(5255)54832878
邮箱:rafagut@cinvestav.mx
*同等贡献
页眉标题: 微电路中电流源密度动态
关键词: 电流源密度、海马、信息传输、微电极阵列、持续活动
电流源密度(Current Source Density, CSD)是贯穿研究的核心分析技术,其本质是通过电生理记录数据量化神经组织内电流的空间分布,为解析神经活动的源 - 汇关系与信息传递路径提供关键依据。
¶ 摘要
高密度微电极阵列(>4000个微电极)的应用使得我们能够以高时空分辨率记录整个海马结构及其他组织的诱发场电位和持续场活动。通过这些记录可获取电流源密度(CSD),该技术能将电流发生器区分为汇和源;这种区分为辨别相关或分离的活动位点提供了方法,并能在接近细胞分辨率级别对其进行独立追踪。通过对被视为汇或源的区域进行矢量平均,我们可获得可随时间追踪的动作中心或质心推定值。因此,连续的中心点将揭示"继承"或受此活动影响的邻近相关单元,从而以高时空精度量化信息传递的推定路径。对于结构化组织,该方法能通过可多维度深入分析的明确参数,为推断有效信息传输提供手段。重要的是,随时间变化的CSD可揭示电压域活动表征所掩盖的活动模式。
新与值得注意:
我们开发了一种新方法,用于分析通过高密度微电极阵列从海马切片获取的电生理记录。电流发生器被分离为汇和源,并在海马亚结构的活跃区域中识别出不相交的组成部分。从每个组成部分获取质心,该质心可在接近细胞分辨率的时间尺度上进行追踪,从而揭示出一条可通过高时空精度量化的信息传递推定路径。
¶ 引言
对神经元网络电场活动进行严谨、明确的测量及其生理学解释,均构成了极具挑战性的难题。电生理记录通常通过单电极或多电极从特定结构的既定部位获取,或利用电极阵列覆盖该结构的更大区域进行多点位记录(1,2)。随后对信号间进行系列因果检验,以探寻潜在的有效连接(3)。
目前已有多种信号分离技术可用,其中大多源自盲源分离分析的应用(4),例如独立成分分析(ICA;5,6,7)。随着高密度多电极阵列技术的进步,需要开发新的信息处理方式,从而形成探究神经元环路的全面而强大的手段。我们在此描述一种追踪实时神经活动的技术,该技术能提供与盲源分离形成互补的独立信息,并可能反映功能性局部连接。我们的启发式分析主要适用于高度结构化神经组织(如啮齿类海马体)中的活动,这类组织中的细胞与轴突通路具有分层分布的特性。
场电位(FP)是由突触电流产生的信号。此外,当电极足够靠近细胞群中突触电流触发锋电位产生的部位时,可以记录到群体锋电位。这种活动被记录在数个紧密排列的相邻微电极上,因此结构化组织中不同相邻元件的顺序激活可以追踪一个假定的活动轨迹。然而,如何在电生理记录中定义和识别这些假定的轨迹仍是一个持续研究的课题(7)。此外,突触传递会同时激活近端和远端神经元,并在不同部位产生电场。先前的研究提出了某种形式的矢量平均方法来揭示活动绘制的轨迹,即质心分析(CMA)。为获得此类矢量平均值所选择的"权重"均基于启发式准则:Chao等人(9,10)选取时间区间内的锋电位密度并计算"动作平均密度";Manjarrez等人(11)与Cuéllar等人(12)则使用场电位记录的正半波作为权重。本文通过引入电流密度分析(CDA)作为权重改进了这些方法,从而能严格分离空间上独立的轨迹,有效利用数据提供的自然密度函数。这种表征不仅为矢量平均过程中的权重提供了数学上的严谨度量,还有助于将数据划分为不相交的集合与不连通的分量。通过追踪电流形成的极性,我们能够在同一感兴趣区域内跟踪独立进程,这些极性可反映网络与神经元活动的独特运作机制。
随着微电极阵列(MEA)密度不断提高,从采集数据中发现活动模式并进行表征变得愈发困难。实际上,对海量信号组合进行检测会引发"组合爆炸"问题(13),导致因果检验耗时剧增且容易产生假阳性结果。因此,高度压缩的时间维度可能掩盖新颖信息。
因此,需要以能够揭示隐藏模式的方式对记录数据进行分析和表示。
我们的方法的应用需要采用二维微电极阵列采集的电生理数据,但在三维阵列中的应用也是可行的。一个典型示例是,非凸结构可能在分离区域表现出同步活动,这可以体现我们方法的鲁棒性。我们已在大鼠海马切片(主要针对CA区)和非结构化的纹状体切片上对该方法进行了测试。记录应具有高时间和空间分辨率,以获得CSD及其随时间变化的良好估计。我们的方法允许我们在结构化神经组织内部绘制活动轨迹,而无需预先了解几何约束条件。这类活动轨迹的激活反映了多种活动类型,包括相邻神经元的连续放电、阈下活动等。
¶ 材料与方法
¶ 动物和切片制备
我们机构的动物研究伦理委员会批准了所有实验程序(Centro de Investigación y de Estudios Avanzados,批准号0210-16),这些程序遵循美国国立卫生研究院《实验室动物护理和使用指南》(第8版)执行。
实验在30-35天龄的雄性Wistar大鼠的海马切片中进行。动物在断头前被深度麻醉(异氟烷)。大脑从颅骨中迅速取出,置于切割溶液中(单位:mM):220蔗糖、2.8 KCl、2 MgSO₄、1.25 NaH₂PO₄、26 NaHCO₃、20葡萄糖、2 MgCl₂、1 CaCl₂;在4°C下;pH 7.35,毫参量 ~ 320,持续通入碳合气(氧气95%;二氧化碳5%)保持。使用振动切片机(Leica VT1200)制备内嗅皮层和腹侧海马的水平切片,厚度为350 μm,保持大脑浸没在切割溶液中。
获取切片后,将其转移至含独立培养孔的容器中,置于34°C孵育溶液内进行孵育。溶液成分为:125 NaCl、2.5 KCl、1.25 NaH₂PO₄、25 NaHCO₃、10葡萄糖、0.4 C₆H₅O₆、4 MgCl₂、1 CaCl₂。30分钟后将切片置于室温环境下保存,直至用于电生理记录。用于记录的标准生理盐水配制如下:125 NaCl、3 KCl、1.8 MgSO₄、1.25 NaH₂PO₄、20 NaHCO₃、15葡萄糖、1.6 CaCl₂。
¶ 电生理记录
海马体记录是使用BioCamX平台进行的,该平台采用CMOS技术构建微电极矩阵,并采用铂黑工艺制造(3Brain AG,瑞士)。我们使用了Arena HD-MEA(在2.67毫米×2.67毫米表面集成64×64微电极矩阵)和Stimulo HD-MEA芯片(在5.12毫米×5.12毫米表面集成64×64微电极矩阵)。微电极(在1kHz频率下约500kΩ)尺寸为21×21微米,Arena芯片的电极间距为42微米,Stimulo芯片的电极间距为80微米。采样频率为17855 Hz/电极,数据生成速率为0.14 GB/s或8.5 GB/分钟。在34°C条件下以10-12毫升/分钟的流速灌注标准生理盐水时获取细胞外场活动信号。原始数据通过BrainWave 4软件处理。每个电极的活动记录以12位分辨率进行,并通过将平台的数字高通滤波器设置为0.1 Hz进行高通滤波。结果以HDF5分层数据格式存储。数据采集后,我们对数据进行了预处理,检测到通道记录中位于组织表面之外或未与待分析组织接触的所有信号,这些信号将从待进一步分析的数据集中剔除。本研究中使用的所有算法均通过Jupyter Notebooks界面(14)使用Julia-Lang 1.7.2和1.11.2(15)进行自定义编写。
¶ 数据预处理与主动通道检测
使用高分辨率微电极阵列进行电生理记录存在若干问题,需在分析真实生理信号前审慎处理。这些问题包括:通道故障(表现为平坦信号、高噪声非生理信号、电极失效)、时间序列因自发饱和事件产生的中断、高空间密度导致的信号重叠、高频高功率噪声、接地不良引起的电气干扰、电极间增益差异(16)、以及CMOS技术易受干扰的光致噪声。由于上述情况会在电流源密度分析、质心计算及后续数据解读中引发误差,因此必须对数据集进行预处理。
我们制定了一套精心设计的预处理流程,从实验记录中提取出洁净可用的数据集,该数据集已通过GitHub链接公开(代码参见doi.org/10.5281/zenodo.17108410,视频及补充图1参见doi.org/10.5281/zenodo.17108470)。简而言之,我们首先将实验数据集分割成若干区段,使其适应我们的计算处理能力,并确保每个"数据箱"在通道串联时能保持各自通道的时间连续性顺序相同,且所有区段大小一致。以下步骤将以相同方式及参数应用于所有区段。长时间呈现饱和的通道被标记为"空值通道"并列入重建清单。在信号总长度中饱和区段占比较低(低于15%)的通道则标记为插值处理,以消除不连续性。首先对此类区段进行插值替换,使用三次B样条基于同一通道的有效数据点进行插值——该方法不仅能确保采样点数值的连续性,还能保证一阶与二阶导数的连续性(C(1)与C(2)连续),从而生成平滑的重构曲线,有效保留动作电位或突触事件的生理形态(17)。解决不连续性后,我们进一步识别尚未标记为"空值"的故障通道,这些通道可能记录到平坦直线或高变异信号,这通常源于组织与电极层之间形成的气泡(使用损耗也可能导致损坏)。此时我们计算两项指标:i)基数(集合中不重复元素的数量,记为集合A的|A|),每个通道的基数值代表该区段内不重复电压值的数量,通过收集基数数值构建权重向量以供后续分析;ii)特定时间窗内电压变化的标准差。我们初步采用50毫秒作为电压信号偏移的基准窗口,该值可能随所记录活性细胞放电频率的升高而反向调整。利用该指标(现称为信号偏移标准差)构建第二组权重向量。两组向量分别用于构建评估时段内各通道的"活动状态"图像。该图像将对信号通道采用阈值处理方法,以检测那些偏离记录区域整体原生分布的通道。该步骤将递归应用于具有相似行为范围的去分层通道子集。上述两种度量指标可根据记录组织的活动类型单独或组合使用——例如在自发性活动水平较高时(如海马组织),基数指标足以显示最佳拟合效果;而在组织活动水平较低时(如纹状体组织),我们发现第二向量更适合用于识别。接下来对前述向量应用阈值算法(我们采用并推荐大津法18),可获得通过阈值的第一批通道子集,这些通道对应被标记为"受损"的通道,随后被归入"空值"子集并进行信号重建。我们收集新的"空值"集,通过取自最近邻8个通道的平均值完全替换这些信号,并重新计算权重向量(基数与信号偏移偏差)。再次应用阈值算法后,我们获得第二批通道子集,即记录真实组织活动的通道(参见补充图1;doi.org/10.5281/zenodo.17108470)。最后基于完整数据集计算质心及其轨迹,以避免算子和滤波器行为变化的影响。
¶ 高密度微电极阵列的CSD
在均匀且各向同性的组织中,CSD由电位的拉普拉斯算子给出;最初,它是通过电位测量值的离散差分方案估算的。随后,引入了逆CSD(icSD)方法(21-24),通过该方法,可以根据CSD的具体形式推导出测得的场电位(FP)波形,但这需要对接触点的特定几何形状进行假设,从而需要针对每个电极分布进行新的计算。为了避免对记录质量或工作电极的具体几何形状做出假设,我们使用了以下两种方法之一:第一种方法是有限差分算子(25),当失效通道数量较少或位于感兴趣区域之外时,我们使用这种方法。这种方法是最优的,因为MEA具有高密度电极且间距短。第二种是核CSD方法(kCSD,26),这是一种逆问题方法,设计用于从任意分布的电极记录的FP中非参数估计CSD。kCSD方法不需要用户指定可允许CSD分布的受限参数化形式,这使我们能够在存在大量不可用通道或时间事件的情况下使用它,这些事件中HD-MEA的部分区域由于气泡或高强度刺激事件而饱和。然而,这种方法极其耗时且计算成本高。为了进行比较,我们使用两种方法进行了一些运行,结果相似(见下文)。由于本文的目标是检测和追踪质心,我们认为所呈现的结果是可靠且可重现的。
¶ 有限差分算子
为了从场电位(FP)中获取电流源密度(CSD),我们需要一个对拉普拉斯算子的良好近似;一种能降低矩形网格交叉效应的方法是使用以下矩阵(25)对数据进行卷积:
该算子对数值的突变极为敏感。由于数据中的噪声在空间域中可被视为快速变化的边缘,因此可在拉普拉斯算子处理前后对数据执行高斯空间平滑,以减少过度边界效应。我们的高斯模糊滤波器设定σ值为电极间距的2倍。直观而言,这意味着它会平滑处理所有小于典型锥体细胞胞体的结构。这与我们的平均场方法相一致——我们预期在神经元尺度上存在平滑可微的场,但在更精细尺度上则不然(详见文献27)。
先前的研究认为数值差分算子会牺牲阵列边界上的所有数据(28)。对于低密度电极阵列来说这是个问题,但在高密度微电极阵列中,即使存在外部噪声和干扰源,每次实验也仅有不到10%的电极被舍弃。由于失效电极极少,iCSDA(24)和kCSDA(26)等更复杂的方法优势并不明显,但仍可被采用。
¶ 核CSD方法
我们的 CSD 模型函数是一个阶跃函数 (24),由以下描述:
R参数是电荷密度的有效半径,在我们的计算中取值为电极间距的一半。每对 是此类模型函数的中心点,我们将其视作各功能电极在适当坐标系中的位置。该函数生成的FP表示为:
其中 为函数支撑的有效高度,在本研究中即海马体切片的半宽度。
我们现在逐帧地将FP投影到这些模型函数上,以获得能生成理想化FP近似值的系数。这些系数与生成相应CSD的系数相同。首个算子是将实验性FP(此后记为)中的K算子投影到理想化FP(我们称之为)空间上的操作。
求和是在我们想要使用的 电极集合上进行的。另一个算子是将 的空间映射到理想化的 CSD 函数的那个,现在称为 :
然后 可以在感兴趣区域上通过:
注意该方法内置了降噪机制,因此无需使用平滑滤波器。该方法的巨大优势在于,即使失效通道出现在感兴趣区域附近或内部,仍能获得较为准确的CSD近似值。相比之下,差分方法会波及故障通道的所有周边通道(包括临近通道),因此当感兴趣区域上方存在足够多的饱和电极时,该方法将无法使用。
需要说明的是,我们数据中的噪声幅度约为信号平均幅度的0.1倍,这意味着矩阵K的正则化是不可避免的(参见文献26及其参考文献)。我们采用了正则化参数 ,其中是K的主特征值。对于高密度MEA而言,获取K和R的计算成本高昂,但并行计算(尤其是在GPU上)可以解决这一问题。
然而,由于我们在整个研究中采用了有限差分算子方法,图中我们使用KCSD方法对两种技术的结果进行了比较验证。全篇采用的有限差分算子方法所获取的CSD结果(汇与源的质心及其位移)与记录组织的解剖结构高度吻合(仅使用电生理信号即可明显观察到),表明该获取技术具有稳健性与可靠性。为进一步验证该方法,我们采用了一个真实聚合模型来补充单细胞模型已测试的不同噪声水平下的方法稳健性(见补充图2:doi.org/10.5281/zenodo.17108470)。为此,我们使用了Traub等人(29)开发并后续经NEURON适配编码的啮齿类动物真实丘脑皮质网络模型数据集(公开于ICM RePod存储库:https://repod.icm.edu.pl/file.xhtml?fileId=116&version=1.0)。在图1结果对应的数据集中,记录时长为0-600毫秒,网络规模为10%(356个细胞)。第5层和第6层锥体细胞分别通过恒定电流注射(0.5 nA和0.375 nA)实现去极化,使其放电频率与完整模型保持一致,并在初始瞬态阶段后施加了额外脉冲刺激(2毫秒,10%模型强度,300毫秒延迟)。
为了扩展质心分析验证的有效性,我们采用了基于核电流源密度(CSD)方法基础教程(2 6)的模拟数据集,该数据集可通过github页面获取:
https://github.com/Neuroinflab/KCSD-python/tree/master?tab=readme-概述-文件
该模拟通过命令true_csd = CSD_PROFILE(csd_at, seed = 8)定义了一个由电流汇和源组成的双极分布。对此合成电流源密度图应用质心识别协议后,我们提取了对应每个相反极性区域的中心点。结果表明:计算得出的质心与模拟电流汇/源的圆形轮廓几何中心完全吻合,这一结果验证了该方法在检测生理相关位点时的准确性。
¶ 在受控环境下的电流流动
¶ CSD 作为向量的权重密度:质心分析
质心分析(CMA)先前已被用于追踪神经组织或大脑活动中假想的"轨迹"(9-12)。这类研究中所选的"质量"是一种启发式度量,足以表征活动位移的粗糙度图像。然而,要获得矢量平均值,每个向量的适当权重应是衡量单位空间内代表值集中度的正数,因此在我们的电生理记录中使用这种自然密度是合理的。电流源密度(CSD)符合数学和解释性要求,下文将其记作。该度量通常以任意单位表示,可解释为矢量电流的微分散度。
根据电荷守恒定律,这与电荷密度的时间变化率相同:
CSD作为一种数学密度(一种准概率密度函数),使得严格应用矢量平均概念成为可能。这种用途此前一直被忽视,很可能是因为较低空间分辨率的采样无法实现足够精确的估计来进行可靠的空间推断——即使采用了复杂的CSD估计方法。在本研究中,我们将该密度估计为向目标空间中的点分配权重的函数,从而允许对其执行线性运算。在此情况下,对单位任意CSD的功能性解读可视为活动性的指示器,并间接作为"局部活动性的密度"。
需要注意的是,CSD作为数学密度函数无法满足非负性要求。但这并不构成问题,因为CSD将测量到的活动分离为三个独立集合:所有源点的集合、所有汇点的集合以及零值集合。这种分离并非定量而是定性——即使电荷符号可任意设定,其本质区别依然存在。因此,CSD在两个活动集合(汇点与源点)上分别表示单位空间(面积)内变化电荷的集中程度,符号可忽略不计。各集合内的运算均独立进行。在CSD表征中,所谓的零值集合(空间中所有记录到零CSD的点)具有明确意义:它构成汇点与源点之间的真实边界。这一点将在后续章节进一步阐述。完成汇点与源点的分离后,我们将得到两个密度函数,更准确地说,是在两个独立集合上定义的不同密度函数。若试图借此求取矢量平均值仍会显得粗略且不精确。当这些集合在大范围扩散时,在非凸区域中,向量平均值可能位于集合之外,几乎没有生理学意义。因此,我们决定引入几何集合中的另一个概念,将分析简化为局部效应。
¶ CSD 和断开组件
图2显示了一幅色度图,其中源和汇以斑块形式呈现,典型交叉长度约为150微米。CSD计算生成三个数值子集:全体源的集合、全体汇的集合以及二者之间的边界,这些对应着结构化组织中放电神经元的预期极点(30)。对应于单个集合的斑块间噪声使得极点识别不够精确;因此我们创建了一个"厚中性集",包含所有CSD值位于零值误差区间内的记录点。由此我们将正负集合分离为各自的不连通分量,该概念用于指代互不接触的给定几何子集(31)。
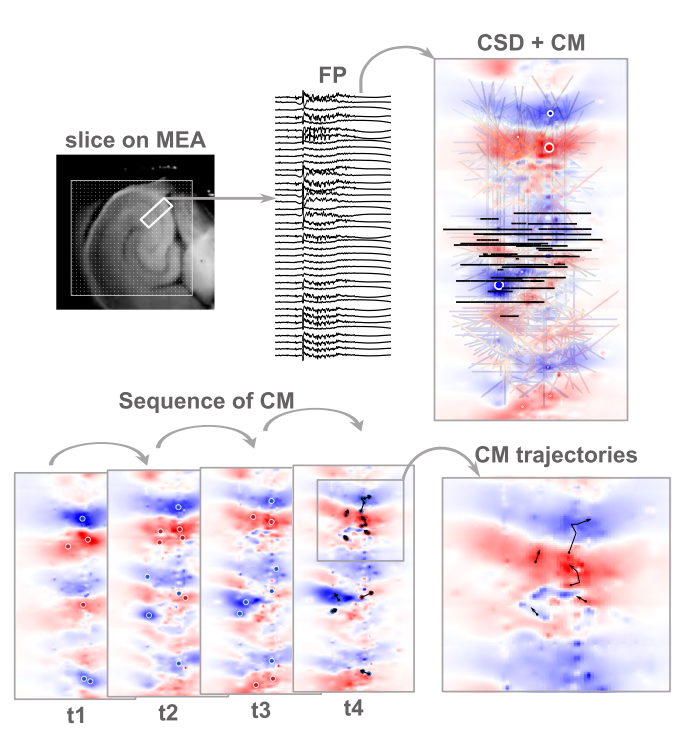
图2描绘了由不同色块表示的几何集合。集合c1、-、c2各自由单个连通分量组成;这意味着人们可以在集合内任意两点间勾勒路径。与之相反,红色集合由两个不连通的分量构成,标记为b。若不离散集合,则无法绘制连接两个分量内点的路径。然而,这些分量确实通过功能连接(时间维度与同源性,即源点或汇点)相互关联,因此仍可追溯连接它们的路径。集合c1、-、c2描绘了两个独立分量,每个分量均可视为独立集合。各集合质心由圆点标示。根据先前定义,质心是集合中所有权重密度平均后所有点的位置。集合a是凸形的集合b则不是凸形,因此其质心可能位于集合外部。集合c的质心同样落在集合外部,因为它包含两个近似相等的离散组件。再次强调,非凸形状确实可能具有位于外部的质心,但由于电极分辨率有限,出现高度非紧致形态的可能性较低,这类形状的质心通常位于边界内部或邻近区域。图2B中的实验数据印证了这一观点。对CA3区诱发响应进行的CSD分析显示,源与汇能够被清晰识别并实现分离(图2C)。所有灰色信号均被忽略,仅显示强度超过特定阈值的信号。若将这些组分分别视为活跃单元,我们可为其分配"活动中心"以追踪其位移轨迹。通过计算每个瞬时离散汇/源的质心,即可获得对"活动轨迹"的实用测量值。在追踪活动位移前,我们可逐帧计算各组分的质心。
向量平均或质心按以下方式获得:在每个分量上,索引为 ,在给定时间 处,我们有多个点(代表电极中心),这些点具有相同符号的 CSD,索引为 。然后,第 个分量的质心将具有通常的定义:
其中 是时间 点 处的 CSD,而我们的"密度质量函数"符号会自行抵消。这些不连通的分量,虽然不严格凸的,并未在测量空间中广泛分布。对此过程应用于图2-C1中彩色集合的结果,在C 2中显示为红色点。
¶ 质心与轨迹
CSD分布取决于神经元的有限尺寸和排列方式,其活动效应具有明确的作用范围。每个被识别为源/汇集合中不连通组件的斑块,都指示着一个联合活动集。每个独立组件的质心则可标示该活动组的平均位置,即一个可赋予位置、强度和时间信息的假定活动中心。此类信息的瞬时快照能够展现有序神经元结构的活动中及其相对强度。但正是通过连续呈现系列快照,这种分析方法才得以展现其解释力——活动中心的出现、位移与消失,可能揭示神经活动动力学中极其精妙的细节特征。
重要的是,必须检测假阳性——即组织中随机产生的质心,并在计算机迹时将其剔除(这些轨迹可能是虚假的或在生理上不存在的)。因此,我们开发了一种对比纹状体和海马组织数据的方法,能够准确识别质心,并为更复杂的定量分析(例如通过机器学习)奠定基础。实际上,这种对比可以排除随机产生的质心。为此,我们测量并比较了在15秒自发性控制条件下记录的两种组织中获得的质心(及其相应轨迹,未显示),随后进行了双重计算记录区域内的欧几里得距离,以及每对检测到的中心点的强度差。假设空间距离和强度差均服从均匀分布,我们获得并分析了残差分布,该分布体现了列联表中观测频率与期望频率之间的差异。残差值超过平均值三个标准差的事件被识别为异常值。这种方法能够将位于海马组织内部的质量中心与落在切片外部的质量中心进行区分(图3)。
为计算质心运动轨迹,每个位于t的质心在时间 会由"后继质心"追踪,其中 为采样时间步长。设 为第一个点的坐标, 为第二个点的对应坐标。需要特别注意的是,这些坐标现在可能是相对于电极网格的有理数(提供亚通道空间分辨率),而质心位置并不受限于网格点。其间距d的计算公式为:
质心的积分强度就是分母部分,即通过对特定组分中的CSD进行积分所获得的总"质量":
我们随后设定一个容差δ。如果在某个时间点t,一个质心与另一个质心在t + Δt处的距离低于δ,我们便将后者视为前者在时间上的后继点。通过持续应用此流程,我们得以开始追踪这些质心的运动轨迹——观察它们如何显现、移动及消散。当特定轨迹无法找到高于强度阈值的后继点时,我们判定该轨迹已终止,因此不会将时间间隔超过Δt的离散点进行关联。
¶ 逐步过程
简而言之,需要按顺序遵循以下步骤:
-
数据采集: 使用高密度微电极阵列采集细胞外电生理数据。记录位点间的距离必须达到所涉神经元的典型尺寸量级或更小,且这些位点需分布在足够密集的网格上以便进行数值差分运算。采样频率需满足检测阈下活动的要求(至少3 kHz)。关键点在于:数据应来自具有明确结构的组织,高度同质化的组织(如纹状体)将无法产生可解决的结果。
-
数据预处理: 数据预处理涉及清除因MEA噪声导致的误差、处理使通道不连续的自发饱和现象,用平均值或插值替代高饱和通道等操作,具体如数据预处理章节所述。应用此步骤后,后续几乎可在所有记录中使用有限差分算子进行CSD分析。CSD分析会生成正值、负值与中性值,这些数值后续将作为区分各子集的依据。由于汇总和源点的界限可能无法明确定义,因此需要根据通道分离的情况采用相应σ值的高斯模糊滤镜(在我们的记录中为42或80微米)。这构成了一种空间去噪机制,有助于在后续步骤中界定不相关的分量,因为噪声可能产生虚假的汇或源。完整描述见补充材料:doi.org/10.5281/zenodo.17108470。
-
计算CSD: 根据数据计算CSD。可采用任何方法,但当通道数量较多时,不推荐使用计算成本较高的技术。我们建议尽可能采用更简单的基于差分的方法。若感兴趣区域附近大量电极失效且在预处理阶段无法修复,采用并行CPU或GPU计算时,kCSD是合适的替代方案。
-
分离CSD数据: 将CSD数据分为三组:源、汇和中性。必须再次界定合理的标准。为设定一个能适应不同噪声水平的阈值,我们采用各通道中位数绝对偏差乘以通用阈值作为阈值λ。
其中 表示单个电极信号中的元素数量 。若更适用时,可采用更启发式的方法:将记录中噪声峰值的平均值作为"中性"值范围的幅度。
-
断开连接组件分析: 在源和汇集合中逐帧执行断开连接组件分析。此处使用单遍算法即可(32, 33)。
-
获取质心: 获取每个组件的质心。丢弃所有低于某个显著阈值的质心。一个经验法则是平均值的十分之一所有质心的值,或处于较低十分位数的那些值。同样建议对每个独立分段采用Donoho规则。
-
最可能后继检测: 对于每一帧及其后续帧,以及每一个质心,执行"最可能后继"检测。在此我们需要根据可用数据设定数值标准,即一个质心在时间t与空间+1上允许相距多远、强度差异多大,才能被视为另一个在时间的质心在时间上的后继。
-
假阳性避免: 为了避免假阳性并优化序列点的搜索和连接,我们首先选择出现在组织二维位置内部或紧邻区域的质心。这意味着,选择在应用分割算法后包含生理活动的通道。(参见数据预处理部分和补充图1,doi.org/10.5281/zenodo.17108470)。其次,应用质心净化算法(在方法部分描述)以避免随机分布的事件(参见图3)。
-
连接轨迹: “连接各点”,即对每个质心依次应用上述步骤,直到它不再拥有后继质心或其强度低于误差标准。然后将连续的质心绘制为一条轨迹。
-
绘制与筛选: 绘制所有轨迹,并且视筛选可能具有生理学意义的路径。作为进一步建议,可实施机器学习算法以无监督、无偏差的方式自动筛选相关轨迹。
¶ 结果
¶ 该方法在海马CA3区诱发反应中的应用
由于海马体是高度分层的结构,它显示出可辨别的源与汇模式。然而,由于胞体层的不规则性,直接从数据中通过电流源密度分析法追踪位移路径被证明是徒劳的。因此,引入具有断开组件的CSD分析为追踪活跃区域(尤其是在高活跃事件期间)的位移提供了正确的概念框架。所提出的分析方法不会对不同时间时活跃区域进行矢量平均,相反,它会将这些区域分离并独立追踪。
根据记录数据获得的彩色图谱,同时呈现了电压(场电位)和电流源密度信息,这些图谱被叠加在记录矩阵上方拍摄的海马体解剖照片上;该方法能够结合显示中的解剖结构和矩阵中定义的坐标,精确定位神经活动的起源。图4展示了从切片选定位置采集的CA3区场电位记录曲线及其对应的电流源密度分析。通过嵌入在记录用微电极阵列门区部位的刺激电极施加刺激,成功诱发了CA3区的响应电流。电流源密度图显示了沿CA3区交替出现的源与汇。
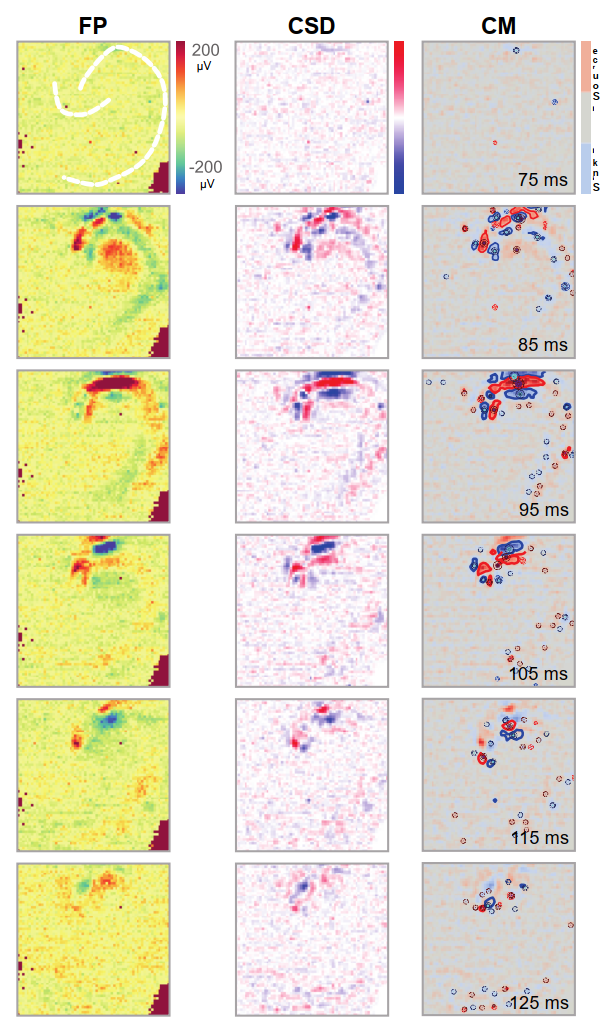
图5显示了在DG区域刺激后13.5毫秒内CA3区域的活动情况。响应强度以及极性(无论是在场电位FP还是电流源密度CSD中)都反映了锥体层胞体树突朝向的分布特性。特别是CSD表征能清晰界定活动密度的空间分布;观察到的汇与源的形成,显然对应着DG和CA3区域细胞亚层的分层结构。可以清晰识别出若干汇与源,随着时间的推移,因此可以进行进一步的分析。我们分析中解决的一个重要问题如图6所示,其中展示了一项通过外部电极对齿状回进行电刺激的实验。在这类实验中,当刺激电流及伴随响应使电极饱和时,电流源密度的获取能够克服这一问题,并揭示CA3特定区域/层次中的电流流动。
一旦获得CSD,便会为每个识别出的不连通分量计算质心。因此,它可作为空间限定区域内最大电流密度的动态追踪器——这些区域被我们的程序定义为电流源偶极子的独立分量。如图6(CM列)所示,局部化的小质心与饱和区域上的大斑块清晰分离。实际上,从响应起始阶段(刺激后立即出现)即可获取CA3区的活动性分析:通过我们的分析方法能清晰区分源密度分量,从而界定不连通集合的边界。在图6中,可观察到锥体层随时间推进呈现交替的汇-源行为,其上下相邻层则伴随源-汇翻转现象。基于这些数据,我们可分别汇与源的连续质心进行串联。局部化活动与协同作用生成的轨迹符合预期的源汇动态分布方向(图7及补充材料;doi.org/10.5281/zenodo.17108470)。由此,诱发活动产生的数值可通过CSD及相应质心进行系统化定量分析,以检测诸如方向性、强度消长等一致特征。活动减弱;实际上,在连续实验中偏离轨迹且超出数值误差的现象,可能指示底层网络响应发生变化。诱发电位可初步揭示电流如何依次流动,然而,正是质量分析中心所呈现的微电路或斑块的活动,能够揭示这些电流如何在海马体中生理形成,以及在组织内传递活动时它们如何相互关联。
¶ 方法在持续活动中的应用
为了分析持续活动中CSD(质心)的动力学特性,我们采用了一种先前描述的皮质损伤模型,该模型可在体外海马体中诱发高频活动(34, 35)。这种实验制备方法的优势在于,电生理事件能够从背景活动中分离出来,这有助于我们识别其起始、传播和终止过程。图8展示了CA3区产生的一阵高频高幅活动。在全海马同步记录场电位使我们能清晰识别其起始位点、传播路径以及由突触信号从高压区间外传递产生的伴随活动区域。然而,如图9所示,电流起始位点及其动态特性通过CSD分析能获得更准确的识别。此外,汇与源的分离组分会被自动识别,各组分的质心经过计算后能以高时空分辨率进行轨迹追踪。随后可通过计算活动在时间和空间域的相关性来推断其传播方向(35)。图10按出现顺序描绘了汇与源的轨迹。计数器经过调整,使零点与活动起始时刻重合。仔细检视图谱可发现,轨迹走向与神经元胞体排布呈平行或正交关系,这一特征在汇点(蓝色)轨迹中尤为显著。路径的渐进式累积不仅暗示着活动的接力传递(以空间连续方式进行),更揭示了被募集皮层区域内信息经历的长时期"局部处理"——其中回荡、延迟侵入、瞬时显现等现象,记录了事件中神经环路长时期相互作用的痕迹。需强调的是,此类活动必须与神经元放电相关联,才能将神经元集群的激活与实际信息传递建立联系,这种关联虽部分体现在场电位记录中,但常被高振幅活动所掩盖。因此,电流源密度分析能揭示潜在的相互作用。该分析方法尤其有助于可视化并理解癫痫样活动或生理性振荡中持续运行的汇源动态,这些动态在数量与质量层面可能承载着最复杂的信息。尽管轨迹分析至关重要,但值得注意的是,我们观察到的大部分电流流动均出现并消失于局限的皮层区域。这一点尤为重要,因为要"追踪"轨迹,首先需要观测到它,而这取决于特定分析所设定的阈值。因此,可能存在某些"隐藏"轨迹未能体现特定数据展示中。另一方面,特定"区域"的激活可能不会产生明确的传递——但具体如此吗?这类分析恰为此开启了探究之门。我们可以根据实验中对脑片提出的具体问题,调整分析参数。通过积累轨迹序列(如图10所示),能够获取特定时间窗内的活动历史,从而全面展现了特定事件轨迹的动态变化(图11)。图12展示了带有轨迹的6秒活动窗口。这些轨迹可在胞体-树突方向追溯,也可在皮层内水平延伸,或穿越锥体细胞层。根据图12所示实验的代表性分析,我们测量了约4600条轨迹(其中半数为汇的质心轨迹,半数为源的质心轨迹),确定其持续时间范围在0.4至3.4毫秒之间,这表明该局部活动具有有限的扩散范围。
值得注意的是,这种分析在应用于均质组织(如纹状体)时会面临特殊挑战。该技术虽适用于有序分层的神经元组织,但在均质无分层组织中仍可识别出若干不连续集合,如图13所示——该图展示了我们在4AP(200μM)条件下从纹状体组织获取的彩色编码场电位活动。通过分析纹状体与海马组织数据,我们发现在相同时间内海马切片中检测到的汇与源质心数量比纹状体切片高出一个数量级。更重要的是,我们成功剔除了海马区域外的假阳性质心,通过识别高概率记录生理信号的"活跃通道"这一预处理方案,有效重建了先前发现的空间分布模式。相比之下,纹状体切片几乎不显示质心,且对阳性识别质心进行随机性检验时,发现几乎没有质心能通过测试。因此纹状体切片中的质心与轨迹检测无法实现(参见补充图1,doi.org/10.5281/zenodo.17108470;及图3与图13)。
补充材料中提供的链接展示了海马切片在各实验条件下CSD活动的高时空分辨率动画,即齿状回刺激在CA3区诱发的反应、皮质创伤模型诱导的高频活动以及4AP诱导的癫痫样活动(doi.org/10.5281/zenodo.17108470)。相关程序已发布于doi.org/10.5281/zenodo.17108410。
¶ 讨论
本文介绍一种数值工具,可通过高密度微电极矩阵辅助探索结构化神经组织的功能连接。此前研究(9、10、12)尚未将允许使用单位面积权重概念(即密度函数)的数学框架应用于此类分析。此外,电荷密度作为数学意义上的密度函数,可划分为正值与负值,从而界定分隔二者的"零点"并赋予其意义。通过非连通分量分析,我们能依据不同符号追踪各组分的活动。研究还表明,对电流源密度施加矢量平均可实现活性位点分离,进而独立追踪各点位对周边区域的影响作用。在神经环路探索中,突触传递与场作用的甄别至关重要。唯有结合高时空分辨率记录与本研究提供的相关数据处理步骤,才能揭示信息在新皮层等高效率环路中的生成与传递机制。
确实,对结构化组织的分析是理解不同细胞构架中传输机制的第一步。在我们的工作中,我们追踪了持续活动期间电流密度的演变过程。为此,我们采用经去抑制处理的脑片(无论是否诱发癫痫样活动)来研究这种活动在多大程度上涉及主动传输与场效应。CSD分析揭示了高压活动期间具有明确传播模式的汇源分布,从而显露出被高压场电位记录所掩盖的底层阈下活动。需说明的是,本文使用的"阈下"术语仅指振幅未达到事件阈值、且具有特定时空模式的活动。
如前所述,为正确开展本分析,组织的分层结构至关重要。我们已在海马体组织中对其进行了评估,并与纹状体切片进行对比——后者未观察到模式化信号;该分析方法在其他皮层结构中的验证应具有重要作用。值得注意的是,若神经活动几乎无法检测,或仅呈现微弱局部相关性(与长程空间相关性相反),则此分析可能适用性有限。汇源轨迹需源自相邻单元的连续激活才能形成有效表征。这种序列激活的合理解释是:它们隶属于同一处理回路,因而轨迹可揭示该回路的存在及其可能包含的简化通路。必须强调这些轨迹本身并非神经连接,而是从细胞外部观测到的高度相关活动的指示指标。这种相关性同时具备时间、空间与因果特征,故能有效提示潜在生理连接。由于轨迹可沿胞体-树突方向及水平方向在同一层内或跨金字塔层追踪时,分析底层锋电位活动至关重要,这样才能将场电流与邻近神经元的激活关联起来。这一基础分析构成了理解信息在时空域中流动行为的基石,有助于揭示锋电位活动与场活动之间的关联行为及相互作用。通过采用真实的神经元集群模型(29),我们支撑了关于神经群体活动与局部场电位的一系列研究(36-39),并由此获得两种不同CSDA实施路径来验证方法的鲁棒性。 我们可进一步挖掘该分析的新潜力。高密度电极阵列能精准绘制场活动/CSD的传播轨迹,这些轨迹可能与单元活动存在关联。目前我们正运用该技术识别构成同一功能回路的活动细胞。通过使用特定受体阻滞剂或兴奋剂,并在不同条件下对比轨迹变化,可揭示不同类型的神经连接。三维微电极阵列也正成为现实,在结构化组织中此类分析将更具揭示力。值得注意的是,电极阻抗变化、动作电位幅度改变、介质电导率变化等因素会对单个神经元的检测识别及动作电位研究产生显著影响,但对单极测试源kCSD或iCSD则无显著影响(39;参见图1)。这使得CSD方法与CM检测更适用于非受控条件下的系统研究。若要串联不同轨迹,需对其起源和解读进行更严谨的分析,这已超出本研究范围。需特别指出,"假阳性"问题的彻底解决仍待探索。为此我们通过选取时间点在能够通过检查原始记录及其背景信息以及衍生的CSD来确定生理事件发生的空间范围内,我们首先需要识别真实的生理边界,以最大限度地提高获取真阳性(生理性)事件的概率。由于在这些条件下提取和分析轨迹并非标准化操作,我们通过确立真实生理边界来优化真阳性事件的捕获。在此基础上,我们能够描述活动模式的潜在差异或新兴特征。通过对"无组织"轨迹与真实组织轨迹,我们试图描述组织轨迹中可观察的行为参数,进而回溯性地修正真实轨迹。由于CSD方法及源汇判定对变化的高度敏感性,组织内部很可能会存在假阳性轨迹;但通过数据预处理与活性通道检测章节所述的严格预处理方案,我们力求避免此类情况。这一流程可作为循环修剪工具,为后续分析提供支持。目前正在实施的机器学习技术将作为解决假阳性问题的重要改进方案。
的确,我们认为这种方法有助于形成关于电流、汇与源生理学解释的新观点,同时能帮助识别在特定结构内电活动模式中活跃的"微电路"或神经元集群。尽管我们的技术可应用于多种多电极系统,但电极阵列的极间距离控制在典型锥体胞体尺寸量级(约30微米),或接近电压变化主要贡献者的尺寸范围,即任何目标可兴奋细胞类型的特征尺度。此外,它或许能为理解"未被观测到"的电话动开辟新途径——这些活动仅通过记录脉冲神经元或场电位是无法捕捉的。事实上,必须采用能够揭示隐藏模式的方式对记录数据进行分析和呈现。例如,多个神经元信号与基础噪声的共同作用可能掩盖单个尖峰或场电位之间的精细时间关联,使得这些关联难以被识别和解释。
¶ 补充数据
- 代码: doi.org/10.5281/zenodo.17108410
- 补充图、视频和信息: doi.org/10.5281/zenodo.17108470
¶ 致谢
¶ 资助
这项研究由墨西哥国家科学技术委员会资助,资助编号:CB-254339和I0000/229/2018。KWPZ获得了墨西哥国家人文科学与技术委员会的博士后资助。伊莎贝尔·罗梅罗·马尔多纳多进行了这项研究,以满足墨西哥国立自治大学生物医学科学博士项目的要求,并获得了墨西哥国家人文科学与技术委员会的博士奖学金。
¶ 披露
作者声明不存在财务或其他方面的利益冲突。
¶ 作者贡献
KZ、IR-M和RG构思并设计研究;IR-M进行实验;KZ和IR-M分析数据;KZ、IR-M和RG解读实验结果;KZ、IR-M和RG起草文稿;RG和IR-M编辑修改文稿;RG获取经费并指导研究。
所有作者均审定了手稿的最终版本。
¶ 参考文献
- Buzsáki G.《神经元群体的大规模记录》Nat Neurosci 7: 446–451, 2004. DOI:10.1038/nn1233
- 奇克斯瓦里 J, 亨泽 DA, 贾米森 B, 哈里斯 KD, 西罗塔 A, 巴托 P, 怀斯 KD, 布扎基 G. 使用硅基电极进行大规模并行单位电位及局部场电位记录。《神经生理学杂志》90卷:1314-1323页,2003年。DOI:10.1152/jn.00116.2003
- Lopes-dos-Santos, V, Ribeiro S, Tort ABL。大规模神经元群体中细胞集群的检测方法。《神经科学方法杂志》220: 149–166, 2013. DOI:10.1016/j.jneumeth.2013.04.010
- 赛义德 MN, 乔治耶夫 PG, 帕达洛斯 PM。计算神经科学中的盲信号分离方法。见 V. 萨卡利斯(编)《现代脑电图评估技术》。施普林格纽约出版社。2013年。DOI:10.1007/7657_2013_64
- Hyvärinen A, Oja E. 独立成分分析:算法与应用. 神经网络 13: 411–430, 2000. DOI:10.1016/S0893-6080(00)00026-5
- Makarov VA, Makarova J, Herreras O. 通过独立成分分析解析局部场电位源. J Comput Neurosci 29, 445–457, 2010. DOI:10.1007/s10827-009-0206-y
- Herrera O. 局部场电位:误解与澄清.《神经环路前沿》10卷101页,2016年。DOI:10.3389/fncir.2016.00101
- Anastassiou CA, Perin R, Markram H, Koch C. 皮质神经元的电突触耦合。《自然神经科学》14: 217–223, 2011. DOI:10.1038/nn.2727
- 赵ZC、Bakkum DJ、Potter SM。模拟与活体皮层网络中区域特异性网络可塑性:活动轨迹中心(CAT)与其他统计量的比较。《神经工程学杂志》4: 294–308, 2007年。DOI:10.1088/1741-2560/4/3/015
- Chao ZC, Bakkum DJ, Wagenaar DA, Potter SM. 强直刺激后随机外部背景刺激对网络突触稳定性的影响:一项模型研究。Neuroinformatics 3: 263–280, 2005. DOI:10.1385/NI:3:3:263
- Manjarrez E, Vázquez M, Flores A. 计算人脑传播α波质心的方法. 脑研究 1145: 239–247, 2007. DOI:10.1016/j.brainres.2007.01.114
- Cuéllar CA, Tapia JA, Juárez V, Quevedo J, Linares P, Martínez L, Manjarrez E. 虚拟运动任务期间正弦电波沿脊髓的传播. 神经科学杂志 29: 798–810, 2009. DOI:10.1523/JNEUROSCI.3408-08.2009
- 郭 F.Y., 斯隆 I.H. 解除维度诅咒. 美国数学会通讯 52: 1320–1328, 2005.
- 克鲁伊弗 T, 拉根-凯利 B, 佩雷斯 F, 布索尼尔 M, 弗雷德里克 J, 汉里克 J, 格劳特 J, 科莱 S, 伊万诺夫 P, 阿卜杜拉 S, 威林 C. Jupyter Notebooks——可复现计算工作流的出版格式. 《学术出版中的定位与权力:参与者、代理人与议程》第87-90页, 2016年. DOI:10.3233/978-1-61499-649-1-87
- 贝赞森 J, 埃德尔曼 A, 卡平斯基 S, 沙 VB。《Julia:数值计算的新方法》。SIAM评论 59, 65–98, 2017. DOI:10.1137/141000671
- Obien MEJ, Hierlemann A, Frey U. 利用高密度微电极阵列精确定位脑切片信号源。《科学报告》9: 788, 2019. doi: 10.1038/s41598-018-36895-y. 勘误于:《科学报告》10:4847, 2020. DOI: 10.1038/s41598-020-61780-y.
- 恩吉莱拉 E, 李泰佑, 温伯格-G, 蒂菲-P, 巴古尔-R, 伊斯拉姆-A, 谢杰, 苏A。三次样条插值结合滤波反投影在动态心肌灌注成像中用于稀疏视角CT图像重建。《断层摄影术》5: 300-307, 2019. doi: 10.18383/j.tom.2019.00013。
- 大津展之. 一种基于灰度直方图的阈值选择方法. IEEE 系统、人与控制论汇刊 9: 62–66, 1979. DOI:10.1109/TSMC.1979.4310076
- Freeman JA, Nicholson C. 无尾目小脑电流源密度技术的实验优化. 神经生理学杂志 38: 369–382, 1975. doi.org/10.1152/jn.1975.38.2.369
- Mitzdorf U. 电流源密度法及其在猫大脑皮层中的应用:诱发电位与脑电图现象研究.《生理学评论》65: 37–100, 1985. doi.org/10.1152/physrev.1985.65.1.37
- Pettersen KH, Devor A, Ulbert I, Dale AM, Einevoll GT. 基于静电正解反演的电流源密度估计方法:神经元活动有限性及电导率不连续性的影响. 神经科学方法杂志 154: 116–133, 2006. doi.org/10.1016/j.jneumeth.2005.12.005
- eski S, Wójcik DK, Tereszczuk J, Swiejkowski DA, Kublik E, Wróbel A. 三维逆向电流源密度方法:重建保真度、边界效应及远场源影响. 神经信息学 5: 207–222, 2007. doi.org/10.1007/s12021-007-9000-z
- Wójcik DK, Leski S. 基于不完整数据的电流源密度重建. Neural Computation 22: 48–60, 2010. doi.org/10.1162/neco.2009.07-08-831
- ski S, Pettersen KH, Tunstall B, Einevoll GT, Gigg J, Wójcik DK. 二维逆电流源密度方法:从多电极记录推断神经激活. 神经信息学, 9: 401–425, 2011. doi.org/10.1007/s12021-011-9111-4
- Lindeberg, T. 离散信号的尺度空间。 《IEEE模式分析与机器智能汇刊》12: 234–254, 1990. DOI:10.1109/34.49051
- 波托洛夫斯基 J,雅库琼 W,文斯基 S,沃伊西克 D。核电流源密度法。 《神经计算》24: 541–575, 2012年。 DOI:10.1162/NECO_a_00236
- 贝达德 C,德斯特谢 A. 脑组织中电流源密度分析的广义理论. 《物理评论E》84: 041909, 2011. DOI:10.1103/PhysRevE.84.041909
- Vaknin G, DiScenna PG, Teyler TJ. 一种无需借助采样体积外记录位点即可计算电流源密度(CSD)的分析方法. 《神经科学方法杂志》24: 131–135, 1988. doi.org/10.1016/0165-0270(88)90056-8
- Traub RD, Contreras D, Cunningham MO, Murray H, LeBeau FEN, Roopun A, Bibbig A, Wilent WB, Higley MJ, Whittington MA. 单列丘脑皮质网络模型呈现伽马振荡、睡眠纺锤波与癫痫样爆发. 神经生理学杂志 93: 2194–2232, 2005. DOI:10.1152/jn.00983.2004.
- 布扎基 G, 阿纳斯塔西乌 CA, 科赫 C. 细胞外场与电流的起源——EEG、ECoG、LFP与锋电位。《自然综述:神经科学》13:407-420, 2012. DOI:10.1038/nrn3241
- Halmos P. R. 朴素集合论. Springer 纽约. 1960. DOI:10.1007/978-1-4757-1645-0
- Vincent L, Soille P. 数字空间中的分水岭:一种基于浸没模拟的高效算法。IEEE模式分析与机器智能汇刊 13卷:583-598页,1991年。DOI:10.1109/34.87344
- AbuBaker A, Qahwaji R, Ipson S, Saleh M. 单次扫描连通区域标记技术. 2007年IEEE信号处理与通信国际会议, 1283–1286, 2007. DOI:10.1109/ICSPC.2007.4728561
- Ortiz F, Gutierrez R. 内嗖皮层损伤导致海马区出现腺苷敏感型高频振荡。《实验神经学》271:319–328, 2015. DOI:10.1016/j.expneurol.2015.06.009
- Ortiz F, Zapfe WPK, Draguhn A, Gutierrez R。皮层创伤性脑损伤模型中海马区快速波纹的早期出现与传播。《神经科学杂志》38卷:9034–9046, 2018年。DOI:10.1523/JNEUROSCI.3507-17.2018
- G bska H, Potworowski J, ski S, Wójcik DK. 神经活动的独立成分携带有关个体群体信息,《公共科学图书馆·综合》9卷,e105071,2014年。DOI:10.1371/JOURNAL.PONE.0105071。
- 格翁布斯卡 H、诺尔海姆 E、德沃尔 A、戴尔 AM、埃内沃尔 GT、沃伊切克 DK。用于解释皮层多电极数据的广义层状群体分析(gLPA),《神经信息学前沿》10卷1期,2016年。DOI: 10.3389/fninf.2016.00001
- G bska H, Chintaluri C, Wójcik DK. 丘脑皮质网络模型仿真数据集的构建. 神经信息学 1 5: 87–99 (2017). DOI.org/10.1007/s12021-016-9319-4
- 尼斯TV,软塔卢里C,波特沃夫斯基J,ski S,格翁布斯卡H,沃伊奇克DK,艾内沃尔GT。微电极阵列(MEA)记录电位的建模与分析。《神经信息学》13: 403–426,2015。doi.org/10.1007/s12021-015-9265-6
¶ 图例
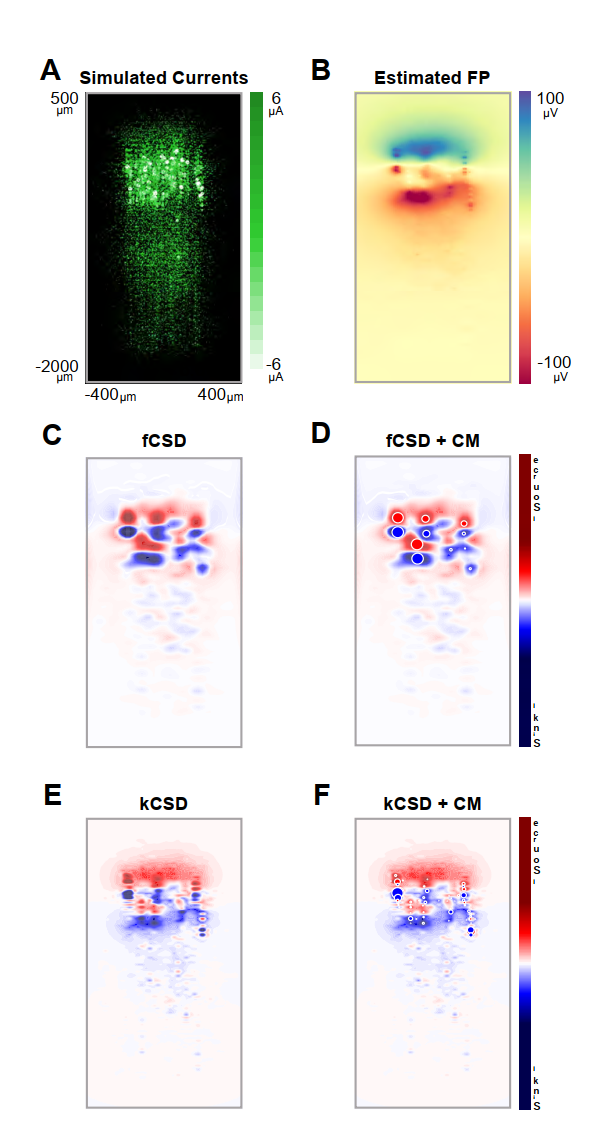
- 图1. 用于验证CSDA方法的神经元聚合模型。我们采用模拟皮层柱对比fCSD与kCSD分析方法。该模型通过精细区室化结构再现丘脑皮层环路(详见正文)。模拟记录时长0-600毫秒,涵盖356个细胞网络。为诱发响应额外施加2毫秒刺激,模拟大鼠桶状皮层触须拨动响应。图A呈现刺激事件前6.6毫秒时基线活动状态,可见23层规则放电锥体细胞跨膜电流存在显著波动。在诱发响应中,向丘脑细胞注入模拟电流可诱导皮层活动,重现大鼠桶状皮层触须拨动响应。细胞外电位根据神经元位置与跨膜电流计算,各电极贡献值按距离倒数定律加权。每个圆点代表模拟桶状柱中心100μm切片内的细胞段,色彩强度标示电流强度。B. 基于整个皮层柱跨膜电流估算的细胞外电位(FP)。C. 采用有限差分算子法(fCSD)估算的电流源密度(CSD)。D. 基于fCSD分布计算的质心(CM)。E. 使用核函数CSD法(kCSD)估算的CSD。F. 基于kCSD分布计算的质心。
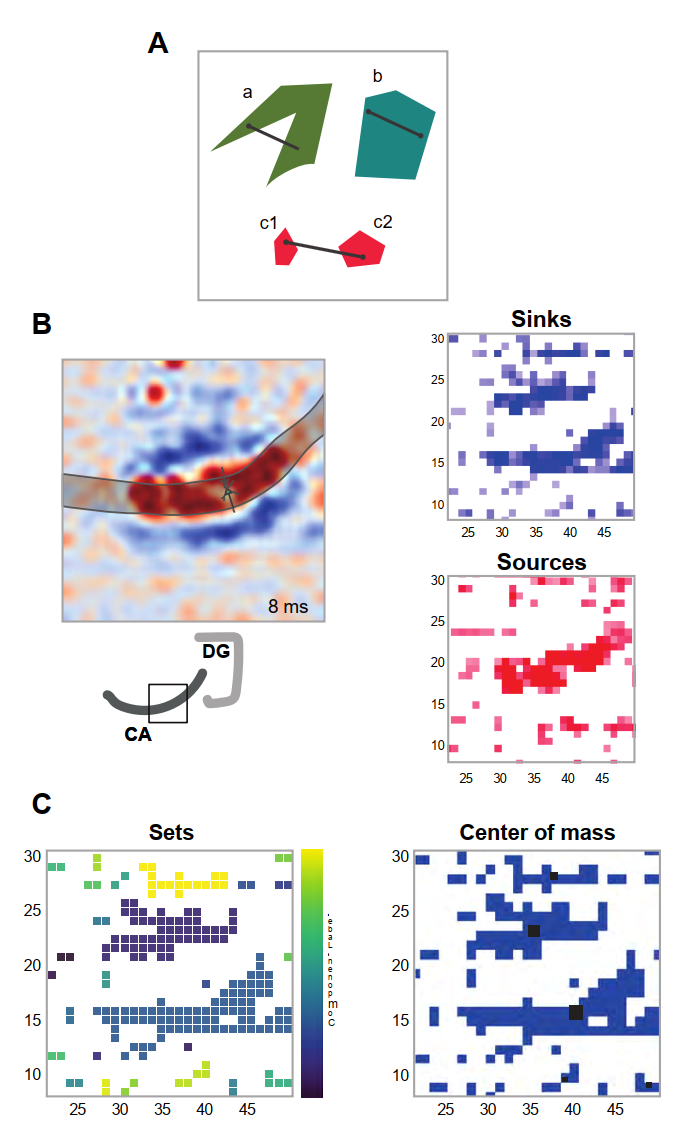
- 图2. 我们分析中使用的几何概念。A) 连通性与凸性的概念。此处几何任意图形将代表活动集,这些集合在数学上可以是凹的(a)或凸的(b)。凹集的特征在于具有任意两点可以通过一条可能穿越集合外部区域的线连接,而在凸集中,点总是可以通过一条从不离开集合区域的线连接。集合 c1 和 c2 代表两个不连接的组件。B) 在 CA3 区域中的 CSDA(如下插图所示)在 DG 中提供刺激后 8 毫秒采集。然后,汇和源分别被分离到集合中(右图)。从这些集合中,检测出汇子集的不相交组件(C),最后我们计算可能组件的积分强度,这些组件可以通过某个阈值进行选择(左图)。对于选中的那些,我们获取它们的"质心",由黄色和黑色圆圈表示(右图)。
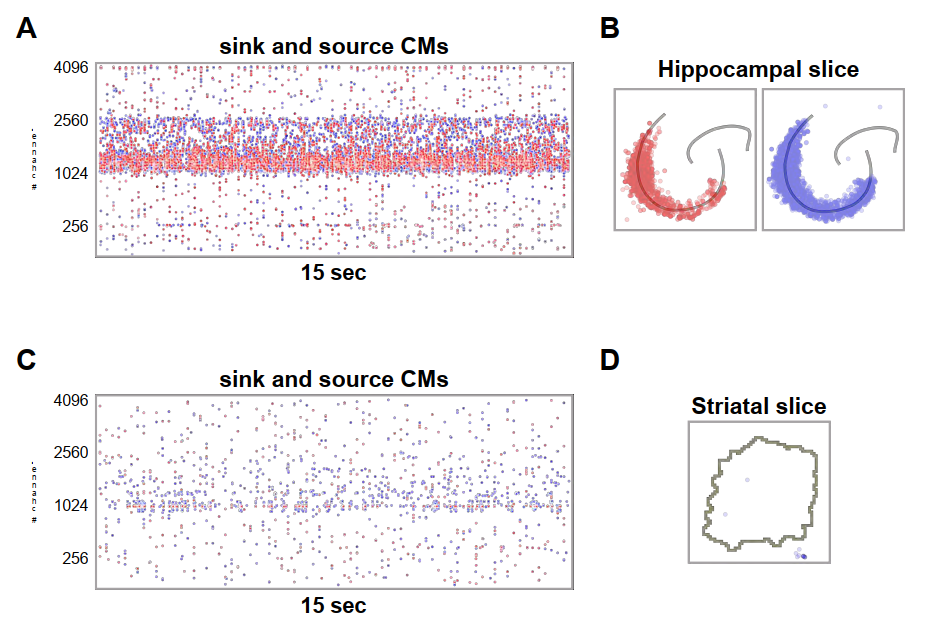
- 图3. 海马体和纹状体切片中原心的识别与筛选。为区分具有生理意义的事件与随机伪迹,我们对15秒自发活动中检测到的汇和源的质心应用了基于阈值和残差的处理方法,具体流程见方法学中"质心与轨迹"部分。A. 过滤前海马体切片中汇(蓝色)与源(红色)的原始分布。B. 经处理后,组织区域外的质心被判定为假阳性并剔除,从而重建海马体活性通道的空间构型。C. 相同条件下纹状体切片中汇与源的原始分布。D. 该方法应用于纹状体记录时未能实现有效分离,表明检测到的事件大多属于随机活动,因而无法提取一致性轨迹。
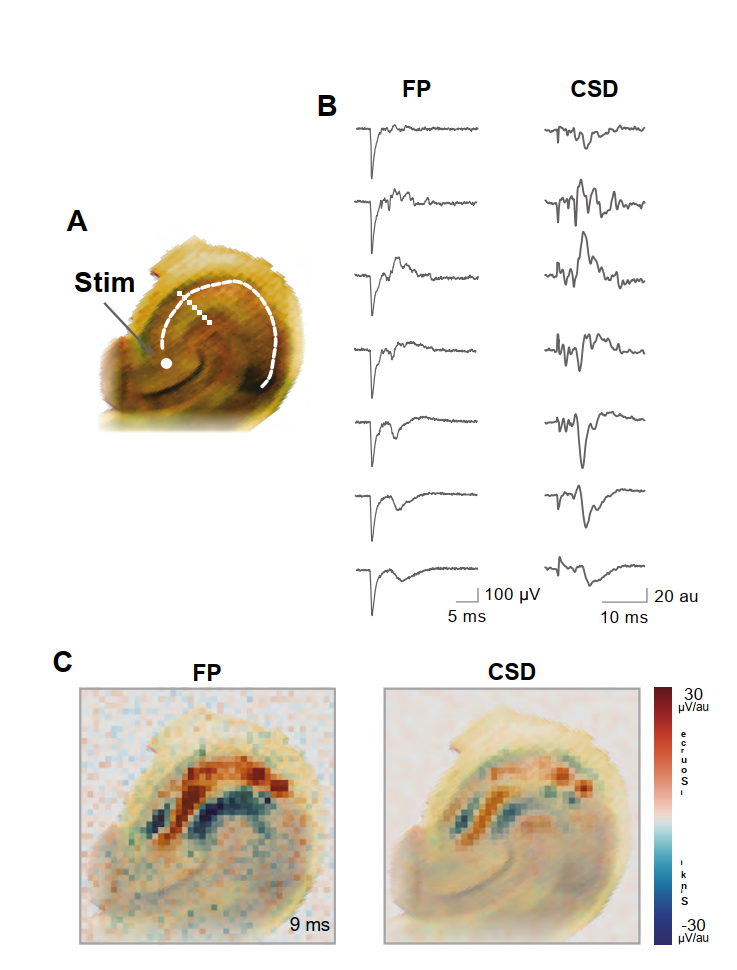
- 图4. CA3区DG诱发电位。A) 海马切片照片显示MEA内置刺激电极位置(刺激点),以及B图示例所用微电极在CA3区的分布点位。B) 通过A图所示位点施加100微秒刺激脉冲诱发的场电位。C) 刺激后9毫秒获取的全切片场电位(单位微伏)与电流源密度(CSD,任意单位)的彩色编码图谱。彩色编码图谱叠加在记录切片的照片上。
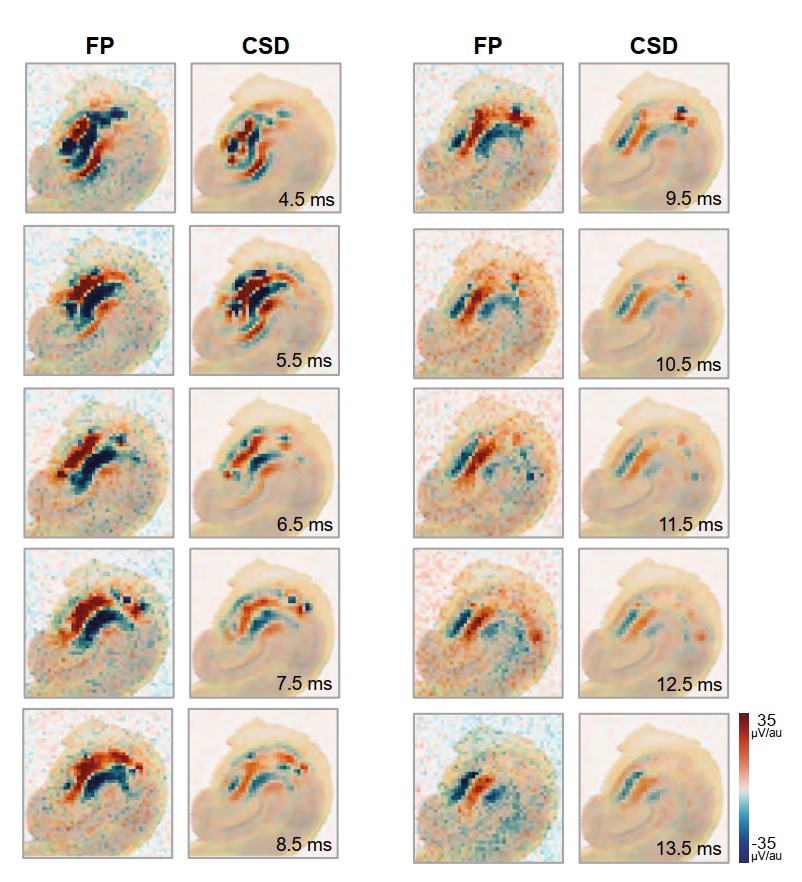
- 图5. DG刺激后CA3区域活动的进程。颜色编码图被叠加到记录切片的一张照片上,以描绘在DG刺激后(100微秒脉冲持续时间)指定时间点采集的场电位和相应的电流源密度(CSD)。注意汇和源的进程以及增强和减弱。
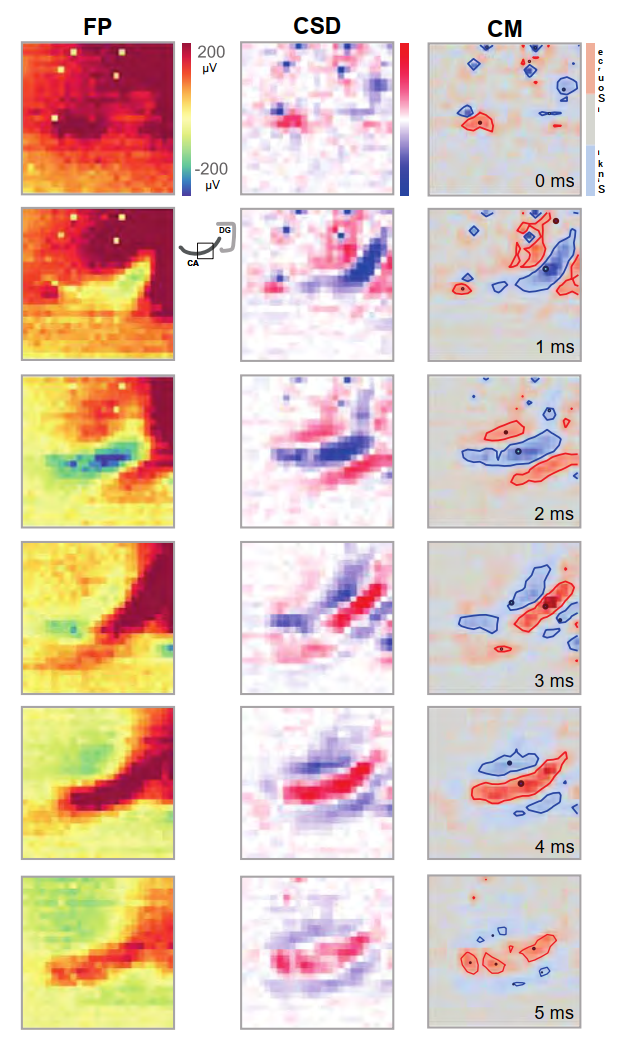
- 图6. DG刺激后CA3区域活动的进展过程。彩色编码图叠加在记录切片的照片上,用以描绘在外界双极刺激电极激活DG后,各行所标时间点记录的场电位、电流源密度(CSD)及质心(CM)。刺激(100微秒脉冲持续时间)引发了FP(左列)通道饱和,从而掩盖了活动信号。相比之下,CSD分析(中列)在同一时期清晰呈现出具有明确传播模式的汇源分布。这一特征同样体现在CM分析(右列)中,该分析采用了不同的配色方案用于显示不相交组件的边界。每个组件的质心用点标记。
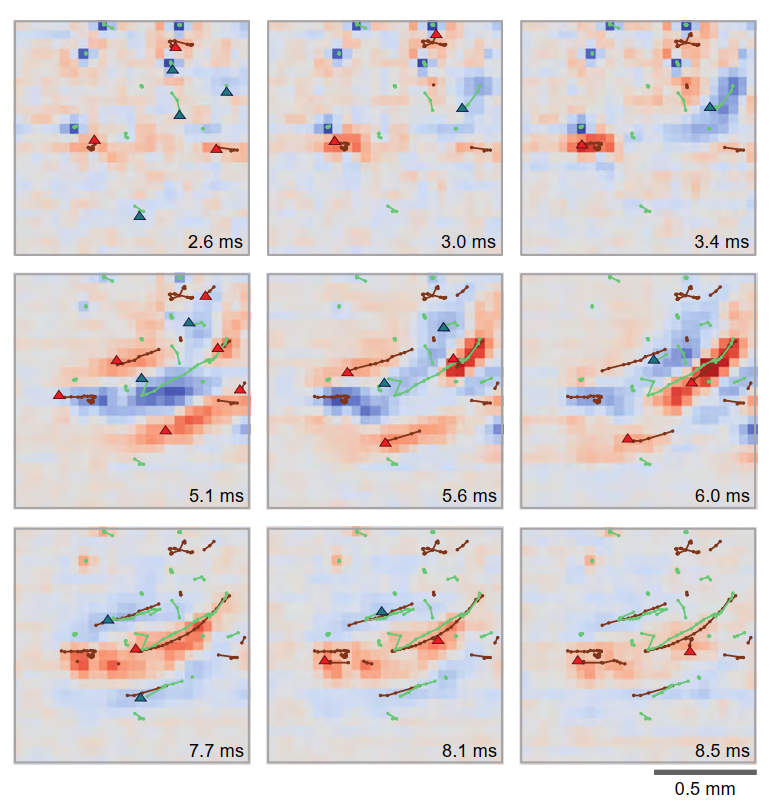
- 图7. CA3感兴趣区内汇点和源点轨迹的高时空分辨率呈现。分析始于DG刺激后2.6毫秒。至3毫秒时出现清晰的汇点轨迹并自右向左移动,同时源点轨迹在两侧出现并跟随。5.6毫秒时沿锥体层出现源点,此时汇点轨迹刚消失并向前推进,而汇点逐渐衰减。注意其空间位移终止于7.7毫秒。线条代表不同组分的运动轨迹,可据此计算并追踪CM。注意其长度限制及特定起始点;观察信号如何随时间衰减。三角形指示轨迹最后激活点的添加位置,用以标示运动方向。
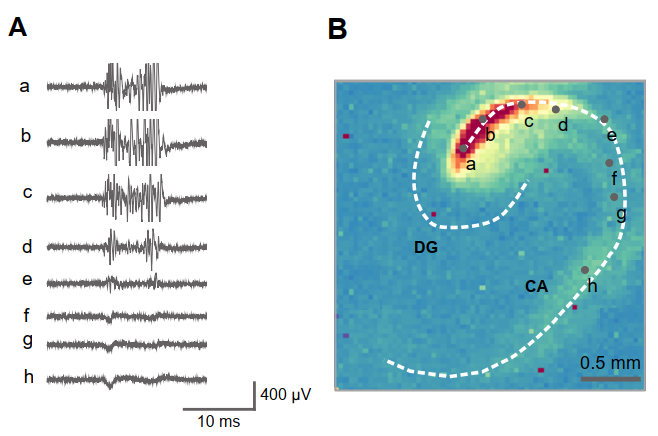
- 图8. A) 从体内皮层损伤大鼠的去抑制海马切片记录的自发活动。在B图中沿CA区域标记为a至h的位置记录了去抑制活动。注意高频高压活动的起始点位于轨迹b标记处。B) 以色码标注场电位标准差作为活动积分测量的分布图。虽然不同高压成分出现的时间点不同,但标准差表征将其整合于单一图谱。该表征取自200毫秒的活动周期。
- 图9. 记录自一只带有皮质的大鼠海马体切片的自发活动体内病变。以 FP、CSD 和 CM 表示的活动在之前和在高频、高振幅活动期间,于每行所示的时间点进行记录。自发性ROI对照活动是在癫痫样活动爆发开始前4.5毫秒采集的。注意CA3区事件的发生、传播及其波动变化。有趣的是,当激活点从近端到远端连续出现在CA1区时,CA3区在场电位(FP)和电流源密度(CSD)中表现出更持续的活动,似乎持续激活CA1区的特定区域。同时,齿状回(DG)也反映出活动迹象,表明活动从CA3区和门区发生了反向传播。
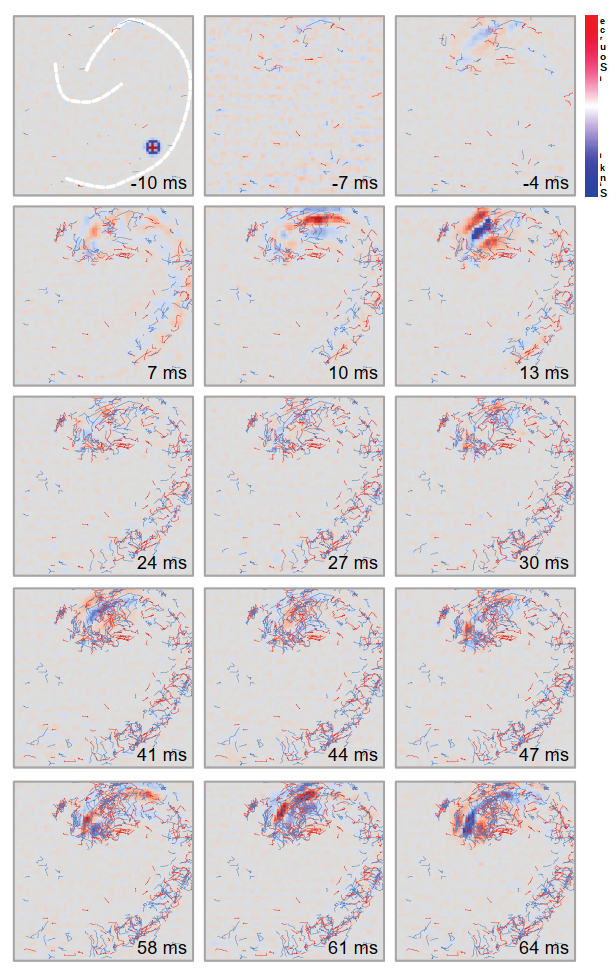
- 图10. 显示了图7所示活动出现之前、期间和之后立即捕捉到的质心轨迹累积。汇轨迹以蓝色显示,源轨迹以红色显示。注意在全面事件发生前,离散位置中汇和源的出现,以及事件发展后对整个CA的侵入。进一步分析可以得出位移的"单位"等其他参数,这些参数有助于解析沿海马回路的"微环路"。
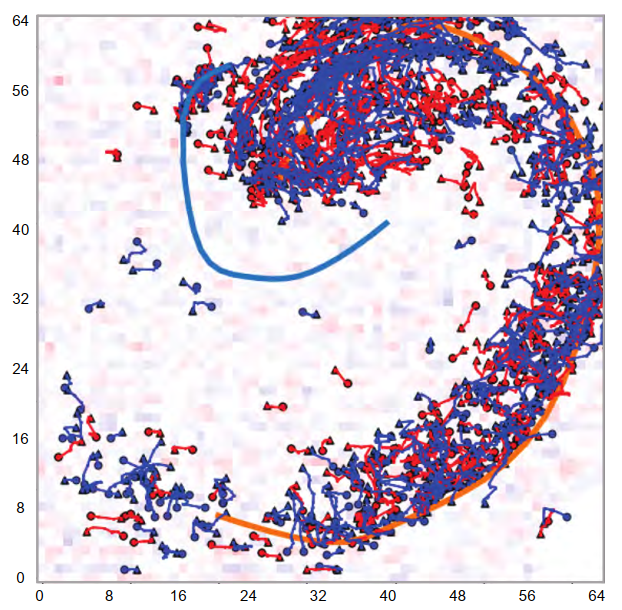
- 图11. 描绘了图8中所有轨迹的累积进程的图像,对应80毫秒的活动。注意,尽管缺乏用于实验的切片的显微照片,但海马体解剖结构通过电活动被大致重建。
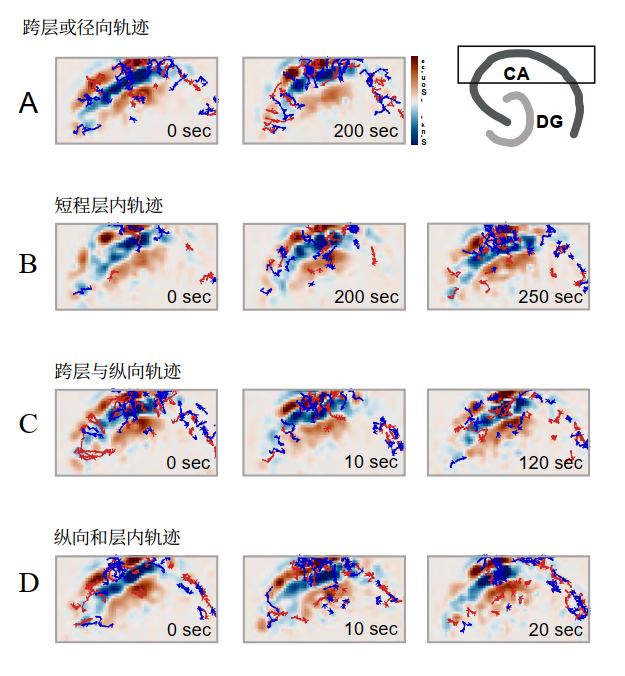
- 图12. 描绘选择性轨迹累积进展的图像在图9中。请注意,轨迹要么遵循胞体-树突路径,要么遵循胞体-胞体(层内)路径,要么遵循跨层路径。尽管在此图中,长而明确的轨迹在不同选定活动时段(由时间戳标记)的时刻被描绘,轨迹持续时间从0.4毫秒至接近4毫秒不等。
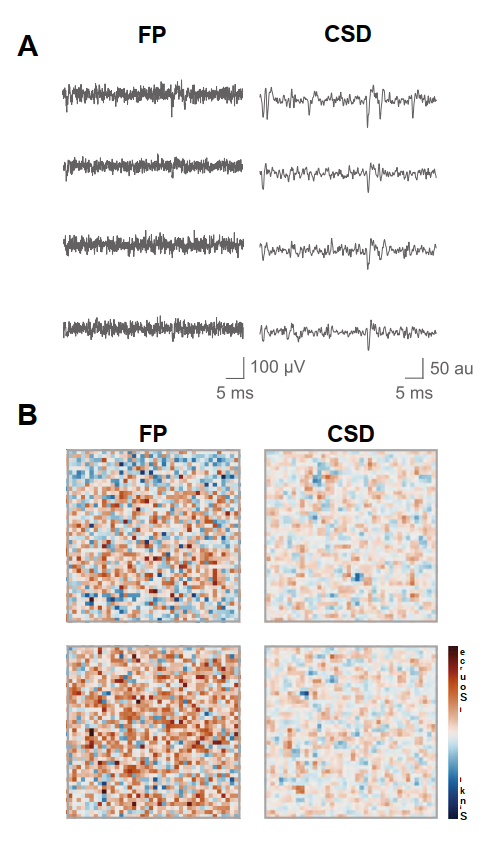
- 图13. 使用4AP灌注的纹状体切片场电位(FP)与电流源密度(CSD)分析。A) 原始FP及对应CSD的示例波形。B)正如非分层结构的预期结果,彩色编码的神经活动图谱与对应CSD未显示可辨别的模式或轨迹;仅在小范围区域短暂观察到高压活动,该处可见源/汇配对现象。符合预期的是,可测量质心所需的最小位移标准未得到满足。