¶ 里程碑白皮书I:急性脑切片技术发展与应用
---------------从冷冻保存并复温的急性切除啮齿动物神经组织中恢复电活动
- 2025年9月22日,Until团队发布
- 从低温保存和回温的急性切除啮齿动物神经组织中恢复电活动
¶ 摘要
冷冻保存技术目前已广泛应用于分离神经细胞的存储,近期研究亦证实该技术能够维持简单神经类器官的电活性。然而,冷冻保存后的急性切除神经组织如何恢复动作电位,仍是该领域持续面临的挑战。本研究通过冷冻保存并复温急性切除的大鼠小脑切片,首次在复温后观测到电活性。据我们所知,这是首个在急性切除的哺乳动物脑组织中实现电活性恢复的研究报告,并同步提供了可供验证与复现的操作方案。
¶ 正文
分离细胞的冷冻保存是一项普遍应用的技术,是存储和运输原代神经祖细胞的必要手段(Hancock等,2000)。虽然源自这些细胞的神经元能够为单细胞生物物理学和电生理学研究提供一定见解,但其电活动与原生微循环环境中的神经元存在本质差异。正因如此,大量神经科学研究主要集中于活体生物或急性组织切片。急性切片不仅能便捷地实现对深部脑区的电信号采集,还能较好地维持细胞间的连接结构(Frey等,2009)。鉴于人类脑组织在快速获取及维持研究可用性方面存在困难,目前绝大多数相关实验仍以鼠类组织为研究对象,这限制了研究成果的转化潜力(Day等,2013)。若能从人类供体中建立有效的急性切除神经组织冷冻保存方法,将实现这类珍贵研究样本的冷冻存储与运输,为基础神经科学研究和药物开发开辟全新平台。近期有研究报道了实验室培养脑类器官的成功冷冻保存方案,其在复温后展现出令人印象深刻的结构完整性与电活动维持(Xue等,2024)。然而,该研究未能在冷冻保存的急性切除神经组织样本中检测到电活动。尽管类器官在模拟疾病与早期脑发育方面具有重要价值,但相较于急性组织切片仍存在局限——例如缺乏成熟的细胞组织结构与功能连接,这可能影响其在神经科学研究中的转化相关性(Qian & Song,2019)。
本研究首次提出大鼠小脑急性切片的冷冻保存方法,并在冷冻保存与复温后观测到部分电活动恢复。据我们所知,这是首次在冷冻保存并复温的急性切除神经组织中检测到动作电位的实证研究。
¶ 我们的研究结果
为实现可存活的组织保存,我们首先对300微米厚的大鼠小脑急性切片进行了冷冻保护剂溶液的扩散加载(图1a、1b)。该溶液成分与成熟的VMP冷冻保护剂配方(Han等,2023;Fahy等,2004)完全相同,仅去除了其中一种组分(X-1000冰阻滞剂)。在冷冻保存准备阶段,将大鼠小脑急性切片置于配备定制扩散加载槽的多功能样品架中(图4)。组织完成冷冻保护剂加载后,采用液氮射流从4℃快速冷却至-196℃,随后通过感应加热器产生的交变磁场进行复温(图1d、1e)。随后将样品架的灌流槽重新放置于样本上方,通过线性梯度灌流在500秒内将槽内冷冻保护剂浓度从最高值降至零,完成冷冻保护剂的卸载。经过约45分钟的冷冻后孵育,将切片转移至多电极阵列(3Brain Duplex系统),在添加卡巴胆碱前记录基线电活动,随后记录添加河豚毒素后的电活动(图2)。
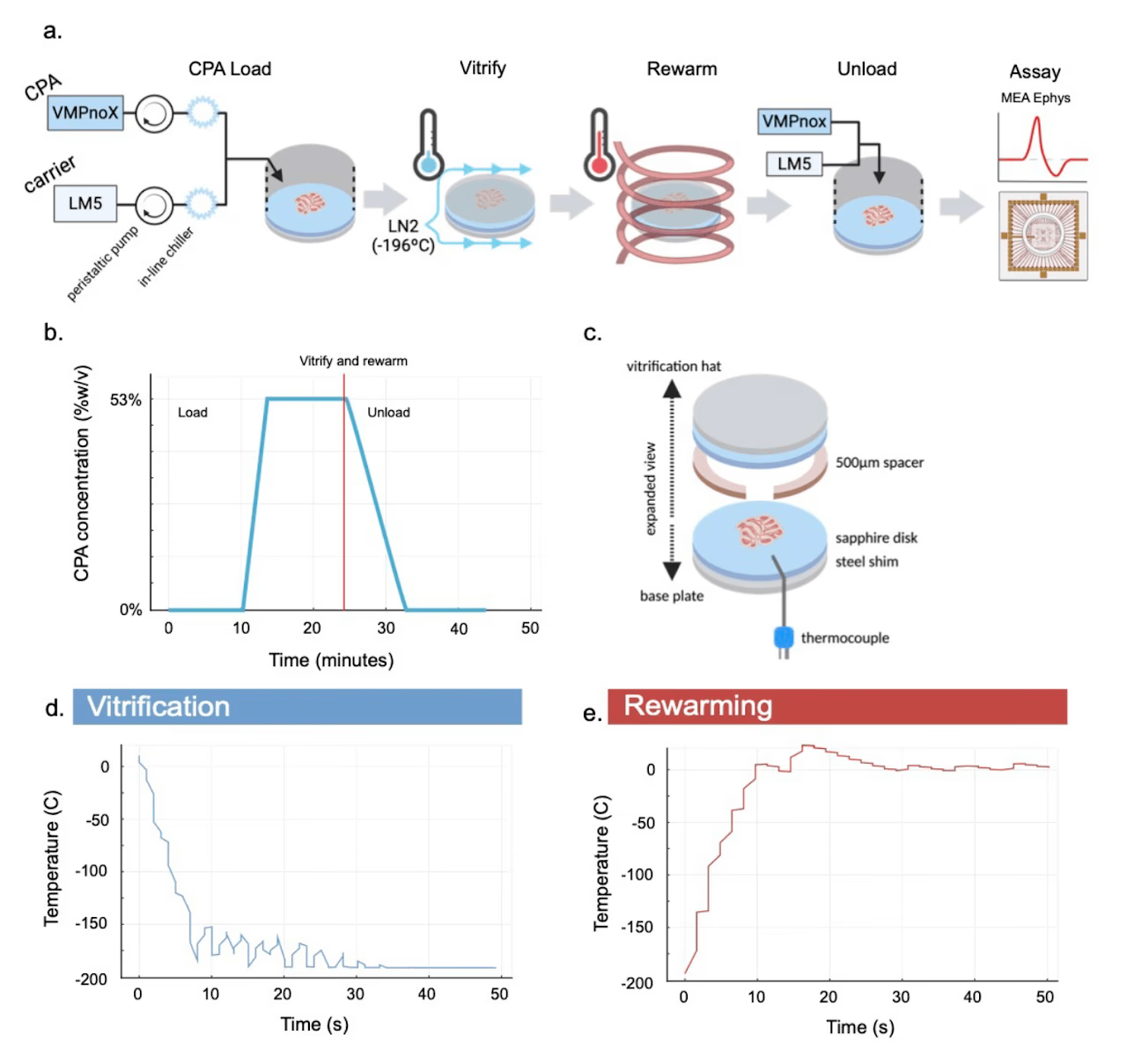
图1. 组织切片冷冻保存流程。a) 系统概览。急性神经组织在玻璃化冷冻和复温前先加载VPMnoX冷冻保护剂(含53% w/v冷冻保护剂),该过程在专用腔室中进行,随后在多电极阵列上记录电活动。b) 冷冻保护剂加载与卸载过程中的浓度随时间变化曲线。c) 玻璃化冷冻与磁性复温过程。d) 图2所示样本的降温温度曲线。e) 图2所示样本的复温温度曲线。
采用该方案测试的4个切片中均检测到电活动,且信号对药理刺激的反应符合预期:卡巴胆碱使活动强度从基线水平增强,而河豚毒素则阻断了动作电位。图2展示了其中一个切片的数据(如需更多数据请联系hunter@untillabs.com)。在基线状态下,多个电极检测到高频放电(图2b、2c)。应用卡巴胆碱增强神经兴奋性后,平均放电频率显著上升。而施加河豚毒素后,放电活动被完全抑制,证实了先前信号属于生理性放电。
尽管在多通道多电极阵列中均检测到神经活动,但可以明确的是,经过该冷冻保存方案后电活动显著减弱。图2e展示了健康对照组切片在基线状态(无药物刺激)下的样本数据。
在4个保留电活动的冷冻切片中,图2所示切片未出现宏观裂纹。组织在相变后若受到大幅热梯度影响易产生裂纹。后续实验将致力于优化玻璃化冷冻与复温曲线,在确保足够快速的降/复温速度以避免冰晶损伤的同时,完全防止裂纹的产生。
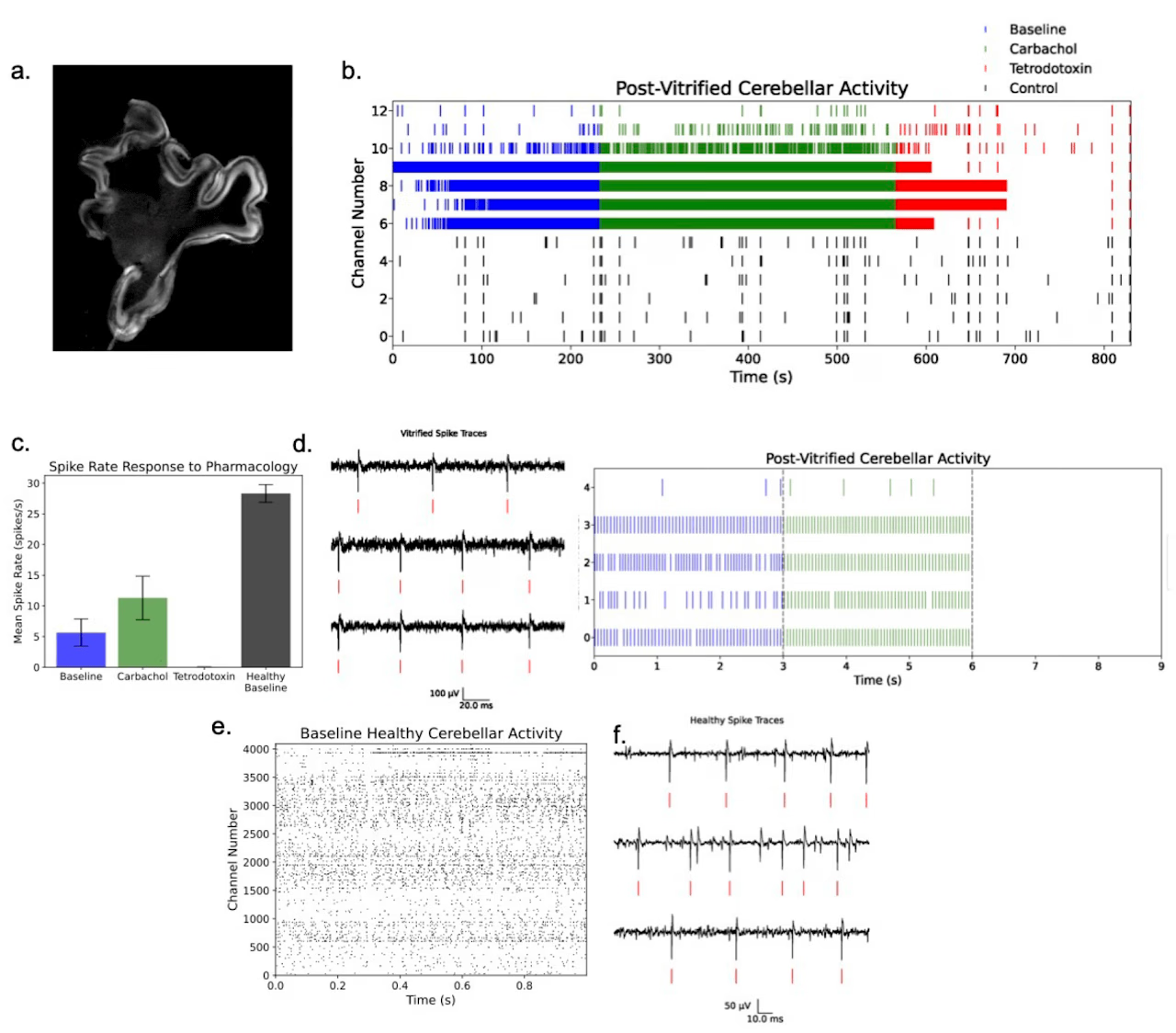
图2. 玻璃化冷冻切片的MEA电活动记录
a) DAPI染色显示冷冻保存后大鼠小脑切片的典型形态结构
b) 玻璃化冷冻复温小脑切片的多电极阵列点阵图。颜色变化标示药理刺激起始时间,黑色区域表示未接触组织的电极通道(用于监测全局噪声)。放大面板清晰展示高活性通道(6-10)的信号片段
c) 与(b)同一切片活跃区域的平均放电频率,按药理条件分组。灰色曲线显示独立健康对照切片的平均放电频率数据
d) 与(b)(c)同源玻璃化冷冻切片的原始信号代表性波形,红线标注检测到的动作电位
e) 健康小脑切片在aCSF灌流条件下的代表性点阵图,显示高强度放电活动。请注意与(b)的时间轴对比
f) 同(d)的呈现格式,但对应健康小脑切片数据
¶ 讨论
本研究首次实现了在经冷冻保存的急性啮齿类神经组织中恢复电活动。由于玻璃化水的高黏度特性,样本在液氮温度(-196℃)下因分子运动极度减缓而可实现近乎无限的存储,此时代谢活动停止且冰晶形成被抑制。神经组织能够经历液氮温度处理并在复温后恢复电活动,这一发现标志着我们在开发适用于人类急性切除组织研究保存的方案道路上取得了重要里程碑。
要实现适用于转化研究所需的保存水平与功能活性,仍需对本方案进行多次优化改进。持续筛选针对神经组织的高效低毒冷冻保护剂配方将有效提升组织存活率。我们在此方向上的下一个目标是应用新型神经专用冷冻保护剂与温控方案,在冷冻保存后的急性切片中验证突触功能与长时程增强效应,推动切片冷冻保存效果逐步逼近健康对照组水平。
此外,本研究为实现全身可逆冷冻保存提供了可能性视野,这将为终末期疾病患者开启医疗休眠疗法——在可预见的治愈方案出现前暂停疾病进展。我们预测,与其他器官相比,神经组织因再生能力有限、功能冗余度低、渗透压敏感性高以及血脑屏障限制冷冻保护剂渗透等特性,将构成特殊挑战。将适用于薄层神经组织切片的技术拓展至全脑或整个生物体的保存,需要进行多项重大技术改进:冷冻保护剂加载方案必须兼容血管灌注方式,相关制剂还需具备穿透血脑屏障的能力;同时需要开发实现均匀复温的精密温控技术。
目前尚未明确何种技术组合能够满足这些复杂需求,但如本研究所示,这种能在冷冻后保持部分电活动的急性神经切片平台,无疑为未来技术开发和迭代提供了宝贵的起点。
¶ 方法
所有实验均遵循动物福利与兽医护理标准执行。Until Healthcare机构的动物护理与使用委员会(IACUC)批准了本研究全部方案。
¶ 实验动物
选取查尔斯河公司提供的CD(斯普拉格-道利)大鼠,自由摄取食物与饮水。使用出生后12至19天(P12-P19)的雄性与雌性大鼠进行实验。
¶ 急性切片制备
为评估冷冻保存后神经组织活性,制备急性小脑矢状切片。选择小脑切片是因相较于其他脑区,其基线活性更高,有利于在活性检测中获得最佳灵敏度。配制含高浓度蔗糖与镁离子的改良aCSF切割液(组分:87mM氯化钠、25mM碳酸氢钠、1.25M磷酸二氢钠、0.5mM氯化钙、2.5mM氯化钾、25mM D-葡萄糖、75mM蔗糖、7mM氯化镁;据Wang等2024年配方),该配方可降低切片过程中的神经活动与组织损伤。溶液经渗透压调整至300-330 mOsm,并使用含95%氧气与5%二氧化碳的混合气体(碳合气)持续通气至少30分钟。该溶液用于心脏灌流、组织分离与振动切片机切片全过程,期间始终保持冰浴环境与持续通气。经异氟烷麻醉及心脏灌流后,取出全脑组织,以3%琼脂糖块为支撑将脑组织粘附于切片平台,进行小脑矢状面振动切片(图3a)。切取300μm厚切片,在32℃碳合aCSF溶液(组分:125mM氯化钠、25mM碳酸氢钠、1.25mM磷酸二氢钠、2mM氯化钙、3mM氯化钾、25mM D-葡萄糖、1mM氯化镁、3mM丙酮酸钠)中孵育30分钟,随后转移至室温碳合aCSF溶液静置至少15分钟后进入实验流程。
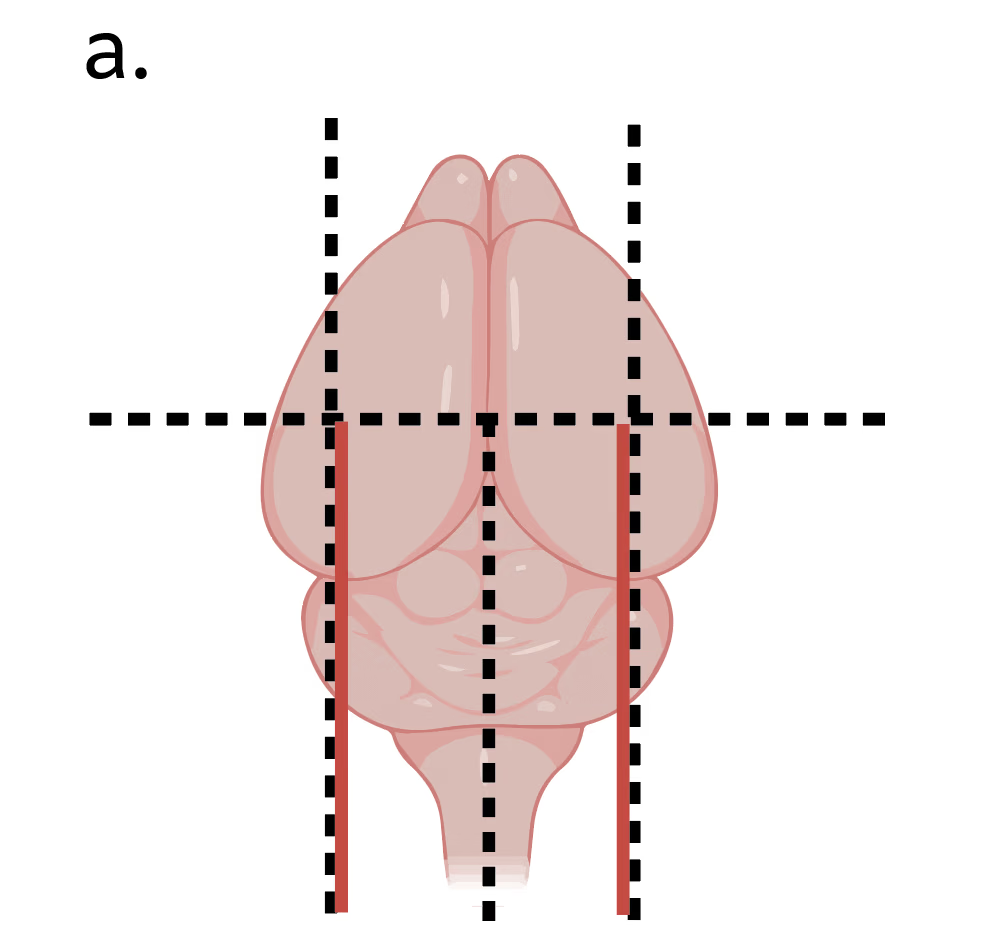
图3a. 小脑急性切片制备流程。示意图展示采用刀片进行钝性分离(黑色虚线标示)并将组织粘附至切片平台(红色区域)的操作步骤,通过振动切片机制备矢状切片。
¶ 冷冻保护剂溶液
冷冻保护剂VMP配方(16.8%重量比乙二醇、22.3%二甲基亚砜、12.9%甲酰胺、1% X-1000、1% Z-1000)此前已用于器官冷冻保存实验(Han等2023,Fahy等2004)。X-1000与Z-1000是21st Century Medicine公司生产的合成冰阻滞剂,分别含有20%重量比的聚乙烯醇和40%重量比的聚甘油。本实验采用VMP的改良配方VMPnoX(16.8%重量比乙二醇、22.3%二甲基亚砜、12.9%甲酰胺、1% Z-1000),该配方仅去除原VMP中的X-1000成分。溶液使用前24小时内通过LM5载体溶液(1mM盐酸腺嘌呤、1mM氯化钙、90mM葡萄糖、5mM谷胱甘肽、2mM氯化镁、28.5mM氯化钾、7.2mM磷酸二氢钾、10mM碳酸氢钠、45mM乳糖、45mM甘露醇;Fahy等2004)稀释配制。采用Ismatec Reglo ICC四通道蠕动泵的程序控制通道,通过灌流槽(图4b)逐步调整CPA与LM5的混合比例,实现组织切片中冷冻保护剂的梯度加载与卸载。
¶ 硬件设计与组装说明
本实验设计了3种定制部件(参见CAD文件),包括配备两种功能盖的通用基板:1)用于组织切片冷冻保护剂加载与卸载的灌流盖(图4b、图4c);2)用于组织玻璃化与复温的处理盖(图4d-f)。所有部件均采用FormLabs 3B打印机搭配Tough 1500树脂打印制成。基板最终组装(参见CAD图纸)时,使用MasterBond EP29LPSPAO-1黑色环氧树脂将直径20mm、厚度500µm的双面抛光蓝宝石圆片固定于直径19mm、厚度250µm的碳钢垫片(图1c、图4a)。该蓝宝石-钢片组件嵌入基板后保持蓝宝石面暴露。
灌流盖(参见CAD图纸)设有进口软管接头,连接至底部带四个流体入口的空心通道(图4b、图4c)。出口软管接头可实现槽内液体从顶部抽吸。防护网可防止组织切片被吸入出口。槽底设置的O型环凹槽(使用内径18mm、厚度2mm的O型环)可与基板蓝宝石片形成防水密封。
玻璃化与复温盖(参见CAD图纸)在功能上与基板对称,采用相同规格的蓝宝石-钢片组件(图4d)。不同之处在于该处理盖的蓝宝石垫片上额外粘附有内径1/2英寸、厚度500µm的PTFE间隔环,确保组织不会在两层蓝宝石片之间受压(图1c)。间隔环开有窄缝用于嵌入T型薄热电偶,使其贴近切片放置。热电偶从后方(液氮排气侧)插入,使组织能被夹于两片蓝宝石之间且仅与蓝宝石接触。
玻璃化过程采用三通电磁阀控制液氮流量(图4f)。阀门关闭时液氮排入空杜瓦瓶,开启时液氮导入切片腔室。复温过程使用15kW、30-80kHz感应加热器配合内径约30mm的加热线圈实现,线圈中心特意留出空隙以适配切片腔室(图4f)。
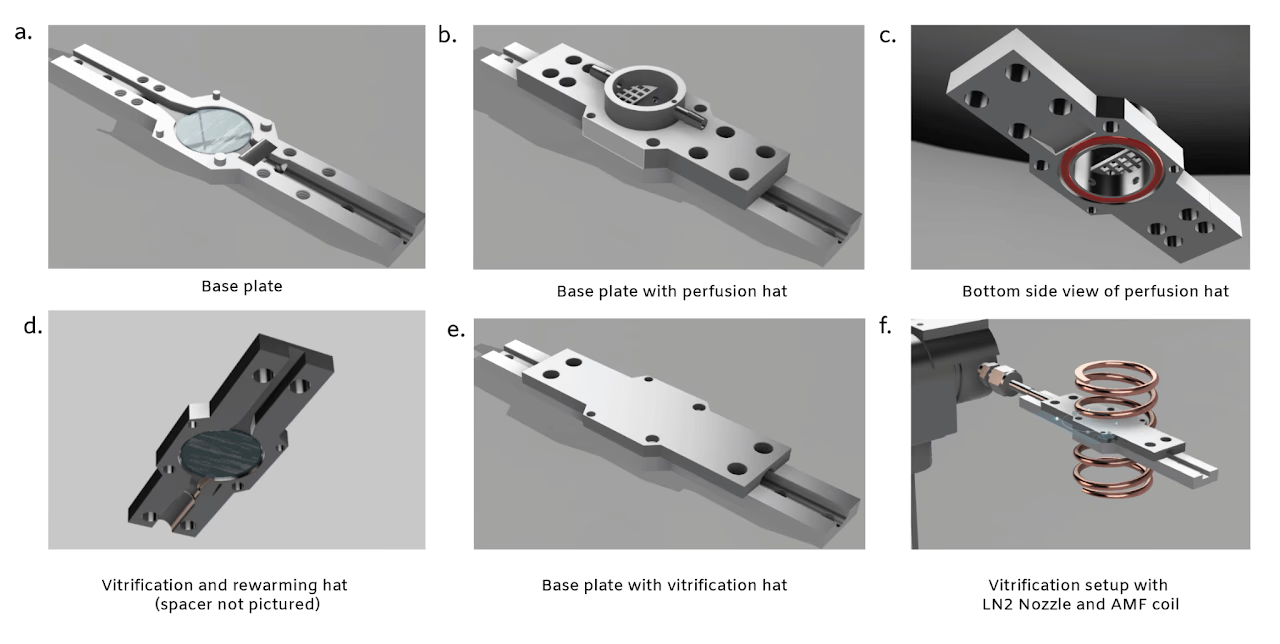
图4. 急性神经组织切片冷冻保护剂加载、玻璃化及复温的硬件装置
¶ 冷冻保护剂加载
在进行CPA加载前,先准备上述切片加载系统,并在管路中预充LM5载体溶液和VMPnoX冷冻保护剂。将按前述方法制备的新鲜小脑切片转移至盛有LM5溶液的灌流槽中,启动CPA加载程序:首先进行10分钟的0% w/v CPA(纯LM5载体)灌流,随后通过200秒梯度爬升从0%提升至53% w/v CPA浓度,最后维持53% w/v CPA浓度10分钟(图1b)。为维持槽内液面稳定,进口总流速设定为2 mL/min,出口流速设定为2.2 mL/min。整个加载与卸载过程的温度设定点为4ºC至10ºC,通过两个在线玻璃热交换器进行调节。为提升温控精度,冷冻保护剂加载操作在4ºC冷藏箱中进行,溶液储罐置于冰上。为评估冷冻保护剂本身毒性(排除深低温冷却造成的损伤干扰),对一组切片执行了完整的加载-卸载流程(未进行玻璃化冷冻与复温步骤)(补充数据可联系hunter@untillabs.com获取)。
¶ 玻璃化冷冻
CPA加载程序结束后,准备将切片快速冷却至深低温。首先吸除灌流槽内液体,将切片轻柔移至蓝宝石片中心区域,卸除灌流盖并更换为玻璃化处理盖(图4d,参见CAD图纸)。将组装体转移至玻璃化-复温工作站,连接预冷的液氮喷嘴进行玻璃化处理,并将其安置于交变磁场感应加热器的线圈内以备后续复温(图4f)。液氮由15psi压力的液氮杜瓦罐供给。就位后开启控制切片区域液氮流量的电磁阀,实现快速冷却。通过置于切片旁的T型热电偶监测温度记录,达到最低温度(约-196ºC)后维持液氮流动30秒。图1、图2所示切片的冷却速率达1140ºC/分钟(按图1d中t=0至t=10s时段计算),不同切片间略有差异。
¶ 交变磁场复温
在-196ºC维持1分钟(确保样本完全达到终点温度)后,终止液氮流动,使用工作场强15W、频率约70kHz的交变磁场电磁铁进行快速复温。复温通过加热与蓝宝石片非接触面贴合的两片薄碳钢垫片实现(图1c)。图1、图2所示切片的复温速率达1280ºC/分钟(按图1e中t=0至t=10s时段计算)。当切片旁温度探头监测到温度达到0ºC时,交变磁场系统通过PID控制将温度稳定维持于0ºC。
¶ 冷冻保护剂卸载
复温完成后卸除玻璃化处理盖,重新安装灌流盖。启动CPA卸载程序(图1b):首先进行500秒从53%至0% w/v CPA的线性梯度下降,随后进行10分钟的0% w/v CPA(纯LM5载体)灌流。程序结束后将切片从CPA灌流装置中取出,置于32ºC恒温碳合aCSF溶液中孵育30分钟,再转移至室温碳合aCSF溶液中静置至少15分钟。
¶ MEA切片电生理学
采用3Brain BioCAM DupleX系统(瑞士)的多电极阵列电生理技术评估组织切片活性。健康对照组切片在切片后孵育完毕立即检测,实验组切片在卸载程序结束后立即检测。
使用3Brain HD-MEA Acura 2D芯片(工作区域3.84mm×3.84mm,包含4,096个21μm×21μm电极),采样频率设置为20kHz。将切片小心放置于多电极阵列芯片上,在体视镜下定位后采用硅胶切片固定器固定,随后置入BioCAM DupleX系统进行记录。实验过程中持续以~2 mL/min流速灌注碳合aCSF溶液,灌流入口与芯片基底温度维持32℃。
首先进行连续记录采集约5分钟基线电活动(图2b),随后灌注50μM卡巴胆碱约5分钟。卡巴胆碱作为乙酰胆碱受体激动剂,可通过激活毒蕈碱受体增强小脑切片的放电活动,提升神经元兴奋性与突触传递功能(Pickford, 2019)。最后灌注10μM河豚毒素约5分钟。河豚毒素通过结合并抑制神经元膜电压门控钠通道,有效阻断动作电位的产生与传导(Wakita等,2015)。
¶ 数据分析
采用Brainwave 5(3Brain)软件中的精确时序峰值检测算法进行峰值检测,该算法专用于识别细胞外神经元放电(Maccione等,2009)。PTSD算法判定规则:当局部极小值出现后,在设定的峰值存活期内出现局部极大值(过冲),且极大值与极小值的峰峰值距离超过信号标准差的设定倍数,同时满足与前次峰值的 refractory period 间隔要求时,则判定为有效峰值。本研究中设定峰峰值阈值为10σ,峰值存活期2毫秒, refractory period 1毫秒。
¶ 组织学分析
MEA电生理检测后,对玻璃化冷冻切片进行DAPI染色形态学观察(图2a)。切片经10%中性缓冲福尔马林固定20分钟,4℃条件下在0.3% Triton X-100的PBS溶液中透化18小时。清洗后使用10μg/mL DAPI溶液染色30分钟对全体细胞核进行标记。切片经PBS载片后通过梯度乙醇脱水(30%乙醇10分钟、50%10分钟、70%15分钟、80%15分钟、95%20分钟、100%40分钟),二甲苯透明40分钟,最后使用Vectamount Express封片剂封片。在奥林巴斯FV3000共聚焦显微镜下采用10倍物镜、1.5倍数码变焦和405nm激光激发,采集完整切片的Z轴堆叠图像。
¶ 参考文献
Day, B., Stringer, B., Wilson, J., Jeffree, R., Jamieson, P., Ensbey, K., Bruce, Z., Inglis, P., Allan, S., Winter, C., Tollesson, G., Campbell, S., Lucas, P., Findlay, W., Kadrian, D., Johnson, D., Robertson, T., Johns, T., Bartlett, P., Osborne, G., & Boyd, A. (2013). 胶质瘤手术抽吸物:实验研究的可行肿瘤组织来源。《癌症》,5, 357-371. https://doi.org/10.3390/cancers5020357
Fahy GM, Wowk B, Wu J, Phan J, Rasch C, Chang A, Zendejas E. 玻璃化冷冻法保存器官:前景与最新进展。《低温生物学》。2004年4月;48(2):157-78. doi: 10.1016/j.cryobiol.2004.02.002. 勘误见:《低温生物学》。2005年6月;50(3):344. PMID: 15094092.
Frey, U., Egert, U., Heer, F., Hafizovic, S., & Hierlemann, A. (2009). 应用于脑切片细胞外电场高分辨率测绘的微电子系统。《生物传感器与生物电子学》,24(7), 2191-2198. https://doi.org/10.1016/j.bios.2008.11.028
Han, Z., Rao, J.S., Gangwar, L. 等. 玻璃化冷冻与纳米复温实现大鼠模型长期器官冷冻保存及维持生命的肾脏移植。《自然通讯》,14, 3407 (2023). https://doi.org/10.1038/s41467-023-38824-8
Hancock, C., Wetherington, J., Lambert, N., & Condie, B. (2000). 小鼠胚胎干细胞来源的神经祖细胞的冷冻保存及神经元分化。《生物化学与生物物理研究通讯》,271(2), 418-421. https://doi.org/10.1006/BBRC.2000.2631
Maccione, A., Gandolfo, M., Massobrio, P., Novellino, A., Martinoia, S., & Chiappalone, M. (2009). 一种精确识别细胞外记录神经元信号中峰电位的新算法。《神经科学方法杂志》,177(1), 241–249. https://doi.org/10.1016/j.jneumeth.2008.09.026
Pickford J, Apps R, Bashir ZI. 小脑顶核毒蕈碱受体调节的体外研究。《神经化学研究》。2019;44(3):627–635. doi: 10.1007/s11064-018-2613-9
Wakita, M., Kotani, N., & Akaike, N. (2015). 河豚毒素突然阻断哺乳动物中枢神经系统的兴奋性神经传递。《毒素学》:国际毒素学会官方期刊,103, 12-18. https://doi.org/10.1016/j.toxicon.2015.05.003
Wang C, Derderian KD, Hamada E, Zhou X, Nelson AD, Kyoung H, Ahituv N, Bouvier G, Bender KJ. 小脑可塑性缺陷导致SCN2A相关自闭症谱系障碍中感觉反射过度敏感。《神经元》。2024年5月1日;112(9):1444-1455.e5. doi: 10.1016/j.neuron.2024.01.029. Epub 2024年2月26日. PMID: 38412857; PMCID: PMC11065582.
Xue W, Li H, Xu J, Yu X, Liu L, Liu H, Zhao R, Shao Z. (2024) 人脑组织与神经类器官的有效冷冻保存。《细胞报告方法》。5月;4(5). https://doi.org/10.1016/j.crmeth.2024.100777
Qian X, Song H, Ming GL. 脑类器官:进展、应用与挑战。《发育》。2019年4月16日;146(8):dev166074. doi: 10.1242/dev.166074. PMID: 30992274; PMCID: PMC6503989.