¶ 移植的人类纹状体祖细胞在亨廷顿病动物模型中表现出功能性整合并调节宿主神经回路
琳达·斯卡拉穆扎 a,b,1、玛尔塔·里博迪诺 c,d,1、克里斯蒂安·卡萨里诺 a,b,2、玛尔塔·莫罗基 a,b,2、加布里埃拉·B·戈麦斯·冈萨雷斯 c,d,2、罗伯塔·帕罗里西c,d,2、爱德华多·索齐 e、贾科莫·图里尼 c,d、 瓦伦蒂娜 ·切拉托 c,d、保拉·孔福尔蒂 a,b、埃里奥拉·霍查 c,d、里卡多·托尼亚托 f、格蕾塔·加莱奥蒂 a,b 基亚拉·科尔迪列里b、玛丽亚·克里斯蒂娜·克罗斯蒂b、斯特凡诺·祖卡d,g、玛蒂娜·洛伦扎蒂c,d、 塞雷娜 ·博韦蒂d,g、保罗·斯帕亚尔迪h、克劳迪奥·德·斯佩拉蒂i、杰拉尔多·别拉h、 琳达·奥托博尼j、马林·帕尔马e、西蒙内·马埃斯特里a,b、达里奥·贝苏索a,b,、埃琳娜·卡塔内奥a,b,,3安娜丽莎·布福 c,d,**,3
a 米兰大学生物科学系,意大利米兰 20133
b 罗密欧与恩里卡·因韦尔尼齐国家分子遗传学研究所,意大利米兰 20122
c 都灵大学丽塔·莱维-蒙塔尔奇尼神经科学系,意大利都灵 10126
d 都灵大学卡瓦列里·奥托伦吉神经科学研究所,意大利奥尔巴萨诺 10043
e 伦德大学瓦伦贝里神经科学中心与伦德干细胞中心,瑞典伦德 22184
f 卡尔蔡司股份有限公司显微镜解决方案部,意大利米兰
g 都灵大学生命科学与系统生物学系,意大利都灵10123
h 帕维亚大学生物学与生物技术系,意大利帕维亚27100
i 行动、感知与认知实验室,圣拉斐尔健康大学,米兰 20132,意大利
j 病理生理学与移植学系(DEPT),迪诺·法拉利中心,米兰大学,米兰 20122,意大利
关键词:干细胞疗法 神经退行性 亨廷顿病 细胞移植 MSN (中等棘神经元) 纹状体
¶ 摘要
亨廷顿舞蹈症(HD)是一种致命的神经退行性疾病,由HTT 基因中CAG重复序列扩增引起。这会导致纹状体神经元进行性丧失和运动认知功能衰退。目前以降低体细胞不稳定性为目标的基因靶向方法虽显示出前景——尤其在早期治疗阶段——但无法修复疾病晚期已受损的神经元回路。因此,细胞替代疗法提供了一种重建受损纹状体回路的再生策略。本研究报道,通过形态发生素引导方案从胚胎干细胞分化获得的人源纹状体祖细胞(hSPs)在移植到HD啮齿类模型后能够长期存活,并重现腹侧端脑发育的关键特征。通过对移植细胞进行单核RNA测序,以前所未有的分辨率解析了它们的转录谱。该分析识别出D1型和D2型中等多棘神经元(MSN)、内侧神经节隆起(MGE)与尾侧神经节隆起(CGE)来源的中间神经元,以及区域特异性星形胶质细胞的转录特征。此外,我们证明移植细胞在移植后6个月会进一步成熟,获得预期的区域特异性转录身份。免疫组化结果证实移植物成分随时间保持稳定,并支持移植后从神经源性向胶质源性的转变。病毒追踪和电生理学检测等多种互补技术证明移植物具备解剖学和功能整合性。值得注意的是,对移植物活性进行化学遗传学调控可影响纹状体依赖性行为,进一步支持移植物有效整合入宿主基底神经节回路。这些结果共同为hSP移植物能具有体内功能整合能力的祖细胞群体,支持人源性干细胞在亨廷顿病及相关基底节疾病临床应用中的潜力。
¶ 1. 引言
亨廷顿病(HD)是一种致命的常染色体显性神经退行性疾病,由HTT 基因中的CAG重复扩增引起,导致纹状体投射神经元的逐渐丧失以及严重的运动、认知和精神功能障碍[1]。受影响最严重的神经元群体之一是纹状体投射中等棘状神经元(MSNs),它们构成人类纹状体神经元的90%以上,并且在基底神经节回路的调节中起核心作用。
旨在降低突变HTT(mHTT)水平的新兴治疗方法,基于反义寡核苷酸(ASO)[2]、RNA干扰(RNAi)、CRISPR基因编辑技术[3,4]以及小分子剪接变体调节剂的应用,在临床前和早期临床研究中已展现出潜力[5]。然而,这些方法仍面临重大挑战,包括等位基因特异性、脱靶效应及递送限制——这对纹状体等深部脑结构的影响尤为显著。此外,现有策略均未直接解决疾病进展过程中基底节区神经元结构与连接性受损的修复问题。
细胞替代疗法通过旨在替换受损神经元群体并部分恢复功能性纹状体回路,为帕金森病(PD)和亨廷顿病(HD)等神经退行性疾病提供了一种潜在恢复性治疗途径。该策略的概念验证已通过使用从腹侧中脑获取的人类胎儿祖细胞进行的初步临床和临床前研究在PD领域建立,部分患者表现出运动症状的显著长期改善[6]。然而疗效结果的差异性,以及伦理、物流和标准化方面的问题,限制了该方法的可扩展性和可重复性[6,7]。近年来,人多能干细胞(hPSC)分化方案的进展使得能够生成具有中等棘神经元(MSN)特性且保真度不断提高的神经元in vitro [8,9]。但关于这些移植物的长期身份稳定性、功能整合及表型影响等关键问题仍然存在——这些根本性问题与其治疗应用密切相关。
我们先前开发了一种基于时序暴露于形态发生素和小分子的分化方案,该方案重现了外侧神经节隆起(LGE)的发育过程,并能生成D1型和D2型纹状体中型多棘神经元前体细胞in vitro [8]。这些人类纹状体前体细胞(hSPs)在体外培养25天in vitro (DIV)内展现出关键转录特征与纹状体特性。本研究旨在探讨这些hSPs移植至化学损伤亨廷顿病啮齿动物模型后的in vivo 成熟度、整合状况及功能贡献。
通过单核转录组技术,我们对移植物进行了高分辨率分子特征解析,发现其中中型多棘神经元呈现富集现象,同时涌现出多种中间神经元亚型与星形胶质细胞。与此同时,我们通过解剖追踪及自发性与诱发型神经元活动分析,评估了神经环路层面的整合情况。最终,我们证实对人源纹状体祖细胞移植物进行化学遗传学调控可改变运动行为,为宿主纹状体环路的功能性整合提供了直接证据。
这些发现证实,LGE模式祖细胞不仅在移植后获得纹状体特性,还能形成一体化移植物,从而影响动物的行为反应,这增强了它们在亨廷顿病未来临床应用中的潜力。
¶ 2. 材料与方法
¶ 2.1. 人胚胎干细胞维持
人类胚胎干细胞H9系(WiCell)在包被有Cul-trex(120-180 μ克/毫升,Trevigen)的培养皿中,使用完整mTeSR1培养基(StemCell Technologies,85850)进行培养,并通过每日更换培养基维持培养长达三个月。传代时,细胞每周两次使用添加了0.5 mM EDTA(Sigma-Aldrich,324506)的PBS(Euroclone,ECB4053)进行解离。
¶ 2.2. 人胚胎干细胞纹状体分化
人胚胎干细胞(hESCs)分化为纹状体神经元的过程参照文献[8]所述方法进行。简言之,将细胞以1××10⁴个细胞/平方厘米的密度接种于Cultrex包被培养板,使用添加10μμM ROCK抑制剂Y-27632(RI;StemCell Technologies, 72307)的完整mTeSR™1培养基。神经诱导阶段采用10μμM SB431542与500 nM LDN193189(StemCell Technologies, 72234与72149)进行双重SMAD抑制,基础培养基为补充N2(Life Technologies, 17502048)及不含视黄酸(RA)的B27(Life Technologies, 17504044)的DMEM/F12(Life Technologies, 11320033),持续诱导12天。从第5天(DIV5)起添加200 ng/mL重组人SHH C-25 II(R&D Systems 464‑SH)与100 ng/mL DKK-1(PreproTech, 120‑30‑10UG),持续培养至DIV25。在DIV21时采用Accutase(StemCell Technologies, 07920)将细胞解离为单细胞,以2××10⁴个细胞/平方厘米密度重新接种于Matrigel GFR(StemCell Technologies, 354230)或Biolaminin 521(5μμg/mL, Voden, LN521‑02)包被的培养板继续培养。后续使用补充N2、含RA的B27(Life Technologies, 17504044)及20 ng/mL BDNF(PreproTech, 450–02–10UG)的DMEM/F12培养基维持培养,直至分化方案结束(DIV35)。
¶ 2.3. 体外细胞计数
在分化的关键阶段(第5、15和35天),细胞用冰冷的4%多聚甲醛固定,并进行中棘神经元命运获得标志物的免疫荧光染色。使用莱卡SP5共聚焦显微镜在40×倍放大倍数下采集图像。通过针对每种特定标志物开发的定制处理流程,采用ImageJ软件进行图像分析以增强图像质量并量化标志物阳性细胞。图像处理流程包括对比度增强、饱和度归一化(设定为0.35)、感兴趣区域边缘检测、使用10像素滚动球半径进行背景扣除、二值掩模转换、孔洞填充以及限定20-300像素尺寸范围的颗粒分析。DAPI染色用于优化和验证细胞分割。该方法能精确检测和量化标志物阳性细胞,各生物学重复和技术重复的平均计数值如下:Hoechst(7000/600)、GABA(6600/441)、DARPP32(1142/90)、CTIP2(3000/230)、SIX3(1170/195)、ISLET1/3(1080/220)、mCherry(6230/580)和HA(6180/530)。
¶ 2.4. 双DREADD人胚胎干细胞系的建立
为了对hESC H9细胞进行工程化改造以引入双向化学遗传系统Bi-DREADD[10],我们使用人类干细胞核转染试剂盒(82µL Solution 2 + 18µL Supplement 1;Lonza,VPH‑5022)对总计2×10个活细胞进行核转染,每次转染分别加入1µg的质粒AAVS1-TALEN-L(Addgene #59025)、AAVS1-TALEN-R(Addgene #59026)和AAVS1-pur-CAG-Bi-DREADD(Addgene #159457)。采用B-016程序进行核转染。转染后,将细胞铺于Cultrex®包被培养皿中,使用含RI的mTeSR™1培养基,于37◦℃培养箱中培养。第6天启动嘌呤霉素筛选(0.5 μμg/mL),持续三天。存活细胞团经解离后,通过流式细胞分选仪(FACSAria III SORP)分选mCherry阳性细胞。将单个mCherry阳性细胞接种至96孔板进行克隆扩增。扩增后的克隆转移至更大规格的培养体系,并在mTeSR™1培养基中持续培养。
为评估盒式载体是否正确插入,采用 NucleoSpin® Tissue 试剂盒(Macherey-Nagel,740952)从达到 80% 汇合度的克隆中提取基因组 DNA。使用 PrimeSTAR HS DNA 聚合酶(Takara,R010A)进行 PCR 筛选,该过程采用靶向 AAVS1 插入位点两侧同源臂左右连接区的引物(补充表 3)。通过电泳分析 PCR 产物,以确认 Bi-DREADD 盒式载体的靶向整合。
¶ 2.5. 表达jGCaMP7f和GFP的慢病毒质粒克隆
为生产表达钙指示剂jGCaMP7f的慢病毒颗粒,首先使用HindIII-HF限制性内切酶从Addgene质粒#104487中亚克隆相应编码序列,随后用T4 DNA聚合酶进行平末端化处理。纯化的线性化质粒经BamHI-HF酶切后,通过凝胶回收获得最终产物。受体质粒Addgene #22909经BamHI和PmeI双酶切并凝胶纯化。取100 ng线性化#22909载体,分别与30 ng平末端插入片段(实验组)或无菌水(对照组)通过T4连接酶在4◦℃过夜连接。次日取2 µl连接产物转化20 µl One Shot™ TOP10化学感受态细胞,42◦℃热激30秒后涂布于氨苄青霉素琼脂平板。隔日挑取四个单克隆于3 mL LB培养基中过夜培养,次日进行克隆扩增及质粒小量提取。小提质粒经BamHI和EcoRI-HF双酶切验证后,通过1%琼脂糖凝胶电泳确认片段插入,阳性克隆经Sanger测序验证后扩大培养进行大规模质粒提取。
采用类似流程将eGFP序列克隆至相同载体骨架:首先用AgeI和PmeI酶切Addgene质粒#22909以去除RFP编码序列。通过NotI酶切从Addgene质粒#13776获取eGFP序列,经T4 DNA聚合酶补平钝化后,再用AgeI进行二次酶切。通过凝胶提取分离eGFP片段。使用90ng载体骨架与30ng插入片段或水在16◦℃下进行过夜连接,随后按前述方法进行转化、单克隆筛选、酶切验证及桑格测序。
¶ 2.6. 体外钙成像
钙成像实验在DIV35天进行,细胞于DIV21天重新辅板至24孔Ibidi培养板。细胞与钙敏感染料Fluo-4 AM(Invitrogen, F14201;按1:1000比例溶于GibcoTM HBSS, 14025-092)共同孵育。移除培养基后,每孔加入500 μL Fluo-4染液,37◦℃孵育15分钟,随后用HBSS清洗两次。为稳定活细胞成像信号,每孔加入300 μL HBSS,细胞继续在37◦℃下孵育10分钟。
使用尼康TiE/CREST视频共聚焦超分辨率显微镜进行记录,该显微镜配备16通道LED、环境箱(37◦℃)和20×倍干式物镜。Fluo-4荧光染料被激发在 488 nm 波长下,以每秒 1 帧(1024×1024 像素)的速度采集图像,每个区域持续 4 分钟。先记录 3 分钟的基础活动,随后加入 10μM CNO(Biotechne, 49236)和 5μM SALB(Biotechne, 5611)后再记录 1 分钟,以评估配体激发的活性。
原始视频在Fiji(ImageJ)软件中进行处理,应用对比度增强(饱和度0.12%)和背景扣除(30像素滚动球算法),随后保存为AVI格式文件以便通过Calima软件进行分析[11, 12]。Calima软件校正了荧光漂白现象,并根据荧光强度识别出感兴趣区域(ROIs):通过帧平均(2.00-18.00)和强度阈值(0.03-0.1)来分离细胞体。荧光轨迹采用30秒基线进行标准化处理,超出基线变异范围的波动被定义为钙峰值。峰值数据以CSV格式导出(行=为时间点;列=为ROIs;数值=为0或1)。
采用RStudio分析流程,结合tidyverse、ggplot2和xlsx软件包进行峰值分析。针对基础状态和配体后状态,分别计算了活跃ROI的百分比及平均放电频率(即每个时间窗口内单个ROI的峰值计数)。
使用Calima软件通过分析ROI间钙事件同步性来评估功能连接。若ROI事件满足以下条件则判定为连接:发生在相同时间窗口内、距离不超过图像对角线长度的三分之一、振荡相似度高于0.7。代表性图像中用红线连接相互关联的ROI。
¶ 2.7. 动物与体内实验操作
涉及活体动物的实验程序严格遵循欧洲指令(2010/63/EU)、《意大利实验动物护理与使用法》(DL116/92)以及都灵大学关于动物福利的机构指南,并获意大利卫生部批准(授权号:327/2020-PR)。此外,都灵大学ad hoc 伦理委员会特别批准了本研究。所有涉及动物的实验均按照ARRIVE指南进行报告。
成年雄性无胸腺裸鼠(Hsd:RH-Foxn1rnu,体重200-250克,周龄7-8周)购自ENVIGO实验室。经过两周适应期后,通过立体定位坐标(毫米):AP -0.4、ML 3.7、DV 4.8/4.2 和 AP 1.2、ML 2.9、DV 4.8/4.2 注射喹啉酸(QA;0.12 M;各点0.25 μL)诱导单侧纹状体损伤。所有外科手术均在4%异氟烷(Isoflurane-Vet 100%,Merial Italy)与O2/N2O 30%:70%混合气体深度全身麻醉下进行。通过阿扑吗啡诱导旋转试验的行为学评估及术后组织学检查确认损伤建模成功。术后 3-4周,将4×10^5个分化15天的人干细胞单细胞悬液分两处植入立体定位坐标(毫米):AP 0.8、ML3.4、DV 4.4/3.7。移植注射的AP定位靶向中型多棘神经元最广泛缺失区域,即两个损伤位点的重叠处。移植细胞使用Accutase(StemCell Technologies, 07920)和10 μM RI解离,重悬于含N2、B27及75,000细胞/μL浓度RA的DMEM/F12培养基中(总体积5.3 μL)。 QA注射与细胞植入均使用汉密尔顿注射器钝头针(Neuros Syringe),以1 μL/min的恒定速率输注。背腹侧注射间隔保持2分钟暂停,末次注射后留针8分钟再缓慢撤出。
在突触追踪实验中,人源干细胞分别在体外培养第10天和第12天进行两次转导,使用由synapsin1启动子驱动的TVA-GP-GFP多顺反子慢病毒载体(Addgene编号#30195),在4 mg/mL聚凝胺(Sigma-Aldrich编号H9268)存在下以2的感染复数进行转导[10,13,14]。该慢病毒载体携带序列用于表达突触素启动子控制的组蛋白标签GFP、TVA受体(用于被携带mCherry报告基因的EnvA假型ΔG-狂犬病病毒选择性感染,即mRV)以及使mRV能够单突触传播的糖蛋白。在处死前一周,移植大鼠接受改良狂犬病毒(ΔG-RV,20–30××106 TU/mL)的移植体内注射,该病毒携带mCherry报告基因,用于标记与移植细胞形成突触连接的传入神经元,立体定位坐标(毫米)为:AP= -0.4、ML= -3.7、DV= − 4.8/− 4.2 以及 AP= +1.2、ML= -2.9、DV= − 4.8/− 4.2。
对于in vivo 钙成像实验,海马切片在DIV10和DIV12时被转导两次,使用编码钙指示剂jGCaMP7f(LV-hSyn-jGCaMP7f,1.18 ×109 TU/mL)或绿色荧光蛋白(LV-hSyn-eGFP,1.07 ×109 TU/mL)的慢病毒颗粒,用作钙不依赖性荧光发射的对照,在人突触素启动子下(Vector Builder,VB230110–1508fjn,pLV230110–1006asc),以10的MOI,在4 mg/mLpolybrene存在的情况下进行。手术后,头部伤口使用不可吸收丝线缝合(尺寸4-0,带BB针,Ethicon),动物在接下来的几天里休息。
¶ 2.8. 体内化学遗传学调控移植物活性
自移植后6个月起,研究人员在基线状态及施用化学遗传配体CNO(3毫克/千克,Hello Bio产品HB1807)与SALB(10毫克/千克,Hello Bio产品HB4887)后,分别对移植DIV15双DREADD人源祖细胞的大鼠及仅奎宁酸损伤对照组大鼠进行了旷场运动能力评估和玻璃圆柱(直径20厘米)内的理毛行为观察。每种药物治疗间隔一周实施,以避免药物相互作用对实验结果的干扰。行为学测试分别于CNO给药后60分钟和SALB给药后15分钟启动。仅奎宁酸损伤组包含假手术大鼠(N=8)——注射5.3微升细胞重悬培养基(DMEM/F12补充N2、B27及维甲酸),以及空载双DREADD移植组(N=2)。
在开阔场地(70 ×70 厘米竞技场)中,30分钟内的平均速度和覆盖的距离使用 Ethovision®(Noldus)进行了测量。然后,大鼠在玻璃圆筒测试中被录像20分钟,并且正确和错误的梳理序列[15,16]被手动注释。
¶ 细胞化学和免疫组织学方法
细胞培养物用冰冷的4%多聚甲醛固定15分钟,用0.5% Triton X-100(Sigma-Aldrich,T8787)在PBS中透化10分钟,并在室温下用5%正常山羊血清(Vector Laboratories,S-1000)封闭1小时。随后细胞与一抗(附表4)在4◦°C下孵育过夜。将适当的Alexa Fluor标记的二抗(Life Technologies)按1:500稀释,并与0.1μμg/mL Hoechst核染色剂(Invitrogen,33342)混合进行核复染。使用LAS-F软件控制的Leica TCS SP5共聚焦激光显微镜(Leica Microsystems),通过40× (倍、数值孔径1.4)的油镜(放大倍数=1.7)采集图像。
在2MPT和6MPT时间点,对大鼠进行深度全身麻醉后经心脏灌注:先灌注生理盐水,随后用冰冷的4%多聚甲醛(溶于0.1 M磷酸盐缓冲液PB,pH 7.4)。立即取出脑组织并在4◦℃下后固定2小时。随后将脑组织置于30%蔗糖溶液(Sigma-Aldrich, S0389,溶于0.1 M PB)中进行冷冻保护,在−80◦℃下包埋于冷冻切片介质(Bio-Optica, 05–9801),并冷冻切片为40μμm厚冠状切片。切片保存于−20◦℃抗冻溶液中待用。对于体内钙信号记录样本,灌注后移除光极电极,并通过30μμm厚矢状切片验证其定位。
免疫荧光反应在漂浮脑切片上进行,切片于4◦℃条件下在0.01 M PBS溶液(pH= 7.4)中孵育48-72小时,该溶液含1% Triton X-100、按1:20比例配制的正常驴血清及一抗(附表4)。使用抗CTIP2一抗时,需在抗体孵育前进行80◦℃ Tris/EDTA抗原修复处理30分钟。切片随后在室温下于0.01 M PBS溶液(pH 7.4)中孵育2小时,该溶液含有0.5% Triton X-100、1:20正常驴血清、Alexa Fluor荧光染料标记的种属特异性二抗(Jackson Immunoresearch)及DAPI(Thermo Fisher Scientific, 62247)。载玻片采用Mowiol(Sigma-Aldrich, 81381)进行封片。使用Axioscan 7全自动显微玻片扫描系统(卡尔蔡司显微镜)采集全脑切片的荧光拼图影像。所有图像均通过ZEN共聚焦显微镜LSM980与ApoTome Axio Observer Z1(卡尔蔡司显微镜)采集。采用ZEN显微镜软件(卡尔蔡司显微镜)和Fiji(ImageJ)软件调整图像对比度。通过人工标注基于显微镜下观察HuNu阳性移植细胞的位置,区分同侧与对侧半球,对迁移细胞的分布进行定性分析。为此,我们沿AP轴每间隔240μμm对每个动物选取一片40μμm厚脑切片进行分析。通过双皮质素DCX共表达特征来区分神经元。
¶ 2.9. 定量组织学分析
移植物体积的测量方法是:在处死后2个月和6个月的小鼠中,每间隔240微米采集一个冠状切片进行取样。每个切片中的移植物区域通过高密度HuNu阳性细胞的存在来界定。移植物存活的标准是存在通过HuNu免疫染色或GFP报告基因表达识别出的人类细胞致密核心。体积测量采用卡瓦列里法进行插值计算。
细胞密度以每平方毫米HuNu阳性细胞数量计算。Ki67、CTIP2、GABA、DARPP32和SOX9在HuNu阳性细胞群中的移植表达量通过以下方式量化:每张切片选取2-3个视野,每个移植物取2-3张切片。各标志物在HuNu阳性细胞中的平均计数如下:2MPT样本中,= ~233个CTIP2+HuNu+细胞/ ~290个HuNu+细胞,= ~89个GABA+HuNu+细胞/ ~433个HuNu+细胞,= ~50个SOX9+HuNu+细胞/ ~575个HuNu+细胞,= ~34个Ki67+HuNu+细胞/ ~565个HuNu+细胞;6MPT样本中,= ~195个CTIP2+HuNu+细胞/ ~374个HuNu+细胞,= ~235个GABA+HuNu+细胞/ ~374个HuNu+细胞,= ~129个CTIP2+GABA+HuNu+细胞/ ~195个CTIP2+HuNu+细胞,= ~30个CTIP2+hDARPP32 GABA+HuNu+细胞/ ~195个CTIP2+HuNu+细胞,= ~122个SOX9+HuNu+细胞/ ~423个HuNu+细胞,= ~7个Ki67+HuNu+细胞/ ~287个HuNu+细胞。
¶ 2.10. 移植物输入与输出的分析
在病毒示踪分析中,使用Axioscan显微镜(蔡司)采集图像,并采用ImageJ软件(美国国立卫生研究院)进行处理与分析。根据无胸腺裸鼠脑图谱[17]的分类标准,结合DAPI染色切片显示的解剖学参照点,将神经元归属至特定脑区。通过多通道免疫荧光技术鉴定宿主(HuNu阴性)在纹状体外区域的被追踪细胞(mCherry阳性GFP阴性)。使用ImageJ(美国国立卫生研究院)对每只动物沿前后轴至少35张切片进行细胞计数。共分析三组脑切片系列,每组包含至少11张间距40微米的切片。所选系列起始于特定前后坐标:前囟+4.20毫米、+4.12毫米和+3.96毫米。
关于移植物输出,由移植物来源的hNCAM+纤维在大脑的纹状体目标区域中占据的阳性分数面积(即整个感兴趣区域中阳性像素的百分比)在手动使用ImageJ-Fiji软件追踪的核区域上进行了量化。在目标区域中有供体迁移细胞的样本已被排除在此分析之外。
¶ 2.11. 组织透明化与光片成像
一只无胸腺成年大鼠的大脑在遭受损伤后,接受了经突触素1启动子驱动的TVA-GP-GFP(Addgene,#30195)多顺反子慢病毒载体转导的细胞移植,随后采用iDISCO透明化方法[18]进行光片显微镜检测,并针对大鼠大脑优化了脱脂步骤[19]。
将大脑沿正中矢状面切开,两个半球分别进行处理。半球先后在PBS/0.02% NaN3(3×1小时)和B1N缓冲液(0.1% Triton X-100/甘氨酸/NaOH/0.02% NaN3)中清洗,随后通过B1N/甲醇梯度(20%至100%)脱水。接着依次用100%甲醇、100%二氯甲烷和100%甲醇清洗,再通过反向B1N/甲醇梯度复水,随后用B1N缓冲液、SdC缓冲液(0.02% NaN3/甲基β-环糊精)和PTwH(PBS/0.1% Triton X-100/0.05% Tween-20/10 mg/mL 肝素/0.02% NaN3)进行清洗。样本在PTx.2(PBS/2% Triton X-100)中室温清洗4次(每次1小时),随后在渗透液(PBS/0.2% Triton X-100/20% DMSO/0.3 M甘氨酸)中孵育过夜。在封闭液(PBS/0.2% Triton X-100/10% DMSO/6%驴血清)中37◦℃孵育24小时后,样本与一抗稀释液(PTwH/5%DMSO/3%驴血清)共同孵育:抗GFP按1:100、抗RFP按1:1500比例溶于含5% DMSO与3%正常驴血清的PTwH中,37◦℃振荡孵育11天。一抗孵育结束后,样本用PTwH清洗(6×1小时),随后在37◦℃条件下与溶于PTwH/3%正常驴血清的二抗共同孵育10天。接着用PTwH清洗(6×1小时),日间每小时追加清洗,静置过夜。组织透明化处理中,样本依次经20%、40%、60%、80%和100%甲醇梯度脱水(每步1小时),100%甲醇过夜处理,随后在66%二氯甲烷/33%甲醇中振荡孵育过夜,转移至100%二氯甲烷,最后用二苄醚(DBE)进行透明。透明化半球使用超显微成像系统II(LaVision Biotec)进行成像,该系统配备sCMOS相机(Andor Zyla,型号5.5)和4×物镜(LaVision LVMI-Fluor 4×/0.3)。采用两种激光配置及对应发射滤光片进行成像:680/30 nm用于RFP检测,525/50 nm用于背景信号与GFP检测。通过InspectorPro软件(LaVision Biotec)以10 µm层间距进行Z轴堆叠采集。采用马赛克采集法获取多个重叠堆叠(10%重叠度)以覆盖完整半脑。使用Arivis(3.01版)对追踪细胞进行分析及三维重建。大鼠脑区图谱参照[20](https://www.ebrains.eu/brain-atlases/referenceatlases/rat-brain)。
作为3D对象导入以实现区室化。染色强度信号(移植物为GFP阳性/初级传入神经示踪为RFP阳性-GFP阴性)与基于体积阈值的分割方法结合使用。完成分割后,所有待区室化的对象被分组并分配至对应的图谱区域。
¶ 2.12. 体内光纤测光法
光纤光度记录采用时间相关单光子计数系统(TCSPC,Becker Hickl GmbH),该系统依据Meng等人[21]的研究方案开发。在大鼠脑内植入光极后,通过多模光纤跳线将光极与探测器和激光器连接。该跳线传递473纳米皮秒脉冲二极管激光(频率50 MHz/功率0.2 mV,等效功率在光纤末端测得),用以激发表达荧光基团的细胞群体,随后通过同一根跳线以20 Hz频率收集发射光子并传输至探测器。探测器由固态光电倍增管构成,可将荧光信号(光子计数)转化为电信号,通过数据采集卡传输至TCSPC记录系统。由此,光纤光度技术得以在细胞群体分辨率层面研究移植物来源的光子信号。
在该方案中,6只大鼠接受了jGCaMP7f-hSPs移植,4只接受了GFP-hSPs移植。这些大鼠在记录开始前2周接受了光极植入手术。光纤尖端(芯径:0.3毫米;长度:4.5/5毫米,B&H品牌)通过颅骨钻孔植入,目标定位于移植体的上部区域,立体定位坐标为(毫米):前囟后= +0.8毫米,中线左=3.5毫米(误差±0.1),依据文献[17]。采用无菌微型磨钻(M1-1.2*3毫米)和牙科水泥(Paladur)将植入物固定并稳定于颅骨。
在大鼠自由活动于开放场地(该条件称为清醒状态,AW,箱体尺寸:58 ×37 ×18.5厘米)或深度麻醉状态下(AN,剂量:腹腔注射氯胺酮-甲苯噻嗪[70毫克, 30毫克/千克]),我们记录了从6至10MPT的自发钙信号。每只动物我们持续记录了约50次AW状态、30次麻醉状态及6次FSK状态下的移植物活动,每次记录持续608秒(6分50秒)。五只动物(3只jGCaMP7f,2只GFP)因以下原因被排除分析:两只大鼠(1只jGCaMP7f,1只GFP)的光电极意外脱落;一只jGCaMP7f大鼠出现癫痫发作而被排除;另一例移植物位于纹状体外围;最后一只GFP大鼠因死后组织学分析无法确认光电极位置。
此外,用于分析的信号轨迹是根据轨迹稳定性(恒定基线光子检测百分比,亦称本底噪声)与信号质量(信噪比)的评估结果筛选的。在信号校正后仍存在噪声信号、且持续时间超过总时长21%的 recordings 已被排除在分析之外(图 S5a)。足底电击(FSK)信号轨迹的筛选标准与刺激前后3秒评估区间所采用的标准一致。因此,最终纳入分析的数据为每只大鼠平均25个清醒状态(AW)记录、22个麻醉状态(AN)记录,以及4-5个FSK记录。
对表现出自发活动(jGCaMP7f移植组)或显著荧光信号(>1000光子/秒,0.2 mV激光功率;GFP移植组)的大鼠施加FSK可诱发开放场中的激发反应。大鼠在不接受FSK刺激的条件下于室内适应2天(每天20分钟)。测试当日,大鼠被置于同一电击箱室(Habitest,型号H13-15)中。每次实验以2分钟无刺激期开始,随后施加两次电刺激(强度0.2-0.7 mA,持续时间0.5-1秒),以2-3分钟的伪随机间隔传递(图4g)。每只大鼠每日最多接受两次实验,直至完成5-6次实验。同步录制20 Hz视频以将光纤记录信号与刺激时间对齐。
¶ 2.13. 纤维光度法钙信号分析
¶ 2.13.1. 原始轨迹的预处理
光纤光度信号通过定制Matlab脚本(GSE302876)进行处理。我们首先对信号施加低通(5 Hz)和高通滤波器(0.02 Hz),分别用于校正高频噪声和缓慢漂移,随后采用平滑滤波器(时间窗口为1秒)以补偿光漂白效应。接着,为消除不同大鼠间的个体差异,我们使用ΔF/F= (F-F0)/F0, 对绝对荧光信号进行归一化处理,其中F0 表示整个记录期间的平均信号值。
¶ 2.13.2. 峰值检测
钙瞬变(峰值)采用针对我们数据调整的启发式方法进行检测(设置:最小峰间间隔0.7秒,最小显著性0.5,阈值为平均信号的2.5倍标准差),该方法综合考虑了钙峰值检测中常用的标准特征[22][23,24]以及jGCaMP7f荧光蛋白的特殊性质[25]。
信号特征,即最大峰值振幅(相对于基线并在每次记录中对齐最大峰值振幅后取平均值)和频率(在每次记录的前400秒内检测),在不同条件和实验组之间进行了计算。对于特定比较中轨迹数量在各组或条件下差异较大的情况,所考虑的样本量由最小样本量决定,并通过从较大组中随机选取等效数量的轨迹进行调整。
¶ 2.13.3. FSK响应分析
峰值检测如上所述进行,不同之处在于轨迹标准化:F0 是在局部计算的,基于刺激前2.5秒的信号,然后从刺激后信号中减去。钙瞬变与各组的FSK时间进行同步锁定。平均荧光信号的变化量(ΔF)是通过刺激施加前后3秒时间窗口计算的(FSK响应,刺激锁定条件)。所有动物对每种刺激的反应通过事件相关热图进行可视化。为验证FSK响应的特异性,还通过将瞬变与从均匀分布中抽取的随机时间点对齐(随机对齐条件)来计算ΔF 。
¶ 2.13.4. MEA在离体脑切片上的记录
使用BioCAM DupleX系统(3Brain)配合CorePlate™ 1 W 38/60 MEA芯片记录神经元活动。经异氟烷麻醉后,对双向DREADD移植大鼠实施断头处理,并经心脏灌注40 mL NMDG-HEPES溶液。在室温下使用振动切片机于碳氧合(95% O2–5% CO2)NMDG-HEPES溶液中以10◦切割角度制备同侧半球300μμm厚旁矢状脑切片。将切片转移至充满碳氧合NMDG-HEPES溶液的恢复室,先于37◦℃恢复10分钟,再在室温(~25◦℃)1X正常林格溶液中继续恢复30分钟。随后将切片置于干燥MEA芯片上,确保移植区等目标区域与电极保持最佳接触。芯片放大电路通过60 dB全局增益实现0.1–5 kHz带通滤波,足以记录快速振荡活动。采用蠕动泵或注射泵以2-4 mL/min流速持续灌注1X正常林格溶液。灌注系统配备进出口管路以确保培养基持续更新与氧合。根据制造商建议对管路实施接地处理以降低灌注系统引入的低频噪声。实验开始时通过体视显微镜获取切片数字图像,在post-hoc 分析期间将数字图像叠加于活动图谱以识别切片中移植区与宿主区。切片定位后,持续灌注1X正常林格溶液至少10分钟使系统稳定并观察基础活动。后续依次进行: 20μμM DA灌注14分钟,1X正常林格溶液冲洗5分钟,继而使用10μμM CNO或20μμM SALB处理10分钟验证响应性。原始数据通过BrainWave软件(3Brain)分析,采用精确时序 spike 检测(PTSD)算法进行spike检测,各电极检测阈值设为基线信号标准差的7倍[26]。信号经100 Hz高通滤波分离多单元活动,使用时基爆发检测算法定义爆发事件(至少连续3个spike且最大峰间隔≤80 ms)。仅将记录到持续spike活动的活跃电极纳入爆发分析。为精确定位信号解剖来源,将记录前获取的明场图像叠加至电极布局图,实现电生理数据的空间映射,从而精确关联spike活动与目标移植区。
¶ 2.13.5. 核仁分离与小核糖核酸测序
在6MPT时,从n = 4只大鼠的纹状体中解剖出n = 6个移植核心样本,并进行快速冷冻。同样,hSPs在所需时间点从培养板中分离,快速冷冻并保存在-80摄氏度。直到进行snRNAseq处理。核分离及snRNAseq样本制备均遵循Fiorenzano等人[27]所述流程。简言之,核分离过程中样本在冰上解冻后转移至玻璃匀浆器,加入1 mL核裂解缓冲液(含0.32 M蔗糖、6 mM CaCl2、3 mM MgAc、0.1 mM Na2EDTA、10 mM Tris_HCl pH 8.0、1 mM DTT、0.1% Triton X),并补充0.4 U/μL RNA酶抑制剂(Ambion与SUPERase In,Invitrogen)。使用松杵匀浆10次制备核悬浮液,再用紧杵追加匀浆10次,4◦C条件下900× g离心15分钟。所得核沉淀根据体积量重悬于200-400μL预冷洗涤缓冲液(含无RNA酶PBS、0.1% BSA组分V、0.4 U/μL RNA酶抑制剂Ambion™/SUPERase In™以及1:1000 DRAQ7染色液)。随后通过配备100μm喷嘴的FACSAria III流式细胞仪进行荧光激活核分选,依据DRAQ7染色信号与事件尺寸(前向/侧向散射)完成分选。每个样本收取12000个细胞核至BSA预包被DNA低吸附管,使用Chromium Single Cell 3´ 芯片捕获单细胞,经混合扩增后通过Bioanalyzer检测文库质量,最终在Illumina NovaSeq 6000平台上进行100 bp双端测序。
¶ 2.14. 生物信息学
¶ 2.14.1. 小核糖核酸测序数据预处理
对四只大鼠共计34874个细胞核进行了测序。单核RNA测序获得的测序读数经过质量过滤、修整,并通过基于Nextflow工作流管理器[28]的nf-core scrnaseq 管道v2.5.1与参考基因组进行比对。该流程首先使用FastQC v0.12.1(https://www.bioinformatics.babraham.ac.uk/projects/fastqc/)检测测序读数质量,随后通过Cell Ranger(v7.1, 10X Genomics)将测序读数与参考基因组比对。具体而言,Cell Ranger采用STAR v2.7.2a比对软件[29],将测序读数与合并Homo sapiens (hg38)和Rattus norvegicus (R6.0)组装而成的定制参考基因组进行比对,并利用Samtools v1.17.0[30]过滤比对结果。采用的参考基因组支持对每个细胞进行物种来源鉴定,从而仅保留人类细胞。此外,该流程还识别每个读数的细胞条形码(CB)与唯一分子标识符(UMI),最终生成记录每个基因及每个细胞分子计数的矩阵。
¶ 2.14.2. 环境RNA去除、细胞筛选与质量控制
所有下游分析均使用Seurat v5.0.1对17679个人源细胞核进行。通过Read10X函数将计数矩阵导入R v4.3.1环境,并利用在空载(无细胞)液滴中检测到的RNA转录本,通过celda包v1.18.1中的DecontX[31]校正环境RNA的影响。针对每个样本,评估了各细胞表达基因数量、总计数及线粒体RNA百分比的分布。仅保留总RNA计数在300-30,000范围内(in vitro 样本为300-20,000)、表达基因数在300-6000之间且线粒体RNA转录本低于1%的细胞。最终移植物样本和in vitro 样本分别保留17,366和10,218个细胞。
¶ 2.14.3. 归一化与降维
数据标准化、缩放和高变特征选择通过SCTransform 函数执行,保留3000个表达量最高的高变基因(HVGs),这些基因至少在5000个细胞中表达,通过利用RunPCA 函数进行主成分分析(PCA)实现了线性降维。通过观察肘部图,我们分别为移植样本和in vitro 样本保留了50个和30个主成分(PCs)用于后续分析。
¶ 2.14.4. 非线性变换与批量集成
采用Harmony[32]批次校正整合方法中的Run-Harmony 函数以消除样本间的技术变异。使用选定的主成分通过RunUMAP 函数执行非线性降维。通过CellCycleScoring 函数利用经过筛选的已知细胞周期标志基因列表推断细胞周期状态。随后分别采用DimPlot 和FeaturePlot 函数绘制均匀流形逼近与投影(UMAP)图,以检验细胞基于来源样本及目标特征的分布均匀性。
¶ 2.14.5. 聚类与人工标注
Louvain算法,在FindNeighbors 函数中实现,被用来基于基因表达谱的相似性聚类细胞。为了设置聚类粒度,分别为移植和in vitro 样本选择了0.65和0.25的分辨率参数。为了注释已识别的细胞簇,采用了手动策划的标记辅助方法,通过检查来自文献的已知标记基因的表达,从而能够为每个簇分配准确的细胞类型。在移植细胞注释之后,随后的分析包括归一化以及线性和非线性降维,仅在神经群体上进行(排除星形胶质细胞)为双重验证所获得的注释结果,采用FindAll- Markers 函数对每个细胞簇中的差异表达基因进行鉴定。若基因在模块中满足以下条件则被视为差异表达:对数倍数变化(logFC)大于0.25、校正后p值低于0.05,且在至少25%的细胞中表达(min.pct = 0.25)。此外,在这些标志基因中仅保留阳性标记(即上调表达基因)(only.pos = TRUE)。分别选取移植物样本和in vitro 样本中每种细胞类型对数倍数变化最高的前30个与前50个差异表达基因,通过DoHeatmap 函数将其表达量以热图形式进行可视化。
¶ 2.15. 统计分析
使用GraphPad Prism 8.0软件(GraphPad Software,美国圣地亚哥)进行统计分析。所有数据均采用鲁棒ROUT方法(Q=1%)进行离群值识别统计评估,该操作在后续分析前实施。通过此方法识别的离群值均被剔除,以确保数据完整性和分析一致性。当p值满足以下条件时视为具有统计学意义:<0.05*;<0.01**;<0.001***;<0.0001****。所有统计分析细节均记录于专用表格(附表5)。
¶ 3. 结果
¶ 3.1. 人源性脊髓移植物在体内成熟过程中重现了腹侧大脑皮质的发育轨迹,包括纹状体和胶质细胞生成谱系。
我们先前已证明,通过形态发生素引导方案可在DIV25期内生成功能性中型多棘神经元[8],这支持了其在亨廷顿病细胞替代治疗中的应用。为探究其发育潜能in vivo,我们将这些人源干细胞在DIV15期移植至裸鼠的喹啉酸损伤纹状体中。大体解剖评估显示,大部分移植体(在6项独立实验中占比64.3%)在移植后存活达2-10个月,这表明其在宿主损伤纹状体中具有强大的适应性与恢复力(附表1)。
在6 MPT时,分离成熟的人源纹状体祖细胞移植物核心(位于纹状体的主要移植物团块),并制备用于单核RNA测序(snRNAseq)(图1a)。对来自四只大鼠约35000个细胞核进行测序,其中17679个被鉴定为人类来源并保留用于表征移植物。这种高分辨率转录组分析揭示了多样的神经元和胶质细胞群体。通过使用已确立的标记基因进行人工注释(图1c、S1d),并借助均匀流形逼近与投影(UMAP)和点图可视化(图1b;S1a-2b),在四个不同移植物中鉴定出具有一致特征的细胞群体(图1d、S1b)。对神经元组分的亚群分析显示,平均以D1-MSN群体为主(占神经元的21.47%),以及定向分化的D2-MSN前体群体(6.38%;图1b、d)。此外,我们鉴定出多个在转录谱上与MGE来源谱系一致的中间神经元亚型,其 collectively 占神经元的55.81%,包括一个显著的LAMP5表达MGE中间神经元群体(33.24%)。同时,CGE来源的中间神经元占神经元群体的8.88%(图1b、d)。将snRNA谱通过标签转移分析映射至小鼠空间转录组数据集,证实了D1-和D2-MSNs的纹状体定位,以及MGE与CGE来源中间神经元的皮层分布(图1e)。此外,与成人单细胞数据集[33]的比较显示与成熟人类MSNs具有高度转录相似性(图1f, g),而移植来源的CGE和MGE中间神经元分别更近似于成年CGE中间神经元、LAMP5-LHX6群体及吊灯形细胞成年群体,由此验证了它们的身份(图1f)。

图1. hSP移植物的snRNAseq分析。(a) snRNAseq工作流程示意图。按细胞类型着色的神经移植细胞UMAP图。(b) 热图展示移植样本中各细胞类型内logFC值最高的前30个差异表达基因的表达情况。© 柱状图显示四只分析大鼠中移植细胞的神经元类型比例及其相对平均值。(d) 按细胞类型划分的神经元移植细胞在Visium成年小鼠脑空间转录组数据集上的标签转移可视化。(e) 按数据来源着色的UMAP图,展示本研究中的神经元移植数据与已发表成人健康个体人脑snRNAseq数据集[10]的整合结果。(f) 标签转移后移植神经元与成人[10]神经元相似性得分的热图。
除神经元群体外,snRNAseq还显示移植细胞中平均有69%具有非神经元性的星形胶质细胞特性(图S1a、f),这一点通过已确立的胶质细胞标志物(如AQP4、GFAP 和SLC1A3 ()的表达得到证实(图S1c、d))。长期移植体内存在星形胶质细胞的情况,与人类多巴胺能细胞在帕金森病大鼠模型中移植的研究结果相呼应[10,13]。
为明确该星形胶质细胞群体的身份特征,我们采用经筛选的星形胶质细胞基因集(436个基因,[34],图S2a,附表2)对细胞进行评分,由此识别出六个不同的星形胶质细胞亚群(图S2b)。通过将空间标签映射至小鼠Visium数据集,发现亚群0、2、3、4具有纹状体特征,而亚群1和5则与皮质区域相符。在亚群0、1和3中还检测到嗅球特征(图S2c)。将其映射至成人星形胶质细胞数据集[33]后,不仅证实了亚群0和4的纹状体区域特性,还揭示了它们与大脑皮层及间脑结构的相似性(图S2d,e)。总体而言,这些研究结果表明移植来源的星形胶质细胞主要呈现端脑特征,且在多数情况下具有纹状体区域特性。为探究观察到的细胞异质性是否{hSP}细胞制备物中已存在in vitro ,我们对用于移植的同批次{hSP}进行了单核RNA测序。根据[8]方法分化后(图S3a),这些细胞显示出分化为成熟中型多棘神经元的能力in vitro (图S3b)。在移植时间点DIV15,细胞群主要由同质神经祖细胞构成(图S3d-g)。但到DIV35时,我们观察到MGE样和GE样前体细胞以及早期中型多棘神经元的出现(图S3d-g)。值得注意的是,一个微小但独特的亚群表达了神经胶质细胞标志物,如SOX9、SOX10、S100B、OLIG2 及GFAP (图S3c),提示此时in vitro 已有胶质祖细胞存在。不能排除这些细胞对6MPT时发现的星形胶质细胞群有所贡献。
总之,这些发现表明人类纹状体前体细胞移植物会沿着腹侧端脑发育轨迹经历in vivo 成熟过程,最终形成由纹状体投射神经元、中间神经元和星形胶质细胞构成的区域化组织且分子多样性的结构。这一发育进程包含神经源性向胶质源性的转化,以及仅被in vitro 分化过程部分捕获的发育轨迹,从而凸显了宿主环境在促进移植物成熟与结构复杂化中的关键作用。
¶ 3.2. 人源性多能干细胞在体内长期成熟过程中,逐渐获得纹状体特征及胶质细胞生成潜能
长期单核RNA测序分析显示,移植组织包含中型多棘神经元、中间神经元和星形胶质细胞,其细胞组成与内源性纹状体细胞谱高度相似。为验证并补充这些转录组学发现,我们在6个月后移植时间点对三组独立实验样本进行了免疫组织化学分析(图2a)。总体而言,移植核心区始终保持稳定的体积(图S4a、d)和细胞密度(图S4b),检测到的细胞增殖可忽略不计(图S4c)。
对星形胶质细胞转录因子SOX9的免疫标记证实了胶质细胞群的存在,占移植细胞的32.9 ± 7.4%(图2b;图S4e)。我们随后聚焦于神经元组分,因转录组数据表明CTIP2(BCL11B)和GABA标记物在移植源性神经元中广泛表达(图S1e)。免疫染色显示SOX9与CTIP2的重叠极少,并确定移植物内56.0 ± 3.2%的神经元为CTIP2阳性(图2b)。其中80.1 ± 8.1%共表达GABA(图2c、d),15.9 ± 5.4%为CTIP2、GABA与DARPP32三重阳性,提示成熟中棘神经元的存在(图2c、d)。已知在D1-或D2-MSNs中分别表达的P物质(SubP)和前脑啡肽(pENK)的表达进一步证实了这一结论。转录组学证据表明在6MPT时存在两种MSN亚型(图2e,e’)。总体而言,这些发现证实了移植核心区内长期存在MSN、MGE源中间神经元和星形胶质细胞,且转录组与蛋白质水平鉴定结果一致,该现象在所有实验重复中均得到一致观察。
与中间神经元和胶质细胞的存在相一致,我们还观察到从移植物到宿主实质的大量迁移现象,且存在个体间差异(图2f;图S4f)。迁移神经元表达双皮质素(DCX)——一种未成熟迁移神经元的标志物,并同时呈现迁移态和更高分化度的形态特征(图2g, g’)。这些细胞优先定植于前额新皮质,可抵达上层区域(图2f;图S4f)。表达SOX9(星形胶质细胞谱系)或SOX10(少突胶质细胞谱系)的胶质细胞也沿着特定迁移路径被检测到(图2h, i),主要占据白质束,并同时向前后方向扩散——包括对侧半球(图2f)。这种迁移行为反映了人源多能干细胞移植物在宿主大脑中的主动整合过程。
对in vitro 分化后人SPs的单核RNA测序揭示了一小部分胶质祖细胞亚群的存在,印证了胶质细胞群体的出现in vivo (图S3c)。为探究这种胶质生成潜能的演进过程,我们分析了不同时间点移植核心的细胞组成。移植后2个月时,约80%的移植细胞表达CTIP2,而仅有10.1±5.61%的细胞呈SOX9阳性。至移植后6个月时,SOX9阳性细胞群增长至三倍,与此同时CTIP2阳性细胞减少三分之一,而GABA能神经元数量则增加三倍(图2j)。这些发现共同表明,hSPs会随时间推移持续向神经元分化,同时通过激活内在的胶质生成程序来响应in vivo 环境信号。
¶ 3.3. 移植细胞表现出与宿主纹状体回路的整合
为研究hSP移植物重建受损纹状体神经环路的潜力,我们检验了其从解剖学适配区域接收传入输入,并向典型纹状体靶区投射的能力。采用基于突变狂犬病病毒的逆行单突触追踪方法研究了宿主至移植物的连接性(图3a;[10, 14])。移植后2个月,通过连续切片的免疫组织化学分析,在所有五个受检大脑的纹状体外区域均识别出宿主传入神经元,表明人干细胞源纹状体祖细胞早期已稳健整合入宿主长程神经环路。宿主追踪的输入信号主要定位于同侧运动皮层(43.2 ± 8.9%)和丘脑(56.8 ± 8.87%),这两个区域均向纹状体投射(图3b)。在皮层内,大部分标记的传入纤维(81%)分布于深层(V–VI层),其余19%分布于上层(II–III层)(图3b),这与内源性皮质纹状体神经元向纹状体投射的层状分布特征一致。移植后6个月,对两只移植大鼠进行分析,在皮层和丘脑区域再次识别到宿主传入纤维,其分布与早期时间点相似,表明移植物连接性随时间推移保持稳定(图3b’)。
为了更全面地了解传入神经的来源,我们对一只移植后6个月的大鼠进行了全脑透明化处理,并对移植物连接进行成像分析。该研究证实了来自皮层和丘脑的输入,同时还揭示了黑质(SN)、苍白球(GP)和腹侧被盖区(VTA)的传入投射(图3c,补充视频1)。这一发现凸显了全脑透明化成像技术的优势——它能降低传统切片采样方法常伴随的结构漏检风险。但需要注意的是,我们尚不能排除个体差异对结果的影响。为了研究移植物到宿主的神经支配,我们在2个月移植后绘制了hNCAM阳性轴突在前后轴上的分布。来自移植细胞的投射到达了多个基底神经节目标,包括SN(21.6 ± 2.3 %)和GP(35.3 ± 4.4 %),它们分别是直接和间接纹状体通路的主要目标(图3d, e)。额外的人类轴突也到达了间接纹状体例如丘脑底核(STN;24.7 ± 4.6%)和腹内侧丘脑核(VM;13.2 ± 3.2%)。在6MPT时,向黑质(SN)、苍白球(GP)和腹内侧丘脑核(VM)的投射保持相对稳定(分别为26.8 ± 5.0%、22.9 ± 8.9%、8.89 ± 5.14%),而向丘脑底核(STN)的投射则显著减少(1.80 ± 1.80%)(图3d,e)。值得注意的是,这种现象伴随着内囊(IC)内hNCAM阳性轴突密度的相应增加(2MPT:5.16 ± 1.48%;6MPT:39.6 ± 9.9%),表明部分移植来源的轴突可能沿着既有的白质束路径生长。
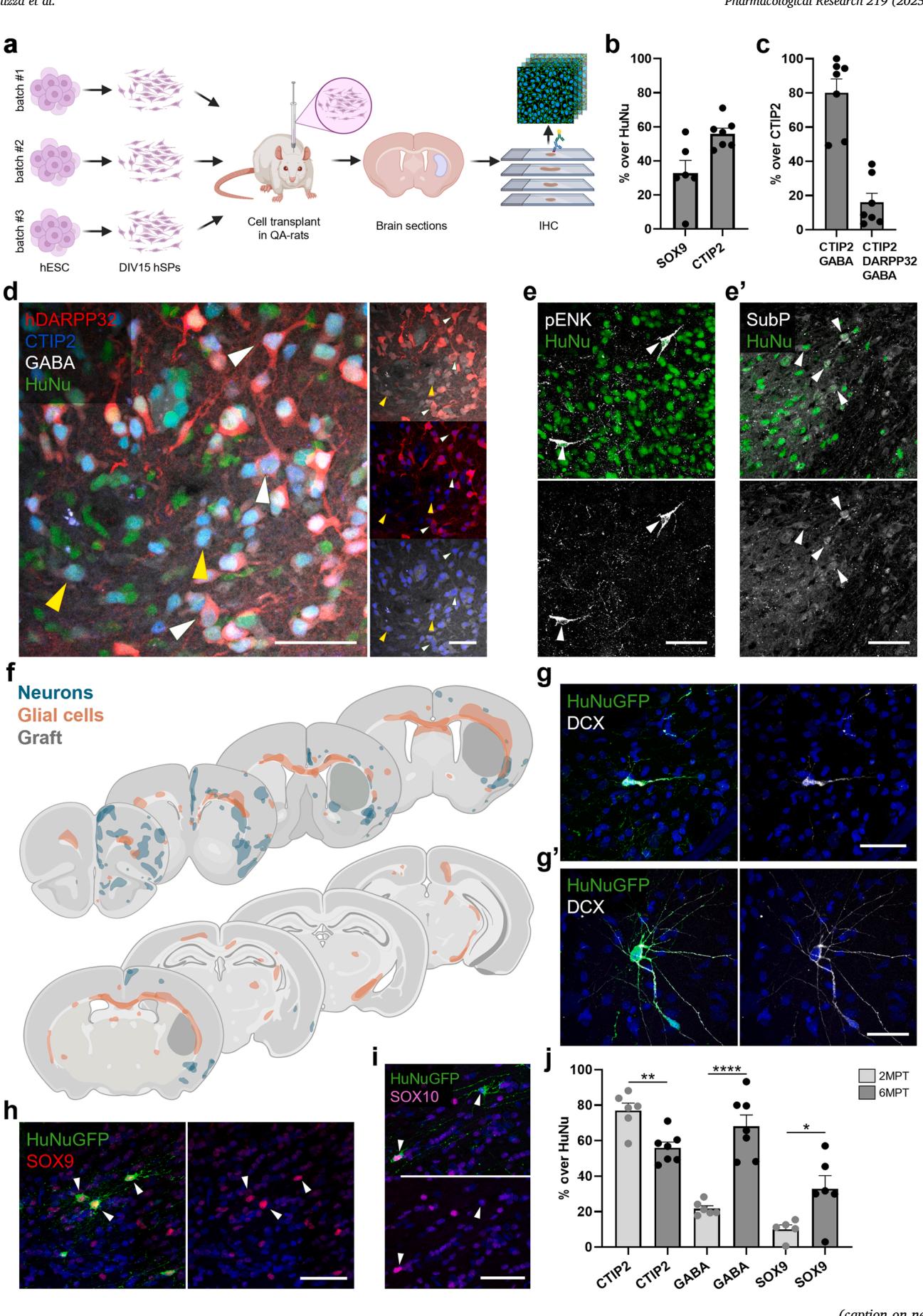
图2. hSP移植体的长期in vivo 表征。(a) 6MPT时hSP移植体免疫组织化学表征的实验流程示意图。(b) 通过HuNu染色鉴定移植细胞中表达星形胶质细胞标志物SOX9及神经元转录因子CTIP2的细胞比例定量。© CTIP2/HuNu阳性细胞群中CTIP2/GABA双阳性及CTIP2/GABA/hDARPP32三阳性hSP移植细胞的比例定量。(d) 移植核心区表达CTIP2/GABA/HuNu(黄色箭头)与hDARPP32/CTIP2/GABA/HuNu(白色箭头)的代表性图像。(e) 移植核心区SubP(e)与pENK(e’)阳性细胞的代表性图像。(f) 迁移至宿主区域的移植源神经元与胶质细胞复合叠加图。(g) 迁出移植核心区的DCX阳性人类神经元代表性图像,呈现迁移态(g)或更高分化态(g’)形态特征。(h-i) 移植核心区外人类SOX9阳性星形胶质细胞(h)与SOX10阳性少突胶质细胞(i)的代表性图像。(j) 2MPT与6MPT时移植细胞表达CTIP2、GABA或SOX9比例的纵向定量。比例尺:50µm(d-e’,g-i)。2MPT:N=6只大鼠;6MPT:N=6-7只大鼠。数据以均值±标准误表示。*p<0.05,**p<0.01,****p<0.0001。详见统计表格(附表5)。
总体而言,这些发现表明移植物衍生投射会经历精细化过程,该过程在6MPT时期可能仍在持续。结果进一步证明人源纹状体祖细胞移植物能与宿主大脑建立互惠性连接——既接收来自直接通路与间接通路的特定脑区输入,又向这些区域发出投射。这些发现共同印证了人源纹状体祖细胞分化神经元具备整合至现有神经环路、促进纹状体回路重建的能力。
¶ 3.4. 移植物来源的神经元表现出功能整合,这通过自发活动和诱发活动得到证实
对移植物传入和投射的研究突出了hSP移植物在宿主组织中的整合。为评估移植细胞的实际功能,我们采用基因编码钙传感器(jGCaMP7f)来监测活体动物中的移植物信号传导。为此,我们采用光纤光度记录技术在自由移动(清醒状态,AW)和麻醉状态(AN)下记录钙信号(图4a)。在三只移植了表达jGCaMP7f的hSP-移植物的大鼠以及一只移植了表达GFP的hSP-移植物的动物中均观察到清晰信号(图S5a, b)。组织学检测证实这些动物的记录区域存在移植神经元,且光极被正确植入移植物正上方或约500微米有效检测范围内[18](图4b;图S5c)。作为额外阴性对照,我们还纳入一例移植物未存活的动物,以揭示与移植及钙信号无关的伪影(无移植组,图S5b)。
在三只移植jGCaMP7f的大鼠中,有两只在大多数记录中观察到持续性振荡活动(图4c)。波峰呈现明显的钙瞬变,具有预期的平均形态(快速上升后伴随缓慢衰减;图4d)。反之,GFP移植组与未移植组动物的自发活动特征为呈现尖锐对称形态的波峰,其快速衰减特性不反映钙动力学且表明存在显著噪声(图S5b)。jGCaMP7f移植组记录的钙瞬变显示可变振幅,最大平均振幅达10.6 ± 0.14(AU),平均发生频率为每分钟5.92 ± 0.42次。该活动持续超过四个月(从6MPT至10MPT),并在AN条件下显著减弱至最大平均振幅1.31 ± 0.03,平均频率4.83 ± 0.15(图4d-f)。第三只接受jGCaMP7f移植的大鼠仅表现出零星钙活动,在17%的记录中可检测到(图S5d)。这些活动呈现间歇性低振幅峰簇(最大振幅1.87 ± 0.04),约占另外两只大鼠平均振幅的16%。在AN条件下振幅进一步降至1.05 ± 0.04,而平均频率维持不变(AW: 4.09 ± 0.4;AN: 3.53 ± 0.35,图S5d)。GFP移植大鼠的自发活动轨迹移植物表现出振荡,其平均峰值振幅和平均频率显著低于jGCaMP7f移植组动物(图S5e),与无移植对照组大鼠的记录结果相似(图S5b、e)。值得注意的是,AN处理显著降低了GFP移植大鼠(觉醒状态:3.23 ± 0.08;麻醉状态:2.02 ± 0.03)和无移植大鼠(觉醒状态:3.23 ± 0.08;麻醉状态:2.02 ± 0.03)的振幅值,表明这些信号中存在运动相关成分(觉醒状态)的贡献(图S5e)。此外,AN处理对GFP移植组的频率无影响(觉醒状态:1.25 ± 0.16;麻醉状态:2.28 ± 0.20),但在无移植大鼠中却出现异常信号增强(图S5e)。总体而言,这些结果表明人类纹状体祖细胞移植体具有自发性活动特征。
然而,自发性钙活动的存在并不必然意味着与宿主脑区存在功能连接,因为峰值可能源于移植物本身固有的神经活动。为评估移植物是否接收功能性输入,我们对移植动物施加足部电击(FSK)(图4g)。这种刺激已知会诱发纹状体的钙响应[35],提示若存在功能连接,移植物可能产生响应。事实上,在三个接受jGCaMP7f移植的大鼠中,有两个出现FSK诱导的特异性钙响应,而GFP移植大鼠则未出现(图4h),表现为刺激锁定条件下诱发的响应强度(刺激后vs.刺激前)显著高于随机锁定条件(FSK vs. 随机,图4i-j)。值得注意的是,在具有零星钙活动的jGCaMP7f移植大鼠中未检测到响应(图S5f),表明该动物存在连接不足。此外,接受GFP移植的动物及无移植对照组均未出现此类FSK诱发响应,后者甚至呈现轻微的刺激后信号减弱(图S5f)。这些结果表明人干细胞移植体能与宿主神经环路建立行为相关的连接。
总之,自发性活动表明hSP移植物中的神经元已获得功能成熟性,而诱发反应则证实它们已整合入宿主神经元网络,包括参与感觉刺激处理的神经回路。这些发现证实,源自hSP移植物的神经元能够参与成熟回路特有的信号过程,从而有助于宿主受损神经元网络的整体功能性、适应性和潜在恢复能力。
¶ 3.5. 化学遗传学调控揭示人脊髓移植物的功能整合与行为影响
为进一步验证hSP移植物与宿主神经环路的功能性整合,我们采用化学遗传学工具同时开展ex vivo 和in vivo 实验(图5a)。为此,我们按照既往方法[36]构建了稳定表达双向DREADD受体(Bi-DREADD)的克隆人胚胎干细胞系(图S6a-c),并在纹状体分化后筛选出最优克隆。在体外培养第35天,细胞除表达典型中型多棘神经元标志物外,还同时高表达mCherry标记的hM3Dq与HA标记的KORD受体(图5b、c)。通过钙指示剂Fluo4的延时成像,我们在基础状态及分别加入hM3Dq特异性配体CNO、KORD特异性配体SALB(以DMSO作为溶剂对照)后评估系统功能。具体而言,与溶剂对照组相比,CNO给药显著提升激活感兴趣区数量及网络连接度,而SALB则降低这些参数,证实了神经元活动的双向化学遗传调控(图5d、e;S6f-h;补充视频2-4)。经in vitro 验证后,携带Bi-DREADD系统的人源多巴胺能祖细胞被移植至QA损伤大鼠体内。在移植后6个月,免疫荧光检测证实移植物内Bi-DREADD系统持续表达,并稳定分化为中型多棘神经元(图5f)。
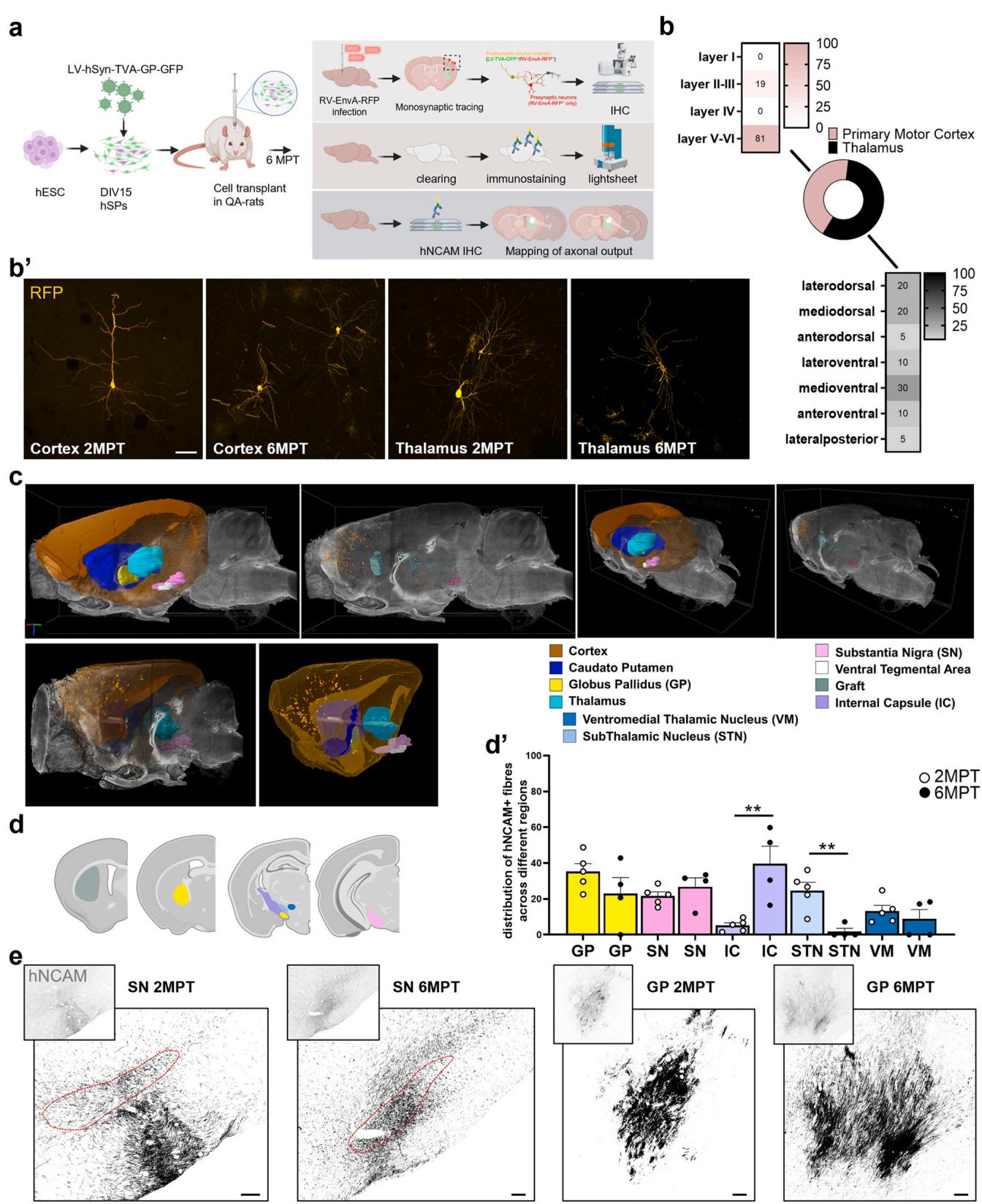
图3. 移植物输入和轴突投射的分析。a). 单突触输入和轴突投射分析的实验流程示意图。b) 在2MPT时,追踪细胞的数量及其在不同皮质层和丘脑核团中的定位量化。b’) 高倍共聚焦图像显示在2和6MPT时,初级运动皮层和丘脑中移植物细胞的初级传入输入(GFP阴性/mCherry阳性)。c) 使用光片显微镜对透明化大脑成像得到的mCherry阳性细胞分布和在图谱参考脑区中的解剖定位的三维渲染。d) 直方图描绘了hNCAM阳性移植物来源轴突到达的移植物和宿主脑区。在d’中量化了在2和6MPT时,移植物支配区域内hNCAM阳性分区面积的比例。e) 代表性图像显示在2和6MPT时,hNCAM阳性移植物来源纤维投射到GP和SN。比例尺,50 µm (b) 和 100 µm (e)。2MPT: N = 5只大鼠; 6MPT: N = 4只大鼠。数据以均值 ± 标准误表示。*p < 0.05, **p < 0.01, ****p < 0.0001。详见统计表(补充表5)。
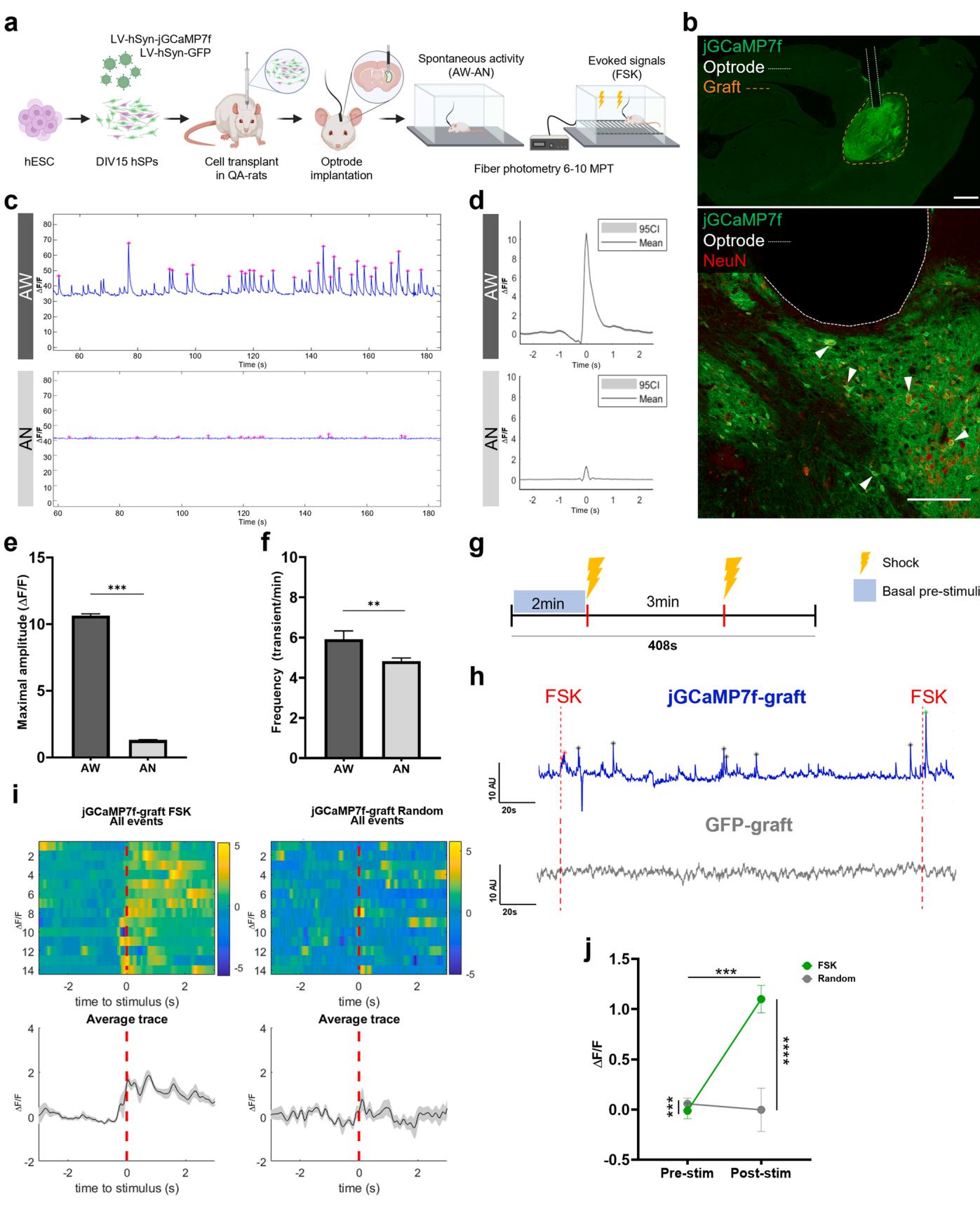
图4. jGCaMP移植体中的In vivo 自发性与诱发钙信号。针对hSP移植体进行in vivo 光纤光度记录的实验设计。(a) 代表性脑切片,显示与表达NeuN的jGCaMP7f移植体(橙色虚线)接触的光极轨迹及末端(白色虚线)。(b) AW与AN状态下jGCaMP7f移植体的代表性记录轨迹,检测到的峰由粉色星号()标示。© 以AW(斜率衰减0.75秒,N=2280个峰)和AN(斜率衰减0.25秒,N=1948个峰)中最大振幅对齐的jGCaMP7f移植体瞬变平均形态。(e) AW与AN状态下jGCaMP7f移植体瞬变的最大振幅(AW:N=2280;AN:N=1948个检测峰)。(f) AW与AN状态下jGCaMP7f移植体瞬变的频率(AW:N=57次记录;AN:N=60次记录)。(g) FSK给药方案的实验设计。(h) FSK测试期间jGCaMP7f与GFP移植体的代表性记录轨迹。仅jGCaMP7f移植体显示自发性信号及FSK诱发响应(星号标示)。(i) jGCaMP7f移植体中FSK诱发响应。上图:按FSK给药时间或随机时间对齐的每次试验信号热图。下图:检测活动的平均信号及95%置信区间(灰色阴影)。(j) 在刺激前后记录的两种对齐方式(FSK对比随机)中jGCaMP7f移植体诱发响应(N=14次试验)。总体信号存在差异(交互作用**,组间因子***)。刺激后与刺激前信号差异显著(条件因子***),仅FSK后显著增强(FSK***;随机ns)。比例尺:(b)主图500微米,(b)插圖200微米。数据呈现为均值±标准误。***p<0.001,ns p>0.05。详见统计表格(附表5)。
在同一时间点,我们对移植动物获得的矢状脑切片进行ex vivo 多电极阵列记录, positioning the graft to overlap with the electrode array (图 S7c)。在灌流液中加入10 μM多巴胺后,平均放电频率、爆发次数和电流幅度均显著增加,表明移植神经元具有多巴胺能反应性(图5g-m)。同样,CNO(10 μM)可增强这些参数,而SALB(20 μM)则降低放电活动,分别证实了移植体的化学遗传学激活与抑制成功实现(图55g-m)。此外,多巴胺和CNO均使神经网络互相关性较基线出现质性提升,这与移植体内成熟网络活动特征一致(图S7b)。重要的是,相同配体在移植体外部区域未产生可检测效应(图S7a),表明多巴胺诱发反应源于移植细胞而非移植物周围的宿主神经元。这些发现共同证实hSP移植体成功实现长期植入,能够分化整合至宿主神经环路,并获得功能性多巴胺能反应能力。
在亨廷顿病细胞替代治疗的研究背景下,关于移植物整合入宿主神经环路并调节运动行为的直接证据仍然匮乏。为解决这一问题,我们将在Bi-DREADD系统的hSPs移植至喹啉酸损伤大鼠模型中,并通过8MPT时点的靶向化学遗传刺激来调节运动行为(图6a)。给予CNO或SALB均能显著降低移植动物在开放场中的平均运动速度,而仅损伤对照组对配体无反应,这证实了移植物功能性整合及其活动调节自主运动行为的能力(图6b、c)。
此外,对梳理行为的分析——这一行为与纹状体介导的精细运动控制尤为相关[15]——显示,SALB给药显著增加了不完整或错误梳理序列的数量,这与移植体沉默后精细运动协调性受损的表现一致。相反,CNO则增加了正确梳理序列的数量,尽管该效应未达到统计学显著性,这一结果支持了化学遗传学激活移植神经元可增强纹状体对精细运动行为协调能力的观点(图6d)。
总之,移植体的化学遗传学激活或抑制调节了神经元活动in vivo,这一点通过放电频率和网络连接的变化得到证实。重要的是,在移植后8个月in vivo 对移植物活性的调节显著影响运动行为——激活和沉默均改变了旷场速度,而沉默则破坏了精细运动控制,表现为受损理毛序列的增加。基线性能比较未达到统计学显著性。
总的来说,这些发现表明hSP移植物不仅与宿主纹状体回路建立了功能连接,还调节纹状体依赖性行为。
¶ 4. 讨论
本研究提供in vivo 证据表明,在亨廷顿病QA大鼠模型中,人胚胎干细胞衍生的人纹状体前体细胞移植后能够存活、分化、整合入宿主神经环路并调控行为。通过采用全面多元的研究方法——包括单核转录组学、空间图谱定位、免疫组织化学、in vivo 钙信号记录、电生理学及化学遗传学调控技术,我们证实人纹状体前体移植物能够重现腹侧端脑发育的关键特征。这些特征包括产生能够调控纹状体相关行为的纹状体投射神经元、中间神经元与星形胶质细胞。
据我们所知,这是首个在亨廷顿病QA模型中对移植后人SP-移植物进行单核RNA测序,并与神经元分化过程中的匹配细胞in vitro进行对比的研究。相较于先前仅对神经干细胞来源移植物中约200个细胞进行转录谱分析的研究[37],我们成功将检测规模提升至分别来自移植物和in vitro培养体系的17,000余个和10,000余个细胞。该方法为表征移植物in vivo的细胞组成与空间结构提供了前所未有的分辨率,突破了传统组织学方法的局限。此外,通过强调环境相互作用对长期分化的影响,in vivo 移植物与in vitro 分化细胞之间的比较提供了新的见解。重要的是,单核RNA测序技术不仅识别了经典与非经典纹状体亚型,还揭示了空间分布模式,并捕获了与神经元成熟、胶质细胞生成及谱系可塑性相关的转录特征。这些发现对于评估移植物保真度、指导旨在实现治疗性应用所需细胞类型精准分化的方案优化具有关键意义。
特别是,我们发现移植物由转录多样性的细胞类型组成,包括D1型和D2型中度多棘神经元、MGE和CGE来源的中间神经元,以及具有端脑特征的星形胶质细胞。值得注意的是,将移植细胞的转录谱与公开的小鼠和人类成年数据集进行比较后,确认其沿腹侧端脑轨迹呈现正确的区域化和成熟模式。此外,通过正交数据集的交叉验证强化了细胞注释的准确性,提供了整合的转录组学与空间证据,证实了hSP移植物的纹状体身份真实性。观察到的细胞异质性可能反映了早期腹侧前脑祖细胞在in vitro 模式化过程中的内在可塑性,尤其是在LGE和MGE命运特化的重叠时间窗口内。与既往研究一致,暴露于SHH和其他腹侧化信号的早期腹侧前脑祖细胞可能同时产生LGE和MGE来源的亚型,具体取决于形态发生素暴露的时间与浓度[38]。尽管in vitro 方案主要呈现神经源性,但从2至6MPT逐渐出现的星形胶质细胞表明出现了in vivo, 神经源向胶质源转换的现象,这可能反映了妊娠期约15周时发生的在人类发育基底神经节的数周内[39],且未被重现in vitro. 。虽然移植物来源的星形胶质细胞主要表现出稳态和突触支持功能,但其表型仍具有可塑性,并受宿主环境影响,需要进一步研究它们在喹啉酸损伤纹状体内潜在的保护性与反应性作用。

图5. 双向DREADD人胚胎干细胞分化为人纹状体前体细胞并移植至QA损伤大鼠体内的功能验证。(a) hSP移植体化学遗传双向操控的实验流程。(b) 免疫染色显示DIV35时双向DREADD hESC来源hSP中hM3Dq-mCherry与HA标签KORD的共表达。© 免疫染色显示DIV35时双向DREADD hESC来源hSP中典型中型多棘神经元标志物CTIP2与GABA的表达。(d) 柱状图显示加入特定配体(DMSO、10μM CNO、5μM SALB)后24秒内Fluo-4钙瞬变峰值活性ROI占比(N=至少6个不同培养孔,源自两次独立生物学重复)。(e) 图示在特定配体(DMSO、10 µM CNO、5 µM SALB)作用后180秒Fluo-4钙瞬变同步活动所获ROI间功能连接(N=至少6个不同培养孔,源自两次独立生物学重复)。(f) 免疫组化图像显示纹状体移植的双向DREADD hESC来源hSP共表达hDARPP32与hM3Dq-mCherry。(g) 点阵图展示MEA记录期间多电极神经元放电活动时序模式。每行代表单个电极,水平刻度标记单个放电时间点。各条件(BASAL、20μM DA、10μM CNO、20μM SALB)均记录30秒活动(BASAL、DA、CNO:N=3个切片来自3只动物;SALB:N=1个切片)。(h-o) 柱状图显示各条件(BASAL、20μM DA、10μM CNO)下移植区域30秒记录测量的不同MEA参数:h) 活性放电单元百分比,i) 平均放电频率(次/秒),j) 电流幅度(pA),k) 放电事件数,l) 簇状放电事件数,m) 簇状放电频率(簇/秒)(BASAL、DA、CNO:N=3个切片来自3只动物)。标尺:50 µm(a、c、e、f插图)。数据表示为均值±标准误。*p<0.05,**p<0.01,****p<0.0001。详见统计表格(附表5)。
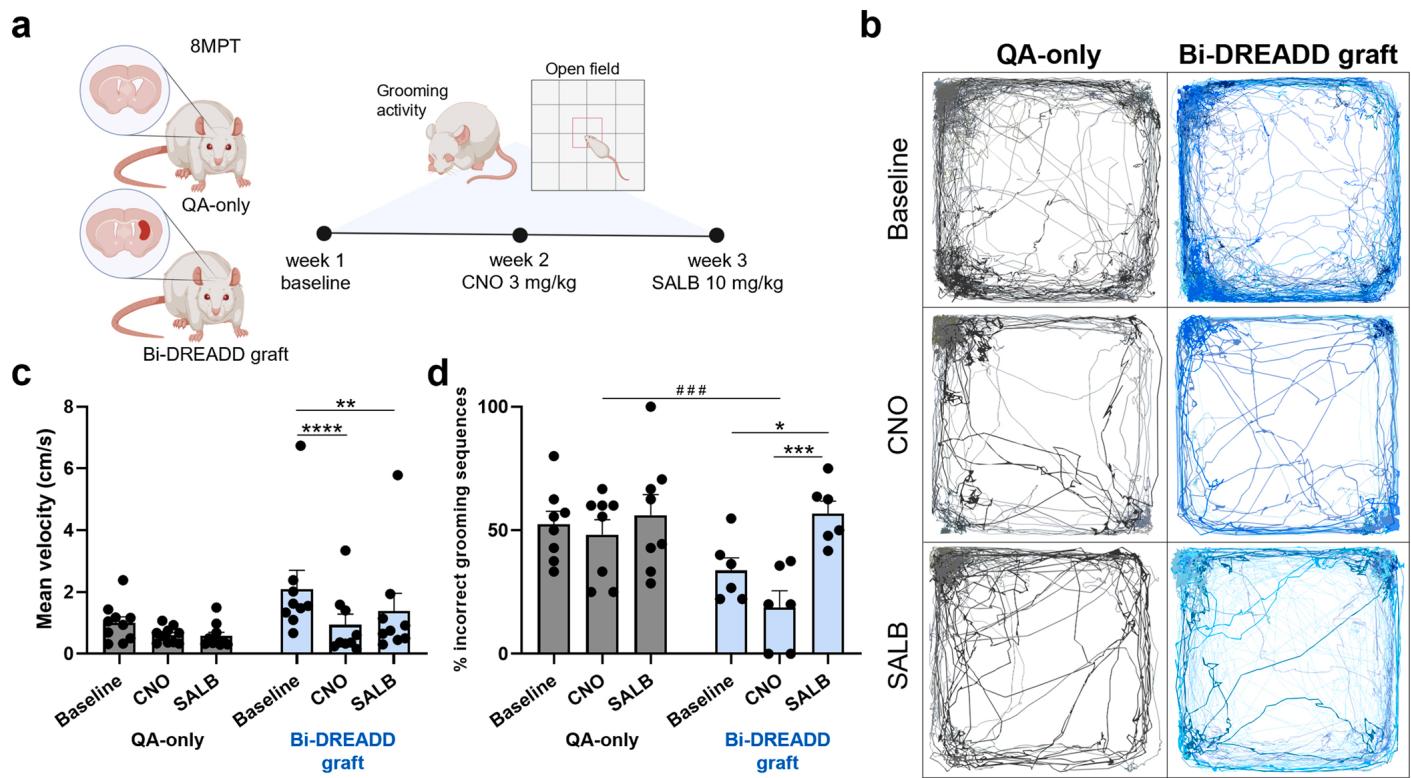
图6. In vivo Bi-DREADD-hSP移植物的双向化学遗传学调控。a) 在纹状体相关行为测试期间对Bi-DREADD-hSP移植物进行双向化学遗传学调控的实验流程。以QA损伤动物(QA-only)作为对照组。b-c) 不同条件下(基线状态、CNO或SALB给药后)QA-only组与Bi-DREADD移植组动物的开放场地运动轨迹(b)及平均速度图表©。d)QA-only组与Bi-DREADD移植组在基线状态、CNO给药后及SALB给药后,错误理毛序列占总体理毛活动的比例。QA-only组:N=8-10只大鼠;Bi-DREADD移植组:N=6-9只大鼠。数据以均值±标准误表示。**p<0.01,***p<0.001,****p<0.0001。详见统计表格(补充表5)。
hSP移植物的一個顯著特徵是出現遷移組分,這些組分在6MPT時從移植物核心廣泛分散至宿主全腦,並同時包含神經元和膠質細胞。其中神經元成分優先定植於吻側新皮質區域,而膠質細胞則呈現更廣泛的分佈,尤其沿白質束擴散。這種空間遷移模式與人類全節隆起紋狀體異種移植在類似大鼠亨廷頓病模型中的觀察結果高度一致[40,41],進一步強化了hSPs已獲得腹側端腦特性的結論。此外,觀察到的神經元遷移軌跡與MGE和CGE來源中間神經元在生理狀態下所採取的遷移路徑高度吻合。小鼠与人类发育的研究,以皮质区域为靶点[42,43]。类似地,先前研究表明将hPSC来源的中间神经元移植到新生啮齿动物大脑中展现出强大的迁移能力[44]。总体而言,这些证据表明我们研究中观察到的迁移神经元是hPS来源的MGE/CGE后代,定向分化为皮质中间神经元谱系。但当前数据集中的单核测序未能捕获该迁移群体,其分子身份尚不明确,功能相关性亦有待阐明。值得注意的是,越来越多证据也凸显了胶质细胞群体的潜在治疗意义。近期研究表明,人类胶质细胞一旦整合入宿主大脑,能促进亨廷顿病模型的功能恢复,这揭示了宿主-移植物嵌合化的潜在益处[45]。然而,QA损伤产生的特定炎症环境可能驱使人类星形胶质细胞表型转向毒性反应,从而对移植物产生负面影响。关于移植物中星形胶质细胞成分的具体特征,仍有待完全阐明。
本研究的一个主要优势在于证明了移植物在宿主纹状体回路中实现了结构和功能整合。单突触逆行追踪显示,早在移植后2个月时,移植物就已接收来自皮层、丘脑及其他已知支配纹状体区域的解剖学对应输入。同样,移植物来源的轴突投射至包括苍白球和黑质在内的典型纹状体靶区——这表明了传出连接的建立。重要的是,这些解剖学发现得到了功能性生理数据的证实:移植神经元在清醒自由活动的动物体内表现出自发性钙瞬变,并对FSK等生理性感觉输入产生响应,从而支持其功能整合性及接收处理内源性神经环路突触输入的能力。
这些发现表明,移植的神经元不仅是在解剖结构上嵌入,更经历了功能性成熟,并能参与动态回路活动。此外,与获得正常纹状体功能特征相一致的是,MEA记录表明移植神经元能够感知并响应多巴胺。同时,化学遗传学实验证明移植体调控可影响网络兴奋性ex vivo。相应地,通过使用化学遗传学工具调控移植体活性,我们首次在亨廷顿病模型中获得移植体功能可调控纹状体依赖性行为的证据。
我们观察到,hSP移植物的激活和抑制都会影响运动和梳理行为,这表明移植物活性的双向调节可以影响自主运动和精细运动协调。CNO诱导的激活和SALB介导的抑制都降低了运动速度,这表明hSP移植物与宿主回路之间存在复杂的相互作用,可能通过不同的平行通路作用于运动输出。此外,用CNO观察到的行为效应应反映了移植物内D1样和D2样神经元的共同激活。然而,这些效应可能因D1样神经元的相对优势而有所偏斜。此外,我们在纹状体外区域如前额叶皮层和屏状核中检测到表达Bi-DREADD的移植物来源神经元——这些是自主运动起始的关键区域[46–48]。这些迁移的神经元可能对观察到的行为调节有所贡献,可能影响下游回路,尤其是在CNO诱导的广泛激活背景下。
值得注意的是,在梳理行为方面,CNO诱导的激活增强了正确梳理序列的数量,这与纹状体控制的加强相一致,而SALB介导的抑制则破坏了梳理行为的精确度。然而,CNO的行为效应似乎比SALB更为微妙。实际上,CNO增加了正确梳理序列的比例,但这一变化未达到统计学显著性。这种不对称性表明,纹状体输出通路可能对抑制比泛化激活更为敏感,或者混合神经元群体(包括兴奋性和抑制性元素)的激活可能导致净输出的不一致性。需要指出的是,在未受刺激的条件下,移植诱导的行为变化未能达到统计学显著性,这表明内源性活动可能不足以或协调性较差,无法驱动测试的自发性行为产生显著改善。此外,迁移至非纹状体区域的神经元活动可能掩盖了纹状体整合细胞的正常功能,导致改善效果未能显现。
我们的研究存在局限性。虽然QA损伤大鼠模型仍是研究亨廷顿病纹状体细胞替代的广受认可且有价值的体系,但它不能完全重现该疾病特征性的渐进性神经退行性变、复杂炎症环境以及内源性突变HTT蛋白的影响。此外,尽管该损伤模型似乎与纹状体细胞类型的生成完全兼容,但QA环境是否以及如何影响移植祖细胞的分化仍有待充分阐明。因此,将该模型的发现外推至人类状况时必须谨慎。电生理学和纤维光度法实验涉及的动物数量有限,反映了纵向in vivo 移植物检测的技术挑战。此外,与未接受移植的损伤动物相比,仅植入hSP移植物在所分析的测试中并未产生统计学意义上的显著行为改善。这些发现,连同移植细胞功能整合的证据以及化学遗传学调控行为的有效性表明,hSP移植物实现的连接性和/或功能成熟度仍不精确或不足以自行驱动功能恢复——这凸显了细胞产品需进一步优化的关键领域。
此外,胶质细胞的存在——虽然可能支持移植物长期整合与存活——也可能引发不可预测且多变的功能结果。优化分化方案以增强纹状体特异性,同时不损害细胞活力或可塑性,仍是必要之举。最后,移植细胞的迁移特性及其对网络动态和行为输出的影响值得进一步研究。总之,这项工作不仅凸显了人类干细胞重建受损纹状体结构的潜力,更揭示了其能以生理相关方式实现纹状体环路的功能整合与调节。随着细胞替代策略在帕金森病治疗中逐步走向临床转化,通过优化移植物特性、促进功能成熟及调控神经环路连接,将最大程度发挥该策略对亨廷顿病的治疗潜力。
¶ 附录 A. 支持信息
本文的补充数据可在在线版本中查看,获取地址为 doi:10.1016/j.phrs.2025.107905.
¶ 参考文献
[1] G.P. Bates, R. Dorsey, J.F. Gusella, M.R. Hayden, C. Kay, B.R. Leavitt, M. Nance, C. A. Ross, R.I. Scahill, R. Wetzel, E.J. Wild, S.J. Tabrizi,《亨廷顿病》,Nat. Rev. Dis. Prim. 1 (2015)15005。
[2] S.J. Tabrizi, C. Estevez-Fraga, W.M.C. van Roon-Mom, M.D. Flower, R.I. Scahill, E.J. Wild, I. Munoz-Sanjuan, C. Sampaio, A.E. Rosser, B.R. Leavitt,《亨廷顿病潜在疾病修饰疗法:经验总结与未来机遇》,Lancet Neurol. 21 (7) (2022) 645–658。
[3] D.E. Choi, J.W. Shin, S. Zeng, E.P. Hong, J.H. Jang, J.M. Loupe, V.C. Wheeler, H. E. Stutzman, B. Kleinstiver, J.M. Lee,《通过碱基编辑策略将CAG转换为CAA以减弱亨廷顿病致病突变》,Elife 12 (2024)。
[4] S. Ling, X. Zhang, Y. Dai, Z. Jiang, X. Zhou, S. Lu, X. Qian, J. Liu, N. Selfjord, T. M. Satir, A. Lundin, J.L. Touza, M. Firth, N. Van Zuydam, B. Bilican, P. Akcakaya, J. Hong, Y. Cai,《可定制病毒样颗粒递送CRISPR-Cas9核糖核蛋白实现眼部新生血管及亨廷顿病基因治疗》,Nat. Nanotechnol. 20 (4) (2025) 543–553。
[5] M. Farag, S.J. Tabrizi, E.J. Wild,《亨廷顿病临床试验更新:2025年3月》,J. Huntingt. Dis. 14 (2) (2025) 191–206。
[6] S. Skidmore, R.A. Barker,《帕金森病细胞疗法临床进展中的挑战》,Nat. Biomed. Eng. 7 (4) (2023) 370–386。
[7] E. Cattaneo, D. Besusso,《干细胞革命:欧盟委员会联盟驱动的帕金森病研究》,Pharm. Res 212 (2025) 107569。
[8] P. Conforti, V.D. Bocchi, I. Campus, L. Scaramuzza, M. Galimberti, T. Lischetti, F. Talpo, M. Pedrazzoli, A. Murgia, I.Ferrari, C. Cordiglieri, A. Fasciani, E.Arenas, D. Felsenfeld, G. Biella, D. Besusso, E. Cattaneo,《体外诱导中型多棘神经元在单细胞分辨率重现人类纹状体发育与复杂性》,Cell Rep. Methods 2 (12) (2022) 100367。
[9] Y.Miura, M.Y. Li, F. Birey, K. Ikeda, O. Revah, M.V. Thete, J.Y. Park, A. Puno, S. H. Lee, M.H. Porteus, S.P. Pasca,《人多能干细胞生成人类纹状体类器官与皮质-纹状体组装体》,Nat. Biotechnol. 38 (12) (2020) 1421–1430。
[10] S. Grealish, A. Heuer, T. Cardoso, A. Kirkeby, M. Jonsson, J. Johansson, A. Bjorklund, J. Jakobsson, M. Parmar,《改良狂犬病毒单突触示踪揭示人胚胎干细胞源神经元早期广泛环路整合》,Stem Cell Rep. 4 (6) (2015) 975–983。
[11] F.D.W. Radstake, E.A.L. Raaijmakers, R. Luttge, S. Zinger, J.P. Frimat,《CALIMA:半自动化开源钙成像分析仪》,Comput Methods Programs Biomed 179 (2019) 104991。
[12] E. Hergenreder, A.P. Minotti, Y. Zorina, P. Oberst, Z. Zhao, H. Munguba, E. L. Calder, A. Baggiolini, R.M.Walsh, C. Liston, J. Levitz, R. Garippa, S. Chen, G. Ciceri, L. Studer,《作者校正:联合小分子处理加速人多能干细胞源神经元成熟》,Nat Biotechnol 42 (10) (2024) 1615。
[13] D. Besusso, R. Schellino, M. Boido, S. Belloli, R. Parolisi, P. Conforti, A. Faedo, M. Cernigoj, I. Campus, A. Laporta, V.D. Bocchi, V. Murtaj, M. Parmar, P. Spaiardi, F. Talpo, C. Maniezzi, M.G. Toselli, G. Biella, R.M. Moresco, A. Vercelli, A. Buffo, E. Cattaneo,《干细胞源人纹状体祖细胞移植至亨廷顿病大鼠模型可支配纹状体靶点并改善感觉运动缺陷》,Stem Cell Rep. 14 (5) (2020) 876–891。
[14] R. Schellino, D. Besusso, R. Parolisi, G.B. Gomez-Gonzalez, S. Dallere, L. Scaramuzza, M. Ribodino, I. Campus, P. Conforti, M. Parmar, M. Boido, E. Cattaneo, A. Buffo,《hESC源纹状体祖细胞移植至亨廷顿病大鼠模型通过分化、自组织与受损纹状体连接实现长期运动功能恢复》,Stem Cell Res Ther. 14 (1) (2023) 189。
[15] A.M. Tartaglione, M. Armida, R.L. Potenza, A. Pezzola, P. Popoli, G. Calamandrei,《异常自我理毛行为作为亨廷顿病大鼠模型运动功能障碍的早期标志》,Behav. Brain Res. 313 (2016) 53–57。
[16] J. Sjobom,M. Tamte, P. Halje, I. Brys, P. Petersson,《皮质与纹状体环路共同编码自然行为转换》,Sci. Adv. 6 (41) (2020)。
[17] B. Mattsson, A. Bj¨ orklund, M. Parmar,《矢状切面》,见:B. Mattsson, A. Bj¨ orklund, M. Parmar (编),《无胸腺裸鼠脑图谱》,学术出版社,2023年,第63–92页。
[18] N. Renier,Z. Wu, D.J. Simon, J. Yang, P. Ariel, M. Tessier-Lavigne,iDISCO:一种用于体积成像的大型组织样本免疫标记的简易快速方法,《细胞》159卷4期(2014年)第896–910页。
[19] A. Branch, D. Tward, A.C. Kolstad, V. Pulyadi, J.T. Vogelstein, Z. Wu, M. Gallagher,大鼠脑标记、成像及高通量分析的优化组织透明化方案,bioRxiv(2021年)639674。
[20] E.A. Papp, T.B. Leergaard, E. Calabrese, G.A. Johnson, J.G. Bjaalie,Sprague Dawley大鼠脑的Waxholm空间图谱,《神经影像》97卷(2014年)第374–386页。
[21] L. Meng, L. Hogstedt, P. Tidemand-Lichtenberg, C. Pedersen, P.J. Rodrigo,通过上转换参量荧光空间滤波增强上转换单光子探测器探测能力,《光学快报》26卷19期(2018年)第24712–24722页。
[22] G. Cui, S.B. Jun,X. Jin, M.D. Pham, S.S. Vogel, D.M. Lovinger, R.M. Costa,动作启动期间纹状体直接与间接通路的同步激活,《自然》494卷7436期(2013年)第238–242页。
[23] L.A. Gunaydin, L. Grosenick, J.C. Finkelstein, I.V. Kauvar, L.E. Fenno, A. Adhikari, S. Lammel, J.J. Mirzabekov, R.D. Airan, K.A. Zalocusky, K.M. Tye, P. Anikeeva, R.C. Malenka, K. Deisseroth,社会行为背后的自然神经投射动力学,《细胞》157卷7期(2014年)第1535–1551页。
[24] G.H. Petty, A.K. Kinnischtzke, Y.K. Hong, R.M. Bruno. 唤醒与运动对次级体感丘脑和视觉丘脑的影响. 《生命》10卷, 2021年.
[25] H. Dana, Y. Sun, B. Mohar, B.K. Hulse, A.M. Kerlin, J.P. Hasseman, G. Tsegaye, A. Tsang, A. Wong, R. Patel, J.J. Macklin, Y. Chen, A. Konnerth, V. Jayaraman, L.L. Looger, E.R. Schreiter, K. Svoboda, D.S. Kim. 用于神经元群体和微区室活动成像的高性能钙传感器. 《自然方法》16卷7期, 2019年, 第649–657页.
[26] A. Maccione, M. Gandolfo, P. Massobrio, A. Novellino, S. Martinoia, M. Chiappalone. 一种精准识别细胞外记录神经元信号中锋电位的新算法. 《神经科学方法》177卷1期, 2009年, 第241–249页.
[27] A. Fiorenzano, P. Storm, E. Sozzi, A. Bruzelius, S. Corsi, J. Kajtez, J. Mudannayake, J. Nelander, B. Mattsson, M. Akerblom, T. Bjorklund, A. Bjorklund, M. Parmar. TARGET-seq:将人多巴胺能神经元单细胞转录组学与其靶向特异性关联. 《美国国家科学院院刊》121卷47期, 2024年, e2410331121.
[28] P. Di Tommaso, M. Chatzou, E.W. Floden, P.P. Barja, E. Palumbo, C. Notredame. Nextflow实现可重复计算工作流. 《自然生物技术》35卷4期, 2017年, 第316–319页.
[29] A. Dobin, C.A. Davis, F. Schlesinger, J. Drenkow, C. Zaleski, S. Jha, P. Batut, M. Chaisson, T.R. Gingeras. STAR:超快速通用RNA-seq比对工具. 《生物信息学》29卷1期, 2013年, 第15–21页.
[30] H. Li, B. Handsaker, A. Wysoker, T. Fennell, J. Ruan, N. Homer, G. Marth, G. Abecasis, R. Durbin, S. 基因组计划数据处理. 序列比对/映射格式与SAMtools. 《生物信息学》25卷16期, 2009年, 第2078–2079页.
[31] S. Yang, S.E. Corbett, Y. Koga, Z. Wang, W.E. Johnson, M. Yajima, J.D. Campbell. 使用DecontX去除单细胞RNA-seq中的环境RNA污染. 《基因组生物学》21卷1期, 2020年, 第57页.
[32] I. Korsunsky, N. Millard, J. Fan, K. Slowikowski, F. Zhang, K. Wei, Y. Baglaenko, M. Brenner, P.R. Loh, S. Raychaudhuri. Harmony实现单细胞数据的快速、灵敏且精准整合. 《自然方法》16卷12期, 2019年, 第1289–1296页.
[33] K. Siletti, R. Hodge, A. Mossi Albiach, K.W. Lee, S.L. Ding, L. Hu, P. Lönnerberg, T. Bakken, T. Casper, M. Clark, N. Dee, J. Gloe, D. Hirschstein, N.V. Shapovalova, C.D. Keene, J. Nyhus, H. Tung, A.M. Yanny, E. Arenas, E.S. Lein, S. Linnarsson. 成人脑细胞类型的转录组多样性. 《科学》382卷6667期, 2023年, eadd7046.
[34] T.M. O’Shea, Y. Ao, S. Wang, A.L. Wollenberg, J.H. Kim, R.A. Ramos Espinoza, A. Czechanski, L.G. Reinholdt, T.J. Deming, M.V. Sofroniew. 病变微环境引导移植神经前体细胞向伤口修复性星形胶质细胞表型转化. 《自然通讯》13卷1期, 2022年, 第5702页.
[35] A.A. Legaria, B.A. Matikainen-Ankney, B. Yang, B. Ahanonu, J.A. Licholai, J.G. Parker, A.V. Kravitz. 纹状体光纤光度测定主要反映钙的非体细胞变化. 《自然神经科学》25卷9期, 2022年, 第1124–1128页.
[36] M. Xiong, Y. Tao, Q. Gao, B. Feng, W. Yan, Y. Zhou, T.A. Kotsonis, T. Yuan, Z. You, Z. Wu, J. Xi, A. Haberman, J. Graham, J. Block, W. Zhou, Y. Chen, S.C. Zhang. 人干细胞源神经元修复神经回路并恢复功能. 《细胞干细胞》28卷1期, 2021年, 第112–126页.
[37] S.M. Holley, J.C. Reidling, C. Cepeda, J. Wu, R.G. Lim, A. Lau, C. Moore, R. Miramontes, B. Fury, I. Orellana, M. Neel, D. Coleal-Bergum, E.S. Monuki, G. Bauer, C.K. Meshul, M.S. Levine, L.M. Thompson. 移植人神经干细胞挽救zQ175亨廷顿病小鼠表型并支配纹状体. 《分子治疗》31卷12期, 2023年, 第3545–3563页.
[38] N. Pavon, Y. Sun, C. Pak. 腹侧端脑类器官中的细胞类型特化与多样性. 《遗传学前沿》15卷, 2024年, 1440583.
[39] U. Roessmann, P. Gambetti. 发育中人脑的星形胶质细胞:免疫组织化学研究. 《神经病理学学报》70卷3-4期, 1986年, 第308–313页.
[40] C.B. Hurelbrink, R.J. Armstrong, S.B. Dunnett, A.E. Rosser, R.A. Barker. 原代人纹状体异种移植神经细胞在成年大鼠中枢神经系统的广泛迁移. 《欧洲神经科学杂志》15卷7期, 2002年, 第1255–1266页.
[41] C.B. Hurelbrink, R.A. Barker. 同种与异种胎儿纹状体组织原代移植细胞在成年大鼠脑内的迁移. 《欧洲神经科学杂志》21卷6期, 2005年, 第1503–1510页.
[42] H·维希特尔、JM·加西亚-维尔杜戈、DG·埃雷拉、A·阿尔瓦雷斯-布伊拉. 来自内侧神经节隆起的年轻神经元在成体和胚胎脑中的分散. 《自然神经科学》第2卷第5期, 1999年, 第461-466页.
[43] 冯旭、高阳、褚芳、单宇、刘敏、王悦、朱毅、卢琴、李敏. 中间神经元皮质区域化揭示人类与猕猴大脑发育中共有和独特的分子程序. 《自然通讯》第16卷第1期, 2025年, 第672页.
[44] Z·诺克斯、F·基夫、C·坦布林尼、CM·凯利、MC·桑托斯、SB·邓尼特、AC·埃林顿、李敏. 人多能干细胞来源的纹状体中间神经元:体外及大鼠脑内的分化与成熟. 《干细胞报告》第12卷第2期, 2019年, 第191-200页.
[45] CB·比利亚努埃瓦、NPT·黄、JN·马里亚尼、B·曼斯基、A·塔特、SS·洛伦岑、D·钱德勒-米利托、A·本赖斯、SA·高盛. 人类胶质祖细胞移植到亨廷顿病小鼠体内可正常化神经元基因表达、树突结构行为. 《细胞报告》第44卷第6期, 2025年, 115762号.
[46] D. Vazquez等. 光遗传学抑制大鼠前扣带皮层损害任务启动与持续执行能力. 《神经科学杂志》第44卷第20期, 2024年.
[47] M.G. White等. 屏状核自上而下信息处理与皮层广播的电路构成. 《大脑结构与功能》第223卷第9期, 2018年, 第3945–3958页.
[48] 寇志强等. 屏状核通过前扣带皮层输入与局部电路同步以准备性方式调控运动活动. 《神经科学通报》第39卷第10期, 2023年, 第1591–1594页.