¶ CXCR4相关原发性免疫缺陷中结构和精神运动缺陷的神经发育起源
¶ 原文下载:https://fb.biokingdom.top/f/2c27b54513a84b09af75/
¶ 亮点
- IEI基因在发育中的人脑中显示出区域和阶段特异性表达
- WHIM突变改变小脑祖细胞动态,导致行为缺陷
- 早期靶向大脑CXCR4抑制可挽救形态和功能结果
¶ 作者
朱莉娅·德梅内戈、萨拉·曼奇内利、安东内拉·博雷卡、罗莎尔巴·奥尔加·普罗切、瓦妮莎·阿拉贡纳、马泰奥·米奥托、马可·克雷莫内西、劳拉·祖凯利、伊雷妮·科拉迪尼、尤金·金、卡塔琳娜·伊利奇、爱德华多·弗拉维加、卢卡·佩莱格里诺、拉法埃莱·巴多尔托、罗伯托·鲁斯科尼、达维德·波齐、马里诺斯·卡利库迪斯、戴安娜·卡什、米凯拉·马泰奥利、西蒙娜·洛达托
¶ 通信
¶ 简而言之
Demenego等人研究表明,先天性免疫错误(IEI)会独立于免疫功能障碍直接影响神经发育。在WHIM综合征中,CXCR4过度激活通过细胞内在机制破坏小脑组装和行为功能。早期使用靶向大脑的CXCR4拮抗剂可同时挽救结构缺陷和精神运动缺陷。该研究重新定义了IEI相关症状的神经发育起源。
Demenego et al., 2025, Neuron 113, 2636–2655 August 20, 2025 © 2025 The Author(s). Published by Elsevier Inc. https://doi.org/10.1016/j.neuron.2025.05.016
¶ 作者单位
1 生物医学科学系,人文大学,罗扎诺,意大利
2 神经发育生物学实验室,IRCCS人文研究医院,罗扎诺,意大利
3 神经科学研究所,国家研究委员会,罗马,意大利
4 药理学与脑病理学实验室,IRCCS人文研究医院,罗扎诺,意大利
5 马克斯·德尔布吕克分子医学中心,亥姆霍兹联合会,柏林,德国
6 适应性免疫实验室,IRCCS人文研究医院,罗扎诺,意大利
7 神经影像学系,精神病学、心理学与神经科学研究所,伦敦国王学院,英国
8 应用物理学、生物物理学与微流体实验室,IRCCS人文研究医院,罗扎诺,意大利
9 儿科诊所与A.诺奇维利分子医学研究所,临床与实验科学系,布雷西亚市民医院-布雷西亚大学,布雷西亚,意大利
10 主要负责人
*通讯作者: simona.lodato@hunimed.eu
https://doi.org/10.1016/j.neuron.2025.05.016
¶ 摘要
先天性免疫缺陷症(IEI)作为先天慢性疾病,常伴随神经行为症状,传统上被视为患者负担的继发表现。然而,其根源机制尚未得到阐明。本研究发现,在人类大脑发育过程中,IEI相关基因在神经谱系中表达;且在无免疫挑战的情况下,IEI突变会直接损害神经发育轨迹,导致精神运动缺陷。携带Cxcr4过度激活突变的WHIM综合征小鼠模型显示,其小脑叶发育缺陷与感觉运动及情感功能障碍相关,重现了患者描述的异常特征。WHIM小脑单细胞测序揭示颗粒细胞前体存在主要转录失调,其异常增殖和迁移导致小脑叶化及神经环路缺陷。脑室注射AMD3100可同时挽救形态学和行为学缺陷,证明这些缺陷具有脑特异性且依赖Cxcr4信号通路。我们的研究结果共同揭示了神经发育机制在IEI精神运动表现中的重要作用,从而拓宽了我们对这类疾病超越免疫功能障碍的认知边界。
¶ 引言
神经系统与免疫系统之间的相互作用是双向的、受精密调控的,对维持生理稳态至关重要1,2。越来越多的证据表明,在正常生理状态下免疫系统对大脑发育及功能具有重要影响3,而神经免疫通讯的紊乱则会引发一系列疾病,包括神经发育障碍4–9、精神疾病4,6,10,11以及神经退行性疾病12–15。此外,患有慢性炎症性疾病(如炎症性肠病16,17、银屑病18,19、类风湿关节炎20–23)的个体常出现焦虑和抑郁共病——这些症状通常被视为潜在免疫功能障碍的继发表现。
先天性免疫错误(IEI)是一类遗传性疾病,其特征是免疫系统组成部分出现部分或完全功能障碍24–26。这些患者对感染和恶性肿瘤的易感性增高,且常伴有复杂的合并症27,28。值得注意的是,IEI患者神经精神症状(尤其是焦虑和抑郁)的患病率也更高26,29–32。这些表现究竟是慢性免疫失调的间接后果,还是影响大脑发育的潜在基因突变的直接结果,目前尚无定论,这主要源于建模挑战和跨学科研究的局限性。
在IEI中,疣低丙种球蛋白血症免疫缺陷骨髓淤滞(WHIM)综合征以反复发作的感染、骨质疏松和心脏缺陷为特征33–39。近期一项针对WHIM患者小群体的神经影像学与神经精神病学评估显示,他们存在轻微但持续存在的运动协调缺陷,包括精细和粗大运动功能障碍及共济失调,并伴有焦虑、抑郁和社交回避现象40。值得注意的是,磁共振成像(MRI)显示66%的病例存在非典型小脑脑叶形态,尤其累及下半球区域,且伴有异常的层状结构取向40。尽管这些现象提示小脑参与WHIM病理过程,但其机制关联尚未明确。
WHIM综合征由C-X-C趋化因子受体4(CXCR4)基因的常染色体显性突变引起,该突变特异性地发生于基因C端胞质结构域(OMIM: #193670)35,41。CXCR4可被其配体C-X-C趋化因子配体12(CXCL12)特异性激活42,结合后发生构象变化,启动调控细胞迁移与增殖的下游信号级联反应。正常情况下,β抑制蛋白介导的受体内化机制可确保CXCR4信号受控传导43。在WHIM综合征中,这种内化过程受损导致细胞表面受体持续暴露(称为CXCR4过度激活)39,42,进而引起造血干细胞41及成熟中性粒细胞35在骨髓中的滞留缺陷。
目前WHIM综合征的治疗方案宽泛且成本高昂,凸显出紧迫的医疗需求。CXCR4拮抗剂普乐沙福(AMD3100)的三期临床试验已证明其能有效提升循环白细胞亚群的数量44–46。但值得注意的是,这些试验仅纳入10岁以上的受试者,然而有证据表明WHIM症状自出生即存在,且早期干预(尤其针对非免疫表现)的潜在获益仍属未知。
本研究揭示了免疫失调综合征相关精神运动缺陷的神经发育起源,将这些表型与系统性免疫功能障碍分离开来。我们发现,在早期大脑发育过程中,IEI相关基因在小脑神经谱系中活跃表达。通过利用WHIM小鼠模型,我们证实Cxcr4过度活化会直接损害小脑细胞结构,引发与临床观察相符的持久性行为及功能缺陷。最后,我们证明早期脑室内注射普乐沙福可挽救WHIM小鼠的结构和行为缺陷,由此确立了大脑内源性Cxcr4功能障碍与神经行为症状之间的直接关联。
¶ 结果
¶ IEI相关基因在人类发育中的大脑中表现出时间和区域特异性表达模式
先天性免疫错误患者经历的早期损伤超出了免疫系统功能障碍的范畴47。尽管大量神经系统改变已被认为与先天性免疫错误相关32,48–50,但人们对其影响程度仍缺乏全面认知。通过采用经过验证的先天性免疫错误相关基因分类法27,28,我们整理了517种先天性免疫错误疾病、446个致病基因(呈现独特的病理变异)及相关临床特征清单——其中在可得情况下包含已报道神经系统症状的详细描述(表S1)。这一方法使我们能够系统性地绘制与IEI相关的神经功能缺损频率和范围。我们发现41.6%的IEI病例伴随智力障碍51–53、神经发育迟滞和小头畸形54–56、焦虑症57–60,以及即使没有明显病毒感染表现也会反复发作的脑病61–64(图1A),这表明IEI基因可能影响神经发育。因此我们借助BrainSpan数据集65——一个提供不同脑区与发育阶段基因表达模式的综合资源——探究IEI基因在人脑中的表达情况。通过对IEI基因进行层次聚类分析(数据集包含444/446个致病基因,图S1A),我们在所有分析区域中识别出三个具有时相特异性表达模式的基因亚组(图1B和S1A)。值得注意的是,一个亚组在产前和婴儿早期富集(早期);另一个在婴儿晚期达到峰值(中期);最后一个从儿童期持续富集至成年期(晚期)(图1B和S1A;表S2)。在不同脑区中,小脑(CB)和丘脑(TH)的IEI基因表达水平最高。小脑中富集的IEI基因数量是丘脑的两倍以上(图1C、S1A和S1B),提示小脑可能对IEI突变的影响尤为敏感。
因此,我们利用最新发布的人类小脑单核RNA测序数据集66,以单细胞分辨率研究IEI基因的表达模式。我们分析了来自健康供体小脑的143,390个核细胞,涵盖从受孕后7周(pcw)到幼儿期(2.8-3.5岁)的9个发育阶段,并检测了IEI基因的表达(图1D–1F和S1C–S1E)。单核分析证实了人类小脑成熟过程中不同时间点和谱系的细胞异质性67–70(图1E和1F)。86%的IEI相关基因在该数据集中呈现特定表达动态(表S2):23%属于BrainSpan小脑集群,22%属于早期集群,22%属于中期集群,8%属于TH集群,7%属于晚期集群。该结果进一步证实了先前观察到的在早期、中期和小脑集群中的富集现象。IEI基因在实质内驻留免疫细胞和脑血管循环免疫细胞中均有表达(图1G,40个变异度最高基因及S1F),但仅少部分基因专属于免疫谱系(如PTPRC和IKZF1);同时我们在神经细胞中也检测到IEI基因(图1G)。我们鉴定出多个已知在大脑发育和成熟过程中具有表达和功能的基因,例如核因子κB亚基1(NFKB1)71,72、B细胞淋巴瘤/白血病转录因子11B(BCL11B)73–75和CXC趋化因子受体4(CXCR4)76,77,它们分别与NfkB1缺陷症、Bcl11b缺陷症及WHIM综合征相关,且均呈现神经系统症状(表S1和S2)。值得注意的是,部分IEI基因(25个基因,如BCL11B、PRKDC和CARD11B)同时收录于西蒙斯基金会自闭症研究计划(SFARI)数据库,并具有高置信度评分78(表S2),凸显了这些基因在神经发育障碍中的重要作用。总体而言,该表达模式提示IEI相关基因在人类发育中大脑的不同细胞类型里具有更广泛的功能。
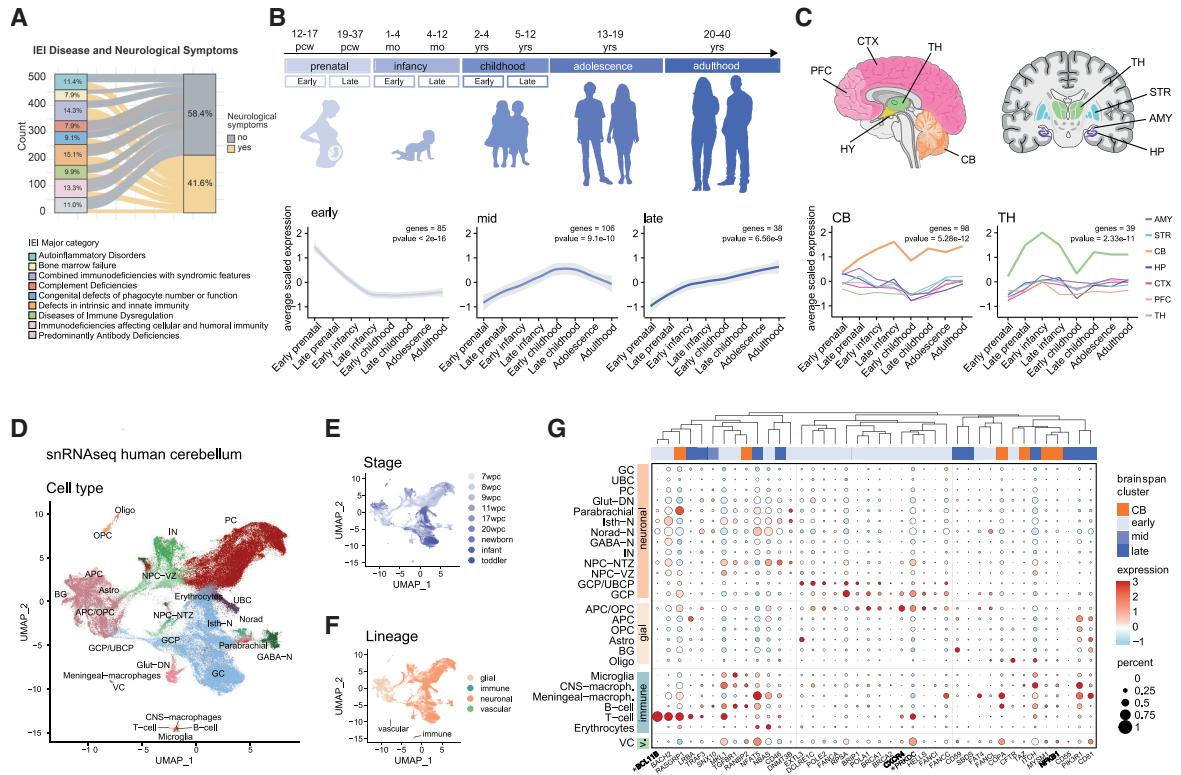
图1. IEI相关基因在⼈类发育⼤脑中呈现时空特异性表达模式(A)桑基图显⽰各临床主要IEI类别中伴有神经系统症状的IEI百分⽐。(B)⼈类发育时间点⽰意图及呈现时间特异性表达模式基因的平均标准化表达折线图(早期,85个基因,p<2e−16;中期,106个基因,p=9.1e−10;晚期,38个基因,p=6.56e−9)。©⼈脑切⽚⽰意图显⽰组织定位及呈现组织特异性表达模式基因的平均标准化表达折线图(⼩脑,98个基因,p=5.28e−12;丘脑,39个基因,p=2.33e−11)。(D)按健康捐赠者⼩脑单细胞核细胞类型着⾊的UMAP图谱。66(E和F)按发育阶段和谱系着⾊的单细胞核UMAP图谱。(G)显⽰选定IEI基因亚型特异性表达的点图。*表⽰存在于SFARI数据库的基因。
¶ 磁共振成像显示WHIM小鼠小脑结构选择性改变
为研究IEI基因改变如何影响大脑组装,我们采用已充分建立的携带WHIM相关杂合子*CXCR4S338X*突变(*CXcr4+/1013*或WHIM)的小鼠模型,该模型已被广泛用于表征免疫和骨骼缺陷33,36,38,39,79–82。
鉴于在WHIM患者中观察到的结构改变40,我们在出生后第45天(P45)对WHIM模型组和对照组大脑进行了磁共振成像扫描(图2A和图S2A)。Ex vivo MRI体素分析显示,结构改变选择性出现在WHIM模型的小脑部位(图2A和图S2A;表S3和S4)。最显著的异常发现于小脑蚓部:我们观察到沿初级裂(fpr)——即分隔小叶IV–V与小叶VI的裂隙——出现显著体积增大,而沿前山顶裂(fpc)——即分隔小叶IV–V与小叶III的裂隙——出现显著体积减小(图2A和图S2A)。由小脑传入和传出投射构成的白质arbor vitae分支长度在小叶III和小叶IX中缩短(图2B),提示*Cxcr4+/1013*动物群体中向小脑传递感觉运动信息及从小脑传出相关信息的通路发生了改变。
随后,我们通过尼氏染色法评估了P45小鼠的小脑细胞构筑结构。在测量沿小脑小叶单层排列的浦肯野细胞所构成的浦肯野细胞层(PCL)长度时67,我们观察到WHIM模型小鼠小脑蚓部第三、第八和第九小叶的PCL出现缩短(图2C和S2B)。我们还评估了不同耳间平面水平小脑半球的PCL,发现包括正中旁小叶(PML)在内的多个小叶均存在显著缩减(图2C和S2B)。值得注意的是,啮齿类动物的正中旁小叶在解剖学上被认为与人类的薄束小叶相对应83,而薄束小叶正是WHIM患者中小脑改变最显著的区域40。
这些数据共同支持WHIM小鼠存在区域性小脑异常和选择性小叶缺陷,与WHIM患者中报道的结果极为相似。
¶ WHIM突变体表现出早期行为改变,对焦虑相关表型具有持久影响
因此,我们研究了WHIM突变体中异常的形态缺陷是否会导致行为改变。首先,我们在旷场中评估了WHIM小鼠的活动情况(图2D)。它们表现出增强的趋触性(倾向于贴近墙壁移动的特性,图2D),外围区域的活动时间显著增加(图S2C),同时减少了在中心区域的静止时间(图S2C)。与对照组相比,这些个体的垂直活动计数更低(图2D),移动总距离更短且运动速度更慢(图S2C)。
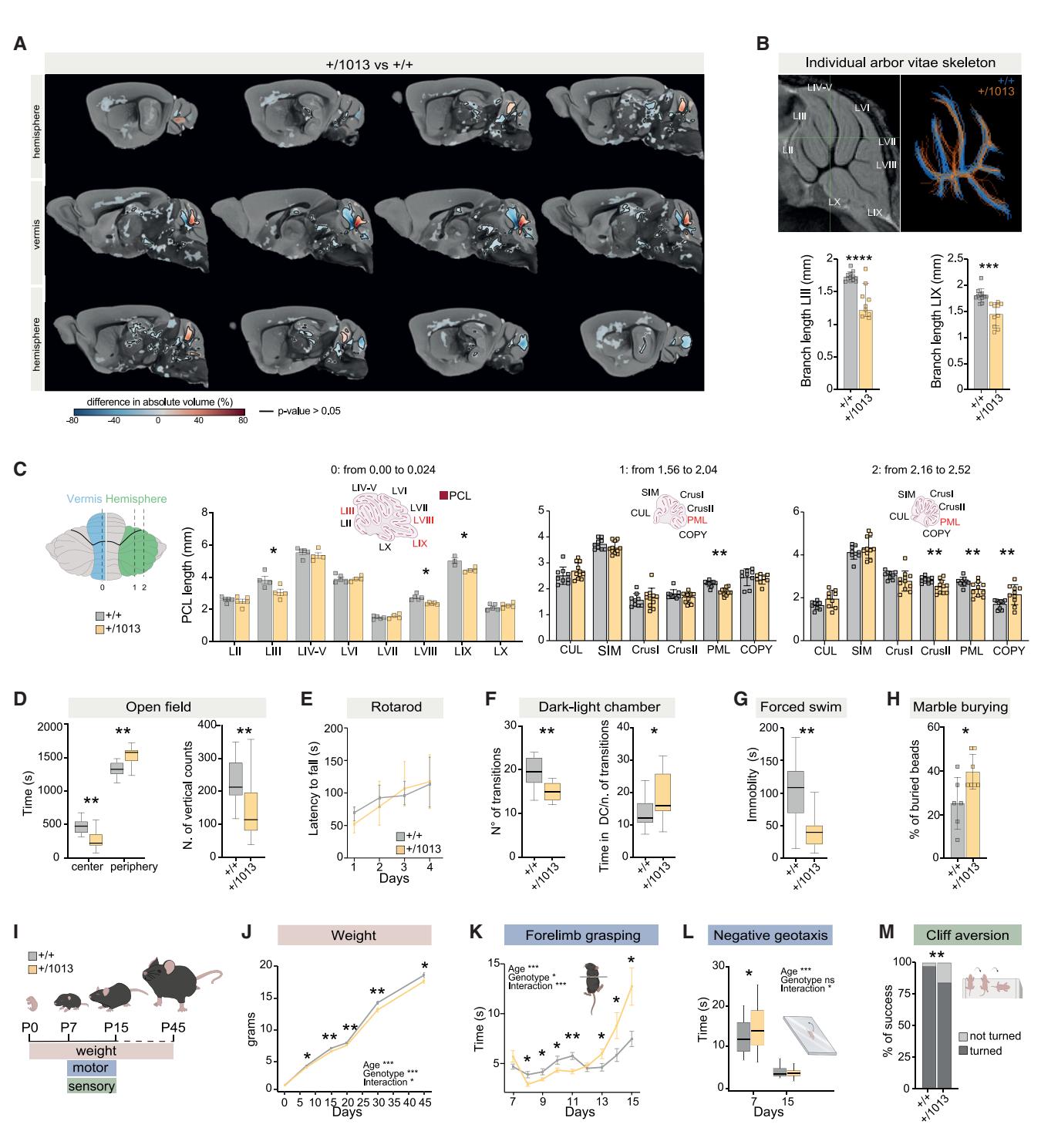
图2. WHIM突变体呈现⼩脑形态改变及焦虑样⾏为表型(A)⼩脑体积的体素级⽐较显⽰P45期WHIM⼩⿏存在宏观形态异常。红⾊:WHIM⼤于对照组;蓝⾊:WHIM⼩于对照组;⿊⾊轮廓:FWE校正后*p<0.05区域;n>9只/条件。(B)⽩质活树Arbor Vitae的⼆维⻣架分析。**p<0.01;n>9只/条件。©⼩⿏⼩脑背侧⽰意图。⼩脑蚓部及半球不同耳间⽔平的柱状图与⽮状切⾯。多重t检验,*p<0.05,**p<0.01;n>4只/条件。(D)显⽰WHI M⼩⿏在开放场停留时间与垂直活动次数的箱形图。学⽣t检验,**p<0.01;n=16只/条件。(E)加速旋转棒跌落潜伏期(秒)的线性图。双因素⽅差分析,*p<0.05;n=11只/条件。(F)穿梭次数、暗室停留时间与穿梭次数之⽐的箱形图。学⽣t检验,*p<0.05,**p<0.01;n=16只/条件。(G)静⽌时间(秒)箱形图。学⽣t检验,**p<0.01;n=16只/条件。
为具体评估*CXcr4+/1013小鼠是否表现出运动表型改变,我们进行了加速旋转棒测试。观察到WHIM小鼠与对照组小鼠的跌落潜伏期无显著差异(图2E和S2D),表明CXcr4+/1013*动物在旷场实验中表现出的活动缺陷并非源于运动功能障碍,提示存在焦虑样表型。事实上,*CXcr4+/1013小鼠在明暗箱测试中表现出探索行为减少,具体表现为箱间穿梭次数减少及在暗箱中停留时间延长(图2F)。此外,在强迫游泳测试中它们表现出不动时间减少(图2G),提示存在与焦虑相关的应对策略功能失调84。自梳理测试中未发现差异(图S2E),但观察到理珠埋藏行为显著增加(图2H)。总体而言,这些数据表明CXcr4+/1013*小鼠存在焦虑样行为。
为理解Cxcr4过度激活对感觉和运动发育的影响,我们采用了一套基于Fox量表85的标准化测试组合(图2I–2M和S3)。与对照组同窝幼崽相比,WHIM幼崽从出生后第7天(P7)起表现出较低体重(图2J)。它们在自由活动(图S3B)和空中翻正(图S3E)测试中未显现运动缺陷,但在旷场穿越(图S3C)与平面翻正(图S3D)测试中呈现出短暂性显著差异。此外,WHIM幼崽在前肢抓握测试(图2K)中表现出行为障碍,提示神经肌肉发育迟缓。通过负趋地性测试测量的前庭重力线索运动反应延迟86,证实其协调性与定向能力存在损伤(图2L)。在耳颤搐(图S3F)和听觉惊跳(图S3G)测试中,还发现其对感觉和听觉刺激的反应延迟。同样,评估感觉刺激驱动运动输出整合能力的悬崖回避测试,揭示了WHIM幼崽的缺陷性反应(图2M)。总之,我们的研究结果表明*CXcr4+/1013*幼崽遵循非常规的躯体感觉与运动发育轨迹。
总体而言,我们的分析表明WHIM小鼠表现出类似焦虑的表型,与WHIM患者中报道的情况相似40。我们的结果还提示Cxcr4过度激活会干扰新生神经环路的发育,导致早期产后发育阶段出现运动协调和感觉整合缺陷。这些发现为理解Cxcr4在神经发育障碍中的作用提供了新见解。
¶ WHIM小脑结构损伤始于孕早期阶段
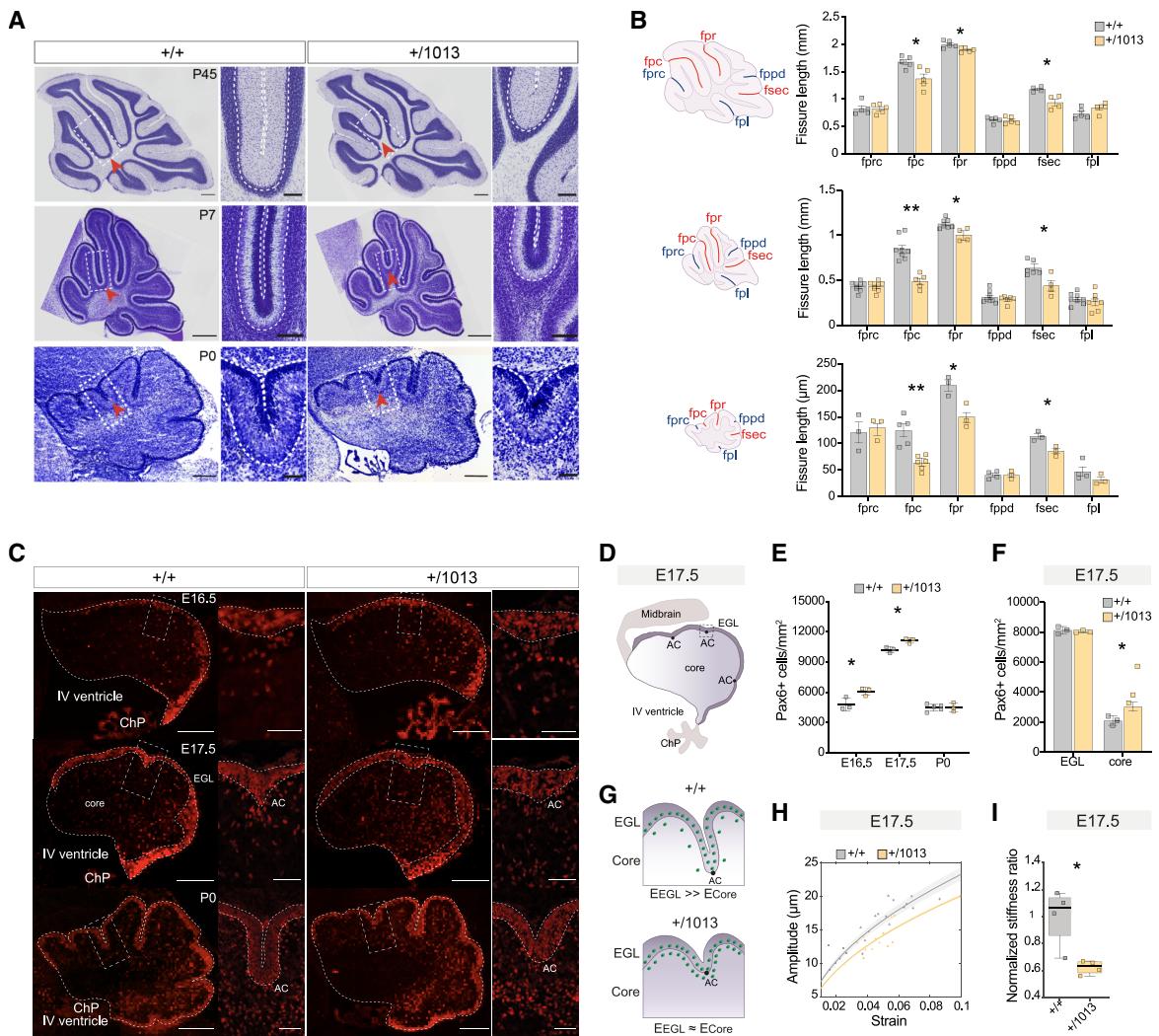
小脑神经元回路对复杂功能的正确执行至关重要87–89,它源于延长的出生后神经发生和高度协调的迁移过程90。我们随后探究WHIM突变体中观察到的分叶缺陷是否反映小脑组装的早期改变。通过测量成年(P45)、出生后早期(P7)和新生(P0)小脑蚓部水平划分不同小叶的裂隙长度12(图3A),发现在每个阶段均存在一致的宏观形态学改变:与同窝对照组相比,WHIM小鼠的正中后裂、锥体后裂以及分隔VIII-IX小叶的次裂长度显著缩短(图3B、S4A),表明Cxcr4突变会严重损害小脑结构。
在小脑发育过程中,外颗粒细胞层(EGL)与内核区呈现不同的生长速率,导致细胞密度差异。这一过程驱动锚定中心(ACs)的形成及后续脑沟裂的延伸91。为探究小脑脑叶异常形成的机制92,93,我们评估了WHIM突变体中EGL与内核的差异性扩张现象。采用权威标志物Pax6检测*Cxcr4+/1013*小脑中颗粒细胞前体(GCPs)与颗粒细胞(GCs)的密度及数量,发现脑叶形成前(E16.5、E17.5期)WHIM小脑的Pax6+细胞密度显著上升(图3C-3E),而细胞总数保持不变(图S4B)。值得注意的是,E17.5期这种变化可归因于小脑内核区Pax6+细胞密度的增加(图3F、S4C)。我们的结果与先前提出的表面皱褶模型相契合,该模型将小脑发育中的折叠动力学解释为EGL与内核间的差异性扩张91,94。因此我们借鉴软质双层材料数学模型95,对E17.5期和P0期小脑切片的形态计量数据进行分析,描述皱褶不稳定性演化过程(图3G)。在E17.5期,内核细胞密度增加会降低新生脑叶的振幅(图3H),这源于EGL与内核间刚度比值的减小(图3I、S4D)。尽管P0期可见明显形态学改变(图3A、3C),但Pax6+细胞密度(图3C、3E)与皱褶分析(图S4E)均未显现差异。这些力学改变导致WHIM突变体出现异常折叠模式,揭示了颗粒细胞前体在出生前行为的关键动态特征。
¶ 单细胞测序分析揭示了小脑前体细胞中过度活跃的Cxcr4信号传导
为了研究*CXcr4+/1013*小鼠中观察到的异常脑回形成的细胞和分子基础,我们对显微切割的小脑小叶进行了单细胞RNA测序(来自P0 *CXcr4+/1013*和对照组的LIII-VI-V,图4A)。通过分析10,742个细胞(按基因型比例分布,图S5A–S5C),我们进行了无监督聚类,揭示了26个簇,归属于19种不同的细胞类型(图4B和图S5A–S5C)。与最近发表的数据集一致66,我们识别出:
- 颗粒前体细胞(GPC,标记物:Top2a、Mki67和Cxcr4)
- 双能前体细胞(BPs,标记物:Glis3、Sox2和Pax3)
- 胶质生成前体细胞(GPs,标记物:Tnc、Slc4a4、Apoe和Aldh1l1)
- 室管膜前体细胞(epy,标记物:Spag17、Foxj1和Tmem212)
- 不同类型的小脑兴奋性神经元:单极刷状细胞(UBCs,高表达Kirrel3、Eomes、Lmx1a)、颗粒细胞(GCs,表达Reln、Neurod1、Eps8、St18),以及分子特征不同的颗粒细胞前体亚群(GCP-A *Top2a+*和GCP-B Mfap4+)及颗粒细胞亚型(GCI *Neurod1+*和GCII)
- 抑制性神经元:浦肯野细胞(标记基因为Pcp2、Calb1)、中间神经元(INs,表达Gad1/2、Pax2、Slc6a5,含表达生长抑素(Sst)的亚群)
- 小脑与中脑交界区域(峡部)的神经元群体:峡部神经元(isth-N,富集Lhx9、Otx2、Asic4)
- 小脑深部核团的GABA能神经元(GABA-DN,富集Sox14、Gad1/2)
- 非神经元细胞群和中胚层衍生细胞类型:小胶质细胞(Cx3cr1、Trem2)、血管细胞(Cldn5、Flt1、Cdh5、Pecam1)、脑膜内皮细胞(Cxcl12、Vtn)、间充质细胞(Col1a1、Col3a1、Dcn)
我们概述了Cxcr4的表达情况,并在颗粒细胞前体、颗粒神经元、篮状细胞、小胶质细胞和室管膜细胞中予以确认(图4C)。通过差异基因表达分析(图4D、4E),我们发现神经元和胶质祖细胞的转录足迹存在显著差异(表S5),同时伴随着神经元分子特征的改变。GCPs表现出最多数量的差异表达基因(DEGs);相比之下,isth-N、GABA-DN和非神经细胞类型(包括小胶质细胞)尽管数量较少,但在WHIM小脑中显示出可忽略或没有转录变化(图4D和4E)。在BP、GP和GCPs中观察到一个明显的转录失调模式,而GCPs A和B共享几个失调基因(图4F),表明在WHIM小脑祖细胞中触发了谱系特异性反应。
通过对祖细胞簇的富集分析,我们发现Cxcr4信号通路存在广泛而协调的激活现象(图4G和图S5D;表S6),这暗示其可能增强细胞迁移和存活能力。为验证这一假设,我们开展了生物学功能的系统性分析(采用ingenuity通路分析技术),结果显示与细胞迁移、侵袭及细胞骨架动力学增强相关的功能术语显著富集(图4G;表S7),这些发现为揭示Cxcr4过度激活在小脑祖细胞中的多效性作用提供了重要线索。
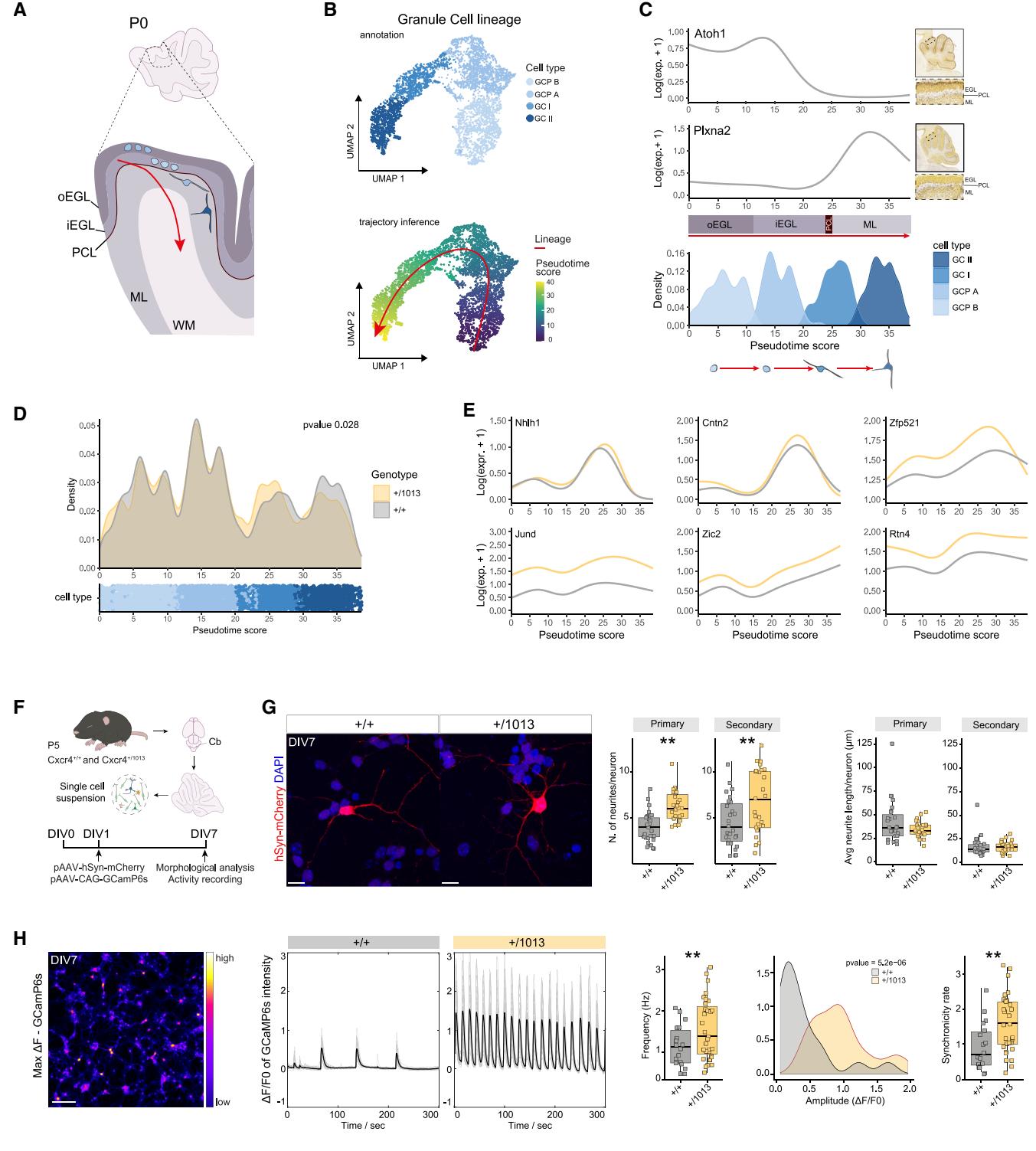
图5. GC缺陷与免疫表型独⽴发⽣(A) GC谱系发育⽰意图。(B)按细胞类型和伪时间评分着⾊的GC谱系UMAP图,红⾊⾼亮显⽰推断的发育轨迹。©线形图展⽰对照⼩脑中选定定位基因(Atoh1和Plxna2)的表达情况,附艾伦脑图谱提供的相对P4原位杂交图像;密度图显⽰细胞沿伪时间的分布,按细胞类型着⾊。(D)细胞分布图显⽰沿伪时间评分的细胞密度,按基因型(上图,密度图,Kolmogorov-Smirnov检验,p=0.028)和细胞类型(下图,点图)着⾊。(E)线形图展⽰Cxcr4+/1013⼩脑在伪时间过程中选定上调基因的表达变化。(F)实验⽅案⽰意图。
有趣的是,伯格曼胶质细胞(BG)的前体——GP细胞(在小脑叶片化过程中会沿每个裂隙(AC)基部排列其纤维,作为颗粒细胞(GCs)向内迁移的轨道94)——表现出Cxcr4通路上调,同时与细胞突起形成和细胞骨架组织相关的术语出现失调(图4G和4H)。为验证GP中观察到的分子变化,我们采用脑脂质结合蛋白(BLBP)标记物进行免疫染色以特异性标记BG96。对BLBP+纤维的追踪分析显示,在P7时期*Cxcr4+/1013*突变体的BG纤维排列发生改变:WHIM模型动物分子层中BLBP+突起数量显著减少,同时这些纤维在LIII与LIV间AC处形成的角度较对照组增大(图4H和4I)。BG纤维这种非典型的扇形分布模式很可能导致小脑小叶发育异常。
总体而言,我们的单细胞分析表明,Cxcr4突变会影响发育过程中多种小脑祖细胞的演化格局,这支持了该突变对不同谱系分化产生直接作用的观点。
¶ 过度活跃的Cxcr4信号传导影响GC分化和自发活动
鉴于在GCPs中观察到的转录变化,我们研究了WHIM小鼠中GCP衍生物(即成熟GCs)的分化与成熟是否受到影响(图5A)。通过推断轨迹拓扑结构并进行拟时序分析,我们检测了颗粒细胞谱系的发育路径(图5B)。我们在GCP-B确定了一个共同的起点(根节点)——该簇具有最高熵值,代表最低分化水平的平均值97(图S5E)——轨迹由此经GCP-A和GCI向前推进,最终终止于GCII(图5B、5C和S5F)。在*Cxcr4+/1013*与对照组之间未观察到谱系拓扑结构的改变(图5B)。
值得注意的是,GCPs起源于菱形唇,迁移至外颗粒层(EGL),随后随着分化为成熟GCs92(示意图见图5A)而向内移动至内颗粒层(IGL)。这种发育轨迹已知与基因表达的动态变化相关,这些变化可识别沿小脑迁移的GCs分化阶段98。我们的伪时间分析证实,位置特异性标记物(如Atoh1和Plxna2)的表达模式遵循与颗粒细胞沿发育轨迹分布相对应的分化序列(图5C和S5F)。这使我们能够将伪时间评分作为分化和颗粒细胞迁移的双重指标,并同步评估不同基因型中的这两个过程。我们观察到细胞分布存在显著差异,其中与GCI状态相关的频率出现分化(伪时间评分20-30,图5D)。尽管Cxcr4仅在祖细胞中特异性表达,但我们发现整个伪时间轨迹都存在转录变化(图5D和5E)。这些发现证实了我们先前关于WHIM小鼠颗粒细胞迁移受损的观察结果(图3),同时揭示了影响该细胞系的更广泛分化缺陷。
然而,仍有待阐明的是:这种迁移受阻是否会干扰分化进程,亦或两种损伤均是Cxcr4信号通路过度活跃所导致的独立结果。
为探究Cxcr4调控异常对颗粒细胞(GCs)的内在影响,我们从P5 Cxcr4+/1013及对照组小脑中分离出GCs并进行体外培养(ex vivo),从而排除局部迁移信号的影响。在体外培养第1天(DIV1),我们通过pAAV-hSyn-mCherry稀疏标记神经元进行形态学分析(图5F、5G),同时利用pAAV-hSyn-GCaMP6s观测其自发电活动(图5F-5H)。至DIV7时,我们发现Cxcr4+/1013神经元与对照组相比初级和次级分支数量显著增加,但神经突长度未发生变化(图5G),表明其对小脑形态复杂性产生了直接影响。在此阶段,我们还发现WHIM GCs相较于对照组在多个神经元中表现出显著增加的放电频率和放电同步率(图5H)。这些发现与既往研究一致:Cxcr4/Cxcl12信号通路改变(例如Cxcr4基因敲除模型)不仅影响神经元定位,还会干扰兴奋性、树突生长及突触可塑性等内在特性99。
总之,我们的研究结果表明Cxcr4的过度激活直接影响颗粒细胞的发育和成熟。虽然神经元分化轨迹与迁移行为是紧密交织的过程,但我们的ex vivo数据表明,WHIM综合征引发的形态和功能表型异常源于颗粒细胞谱系的自主性缺陷,这一缺陷与发育中小脑的三维细胞结构无关,也不受任何外周因素改变的影响。
¶ WHIM⼩⿏颗粒谱系发育缺陷影响浆细胞分化及功能特性
颗粒细胞的正常发育是浦肯野细胞成熟所必需的。90浦肯野细胞具有独特的树突乔⽊结构(图6A),并呈现⼩脑⽪质的唯⼀输出。100在我们的转录分析中,浦肯野细胞及其他Cxcr4阴性细胞均表现出显著的基因表达失调(图4D)。富集分析显⽰,与树突分枝化和轴突形成相关的基因,以及突触神经传递和⻓时程增强相关的基因均出现下调(图6B),这表明浦肯野细胞的发育和突触成熟过程受损。⼀致地,我们观察到P30时期受损⼩叶内浦肯野细胞总数减少(图6C)。此外,尽管树突分⽀点的总数未⻅显著变化(数据未显⽰),但在距离胞体特定范围(40-70μμm)内,我们发现浦肯野细胞树突复杂性显著降低(图6D和图S6A)。这表明Cxcr4的过度激活以⾮细胞⾃主性⽅式选择性调控浦肯野细胞数量及其近端树突分⽀,可能破坏神经环路的组装。
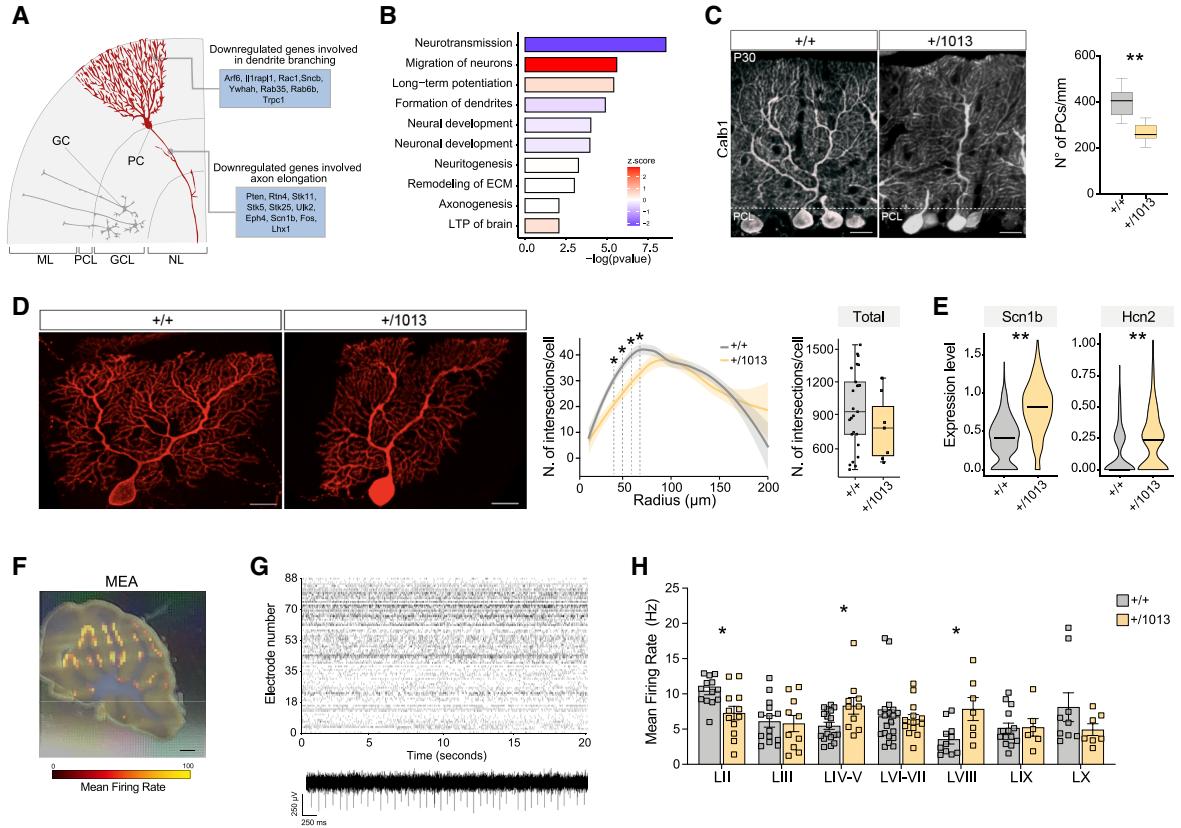
图6. Cxcr4突变的⾮细胞⾃主效应(A)⼩脑层结构⽰意图,显⽰浦肯野细胞定位及部分下调基因。(B)条形图展⽰浦肯野细胞中主要失调的⽣物学功能,按激活Z评分着⾊。(C)P30⼩脑免疫荧光染⾊显⽰Cxcr4+/1013区域Calb1+阳性浦肯野细胞(红⾊),箱形图显⽰浦肯野细胞密度。Student t检验,**p<0.01;n>7只动物/组。⽐例尺20μm。(D)对照组与WHIM⼩⿏P21时期单个浦肯野细胞。线形图显⽰树突半径(μm)及交叉点数量,箱形图显⽰总交叉点数。Student t检验,*p<0.05;n>7个细胞/组。⽐例尺20μm。(E)⼩提琴图显⽰浦肯野细胞中Scn1b与Hcn2的表达,**p<0.01。(F)⼩脑切⽚光学图像与活动图谱叠加。⽐例尺2 mm。(G)对照组⼩脑活动记录的代表性点阵图(上)及随时间推移单个活性电极记录的动作电位(下)。(H)条形图显⽰各脑叶平均放电频率的定量分析。圆点表⽰分析切⽚数量。Mann-Whitney检验,*p<0.05;n>6只动物/组。
转录组分析显⽰,若⼲离⼦通道基因表达增加,包括钠电压⻔控通道β1亚基(Scn1b)与超极化激活的环核苷酸⻔控通道在WHIM浦肯野细胞中观察到的clic核苷酸⻔控通道2(Hcn2)(图6E)。为探究WHIM⼩脑异常特征可能引发的功能后果,我们采⽤⾼密度多电极阵列记录了Cxcr4+/1013与对照组⼩脑切⽚的⾃发电活动(图6F‒6H、S6B‒S6E)。在基础条件下,该技术可记录浦肯野细胞活动101。WHIM切⽚的整体平均放电频率和活跃单元数量与对照组⽆显著差异(图S6C),但特定⼩叶的放电频率存在明显差异(图6H、S6E)。在WHIM⼩脑中,毗邻异常脑沟的LIV‒V叶和LVIII叶显⽰平均放电频率显著升⾼,且LVIII叶的棘波振幅也相应增⼤(图S6D)。
总体⽽⾔,这些数据证明了⼩脑发育过程中兴奋性和抑制性神经元之间的密切相互作⽤,导致异常的⼩叶特异性⽹络活动,并可能损害WHIM⼩脑⽪层的整体输出。
¶ WHIM突变体表现出先天性白细胞减少症,但小脑中的免疫状态未发生改变
尽管在成年期已得到广泛表征36,38,但WHIM小鼠在发育过程中的免疫表型从未被探索过。这一空白尤为关键,特别是考虑到WHIM患者102,103早期出现的免疫缺陷现象,以及我们在*Cxcr4+/1013*幼鼠中获得的神经发育研究结果。为此,我们对WHIM小鼠进行了从胚胎期16.5天(E16.5)到出生后45天(P45)的纵向免疫特征分析,采用多参数流式细胞术检测了肝脏、脾脏、血液及小脑组织(图7A)。
不出所料,在E16.5时期的WHIM模型胎肝中,所有研究的免疫细胞群体均未发现差异(图7B),胎肝造血过程独立于Cxcr4-Cxcl12轴进行104–106。相应地,在同一阶段的脾脏免疫群体数量中也未观察到变化(图S7E和图S7F)。
有趣的是,早在P0阶段,携带WHIM突变的小鼠就表现出明显的中性粒细胞减少症和淋巴细胞减少症(图7C、7D、S7A和S7B)。在WHIM突变体的血液中观察到CD45+细胞数量广泛减少(图7C、7D、S7A和S7B),而在新生WHIM小鼠的脾脏中,CD11b+免疫细胞、中性粒细胞和B细胞均显著减少,其他分析细胞类型也呈现整体下降趋势(图S7E和S7G)。
在所研究的任何免疫群体(包括驻留小胶质细胞)中,均未检测到WHIM小脑存在差异(图7E、7F和S7C)。同时,小胶质细胞丰度与CD86平均荧光强度(激活标志物)均保持不变(图7E和7F)。一致性地,Iba1免疫染色显示Cxcr4+/1013与对照组新生小鼠的小胶质细胞密度无差异(图7G),且在P21时期,以前端分支与连接点计数/细胞衡量的小胶质细胞形态也未受影响(图7H)。值得注意的是,WHIM小鼠始终在无特定病原体(SPF)条件下饲养,从未接触任何免疫挑战。此外,与焦虑样行为相关的γδT细胞介导的白细胞介素(IL)-17信号通路组分——Il17及其受体Il17ra的表达水平在WHIM小脑中均未发生改变(图S7D)。
这些发现共同表明,在基础条件下,WHIM小脑并未表现出免疫失调的迹象,从而支持了观察到的形态和行为表型具有细胞自主性起源。
¶ 早期发育干预可改善WHIM综合征的行为和结构缺陷
AMD3100是一种CXCR4拮抗剂,目前正作为治疗WHIM综合征免疫相关症状的潜力疗法处于评估阶段。然而,尽管该疾病的临床表现早在出生时即已显现102,103,迄今为止的临床试验仅纳入了10岁以上的患者44–46。
为评估早期脑特异性CXCR4抑制能否挽救WHIM表型,我们在E12.5阶段向侧脑室内注射AMD3100,并在P7和P45阶段分析行为学和小脑结果(图8A)。接受治疗的*Cxcr4+/1013*幼崽体重显著增加,与野生型对照组相比(图8B),表明AMD3100影响了关键的发育轨迹。在悬崖回避测试中,几乎所有AMD3100处理的幼崽都表现出适当的回避反应,与载体处理的突变同窝仔表现较差形成对比(图8C)。形态学评估显示,P7时小脑裂长度显著恢复(图8D和S8A),同时P45时观察到fsec长度部分改善(图S8B)。
为了探索具有潜在临床意义的早期产后治疗干预,我们在P1时重复进行了脑室内AMD3100注射(图8E)。与in utero给药类似,AMD3100处理的*Cxcr4+/1013*幼崽在P7时体重显著增加,达到与野生型相当的水平(图8F),并且在悬崖回避测试中的表现明显优于载体处理的突变同窝仔(图8G)。在P45时,治疗组小鼠在开放场中心停留时间增加,垂直站立次数增多(图8H),表明探索行为改善。该阶段的形态学分析还显示fsec长度增加(图S8C),与胚胎期AMD3100给药的结果一致。
这些发现共同提供了有力证据,表明WHIM小鼠中观察到的结构和行为异常源于发育中大脑的Cxcr4内在功能障碍,并可通过早期靶向干预得以修复。
¶ 讨论
我们的研究结果为理解慢性免疫条件下神经行为症状背后复杂的神经免疫相互作用提供了新视角。通过发现IEI基因在小脑谱系中的发育富集现象,我们提出内在的、脑特异性因素可能是IEI患者神经行为特征的潜在机制。基于对WHIM小鼠模型的全面表征——该模型精准重现了人类遗传和免疫表型33,36,38,39——我们证明即使在无免疫挑战的情况下,颗粒细胞前体仍是小脑叶缺陷和观测到的神经回路错误连接的关键介导因子。其分子、形态和功能层面的紊乱会损害浦肯野细胞发育和小脑输出功能,最终导致与患者临床表现相符的持久性行为表型。
¶ 绘制发育过程中IEI相关基因的人脑表达图谱
虽然行为改变在IEI和其他慢性炎症状况中经常被报道,尤其是焦虑和抑郁,但这些症状常被归因于全身性疾病的继发表现——特别是在儿科患者中。然而,未确诊或未治疗的神经精神症状可能产生深远的长期影响。尽管先前研究已通过非细胞自主途径将免疫信号与大脑功能联系起来2,17,108,但IEI基因对神经发育过程的直接贡献尚未得到系统性研究。
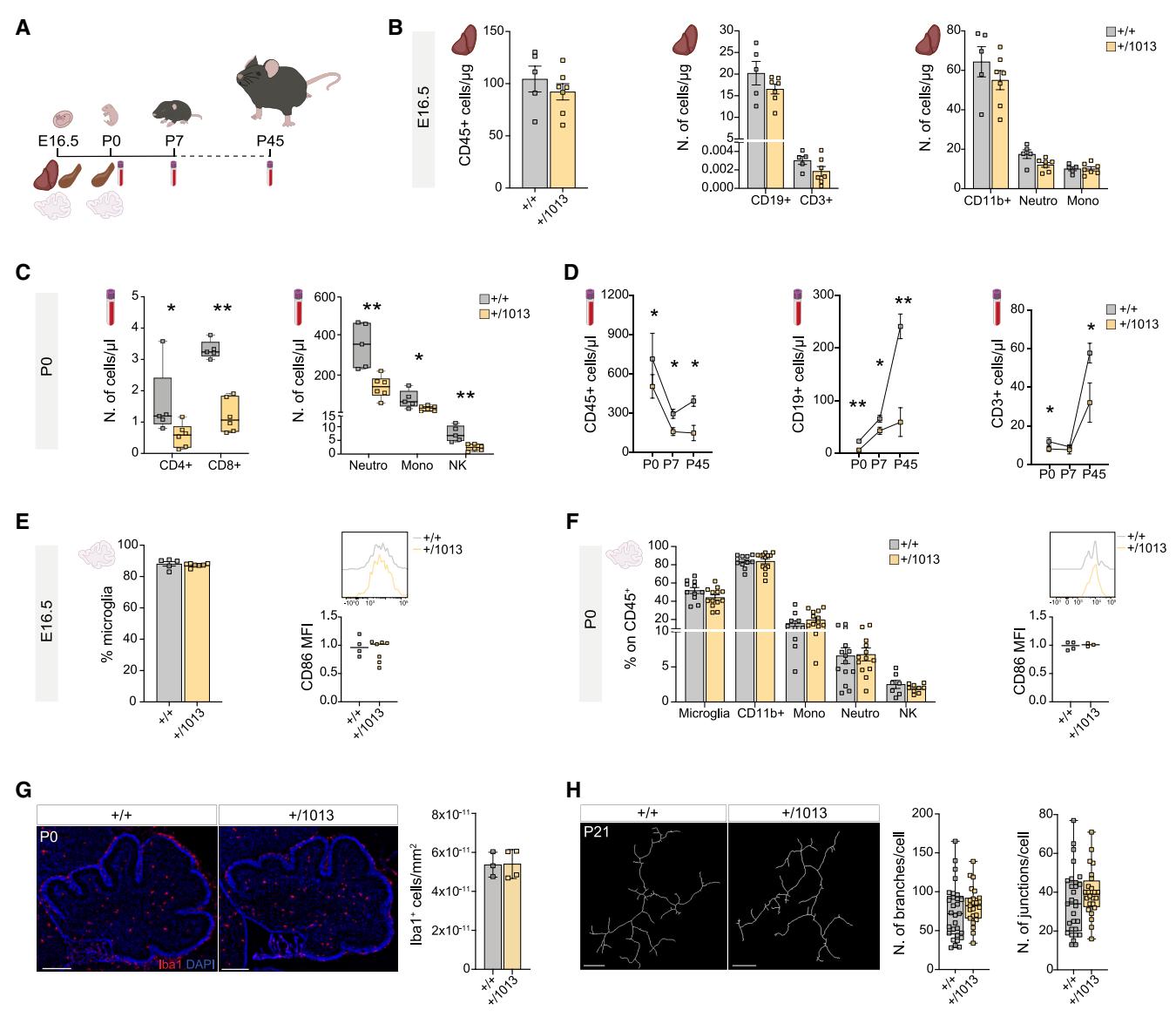
图7. WHIM突变体表现为先天性⽩细胞减少症,但⼩脑免疫状态未改变(A)实验⽅案。
(B)柱状图显⽰通过流式细胞术分析的E16.5 WHIM模型肝脏免疫细胞亚群。学⽣t检验,*p<0.05;n>4只动物/组。数据以平均值±SEM表⽰。©箱形图显⽰通过流式细胞术分析的P0 WHIM模型⾎液循环免疫细胞亚群。学⽣t检验,*p<0.05;n>4只动物/组。数据以平均值±SEM表⽰。(D)折线图显⽰通过流式细胞术分析Cxcr4+/1013⾎液中P0⾄P45期间的CD45+、CD19+和CD3+循环细胞。学⽣t检验,*p<0.05,**p<0.01;n>4只动物/组。(E)散点图显⽰通过流式细胞术分析的E16.5 WHIM模型⼩脑中CD45+细胞上的⼩胶质细胞百分⽐、CD86平均荧光强度及相对定量。学⽣t检验,*p<0.05;n>4只动物/组。(F)散点图显⽰通过流式细胞术分析的P0 WHIM模型⼩脑免疫学特征、CD86平均荧光强度及相对定量。学⽣t检验,*p<0.05;n>3只动物/组。数据以平均值±SEM表⽰。(G)Cxcr4+/1013与对照组P0时期⼩脑切⽚的⼩胶质细胞标记物Iba1染⾊代表性图像及密度柱状图。⽐例尺200μm。多重t检验,*p<0.05;n>3只动物/组。(H) P21时
期WHIM与对照组⼩脑Iba1+⼩胶质细胞的3D重建及相对定量。⽐例尺10μm。多重t检验,*p<0.05;n>3只动物/组。
在此,我们首次对IEI及其遗传结构和相关临床特征进行全面分析。本研究发现超过40%的IEI基因与神经行为表型相关这一数据,可能因患者神经系统特征研究不足而仍被低估。通过识别特定发育通过⼼智窗⼝和⼩脑脆弱性,我们为深⼊理解免疫相关基因变异如何塑造⼤脑结构和功能奠定了基础。
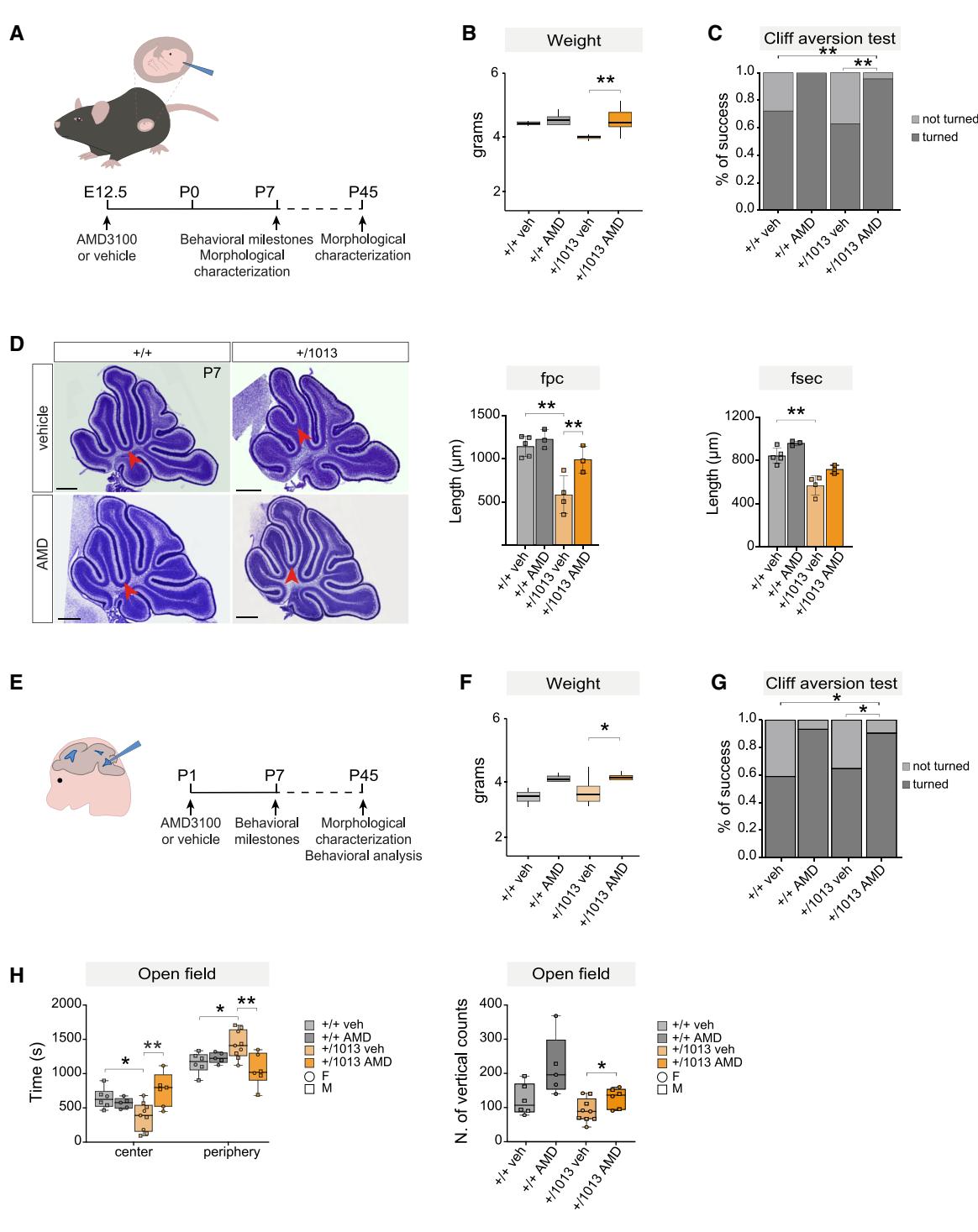
图8. WHIM⾏为与结构异常可在发育早期阶段被挽救(A)显⽰E12.5期注射AMD3100或对照溶剂的实验⽅案(B)箱形图显⽰E12.5期注射AMD3100或对照溶剂后P7幼崽的体重。多重t检验,**p<0.01;n>4只动物/组©柱状图显⽰E12.5期接受AMD3100或对照溶剂处理的P7幼崽在悬崖回避测试中的转⾝百分⽐。多重t检验,**p<0.01;n>4只动物/组 (D)在E12.5注射AMD3100或载体后,P7时WHIM和对照⼩脑的代表性⽮状Nissl切⽚以及显⽰裂沟⻓度的柱状图。⽐例尺,200μ微⽶。多重t检验,**p<0.01;n>每个条件3只动物。(E)出⽣后注射AMD3100或载体的实验⽅案。(F)箱形图显⽰在P1注射AMD3100或载体后P7幼崽的体重。多重t检验,*p<0.05;n>每个条件4只动物。
¶ 与WHIM相关的突变直接控制GC时空动态
对免疫功能紊乱小鼠模型(如IL-6、IL-10和IL-18基因缺陷小鼠)的MRI研究已表明,免疫失调与大脑结构改变存在关联,尤其在小脑和外侧隔膜区域109。我们的研究通过揭示一种直接的基因特异性机制拓展了该领域:Cxcr4的过度活化会干扰颗粒细胞前体行为,从而损害小脑叶化(通过MRI和组织学评估)与颗粒细胞回路组装。鉴于树突接收的输入信号密集而高度特异,可以合理推断胚胎期WHIM小脑中颗粒细胞的功能行为深受其精确空间定位的影响110。
我们在Cxcr4依赖性BG纤维扇形图案改变方面的研究结果,影响了WHIM小鼠小叶中成熟GC的最终排列格局,这可能调控细胞间接触信号及其沿小叶迁移的支架结构。这些发现共同印证了存在一个明确的产前发育窗口期——该窗口不仅主导小叶化的启动与进程,更通过机械支撑作用受到高活性Cxcr4通路的持续调控。颗粒细胞(GCs)跨层协调迁移与其分化过程紧密相连,建⽴了成熟状态与空间定位之间的明确关联——这种关联可通过单细胞伪时间/伪空间分析有效捕捉。这种耦合现象并⾮GC谱系所独有,其他神经元群体——⼩脑111与⼤脑⽪层112的抑制性中间神经元——在向最终位置迁移的过程中,也会逐步明确其⾝份特征。
我们的exvivo培养实验表明,即使没有迁移线索,WHIM颗粒细胞也表现出独特的形态学和电⽣理学特征。既往对孤⽴颗粒细胞的研究表明,其迁移遵循内在的连续形态变化程序,这⼀过程不依赖外部信号,最终进⼊以树突分⽀增多为特征的静⽌期99,113。因此,WHIM颗粒细胞中观察到的分⽀增多现象invitro很可能源于迁移过早停滞及神经突⽣成提前。
考虑到免疫学纵向数据,表明在WHIM⼩⿏中观察到的结构缺陷源于GC迁移和分化的内在改变。
¶ WHIM突变损害⼩脑回路组装与⾏为功能
⼩脑在情感调节中的作⽤⽇益受到关注,其连接性改变与焦虑和情绪障碍密切相关。114,115在细胞尺度上,颗粒细胞作为全脑数量最庞⼤的神经元群体,能编码多种感觉与运动信息,其活动模式可反映感觉运动情境。110WHIM幼⿏⾏为中普遍存在的改变,印证了⼩脑颗粒细胞在整合感觉与运动信号中的重要作⽤。颗粒细胞确实接收来⾃来⾃苔藓纤维,将信息传递⾄浦肯野细胞,继⽽投射到⼩脑核团。这种复杂的结构最终将⼩脑与中枢神经系统其他部分相连。110本研究显⽰,Cxcr4相关改变不仅影响颗粒细胞,还会以⾮细胞⾃主⽅式影响浦肯野细胞,改变其转录谱并减少树突延伸与分⽀复杂度,最终导致微环路活动变化。兴奋性与抑制性神经元亚型间的动态相互作⽤已被证明对⼤脑发育⾄关重要,116,117但不同⼩叶中颗粒细胞-浦肯野细胞连接是否受特定分⼦编码调控以实现细胞类型特异性及空间组装,仍有待阐明。
尽管WHIM幼鼠的早期发育行为受到干扰,但部分行为在出生后第二周有所改善,这表明存在代偿机制的可能性。然而,焦虑样表型会持续到成年期,且可通过CXCR4拮抗剂逆转,这凸显了小脑情感回路可塑性有限,并进一步证实发育敏感期的存在118。未来研究应探讨这些效应是小脑特异性表现,还是远距离神经连接广泛受损的结果。
¶ 早期AMD3100治疗可恢复WHIM小鼠的小脑脑叶形成,并对其行为产生持久影响
CXCR4拮抗剂AMD3100已获国际药物机构批准用于儿科造血干细胞动员119,120,但仅在10岁以上WHIM综合征患者中进行过测试44,45。本研究表明,在小鼠胚胎期和出生后早期阶段进行脑室内AMD3100给药,可改善小脑形态并挽救行为缺陷。这些发现揭示了针对中枢神经系统的早期干预在CXCR4相关病理中具有前所未有的潜力。尽管既往研究显示in utero脑室内注射AMD3100可调节表达Cxcr4的GABA能中间神经元进入小鼠皮质板的过程121,但据我们所知,这是首个证明AMD3100直接作用于小脑发育过程的证据。
尽管我们的研究结果揭示了Cxcr4-Cxcl12轴在小脑发育中的重要作用,并证实了早期干预的可行性,但仍需进一步评估这些发现如何应用于人类病理学研究。因此,建立大规模患者队列、设置年龄匹配的对照组,以及整合形态计量学与行为学分析至关重要。
我们的研究结果支持这样一种可能性,即大脑结构(其发育直接受到突变影响)在面临免疫损伤时可能更容易发生功能改变。进一步的研究将阐明:在WHIM综合征乃至其他涉及神经行为缺陷的先天性免疫错误病(IEI)中,反复的免疫挑战是否会引发神经免疫相互作用的改变,最终加剧现有表型。
我们的研究整体上揭示了中枢神经系统(CNS)发育——尤其是小脑发育——在IEI神经行为症状中的重要作用,以及神经免疫相互作用对IEI行为的影响。在IEI中准确诊断神经行为疾病对于全面患者护理至关重要,并将代表这些复杂疾病临床评估的重大转变。
¶ 资源可用性
¶ 主要联系人
进一步的信息和资源与试剂的请求应直接发送给主要联系人Simona Lodato(simona.lodato@hunimed.eu),并将由她处理。
¶ 材料可用性
本研究未产生任何新的独特试剂。
¶ 数据和代码可用性
- P1 WHIM及对照小脑的单细胞基因表达数据集已存储于GEO数据库,自发布之日起公开可查。GEO:GSE266671。
- P45 WHIM模型及对照组小脑的MRI数据已上传至OpenNeuro平台,自发布之日起公开可用。OpenNeuro访问编号:ds005137。
- BrainSpan图谱可在 https://www.brainspan.org/ 获取。
- 人类单核数据集可在 https://cellxgene.cziscience.com/collections/72d37bc976cc-442d-9131-da0e273862db/ 获取。
- 本文未包含原始代码。
- 重新分析本工作论文中报告的数据所需的任何补充信息,可根据要求向主要联系人获取。
¶ 作者贡献
S.L.和G.D.构思了本研究,设计实验方案并分析数据。G.D.负责所有实验及菌群维持工作;G.D.和L.Z.进行基因分型、样本采集和组织学染色;S.M.完成单细胞测序实验及批量转录数据分析;S.M.与M. Miotto共同分析解读单细胞/细胞核测序数据;R.O.P.开展尼氏染色分析并设立里程碑测试;A.B、I.C.与M. Matteoli实施并分析行为学实验;V.A.、M.C.和M.K.执行并分析流式细胞分选实验;E.K.、K.I.和D.C.完成磁共振成像实验及数据分析;E.F.与D.P.进行微电极阵列记录及分析;L.P.和R.R.设计并解析脑叶发育模型;S.L.、G.D.与S.M.撰写初稿;全体作者参与稿件修订。
¶ STAR★方法
本文在线版本提供了详细方法,包括以下内容:
- 关键资源表
- 实验模型与研究参与者详情(动物、原代颗粒细胞培养、人脑中IEI)
- ⽅法细节○⼈脑中IEI相关基因的数据集和分析○Ex-vivo磁共振成像○成年⼩⿏的⾏为测试○发育⾥程碑测试○尼⽒染⾊○实时定量PCR○叶状结构分析○单细胞RNA测序和分析○多电极阵列分析○肝脏、脾脏、⾎液和⼩脑来源的免疫细胞收集○细胞培养上的免疫染⾊○切⽚上的免疫染⾊○AMD3100的脑室内注射○成像○图像分析
¶ 关键资源表
| REAGENT or RESOURCE | SOURCE | IDENTIFIER |
|---|---|---|
| Antibodies | ||
| Anti-Calbindin (mouse monoclonal) | Swant | Cat#300; RRID: AB_10000347 |
| Anti-Pax6 (rabbit polyclonal) | Sigma-Aldrich | Cat#AB2237; RRID: AB_1587367 |
| Anti-Iba1 (rabbit polyclonal) | FujiFilm | Cat#019-19741; RRID: AB_839504 |
| Anti-BLBP (rabbit polyclonal) | Merck Millipore | Cat#ABN14; RRID: AB_10000325 |
| Anti-RFP (rabbit polyclonal) | Rockland | Cat#600-401-379; RRID: AB_2209751 |
| Anti-CD45 | Biolegend / BD | Cat#103139/564225; RRID: AB_2716861 |
| Anti-CD19 | BD | Cat#560245/612971; RRID: AB_2870243 |
| Anti-CD3e | Invitrogen | Cat#15-0031-81; RRID: AB_3697163 |
| Anti-Ly-6C | BD | Cat#560596; RRID: AB_1727555 |
| Anti-CCR2 | Biolegend | Cat#150605; RRID: AB_2571913 |
| Anti-CX3CR1 | Biolegend | Cat#149027; RRID: AB_2565967 |
| Anti-CD49b | BD | Cat#740704; RRID: AB_2740388 |
| Anti-CD11b | BD | Cat#563553; RRID: AB_2738276 |
| Anti-CD4 | BD | Cat#612952; RRID: AB_2813886 |
| Anti-CD8 | BD | Cat#612898; RRID: AB_2870186 |
| Anti-Ly-6G | BD | Cat#560601; RRID: AB_1727562 |
| Anti-F4/80 | BD | Cat#567201/565613; RRID: AB_2734770 |
| Anti-CD86 | Biolegend | Cat#105016; RRID: AB_493602 |
| Bacterial and virus strains | ||
| pAAV-hSyn-GCaMP6s-WPRE | Plasmid was a gift from Douglas Kim & GENIE Project; Chen et al. 122 | Addgene, Cat#100843 |
| pAAV-hSyn-mCherry | Plasmid was a gift from Karl Deisseroth Lab | Addgene, Cat#114472 |
| Biological samples | ||
| Cerebellar tissue from Cxcr4+/1013 and WT mice | This paper | N/A |
| Liver, spleen, blood from Cxcr4+/1013 and WT mice | This paper | N/A |
| Chemicals, peptides, and recombinant proteins | ||
| Poly-L-lysine | Sigma-Aldrich | Cat#P2636 |
| Neurobasal medium | Life Technologies | Cat#21103049 |
| Fetal Bovine Serum (FBS) | Life Technologies | Cat#1600004 |
| B-27 Supplement | Life Technologies | Cat#17504001 |
| Penicillin-Streptomycin | Euroclone | Cat#ECB3001 |
| Cytosine arabinofuranoside (AraC) | Sigma-Aldrich | Cat#C1768 |
| Papain Dissociation System | Worthington Biochemical | Cat#LK003150 |
| AMD3100 (Plerixafor) | Sigma-Aldrich | Cat#239825 |
| Eukitt Mounting Medium | Sigma-Aldrich | Cat#3989 |
| Violet stain | Sigma-Aldrich | Cat#C1791 |
| Glacial Acetic Acid | Sigma-Aldrich | Cat#A6283 |
| Fluoromount | Thermo Fisher Scientific | Cat#F4680 |
| LIVE/DEAD Aqua Dead Cell Stain Kit | Thermo Fisher Scientific | Cat#L34957 |
| DAPI | Thermo Fisher Scientific | Cat#D1306 |
| Critical commercial assays | ||
| RNeasy Mini Kit | Qiagen | Cat#74106 |
| QuantiTec Reverse Transcription Kit | Qiagen | Cat#205313 |
| PowerTrack SYBR Green Master Mix | Thermo Fisher Scientific | Cat#A4611 |
| Deposited data | ||
| Single cell gene expression datasets | GEO | GSE266671 |
| MRI data | OpenNeuro | ds005137 |
| Experimental models: Organisms/strains | ||
| Cxcr4+/1013 knock-in mice | Institut Pasteur; Balabanian et al. 38 | N/A |
| Wild type C57BL/6J mice | Jackson Laboratory | Cat#000664 |
| Oligonucleotides | ||
| IL17ra primer fw: CCTCATCACACTCATCGCCA | This paper | N/A |
| IL17ra primer rev: GCCGAGTAGACGATCCAGAC | This paper | N/A |
| Software and algorithms | ||
| GraphPad Prism (v10.0.0) | GraphPad | www.graphpad.com |
| R (v4.3.1) | R Project | www.r-project.org |
| Seurat (v4.4.0) | Hao et al. 123 | https://satijalab.org/seurat/ |
| FIJI (ImageJ) | NIH | https://imagej.net/Fiji |
| FlowJo (v10.10.0) | BD | https://www.flowjo.com/ |
| MATLAB | MathWorks | www.mathworks.com |
¶ 实验模型与研究参与者详情
¶ 动物
所有实验均遵循欧洲共同体理事会(2010年9月22日第2010/63/EU号指令)和意大利D.Lg. 26/2014法案制定的指南进行。本研究经Humanitas研究医院机构动物护理与使用委员会及意大利卫生部批准。
小鼠饲养于特定无病原体(SPF)环境中,恒定温度(22±1°C)和湿度(50%),采用12小时光暗周期,并ad libitum获取食物和水。SPF环境确保动物从未接触免疫性挑战。WHIM相关突变体*Cxcr4+/1013*基因敲入小鼠由Arenzana-Seisdedos教授慷慨惠赠,最初由巴斯德研究所38培育,并维持C57BL/6J遗传背景。实验队列包含从胚胎期16.5天至出生后45天的同窝仔鼠。在所有观测参数中均未发现性别差异。除成年行为测试仅使用年龄匹配的同窝雄性小鼠外,其余实验数据均合并两性结果。
对于定时妊娠,将*CXCR4+/1013*基因敲入雄性小鼠与最多三只C57BL/6J雌性小鼠(购自查尔斯河实验室)合笼过夜,并通过次晨观察到阴道栓确认成功交配。本研究中使用的所有动物均未经历任何实验处理,既往未接触过AMD3100或其他干预措施。
¶ 原代颗粒细胞培养
颗粒细胞培养物的获取方法如前所述124–126。每次实验至少使用4只出生后第5天(P5)的幼鼠(来自至少两个不同窝次)。将颗粒细胞以约60万细胞/毫升的密度铺展于多聚赖氨酸涂层盖玻片(#P2636,西格玛奥德里奇)上,培养体系为添加了10%胎牛血清(#1600004,Life Technologies)、0.5%无血清添加剂B-27(#17504001,赛默飞世尔)及100 IU/mL青霉素-链霉素(#ECB3001,Euroclone)的神经基础培养基(#21103049,Life Technologies)。细胞培养条件为37℃、5% CO2。
24小时后更换为含10%胎牛血清、0.5%无血清添加剂B-27、100 IU/mL青霉素-链霉素、10μM阿糖胞苷(用于消除增殖性非神经元细胞,如内皮细胞和小胶质细胞)以及25mM氯化钾(通过温和去极化促进颗粒细胞存活)的新鲜神经基础培养基。
在体外培养第4天(DIV4),将培养基更换为新鲜配制的Neurobasal培养基(添加10%胎牛血清、0.5%无血清补充剂B-27、100 IU/mL青霉素-链霉素、10μM阿糖胞苷以及5mM氯化钾),以促进功能性突触的形成。
¶ 方法细节
¶ 人脑中IEI相关基因的数据集和分析
为探索人类大脑中IEI相关基因的表达,我们首先利用经验证的分类系统(来源:国际免疫学会联盟IUIS,https://www.niaid.nih.gov/diseases-conditions/types-IEI)整理了526种遗传性IEI及其对应的444个致病基因名单27,28。随后,我们借助BrainSpan发育转录组65和单核RNA测序66数据集来分析基因表达模式。
- 我们利用BrainSpan数据集分析:该数据集包含归一化表达数据(RPKM),汇总了25个脑结构和31个年龄阶段的基因表达信息。数据被系统性地划分为7个不同脑区类型(前额叶皮层、大脑皮层、海马体、小脑、纹状体、杏仁核和丘脑)以及8个发育阶段(孕早期、孕晚期、婴儿晚期、幼儿期、儿童晚期、青春期和成年期)。筛选出444个目标基因的表达子集,采用层次聚类分析进行基因聚类,将脑区类型和发育时期作为关键分组变量。通过轮廓系数确定最佳聚类数量(k),选择使该指标最大化的数值。绘制跨区域和发育阶段的平均标准化基因表达图谱以识别不同的基因表达模式。 在单核分析中,为捕捉关键发育期基因表达的动态变化,我们聚焦于健康被试的十个时间点中的九个子集(排除成年阶段),以捕捉关键发育期基因表达的动态变化。使用
SCTransform()对个体时间点进行数据标准化,随后通过RunHarmony()对标准化数据进行降维处理,在保持原始注释不变的前提下实现数据整合可视化。计算跨细胞类型的平均基因表达水平,结果以点阵图形式呈现(图1G)。
¶ Ex-vivo磁共振成像
-
样本制备:动物首先经心脏灌注肝素化盐水,随后灌注溶于PBS的4%多聚甲醛(PFA)并实施断头术。移除皮肤、耳朵及下颌骨,将大脑保留在颅腔内以最大限度减少解剖造成的组织损伤和变形。每个脑样本在4% PFA溶液中浸泡24小时,再转移至含0.05%(重量/体积)叠氮化钠的0.1 M PBS溶液。在ex vivo核磁共振成像采集前60天,样本被转移至含8 mM钆布醇(Gadovist,拜耳公司)的0.1 M PBS与0.05%叠氮化钠溶液。核磁共振检测人员对实验分组情况不知情。
-
扫描参数:样品以四个为一组进行扫描,固定于定制3D打印支架内,置于装有全氟聚醚(Galden SV80,Apollo Scientific)的50毫升离心管中。采用9.4T BioSpec 94/20(Bruker BioSpin)系统,配备39毫米正交发射/接收体积线圈(RAPID Biomedical)、B-GA12S HP梯度线圈组(1000 mT/m)以及由ParaVision 7.0.0控制的Avance™ III HD控制台。通过三维FLASH序列采集各向同性分辨率40微米的图像,具体参数:回波时间=6毫秒、重复时间=20毫秒、翻转角=33°、读出带宽=100千赫、平均次数=7、矩阵尺寸=625×625×500、视野=25×25×20毫米、扫描时间=14小时。
-
图像分析:幅值和相位图像在ParaVision 7.0.0中完成重建,通过BrkRaw转换为NIfTI格式。利用定量成像工具(QUIT)中的
unwrap_path命令对相位图像进行解包裹处理127。基于全部22名受试者的幅值与相位图像,采用高级标准化工具(ANTs)中的antsMultivariateTemplateConstruction2.sh脚本构建多变量研究专用模板128。使用antsRegistration通过刚性变换、仿射变换及微分同胚变换(SyN算法)的序列配准流程,将所有受试者数据对齐至该模板129。通过ANTs的CreateJacobianDeterminantImage命令生成复合变换的对数变换雅可比行列式图谱。采用FSLrandomize对对数雅可比图像进行置换检验(5000次置换,采用无阈值集群增强方法,控制家族误差率)130,以逐体素比较WHIM与WT脑部局部体积差异。
4.每幅个体磁共振幅度图像均使⽤antsRegistration与模板进⾏刚性配准,并围绕⼩脑区域进⾏裁剪。在Fiji软件中,先应⽤半径为⼆体素(80μm)的三维中值滤波器,随后创建⽮状⾯中⼼10个体素的最⼩强度投影,最后执⾏半径为3、掩模权重为0.7的反锐化掩模处
理。基于此滤波图像,采⽤魔棒⼯具对arborvitae进⾏半⾃动分割。对模板图像实施相同流程后,使⽤antsRegistration将每个受试者分割的中央⽮状⾯⼩脑活树与模板进⾏刚性配准。在Python环境中,利⽤scikit-image 0.21.0(skimage.morphology.skeletonize)⽣成arborvitae的⻣架结构,131并通过Skan 0.11.1(skan.summarize)测量⻣架分⽀⻓度。132根据skan.summarize返回的连接点/端点坐标,系统⾃动将分⽀归属⾄特定⼩脑⼩叶。
¶ 实时定量PCR
-
RNA提取与反转录:来自P45小鼠的小脑在TRIzol(#15596018,Thermo Fisher Scientific)中裂解,按说明书提取总RNA。通过Nanodrop(Thermo Fisher Scientific)分光光度法定量RNA。使用QuantiTec反转录试剂盒(货号#205313,Qiagen),将500 ng样本反转录为cDNA。
-
RT-qPCR检测:使用PowerTrack™ SYBR Green Master Mix(货号A4611,赛默飞世尔科技公司)进行检测,以GAPDH作为内参基因。反应在Viia7实时荧光定量PCR系统(赛默飞世尔科技公司)上运行,采用2-ΔΔCT法135分析基因相对表达量。所有独立生物学重复均取三个技术重复的循环阈值平均值进行计算。IL17ra检测引物:正向=CCTCATCACACTCATCGCCA,反向=GCCGAGTAGACGATCCAGAC。
¶ 叶理分析
对E17.5和P0时期小脑矢状切片的免疫荧光图像进行形态计量学分析,需测量:
- 外颗粒层(EGL)长度及代表EGL平滑长度的凸面长度(EGL0);
- 由EGL边界界定的总面积,及由小脑切片外部和内部平滑边界围成的区域。
这些参数用于评估施加在小脑双层结构上的机械应变(ϵ)及皱纹振幅(A),具体模型如下:
- 低机械变形条件(E17.5阶段)
其中, 为触发失稳的临界应变, 和 分别代表外层面内弹性模量与芯层面内弹性模量。
- 高变形条件(P0阶段,)
引入
解释应力-应变响应中的非线性(类新霍克行为),更好地表征褶皱向折叠式失稳的演化过程。
¶ 单细胞RNA测序与分析
¶ Sample preparation
从对照和*CXcr4+/1013幼鼠中取出围绕fpc(LIII和LIV-V)的P0小脑区域(每窝每样本n=8个胚胎),在无菌冰冷HBSS溶液中通过显微操作快速分离。对照组和Cxcr4+/1013*样本均采用雌雄数量均衡的混合样本,以减少性别影响。使用木瓜蛋白酶解离系统试剂盒(#LK003150,Worthington)按说明书解离组织。每个样本约10,000个细胞通过Single Cell 30 v2.1单细胞试剂盒(10X Genomics)加载至Single Cell Chip G中,在Chromium系统内生成凝胶珠乳液。完成细胞捕获和裂解后,按10X Genomics方案进行cDNA合成并扩增14个循环。取50 ng/样本的扩增cDNA构建Illumina测序文库,在NovaSeq 6000 Illumina测序平台上按指令生成测序读段。
¶ Single-cell RNA sequencing analysis
-
数据预处理:原始测序数据通过Illumina bcl-convert工具转换为fastq文件。使用CellRanger(10X Genomics,版本6.1.1.113)计数模块,以默认设置及
r2-length=90参数进行读段比对与计数,参考预构建的小鼠基因组(版本mm10-1.2.0)。每个样本平均产生45,000条读段/细胞。 -
质量控制与标准化:通过Seurat R软件包(版本4.4.0)将原始数字基因表达矩阵导入R环境(版本4.3.1)。样本质量控制标准:
- 计算表达基因与UMI计数的log10(MAD)(中位数绝对偏差),剔除偏离中位数2.5倍MAD(上下限)的细胞;
- 排除线粒体基因比对率超过10.0%的细胞;
- 移除在少于中位数-2.5倍MAD的细胞中表达的基因、Y染色体表达基因、XIST、TSIX及核糖体基因。
对每个细胞,将特征计数除以该细胞的总计数后乘以10,000,随后使用log1p进行自然对数转换。根据G2/M期和S期标志基因的表达情况,为单个细胞分配细胞周期评分。
-
数据整合与聚类:采用Seurat中的SCT v2流程:
- 使用
SCTransform (vst.flavor = "v2", assay = "RNA")对样本单独标准化; - 通过
SelectIntegrationFeatures筛选整合特征; - 依次执行
PrepSCTIntegration、FindIntegrationAnchors及IntegrateData(normalization.method = "SCT")完成数据整合。
对标准化数据进行主成分分析(PCA),采用基于图形的方法(肘部图)确定使用的主成分数量。使用Lou vain算法对细胞进行迭代聚类,通过分析聚类树图(clustree)选定最佳分辨率。
- 使用
-
细胞类型注释:利用Seurat内置的
FindAllMarkers函数(采用Wilcoxon秩和检验并经过邦费罗尼多重检验校正;调整后P值<0.05)筛选差异表达基因,仅检测在簇内至少40%细胞中表达、且簇内细胞与其余细胞间平均表达量差异达到0.25倍(对数尺度)的基因。结合所得标记基因、经典标记基因及文献附加标记66,136,确定细胞类型身份。
¶ Cell-type-specific differential gene expression analysis
使用Seurat的FindMark### er(s)工具(默认双部分障碍模型MAST)筛选差异表达基因,仅保留在聚类内至少20%细胞中检测到、且不同基因型间平均差异≥0.10倍(对数尺度)的基因。通过Ingenuity Pathway Analysis(IPA - Qiagen Ingenuity Systems)对差异基因列表进行经典通路和生物学功能富集分析。
¶ Trajectory inference and pseudotime scoring
- 数据子集化与降维:对Seurat对象子集化,仅保留GCPs和GCs。在该子集上使用UMAP进行降维,将高维数据可视化于降维空间。
- 轨迹起点确定:采用基于熵的方法,通过TSCAN 1.40.0软件包的
perCellEntropy()函数计算每个细胞的熵值,识别轨迹起点(根节点)。 - 轨迹推断与拟时间分配:使用Slingshot 2.10.0算法进行轨迹推断,选择GCP-B细胞群作为轨迹起点,基于UMAP降维结果分配拟时间分数。通过
slingshot()函数拟合轨迹曲线,应用slingCurves()获取谱系曲线数据。 - 差异显著性检验:采用Kolmogorov-Smirnov检验(
ks.test()函数)比较野生型与*Cxcr4+/1013*突变型的拟时间分数密度分布,评估基因型间拟时间分布差异的显著性。
¶ Differential expression analysis along pseudotime
运用Tradeseq软件包1.16.0中的fitGAM()函数,沿拟时序并跨不同基因型建模基因表达变化(每种条件使用6个节点拟合模型)。通过associationTest()函数执行拟时序差异表达分析,评估沿轨迹表达显著变化的基因。采用p.adjust()函数进行p值校正,筛选错误发现率(FDR)≤0.05的基因,生成两种基因型的最终差异基因列表。
¶ 多电极阵列分析
¶ Ex vivo acute cerebellar slices preparation
P21期动物经异氟烷深度麻醉后断头处死。立即解剖取出脑组织并置于冰镇溶液中(成分:87 mM NaCl、21 mM NaHCO3、1.25 mM NaHPO4、7 mM MgCl2、0.5 mM CaCl2、2.5 mM KCl、25 mM D-葡萄糖、7 mM蔗糖,经95% O2/5% CO2平衡,pH 7.4)。使用振动切片机(Leica VT1000S)切割小脑蚓部旁矢状切片(300 μm),随后在33℃条件下置于人工脑脊液(ACSF,成分:129 mM NaCl、21 mM NaHCO3、1.25 mM NaHPO4、1.8 mM MgSO4、1.6 mM CaCl2、3 mM KCl、10 mM D-葡萄糖,经95% O2/5% CO2平衡,pH 7.4)中孵育至少1小时。记录过程中采用蠕动泵以3.0 mL/min流速持续灌注ACSF溶液。
¶ MEA electrophysiological recordings
电生理记录采用二维高密度多电极阵列(HD-MEA,3Brain)进行,该阵列含4096个电极(81μm间距,分布于5.1×5.1 mm2记录区域,HD-Stimulo系统)。小脑切片通过带100μm宽铂丝的锚定装置固定于芯片上。10分钟平衡期后,在标准ACSF溶液中以20kHz采样率记录小脑切片自发电活动5分钟,使用50Hz高通滤波器。每次记录后通过高清数码显微镜(Bysameyee)获取切片图像,与电活动图谱叠加以实现精确的电生理-解剖学关联定位。
¶ MEA data analysis
使用3Brain公司的BrainWave 4软件进行记录、峰电位检测和峰电位分类:
- 峰电位检测:采用硬阈值算法(阈值=-70μV,不应期=1ms,AI验证);
- 峰电位分类:采用含3个特征的主成分分析(PCA)及标准k均值聚类算法。
仅纳入满足以下条件的记录数据:尖峰频率>0.8次/秒,且每个脑叶活跃单元>10个。若某基因型所有切片均不满足标准,则排除整个实验数据。测量各脑叶的平均放电频率(MFR)和振幅中位数,采用核密度估计(KDE)可视化数据分布。使用Mann-Whitney检验(非参数t检验)评估同一小脑叶内对照组与*Cxcr4+/1013*切片在频率和振幅指标上的差异。
¶ 肝脏、脾脏、血液和小脑来源的免疫细胞群分析
-
E16.5胚胎组织处理:解剖E16.5胚胎,取肝脏、脾脏和小脑组织,在40 μm细胞筛网上研磨。研磨组织置于1×裂解液(8.29g/L氯化铵#A9434、1g/L碳酸氢钾#60339、0.0372g/L乙二胺四乙酸二钠二水合物#ED2SS)中静置10分钟,洗涤后对细胞进行活性标记物染色并直接耦联一抗。细胞经4%多聚甲醛固定后,使用BD LSR Fortessa或FACSymphony细胞分析仪检测。
-
P0幼鼠组织处理:解剖P0幼鼠,取脾脏和小脑在40 μm细胞筛网上研磨。组织研磨液置于1×裂解缓冲液中静置10分钟,洗涤后用活性标记物及直接偶联一抗染色。细胞固定后使用上述流式细胞仪检测。
-
血液样本采集与处理:
- P0和P7时间点:通过断头法采集血液;
- P45时间点:尾侧静脉采血(70%酒精清洁,轻划静脉采集80-100 μL,无菌纱布止血)。
样本中红细胞通过1×裂解缓冲液去除,细胞经活性标记物及直接偶联一抗染色,固定后加入计数微球,使用上述流式细胞仪检测。
-
试剂与数据分析:
- 活性标记物:LIVE/DEAD可固定蓝色死细胞染色试剂盒(货号L34957,赛默飞世尔);
- 一抗列表:抗CD45(Biolegend #103139/BD #564225)、抗CD19(BD #560245/612971)、抗CD3ε(eBioscience #15-0031-81)、抗Ly-6C(BD #560596)、抗CCR2(Biolegend #150605)、抗CX3CR1(Biolegend #149027)、抗CD49b(BD #740704)、抗CD11b(BD #563553)、抗CD4(BD #612952)、抗CD8(BD #612898)、抗Ly-6G(BD #560601)、抗F4/80(BD #567201/565613)、抗CD86(Biolegend #105016);
- 数据分析:使用FlowJo(10.10.0版)软件。
¶ Cerebellar granule cells culture钙成像与形态学分析
¶ Granule cell culture calcium imaging recordings and analysis
对表达GCaMP6s的DIV7 GCs进行钙成像(Ca2+观测),使用雷卡达Thunder成像系统在20倍放大倍数下完成。活细胞成像在37℃/5% CO2的人工脑脊液(aCSF成分:125 mM NaCl、5 mM KCl、1.2 mM KH2PO4、25 mM HEPES、6 mM葡萄糖、2 mM CaCl2,pH 7.4)记录室中进行,每次记录持续5分钟,采样率为每帧300毫秒。每个玻片随机选取3-4个视野拍摄分析。
延时成像文件通过改编自Sun和Su¨dhof137的MATLAB(MathWorks)脚本分析:
- 采用定制函数
GCAMP_multiROI.m提取感兴趣区域(ROIs)的荧光强度,量化钙活性; - 从前50帧生成第10-40帧的中值强度投影预览数据,基于荧光强度用
impixel函数手动选择圆形ROIs; - 提取每个ROI在所有帧中的平均荧光强度,计算1.5倍标准差作为阈值,通过
spike_detection函数识别超过阈值的局部最大值(峰值); - 同步钙峰定义为特定时间窗口内跨多个ROIs的峰值,同步放电率计算为每分钟同步峰值数量,同步峰幅度通过神经元平均ΔF/F0(F0为不同时间窗口内三个最低强度值的均值)量化;
- 绘制同步峰值时间变化的稀疏矩阵,分析ROIs内尖峰振幅与频率分布,计算变异系数(CV)评估活动稳定性。
¶ 细胞培养中的免疫染色
DIV7 GCs使用4%多聚甲醛/10%蔗糖的1×PBS溶液固定。细胞在含10%山羊血清、0.3% Triton X-100的1×PBS中室温封闭透化1小时,随后与一抗(小鼠抗RFP抗体,1:500,Rockland #600-401-379)在4℃下孵育过夜。经1×PBS洗涤后,细胞与二抗(1:750,Molecular Probes Alexa Fluor,Life Technologies)室温孵育2小时,再次洗涤后用DAPI(Sigma-Aldrich,1:5000溶于1×PBS)复染10分钟,最后用Fluoromount水性封片剂(ThermoFisher Scientific #F4680)封片。
¶ 免疫染色切片
动物经心内灌注4%多聚甲醛PBS溶液后断头取脑。脑组织置于4%多聚甲醛1×PBS中固定,随后使用莱卡VT1000S振动切片机获取50μm厚切片,或通过Histo-Line MC4000冷冻切片机制备15μm厚切片进行荧光免疫组化染色。
矢状小脑切片在含10%山羊血清、0.3% Triton X-100的1×PBS中室温封闭通透1小时,随后于4℃条件下与一抗共同孵育过夜。经1×PBS冲洗后,切片与二抗(1:750,Molecular Probes Alexa Fluor,Life Technologies)室温孵育2小时,再次冲洗后用DAPI(Sigma-Aldrich,1:5000溶于1×PBS)复染10分钟,最后使用Fluoromount水性封片剂(ThermoFisher Scientific #F4680)封片。
使用的一抗包括:
- 小鼠抗钙结合蛋白(1:1000,Swant #300)
- 兔抗Pax6(1:500,Sigma-Aldrich #AB2237)
- 兔抗Iba1(1:2000,FujiFilm #019-19741)
- 兔抗BLBP(1:200,Merck Millipore #ABN14)
- 抗RFP(1:500,Rockland #600-401-379)
¶ AAV injection in neonatal mouse cerebellum
根据既定方案138–141,向新生WHIM小鼠及对照小鼠的小脑注射AAV病毒:
- P0幼鼠经低温麻醉后固定于操作台,使用微量注射器(汉密尔顿公司#87930)将针头插入小脑蚓部分子层0.5毫米深度,60秒内缓慢注入1μL滴度为1012 vg/ml的AAV-hSyn-mCherry病毒液(Addgene #114472);
- 注射后幼鼠经37℃复苏并放回原窝;
- P21日通过心内灌注法获取脑组织,对100μm厚度的小脑切片进行荧光免疫组化染色。
¶ 脑室内注射AMD3100
AMD3100(用于WHIM综合征患者临床试验:ClinicalTrials.gov: NCT02231879; NCT00967785; NCT01058993)或溶剂(含0.005%快绿的无菌盐水)注入WHIM和对照组胚胎(E12.5)或幼崽(P1)的第四脑室,具体操作:
- 胚胎期(E12.5)注射:将1μL AMD3100(1mg/ml,Sigma-Aldrich #239825)与0.005%快绿溶于无菌盐溶液混合,对WHIM模型胚胎和对照组胚胎进行注射;
- 出生后(P1)注射:P1幼鼠经低温麻醉,注射2μL含0.005%快绿的AMD3100(5mg/ml)无菌生理盐水溶液;
- 后续处理:幼鼠在37℃环境下复苏后放回同窝饲养。注射胚胎在P7阶段进行行为分析,随后收集组织进行灌注和组织学表征;其他组别分别在P7或P45进行分析。
¶ 图像分析
¶ PCL length measurement
在P45脑矢状切面上,通过QuPath软件(版本0.4.4)对小脑不同耳间水平区域(蚓部和小脑半球)的尼氏染色切片测定浦肯野细胞层(PCL)长度。小叶划分以裂沟起始为界,沿每个小叶的PCL绘制测量线。所有实验包含至少3个生物学重复,每个动物在不同耳间水平上至少分析5个切片。
¶ Fissure length measurement
采用QuPath软件,在P0、P7和P45时间点的小脑矢状尼氏染色切片上测量小脑裂长度。测量区域涵盖不同耳间水平的蚓部和小脑半球,从切片表面相邻小叶连接处起始,沿各小脑裂走向划线追踪。所有实验包含至少3个生物学重复,每个动物取不同耳间水平的切片不少于5张。
¶ Cell counting
采用QuPath软件中的阳性细胞检测功能进行半自动分析:
- 手动界定感兴趣区域(ROIs),人工调整强度阈值实现各标记物的精确分割;
- 仅统计与DAPI共染的标记阳性细胞以确保细胞身份;
- 计数结果经ROI面积标准化后获得细胞密度。
所有实验包含至少3个生物学重复,每只动物取样不少于6个组织切片,分析过程中保持阈值参数一致。
¶ Microglia morphological analysis
对P21动物小脑矢状切片的蚓部水平进行抗Iba1抗体染色。采用Fiji软件(v2.14版本)对Iba1阳性细胞进行二值化处理和分割,使用Fiji的Skeletonize插件142对图像进行骨架化,通过Analyze Skeleton功能获取每个细胞的分支数量和连接点数量。
¶ Bergmann glia fibers analysis
在P7幼鼠小脑矢状切片的蚓部水平,采用抗BLBP抗体染色。使用Fiji的多点工具统计分子层每100μm长度内的突起数量,通过角度工具测量小脑裂线与最近BLBP+纤维之间的夹角。所有实验设置至少3个生物学重复,每只动物选取不少于6个组织切片。
¶ Purkinje cell morphology analysis
对P21动物小脑矢状切片的蚓部水平进行抗RFP抗体染色以增强AAV-hSyn-mCherry信号。选取Calb1与RFP双标阳性细胞,通过Fiji的Threshold功能创建掩膜,使用神经解剖学插件中的Sholl功能分析图像,获取每个细胞的分支数量及树突延伸长度。
¶ Granule cell morphological analysis
DIV7时,使用Fiji插件NeuronJ(8位图像)对表达mCherry的单个颗粒细胞进行筛选分析。每个选中的神经元通过半自动追踪量化神经突形态,包括神经突总长度和神经突数量。
¶ 量化与统计分析
数据收集和数据分析采用盲法进行。所有统计检验方法均在相应位置注明,使用Prism 8(GraphPad Prism 10.0.0 Windows版,美国马萨诸塞州波士顿GraphPad软件公司,www.graphpad.com)和R(4.3.1版)完成统计分析:
- 剔除异常值并通过Shapiro-Wilk检验验证数据正态性;
- 单次比较:采用非配对双尾Student t检验或Mann-Whitney U检验;
- 多重比较:采用单因素/双因素方差分析(ANOVA)结合Bonferroni多重比较检验;
- 统计学显著性标注:(p<0.05)(*)、(p<0.01)(**)、(p>0.05)(n.s.),具体标注方式见图注;
- 数据表示:除非特别说明,所有数据均以平均值±标准差(SD)表示;
- 样本量:样本量n的具体数值及其含义(动物数量、细胞数量等)均在相应图注中注明。
¶ 补充信息
¶ Figure S1:人脑组织中IEI相关基因的表达(与图1相关)
(a) 热图显示IEI基因在人类脑组织不同prenatal(产前)、postnatal(产后)和adult(成年)阶段的标准化表达。
(b) 展示组织特异性表达模式基因平均标准化表达的箱线图。
© 对来自7孕周至成年期健康捐赠者小脑的单细胞核按细胞类型着色的UMAP图66。
(d) 显示按发育阶段(从7孕周至成年期)着色的单细胞核UMAP图。
(e) 显示按谱系(胶质细胞、神经元、血管和免疫细胞)着色的单细胞核UMAP图,时间跨度为7孕周至成年期。
(f) 展示选定IEI基因亚型特异性表达的点图。
缩写:pcw(受孕后周数)、mo(月份)、yrs(年份)、PFC(前额叶皮层)、CTX(皮层)、HP(海马体)、CB(小脑)、STR(纹状体)、AMY(杏仁核)、TH(丘脑)、GC(颗粒细胞)、UBC(单极刷细胞)、Glut-DN(深部核团的谷氨酸能神经元)、Isth-N(峡部神经元)、Norad-N(去甲肾上腺素能神经元)、GABA-N(GABA能神经元)、IN(中间神经元)、NPC-NTZ(核过渡区的神经元前体细胞)、NPC-VZ(脑室区的神经元前体细胞)、GCP/UBCP(颗粒细胞祖细胞/单极刷细胞祖细胞)、GCP(颗粒细胞祖细胞)、APC/OPC(星形胶质细胞祖细胞/少突胶质细胞祖细胞)、APC(星形胶质细胞祖细胞)、OPC(少突胶质细胞祖细胞)、Astro(星形胶质细胞)、BG(伯格曼胶质细胞)、Oligo(少突胶质细胞)、CNS-macroph(中枢神经系统巨噬细胞)、Meningeal-macroph(脑膜巨噬细胞)、VC(血管细胞)。
¶ Figure S2:WHIM小鼠表现出小脑改变和焦虑样行为表型(与图2相关)
(a) 小脑体积的体素级比较显示,在水平和冠状平面上P45 *Cxcr4+/1013*小鼠相对于对照组存在显著形态学异常。红色:WHIM大于WT;蓝色:WHIM小于WT;黑色轮廓:FWE校正后(*p<0.05)的区域;每种条件>10只动物。
(b) 小鼠小脑示意图、条形图及矢状面小脑切片(蚓部:0.00-0.24;半球:1.56-2.04;2.16-2.52),显示小脑小叶PCL长度的倍数变化。多重t检验,(p<0.05),(p<0.01);每种条件n>4只动物。
© 显示对照组和Cxcr4+/1013*小鼠在旷场测试中的行进距离和速度的条形图(Student’s t检验、Mann Whitney检验,(p<0.01);n<每组16只动物);及旷场测试中场地中心和周边的活动时间(s)和休息时间(s)的箱线图(单因素方差分析,(*p<0.05);n>每组16只动物)。
(d) 显示从加速旋转棒跌落潜伏期(s)的折线图(双因素方差分析,(*p<0.05);n=每组11只动物)。
(e) 显示WHIM和对照组小鼠自我梳理时间百分比的条形图(Student’s t检验,(*p<0.05);n>每组6只动物)。
¶ Figure S3:WHIM行为缺陷具有发育起源(与图2相关)
(a) 已执行的发育里程碑及实验时间点示意图。
(b) 堆叠条形图显示WHIM与对照组幼崽在运动测试中的得分情况(多重t检验,(*p<0.05);各条件n>30只动物)。
© 折线图显示WHIM与对照组幼崽走出圆圈所需时间,条形图显示旷场穿越测试中30秒内成功幼崽数量(多重t检验,(*p<0.05);各条件n>14只动物)。
(d) 箱形图显示平面翻正测试中WHIM与对照组幼崽翻转身体所需时间(多重t检验,(*p<0.05);各条件n>30只动物)。
(e) 折线图显示空中翻正测试中WHIM与对照组幼崽成功翻正百分比(多重t检验,(*p<0.05);各条件n>4只动物)。
(f) 折线图显示耳颤测试中对感觉刺激的反应百分比(多重t检验,(*p<0.05),(p<0.01);各条件n>4只动物)。
(g) 折线图显示对听觉刺激的反应百分比(多重t检验,(*p<0.05),(p<0.01);各条件n>4只动物)。
¶ Figure S4:小脑小叶形成过程在WHIM突变体中受到影响(与图3相关)
(a) 显示小脑裂长度变化倍数的柱状图(多重t检验,(p<0.05),(p<0.01);n>4只动物每组)。
(b) 显示E16.5、E17.5、P0时期Cxcr4+/1013*与对照组小脑中Pax6+阳性细胞数量的散点图(多重t检验,(p<0.05);n>3只动物每组)。
© 显示E17.5时期Cxcr4+/1013*与对照组外颗粒层和小脑核心区域Pax6+阳性细胞数量的柱状图(多重t检验,(*p<0.05);n=3只动物每组)。
(d) 显示E17.5时期WHIM小脑标准化临界应变增加的箱形图(Student t检验,(p<0.05);n>3只动物每组)。
(e) 箱形图显示在P0时期Cxcr4+/1013*小脑中未改变的刚度比和归一化临界应变;高变形褶皱模型(实线)显示在P0时期WHIM小脑振幅略有下降(学生t检验;每个条件n>3只动物)。
¶ Figure S5:发育中WHIM与对照小脑小叶的单细胞测序(与图4、图5相关)
(a) 对照和*Cxcr4+/1013小脑的UMAP图,按细胞类型着色。
(b) 显示19种不同细胞类型在基因型之间比例的堆叠条形图。
© 显示对照和Cxcr4+/1013*小脑样本中每个细胞的UMI数、每个细胞的基因数、线粒体和核糖体基因比率分布的小提琴图。
(d) Ingenuity Pathway Analysis(IPA)显示小脑祖细胞中Cxcr4信号通路组分的显著上调。
(e) 显示熵分数/细胞类型的小提琴图。
(f) 按基因型分割的每个细胞类型按伪时间分数值着色的密度图。
(g) 沿颗粒细胞谱系按基因型分割的与皮质小脑层(左侧注释条)相关基因的伪时间热图。
(h) 来自Allen Brain Atlas的代表性矢状面in-situ图像,显示P4时颗粒谱系标记的表达。
缩写:PC(浦肯野细胞)、UBC(单极刷细胞)、OPC(少突胶质前体细胞)、Sst-IN(生长抑素+中间神经元)、IN(中间神经元)、VZ_neuroblast(脑室区神经母细胞)、isth-N(峡部神经元)、GC_I/II(颗粒细胞)、GCP_A/B(颗粒细胞前体)、epy(室管膜前体)、BP(双能祖细胞)、GP(胶质生成祖细胞)、GABA_DN(深部核团GABA能神经元)、nCount_RNA(单细胞UMI数量)、nFeature_RNA(单细胞基因数量)、mitoRatio(线粒体基因占比)、riboRatio(核糖体基因占比)。
¶ Figure S6:Cxcr4突变影响浦肯野细胞形态和功能(与图6相关)
(a) 箱形图显示在50μm半径范围内WHIM浦肯野细胞与对照组交叉点数量的比较(学生t检验,(*p>0.05);每种条件n>7个细胞)。
(b) 全小脑计算的MFR分析:*Cxcr4+/1013与对照组比较。
© 条形图显示Cxcr4+/1013*与对照组各脑叶中活性单元数量(Mann-Whitney检验,(*p>0.05);每种条件n>6只动物)。
(d) 条形图显示各脑叶记录振幅的定量分析(圆点表示分析的切片数量;Mann-Whitney检验,(p<0.05);每种条件n>6只动物)。
(e) 概率密度函数显示Cxcr4+/1013*和对照组中单叶频率的分布(核密度估计,(p<0.01);n>6只动物每个条件)。
¶ Figure S7:WHIM免疫表型在出生时即已显现(与图7相关)
(a) 从P0 WHIM与对照幼鼠血液中分离的NK细胞(CD11blowCD49b+)、单核细胞(CD11b+Ly6C+)、中性粒细胞(CD11b+Ly6C+Ly6G+)、B细胞(CD11b-CD19+CD3-)与T细胞(CD11b-CD19-CD3+CD4+、CD11b-CD19-CD3+CD8+)的代表性流式细胞术门控策略。
(b) 箱形图显示通过FACS分析的P0 WHIM血液中循环免疫细胞亚群百分比(Student t检验,(p<0.05);各条件n≥4只动物)。
© 从P0 Cxcr4+/1013与对照幼鼠小脑中分离的NK细胞(CD11blowCD49b+)、单核细胞(CD11b+Ly6C+)、小胶质细胞(CD11b+Ly6C-F4/80+CX3CR1+)及中性粒细胞(CD11b+F4/80-Ly6C+Ly6G+)的代表性流式细胞术门控策略。
(d) 柱状图显示通过RT-qPCR定量分析的成年WHIM小脑中Il17ra相对表达量,以Gadph表达为内参。
(e) 从Cxcr4+/1013*与对照幼鼠肝脏(E16.5)和脾脏(E16.5及P0)中分离的NK细胞(CD11blowCD49b+)、单核细胞(CD11b+Ly6C+)、巨噬细胞(CD11b+Ly6G-F4/80+)、B细胞(CD11b-CD19+CD3-)与T细胞(CD11b-CD19-CD3+CD4+、CD11b-CD19-CD3+CD8+)的代表性流式细胞术门控策略。
(f) 柱状图显示E16.5 WHIM脾脏中不同免疫细胞亚群(Student t检验,(*p<0.05);各条件n≥4只动物)。
(g) 柱状图显示P0 WHIM脾脏中不同免疫细胞亚群(Student t检验,(*p<0.05);各条件n≥4只动物)。
缩写:Neutro(中性粒细胞)、Mono(单核细胞)、Macro(巨噬细胞)、NK(自然杀伤细胞)。
¶ Figure S8:WHIM行为和结构改变可在早期发育阶段被挽救(与图8相关)
(a) 柱状图显示E12.5期注射AMD3100或溶剂后P7天WHIM与对照组小脑的裂隙长度(微米或倍数变化)(多重t检验,(*p<0.05),(p<0.01);每组n>3只动物)。
(b) E12.5期注射AMD3100或溶剂后P45天WHIM与对照组小脑的代表性矢状位尼氏染色切片,及显示裂隙长度(微米或倍数变化)的柱状图(标尺=500微米;多重t检验,(*p<0.05),(p<0.01);每组n>3只动物)。
© P45时WHIM模型小鼠与对照组小鼠小脑的代表性矢状位尼氏染色切片(分别于P1时注射AMD3100或溶剂);条形图显示裂沟长度(微米或倍数变化)(多重t检验,(*p<0.05),(p<0.01);n>3只动物/组)。
缩写:AMD(AMD3100)、veh(溶剂)、fprc(中央前裂)、fpc(锥前裂)、fpr(原裂)、fppd(锥体前裂)、fsec(次裂)、fpl(后外侧裂)。
¶ 收稿与发表信息
- 收稿日期:2024年8月1日
- 修回日期:2025年3月28日
- 接受日期:2025年5月14日
- 在线发表日期:2025年6月6日
- 补充信息获取网址:https://doi.org/10.1016/j.neuron.2025.05.016
¶ 参考文献
- Ben-Shaanan, T.L., Azulay-Debby, H., Dubovik, T., Starosvetsky, E., Korin, B., Schiller, M., Green, N.L., Admon, Y., Hakim, F., Shen-Orr, S.S. 等 (2016). 奖励系统激活可增强先天性与适应性免疫. 《自然·医学》22, 940–944. https://doi.org/10.1038/nm.4133
- Haykin, H. 与 Rolls, A. (2021). 应激期间的神经免疫反应:生理学视角. 《免疫》54, 1933–1947. https://doi.org/10.1016/j.immuni.2021.08.023
- Pavlov, V.A., Chavan, S.S. 与 Tracey, K.J. (2018). 免疫学中的分子与功能神经科学. 《免疫学年度评论》36, 783–812. https://doi.org/10.1146/annurev-immunol-042617-053158
- Al-Haddad, B.J.S., Jacobsson, B., Chabra, S., Modzelewska, D., Olson, E.M., Bernier, R., Enquobahrie, D.A., Hagberg, H., Östling, S., Rajagopal, L. 等 (2019). 子宫内感染暴露后神经精神疾病的长期风险. 《美国医学会精神病学杂志》76, 594–602. https://doi.org/10.1001/jamapsychiatry.2019.0029
- Choi, G.B., Yim, Y.S., Wong, H., Kim, S., Kim, H., Kim, S.V., Hoeffer, C.A., Littman, D.R. 与 Huh, J.R. (2016). 母体白细胞介素-17a通路促进子代出现自闭症样表型. 《科学》351, 933–939. https://doi.org/10.1126/science.aad0314
- Khandaker, G.M., Zimbron, J., Lewis, G. 与 Jones, P.B. (2013). 产前母体感染、神经发育与成人精神分裂症:基于人群研究的系统评价. 《心理医学》43, 239–257. https://doi.org/10.1017/S0033291712000736
- Kim, S., Kim, H., Yim, Y.S., Ha, S., Atarashi, K., Tan, T.G., Longman, R.S., Honda, K., Littman, D.R., Choi, G.B. 等 (2017). 母体肠道细菌在小鼠后代中促进神经发育异常. 《自然》549, 528–532. https://doi.org/10.1038/nature23910
- Mirabella, F.等人 (2021). 产前白介素6水平升高会增加后代谷氨酸能突触密度并破坏海马连接. 《免疫》54, 2611–2631.e8. https://doi.org/10.1016/j.immuni.2021.10.006
- Reed, M.D.等人 (2020). IL-17a在神经发育障碍小鼠模型中促进社交行为. 《自然》577, 249–253. https://doi.org/10.1038/s41586-019-1843-6
- Fraguas, D.等人 (2019). 首发精神病中的氧化应激和炎症:系统综述与荟萃分析. 《精神分裂症通报》45, 742–751. https://doi.org/10.1093/schbul/sby125
- Iakunchykova, O.等人 (2024). 免疫功能障碍对精神疾病因果作用的遗传学证据:我们进展如何? 《转化精神病学》14, 63. https://doi.org/10.1038/s41398-024-02778-2
- Berriat, F.等人 (2023). 外周免疫系统对神经退行性变的贡献. 《自然神经科学》26, 942–954. https://doi.org/10.1038/s41593-023-01323-6
- Michaud, M.等人 (2013). 促炎细胞因子、衰老与年龄相关疾病. 《美国医学会杂志》14, 877–882. https://doi.org/10.1016/j.jamda.2013.05.009
- Mildner, A.等人 (2011). 小胶质细胞和髓系细胞亚群在阿尔茨海默病小鼠模型中的独特且不可替代的作用. 《神经科学杂志》31, 11159–11171. https://doi.org/10.1523/JNEUROSCI.6209-10.2011
- Peter, I.等人 (2018). 抗肿瘤坏死因子治疗与炎症性肠病患者帕金森病发病率的关系. 《美国医学会神经病学杂志》75, 939–946. https://doi.org/10.1001/jamaneurol.2018.0605
- Bannaga, A.S. 等人 (2015). 炎症性肠病与焦虑:联系、风险与面临的挑战. 《临床与实验胃肠病学》8, 111–117. https://doi.org/10.2147/CEG.S57982
- Carloni, S.等人 (2021). 发现肠道炎症期间关闭的脉络丛血管屏障. 《科学》374, 439–448. https://doi.org/10.1126/science.abc6108
- Hedemann, T.L.等人 (2022). 银屑病与精神疾病的关联:临床医生更新. 《综合医院精神病学》75, 30–37. https://doi.org/10.1016/j.genhosppsych.2022.01.006
- Martínez-Ortega, J.M.等人 (2019). 银屑病患者的生活质量、焦虑和抑郁症状:病例对照研究. 《心身研究杂志》124, 109780. https://doi.org/10.1016/j.jpsychores.2019.109780
- Jones Amaowei, E.E.等人 (2022). 抑郁症和焦虑与类风湿关节炎的相关性. 《Cureus》14, e23137. https://doi.org/10.7759/cureus.23137
- Machin, A.R.等人 (2020). 类风湿关节炎中焦虑与疾病活动度及生活质量的关联:系统综述与荟萃分析. 《临床风湿病学》39, 1471–1482. https://doi.org/10.1007/s10067-019-04900-y
- Marrie, R.A., Hitchon, C.A., Walld, R., Patten, S.B., Bolton, J.M., Sareen, J., Walker, J.R., Singer, A., Lix, L.M., El-Gabalawy, R. 等 (2018). 类风湿关节炎患者精神疾病负担加重. 《关节炎护理与研究》70, 970–978. https://doi.org/10.1002/acr.23539
- Uda, M., Hashimoto, M., Uozumi, R., Torii, M., Fujii, T., Tanaka, M., Furu, M., Ito, H., Terao, C., Yamamoto, W. 等 (2021). 类风湿关节炎患者焦虑抑郁相关因素:一项横断面研究. 《风湿病学进展》61, 65. https://doi.org/10.1186/s42358-021-00223-2
- Amaya-Uribe, L., Rojas, M., Azizi, G., Anaya, J.M., Gershwin, M.E. (2019). 原发性免疫缺陷与自身免疫:全面综述. 《自身免疫杂志》99, 52–72. https://doi.org/10.1016/j.jaut.2019.01.011
- McCusker, C., Upton, J., Warrington, R. (2018). 原发性免疫缺陷. 《过敏、哮喘与临床免疫学》14, 61. https://doi.org/10.1186/s13223-018-0290-5
- Picard, C., Bobby Gaspar, H., Al-Herz, W., Bousfiha, A., Casanova, J.-L., Chatila, T., Crow, Y.J., Cunningham-Rundles, C., Etzioni, A., Franco, J.L. 等 (2018). 国际免疫学会联盟:2017年原发性免疫缺陷疾病委员会关于先天性免疫错误的报告. 《临床免疫学杂志》38, 96–128. https://doi.org/10.1007/s10875-017-0464-9
- Tangye, S.G., Al-Herz, W., Bousfiha, A., Chatila, T., Cunningham-Rundles, C., Etzioni, A., Franco, J.L., Holland, S.M., Klein, C., Morio, T. 等 (2020). 人类先天性免疫错误:国际免疫学会联盟专家委员会2019年分类更新. 《临床免疫学杂志》40, 24–64. https://doi.org/10.1007/s10875-019-00737-x
- Tangye, S.G., Al-Herz, W., Bousfiha, A., Cunningham-Rundles, C., Franco, J.L., Holland, S.M., Klein, C., Morio, T., Oxenhendler, E., Picard, C. 等 (2022). 人类先天性免疫错误:国际免疫学会联盟专家委员会2022年分类更新. 《临床免疫学杂志》42, 1473–1507. https://doi.org/10.1007/s10875-022-01289-3
- Isung, J., Williams, K., Isomura, K., Gromark, C., Hesselmark, E., Lichtenstein, P., Larsson, H., Fernández de la Cruz, L.F., Sidorchuk, A., Mataix-Cols, D. (2020). 原发性体液免疫缺陷与精神障碍及自杀行为的关联及自身免疫疾病的作用. 《美国医学会精神病学杂志》77, 1147–1154. https://doi.org/10.1001/jamapsychiatry.2020.1260
- Rider, N.L., Kutac, C., Hajjar, J., Scalchunes, C., Seeborg, F.O., Boyle, M., Orange, J.S. (2017). 常见变异型免疫缺陷病成年患者的健康相关生活质量及治疗影响. 《临床免疫学杂志》37, 461–475. https://doi.org/10.1007/s10875-017-0404-8
- Titman, P., Allwood, Z., Gilmour, C., Malcolmson, C., Duran-Persson, C., Cale, C., Davies, G., Gaspar, H., Jones, A. (2014). 原发性抗体缺陷患儿的生命质量. 《临床免疫学杂志》34, 844–852. https://doi.org/10.1007/s10875-014-0072-x
- Manusama, O.R., van Beveren, N.J.M., van Hagen, P.M., Drexhage, H.A., Dalm, V.A.S.H. (2022). 原发性免疫缺陷中的心理症状:常见共病? 《临床免疫学杂志》42, 695–698. https://doi.org/10.1007/s10875-022-01207-7
- Anginot, A., Nguyen, J., Abou Nader, Z., Rondeau, V., Bonaud, A., Kalogeraki, M., Boutin, A., Lemos, J.P., Bisio, V., Koenen, J. 等 (2023). WHIM综合征相关CXCR4突变驱动骨质疏松症. 《自然通讯》14, 2058. https://doi.org/10.1038/s41467-023-37791-4
- Dotta, L., Notarangelo, L.D., Moratto, D., Kumar, R., Porta, F., Soresina, A., Lougaris, V., Plebani, A., Smith, C.I.E., Norlin, A.-C. 等 (2019). 18例WHIM综合征患者的长期结局:肺部疾病和HPV相关恶性肿瘤的高风险. 《过敏与临床免疫学实践杂志》7, 1568–1577. https://doi.org/10.1016/j.jaip.2019.01.045
- Hernandez, P.A., Gorlin, R.J., Lukens, J.N., Taniuchi, S., Bohinjec, J., Francois, F., Klotman, M.E., Diaz, G.A. (2003). 趋化因子受体基因 CXCR4 与 WHIM 综合征(一种联合免疫缺陷疾病)相关. 《自然·遗传学》34, 70–74. https://doi.org/10.1038/ng1149
- Kallikourdis, M., Trovato, A.E., Anselmi, F., Sarukhan, A., Roselli, G., Tassone, L., Badolato, R., and Viola, A. (2013). WHIM综合征中的CXCR4突变损害T细胞免疫突触的稳定性. 《血液》122, 666–673. https://doi.org/10.1182/blood-2012-10-461830
- Kawai, T. 与 Malech, H.L. (2009). WHIM综合征:先天性免疫缺陷疾病. 《当代血液学观点》16, 20–26. https://doi.org/10.1097/MOH.0b013e32831ac557
- Balabanian, K., Brotin, E., Biajoux, V., Bouchet-Delbos, L., Lainey, E., Fenneteau, O., Bonnet, D., Fiette, L., Emilie, D. 与 Bachelerie, F. (2012). CXCR4的正确脱敏机制对小鼠淋巴细胞发育及外周区室化至关重要. 《血液》119, 5722–5730. https://doi.org/10.1182/blood-2012-01-403378
- Balabanian, K., Lagane, B., Pablos, J.L., Laurent, L., Planchenault, T., Verola, O., Lebbe, C., Kerob, D., Dupuy, A., Hermine, O.等(2005). 不同遗传异常的WHIM综合征可通过CXCR4对CXCL12脱敏受损来解释. 《血液》105, 2449–2457. https://doi.org/10.1182/blood-2004-06-2289
- Galli, J., Pinelli, L., Micheletti, S., Palumbo, G., Notarangelo, L.D., Lougaris, V., Dotta, L., Fazzi, E., and Badolato, R. (2019). 疣状低丙种球蛋白血症免疫缺陷伴粒细胞减少症患者的小脑受累:神经影像学与临床表现. 《孤儿病杂志》14, 61. https://doi.org/10.1186/s13023-019-1030-8
- Heusinkveld, L.E., Yim, E., Yang, A., Azani, A.B., Liu, Q., Gao, J.-L., McDermott, D.H., 与 Murphy, P.M. (2017). WHIM综合征免疫缺陷的发病机制、诊断及治疗策略. 《专家观点:孤儿药》5, 813–825. https://doi.org/10.1080/21678707.2017.1375403
- Milanesi, S., Locati, M.与Borroni, E.M. (2020). WHIM综合征与华氏巨球蛋白血症交叉路径中的CXCR4信号异常. 《国际分子科学杂志》21, 5696. https://doi.org/10.3390/ijms21165696
- Bianchi, M.E. 与 Mezzapelle, R. (2020). 趋化因子受体CXCR4在细胞增殖与组织再生中的作用. 《免疫学前沿》11, 2109. https://doi.org/10.3389/fimmu.2020.02109
- McDermott, D.H., Liu, Q., Velez, D., Lopez, L., Anaya-O’Brien, S., Ulrick, J., Kwatemaa, N., Starling, J., Fleisher, T.A., Priel, D.A.L. 等人 (2014). 一项长期低剂量使用CXCR4拮抗剂普乐沙福治疗WHIM综合征的I期临床试验. 《血液》123, 2308–2316. https://doi.org/10.1182/blood-2013-09-527226
- McDermott, D.H., Velez, D., Cho, E., Cowen, E.W., DiGiovanna, J.J., Pastrana, D.V., Buck, C.B., Calvo, K.R., Gardner, P.J., Rosenzweig, S.D. 等人 (2023). 普乐沙福对比G-CSF治疗WHIM综合征的III期随机交叉试验. 《临床研究杂志》133, e164918. https://doi.org/10.1172/JCI164918
- Levy, A., Mondini, M., Deutsch, E. (2019). 普乐沙福治疗WHIM综合征. 《新英格兰医学杂志》380, e25. https://doi.org/10.1056/NEJMc1901646
- Özdemir, E. (2022). 成人原发性免疫缺陷疾病的回顾性评估. 《皮肤性病学进展》39, 976–979. https://doi.org/10.5114/ada.2022.120887
- 德赫科迪,S.F.,阿迦穆罕默迪,A.,奥克斯,H.D.,与雷扎伊,N.(2012). 伴神经系统表现的原发性免疫缺陷疾病. 《临床免疫学杂志》32, 1–24. https://doi.org/10.1007/s10875-011-9593-8
- 索尔斯、盖达-切尔德与加兰蒂诺 (2020). 原发性免疫缺陷疾病患者自我报告的认知功能障碍. 《脑行为与免疫健康》9, 100170. https://doi.org/10.1016/j.bbih.2020.100170
- Yildirim, M., Ayvaz, D.C., Konuskan, B., Gocmen, R., Tezcan, I., Topcu, M., Topaloglu, H., and Anlar, B. (2018). 原发性免疫缺陷疾病中的神经系统受累. 《儿童神经病学杂志》33, 320–328. https://doi.org/10.1177/0883073817754176
- Grossfeld, P.D., Mattina, T., Lai, Z., Favier, R., Jones, K.L., Cotter, F., and Jones, C. (2004). 11q末端缺失障碍:110例前瞻性研究. 《美国医学遗传学杂志A》129A, 51–61. https://doi.org/10.1002/ajmg.a.30090
- Sauer, A.V., Hernandez, R.J., Fumagalli, F., Bianchi, V., Poliani, P.L., Dallatomasina, C., Riboni, E., Politi, L.S., Tabucchi, A., Carlucci, F. 等 (2017). 脑内腺苷代谢改变导致ADA缺陷小鼠及患者出现行为与神经功能损伤. 《科学报告》7, 40136. https://doi.org/10.1038/srep40136
- Zhang, Y., Yu, X., Ichikawa, M., Lyons, J.J., Datta, S., Lamborn, I.T., Jing, H., Kim, E.S., Biancalana, M., Wolfe, L.A. 等 (2014). 常染色体隐性磷酸葡萄糖变位酶3(PGM3)突变将糖基化缺陷与特应性、免疫缺陷、自身免疫及神经认知损伤相关联. 《过敏与临床免疫学杂志》133, 1400–1409.e1–5. https://doi.org/10.1016/j.jaci.2014.02.013
- Ammann, S., Schulz, A., Krägeloh-Mann, I., Dieckmann, N.M.G., Niethammer, K., Fuchs, S., Eckl, K.M., Plank, R., Werner, R., Altmüller, J. 等 (2016). AP3D1基因突变伴免疫缺陷与癫痫发作,定义新型赫曼斯基-普德拉克综合征. 《血液》127, 997–1006. https://doi.org/10.1182/blood-2015-09-671636
- Bhala, S., Best, A.F., Giri, N., Alter, B.P., Pao, M., Gropman, A., Baker, E.H., and Savage, S.A. (2019). 端粒生物学疾病患者的中枢神经系统表现. 《神经遗传学》5, 370. https://doi.org/10.1212/NXG.0000000000000370
- Oud, M.M., Tuijnenburg, P., Hempel, M., van Vlies, N., Ren, Z., Ferdinandusse, S., Jansen, M.H., Santer, R., Johannsen, J., Bacchelli, C. 等 (2017). EXTL3基因突变导致神经-免疫-骨骼发育不良综合征. 《美国人类遗传学杂志》100, 281–296. https://doi.org/10.1016/j.ajhg.2017.01.013
- Versteegh, J.J., Dulfer, K., Stuvel, K., Pasmans, S.G., and Utens, E.M. (2020). Netherton综合征:儿童及成人患者与其父母的心理社会及神经心理功能. 《健康心理学杂志》25, 2296–2316. https://doi.org/10.1177/1359105318790052
- Fageeh, H.N. (2018). Papillon-Lefèvre综合征:兄弟罕见病例报告及文献综述. 《国际临床儿科牙科杂志》11, 352–355. https://doi.org/10.5005/jp-journals-10005-1538
- Phull, T., Jyoti, D., Malhotra, R., Nayak, S., Modi, H., Singla, I., and P, A. (2023). Papillon-Lefevre综合征的诊断与管理:罕见病例报告及文献简述. 《Cureus》15, e43335. https://doi.org/10.7759/cureus.43335
- Mazar, I., Stokes, J., Ollis, S., Love, E., Espensen, A., Barth, P.G., Powers, J.H., 3rd, and Shields, A.L. (2019). 从成人视角理解Barth综合征的生活经历:定性一对一访谈研究. 《孤儿病杂志》14, 243. https://doi.org/10.1186/s13023-019-1200-8
- Bolze, A., Byun, M., McDonald, D., Morgan, N.V., Abhyankar, A., Premkumar, L., Puel, A., Bacon, C.M., Rieux-Laucat, F., Pang, K. 等 (2010). 基于全外显子测序发现人类FADD缺陷. 《美国人类遗传学杂志》87, 873–881. https://doi.org/10.1016/j.ajhg.2010.10.028
- Kotlarz, D., Marquardt, B., Barøy, T., Lee, W.S., Konnikova, L., Hollizeck, S., Magg, T., Lehle, A.S., Walz, C., Borggraefe, I. 等 (2018). 人类TGF-β1缺陷导致严重炎症性肠病与脑病. 《自然遗传学》50, 344–348. https://doi.org/10.1038/s41588-018-0063-6
- Russ, A., Mack, J., Green-Murphy, A., Occidental, M., and Mian, A. (2019). Griscelli 2型综合征与噬血细胞性淋巴组织细胞增生症:相同突变但表现迥异的姐妹病例. 《儿科血液学与肿瘤学杂志》41, 473–477. https://doi.org/10.1097/MPH.0000000000001522
- Savic, S., Parry, D., Carter, C., Johnson, C., Logan, C., Gutierrez, B.M., Thomas, J.E., Bacon, C.M., Cant, A., and Hambleton, S. (2015). Fas相关死亡结构域蛋白缺乏症新病例及治疗结果更新. 《过敏与临床免疫学杂志》136, 502–505.e4. https://doi.org/10.1016/j.jaci.2015.02.002
- Kang, H.J., Kawasawa, Y.I., Cheng, F., Zhu, Y., Xu, X., Li, M., Sousa, A.M.M., Pletikos, M., Meyer, K.A., Sedmak, G. 等 (2011). 人脑时空转录组图谱. 《自然》478, 483–489. https://doi.org/10.1038/nature10523
- Sepp, M., Leiss, K., Murat, F., Okonechnikov, K., Joshi, P., Leushkin, E., Spä nig, L., Mbengue, N., Schneider, C., Schmidt, J. 等 (2024). 哺乳动物小脑的细胞发育与演化. 《自然》625, 788–796. https://doi.org/10.1038/s41586-023-06884-x
- Hull, C., and Regehr, W.G. (2022). 小脑皮层研究进展. 《神经科学年度评论》45, 151–175. https://doi.org/10.1146/annurev-neuro-091421-125115
- Kozareva, V., Martin, C., Osorno, T., Rudolph, S., Guo, C., Vanderburg, C., Nadaf, N., Regev, A., Regehr, W.G., and Macosko, E. (2021). 小鼠小脑皮层转录组图谱全面界定细胞类型. 《自然》598, 214–219. https://doi.org/10.1038/s41586-021-03220-z
- Leto, K., Arancillo, M., Becker, E.B.E., Buffo, A., Chiang, C., Ding, B., Dobyns, W.B., Dusart, I., Haldipur, P., Hatten, M.E. 等 (2016). 共识文件:小脑发育研究. 《小脑》15, 789–828. https://doi.org/10.1007/s12311-015-0724-2
- Voogd, J., and Glickstein, M. (1998). 小脑解剖结构研究进展. 《神经科学趋势》21, 370–375. https://doi.org/10.1016/s0166-2236(98)01318-6
- Dresselhaus, E.C., and Meffert, M.K. (2019). NF-κB在神经系统中的细胞特异性功能. 《免疫学前沿》10, 1043. https://doi.org/10.3389/fimmu.2019.01043
- Kaltschmidt, B., and Kaltschmidt, C. (2009). 神经系统中的NF-κB. 《冷泉港生物学视角》1, a001271. https://doi.org/10.1101/cshperspect.a001271
- Du, H., Wang, Z., Guo, R., Yang, L., Liu, G., Zhang, Z., Xu, Z., Tian, Y., Yang, Z., Li, X. 等 (2022). Bcl11a与Bcl11b转录因子调控皮层投射神经元的生成与分化. 《大脑皮层》32, 3611–3632. https://doi.org/10.1093/cercor/bhab437
- Simon, R., Wiegreffe, C., and Britsch, S. (2020). Bcl11转录因子调控皮层发育与功能. 《分子神经科学前沿》13, 51. https://doi.org/10.3389/fnmol.2020.00051
- Molyneaux, B.J., Goff, L.A., Brettler, A.C., Chen, H.H., Hrvatin, S., Rinn, J.L., and Arlotta, P. (2015). DeCoN:新皮层锥体神经元命运选择过程中体内转录动态的全基因组分析. 《神经元》85, 275–288. https://doi.org/10.1016/j.neuron.2014.12.024
- Ozawa, P.M.M., Ariza, C.B., Ishibashi, C.M., Fujita, T.C., Banin-Hirata, B.K., Oda, J.M.M., and Watanabe, M.A.E. (2016). CXCL12与CXCR4在正常小脑发育及髓母细胞瘤中的作用. 《国际癌症杂志》138, 10–13. https://doi.org/10.1002/ijc.29333
- Wang, Y., Li, G., Stanco, A., Long, J.E., Crawford, D., Potter, G.B., Pleasure, S.J., Behrens, T., and Rubenstein, J.L.R. (2011). CXCR4与CXCR7在调控中间神经元迁移中的独特功能. 《神经元》69, 61–76. https://doi.org/10.1016/j.neuron.2010.12.005
- Arpi, M.N.T., and Simpson, T.I. (2022). SFARI基因及其定位:利用RNA-seq数据模拟自闭症谱系障碍特异性基因表达失调. 《科学报告》12, 10158. https://doi.org/10.1038/s41598-022-14077-1
- Alouche, N., Bonaud, A., Rondeau, V., Hussein-Agha, R., Nguyen, J., Bisio, V., Khamyath, M., Crickx, E., Setterblad, N., Dulphy, N. 等 (2021). 血液系统疾病相关Cxcr4功能获得性突变导致滤泡外免疫应答失控. 《血液》137, 3050–3063. https://doi.org/10.1182/blood.2020007450
- Freitas, C., Wittner, M., Nguyen, J., Rondeau, V., Biajoux, V., Aknin, M.-L., Gaudin, F., Beaussant-Cohen, S., Bertrand, Y., Bellanne´-Chantelot, C. 等 (2017). 造血干细胞的淋巴样分化需要高效的Cxcr4脱敏作用. 《实验医学杂志》214, 2023–2040. https://doi.org/10.1084/jem.20160806
- Mayol, K., Biajoux, V., Marvel, J., Balabanian, K. 与 Walzer, T. (2011). CXCR4与S1P5的顺序脱敏调控自然杀伤细胞的定向迁移. 《血液》118, 4863–4871. https://doi.org/10.1182/blood-2011-06-362574
- Biajoux, V., Natt, J., Freitas, C., Alouche, N., Sacquin, A., Hemon, P., Gaudin, F., Fazilleau, N., Espe´li, M. 与 Balabanian, K. (2016). 浆细胞高效分化与定向迁移需要Cxcr4脱敏机制. 《细胞报告》17, 193–205. https://doi.org/10.1016/j.celrep.2016.08.068
- Apps, R. 与 Hawkes, R. (2009). 小脑皮层组织模式:单图谱假说. 《自然神经科学评论》10, 670–681. https://doi.org/10.1038/nrn2698
- Anyan, J. 与 Amir, S. (2018). 是过度抑郁无力游泳,还是过度恐惧不敢停止?强迫游泳实验作为焦虑样行为测量工具的新诠释. 《神经精神药理学》43, 931–933. https://doi.org/10.1038/npp.2017.260
- Fox, W.M. (1965). 小鼠反射个体发生与行为发育. 《动物行为》13, 234–241. https://doi.org/10.1016/0003-3472(65)90041-2
- Feather-Schussler, D.N. 与 Ferguson, T.S. (2016). 脑瘫新生小鼠模型运动测试方法集. 《可视化实验期刊》117, 53569. https://doi.org/10.3791/53569
- Baumann, O., Borra, R.J., Bower, J.M., Cullen, K.E., Habas, C., Ivry, R.B., Leggio, M., Mattingley, J.B., Molinari, M., Moulton, E.A. 等 (2015). 共识论文:小脑在感知加工中的作用. 《小脑》14, 197–220. https://doi.org/10.1007/s12311-014-0627-7
- MacNeilage, P.R. 与 Glasauer, S. (2018). 重力感知:小脑的作用. 《当代生物学》28, R1296–R1298. https://doi.org/10.1016/j.cub.2018.09.053
- Therrien, A.S.与Bastian, A.J. (2015). 小脑损伤损害感觉与运动功能的内在预测机制. 《当前神经生物学观点》33, 127–133. https://doi.org/10.1016/j.conb.2015.03.013
- van der Heijden, M.E., Lackey, E.P., Perez, R., Ileyen, F.S., Brown, A.M., Donofrio, S.G., Lin, T., Zoghbi, H.Y., and Sillitoe, R.V. (2021). 浦肯野细胞放电特性的成熟依赖于兴奋性神经元的神经发生. 《生命》10, e68045. https://doi.org/10.7554/eLife.68045
- Lawton, A.K., Engstrom, T., Rohrbach, D., Omura, M., Turnbull, D.H., Mamou, J., Zhang, T., Schwarz, J.M., and Joyner, A.L. (2019). 小脑褶皱的形成始于流体样层上的机械约束,无需细胞预模式. 《生命》8, e45019. https://doi.org/10.7554/eLife.45019
- Consalez, G.G., Goldowitz, D., Casoni, F., and Hawkes, R. (2020). 小脑颗粒细胞的起源、发育与分区. 《神经回路前沿》14, 611841. https://doi.org/10.3389/fncir.2020.611841
- Yeung, J., Ha, T.J., Swanson, D.J., and Goldowitz, D. (2016). Pax6在小脑发育中的新颖多重功能. 《神经科学杂志》36, 9057–9069. https://doi.org/10.1523/JNEUROSCI.4385-15.2016
- Sudarov, A., and Joyner, A.L. (2007). 小脑形态发生:小叶模式由多细胞锚定中心协调. 《神经发育》2, 26. https://doi.org/10.1186/1749-8104-2-26
- Pellegrino, L., Khodaparast, S., and Cabral, J.T. (2020). 皱纹状等离子氧化聚二甲基硅氧烷表面的正交波叠加. 《软物质》16, 595–603. https://doi.org/10.1039/C9SM02124H
- Oomman, S., Strahlendorf, H., Finckbone, V., and Strahlendorf, J. (2005). 出生后大鼠小脑伯格曼胶质细胞中非致死性活性caspase-3表达. 《脑研究:发育脑研究》160, 130–145. https://doi.org/10.1016/j.devbrainres.2005.07.010
- Gulati, G.S., Sikandar, S.S., Wesche, D.J., Manjunath, A., Bharadwaj, A., Berger, M.J., Ilagan, F., Kuo, A.H., Hsieh, R.W., Cai, S. 等 (2020). 单细胞转录多样性是发育潜能的标志. 《科学》367, 405–411. https://doi.org/10.1126/science.aax0249
- Sato, M., Suzuki, K., and Nakanishi, S. (2006). 小脑颗粒细胞发育过程中BDNF应答基因的表达谱. 《生物化学与生物物理研究通讯》341, 304–309. https://doi.org/10.1016/j.bbrc.2005.12.184
- Limatola, C., Giovannelli, A., Maggi, L., Ragozzino, D., Castellani, L., Ciotti, M.T., Vacca, F., Mercanti, D., Santoni, A. 与 Eusebi, F. (2000). SDF-1α介导的大鼠小脑突触传递调控. 《欧洲神经科学杂志》12, 2497–2504. https://doi.org/10.1046/j.1460-9568.2000.00139.x
- Witter, L., Rudolph, S., Pressler, R.T., Lahlaf, S.I., and Regehr, W.G. (2016). 浦肯野细胞侧枝使小脑皮层的输出信号能够反馈至浦肯野细胞与中间神经元. 《神经元》91, 312–319. https://doi.org/10.1016/j.neuron.2016.05.037
- Mapelli, L., Dubochet, O., Tedesco, M., Sciacca, G., Ottaviani, A., Monteverdi, A., Battaglia, C., Tritto, S., Cardot, F., Surbled, P. 等 (2022). 新一代用于脑组织与类器官的微针三维高密度CMOS多电极阵列的设计、实现与功能验证. bioRxiv预印本. https://doi.org/10.1101/2022.08.11.503595
- Geier, C.B., Ellison, M., Cruz, R., Pawar, S., Leiss-Piller, A., Zmajkovicova, K., McNulty, S.M., Yilmaz, M., Evans, M.O., 2nd, Gordon, S. 等人 (2022). WHIM综合征在66名儿科和成人患者国际队列中的疾病进展. 《临床免疫学杂志》42, 1748–1765. https://doi.org/10.1007/s10875-022-01312-7
- Evans, M.O., 第二,McDermott, D.H., Murphy, P.M., 与 Petersen, M.M. (2019). WHIM综合征患儿的新生儿筛查异常结果分析. 《临床免疫学杂志》39, 839–841. https://doi.org/10.1007/s10875-019-00686-5
- Ara, T., Tokoyoda, K., Sugiyama, T., Egawa, T., Kawabata, K. 和 Nagasawa, T. (2003). 长期造血干细胞在个体发育过程中定植骨髓需要基质细胞衍生因子-1的参与. 《Immunity》19, 257–267. https://doi.org/10.1016/s1074-7613(03)00201-2
- 克里斯滕森 (Christensen, J.L.)、赖特 (Wright, D.E.)、瓦杰斯 (Wagers, A.J.) 与韦斯曼 (Weissman, I.L.) (2004). 胎儿造血干细胞的循环与趋化性. 《公共科学图书馆·生物学》2, E75. https://doi.org/10.1371/journal.pbio.0020075
- Zou, Y.R., Kottmann, A.H., Kuroda, M., Taniuchi, I., and Littman, D.R. (1998). 趋化因子受体CXCR4在造血和小脑发育中的功能. 《自然》393, 595–599. https://doi.org/10.1038/31269
- Alves de Lima, K., Rustenhoven, J., Da Mesquita, S., Wall, M., Salvador, A.F., Smirnov, I., Martelossi Cebinelli, G., Mamuladze, T., Baker, W., Papadopoulos, Z. 等 (2020). 脑膜γδ T细胞通过神经元中的IL-17a信号通路调控焦虑样行为. 《自然免疫学》21, 1421–1429. https://doi.org/10.1038/s41590-020-0776-4
- Goyal, M., Goyal, R. 与 Sanguinetti, J.L. (2024). 迷走神经超声刺激作为焦虑治疗新方案. 《精神病学前沿》15, 1376140. https://doi.org/10.3389/fpsyt.2024.1376140
- Fernandes, D.J., Spring, S., Corre, C., Tu, A., Qiu, L.R., Hammill, C., Vousden, D.A., Spencer Noakes, T.L., Nieman, B.J., Bowdish, D.M.E. 等人 (2022). 免疫功能障碍小鼠模型:其神经解剖学差异反映焦虑行为表型. 《分子精神病学》27, 3047–3055. https://doi.org/10.1038/s41380-022-01535-5
- Sawtell, N.B. (2010). 颗粒细胞中的多模态整合作为类小脑回路中关联可塑性与感觉预测的基础. 《神经元》66, 573–584. https://doi.org/10.1016/j.neuron.2010.04.018
- 王W.X. 和 J.L. 勒费弗尔 (2022). 形态学伪时间排序和命运图谱揭示小脑抑制性中间神经元的多样化. 《自然通讯》13, 3433. https://doi.org/10.1038/s41467-022-30977-2
- Silva, C.G., Peyre, E.与Nguyen, L. (2019). 细胞迁移通过动态细胞互作调控大脑皮层形态发生. 《自然神经科学评论》20, 318–329. https://doi.org/10.1038/s41583-019-0148-y
- Komuro, H.与Yacubova, E. (2003). 小脑颗粒细胞迁移研究新进展. 《细胞与分子生命科学》60, 1084–1098. https://doi.org/10.1007/s00018-003-2248-z
- Chin, P.W.与Augustine, G.J. (2023). 小脑与焦虑关联性研究. 《细胞神经科学前沿》17, 1130505. https://doi.org/10.3389/fncel.2023.1130505
- Moreno-Rius, J. (2018). 小脑在恐惧与焦虑相关障碍中的作用. 《神经精神药理学与生物精神病学进展》85, 23–32. https://doi.org/10.1016/j.pnpbp.2018.04.002
- Wester, J.C., Mahadevan, V., Rhodes, C.T., Calvigioni, D., Venkatesh, S., Maric, D., Hunt, S., Yuan, X., Zhang, Y., Petros, T.J.等 (2019). 新皮层投射神经元通过谱系依赖方式指导抑制性中间神经元环路发育. 《神经元》102, 960–975.e6. https://doi.org/10.1016/j.neuron.2019.03.036
- Lodato, S., Rouaux, C., Quast, K.B., Jantrachotechatchawan, C., Studer, M., Hensch, T.K., 与 Arlotta, P. (2011). 兴奋性投射神经元亚型控制大脑皮层局部抑制性中间神经元的分布. 《神经元》69, 763–779. https://doi.org/10.1016/j.neuron.2011.01.015
- Wang, S.S.-H., Kloth, A.D., and Badura, A. (2014). 小脑、敏感期与自闭症. 《神经元》83, 518–532. https://doi.org/10.1016/j.neuron.2014.07.016
- Morland, B., Kepak, T., Dallorso, S., Sevilla, J., Murphy, D., Luksch, R., Yaniv, I., Bader, P., Röβler, J., Bisogno, G. 等. (2020). 普乐沙福联合标准方案用于适合自体移植的实体瘤儿科患者造血干细胞动员:双臂I/II期研究(MOZAIC). 《骨髓移植》55, 1744–1753. https://doi.org/10.1038/s41409-020-0836-2
- Karres, D., Ali, S., van Hennik, P.B., Straus, S., Josephson, F., Thole, G., Glerum, P.J., Herberts, C., Babae, N., Herold, R. 等人 (2020). EMA关于普乐沙福(mozobil)儿科适应症的建议:用于增强淋巴瘤或恶性实体瘤患儿造血干细胞动员采集及后续自体移植. 《肿瘤学家》25, e976–e981. https://doi.org/10.1634/theoncologist.2019-0898
- López-Bendito, G., Sánchez-Alcañiz, J.A., Pla, R., Borrell, V., Picó, E., Valdeolmillos, M., and Marín, O. (2008). 趋化因子信号控制GABA能中间神经元的皮层内迁移及最终分布. 《神经科学杂志》28, 1613–1624. https://doi.org/10.1523/JNEUROSCI.4651-07.2008
- Chen, T.W., Wardill, T.J., Sun, Y., Pulver, S.R., Renninger, S.L., Baohan, A., Schreiter, E.R., Kerr, R.A., Orger, M.B., Jayaraman, V. 等人 (2013). 用于神经元活动成像的超灵敏荧光蛋白. 《自然》499, 295–300. https://doi.org/10.1038/nature12354
- Hao, Y., Hao, S., Andersen-Nissen, E., Mauck, W.M., 3rd, Zheng, S., Butler, A., Lee, M.J., Wilk, A.J., Darby, C., Zager, M. 等人 (2021). 多模态单细胞数据的整合分析. 《细胞》184, 3573–3587.e29. https://doi.org/10.1016/j.cell.2021.04.048
- Lee, H.Y., Greene, L.A., Mason, C.A., and Manzini, M.C. (2009). 产后小鼠小脑颗粒神经元祖细胞及神经元的分离与培养. 《可视化实验杂志》23, 990. https://doi.org/10.3791/990
- Krämer, D., and Minichiello, L. (2010). 原代小脑颗粒细胞的培养. 《分子生物学方法》633, 233–239. https://doi.org/10.1007/978-1-59745-019-5_17
- Losi, G., Prybylowski, K., Fu, Z., Luo, J.H., and Vicini, S. (2002). 发育中小脑颗粒神经元的沉默突触. 《神经生理学杂志》87, 1263–1270. https://doi.org/10.1152/jn.00633.2001
- C Wood, T. (2018). QUIT:定量成像工具. 《开源软件杂志》3, 656. https://doi.org/10.21105/joss.00656
- Avants, B.B., Tustison, N.J., Song, G., Cook, P.A., Klein, A., and Gee, J.C. (2011). 基于ANTs相似性度量的大脑图像配准性能可重复性评估. 《神经影像学》54, 2033–2044. https://doi.org/10.1016/j.neuroimage.2010.09.025
- Avants, B.B., Epstein, C.L., Grossman, M., and Gee, J.C. (2008). 采用互相关的对称微分同胚图像配准:评估老年性与神经退行性脑部自动标注效果. 《医学图像分析》12, 26–41. https://doi.org/10.1016/j.media.2007.06.004
- Winkler, A.M., Ridgway, G.R., Webster, M.A., Smith, S.M., and Nichols, T.E. (2014). 广义线性模型的置换检验方法. 《神经影像学》92, 381–397. https://doi.org/10.1016/j.neuroimage.2014.01.060
- van der Walt, S., Schönberger, J.L., Nunez-Iglesias, J., Boulogne, F., Warner, J.D., Yager, N., Gouillart, E., and Yu, T.; scikit-image贡献者 (2014). scikit-image:基于Python的图像处理工具库. 《PeerJ》2, e453. https://doi.org/10.7717/peerj.453
- Nunez-Iglesias, J., Blanch, A.J., Looker, O., Dixon, M.W., and Tilley, L. (2018). 新型Python骨骼图像分析库证实疟原虫重构红细胞膜骨架. 《PeerJ》6, e4312. https://doi.org/10.7717/peerj.4312
- Boitnott, A., Garcia-Forn, M., Ung, D.C., Niblo, K., Mendonca, D., Park, Y., Flores, M., Maxwell, S., Ellegood, J., Qiu, L.R. 等 (2021). DDX3X综合征小鼠模型的发育与行为表型研究. 《生物精神病学》90, 742–755. https://doi.org/10.1016/j.biopsych.2021.05.027
- Heyser, C.J. (2004). 啮齿类动物发育里程碑事件评估方法. 《当代神经科学实验方案》Chapter 8, 单元8.18. https://doi.org/10.1002/0471142301.ns0818s25
- Livak, K.J., and Schmittgen, T.D. (2001). 使用实时定量PCR与2(-ΔΔCT)法分析基因相对表达量. 《方法》25, 402–408. https://doi.org/10.1006/meth.2001.1262
- 罗 W., 林 G.N., 宋 W., 张 Y., 赖 H., 张 M., 苗 J., 程 X., 王 Y., 李 W. 等. (2021). 单细胞空间转录组分析揭示了发育中的出生后颗粒小脑细胞和髓母细胞瘤的共同和差异特征. 《BMC生物学》19, 135. https://doi.org/10.1186/s12915-021-01071-8
- 孙志与托马斯·C·苏德霍夫 (2021). 培养神经元神经网络分析的简易Ca²⁺成像方法. 《神经科学方法杂志》349, 109041. https://doi.org/10.1016/j.jneumeth.2020.109041
- 皮尔佩尔、兰德克、克鲁格曼、西伯格与施瓦茨 (2009). 通过向新生小鼠脑部定向注射重组病毒实现特定前脑区域的快速、可重复转导. 《神经科学方法杂志》182, 55–63. https://doi.org/10.1016/j.jneumeth.2009.05.020
- 金子昌司、山口佳世子、永楽元次、佐藤守、高田信、清原康弘、三品昌美、平瀬肇、橋川俊、および権賀政人 (2011). 小脳回路形成における単平面プルキンエ細胞樹状突起のリモデリング. 《PLoS One》6, e20108. https://doi.org/10.1371/journal.pone.0020108
- 藤岛启辅、堀江亮、望月敦史、& 剑岳万裕 (2012). 调控小脑浦肯野细胞树突形态特征的分支动力学原理. 《发育》139, 3442–3455. https://doi.org/10.1242/dev.081315
- Gibson, D.A. 与 Ma, L. (2011). 利用基于病毒的Cre重组酶进行出生后小鼠大脑发育中基因功能的镶嵌分析. 《可视化实验期刊》54, 2823. https://doi.org/10.3791/2823
- 阿甘达-卡雷拉斯 I.、费尔南德斯-冈萨莱斯 R.、穆尼奥斯-巴鲁蒂亚 A. 和 奥尔蒂斯-德索洛萨诺 C. (2010). 组织学切片的三维重建:应用于乳腺组织显微镜研究. 《技术》73, 1019–1029. https://doi.org/10.1002/jemt.20829