¶ 探索Aβ42寡聚物在原代皮层神经元培养中对神经网络的病理效应
原文下载:/ldw/3brain/publication/adfd40e5a0f010d64f4d86a01ffe24589383.pdf
杜尔贡·甘巴特 1, 全在景 1, 李允宗 2,* 和 金相成 1,*
1 汉阳大学药学院,安山 15588,韩国
2 成均馆大学医学院药理学系,水原 16419,韩国
* 通讯作者:ylee69@skku.edu (Y.L.);talpiot@hanyang.ac.kr (S.S.K.)
摘要:阿尔茨海默病(AD)是一种影响认知功能、行为及神经元特性的多因素疾病。神经元功能障碍是导致AD患者认知衰退的主要原因,其诱因包括Aβ42斑块沉积。由Aβ42沉积诱导的神经超兴奋性会引发神经网络异常,导致突触活动改变和中间神经元功能障碍。尽管神经影像技术已阐明神经连接的内在机制,但在细胞层面的精确认知仍不明确。既往多电极阵列研究通过体外培养模型考察了神经元网络调控,揭示了Aβ42存在下离子通道与化学调节因子的关联性。本研究采用高密度多电极阵列探究神经元连接性与动态变化,重点关注全网络参数随时间的变化规律。通过比较正常与Aβ42处理的神经元培养模型,我们发现了Aβ42寡聚体改变网络特征的直接病理效应。Aβ42寡聚体的有害影响不仅表现为放电激活减弱,还包括神经连接质量的损害以及分散性的定向障碍。这一发现将深化我们对AD进展过程中神经网络重塑机制的理解。
关键词: 阿尔茨海默病; Aβ42; 寡聚体; 高密度多电极阵列; 神经元网络; 图论; 活动轨迹中心
¶ 1. 引言
阿尔茨海默病(AD)对记忆、推理甚至行为等正常认知功能产生不利影响,使其成为神经退行性疾病中最具致残性的病症[1]。AD是一种多因素疾病,其中β淀粉样蛋白(Aβ)已被证实在神经元功能与形态特性方面产生显著影响[2]。在临床和实验环境中,AD进展的不同阶段常可观察到矛盾性神经活动[3]。多数轻度认知障碍(MCI)患者会出现癫痫样放电,随后在晚年出现认知功能障碍[4,5]。多项研究表明,由淀粉样前体蛋白(APP)经内体蛋白水解切割形成的致病性Aβ42寡聚体,会导致神经元网络过度兴奋[6,7]。在神经活动过度诱导下,Aβ42沉积与tau蛋白扩散会相互加剧进程[8]。作为Aβ42病理生理机制的重要组成部分,其对突触修饰的影响——无论是引起突触前易化还是突触后抑制——已得到深入研究[9]。此外,研究证实突触活动改变连同中间神经元功能障碍,可能在APP或Aβ42存在时导致网络异常[10,11]。由此可见,Aβ42寡聚体确实能够引发神经网络异常。为了更全面地理解皮层在阿尔茨海默病进展过程中,为研究神经网络连接性与认知状态的关系,临床上常对痴呆患者采用弥散张量成像、功能性磁共振成像和脑电图等神经影像技术。与传统方法相比,在高密度微电极阵列上进行分离神经元培养,为观察时序阶段的神经网络形成提供了更可控的研究手段,从而揭示神经网络的变化机制[12]。这种培养体系还能通过时空视角观察网络形成过程,在实验控制下探究神经网络的演变规律。尽管属于人工培养体系,该神经培养物仍保留着大脑的内在特性[13]。通过高密度微电极阵列获取神经信号后,我们仍面临从海量数据中高效提取拓扑特征并表征网络动态状态的任务。在脑影像连接分析的多种方法中,图论被视为优势指标,能够从结构和功能层面反映神经网络在整合、分离和连接强度等方面的组织状态[14,15]。
本研究通过Aβ42寡聚体随时间暴露的干预,展示了神经元网络的动态变化过程。基于图论方法对关键网络参数的分析,实现了对神经网络巩固与解离过程的量化评估。此外,通过活动中心轨迹(CAT)分析确定了培养区域内网络爆发轨迹的分布特征及神经元信号传递速率。高密度微电极阵列记录结果明确显示,Aβ42寡聚体诱导的神经网络效率递减现象,有助于深入理解阿尔茨海默病进展中神经网络所受影响。
¶ 2. 结果
¶ 2.1. Aβ42应用下不同培养龄皮质神经元培养物的特征
已知Aβ42会根据其细胞外浓度改变神经元活动,引起突触前易化或突触后抑制[9]。本研究采用的10 µM Aβ42寡聚物在前期研究中已被证实具有神经毒性[16]。平均放电频率( MFR)的变化在目视检查(图1A)和小提琴图(图1B)中均显而易见。两种培养物中,通过MFR反映的放电活动量均随培养时间延长而稳定增加(图1B)。相比之下,Aβ42培养组的MFR在数量和变异程度上至少直至DIV10均高于对照组,这表明其初始成熟速度更快,与先前在Aβ42培养组中观察到的神经元过度激活现象相符[17,18]。值得注意的是,作为神经元兴奋性和连接性的另一指标,两组培养物的放电间隔(ISI)值均随培养时间延长而逐渐下降(图1C)。当平均ISI在对照组DIV1-4期间下降至35.68%时,Aβ42培养组的下降幅度为64.02%,两者下降模式存在细微差异。DIV4后对照组平均ISI保持相对稳定,而Aβ42组的ISI始终高于对照组。这种ISI下降模式的差异表明,Aβ42处理以较慢速率影响突触传递,并降低了神经元间信息交换的响应能力。
¶ 2.2. Aβ42寡聚体引起的原代皮质神经元培养体系功能连接异常
图2A从连接图谱的图形视角展示了对照组与Aβ42培养组之间的显著差异。值得注意的是,与对照组中随培养时间增加神经元节点连接数量持续上升的趋势相比,Aβ42培养组的连接复杂度呈现双相变化模式:在DIV10之前初始上升,随后直至DIV16逐渐下降。这种模式与图1中观察到的神经簇发放电活动和平均放电率具有相似性。聚类系数(CC)反映神经元形成局部簇的能力。在此方面,Aβ42培养组在整个培养期间始终保持较强的聚类特性,其CC值始终高于对照组(图2B)。有趣的是,对照组的CC值 从DIV4到DIV10保持稳定,随后在DIV13突然增加。然而PL值显示出更动态的变化。从DI V4到13,对照组的PL值逐渐下降(图2C)。与此相反,Aβ42培养物的PL值以双相模式反映了连接图谱:在DIV4之前急剧上升,之后逐渐下降。由于PL指的是从一个节点到达另一个节点所需的最小步数,较短的PL意味着网络内连接效率更高,即更好的小世界性[15]。本研究中,对照组培养物随周龄发展出网络效率。对照组在DIV13出现最低PL值与最高CC值同时发生的现象,表明分离神经元达到了自组织临界状态——在此状态下系统能快速响应环境变化,同时在外界或内部扰动下保持稳定性与鲁棒性[19]。而Aβ42培养物中DIV4至10期间PL值的逐渐升高,表明网络形成效率持续恶化。后期DIV13至16的下降可能源于网络整体规模的缩减,这从连接图谱和ND值中均可观察到(图2A,D)。因此与对照组不同, Aβ42培养物未能达到临界状态。另一网络参数ND也为理解网络组织提供了重要工具(图2 D)。在Aβ42培养物中,由于DIV4至7期间平均ND增加近六倍,节点内连接分支的修剪未能优化执行,导致神经元承受额外负担。而对照组培养物的ND值随着PL值下降逐渐上升。根据对照组所有网络参数的变化,该网络随着非必要连接的修剪、局部连接的增加及远距离节点间捷径的形成而逐渐成熟。如图S1A和S2A(补充材料)所示,PL分布直方图以更精细的方式呈现了神经网络的成熟过程。与较晚启动该过程的对照组相比,Aβ42培养物在所有PL分布范围内均表现出更早的神经连接。当对照组网络在DIV13达到临界阶段时,其中位PL直方图维持在2.75个链接。而在Aβ42培养物中,中位PL直方图从2.25(DIV7)升至3.2 5(DIV10)后回落至2.75(DIV13)。该中位数偏移导致Aβ42培养物的PL分布直方图较对照组具有更肥厚的尾部,意味着通往远距离节点的捷径链接更长。对照组在DIV16显示出较前序培养日明显的链接增长,使中位数保持稳定,表明网络完整性处于稳定状态。而Aβ42培养物未显示PL分布尾部模式的变化,说明网络规模扩张受阻。较高ND链接的肥尾现象在Aβ42培养物中亦有显现(图S1B、S2B)。基于所有拓扑参数可知,Aβ42寡聚体通过阻碍网络临界态的形成,同时损害了神经网络的质性与量化成熟。
¶
2.3. Aβ42应用对脉冲簇放电模式的改变
图3展示了培养神经元在狭窄时间窗内快速发放动作电位时出现的锋电位簇发现象。随着培养时间的增长,可观察到锋电位簇发和网络簇发(图3A)。在对照组中,除DIV13外,簇发数量和频率均呈现持续上升趋势(图3B,C)。相比之下,锋电位簇发持续时间从DIV4到DIV16呈下降趋势,仅DIV13例外(图3D)。锋电位网络簇发也呈现类似规律,其数量和频率随时间逐渐增加,而持续时间除DIV13外逐步缩短(图3E-G)。然而Aβ42培养组的簇发模式未显现显著特征:锋电位簇发数量从DIV1至DIV4下降,但DIV4与DIV7间无差异(图3B);DIV7至DIV10的上升趋势在DIV13发生逆转。除DIV1外,锋电位持续时间呈现稳定递减(图3D)。若忽略DIV1数据,可观察到Aβ42培养组的网络簇发数量与频率呈双相变化——初始上升后在DIV10转为下降(图3E,F);而网络持续时间在排除DIV1后,则与锋电位簇发模式类似持续递减(图3G)。
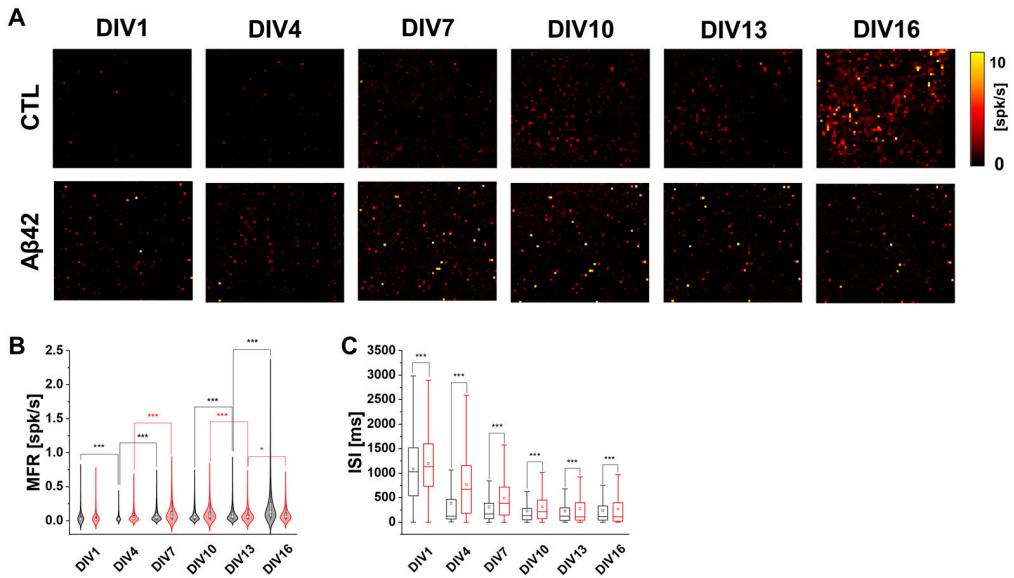
图1. HD MEA记录测量中发育神经元培养物的脉冲激活特性。(A) 5分钟记录期间自发性神经元激活的MFR活动图谱。对照组(CTL)与Aβ42寡聚物处理组在DIV1、4、7、10、13和16天的表现。强度标度范围为0-10次脉冲/秒。(B) 对照组(黑色)与Aβ42组(红色)在培养天数(DIVs)期间5分钟记录的平均放电率(MFR)小提琴图。白点表示中位数,中央粗白条表示四分位距。细黑线表示1.5×倍四分位距。(C) 对照组(黑色)与Aβ42组(红色)在培养天数期间5分钟记录的脉冲间隔(ISI)箱形图(毫秒)。靠近零位的箱体下边界为第25百分位数(下四分位数),远离零位的箱体上边界为第75百分位数(上四分位数)。误差线表示标准误。*** p < 0.005, * p < 0.05;采用韦尔奇校正的非配对双尾t检验。
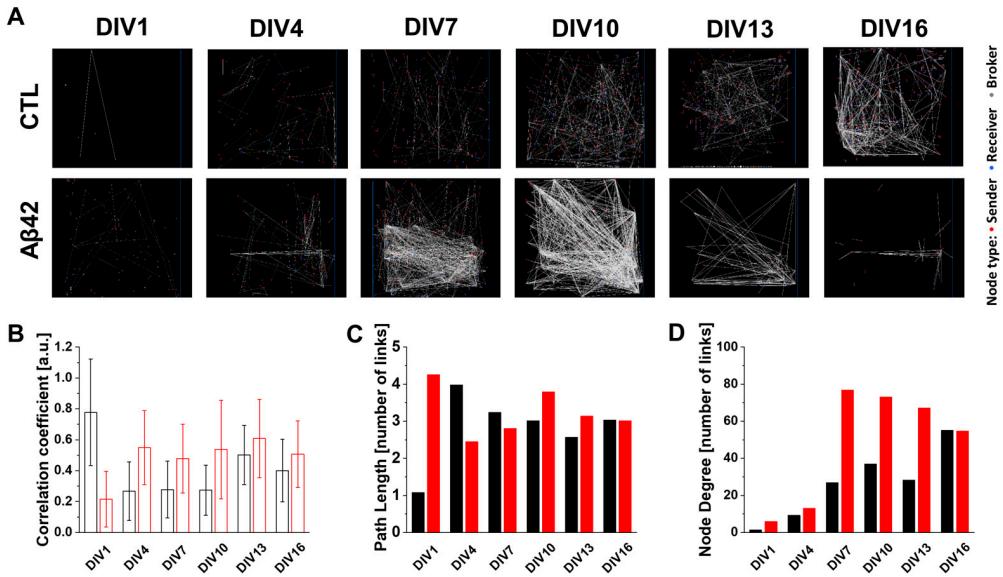
图2. 基于图论的神经元连接图谱及其特征分析。(A)5分钟记录期间自发性神经元激活的连接图谱,展示了对照组与Aβ42寡聚体处理组在体外培养第1、4、7、10、13、16天的连接模式。红点代表信号发送节点,蓝点代表接收节点,灰点代表中转节点,白线表示节点间的连接。(B)培养期间对照组(黑色)与Aβ42组(红色)在5分钟记录中神经元连接聚类系数的平均值,线段表示标准差。(C )以连接数为单位的平均路径长度直方图。(D)以连接数为单位的节点度分布直方图。
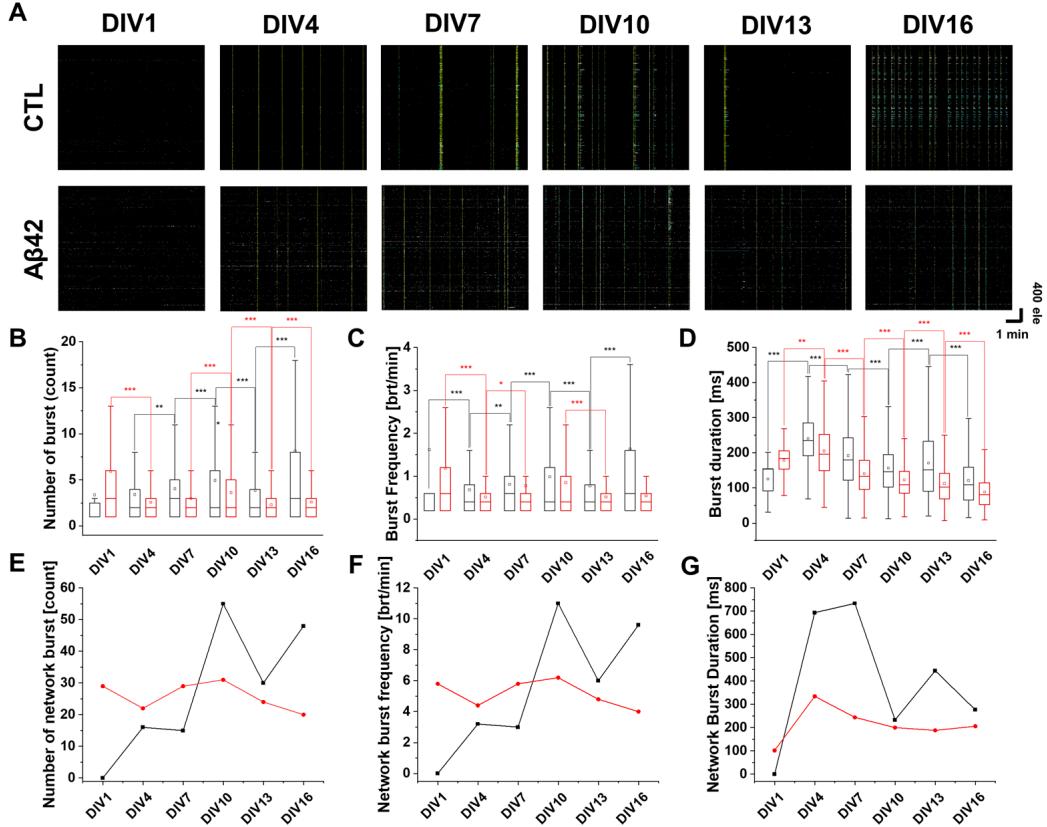
图3. 发育中神经元文化的峰爆发放电分析。(A) 4096个电极(y轴)在5分钟记录期间(x轴)的神经元放电点状图。对照组(CTL)和Aβ42寡聚物处理组在培养第1、4、7、10、13和16天的情况。比例尺表示1分钟和400个电极。芥末色代表峰电位网络爆发,蓝色显示峰爆发放电。(B) 对照组(黑色)和Aβ42寡聚物处理组(红色)峰爆发放电次数的箱形图。(C) 显示每分钟爆发次数的峰爆发频率箱形图。(D) 以毫秒为单位的峰爆发持续时间箱形图。(E) 对照组(黑色)和Aβ42寡聚物处理组(红色)网络爆发次数的折线图。(F) 每分钟网络爆发次数的网络爆发频率折线图。(G) 以毫秒为单位的网络爆发持续时间折线图。所有箱形图中,靠近零值的箱体下边界表示第25百分位数(下四分位数),远离零值的箱体上边界表示第75百分位数(上四分位数)。误差线显示标准误。*** p < 0.005,** p < 0.01,* p < 0.05;采用韦尔奇校正的双尾t检验。
¶ 2.4. 基于CAT分析的离体培养体系中全网络时空信号传导特性
在神经元网络的背景下,活动模式是所涉及神经元之间复杂相互作用的结果,因此需要全面考虑这些神经元放电的时间和空间动态,即时空模态。通过将神经活动向量求和纳入活动中心(CA),可以分析短时间内群体活动的流动[20]。若神经活动更均匀,CA将更靠近实验场域中心,因为个体向量是从场域中心计算的。因此,对CA进行连续追踪能够提供有关神经爆发的时空轨迹的重要信息,如一致性、速度和分散性等[21]。在对照组中,随着培养时间增长,网络爆发次数从0逐渐增加至超过50次,而Aβ42培养组则相对稳定在20至30次之间(图3E)。CATs的总密度也受到网络爆发次数差异的影响(图4A)。对照组中,从第7天(DIV7)开始,轨迹终点的CA位置(黄色标记)向实验场域中心移动。可利用向量空间可视化每个CAT从起点到终点的移动路径(图S3)。然而在Aβ42培养组中,CAT 表现出迷失方向,而非汇聚到文化区的中心点。基于这一结果,对照组中的神经放电即使是在培养早期(DIV7)也呈现均质化,而Aβ42培养组中的放电在整个培养期间始终保持非均质性。Aβ42培养组之所以出现更短的CAT持续时间和更快的速度,可能是因为神经活动集中在CAT中心模式之外(图4B,C)。在此条件下CC值更高,因为神经信号被限制在局部区域,这解释了难以抵达远端神经元的原因(图2B)。
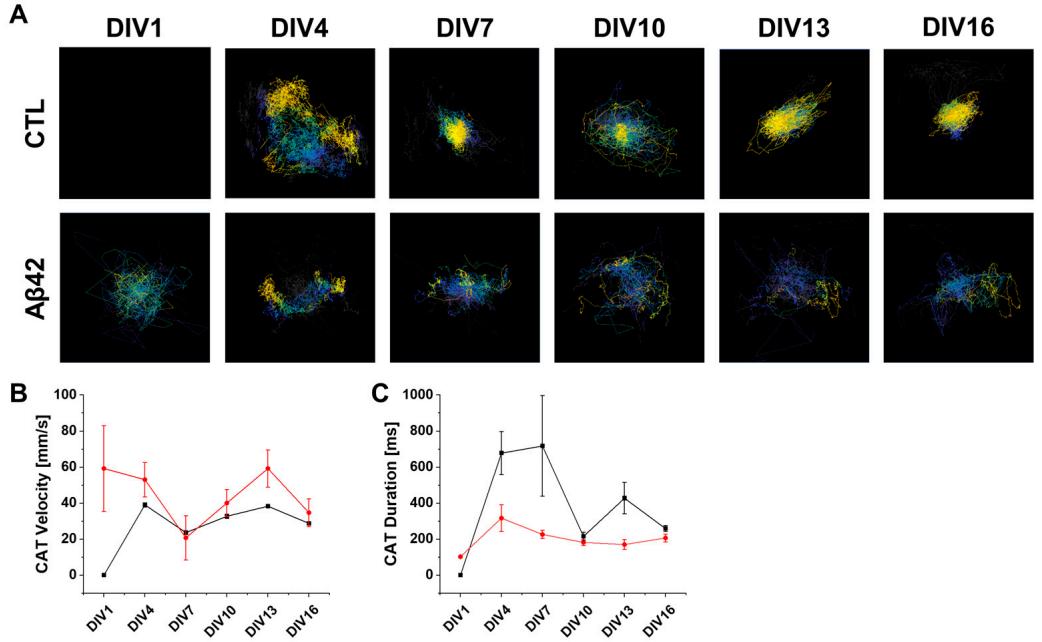
图4. 发育中神经元培养物的CAT分析。(A) 对照组(CTL)与Aβ42寡聚体处理组在培养第1、4、7、1 0、13和16天的CAT分析图像。色标尺代表从起始(灰色)到终止(黄色)的范围。(B) 对照组(黑色)与Aβ42寡聚体处理组(红色)的CAT速度折线图, 图,垂直线段表示变异范围,单位毫米/秒。(C) CAT持续时间变化折线图,垂直线段表示变异范围,单位毫秒。
¶ 3. 讨论
神经元天生会构建一个为神经通讯和抗扰动能力优化的神经网络。然而在AD患者大脑中,值得关注的是发现神经元异常激活和神经网络组织结构破坏[22]。先前使用MEA的研究已通过Aβ42寡聚体处理表征了神经网络功能障碍[23,24]。Hamid等人观察到,当将5µM的Aβ42寡聚体施加于60电极MEA上的神经元培养物时,峰值速率降低了60%[23]。另一项HD MEA研究表明,用0.1µM Aβ42寡聚体处理26小时后,DIV24海马神经元培养物的MFR降低约50%[24]。在1µM浓度下降低了近23.5%,而在10µM浓度下峰值活动完全消失。虽然从DIV1到16期间向神经元培养物施加10µM Aβ42寡聚体,我们仍能观察到峰电位,这可能是因为培养物取自相对早期的DIV1至16阶段。年轻神经元的活力以及皮质培养物中多种细胞类型可能延长了神经元在Aβ42寡聚体毒性下的存活时间。本研究进一步阐述了神经连接性与动态变化,特别是网络层面参数的变化。通过比较相同培养条件下的神经网络,可以观察到Aβ42寡聚体的直接病理效应。基于CC、PL和ND值的变化,我们分析了神经网络通信效率和优化能力的拓扑与定性特征。在正常神经元培养中,建立网络优化(即临界性)需要13天。虽然用Aβ42寡聚体培养的神经元定量网络规模远大于在对照组中,它们的网络转而指向异常。通常情况下,随着培养体系的成熟,爆发频率会增加而爆发持续时间会缩短,这表明从低频、长时程爆发模式向高频、短时程爆发模式的转变。在本研究中,我们在正常神经元培养体系中观察到了相同的模式。相反,在Aβ42处理的培养体系中未发现明显的爆发参数趋势,这暗示了网络内兴奋性和抑制性突触的失衡,或神经元内在特性的改变。CAT分析还揭示了网络结构内在本质的新发现。以往难以通过包含时空特征的单一参数来评估神经元爆发的网络整体同步性。通过CAT分析,在正常神经元发育的相对早期阶段观察到了更均匀的神经元爆发。Aβ42培养体系中CA的偏心定位表明阿尔茨海默症神经网络存在断裂特性,这解释了其他脑成像研究中出现的分散激活区域。 通过使用高清微电极阵列精细测量神经元连接性,我们得以识别神经元连接随时间的发展模式。研究采用图论和CAT分析方法,将神经网络效率与同步性作为界定临界态的代表性参数进行量化。在类似记录环境下,通过观察并比较tau蛋白等相关阿尔茨海默症因子或关键基因对神经网络的影响,未来研究可评估候选疗法的效力。这将帮助我们筛选更有效的候选药物,并确定更精确治疗阿尔茨海默症的干预时间窗。
4. 材料与方法
¶ 4.1. Aβ42寡聚体制备
对应人类Aβ42寡聚体的肽段(Anaspec公司,货号AS-64129-1,1毫克,美国加州弗里蒙特)溶于100微升DMSO中,室温涡旋30分钟,随后将该溶液加入900微升PBS中,于4℃条件下孵育24小时。
¶ 4.2. 原代神经元培养
解剖培养基神经基础培养基(NBM)包含45毫升神经基础培养基A、1毫升B27(50× )、0.5毫摩尔谷氨酰胺溶液、25µ微摩尔谷氨酸、5毫升马血清及500µ微升青霉素/链霉素。培养培养基由50毫升神经基础培养基A、1毫升B27、0.5毫摩尔谷氨酰胺溶液、500µ微升青霉素/链霉素及50µ微升HEPES组成。生物芯片腔室(3Brain,Arena,苏黎世,瑞士)经清洁后注入70%乙醇20-30分钟,用无菌DDW冲洗3-4次,并在洁净工作台内与NBM共同干燥过夜。次日,将溶解于硼酸盐缓冲液的30-90µ微升过滤PDLO添加至生物芯片活性表面,并置于培养箱中过夜。细胞接种前用无菌DDW冲洗生物芯片3次。原代皮层与海马神经元培养取自出生0天幼鼠。用灭菌剪刀断头取出全脑,将取出的脑组织置于含0.003克/毫升木瓜蛋白酶溶液的4◦℃冷神经基础培养基中,于35毫米培养皿内冷却。在4◦℃条件下使用相同培养基于第二培养皿中,在显微镜(倒置显微镜,尼康,日本)下剥离周围脑膜及多余白质。将皮层与海马部分从脑组织分离,用NBM和木瓜蛋白酶溶液清洗后切碎。将碎组织转移至15毫升离心管,于37◦℃水浴中孵育30分钟,期间每5分钟轻柔颠倒混匀。用HBSS清洗组织两次,沉降后将皮层与海马组织转移至预热的NBM,使用火焰抛光的巴斯德吸管吹打20-30次。细胞计数后,将30-90µ微升细胞滴(含~1000-1500细胞/µ微升)接种于生物芯片(在37◦℃ 5% CO2条件下培养)。为比较对照组与Aβ42处理组神经元网络活性随时间的变化,两组将相同数量的原代皮层神经元制备在64×64高清微电极阵列芯片上,在相同的培养条件和测量周期下持续培养至体外培养第16天。每3天更换一次全新培养液。
¶ 4.3. 基于HD MEA的神经元锋电位记录与数据分析
采用CMOS生物芯片(BiocamX;3Brain GmbH,瑞士苏黎世)的4096电极高清微电极阵列以10 KHz采样率进行记录。该阵列中植入的活性电极为21µm×21µm尺寸,电极间距为42µm,以64×64网格(2.67×2.67 mm2)排列并居中置于6×6 mm2工作区域。在培养期间的相同时点,对每种培养样本进行5分钟自发性神经元锋电位记录。所有记录均通过Brainwav e软件(3Brain GmbH,瑞士苏黎世)采集分析。该软件中的CAT分析采用Gandolfo等人[21]提出的算法。
¶ 5. 结论
该研究通过高清微电极阵列技术,证实了Aβ42寡聚体会引发神经元异常激活并破坏神经网络结构。经Aβ42处理的神经元培养体系随时间推移呈现出基础拓扑特性的显著退化,包括放电频率与放电时程。基于图论的网络分析同样显示,随着聚类系数、路径长度和节点度等网络参数的改变,神经网络会出现功能紊乱。此外,交叉相关分析揭示了神经元间通信失同步及网络爆发活动不均一的现象。本研究为理解阿尔茨海默病进展中神经网络演变机制提供了新的见解。
补充材料:以下补充信息可在 https://www.mdpi.com/article/10.3390/ijms24076641/s1 下载。
作者贡献:概念化,S.S.K.;方法论,D.G.与J.K.J.;软件,D.G.与J.K.J.;验证,D.G.与J.K.J.;形式分析,S.S.K.;调研,D.G.与J.K.J.;资源,S.S.K.;数据管理,S.S.K.;初稿撰写,S.S.K.;审阅与编辑,S.S.K.;可视化,S.S.K.;监督,S.S.K.;项目管理,S.S.K.;资金获取,S.S.K.与Y.L.。所有作者均已阅读并同意稿件最终版本。
经费来源:本研究由韩国保健产业振兴院(KHIDI)主管的韩国保健医疗技术研发计划(项目编号: HI17C1711)以及韩国国家研究基金会(NRF)韩国政府(MSIP)资助项目(NRF-2018R1D1A1B07 046762)提供支持。
机构审查委员会声明:该动物研究方案已获得汉阳大学动物护理与使用委员会批准(批准文号2019-0 192A,批准日期2019年12月3日)。
知情同意声明:因本研究未涉及人类,请予以移除。
数据可用性声明:所有数据可以通过MDPI的数据库共享。利益冲突:作者声明无利益冲突。
¶ 参考文献
1. Knopman, D.S.; Amieva, H.; Petersen, R.C.; Chételat, G.; Holtzman, D.M.; Hyman, B.T.; Nixon, R.A.; Jones, D.T. 阿尔茨海默病。Nat. Rev. Dis. Primers 2021, 7, 33. [CrossRef] [PubMed]
2. Cleary, J.P.; Walsh, D.M.; Hofmeister, J.J.; Shankar, G.M.; Kuskowski, M.A.; Selkoe, D.J.; Ashe, K.H. 淀粉样蛋白天然寡聚体特异性破坏认知功能。Nat. Neurosci. 2005, 8, 79–84. [CrossRef] [PubMed]
3. Zott, B.; Busche, M.A.; Sperling, R.A.; Konnerth, A. 阿尔茨海默病中小鼠与人类的神经环路变化?Annu. Rev. Neurosci. 2018, 41, 277–297. [CrossRef]
4. Allen,G.; Barnard, H.; McColl, R.; Hester, A.L.; Fields, J.A.; Weiner, M.F.; Ringe, W.K.; Lipton, A.M.; Brooker, M.; McDonald, E.; et al. 阿尔茨海默病中海马功能连接性降低。Arch. Neurol. 2007, 64, 1482–1487. [CrossRef] [PubMed]
5. Dickerson, B.C.; Salat, D.H.; Greve, D.N.; Chua, E.F.; Rand-Giovannetti, E.; Rentz, D.M.; Bertram, L.; Mullin, K.; Tanzi, R.E.; Blacker, D.; et al. 轻度认知障碍患者海马激活增强:与正常衰老及阿尔茨海默病的对比研究。Neurology 2005, 65, 404–411. [CrossRef]
6. Walsh, D.M.; Klyubin, I.; Fadeeva, J.V.; Cullen, W.K.; Anwyl, R.; Wolfe, M.S.; Rowan, M.J.; Selkoe, D.J. 天然分泌的β淀粉样蛋白寡聚体在体内有效抑制海马长时程增强。Nature 2002, 416, 535–539. [CrossRef] [PubMed]
7. Fernandez-Perez, E.J.; Munoz, B.; Bascunan, D.A.; Peters, C.; Riffo-Lepe, N.O.; Espinoza, M.P.; Morgan, P.J.; Filippi, C.; Bourboulou, R.; Sengupta, U.; et al. 细胞内β淀粉样蛋白寡聚体诱导的突触失调与过度兴奋。Aging Cell 2021, 20, e13455. [CrossRef]
8. Wu, J.W.; Hussaini, S.A.; Bastille, I.M.; Rodriguez, G.A.; Mrejeru, A.; Rilett,K.; Sanders, D.W.; Cook, C.; Fu, H.; Boonen, R.A.; et al. 神经元活动促进体内tau蛋白传播与tau病理形成。Nat. Neurosci. 2016, 19, 1085–1092. [CrossRef]
9. Palop, J.J.; Mucke, L. 阿尔茨海默病中β淀粉样蛋白诱导的神经元功能障碍:从突触到神经网络。Nat. Neurosci. 2010, 13,812–818. [CrossRef]
10. Yang, L.; Wang, Z.; Wang, B.; Justice, N.J.; Zheng, H. 淀粉样前体蛋白通过调控Cav1.2 L型钙通道水平影响GABA能短时程可塑性。J. Neurosci. 2009, 29, 15660–15668. [CrossRef]
11. Ulrich, D. β淀粉样蛋白通过GABA(A)受体内吞损害突触抑制功能。J. Neurosci. 2015, 35, 9205–9210. [CrossRef] [PubMed]
12. Kazim, S.F.; Seo, J.H.; Bianchi, R.; Larson, C.S.; Sharma, A.; Wong, R.K.S.; Gorbachev, K.Y.; Pereira, A.C. 阿尔茨海默病中的神经元网络兴奋性:β淀粉样蛋白与Tau蛋白作用相似性与差异性的谜题。eNeuro 2021, 8, ENEURO.0418-20.2020. [CrossRef] [PubMed]
13. Marom, S.; Shahaf, G. 大规模随机皮层神经元网络中的发育、学习与记忆:超越解剖结构的启示。Q. Rev. Biophys. 2002, 35, 63–87. [CrossRef] [PubMed]
14. Munoz-Moreno, E.; Tudela, R.; Lopez-Gil, X.; Soria, G. 转基因大鼠模型阿尔茨海默病进展过程中的脑连接及其认知影响。Netw. Neurosci. 2020, 4, 397–4
15. [CrossRef] 15. Watts, D.J.; Strogatz, S.H. “小世界”网络的集体动力学。Nature 1998, 393, 440–442. [CrossRef] [PubMed]
16. Chun, Y.S.; Kim, M.Y.; Lee, S.Y.; Kim, M.J.; Hong, T.J.; Jeon, J.K.; Ganbat, D.; Kim, H.T.; Kim, S.S.; Kam, T.I.; et al. MEK1/2抑制剂通过TFEB介导的自噬溶酶体功能激活挽救阿尔茨海默病模型中的神经退行性变。Mol. Psychiatry 2022, 27, 4770–4780. [CrossRef] [PubMed]
17. Styr, B.; Slutsky, I. 放电稳态与突触可塑性之间的失衡驱动早期阿尔茨海默病。Nat. Neurosci. 2018, 21, 463–473. [CrossRef]
18. Vico Varela, E.; Etter, G.; Williams, S. 阿尔茨海默病中的兴奋-抑制失衡及其治疗意义。Neurobiol. Dis. 2019, 127, 605–615. [CrossRef]
19. Hesse, J.; Gross, T. 自组织临界性作为神经系统的基本特性。Front. Syst. Neurosci. 2014, 8, 166. [CrossRef]
20. Chao, Z.C.; Bakkum, D.J.; Wagenaar, D.A.; Potter, S.M. 随机外部背景刺激对强直后网络突触稳定性的影响:模型研究。Neuroinformatics 2005, 3, 263–280. [CrossRef]
21. Gandolfo, M.; Maccione, A.; Tedesco, M.; Martinoia, S.; Berdondini, L. 利用高密度CMOS-MEAs追踪海马神经培养中的爆发模式。J. Neural Eng. 2010, 7, 056001. [CrossRef] [PubMed]
22. Watanabe, H.; Bagarinao, E.; Maesawa, S.; Hara, K.; Kawabata, K.; Ogura, A.; Ohdake, R.; Shima, S.; Mizutani, Y.; Ueda, A.; et al. 正常衰老与早期痴呆中神经网络变化的特征。Front. Aging Neurosci. 2021, 13, 747359. [CrossRef] [PubMed]
23. Charkhkar, H.; Meyyappan, S.; Matveeva, E.; Moll, J.R.; McHail, D.G.; Peixoto, N.; Cliff, R.O.; Pancrazio, J.J. β淀粉样蛋白对体外神经元网络活动的调控作用。Brain Res. 2015, 1629, 1–9. [CrossRef] [PubMed]
24. Amin, H.; Nieus, T.; Lonardoni, D.; Maccione, A.; Berdondini, L. 基于CMOS-MEAs的高分辨率生物电成像技术研究Aβ诱导的网络功能障碍及神经毒性救援。Sci. Rep. 2017, 7, 2460. [CrossRef]