¶ 使用3D高密度微电极阵列增强急性脑切片、球状体和类器官的电生理记录
出版日期:2025年9月4日
https://doi.org/10.1371/journal.pone.0328903
¶ 作者
丽莎·马佩利 (Lisa Mapelli)、达尼拉·迪·多梅尼科 (Danila Di Domenico)、贾科莫·夏卡 (Giacomo Sciacca)、弗朗切斯科·马伊纳尔迪 (Francesco Mainardi)、亚历山德拉·奥塔维亚尼 (Alessandra Ottaviani)、安妮塔·蒙特韦尔迪 (Anita Monteverdi)、玛丽亚特雷莎·特德斯科 (Mariateresa Tedesco)、基娅拉·罗莎·巴塔利亚 (Chiara Rosa Battaglia)、西莫娜·特里托 (Simona Tritto)、毛罗·甘多尔福 (Mauro Gandolfo)、基利安·伊姆费尔德 (Kilian Imfeld)、斯特凡妮·基德伦 (Stefanie Kiderlen)、卢卡斯·克雷纳 (Lukas Krainer)、基娅拉·切尔韦托 (Chiara Cervetto)、曼努埃拉·马尔科利 (Manuela Marcoli)、安森·辛 (Anson Sing)、希梅娜·安德森 (Jimena Andersen)、菲克里·比雷 (Fikri Birey)、史蒂文·A·斯隆 (Steven A. Sloan)、亚历山德罗·马乔内 (Alessandro Maccione)、埃吉迪奥·丹杰洛 (Egidio D'Angelo)
作者详细信息看此链接:https://journals.plos.org/plosone/article/authors?id=10.1371/journal.pone.0328903
¶ 摘要
体外和离体3D(3D)生物脑模型的最新进展为理解神经网络的复杂性提供了新机遇,但也带来了技术挑战:如何在高时空分辨率下实现对3D样本多点电活动的高通量记录。传统的平面多电极阵列(MEA)仅能接触神经结构的单侧,无法实现这一目标。此外,样本在平面MEA上的粘附会限制液体灌注,从而影响组织活性和药物施加效果。本研究通过高级3D高密度(HD)-MEA技术,在获取自不同脑区的急性脑切片、球状体和类器官中评估了组织-传感器界面的效能。3D HD-MEA的微针可抵达样本内层而不破坏网络完整性,微针间的微通道网络还提升了组织活性及化合物扩散效率。在急性皮质-海马切片和小脑切片中,3D HD-MEA在信号记录和刺激效率上均证明优于平面MEA,提升了对网络活动表征及功能连接性分析的准确性。该技术还成功解决了对脑球状体、皮质类器官和脊髓类器官进行电信号记录的难题。我们的结果表明,3D HD-MEA技术是解析脑微环路活动复杂时空组织的重要工具,为研究3D生物模型提供了关键技术支撑。
¶ 图示
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| 引用文献:Mapelli L, Di Domenico D, Sciacca G, Mainardi F, Ottaviani A, Monteverdi A, 等. (2025) 使用3D高密度微电极阵列增强急性脑切片、球状体和类器官的电生理记录。PLoS One 20(9): e0328903. https://doi.org/10.1371/journal.pone.0328903 |
| 责任编辑:Gerrit Hilgen(英国北umbria大学) |
| 收稿日期:2025年2月17日;接受日期:2025年7月9日;出版日期:2025年9月4日 |
| 版权声明:© 2025 Mapelli 等. 这是一篇根据知识共享署名许可协议条款发布的开放获取文章,允许在任何媒介上不受限制地使用、分发和复制,但须注明原作者及来源。 |
| 数据可用性:所有数据文件可通过以下链接获取:https://doi.org/10.5281/zenodo.16028942 |
|
资助声明:作者感谢以下资金支持:#NEXTGENERATIONEU(NGEU)与意大利大学与研究部(MUR)通过国家复苏与韧性计划(NRRP)资助的MNESYS项目(PE0000006)——"健康与疾病状态下神经系统的多尺度集成研究方法"(授权号:DN. 1553 11.10.2022)致ED; 欧盟"地平线2020"研究与创新计划下的NEUCHIP项目(授权协议编号:964877)致AMa; 欧盟下一代EU——国家复苏与韧性计划(NRRP)——使命4组件2投资1.1,PRIN 2022 PNRR呼叫(项目编号:CUP F53D23010320001,MUR代码:P2022YMM29)致LM; 3Brain AG为本研究提供员工薪资支持(MT, GS, CRB, MG, KI, AM)。资助方未参与研究设计、数据收集、分析、发表决策及文稿制备。 |
| 利益冲突声明:作者已阅读本刊政策并声明以下利益冲突:MT、GS、CRB为3Brain AG受薪员工;MG、KI和AM是3Brain AG股东;2D HD-MEA芯片和3D HD-MEA芯片是3Brain AG商业化产品。这不改变我们遵守PLOS ONE数据与材料共享政策的承诺。 |
¶ 引言
当前,多种源自人类和动物的3D模型(如组织切片、球状体、类器官及多细胞3D培养体系)能够以比传统2D培养模型更高的精确度和相关性重现大脑结构与功能的关键特征[1]。然而,这些3D系统日益增长的复杂性也带来了新的方法论挑战。从生理学角度来看,核心问题在于如何以足够的时空分辨率探测这些结构内部相互关联的层次,从而在最小化生物系统扰动的条件下准确描述其复杂的网络活动[3]。
多电极阵列(MEA)技术是目前最具前景的解决方案之一。这种细胞-电子生物界面被广泛用于体外和离体条件下对脑活动进行无创、无标记的多位点细胞外记录。除了应用于原代或诱导多能干细胞(iPSC)来源的2D培养体系[4-7],该技术还被用于结构化3D模型(如急性脑切片和外植组织[8-14])以及球状体和类器官等3D培养模型[15-17]。然而,将该技术应用于3D模型时仍存在若干关键局限性。
首要问题在于目前大多数商用和定制MEA均为平面构型,导致记录信号主要来源于样本最外层,难以有效捕捉3D结构内部细胞的活动信号。这一局限在急性脑切片中尤为突出——因切片操作产生的死细胞层会阻碍信号采集[18];在类器官中也同样存在——支架基质(如Matrigel)对组织的包裹可能形成绝缘层[19]。为解决这一核心问题,MEA领域已开发出多种穿透性电极技术以获取3D模型内部信号。早在90年代初,Hoogerwerf等人[20]就首次尝试制造3D电极,随后数十年间陆续出现类似技术方案[21-30]。另一些创新方案包括采用环绕3D样本表面的柔性电极[19],或在样本生长过程中可整合入3D结构的可拉伸网状电极[31]。
3D模型活动记录面临的第二项挑战是需要在大范围区域内进行多点记录,以精确捕捉3D组织复杂而精细的活动特征[32,33]。采用基于微芯片的高密度MEA(HD-MEA)提供了部分解决方案:该技术通过集成数千个具有细胞或亚细胞级空间分辨率的电极,能够生成功能活动的详细时空图谱[2,34-36]。Wang等人[37]最近提出将HD-MEA与3D电极技术相结合的新方法,目前该技术已在视网膜应用领域完成优化与验证[38]。
第三项挑战在于应对3D模型的高细胞密度和空间排列特性,这要求有效的营养物质扩散、适当氧合及快速代谢废物清除,以避免组织核心区域快速坏死[39]。传统或高密度MEA设备需要细胞-电极紧密接触才能获取信号,这意味着组织必须良好粘附于电极表面,从而严重限制了记录层的溶液交换。这通常导致电活动快速衰减和生理状态恶化。为解决该特定问题,领域内已开发出专项解决方案,如Killian等人[40]提出的定制化设计及多孔MEA技术[41]。
2023年,新一代先进3D HD-MEA技术的问世为应对3D组织接口的复杂挑战提供了全新解决方案。基于已获多种生物模型验证的微芯片MEA技术[42-46],该3D HD-MEA系统集成了数千个具有基座的双向(记录与刺激)微针(μneedles)。当与组织接触时,这些微针基座会形成微通道,避免组织与芯片基底完全贴合,从而在64×64微针电极网格中集成了微流体系统,实现氧气、营养物质和化学物质在组织底层的有效扩散。此项技术首次实现了穿透能力、高时空分辨率记录、靶向细胞刺激以及增强组织活性的多维整合。
本文利用这种新型3D HD-MEA技术,对包括急性脑切片、球状体和类器官在内的3D生物样本进行了电生理记录——这些样本在平面芯片上通常难以有效处理[47,48]。我们首先验证了微针穿透组织的性能以及微通道提升组织活性的有效性,进而评估了3D HD-MEA在检测自发活动、化学调制活动及诱发神经响应方面的效能。总体而言,3D HD-MEA技术展现出在3D模型中研究神经环路生理特性的巨大潜力。
¶ 材料与方法
¶ 急性小脑及脑切片制备
¶ 动物伦理与批准声明
动物饲养与实验操作遵循欧盟指令2010/63/EU关于动物伦理使用的国际准则,并经意大利帕维亚大学地方伦理委员会及意大利卫生部批准(根据D.Lgs. n. 26/2014第1条第4款授权,2017年12月9日批准;授权编号:1019/2023-PR)。
¶ 实验动物
物种与品系: C57BL6小鼠
日龄: 20-26日龄
性别: 性别不限
¶ 切片制备流程
参照既往报道的标准流程[8,49,50]获取急性脑切片。
麻醉与安乐死:
使用氟烷(Sigma-Aldrich)对小鼠实施深度麻醉,直至其爪部和胡须反射完全消失。
通过断头法实施安乐死。
切片制备:
小脑切片: 使用振动切片机(Leica VT1200S, Leica Microsystems)切割小脑蚓部,制备220 µm厚的矢状旁切片。
海马切片: 使用振动切片机(Leica VT1200S)制备包含海马的320 µm厚的冠状切片。
前额叶皮层切片: 部分实验中制备包含前额叶皮层的300 µm厚切片。
切片保存与恢复:
全过程切片均置于冰镇Krebs溶液中保存。
随后将切片转移至室温Krebs溶液中恢复至少1小时。
¶ 溶液配制
¶ 1. 标准Krebs溶液
用途: 切片保存、恢复及大部分电生理记录。
成分(mM):
120 NaCl
2 KCl
1.2 MgSO₄
26 NaHCO₃
1.2 KH₂PO₄
2 CaCl₂
11 Glucose
处理: 经95% O₂ - 5% CO₂混合气饱和(pH 7.4)。
灌注速率: 记录期间使用蠕动泵(Ismatec)以 2 ml/min 速率持续灌注。
¶ 2. 改良人工脑脊液(mACSF)
用途: 特定前额叶皮层切片实验。
成分(mM):
124 NaCl
3.5 KCl
1 MgCl₂
1.25 NaHPO₄
1.2 CaCl₂
26 NaHCO₃
10 Glucose
处理: 经95% O₂ - 5% CO₂混合气饱和(pH 7.4)[51]。
¶ 3. 高兴奋性Krebs溶液
用途: 针对皮质-海马切片实验,为增强组织兴奋性。
改良方式:
将 [K⁺] 升至 8 mM
将 [Ca²⁺] 升至 4 mM
去除 [Mg²⁺]
¶ 实验用药与处理
河豚毒素(TTX):
浓度: 3 µM
供应商: Tocris
用途: 在特定实验条件下添加至标准Krebs溶液中,以阻断动作电位。
SR95531(加巴嗪):
浓度: 10 µM
供应商: Abcam
用途: 仅在特定前额叶皮层切片实验中,作为选择性GABA-A受体阻断剂添加至mACSF中。
¶ 脑球状体制备
¶ 动物伦理与批准声明
实验操作与动物护理遵循欧洲议会与理事会2010年9月22日指令(2010/63/EU)及意大利第26号立法令(2014年),并获得意大利卫生部批准(协议编号:75F11.N.6JI,批准日期:2018年8月8日)。我们已尽一切努力最大限度地减少实验动物使用数量并减轻其痛苦。
¶ 实验动物与饲养条件
物种与品系: 斯普拉格·道利大鼠(Sprague Dawley rats)
体重: 200-250克
饲养环境:
地点: 热那亚大学药理学系动物设施
温度: 22 ± 1℃(恒温)
湿度: 50%(恒湿)
光照: 明暗循环照明(7:00-19:00为光照期)
饮食: 自由获取标准颗粒饲料与饮水
¶ 神经球制备流程
根据既往标准流程[52-54]从原代胚胎神经元培养物制备脑球状体(神经球)。简要步骤如下:
安乐死与组织获取:
对大鼠实施深度麻醉,直至其爪部和胡须反射完全消失。
通过断头法实施安乐死。
取胚胎期18-19天(E18-19)的大鼠胚胎皮质组织。
组织消化与解离:
将皮质组织置于无钙镁的HBSS液中。
加入含 0.125%胰蛋白酶 和 50 µg/ml DNAse 的溶液。
在37℃下消化18-20分钟。
通过添加含 10% FBS 的培养基(成分:Neurobasal + B27 + 1% Glutamax-100 + 10 µg/ml庆大霉素)来终止胰蛋白酶消化作用。
去除含血清的培养基后,用无血清的新鲜培养基洗涤组织两次。
细胞悬液制备与接种:
使用细口巴斯德吸管对组织进行机械吹打,以制备单细胞悬液。
使用血球计数板进行细胞计数。
将细胞悬液调整至目标浓度后,直接接种于超低吸附的96孔板(Biofloat)中,以促进球状体形成。
典型接种量: 每孔12,000-13,000个细胞,可培养获得直径约500微米的球状体。
¶ 细胞培养方案
初始接种培养基:
Neurobasal + B27 + 1% Glutamax-100 (ThermoFisher-Gibco) + 10 µg/ml庆大霉素。
培养与维持:
培养环境: 37℃, 5% CO₂, 95%湿度。
培养周期: 18-25天。
观察: 接种48小时后即可在显微镜下观察到球状体结构形成。
换液流程:
第3天: 更换50%体积的培养基(以清除细胞碎片)。
第5天: 将80%的培养基更换为 分化培养基(成分:BrainPhys + SM1 + 1% Glutamax-100 (StemCells Technologies) + 50 μg/ml庆大霉素)。
后续: 每2-3天更换50%的培养基。
¶ 电生理记录
方法: 将单个成熟的球状体直接转移至3D高密度微电极阵列(HD-MEA)芯片上。
类型: 进行电生理活性的急性评估。
¶ 皮质与脊髓类器官制备
¶ 细胞来源与伦理声明
细胞类型: 人诱导多能干细胞(hiPSCs)
来源: 一名健康个体
培养依据: 参照既往报道方法[55,56](注:根据学术惯例,使用人源细胞通常需声明伦理批准,虽原文未提供,但建议在正式论文中补充)
¶ hiPSCs培养与类器官聚合流程
细胞准备:
将hiPSCs从6孔板转移至100 mm培养皿中培养,直至80-90%融合度。
消化:
每100 mm培养皿中加入5 ml Accutase(VWR, #10761-312)。
置于37℃、5% CO₂培养箱中消化10分钟。
重悬:
将细胞转移至50 ml锥形管中离心。
离心后细胞重悬于 Essential 8培养基(E8)(ThermoFisher, #A1517001)中,并添加 10 μM Rock抑制剂(RI)(Tocris, #1254)。
接种与聚合:
进行细胞计数,并将细胞浓度调整至 300万细胞/ml。
取1 ml细胞悬液,加入 Aggrewell 800板(24孔,Stemcell, #34811)的每个孔中。
预处理: 每孔已预先装有1 ml含10 μM RI的E8培养基,且板子已用 500 μl 抗黏附冲洗液(AARS)(Stemcell, #07010)处理过。
最终体系: 每孔总体积为2 ml。
离心: 以200 ×g离心5分钟,使细胞均匀分布于微孔中。
培养: 置于37℃、5% CO₂培养箱中聚合 24小时。
转移:
聚合24小时后,将形成的类器官转移至 10 cm 超低吸附培养板 中继续进行分化培养。
¶ 类器官分化方案
¶ 一、皮质类器官分化培养基与流程
基础培养基: Essential 6(E6)(ThermoFisher, #A1516401)
诱导添加剂: 2.5 μM Dorsomorphin (DM, Sigma #P5499-25MG) + 10 μM SB-431542 (SB, Selleck Chemicals #S1067) + 10 μM RI
| 分化阶段 | 培养基配方 | 换液频率 |
|---|---|---|
| 第 1 - 5 天 | E6 + 2.5 μM DM + 10 μM SB | 每日更换 |
| 第 6 - 25 天 | NeuroBasal-A (NB-A, ThermoFisher #12349015) + 20 ng/ml FGF2 (R&D #233-FB) + 20 ng/ml EGF (R&D #236-EG) | 每日更换至第16天,之后每2天更换 |
| 第 26 - 44 天 | NB-A + 20 ng/ml BDNF (PeproTech #450-02) + 20 ng/ml NT3 (R&D #267-N3-005/CF) | 每2天更换直至第43天 |
| 第 44 天以后 | 仅使用 NB-A 基础培养基 | 每3-4天更换 |
¶ 二、脊髓类器官分化培养基与流程
基础培养基: Essential 6(E6) 与 NeuroBasal-A (NB-A),其中NB-A(+)指添加了1% N-2、1% Glutamax和1% Pen-Strep的NB-A培养基。
诱导添加剂: 如下表所示。
| 分化阶段 | 培养基配方 | 换液频率 |
|---|---|---|
| 第 1 - 2 天 | E6 + 2.5 µM DM + 10 μM SB-431542 | 每日更换 |
| 第 3 - 4 天 | E6 + 2.5 µM DM + 10 μM SB + 3 μM CHIR (Selleck #S1263) | 每日更换 |
| 第 5 - 9 天 | NB-A(+) + 10 ng/ml FGF2 + 20 ng/ml EGF + 0.1 µM RA (Sigma #R2625) + 3 μM CHIR | 每日更换至第6天,之后每2天更换 |
| 第 10 - 17 天 | NB-A(+) + 10 ng/ml FGF2 + 20 ng/ml EGF + 0.1 µM RA + 3 μM CHIR + 0.1 μM SAG (Sigma Millipore #566660) | 每2天更换 |
| 第 18 - 23 天 | NB-A(+) + 1x N-2 (ThermoFisher #17502048) + 20 ng/ml BDNF + 50 nM cAMP (Sigma #D0627) + 200 nM LAA (Fisher #50-990-141) + 10 ng/ml IGF (PeproTech #100-11) | 每2天更换 |
| 第 24 天 起 | NB-A(+) + 1x N-2 + 20 ng/ml BDNF + 50 nM cAMP + 200 nM LAA + 10 ng/ml IGF | 每2天更换直至第43天,之后每3-4天更换 |
注: 所有培养均在37℃、5% CO₂、95%湿度的标准培养箱中进行。
¶ 荧光活性分析
¶ 一、染色与固定
染料负载:
染料: 钙黄绿素AM(calcein乙酰甲酯,ThermoFisher Scientific)
浓度: 20 µM
溶液: 溶于Krebs溶液中
条件: 将小脑切片置于上述染料溶液中,孵育 40分钟。
冲洗:负载完成后,使用 正常Krebs溶液 对切片进行冲洗,共 三次。
固定:
固定液: 4% PAF(多聚甲醛)的PBS溶液。
条件:
方案一: 于 室温 固定 至少2小时。
方案二: 于 4℃ 固定 过夜。
洗涤:固定后,使用 PBS溶液 洗涤切片,每次5分钟,共 三次。
封片:使用 含DAPI的氟屏蔽封片介质(Abcam,英国)对切片进行封片,以备成像。
¶ 二、图像采集
样品制备: 为同时清晰观察分析两侧结构,将 220 µm 厚的切片夹在两片盖玻片之间。
成像系统:
设备: TCS SP5 II LEICA系统(Leica Microsystem)
显微镜: 配备倒置显微镜 LEICA DM IRBE
地点: 帕维亚大学PASS-BioMed设施
分析软件: ImageJ软件[57]
¶ 三、数据分析与统计
计算指标: 颗粒细胞存活率
计算方法:
存活率 = (钙黄绿素AM阳性细胞数) / (DAPI阳性颗粒细胞总数) × 100%
分子: 钙黄绿素AM负载的活细胞数。
分母: 仅DAPI染色的颗粒细胞数(代表所有存活与非存活的细胞总数)。
统计方案:
对 每个样本 分析 20个随机视野。
对 每个视野 至少选取 三个不同的焦平面 进行成像并计数,以避免重复计数并确保统计准确性。
¶ 电压敏感染料成像(VSDi)
实验在急性小脑切片上进行,方法参照既往报道[49,58,59]。
¶ 一、染料负载与切片准备
染料孵育:
染料: Di-4-ANEPPS (Invitrogen)
储备液: 3% Di-4-ANEPPS储备液与等体积胎牛血清(Invitrogen)混合。
工作浓度: 2 mM
溶液: 将上述工作液添加至充氧的Krebs溶液中。
条件: 将切片置于该染料溶液中,孵育 30分钟。
冲洗与转移:
孵育完成后,用正常的Krebs溶液冲洗切片。
将切片转移至 直立式落射荧光显微镜(Slicescope, Scientifica Ltd)的载物台上,准备记录。
¶ 二、光学成像系统配置
| 组件 | 规格与参数 |
|---|---|
| 显微镜 | 直立式落射荧光显微镜 (Slicescope, Scientifica Ltd) |
| 物镜 | 20倍水浸物镜 (XLUMPlanFl, NA 0.95; Olympus) |
| 激发滤光片 | λ = 535 ± 20 nm |
| 二向色镜 | λ = 565 nm |
| 吸收滤光片 | λ > 580 nm |
| 相机 | CCD相机 (MICAM01, SciMedia, Brain Vision) |
| 像素尺寸 | 4.5 × 4.5 µm |
| 控制单元 | 通过输入/输出接口(Brain Vision)与PC连接,控制照明、刺激及采集 |
¶ 三、刺激与数据采集参数
采样率: 0.5 kHz (由BrainVision软件控制)
刺激电极: 钨双极电极 (WPI),经刺激隔离器连接。
刺激靶点: 苔藓纤维束
刺激参数:
强度: 15 V
持续时间: 250 μs
频率: 0.1 Hz (单脉冲刺激)
信噪比优化: 每个最终的VSDi轨迹由 十次重复 的平均结果获得。
¶ 四、数据分析方法
数据分析参照既往方法[49],主要步骤如下:
预处理:
首先对原始荧光信号数据进行 3×3 立方和空间滤波 处理。
响应判定:
使用 Matlab (Mathworks) 专用程序分析刺激响应。
将荧光快速瞬变(∆F/F)的增强幅度超过 基线平均值的2.5个标准差 以上的反应,判定为有效响应。
活性区域量化:
通过上述方法获得颗粒层的刺激响应空间分布图。
计算公式: 激活区域比例 (%) = (刺激响应像素数 / 颗粒层总采样像素数) × 100
¶ 五、统计与数据呈现
统计检验: 非配对Student t检验
显著性水平: p < 0.05
数据呈现: 所有数据均以 均值 ± 标准误(SEM) 表示。
¶ 电子芯片性能表征
为评估芯片电路性能,我们计算了片上放大器的信噪比(SNR)。该指标定义为每个电极信号功率(Psignal)与噪声功率(Pnoise)的比值:
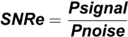
随后以中位值计算单个芯片的信噪比(SNRc)。本分析共使用N=5个平面芯片和N=5个3D高密度微电极阵列(3D HD-MEA)。注入信号为峰峰值幅度100 µV、频率1 kHz的正弦波。注入前使用示波器(Siglent SDS2104X Plus)验证信号特性。
需要特别说明的是,本评估在干态条件下进行,旨在单独比较平面与3DHD-MEA的固有电路性能。因此,结果并不反映芯片在实际工作(湿态)条件下从背景噪声中检测电压波动的真实能力(该能力更准确地体现于图3和图4)。这些测量结果实际表明:两种芯片的电路性能相当,而3DHD-MEA观察到的信号检测增强应归因于其电极结构设计,而非放大器性能差异。
 |
|
图1. 3D高密度微电极阵列芯片特性与组织穿透效果 |
 |
|
图2. 平面与3D高密度MEA上小脑切片的组织活性及网络保存情况 |
¶ 电生理记录
小脑及皮质-海马脑切片的电生理记录采用3Brain AG生产的平面和3D高密度微电极阵列(CorePlate 1W 38/60与CorePlate 1W-3D 38/60/90)完成。平面与微针3D HD-MEA均基于相同电子芯片设计,该芯片集成4096个电极,以60 µm间距排列成64×64网格(总记录区域3.8×3.8 mm²)。每个电极集成放大级和如文献[60]所述的多路复用架构,支持以20 kHz采样率同步记录全部4096个电极信号。与原始架构[60]不同,本系统通过开关电路将各电极路由至采集系统(3Brain AG BioCAM Duplex)内置的电流信号发生器,实现HD-MEA芯片的电刺激功能。平面电极为边长21 µm的正方形铂金涂层结构,而3D微针电极采用30 µm宽、15 µm高的金质基座。基座上制备两种微针规格:大尺寸(宽26 µm,高90 µm,图1A)与小尺寸(宽14 µm,高65 µm,图1B)。电极表面通过聚对二甲苯绝缘层包裹,仅在针尖保留电化学活性位点(图1C)。在"活性提升与功能网络保存"实验中采用了不同基座尺寸(44、36、30 µm)的芯片。
针对皮质-海马切片,应用10 Hz高通滤波器消除慢振荡,仅选取皮质区域中平均放电频率高于0.1 Hz的电极进行分析。小脑切片记录时采用50 Hz高通滤波器,仅分析平均放电频率超过0.5 Hz的电极信号。
为直接比较微针电极与平面电极的信号记录效率,每个切片均分别在平面和3D高密度微电极阵列上进行测量。实验共使用3只不同动物的6个小脑切片和4个皮质-海马切片。在平面高密度微电极阵列上,采用100微米宽铂金锚定丝固定切片,而3D阵列未使用固定装置。切片置于芯片5分钟后,记录3-5分钟的自发电活动。为验证5分钟是否足以使平面与3D芯片达成稳定耦合,我们测量了小脑切片放置后前25分钟内检测到峰电位活动的通道数量。使用Brainwave 5软件进行峰电位检测(硬阈值设定为-100微伏),仅分析峰电位频率高于10赫兹的通道。虽然平面芯片在最初几分钟显示活跃通道数略有增加(3.9±2.5%,N=5),但3D芯片同一参数呈轻微下降(8.1±2.9%,N=5;S1A图)。然而如S1B图所示(数据以5分钟时的活跃通道数为基准标准化),两种芯片从切片放置5分钟至25分钟期间活跃通道数均保持稳定(平面与3D未配对Student t检验p=0.38)。
小脑切片自发电活动的TTX调制实验记录流程:先在标准Krebs溶液中记录约4分钟活动,随后灌注含3微摩尔TTX的Krebs溶液。每个切片持续监测3分钟或直至电活动完全消失。对平面和3D高密度微电极阵列各测试了来自3只不同动物的10个切片。
在装载于3D高密度微电极阵列的部分小脑切片上,还通过选择小叶颗粒层中苔藓纤维对应位置的两个相邻电极施加双相电刺激。刺激参数设置为:第一相强度80微安、持续时间120微秒,间隔25微秒后施加第二相(强度-40微安、持续时间50微秒)。同一切片的不同小叶均接受测试。每个脉冲后放大器屏蔽500微秒以减小电刺激产生的伪迹。采用10微摩尔NBQX(AMPA受体选择性拮抗剂;Abcam)和3微摩尔TTX(Abcam)评估响应性质。
前额叶皮层切片处理采用100赫兹高通滤波器消除慢振荡,仅分析平均放电频率高于0.1赫兹的通道。
皮质脑球状体(n=6)的自发电活动在体外培养第19-20天(DIV 19–20)使用3D高密度微电极阵列测量。急性条件下记录数分钟基础活动:每个芯片移植三个球状体,使用大口径移液管将经等离子清洗器处理(使表面亲水化)的3D芯片上的球状体转移。未使用固定锚,球状体置于芯片后立即显示自发电位活动。测试两种不同尺寸的脑球状体(约400微米和600微米)。记录期间球状体维持于含5% CO2加湿气流且温度约35℃的培养介质中。
皮质类器官和脊髓类器官分别于体外培养第219天(DIV 219)和第131天(DIV 131)使用3D高密度微电极阵列检测。采用大口径塑料巴斯德移液管将类器官转移至芯片,并使用3D打印硅胶固定器将类器官定位于电极阵列中心以促进微针穿透。类器官放置后立即检测自发电活动,先进行2分钟基线记录,随后在培养基中添加1毫摩尔KCl并记录2分钟活动,最后将KCl浓度增至5毫摩尔再次记录2分钟电活动。整个记录过程中类器官维持于含5% CO2加湿气流且温度约37℃的培养介质中。
¶ 电生理记录:数据分析
采用3Brain AG的BrainWave软件(4.0及5.0版本)进行数据采集、可视化与存储。该软件支持将切片图像与电活动图谱叠加,实现记录信号与脑区结构的解剖学匹配(如图3A和3B所示)。小脑切片记录中的峰电位使用Multhmann等人2015年提出的算法[61]提取,皮质-海马切片则采用Maccione等人2009年描述的精确时序峰电位检测(PTSD)算法[62]。小脑切片检测到的事件按文献[63]方法进行分类,皮质-海马切片使用BrainWave 5软件的排序工具进行聚类分析:通过主成分分析提取峰电位波形特征,结合间隙统计量(Gap Statistics)的K均值聚类确定最优聚类数,每个电极最多可分类四个聚类(即四个细胞)。分析时仅考虑峰电位频率高于0.5 Hz(小脑切片)或0.1 Hz(皮质-海马切片)且位于目标脑区内的活跃单元。"急性切片峰电位检测能力提升"与"药物调控电活动加速效应"数据分析分别使用6个和20个小脑切片(来自3只动物)。所有数据集均经Shapiro-Wilk正态性检验确认符合高斯分布。"急性切片峰电位检测能力提升"数据分析采用非配对Student t检验进行组间比较;"药物调控电活动加速效应"数据分析使用双因素方差分析及Tukey多重比较事后检验。显著性水平设定为p<0.05,所有统计分析通过GraphPad Prism(9.0版,美国加州拉霍亚GraphPad软件公司)完成。
针对前额叶皮层切片(4只动物的7个切片),使用3Brain AG的BrainWave 5软件及定制Python脚本计算前边缘区不同单元间的活动相关性。相关性分析提供单元间直接连接总数(推定连接)[64,65],该数值除以选定单元总数得到各切片的标准化相关指数(CI)。通过NEUROPulse软件[66]分析各单元的放电参数(基础频率、变异系数CV和CV2)及对刺激的响应(局部场电位、栅格图和PSTH图)。相关性与基础活动数据均使用GraphPad Prism(9.0版)处理,除特别说明外均采用配对Student t检验进行统计分析,显著性水平设定为p<0.05。
脑球状体实验数据分析,峰电位检测采用上述PTSD算法,单个电极的峰电位排序则使用主成分分析(PCA)提取3个特征,并结合标准k均值聚类算法进行处理。若某单元的峰电位频率高于0.1 Hz且位于球状体覆盖的电极区域下方,则被判定为活跃单元。实验共检测来自同一制备样本的6个不同尺寸球状体。
皮质与脊髓类器官记录分析,所有记录均采用PTSD算法进行峰电位检测(方法同上)。将峰电位频率分别高于0.5 Hz(皮质类器官)和0.1 Hz(脊髓类器官)的单元判定为活跃单元;将至少包含5个连续峰电位且峰间隔≤100 ms的序列定义为簇发放电。在30 ms相关窗口内以3 ms为间隔进行分箱,计算活跃单元对之间的峰序列互相关性。互相关计算结果经标准化处理获得0-1之间的"相关值"[64,65]。统计分析涵盖记录各阶段所有活跃单元,而相关值统计分析则通过每阶段随机抽取100个数值进行。采用单因素方差分析(one-way ANOVA)与Tukey事后检验,显著性水平设定为p<0.05,所有统计分析通过GraphPad Prism(9.0版,美国加州拉霍亚GraphPad软件公司)完成。
¶ 双光子显微镜检测
将小脑切片与脑球状体置于0.2% Triton X-100(Acros Organics)中孵育20分钟,随后转移至含0.1% Triton X-100、200 nM鬼笔环肽-Atto488(Atto-tech)及2.5 µg/ml碘化丙啶(Sigma)的染色溶液孵育1小时。移除染色液后,用PBS溶液清洗3次。最后将样本用70%甘油封片于粘附在35 mm细胞培养皿(ibidi)腔体中央的3D高密度MEA芯片表面。采用直立式MPX多光子显微镜(Prospective Instruments)配合20倍奥林巴斯水浸物镜(数值孔径1.0,工作距离2.0 mm)进行体积扫描。同步记录三个通道分别捕获芯片的自发双光子荧光、肌动蛋白纤维及细胞核信号。3D体积扫描步进精度设置为2 µm,使用ImageJ软件(1.52v版本)进行三通道图像融合。
¶ 结果
¶ 3D微针结构与组织穿透性
图1扫描电子显微镜(SEM)图像清晰展示了3D高密度微电极阵列表面制备的密集微针结构。实验采用两种不同规格的微针:用于脑切片记录的微针(高90微米,宽26微米,图1A)和用于类器官记录的微针(高65微米,宽14微米,图1B)。如图1A,B箭头所示,微针底部基座形成微通道网格结构。图1C显示微针内部为金质主体,外层包裹聚对二甲苯薄绝缘层。3D微针的核心特性在于其组织穿透能力。为验证两种微针的穿透性能,我们将小脑切片或球状体固定于3D芯片上(详见方法部分),采用扫描电镜、微分干涉差显微镜(DIC)或双光子显微镜进行评估。通过聚焦离子束技术对小脑切片进行纵向切割,暴露内部层次结构。扫描电镜图像(图1D)显示微针可穿透组织厚度的三分之一,同时保持与芯片基底的接触。针对类器官等较小生物模型开发的更细微针(图1B)通过球状体测试其穿透性能。微分干涉差显微镜显示该微针可完全穿透组织(图1E),组织在包裹微针的同时保持球形结构,未出现明显碎片或细胞脱落迹象(完整图像栈见S1影片)。图1F同样展示类器官中微针穿透未引起明显损伤。通过双光子显微镜扫描进一步验证了小脑切片(图1G)和球状体(图1H)的组织穿透效果。
¶ 组织活性与功能网络保存
为验证3D高密度微电极阵列的微通道结构能否提升组织活性,我们针对三种不同微通道配置进行了活性和功能测试(详见材料与方法部分)。小脑切片是测试活性的理想模型,因为小脑皮层颗粒细胞的高密度特性[67,68]使其对缺氧更为敏感。将急性小脑切片置于不同微通道宽度的芯片上,通过改变与切片的直接接触面积来优化组织活性:减少直接接触面积可增强组织活性,因为微通道中循环的灌注溶液可获得更大交换表面积。为此设计三种实验条件:小微通道芯片(SMC,通道宽16微米,基座宽44微米,总接触面积7.9 mm²)、中微通道芯片(IMC,通道宽24微米,基座宽36微米,总接触面积5.3 mm²)和大微通道芯片(LMC,通道宽30微米,基座宽30微米,总接触面积3.6 mm²)。将这些芯片上的切片活性与平面芯片(2D)进行对比。
在持续灌注氧合Krebs溶液一小时后,将切片从芯片或盖玻片轻柔移除,并加载20 μM钙黄绿素AM(该化合物被活细胞酯酶水解后产生荧光[69])。通过共聚焦显微镜获取切片双侧图像并进行钙黄绿素染色定量(图2A)。结果显示:盖玻片组切片下表面(接触面)相对于上表面的活性比为38±4%,而LMC3D芯片组达到76±3%(图2A)。该差异与接触面积变化相符(3D芯片3.6 mm² vs 平面芯片15 mm²,图2B),证明微通道通过增强切片底层的氧合与营养扩散显著提升组织活性。
尽管活性提升,但数千个微针可能通过改变细胞功能或破坏局部连接干扰网络活动。为验证此问题,我们采用具有高空间分辨率的电压敏感染料成像(VSDi)追踪神经元膜电位去极化过程[49]。将小脑切片置于3D高密度微电极阵列上,通过VSDi检测苔藓纤维刺激响应。小脑颗粒层因细胞密度冠绝全脑,成为检测活动空间分布变化的理想模型。实验组切片置于芯片表面,对照组切片置于记录室底部(方法同[49])。两组对刺激产生响应的颗粒层面积百分比无显著差异(芯片组43.7±3.8% n=5 vs 对照组39.7±8.1% n=5;p=0.66,图2C,D),表明微针未引起颗粒层活动的显著改变。
¶ 急性切片峰电位检测能力提升
为评估微针电极在检测峰电位活动方面的增强性能,我们首先在干态测试条件下计算了平面与3D高密度微电极阵列的信噪比(S/N)以评估芯片电子性能。S2图显示两者无显著差异,证实放大性能与芯片类型无关,后续章节展示的传感能力提升应归因于电极表面制备的微针结构。
采用小脑和皮质-海马切片表征高密度微电极阵列上的自发电活动。先将切片置于平面芯片,随后转移至3D芯片(或反之),每种情况记录3分钟。如图3A放电频率图谱所示,3D芯片检测小脑浦肯野细胞层活动的性能显著提升:其记录的活动图谱能更精细地匹配小脑切片的解剖结构。定量分析显示,与平面芯片相比,3D芯片记录的小脑切片表现出显著更高的活性电极数量(提升80±19%,平面组390±49 vs 3D组790±62;n=6切片,p=0.0006)、分类细胞数量(提升102±23%,平面组371±45 vs 3D组668±39;n=6切片,p=0.0005)及细胞-电极比率(提升12±5%,平面组1.05±0.01 vs 3D组1.18±0.03;n=6切片,p=0.0126)(图3B)。经峰电位检测与分类分析,3D芯片上小脑切片的活跃单元平均放电频率(提升105±30%,平面组25±1.8 Hz vs 3D组51±5.4 Hz;p=0.0010)和峰峰值振幅(提升46±14%,平面组76±5 µV vs 3D组111±9 µV;p=0.0060)均显著优于平面芯片(图3C)。
类似地,皮质-海马切片的峰电位检测图谱显示3D芯片记录的活动更为清晰(图4A)。其皮质区活性电极数量显著高于平面芯片(提升92±85%,平面组56±17 vs 3D组154±25;n=3切片,p=0.0384)(图4C)。虽未达统计学显著性,但3D芯片的细胞数量(图4B,C)与检测到的峰电位数量(图4C)均高于平面芯片。特别值得注意的是,3D芯片检测到的峰电位峰峰值振幅显著更大(提升105%±30%,平面组166±7 µV vs 3D组257±30 µV;n=3切片,p=0.0221)(图4C)。考虑到皮质活动具有"随机"且稀疏的放电特征,微针可能穿透至神经元保存更完好的内层,从而增加可检测的活跃单元数量。综上所述,3D高密度微电极阵列的微针结构显著提升了电极在测试脑区中的记录性能。
¶ 药物调控电活动的加速效应
微针基座可防止组织接触3D高密度微电极阵列芯片底部,从而在组织下方形成微通道网格(图1G-H)。除提升组织活性外,流经组织底层的溶液交换效率也得到改善,既促进化合物扩散又缩短药物起效时间。为验证该特性,我们在灌注含3微摩尔河豚毒素(TTX)的Krebs溶液前后,分别记录小脑切片的自发电活动。如图5A所示,TTX灌注逐渐抑制了平面和3D芯片上切片的峰电位活动,但3D芯片上的切片在TTX给药后表现出更快的平均放电频率下降速率(在下降幅度达10%、50%和90%时均满足p<0.0001,n=10切片),其神经元活动完全抑制的时间早于平面芯片(图5B和5C,S2影片)。这些结果表明,3D高密度微电极阵列能显著加速活性化合物的作用效率。
 |
|
图3. 小脑切片中3D与平面高密度微电极阵列记录性能对比 |
 |
|
图4. 皮质-海马切片中3D与平面高密度微电极阵列记录性能对比 |
 |
| 图5. 3D与平面高密度微电极阵列的药物作用加速效应对比 通过向急性小脑切片施加TTX测试药物灌注效率。A) 3D芯片上切片在TTX施加前(上)与施加后(下)的活性电极分布电活动图谱示例(色标尺:0-300微伏)。B) 曲线图显示平面与3D芯片上小脑切片活性单元在TTX灌注后平均放电频率(MFR)的归一化时序变化(平均放电频率以TTX施加前1分钟基线活动为基准归一化)。C) 柱状图显示两种条件下TTX施加后达到放电频率下降10%、50%及90%所需时间。柱状图数据表示为均值±标准误,星号标注显著性差异:* p<0.05,** p<0.01,*** p<0.001。 |
¶ 刺激功能分析
平面与3D高密度微电极阵列芯片均配备可记录和施加电刺激的双向电极。小脑切片中颗粒层对苔藓纤维刺激的响应为毫秒级快速反应[8,13],因此检测难度较大。此外,有效刺激需要穿透组织以接触内部苔藓纤维。基于这些原因,微针技术有望为记录和刺激诱发响应提供关键优势。研究结果显示:苔藓纤维刺激可诱发局部场电位(LFP),该电位以311±39 mm/s的平均速度(n=8)在受刺激小叶内传播(图6A)。3D芯片能持续观察到快速响应(图6A和S3影片),而相同方案在平面芯片记录中未能激活颗粒层。通过药理学干预验证发现:阻断AMPA受体(10 µM NBQX,图6A,S3图)和电压门控钠通道(3 µM TTX,图6A)可消除该响应。从受刺激小叶浦肯野细胞检测到的响应可知(图6 B,C),刺激能有效实现信号在环路中的传导。浦肯野细胞接收颗粒细胞轴突的突触输入,表明刺激成功激活了神经网络。NBQX灌注亦可消除浦肯野细胞响应(图6 B,C)。
 |
|
图6. 3D高密度微电极阵列芯片在小脑切片中诱发神经元电活动的响应特征 |
¶ 3D高密度微电极阵列在高难度样本中的记录效能验证
基于3D芯片在前述测试中展现的增强记录性能,我们进一步评估了该设备在复杂制备样本(即传统上被认为难以评估功能网络电生理特性的实验条件)中的记录能力。重点针对包含前额叶皮层(PFC)的脑切片、脑球状体及类器官中的自发电活动进行了记录分析。
¶ 急性切片中前额叶皮层的自发网络活动
近年来,前额叶皮层(PFC)环路特征解析研究备受关注——鉴于该脑区承担高级认知功能,这一趋势不足为奇。然而,目前仍缺乏对PFC神经元在网络中协同活动的详细表征,这主要源于记录PFC自发电活动固有的技术挑战(通常需通过调控神经元兴奋性实现,详见讨论部分)。为验证3D芯片增强的记录能力能否解决此问题,我们在生理条件下(即未通过改变细胞外液提高神经元兴奋性)记录了急性切片中PFC前边缘区(PrL)的自发电活动。在7个切片2284个PrL采样电极中,共有983个通道记录到基础自发电活动(>0.1 Hz),占比43%。这些单元的平均放电频率为0.71±0.09 Hz。为进一步表征PrL活动特性,我们通过灌注无镁离子且升高钾离子浓度的改良人工脑脊液(mACSF,方法详见)及添加抑制性传递阻断剂(10 µM加巴嗪)来调控神经元兴奋性(图7A和S4图)。如预期所示,这两种干预均增强了网络兴奋性。值得注意的是,我们观察到自发性大型事件以局部场电位(LFP)形式沿皮层传播,并叠加簇发放电(图7B和S4影片)。这种阵发性网络事件在部分实验中显现。为此,我们对比分析两组切片(有无传播性LFP),以探究仅部分切片在加巴嗪灌注后出现阵发性事件的基础活动差异。无LFP组(n=3;Group 1)与有LFP组(n=4;Group 2)的基础放电特性无显著差异(S5图):生理条件下放电频率(Group 1:363单元,0.63±0.07 Hz;Group 2:620单元,0.79±0.12 Hz;非配对t检验p=0.25)与放电规律性(Group 1:变异系数CV 0.72±0.02,CV2 0.89±0.01;Group 2:CV 0.74±0.03,CV2 0.89±0.01;非配对t检验p=0.97和p=0.99)均无统计学差异。两组切片在mACSF灌注后基础放电频率均呈现一致性(但不显著)增加,且组间参数仍无差异(Group 1:363单元,基础频率0.76±0.05 Hz,CV=0.74±0.01,CV2=0.90±0.01;Group 2:735单元,基础频率0.82±0.10 Hz,CV=0.75±0.02,CV2=0.90±0.01;非配对t检验p=0.70,p=0.97,p=0.99)。加巴嗪灌注期间的基础频率增加仅第二组达显著水平(S5图),该结果可能反映阵发性事件的出现,同时解释了这些单元放电CV值的变化(图7A,B)。针对网络事件的特征,我们通过计算相关性指数(经单元数标准化,CI,详见方法)(图7C)探究两组切片的网络连接水平。有趣的是,相关性分析显示Group 1切片在生理条件下的网络相关性水平低于Group 2(CI Group 1=0.67±0.19,Group 2=1.88±0.76,p=0.08)(图7C)。两组在mASCF中网络相关性均显著增强(Group 1:363.18±148.62%,p=0.01;Group 2:141.70±64.99,p=0.02),但仅在出现阵发性事件的切片中,抑制阻断后相关性进一步升高(414.05±207.64%,p=0.02;图7C)。这些结果表明,利用3D高密度微电极阵列能够有效研究前额叶皮层切片的网络特性与 emergent 现象。此外,电极的高密度特性还适用于维持PFC亚区(如常需单独研究的PrL区)的良好空间分辨率。
 |
|
图7. 采用3D高密度微电极阵列表征小鼠前边缘区电活动特性 |
¶ 采用3D高密度微电极阵列检测脑球状体电活动
近年来,构建能够维持3D结构的体外细胞培养体系的需求,推动了球状体与类器官等复杂模型的发展[52,70]。然而,此类模型通常尺寸小于离体组织且细胞密度较低[71,72]。为此,我们采用配备更细电极的3D高密度微电极阵列以减少针尖穿透可能造成的损伤(图1B)。这些芯片在原代胚胎神经元培育的脑球状体上进行测试,球状体培养为约400微米和600微米两种直径规格。3.8×3.8 mm²的记录区域允许在同一芯片上放置多个样本,同时凭借电极的高密度特性保持良好空间分辨率。将三种不同尺寸(大、小)的球状体装载于两个不同芯片(图8A左图),放置后立即显示电活动。急性测量结果显示存在稳定的峰电位发放和簇发放电活动(图8A右图)。尽管相邻三个球状体共享相同培养基,但其活动并未同步(图8A中图栅格图所示),因此我们将每个样本视为独立单元。大型球状体被更多微针穿透,因而显示更多检测到活性细胞的电极数量(图8B)。但大小球状体的"活性细胞/覆盖电极"比率相近(约1.5),表明样本尺寸未直接影响微针的传感/穿透能力。将各球状体记录数据取平均值后按尺寸分组,两组平均放电频率、簇发频率及峰峰值振幅如图8C所示。值得注意的是,大型球状体呈现出平均放电频率与簇发活动增高的趋势(虽未达统计学显著性),而峰峰值振幅无此趋势(图8C),提示球状体尺寸不影响信号振幅或神经元-电极耦合效率。
 |
|
图8. 采用3D高密度微电极阵列记录小鼠脑球状体电活动 |
¶ 采用3D高密度微电极阵列实现类器官电活动的化学调控
尽管脑球状体具有3D结构特征,但其缺乏特定细胞架构的自组织发育模式,导致细胞组成与神经环路的复杂性显著不足[73]。为克服这些局限,脑类器官已成为研究人类大脑发育与疾病的新型生物模型[74-76]。将219天龄的人iPSC来源皮质类器官和131天龄脊髓类器官分别置于3D高密度微电极阵列芯片中并维持于各自培养基内(方法详见)。急性测量显示皮质类器官存在数百个活性位点,呈现自发性峰电位与簇发放电活动(图9)。高度同步化现象(见图9B栅格图)表明存在网络级激活。通过向培养基添加1 mM KCl可调控放电频率与簇发频率(分别增加18%和14%;n=236,p=0.03),而添加5 mM KCl则部分抑制该活动(分别改变22%和-50%;n=236,p值分别为0.007和0.001)(图9A,C)。值得注意的是,较低浓度KCl可在不显著改变总体峰电位活动的情况下破坏网络同步性,而更高浓度KCl会引发强直放电模式(数分钟内逐渐消失)并彻底破坏同步性[58,59]。此外,KCl灌注影响类器官功能连接:1 mM KCl使单元间相关性强度与连接数量略有增加(不显著),整体拓扑连接图谱得以保持;相反,5 mM KCl导致相关性强度急剧下降及拓扑连接分布重构,相关值显著降低,连接数量大幅减少(p<0.0001,分别降低47%和53%)(图9D)。
脊髓类器官则呈现不同的活动模式:基础活动远不如皮质类器官明显。低浓度KCl(+1 mM)诱发同步网络事件(暴露4分钟后减弱),高浓度(+5 mM)则使活动完全消失(图10A,B,D)。与皮质类器官类似,1 mM KCl可显著调控放电与簇发活动(放电频率从0.06增至1.2 Hz,增幅1916%;簇发频率从0.02增至1.9次/分钟,增幅9400%;n=230,p=0.0001)。5 mM KCl使两者活动部分抑制(分别降低66%和89%;n=230,p=0.0001)(图10C)。有趣的是,首次KCl给药后簇发内招募的峰电位数量显著增加(98%,图10D),而5 mM KCl使放电水平恢复至基线状态。虽然高浓度KCl下簇发内峰电位数量不变,但实验后期簇发内峰间隔(ISI)变得不规则(通过四分位距IQR衡量),该参数异质性增加48%表明网络活动紊乱。
 |
|
图9. 采用3D高密度微电极阵列记录人类皮质类器官电活动 |
 |
|
图10. 采用3D高密度微电极阵列记录人类脊髓类器官电活动 |
¶ 讨论
本研究证明,3D高密度微电极阵列是一种高效技术,能够以高分辨率传感和刺激互连的3D神经网络,同时提升组织活性,并促进神经元活动的药理学或电学调控。
¶ 3D高密度微电极阵列上的组织活性
扫描电镜和共聚焦显微镜评估结合活性与功能测量表明,3D微针可穿透急性切片和球状体,触及外层细胞以内的深层神经结构。活性化合物更快速的作用表明芯片基底处存在有效扩散,这与钙黄绿素染色检测的组织活性高度吻合。穿透式3D芯片可能存在的顾虑是微针(在3.8×3.8 mm²区域内集成4096个电极)对组织完整性的扰动。但小脑切片的电压敏感染料成像显示,与盖玻片上的切片数据相比,3D芯片未引起小脑网络激活模式的改变。此外,球状体和类器官的测量均显示出强劲的持续网络簇发活动,符合良好组织活性特征。这些结果表明,相较于平面微电极阵列,3D高密度微电极阵列在提升组织活性和实现高效组织穿透的同时,未显著影响神经网络结构与功能。
¶ 3D高密度微电极阵列的记录效率
除提升组织活性外,3D高密度微电极阵列还提高了信号采集效率,表现为活性电极数量、细胞-电极比率及记录单元数量的增加。此外,穿透性微针的3D组织电刺激效率优于平面微电极阵列。因此,3D芯片可用于刺激神经元微环路并记录不同区域的响应,为在同一脑切片中比较网络与子网络特性提供可能。在对高难度样本的测试中,3D芯片检测到了以往难以追踪的活动:系统灵敏度足以检测内侧前额叶皮层前边缘区神经元的稀疏基础放电活动,且无需增强其兴奋性;当出现大型网络事件时,还能同步检测电生理信号的低频(局部场电位)与高频(峰电位)成分。
¶ 前额叶皮层急性切片的电生理记录
本研究首次实现在生理条件下利用3D高密度微电极阵列检测前额叶皮层(PFC)电活动,并解析包括药理学调控在内的复杂网络特性。记录大量神经元活动的能力对研究皮层处理机制至关重要——该机制主要基于分布式网络活动与同步化。虽然运动皮层等脑区的神经元活动组织与编码机制已有研究,但PFC神经元在生理条件下的活动表征始终难以实现,这主要源于电生理技术记录急性PFC切片自发电活动的技术瓶颈[77-79]。事实上,平面微电极阵列仅能记录局部场电位[80],且需通过操纵细胞外液提高神经元兴奋性[81,82];而钙成像技术无法直接记录单细胞峰电位[83,84]。
3D高密度微电极阵列成功解析了PFC的低放电率特性[85-90](该特性与谷氨酸能驱动需求相关[91,92]),同时避免了使用非生理条件(如用于增强神经元兴奋性的0 mM镁离子溶液[93,94])。值得注意的是,我们的数据实现了生理条件下多单元相关活动的量化,提供了切片中前边缘区网络连接强度与连接性的测量指标。更重要的是,电极高密度特性支持选择性采集前边缘区活动,将分析限定于PFC亚区的同时,保留足够通道数确保统计有效性(尽管前边缘区采样通道中仅不到半数呈活性,但7个切片仍记录到983个单元)。
¶ 球状体与类器官的记录性能
3D高密度微电极阵列同样适用于神经球状体与类器官的记录。需要强调的是,脑球状体相较于脑切片具有更低的细胞密度和更小的尺寸(通常仅数百微米),这使得同一样本多点记录极具挑战性。因此,本研究采用的更细微针尺寸可能起到关键作用。值得注意的是,单个3D芯片可同步记录多个球状体,为并行测试多样本提供可能。对于类器官而言,无需数日芯片培养即可实现急性测量,避免了平面微电极阵列常见的细胞迁移效应。这带来两大优势:其一确保障神经元在3D环境中被记录,而非细胞迁移形成的2D网络;其二防止类器官从自由悬浮环境固定后可能出现的3D结构改变或坏死核心扩大。此外,我们成功实现了皮质与脊髓类器官放电频率与同步性的调控——这类操纵在常规实验中难以实现。尽管KCl诱导的膜去极化已知能有效调控脊椎/无脊椎动物原代培养物的神经连接[95,96],但此类调控在脑类器官中尚未得到系统表征。
¶ 结论
3D高密度微电极阵列技术显著提升了3D生物模型中电生理记录与刺激的效率。我们认为本研究为解答以往悬而未决的具体科学问题奠定了初步基础:例如,解析大脑切片(如大脑皮层、小脑和海马)中电信号的空间分布规律,以及探索未解决的生理学与计算科学问题,均需要高分辨率的记录与刺激位点定位。该技术还为研究生理条件下培育的球状体与类器官的神经活动提供新途径,有助于缩小动物组织与人类组织观测结果之间的差距。在所有样本制备中,通过灌注系统给药的效率将因流体与分子交换更快速、更充分而大幅提升。综上所述,3D高密度微电极阵列的综合优势使我们能够深入探究神经元活动的时空动力学、突触可塑性及药物的神经调控效应。最终,从同一样本中数千个互联神经元同步记录获得的海量数据,将为构建神经网络计算模型提供理想数据源,从而获得对环路组织与神经动力学机制的深刻洞见[97]。
¶ 支持信息
平面与3D高密度微电极阵列芯片的活性通道数量稳定性

|
S1图 平面与3D高密度微电极阵列芯片的活性通道数量稳定性 S2图 平面与3D高密度微电极阵列芯片放大性能表征 S3图 3D高密度微电极阵列芯片在小脑切片中诱发神经元电活动 S4图 使用3D芯片对无局部场电位切片的前边缘区活性表征 S5图 3D芯片记录的前边缘区活性单元自发放电特性 S1影片 不同焦平面的图像栈显示微针穿透3D芯片上的脑球状体 S2影片 TTX对平面与3D芯片上小脑切片作用的对比 S3影片 小脑切片颗粒层的电刺激 S4影片 在含加巴嗪的改良人工脑脊液中记录到源自前边缘区并传播至全切片的自发性局部场电位 |

|
|

|
|

|
|

|
|

原视频下载地址:https://fb.biokingdom.top/f/9bf7c1047aa146f8a4d9/
|
|

|
|

|
|

|
¶ 致谢
作者感谢意大利技术研究院(IIT,意大利热那亚)的Michele Dipalo博士提供了图1D中所示3D高密度微电极阵列芯片上的小脑切片扫描电镜图像。同时感谢埃默里大学脑类器官中心的A. King、Z. Ou和R. Yu提供类器官样本。作者衷心感谢Centro Grandi Strumenti大型仪器中心及共聚焦显微镜平台对本研究的支持与协助,特别鸣谢该中心共聚焦显微镜平台的Patrizia Vaghi女士在本工作中提供的技术支援。
¶ 文献列表
- 1.Gordon A, Yoon S-J, Tran SS, Makinson CD, Park JY, Andersen J, et al. Long-term maturation of human cortical organoids matches key early postnatal transitions. Nat Neurosci. 2021;24(3):331–42. pmid:33619405
- 2.Ballini M, Müller J, Livi P, Chen Y, Frey U, Stettler A, et al. A 1024-Channel CMOS Microelectrode Array With 26,400 Electrodes for Recording and Stimulation of Electrogenic Cells In Vitro. IEEE J Solid-State Circuits. 2014;49(11):2705–19. pmid:28502989
- 3.Costamagna G, Comi GP, Corti S. Advancing drug discovery for neurological disorders using iPSC-derived neural organoids. Int J Mol Sci. 2021;22(5):2659. pmid:33800815
- 4.Odawara A, Matsuda N, Ishibashi Y, Yokoi R, Suzuki I. Toxicological evaluation of convulsant and anticonvulsant drugs in human induced pluripotent stem cell-derived cortical neuronal networks using an MEA system. Sci Rep. 2018;8(1):10416. pmid:29991696
- 5.Tukker AM, Wijnolts FMJ, de Groot A, Westerink RHS. Human iPSC-derived neuronal models for in vitro neurotoxicity assessment. NeuroToxicology. 2018;67:215–25.
- 6.Cutarelli A, Martínez-Rojas VA, Tata A, Battistella I, Rossi D, Arosio D, et al. A monolayer system for the efficient generation of motor neuron progenitors and functional motor neurons from human pluripotent stem cells. Cells. 2021;10(5):1127.
- 7.Sun C, Lin KC, Yeung CY, Ching ESC, Huang Y-T, Lai P-Y, et al. Revealing directed effective connectivity of cortical neuronal networks from measurements. Phys Rev E. 2022;105(4–1):044406. pmid:35590680
- 8.Gagliano G, Monteverdi A, Casali S, Laforenza U, Gandini Wheeler-Kingshott CAM, D’Angelo E, et al. Non-linear frequency dependence of neurovascular coupling in the cerebellar cortex implies vasodilation–vasoconstriction competition. Cells. 2022;11(6):1047.
- 9.González-Calvo I, Iyer K, Carquin M, Khayachi A, Giuliani FA, Sigoillot SM, et al. Sushi domain-containing protein 4 controls synaptic plasticity and motor learning. Elife. 2021;10:e65712. pmid:33661101
- 10.Hu X, Khanzada S, Klütsch D, Calegari F, Amin H. Implementation of biohybrid olfactory bulb on a high-density CMOS-chip to reveal large-scale spatiotemporal circuit information. Biosens Bioelectron. 2022;198:113834. pmid:34852985
- 11.Mahadevan A, Codadu NK, Parrish RR. Xenon LFP analysis platform is a novel graphical user interface for analysis of local field potential from large-scale MEA recordings. Front Neurosci. 2022;16:904931. pmid:35844228
- 12.Mapelli J, D’Angelo E. The spatial organization of long-term synaptic plasticity at the input stage of cerebellum. J Neurosci. 2007;27(6):1285–96. pmid:17287503
- 13.Monteverdi A, Di Domenico D, D’Angelo E, Mapelli L. Anisotropy and frequency dependence of signal propagation in the cerebellar circuit revealed by high-density multielectrode array recordings. Biomedicines. 2023;11(5):1475. pmid:37239146
- 14.Tognolina M, Monteverdi A, D’Angelo E. Discovering microcircuit secrets with multi-spot imaging and electrophysiological recordings: the example of cerebellar network dynamics. Front Cell Neurosci. 2022;16:805670. pmid:35370553
- 15.Dorgau B, Georgiou M, Chaudhary A, Moya-Molina M, Collin J, Queen R, et al. Human retinal organoids provide a suitable tool for toxicological investigations: a comprehensive validation using drugs and compounds affecting the retina. Stem Cells Transl Med. 2022;11(2):159–77. pmid:35298655
- 16.Georgiou M, Chichagova V, Hilgen G, Dorgau B, Sernagor E, Armstrong L, et al. Room temperature shipment does not affect the biological activity of pluripotent stem cell-derived retinal organoids. PLoS One. 2020;15(6):e0233860. pmid:32479513
- 17.Mayer M, Arrizabalaga O, Ciba M, Schroeder IS, Ritter S, Thielemann C. Novel in vitro assay to investigate radiation induced changes in the functionality of human embryonic stem cell-derived neurospheres. Neurotoxicology. 2020;79:40–7. pmid:32320710
- 18.Buskila Y, Breen PP, Tapson J, van Schaik A, Barton M, Morley JW. Extending the viability of acute brain slices. Sci Rep. 2014;4:5309. pmid:24930889
- 19.Tasnim K, Liu J. Emerging bioelectronics for brain organoid electrophysiology. J Mol Biol. 2022;434(3):167165. pmid:34293341
- 20.Hoogerwerf AC, Wise KD. A three-dimensional microelectrode array for chronic neural recording. IEEE Trans Biomed Eng. 1994;41(12):1136–46. pmid:7851915
- 21.Bai Q, Wise KD, Anderson DJ. A high-yield microassembly structure for three-dimensional microelectrode arrays. IEEE Trans Biomed Eng. 2000;47(3):281–9. pmid:10743769
- 22.Du J, Riedel-Kruse IH, Nawroth JC, Roukes ML, Laurent G, Masmanidis SC. High-resolution three-dimensional extracellular recording of neuronal activity with microfabricated electrode arrays. J Neurophysiol. 2009;101(3):1671–8. pmid:19091921
- 23.Heuschkel MO, Fejtl M, Raggenbass M, Bertrand D, Renaud P. A three-dimensional multi-electrode array for multi-site stimulation and recording in acute brain slices. J Neurosci Methods. 2002;114(2):135–48. pmid:11856564
- 24.Irons HR, Cullen DK, Shapiro NP, Lambert NA, Lee RH, Laplaca MC. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J Neural Eng. 2008;5(3):333–41. pmid:18756031
- 25.Musick K, Khatami D, Wheeler BC. Three-dimensional micro-electrode array for recording dissociated neuronal cultures. Lab Chip. 2009;9(14):2036–42. pmid:19568672
- 26.Thiébaud P, de Rooij NF, Koudelka-Hep M, Stoppini L. Microelectrode arrays for electrophysiological monitoring of hippocampal organotypic slice cultures. IEEE Trans Biomed Eng. 1997;44(11):1159–63. pmid:9353996
- 27.Aziz JNY, Genov R, Bardakjian BL, Derchansky M, Carlen PL. Brain-Silicon Interface for High-Resolution in vitro Neural Recording. IEEE Trans Biomed Circuits Syst. 2007;1(1):56–62. pmid:23851521
- 28.Hashemi S, Joye N, Schmid A, Leblebici Y. Very high density microelectrode array with monolithically integrated readout circuits. 6th Conference on Ph.D. Research in Microelectronics and Electronics, PRIME 2010. 2010.
- 29.Gunning DE, Beggs JM, Dabrowski W, Hottowy P, Kenney CJ, Sher A, et al. Dense arrays of micro-needles for recording and electrical stimulation of neural activity in acute brain slices. J Neural Eng. 2013;10(1):016007. pmid:23234809
- 30.Multichannel Systems 2018 Microelectrode array (MEA) manual. In: Multichannel Systems [Internet]. 2018 [cited 10 Aug 2022]. Available from: www.multichannelsystems.com/sites/multichannelsystems.com/files/documents/manuals/MEA_Manual.pdf
- 31.Li F, Ulrich ML, Shih VF-S, Cochran JH, Hunter JH, Westendorf L, et al. Mouse Strains Influence Clearance and Efficacy of Antibody and Antibody-Drug Conjugate Via Fc-FcγR Interaction. Mol Cancer Ther. 2019;18(4):780–7. pmid:30824607
- 32.Egert U, Heck D, Aertsen A. Two-dimensional monitoring of spiking networks in acute brain slices. Exp Brain Res. 2002;142(2):268–74. pmid:11807580
- 33.Ma Y-L, Weston SE, Whalley BJ, Stephens GJ. The phytocannabinoid Delta(9)-tetrahydrocannabivarin modulates inhibitory neurotransmission in the cerebellum. Br J Pharmacol. 2008;154(1):204–15. pmid:18311186
- 34.Berdondini L, Bosca A, Nieus T, Maccione A. Active Pixel Sensor Multielectrode Array for High Spatiotemporal Resolution. In: De Vittorio M, Martiradonna L, Assad J, editors. Nanotechnology and Neuroscience: Nano-electronic, Photonic and Mechanical Neuronal Interfacing. New York, NY: Springer New York; 2014. pp. 207–238.
- 35.Imfeld K, Maccione A, Gandolfo M, Martinoia S, Farine P ‐A., Koudelka‐Hep M, et al. Real‐time signal processing for high‐density microelectrode array systems. Adaptive Control Signal. 2008;23(11):983–98.
- 36.Suzuki I, Matsuda N, Han X, Noji S, Shibata M, Nagafuku N, et al. Large-Area Field Potential Imaging Having Single Neuron Resolution Using 236 880 Electrodes CMOS-MEA Technology. Adv Sci (Weinh). 2023;10(20):e2207732. pmid:37088859
- 37.Wang P, Wu EG, Uluşan H, Zhao ET, Phillips AJ, Kling A, et al. Direct-Print 3D electrodes for large-scale, high-density, and customizable neural interfaces. Adv Sci (Weinh). 2025;12(3):e2408602. pmid:39588825
- 38.Wang P, Wu EG, Uluşan H, Phillips AJ, Rose Hays M, Kling A, et al. Direct-print three-dimensional electrodes for large- scale, high-density, and customizable neural inter- faces. bioRxiv. 2023. pmid:37398164
- 39.Liu L, Zhou X, Wu J-Y. Preparing viable hippocampal slices from adult mice for the study of Sharp Wave-ripples. Bio Protoc. 2020;10(19):e3771. pmid:33659429
- 40.Killian NJ, Vernekar VN, Potter SM, Vukasinovic J. A device for long-term perfusion, imaging, and electrical interfacing of brain tissue in vitro. Front Neurosci. 2016;10:135. pmid:27065793
- 41.Rowe L, Almasri M, Lee K, Fogleman N, Brewer GJ, Nam Y, et al. Active 3-D microscaffold system with fluid perfusion for culturing in vitro neuronal networks. Lab Chip. 2007;7(4):475–82. pmid:17389964
- 42.Amin H, Maccione A, Marinaro F, Zordan S, Nieus T, Berdondini L. Electrical responses and spontaneous activity of human iPS-derived neuronal networks characterized for 3-month culture with 4096-electrode arrays. Front Neurosci. 2016;10:121. pmid:27065786
- 43.Amin H, Marinaro F, De Pietri Tonelli D, Berdondini L. Developmental excitatory-to-inhibitory GABA-polarity switch is disrupted in 22q11.2 deletion syndrome: a potential target for clinical therapeutics. Sci Rep. 2017;7(1):15752. pmid:29146941
- 44.Ferrea E, Maccione A, Medrihan L, Nieus T, Ghezzi D, Baldelli P, et al. Large-scale, high-resolution electrophysiological imaging of field potentials in brain slices with microelectronic multielectrode arrays. Front Neural Circuits. 2012;6:80. pmid:23162432
- 45.Muzzi L, Di Lisa D, Falappa M, Pepe S, Maccione A, Pastorino L, et al. Human-derived cortical neurospheroids coupled to passive, high-density and 3D MEAs: a valid platform for functional tests. Bioengineering (Basel). 2023;10(4):449. pmid:37106636
- 46.Maccione A, Hennig MH, Gandolfo M, Muthmann O, van Coppenhagen J, Eglen SJ, et al. Following the ontogeny of retinal waves: pan-retinal recordings of population dynamics in the neonatal mouse. J Physiol. 2014;592(7):1545–63. pmid:24366261
- 47.Sharf T, van der Molen T, Glasauer SMK, Guzman E, Buccino AP, Luna G, et al. Functional neuronal circuitry and oscillatory dynamics in human brain organoids. Nat Commun. 2022;13(1):4403. pmid:35906223
- 48.Pan T, Jaklic DC, Vaid S, Lin G, VanHeyningen D, Dang LT. A Multi-Electrode array platform for modeling epilepsy using human pluripotent stem cell-derived brain assembloids. J Vis Exp. 2024;(211). pmid:39400160
- 49.Soda T, Mapelli L, Locatelli F, Botta L, Goldfarb M, Prestori F, et al. Hyperexcitability and hyperplasticity disrupt cerebellar signal transfer in the IB2 KO mouse model of autism. J Neurosci. 2019;39(13):2383–97. pmid:30696733
- 50.Tapella L, Soda T, Mapelli L, Bortolotto V, Bondi H, Ruffinatti FA, et al. Deletion of calcineurin from GFAP-expressing astrocytes impairs excitability of cerebellar and hippocampal neurons through astroglial Na+ /K+ ATPase. Glia. 2020;68(3):543–60. pmid:31626368
- 51.Sanchez-Vives MV, McCormick DA. Cellular and network mechanisms of rhythmic recurrent activity in neocortex. Nat Neurosci. 2000;3(10):1027–34. pmid:11017176
- 52.Dingle Y-TL, Boutin ME, Chirila AM, Livi LL, Labriola NR, Jakubek LM, et al. Three-dimensional neural spheroid culture: Anin vitromodel for cortical studies. Tissue Eng Part C: Methods. 2015;21(12):1274–83.
- 53.Khan J, Das G, Gupta V, Mohapatra S, Ghosh S, Ghosh S. Neurosphere development from hippocampal and cortical embryonic mixed primary neuron culture: a potential platform for screening neurochemical modulator. ACS Chem Neurosci. 2018;9(11):2870–8. pmid:30346714
- 54.Sevetson JL, Theyel BB, Hoffman-Kim D. Cortical spheroids display oscillatory network dynamics. bioRxiv. 2021.
- 55.Sloan SA, Andersen J, Pașca AM, Birey F, Pașca SP. Generation and assembly of human brain region-specific three-dimensional cultures. Nat Protoc. 2018;13(9):2062–85. pmid:30202107
- 56.Voss AJ, Lanjewar SN, Sampson MM, King A, Hill EJ, Sing A, et al. Identification of ligand-receptor pairs that drive human astrocyte development. Nat Neurosci. 2023;26(8):1339–51. pmid:37460808
- 57.Schneider CA, Rasband WS, Eliceiri KW. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 2012;9(7):671–5. pmid:22930834
- 58.Mapelli J, Gandolfi D, D’Angelo E. High-pass filtering and dynamic gain regulation enhance vertical bursts transmission along the mossy fiber pathway of cerebellum. Front Cell Neurosci. 2010;4:14. pmid:20577586
- 59.Prestori F, Bonardi C, Mapelli L, Lombardo P, Goselink R, De Stefano ME, et al. Gating of long-term potentiation by nicotinic acetylcholine receptors at the cerebellum input stage. PLoS One. 2013;8(5):e64828. pmid:23741401
- 60.Imfeld K, Neukom S, Maccione A, Bornat Y, Martinoia S, Farine P-A, et al. Large-scale, high-resolution data acquisition system for extracellular recording of electrophysiological activity. IEEE Trans Biomed Eng. 2008;55(8):2064–73. pmid:18632369
- 61.Muthmann J-O, Amin H, Sernagor E, Maccione A, Panas D, Berdondini L, et al. Spike DETECTION FOR LARGE NEURAL POPULATIONS USING HIGH DENSITY MULTIELECTRODE ARRAYS. Front Neuroinform. 2015;9.
- 62.Maccione A, Gandolfo M, Massobrio P, Novellino A, Martinoia S, Chiappalone M. A novel algorithm for precise identification of spikes in extracellularly recorded neuronal signals. J Neurosci Methods. 2009;177(1):241–9. pmid:18957306
- 63.Hilgen G, Sorbaro M, Pirmoradian S, Muthmann J-O, Kepiro IE, Ullo S, et al. Unsupervised Spike Sorting for Large-Scale, High-Density Multielectrode Arrays. Cell Rep. 2017;18(10):2521–32. pmid:28273464
- 64.Pastore VP, Godjoski A, Martinoia S, Massobrio P. SPICODYN: A Toolbox for the analysis of neuronal network dynamics and connectivity from multi-Site Spike Signal Recordings. Neuroinformatics. 2018;16(1):15–30. pmid:28988388
- 65.Rubinov M, Sporns O. Complex network measures of brain connectivity: uses and interpretations. Neuroimage. 2010;52(3):1059–69. pmid:19819337
- 66.Mainardi F, Mapelli L, D’Angelo E. HD-MEA NEUROPulse. Zenodo. 2024.
- 67.Howarth C, Peppiatt-Wildman CM, Attwell D. The energy use associated with neural computation in the cerebellum. J Cereb Blood Flow Metab. 2010;30(2):403–14. pmid:19888288
- 68.D’Angelo E. Physiology of the cerebellum. 2018. pp. 85–108.
- 69.Braut-Boucher F, Pichon J, Rat P, Adolphe M, Aubery M, Font J. A non-isotopic, highly sensitive, fluorimetric, cell-cell adhesion microplate assay using calcein AM-labeled lymphocytes. J Immunol Methods. 1995;178(1):41–51. pmid:7829864
- 70.Kelava I, Lancaster MA. Dishing out mini-brains: Current progress and future prospects in brain organoid research. Dev Biol. 2016;420(2):199–209. pmid:27402594
- 71.Collins CE, Airey DC, Young NA, Leitch DB, Kaas JH. Neuron densities vary across and within cortical areas in primates. Proc Natl Acad Sci USA. 2010;107(36):15927–32.
- 72.Frega M, Tedesco M, Massobrio P, Pesce M, Martinoia S. Network dynamics of 3D engineered neuronal cultures: a new experimental model for in-vitro electrophysiology. Sci Rep. 2014;4:5489. pmid:24976386
- 73.Mansour AA, Schafer ST, Gage FH. Cellular complexity in brain organoids: Current progress and unsolved issues. Semin Cell Dev Biol. 2021;111:32–9. pmid:32499191
- 74.Addam S, Mullis DLK. Functional bioengineered tissue models of neurodegenerative diseases. Biomaterials. 2023;298:122143. pmid:37146365
- 75.Cerneckis J, Bu G, Shi Y. Pushing the boundaries of brain organoids to study Alzheimer’s disease. Trends Mol Med. 2023;29(8):659–72. pmid:37353408
- 76.Nieto-Estévez V, Hsieh J. Human Brain Organoid Models of Developmental Epilepsies. Epilepsy Curr. 2020;20(5):282–90. pmid:33017223
- 77.Seamans JK, Yang CR. The principal features and mechanisms of dopamine modulation in the prefrontal cortex. Prog Neurobiol. 2004;74(1):1–58. pmid:15381316
- 78.Puig MV, Rose J, Schmidt R, Freund N. Dopamine modulation of learning and memory in the prefrontal cortex: insights from studies in primates, rodents, and birds. Front Neural Circuits. 2014;8:93. pmid:25140130
- 79.Di Domenico D, Mapelli L. Dopaminergic Modulation of Prefrontal Cortex Inhibition. Biomedicines. 2023;11(5):1276. pmid:37238947
- 80.Capone C, Rebollo B, Muñoz A, Illa X, Del Giudice P, Sanchez-Vives MV, et al. Slow waves in cortical slices: how spontaneous activity is shaped by laminar structure. Cereb Cortex. 2019;29(1):319–35. pmid:29190336
- 81.Michetti C, Ferrante D, Parisi B, Ciano L, Prestigio C, Casagrande S, et al. Low glycemic index diet restrains epileptogenesis in a gender-specific fashion. Cell Mol Life Sci. 2023;80(12):356. pmid:37947886
- 82.Goodchild SJ, Shuart NG, Williams AD, Ye W, Parrish RR, Soriano M, et al. Molecular Pharmacology of Selective NaV1.6 and Dual NaV1.6/NaV1.2 Channel Inhibitors that Suppress Excitatory Neuronal Activity Ex Vivo. ACS Chem Neurosci. 2024;15(6):1169–84. pmid:38359277
- 83.Mao BQ, Hamzei-Sichani F, Aronov D, Froemke RC, Yuste R. Dynamics of spontaneous activity in neocortical slices. Neuron. 2001;32(5):883–98. pmid:11738033
- 84.Blaeser AS, Connors BW, Nurmikko AV. Spontaneous dynamics of neural networks in deep layers of prefrontal cortex. J Neurophysiol. 2017;117(4):1581–94. pmid:28123005
- 85.Watson TC, Becker N, Apps R, Jones MW. Back to front: cerebellar connections and interactions with the prefrontal cortex. Front Syst Neurosci. 2014;8:4. pmid:24550789
- 86.Jacob V, Brasier DJ, Erchova I, Feldman D, Shulz DE. Spike timing-dependent synaptic depression in the in vivo barrel cortex of the rat. J Neurosci. 2007;27(6):1271–84. pmid:17287502
- 87.de Kock CPJ, Sakmann B. Spiking in primary somatosensory cortex during natural whisking in awake head-restrained rats is cell-type specific. Proc Natl Acad Sci U S A. 2009;106(38):16446–50. pmid:19805318
- 88.Gong Y, Huang C, Li JZ, Grewe BF, Zhang Y, Eismann S, et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science. 2015;350(6266):1361–6. pmid:26586188
- 89.Jia X, Siegle JH, Durand S, Heller G, Ramirez TK, Koch C, et al. Multi-regional module-based signal transmission in mouse visual cortex. Neuron. 2022;110(9):1585–1598.e9. pmid:35143752
- 90.Zagha E, Ge X, McCormick DA. Competing Neural Ensembles in Motor Cortex Gate Goal-Directed Motor Output. Neuron. 2015;88(3):565–77. pmid:26593093
- 91.Oikonomou KD, Singh MB, Sterjanaj EV, Antic SD. Spiny neurons of amygdala, striatum, and cortex use dendritic plateau potentials to detect network UP states. Front Cell Neurosci. 2014;8.
- 92.Rotaru DC, Yoshino H, Lewis DA, Ermentrout GB, Gonzalez-Burgos G. Glutamate receptor subtypes mediating synaptic activation of prefrontal cortex neurons: relevance for schizophrenia. J Neurosci. 2011;31(1):142–56.
- 93.Moser J, Kilb W, Werhahn K-J, Luhmann HJ. Early developmental alterations of low-Mg2+-induced epileptiform activity in the intact corticohippocampal formation of the newborn mouse in vitro. Brain Res. 2006;1077(1):170–7.
- 94.Quilichini PP, Diabira D, Chiron C, Ben‐Ari Y, Gozlan H. Persistent epileptiform activity induced by low Mg2+ in intact immature brain structures. Eur J Neurosci. 2002;16(5):850–60.
- 95.Golbs A, Nimmervoll B, Sun J-J, Sava IE, Luhmann HJ. Control of programmed cell death by distinct electrical activity patterns. Cereb Cortex. 2011;21(5):1192–202. pmid:20966045
- 96.Massobrio P, Giachello CN, Ghirardi M, Martinoia S. Selective modulation of chemical and electrical synapses of Helix neuronal networks during in vitro development. BMC Neurosci. 2013;14:22. pmid:23442557
- 97.De Schepper R, Geminiani A, Masoli S, Rizza MF, Antonietti A, Casellato C, et al. Model simulations unveil the structure-function-dynamics relationship of the cerebellar cortical microcircuit. Commun Biol. 2022;5(1):1240. pmid:36376444