¶ 选择性 及双重 通道抑制剂的分子药理学研究—一体外抑制兴奋性神经元活性机制分析
塞缪尔·J古德柴尔德*、诺亚·格雷戈里·舒特、亚伦·D威廉姆斯、叶文磊、R·赖利·帕里什、梅根·索里亚诺、萨姆拉特·索塔、贾内特·梅泽约娃、马修·沃尔德布鲁克、理查德·迪恩、蒂洛·福肯、穆罕默德-雷扎戈万洛、彼得·C鲁本、菲奥娜·斯科特、查尔斯·J科恩、詹姆斯·恩普菲尔德、JP·约翰逊
摘要:电压门控钠通道 ,抑制剂用于治疗过度兴奋性神经系统疾病,如癫痫。这类药物通过减弱神经元动作电位放电来降低大脑兴奋性。然而,目前所有靶向 的抗癫痫药物都会非选择性地抑制大脑中的 、 和 1.6通道,这可能限制其疗效与治疗安全窗口。本文报道的XPC-7724和XPC-5462代表了一类新型靶向 的小分子化合物,它们能特异性抑制 及
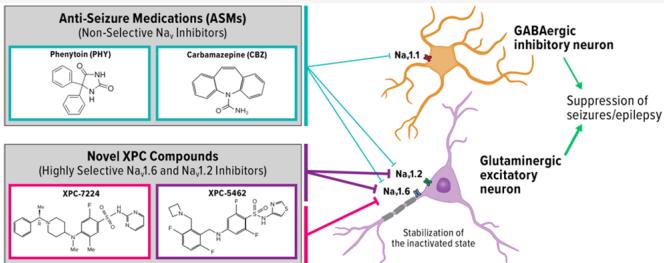
钠y1.2通道在兴奋性锥体神经元中大量表达。该通道对主要表达于抑制性神经元的钠y1.1通道具有 倍分子选择性。保留钠v1.1通道可维持大脑的抑制性活动。这些化合物通过结合并稳定通道的失活状态,从而降低兴奋性神经元活性。与临床使用的抗癫痫药物卡马西平和苯妥英相比,它们具有更高效力、更长的驻留时间和更慢的解离速率。通过抑制皮层兴奋性锥体神经元放电而不影响快速放电的抑制性中间神经元,这些化合物的神经元选择性在脑切片实验中得以验证。XPC-5462还能在离体脑切片癫痫模型中抑制癫痫样活动,而XPC-7224则无此作用,这表明在0-镁2+或4-AP诱导的脑切片癫痫模型中可能需要抑制Nav1.2通道。这些化合物的特征将有助于剖析钠v1.2和钠v1.6通道在神经元中的生理作用,并明确特定通道在疾病状态中的功能。这种独特的选择性特征为通过选择性下调兴奋性回路来潜在治疗神经元过度兴奋性疾病提供了新途径。
关键词: 癫痫,钠通道,药理学,生物物理学,精准医学,抗癫痫药物
¶ 引言
在中枢神经系统(CNS)中,电压门控钠通道 控制神经元动作电位(APs)的起始与传播。1-这些特性使 通道成为过度兴奋性疾病(如心律失常、癫痫和疼痛)的理想药理靶点。本文引入新型药理工具,可解析 与 的功能差异,有助于明确各通道亚型在多种疾病状态中的作用。我们此前已报道过选择性 抑制剂的抗癫痫活性。4与 类似, 同样优先表达于中枢神经系统的兴奋性回路中。本研究报告了两种药理制剂,它们对 的抑制作用极为相似,但对 的抑制效果存在显著差异。这将为评估Na 抑制作用的体内研究提供重要手段。
在成年中枢神经系统中,高度表达四种钠通道亚型: 、 和 与 是兴奋性神经元中的主要亚型,而 则主要表达于抑制性中间神经元。‘目前来自小鼠和人类研究的多项证据支持将钠通道亚型区分为兴奋性与抑制性网络,包括许多研究表明 和 的功能获得性突变以及功能缺失性钠通道功能缺失(LOF)与过度兴奋性疾病癫痫相关。6-15钠通道亚型在兴奋性和抑制性回路中的选择性表达,为针对兴奋性网络的靶向药物治疗提供了理论依据,该疗法可在不影响抑制性网络的前提下治疗兴奋性障碍疾病。
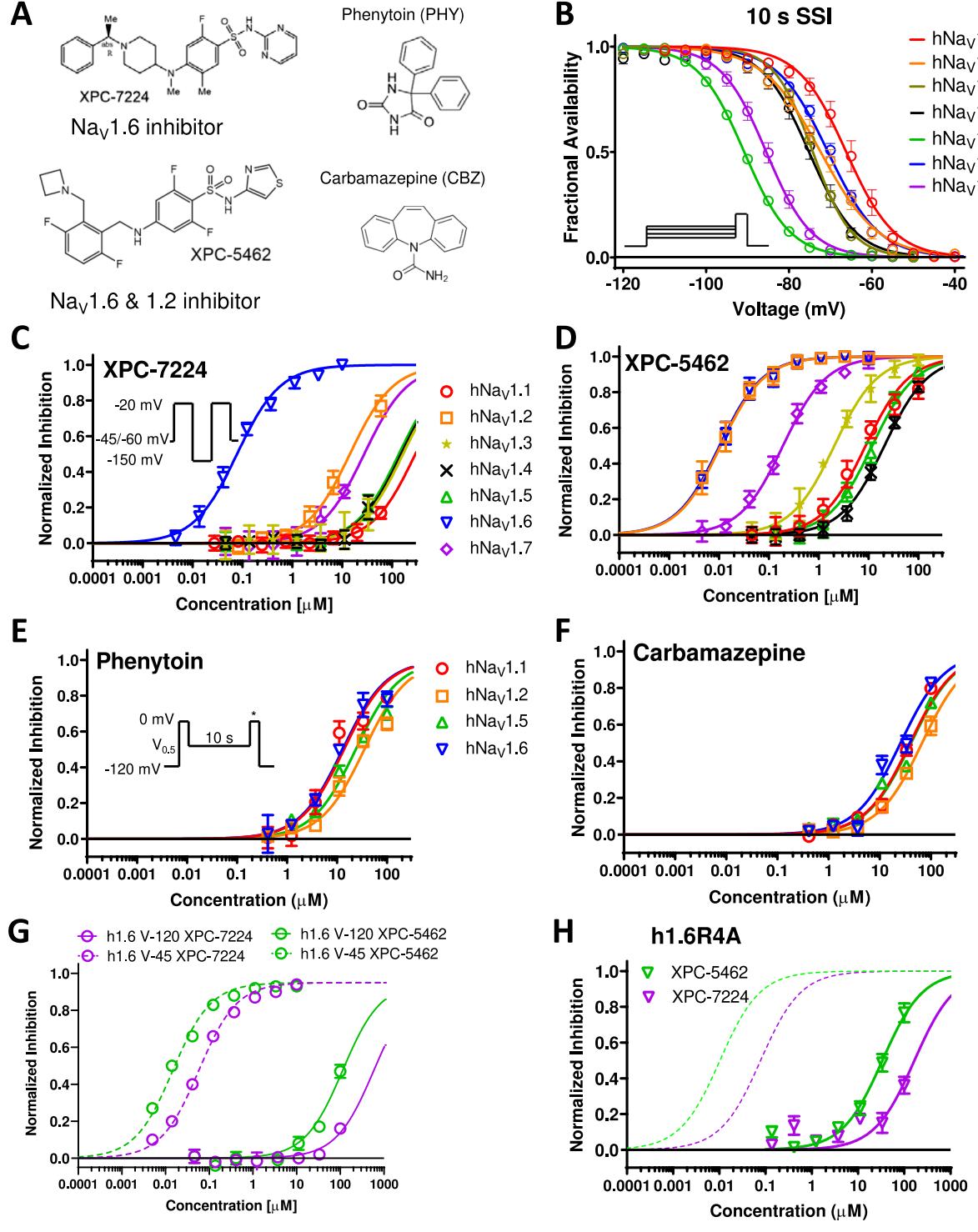
图1.分子选择性状态依赖性抑制剂与非选择性ASMs的比较药理学研究。(A)XPC化合物及经典孔道阻断型ASMs (PHY与CBZ)的化学结构。(B)标准化失活曲线显示人源 亚型 ( 个细胞)、 个细胞)、 个细胞)、 个细胞)和 个细胞)的电压依赖性失活特征差异。©XPC-7224对不同通道亚型的抑制率曲线(采用希尔方程拟合),每个浓度点 个细胞。(D)XPC-5462的效能曲线,每个浓度点 个细胞。(E,F)采用快速解离 protocol检测孔道阻断型ASMs的效能,每个浓度点 个细胞。(G)XPC-7224(每个浓度点 个细胞)与XPC-5462(每个数据点 个细胞)的膜保持电压依赖性效能曲线。 XPC-7224(每个浓度点 个细胞)与XPC-5462(每个浓度点 个细胞)对h1.6R4A通道的效能测定。
通道是异源多聚体蛋白,由大的离子传导 -亚基和较小的辅助 -亚基组成。 -亚基由一个单一转录本组成,该转录本编码四个6-跨膜片段结构域。这四个结构域中的每一个都可以分为两个功能亚域,称为电压感应域(VSD)与孔结构域(PD)通过胞内S4-S5连接体相耦联,共同调控门控机制。钠通道在静息、开放与失活三种基本门控状态间循环。当去极化达到特定阈值时,VSDI-III的向外运动通过机电耦合机制将跨膜电位变化传递至孔腔内部的激活门,17-19引发通道开放。随后VSD-IV的外向运动介导通道快速进入失活状态。VSD-IV在失活调控中具有特殊功能:其电压依赖性更偏向超极化方向,向激活态转化的速率略慢于VSDI-III,实验证明该结构域对失活过程既必要又充分。17,20与VSDI-III相比,VSD-IV的超极化电压依赖性还使通道能在未开放时直接进入失活状态,即闭合态失活或稳态失活。²1这种失活机制导致不同神经元类型、细胞亚区以及神经活动过程中,通道可用性随静息膜电位动态变化。²2失活过程中的S4运动触发DIII-IV连接子中的IFM疏水基团与通道其他区域相互作用,²3结构学研究证实失活本质属于变构机制:IFM基团嵌入S6与S4-S5形成的空隙,引发构象变化最终关闭渗透路径。24,25关键之处在于,当典型中枢神经元静息膜电位维持在-70至 时,由于该电位值常接近通道半失活电压( ),钠通道将同时分布于静息与失活两种状态。26
它表 的 通道亚型抑制效力
磅
| XPC-7724 | XPC-5462 | phenytoin | carbamazepine | |||||||||
| IC50 | 95% CI | n (cells) | ICs0 | 95% CI | n (cells) | IC50 | 95% CI | n (cells) | IC50 | 95% CI | n (cells) | |
| hNay1.1 | 294 | 255-354 | 71 | 8.75 | 7.53-10.2 | 62 | 13.8 | 9.59-20.1 | 26 | 39.3 | 33.3-46.7 | 41 |
| hNay1.2 | 14.3 | 12.2-16.9 | 32 | 0.0109 | 0.00968-0.0122 | 49 | 35.2 | 2.1-44.3 | 26 | 67.4 | 57.3-79.6 | 35 |
| hNav1.3 | 167 | 117-268 | 45 | 206 | 1.85-2.30 | 63 | ||||||
| hNay1.4 | 153 | 123-197 | 41 | 20.8 | 19.1-22.7 | 42 | ||||||
| hNay1.5 | 138 | 103-197 | 15 | 11.9 | 10.4-13.5 | 27 | 23.8 | 19.2-29.6 | 23 | 41.1 | 35.3-47.8 | 39 |
| hNay1.6 | 0.078 | 0.0718-0.0848 | 70 | 0.0103 | 0.000921-0.0115 | 50 | 13 | 10.1-16.9 | 29 | 25.6 | 21.1-30.8 | 45 |
| hNav1.7 | 27.7 | 20.4-40.1 | 45 | 0.192 | 0.175-0.211 | 54 | ||||||
| mNay1.6 | 0.13 | 0.103-0.164 | 30 | 0.0137 | 0.0112-0.0169 | 30 | ||||||
已知能抑制钠通道的大多数小分子均具有非选择性特性,这与孔道结合位点高度保守的关键残基在旁系同源物中高度保守有关。27-31这类分子在兴奋性障碍疾病(如疼痛、心律失常和癫痫)中展现出广泛的临床疗效。然而卡马西平(CBZ)和苯妥英(PHY)等化合物的安全窗较窄,其副作用可能在治疗剂量范围内出现,可能源于钠v电流的过度抑制和/或脱靶相互作用。32-34这些分子抑制钠v通道的机制具有多因素特性,包括:29物理性阻塞离子传导、3稳定失活状态、以及35固定电压传感器。
最近,研究人员发现了一类新的选择性Nav通道抑制剂小分子,它们与VSD-IV的胞外部分相互作用,并利用该位点旁系同源物间的序列差异。36这些化合物能够结合至VSD-IV的激活状态与VSD-IV-S4上的第四个精氨酸残基形成重要静电相互作用,将VSD-IV捕获于上升构象,从而使通道维持在非导电的失活状态37,38。此类初始化合物能有效抑制 、 和 通道,并对 和 表现出高度选择性。此外,这些化合物的中枢神经系统渗透性极低。我们最新发现了一类具有中枢渗透性的VSD-IV靶向化合物,其选择性特征前所未有:可单独靶向 通道4,或同时靶向 与N 通道用于癫痫治疗39。啮齿类动物癫痫疗效数据表明,与非选择性抗癫痫药物(ASMs)卡马西平和苯妥英相比, 选择性抑制能产生更佳的治疗指数,这为选择性化合物提升安全边际提供了可能性4。
在此,我们描述了 选择性抑制剂XPC-7224及N 与 双重抑制剂XPC-5462,与临床常用的非选择性钠通道阻断抗癫痫药物PHY、CBZ的比较分子药理学特性。我们揭示了这些化合物间若干重要的生物物理学和药理学差异:相较于CBZ与PHY,XPC系列化合物作用于通道的不同位点,对兴奋性钠通道亚型具有高度选择性,并展现出截然不同的动力学特征及效能状态依赖性。随后通过成年小鼠兴奋性与抑制性神经元的膜片钳记录,验证了该药理特征降低癫痫发作的机制假设,并在急性脑切片的多电极阵列癫痫模型中加以验证。通过探究选择性、动力学特性及状态依赖性的差异,我们提出静息膜电位下的稳态抑制机制,可在机理层面有效降低中枢神经系统神经元兴奋性,并抑制脑切片中的癫痫样活动。
¶ 结果
XPC-7224和XPC-5462分别是 和 的分子选择性抑制剂。状态依赖性是小分子 通道抑制剂的常见特征,其中化合物与通道的失活状态相互作用更强。30,40例如,传统局部麻醉剂靶向内部孔腔,以比关闭/静息状态更高的效力抑制通道的失活或开放状态。这对于ASMs 也是如此,例如靶向相同结合位点的PHY 和CBZ(图1A)。27,41 增加的效力被提出是由于在失活状态下孔腔中有利的结构构型增加了结合亲和力42。
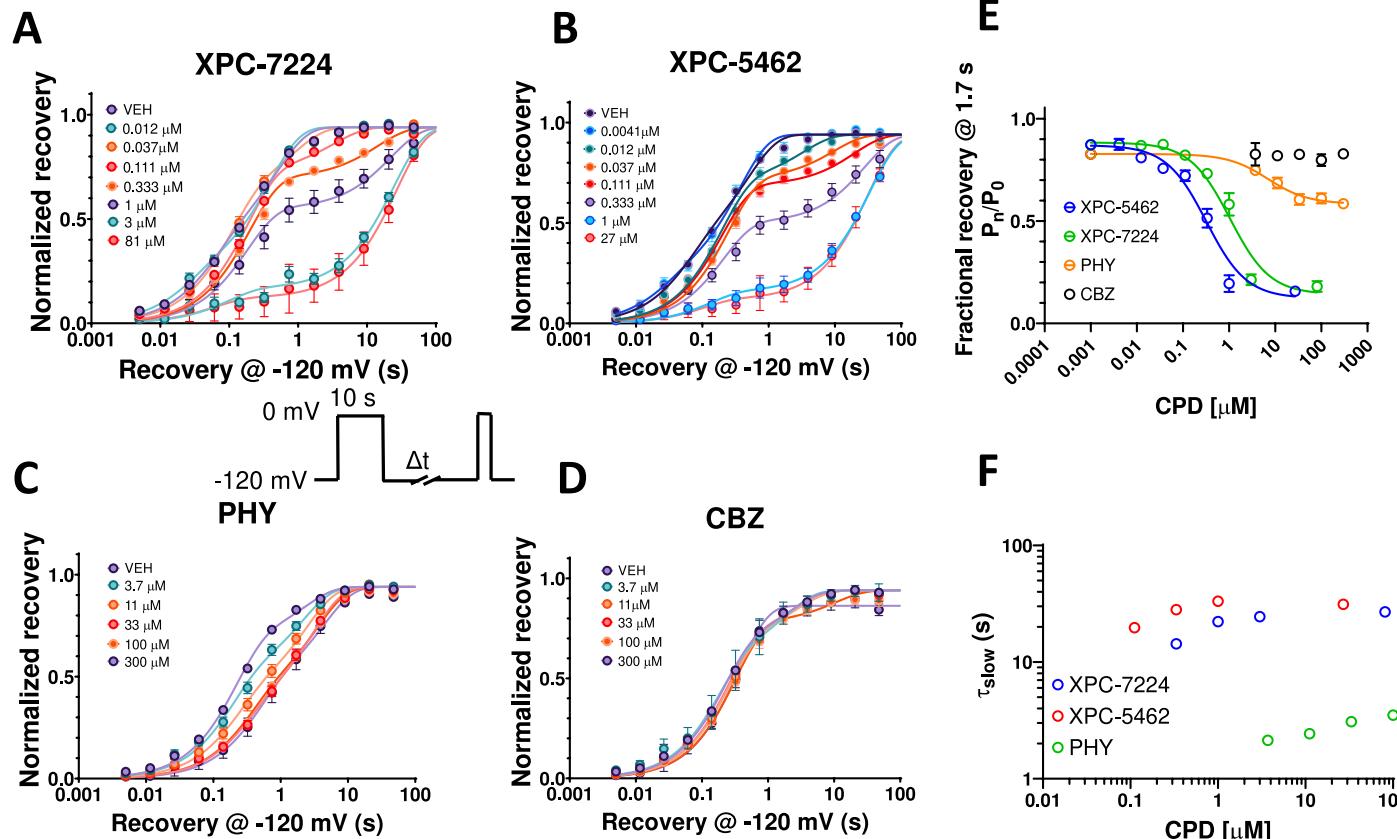
图2.从失活中恢复受限于化合物解离。在 通道中,使用插图中所示的方案,在不同浓度化合物存在下,通过10秒预脉冲至 诱导的归一化从失活中恢复图,在 下测量。(A)XPC-7224,每个浓度 个细胞(B)XPC-5462,每个浓度 3-8个细胞©PHY,每个浓度 个细胞(D)CBZ,每个浓度 个细胞。(E)在1.7秒时测量,由化合物结合诱导的恢复慢成分的时间常数与化合物浓度的关系。(F)对于XPC-7224( 个细胞)、XPC-5462( 个细胞)和PHY( 个细胞),在1.7秒后部分恢复与化合物浓度的关系图。平均数据用双指数函数拟合。
选择性钠y通道VSD-IV靶向化合物具有高度状态依赖性,其高亲和力结合取决于与VSD-IV上升状态的相互作用,该状态控制着通道的失活状态7。在电压钳实验中,为了准确测量亚型分子选择性,必须控制通道状态并施加跨膜电压以确保化合物结合时具有等效的状态占据率。为此,我们评估了各亚型的稳态可用性,并获取了 与斜率参数(图1B和表S1)。随后在保持电位下测量了化合物XPC-7224、XPC-5462、PHY和CBZ的浓度响应曲线,该电位根据钠v通道可用性分数将通道维持在完全失活电位(图1B)。钠v1.6化合物XPC-7224的选择性特征显示,其对钠v1.6的 值为 (95 ,效力较其他所有测试钠v亚型强 倍(图1C)。而以XPC-5462为代表的不同化学系列的抑制选择性特征表明,其对钠v1.2和钠v1.6具有等效抑制作用, 值均处于低纳摩尔范围(钠v1.2的IC 为 ,钠v1.6的I 为 )(图1D及表1)。
这些化合物对小鼠 通道的效价与人源通道极为相似,表明不存在同源差异(图S1和表1)。未对PHY和CBZ采用完全失活状态方案,因为这两种化合物的抑制作用会消失,在持续20或60毫秒的超极化至 期间(该步骤用于在全失活状态方案中恢复通道可用性),PHY和CBZ的效能测试采用以下方式:在测试脉冲前将细胞维持在通过实验确定的各细胞失活电位 持续10秒,从而测量通过与失活状态高亲和力结合所促进的抑制效果。PHY和CBZ的效能显著较低且基本无选择性,其对CNS通道和 的 值差异在3倍以内(图1E、F,表1)。这些结果证实了该新型XPC化合物相较于传统钠通道靶向抗痉挛药物,具有分子选择性及更强的药效。
XPC-7224与XPC-5462的效价呈现高度失活状态依赖性。我们随后在膜电位为 的条件下测试了XPC化合物的效价,该电位可使通道在静息状态下完全开放。对于XPC-7224,Nav1.6的效价从0.078μM降至>100 μM(降幅达>1000倍;基于 个细胞);对于XPC-5462,则从0.010μM降至 (基于n =32个细胞),这表明二者与通道失活状态的相互作用表现出极强的偏好性(图1G)。
XPC-7224和XPC-5462的高效抑制依赖于 中VSD-IV-S4上的第四个带正电荷残基(R1626)。先前在 1.7中使用X射线晶体学的研究确定,一种芳基磺酰胺(GX-674)化合物结合VSD-IV段。37VSD-IV和化合物之间的这种相互作用通过带负电荷的磺酰胺基团的GX-674与VSD-IV-S4上第四个带正电荷的精氨酸侧链(R1608)相互作用。37功能研究还证明,通过丙氨酸诱变(h1.7-R1608A)中和R4电荷会导致高亲和力结合丧失。36,37这些XPC选择性抑制剂同样属于芳基磺酰胺类(图1A),但其化学骨架与先前开发的 靶向化合物存在显著差异。为验证对应的 VSD-IV-S4精氨酸侧链(R1626)是否构成这些化合物的高亲和力结合位点,我们检测了 (R1626A)突变体。发现该突变体的失活门控更稳定,其 值较野生型左移 (图S2)。R1626A点突变导致效能降低 倍:XPC-7224的 值为 , 29个细胞),XPC-5462的 值为 ( CI 27. , 个细胞)(图1H)。因此, VSD-IV-S4上的这一带正电荷残基构成了这些化合物高亲和力结合相互作用的关键部分。这些发现凸显了XPC化合物与GX-674作用于 的相似性,从而确立了该相互作用的分子基础。XPC-7224和XPC-5462与 强状态依赖性结合的基础。
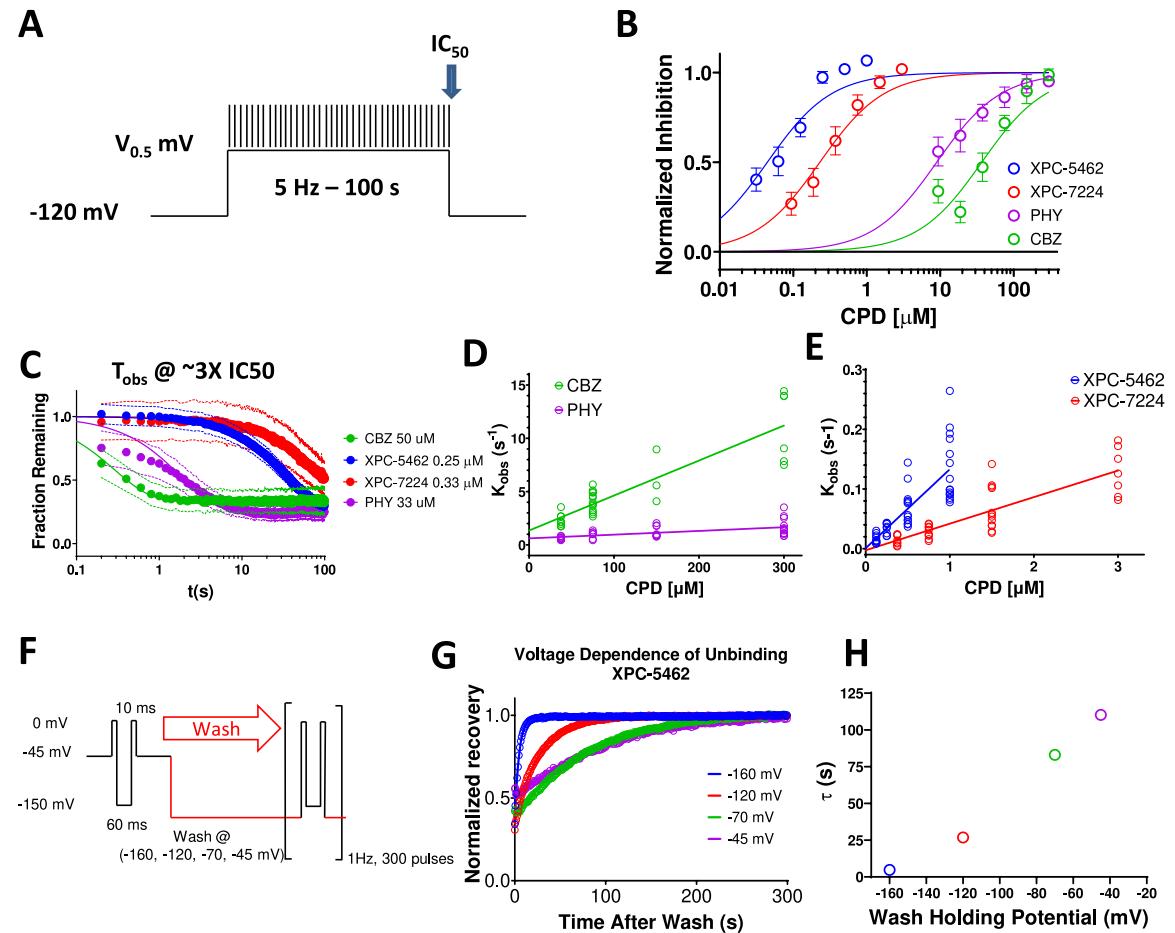
图3.VSD-IV结合型XPC化合物表现出比典型孔隙结合型ASM更慢的动力学特征。(A)用于确定化合物在 保持电位下平衡动力学的方案:将电压阶跃至 并维持100秒,同时以5Hz频率施加测试脉冲以评估抑制速率。(B)经希尔方程拟合的标准化浓度响应曲线,用于计算XPC-5462( 个细胞)、XPC-7224( 个细胞)、PHY( 个细胞)和CBZ( 个细胞)对 的 值。©化合物在约 倍 浓度下的标准化平衡速率,圆点表示 置信区间(每种化合物 个细胞)。(D,E)通过直线方程拟合 与浓度关系曲线,得到CBZ(每个浓度 个细胞)、PHY(每个浓度 个细胞)、XPC-7724(每个浓度 个细胞)和XPC-5462(每个浓度 个细胞)的 值。(F)用于评估解离速率电压依赖性的方案:使化合物在 处与处于失活状态的CPD平衡,随后在阶跃电压的同时冲洗CPD。(G)不同保持电压下标准化分数恢复与时间的关系曲线,经单指数函数拟合。(H)冲洗过程中恢复速率的时间常数与膜电压的关系图。
XPC-7224与XPC-5462延缓失活恢复。既往研究证实,通道重新开放前必须发生从失活中的恢复过程,该过程的时间依赖性反映了VSD-IV结构域回归至下沉状态43。我们测量了化合物存在情况下 失活恢复的浓度依赖性,发现这两种化合物引入了通道恢复的慢速组分 (图2A-D)。XPC-7224与XPC-5462的 为 秒,PHY的T 为 秒,而CBZ在恢复速率中未显现慢速组分。随着化合物浓度升高,恢复过程的 分数相应增加。图2E展示了 浓度依赖性的曲线,表明该参数未随浓度发生显著变化。由于配体解离速率 具有浓度非依赖性,这些数据证实 反映了化合物在-120 电位下的解离速率,该过程是VSD-IV回归静息状态的限速步骤。CBZ未检测到变化则表明其解离该化合物的速率比通道从失活中恢复的速率快得多。
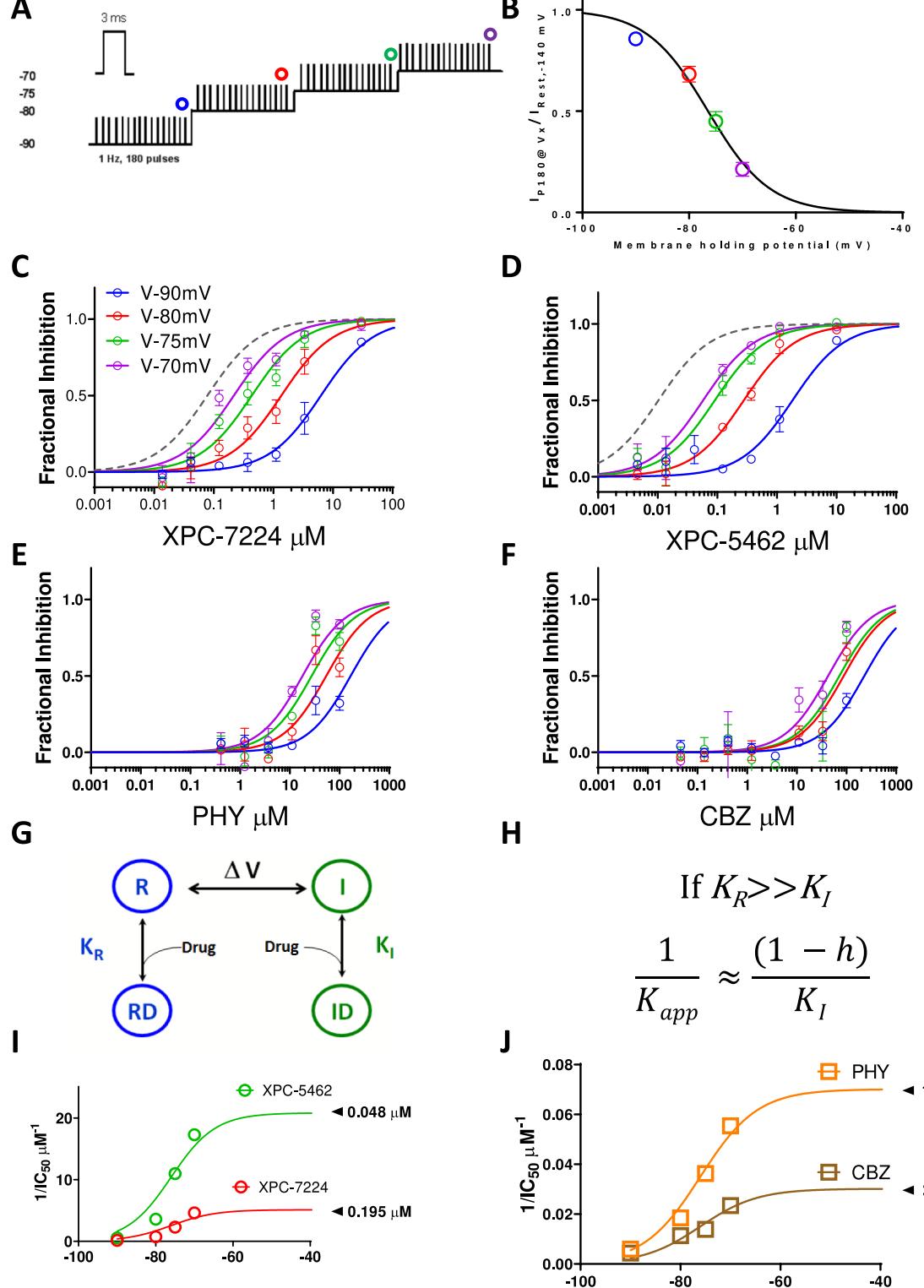
图4. 抑制的状态依赖性。(A)用于评估效能状态依赖性的实验方案。在每个保持电位下施加180个持续 、频率1Hz的0 脉冲。(B)前述方案中失活的电压依赖性。在各保持电位维持3分钟后,测量通道可用性并将其归一化至静息态可用性,随后与电压关系进行绘图 个细胞)。(C-F)在不同电压下第180个脉冲时测量的归一化通道分数抑制情况,分别对应XPC-7224( 每个浓度4-7个细胞)、XPC-5462( 每个浓度3-8个细胞)、 每个浓度3-10个细胞)和CBZ( 每个浓度3-9个细胞)。灰色虚线表示在 条件下完全失活 通道的曲线拟合结果(图1)。(G)用于模拟化合物与失活态或静息态通道相互作用的四态模型。(H)模型预测的效能随状态占据率变化情况。(I,J)采用模型拟合的 关系图。
我们通过使用1.7秒时的恢复情况(该时间点最能体现 比例)来量化其浓度依赖性分离了 和 -—其中未结合通道已恢复而结合通道尚未恢复(图2F)。该表征方式显示 随浓度变化的分数比,并通过希尔方程进行分析以
得出XPC-7224和XPC-5462的 值分别为 (95% CI 0.836-1.29 μM, 个细胞)与0.322μM( CI0.252-0.413μM,n=63个细胞),PHY的ICμ值为6.94 μM(95%CI3.10-14.2μM,n=109个细胞)。值得注意的是,XPC-7224和XPC-5462的这些 值低于表1和图1中所示完全失活状态的效能,但与PHY的 值相近。这些数据表明XPC化合物需要超过10秒才能与通道的失活状态完全达到平衡,而PHY在10秒内即可实现平衡。这表明XPC化合物相比PHY具有更慢的结合动力学特性。
XPC-7224和XPC-5462与PHY及CBZ相比具有更慢的结合动力学。平衡 测量通常被用作解离常数 的替代指标,其假设抑制与结合紧密耦合。然而平衡测量无法提供结合动力学的信息,而结合动力学可能对药物的生理活性起重要作用,并由内在化学结合与解离速率 决定。 和 与配体结合或解离时穿越的过渡态能垒成正比,因此可揭示驱动效价的关键因素:是结合速率、解离速率还是两者共同作用。我们通过持续100秒 保持电位下的抑制追踪方案,测量了化合物与 通道的结合动力学((图3A))。各化合物在 (保持电位100秒时的效价如)图3B所示。为在与平衡 (成比例的浓度下比较动力学参数,我们以约3倍各化合物 的浓度观测平均标准化抑制速率()图3C)。通过单指数函数拟合平均数据获得以下 值:XPC-5462:36.8秒 , 个细胞)、XPC-7224:84秒 秒, 个细胞)、CBZ:0.29秒( , 个细胞)、PHY:1.86秒 少, 个细胞)。CBZ和PHY分别比XPC化合物快 倍和 倍达到平衡,这凸显了传统孔道阻滞剂与我们XPC化合物在作用机制上的显著动力学差异。
通过评估从大约 (开始的更宽范围递增浓度下的 (图S3)),可以估算每种化合物的 。我们发现 具有浓度依赖性(图3D,E),这与准一级动力学反应方案预期一致—一该方案中浓度变化后的弛豫速率由 描述,其中[CPD]表示XPC浓度, 通过绘制 与浓度关系图,我们得到 (204的拟合参数:XPC-5462为 (( CI 1 ),XPC-7224为 S ( ),CBZ为0.328 ( ), HY为 )。值得注意的是,CBZ和PHY的 速率与XPC-7224和XPC-5462的 相近或更慢,表明XPC化合物更强效的作用由更稳定的结合和更长的驻留时间驱动(图3C)。因此,在等效浓度下的动力学差异由较慢的 与XPC化合物较低浓度的共同作用驱动,后者通过质量作用 )降低了平衡速率。
解离速率具有电压依赖性并反映化合物解离过程。由于神经元生理环境中的膜电压并非恒定,我们试图探究膜电压对 的影响。为直接评估 我们先将化合物与通道在 保持电位下平衡,每10秒施加测试脉冲,持续5分钟(图3F)。随后将膜电压同时钳制在负向保持电位,并将化合物溶液更换为对照溶液。实验使用接近 值 的XPC-5462进行,以确保冲洗步骤能完全清除微流控腔室内残留的化合物。XPC-5462冲洗后的电流恢复值被归一化至同批对照组细胞的电流恢复情况一一这些细胞仅暴露于溶剂载体,并在-45 保持电位期间累积了一定的失活(图3G)。通过单指数函数拟合归一化恢复曲线,可提取不同膜保持电位下的 (图3H)。更负的膜电位会加速XPC-5462的解离过程(图3H)。随着超极化作用增强对VSD-IV-S4结构域向下的作用力,高亲和力结合位点发生形变,导致化合物解离。
膜电位通过控制VSD-IV状态调节XPC-7224与XPC-5462的表观效能。为研究 在生理可达电压范围内的抑制性膜电压依赖性,在通道失活快速变化的电压条件下测量了化合物的表观效能 。通过阶梯式升压法从- 逐步增至 (各电压间隔180秒)评估效能(图4A)。给药前失活的电压依赖性特征为: 值 置信区间-77.0至 ),斜率5.76( 置信区间5.06-6.54, 个细胞)(图4B)。为探究 的膜电位依赖性,将末次(第180次)脉冲的标准化平均抑制率随化合物浓度变化的数据用希尔方程进行拟合。XPC-7224与XPC-5462的效能呈现显著膜电压依赖性:在 至 的 V电压范围内变化达100倍, 从低 级至nM级(图4C,D,表S2)。作为对照,图中以虚线标示了在-45 电压下完全失活状态的效能曲线。PHY与CBZ的IC50,app膜电压依赖性较低, 与 间仅相差10倍(图4E,F)。
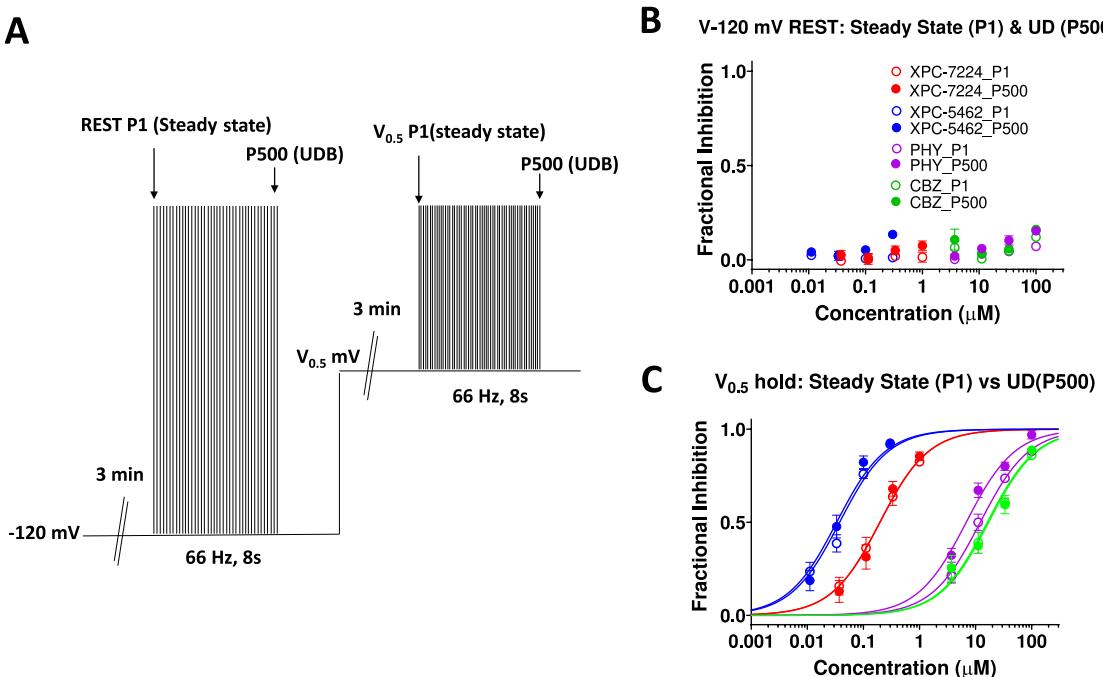
图5.从静息膜电位产生的稳态抑制足以实现抑制。(A)用于评估来自 或经验推导的 的稳态和使用依赖性抑制的方案。(B,C)在保持电位为 (B)或 ©时,归一化抑制在第一个脉冲(稳态)或第500个脉冲(使用依赖性)的浓度响应图。 个细胞每个浓度。
为了检验效能变化是否与失活态的相对可用性相关,我们测试了一个四态结合模型,该模型假设药物对失活状态的结合亲和力远高于静息状态(图4G,H)。4」该模型预测稳态亲和力 将按照图4H中的公式与通道处于失活状态的比例成正比变化,其中h代表图4B中的失活概率曲线。实验数据与该方程高度吻合,且推算的最大效能(图4I,J)与先前报道的失活状态 值相近(表1)。这些数据表明化合物的效能直接由通道处于失活状态的比例决定,并间接受膜电位调控XPC-7224与XPC-5462对钠电流的抑制不依赖于高频放电。为评估VSD结合剂的使用依赖性,我们采用了一种实验方案:分别测量静息状态和部分失活状态(经验推导的 ,更能代表神经元静息膜电位)下的使用依赖性(图5A)。所有细胞的平均 为 0 。在 保持电位下,四种化合物首次脉冲(稳态静息抑制)与第500次脉冲(使用依赖性抑制)的标准化电流抑制率表明,由于前述状态依赖性,任何浓度下均仅产生最小抑制(图5B)。图5C展示了V 保持电位下的部分失活稳态与使用依赖性效能。XPC-7224在 保持电位下的稳态抑制 (P1)为 M , 细胞);XPC-5462为 细胞);PHY为 细胞);CBZ为 细胞)。在 保持电位下,使用依赖性阻滞(P500)的 分别为: ) ;PHY ;CBZ M 。结果表明:无论是孔阻滞剂PHY还是VSD阻滞剂,在 或 条件下,其稳态效能与使用依赖性效能均无显著差异。这表明靶向VSD-IV的XPC化合物主要通过抑制稳态发挥作用,而非增强高频短脉冲下的抑制。鉴于选择性VSD结合剂在动物模型中已显示疗效4,这些数据表明抑制中等膜电位引发的过度兴奋并不需要依赖使用依赖性阻滞机制。
抑制Nav1.6或 与1.2能选择性抑制离体兴奋性皮质神经元。为
为测试这些化合物的细胞选择性,我们在脑切片中记录了体感皮层第5层兴奋性和抑制性神经元的内在兴奋性。选择性 抑制剂XPC-7224( 及 双效抑制剂XPC-5462( )可抑制兴奋性神经元的动作电位发放,但不影响抑制性中间神经元(图6A,B,D,E)。相比之下, 非选择性孔道靶向抑制剂CBZ同时抑制了兴奋性与抑制性细胞(图6C,F)。我们选择的化合物浓度较其在 条件下测得的效价高出约3倍(表S2),该电位值经液体接界电位校正后为 ,以匹配这些神经元的LJP校正静息膜电位(锥体细胞RMP为 ;快速放电中间神经元RMP为 n = 1 0 \mathrm { \ : \AA \ : } )。这些数据证实 抑制剂及 双靶点分子选择性抑制剂可作为特异性兴奋性神经元抑制剂。
CA1锥体神经元动作电位发放的抑制受膜电位调节。由于XPC-7224和XPC-5462是状态依赖性抑制剂(图4),我们推测它们在去极化膜电位下对神经元兴奋的抑制作用更强。为在体外验证该假设,我们在调节膜电位的同时评估了锥体神经元中动作电位发放的抑制情况。如图S4A(i,ii)、B和E(i,ii)、F所示,XPC-7224( 与XPC-5462( 均能抑制电流注入诱导的CA1锥体神经元动作电位发放,但值得注意的是其抑制效果弱于新皮层锥体神经元(图6)。膜电位去极化可降低动作电位数量(图S4A(ii)、D、E(ii)、H),这与我们的假设一致:这两种化合物在去极化状态下能稳定更大比例的 通道于失活状态。 和 抑制可抑制离体癫痫样活动。最后,我们通过MEA检测了这些化合物在抑制新皮质离体癫痫样事件中的功效,以评估选择性抑制完整网络中兴奋性神经元的效果(图S5)。我们发现XPC-5462和CBZ均能显著减少所有癫痫样放电(图S5E,G)。在 模型中,XPC-7224对总癫痫样放电有降低趋势但未达统计学意义 )(图S5E),而在4-AP模型中未见明显效果。这些数据表明,联合特异性阻断 和 通道亚型可显著抑制由 或4-AP诱导的网络癫痫样活动。
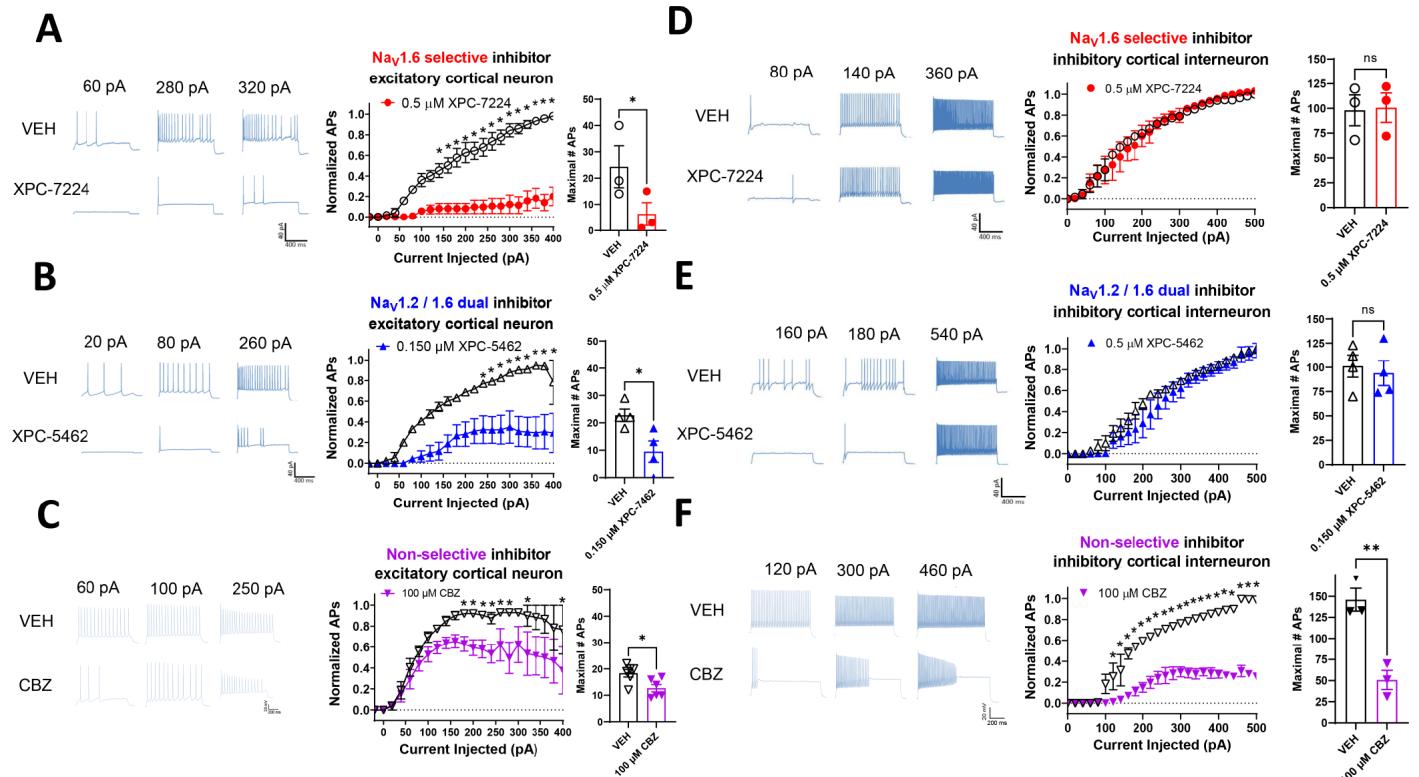
图6.靶向 及NaV1.6/1.2的化合物选择性抑制皮层兴奋性锥体细胞动作电位。(A-C)和快放电中间神经元(E、F)在指定浓度化合物孵育10分钟前后,基于选定去极化电流注射的皮层神经元电压钳记录代表性电压轨迹。中间面板显示输入-输出曲线,呈现同一细胞中动作电位发放数量(以载体对照组最大动作电位数为基准标准化)与去极化电流注射强度的关系。右侧面板展示载体或化合物条件下不同电流注射范围对应的绝对最大动作电位数。(A) 显著抑制锥体细胞动作电位发放 ,但不影响快放电中间神经元 )(D)。(B) 显著抑制锥体细胞动作电位发放 ),但不影响快放电中间神经元 (E)。© CBZ同时显著抑制锥体细胞 )与快放电中间神经元 )动作电位发放(B)。采用双因素方差分析及Bonferroni多重比较检验各组电流注射下的动作电位数量差异( )。采用学生双尾配对t检验验证各细胞在载体或化合物条件下最大动作电位数量的显著性( , )。
¶ 结论
在本研究中,我们提供了XPC-7224和XPC-5462的详细比较药理学和机制特征,它们代表了一类新的选择性N 抑制剂。开发这类化合物的动机是提高疗效并减少常见非选择性Nav抑制ASM药物的常见不良事件概况。32 近期,由Xenon公司研发的分子NBI-921352(其选择性谱与XPC-7224相似)在啮齿动物癫痫模型中显示出良好疗效,且相较于非选择性Nav抑制剂具有更优的耐受性抑制剂.4神经分泌生物科学公司正在开发选择性钠抑制剂作为癫痫疾病的潜在治疗方法.45,46
我们先前关于NBI-921352的研究工作已凸显该类化合物的选择性及体内药理特性,但未对其生物物理学特性与药理学机制进行深入表征。由于XPC-7224与NBI-921352具有相同的化学骨架,本文阐述的作用机制很可能适用于该化学骨架的所有化合物。XPC-5462的骨架结构与XPC-7224存在显著差异,因此具有不同的选择性特征—-包括对 的活性。然而如本研究所示,除选择性差异外,这两种化合物的作用机制几乎完全一致:它们作用于相同结合位点(图1H),在效价(图1C、D,表1)、动力学特征(图3C)及膜电压依赖性(图4)方面表现相似。这些药理学相似性表明,XPC-7224与XPC-5462可被视为具有相同的分子作用机制。
这些靶向VSD-IV的化合物与目前使用的靶向Nav的抗癫痫药物有几个关键区别。最为显著的是,这些化合物对 的分子选择性或对 和1.6的双重选择性,使其成为一类独特的钠通道调节剂。这些抑制剂有望转化为一种差异化的癫痫疗法。对心脏亚型 高达 倍的选择性可显著降低心脏风险特征。两种化合物对 的保留作用将减轻抑制性中间神经元活动被压制可能带来的负担。这非常理想,因为 电导的缺失正是驱动早期婴儿发病癫痫性脑病6型(即Dravet综合征)过度兴奋的病理生理机制。6,47除选择性外,这些化合物的效能范围( 较CBZ、PHY及其他靶向 的候选抗癫痫药物(如拉莫三嗪和拉科酰胺)至少高出一个数量级一一后者的效能范围在 之间。48,49
针对 和 靶点化合物的发现,是通过对最初靶向 和 的芳基磺酰胺支架进行渐进式药物化学驱动演化而实现的。39早期芳基磺酰胺的结合模式已通过 通道与配体的共结晶结构解析得以阐明,该位点位于控制 通道失活的VSD-IV激活态顶部的细胞外水相裂隙口袋中。37,38为评估XPC-7224与XPC-5462是否与 靶向化合物结合于相同位点,我们将 1.6中从Nav1.7晶体结构确定的芳基磺酰胺结合关键残基VSD-IV-S4精氨酸R1626突变为丙氨酸。该 R1626A突变体对XPC-7224和XPC-5462的效力均出现 千倍下降,证实这一关键结合相互作用在新支架中得以保留。
我们通过测量在化合物存在下- 处从失活恢复的速率,检验了XPC化合物与VSD-IV结合的紧密程度以稳定上升态。从失活恢复需要通道转换回静息状态,此时所有电压传感器均处于向下位置4。我们发现XPC-7224和XPC-5462引入了一个显著的较慢第二恢复组分,该组分不具有强浓度依赖性,但缓慢恢复电流的比例具有浓度依赖性(图2)。最直接的解释是VSD-IV处结合的通道比例随浓度增加,且结合通道的恢复速率反映了化合物在 处的解离速率。靶向孔道的 抑制剂同样能稳定失活态并延缓失活恢复35,41。我们观察到PHY(而非CBZ)引入了清晰可辨的缓慢恢复组分,表明CBZ解离速率快于失活恢复。 的时间常数与Tslow贡献比例的效价关系按 的顺序与化合物效价一致。这些数据表明,与PHY和CBZ相比,XPC化合物在通道上的解离速率显著减缓,停留时间明显延长。
平衡速率取决于结合速率、浓度以及解离速率,遵循公式 $ K _ { \mathrm { o b s } } = k _ { \mathrm { o n } } { } ^ { * } [ \mathrm { C P D } ] + k _ { \mathrm { o f f } } . ^ { 3 }$ 。因此,更快的 和/或 会提高平衡速率。通过比较浓度高于 三倍时的平衡速率(该浓度与在MES啮齿动物模型中抑制癫痫发作的E 脑浓度相近)4,50,我们发现这些XPC化合物的平衡速率远低于卡马西平和苯妥英(图3C)。出乎意料的是,尽管平衡速率较慢,XPC化合物的 速率却比孔道结合化合物更快。在 (的3倍处,图3F)。这表明更快的 和质量作用是导致CBZ和PHY 的平衡速率比XPC 化合物更快的主要原因。我们还发现 被超极化加速,这与化合物与VSD-IVUP状态结合的不稳定性一致(图3H-J)。
已有实验表明,这些化合物对结合IV号电压感应结构域(VSD-IV)失活态具有强烈偏好性,且其解离速率与膜电位相关(图3G)。因此,药物效能与膜电压存在显著依存关系(图4A-F)。通过在逐渐去极化的膜电位下进行测定,发现XPC化合物相较PHY和CBZ的效能显著提升。我们发现效能变化可通过四态模型完美拟合,该模型认为化合物与失活态的结合亲和力远高于静息态(图4G-J),这与先前关于钠通道v抑制剂的经典研究一致4。这表明效能与膜电压的关系取决于通道失活比例,而非直接电压依赖性(图4D)。这种依赖关系的重要推论是:化合物表观效能会因神经元膜电位分布、通道亚型及通道亚细胞定位的不同而产生差异26,51
据推测,对于包括癫痫在内的过度兴奋性疾病,使用依赖性阻滞可能是抑制剂分子的理想特性。在过度兴奋状态下,膜的快速尖峰放电和反复去极化会促使通道进入失活状态。有趣的是,当膜电压通过LJP校正保持在 时,XPC化合物在高频刺激后并未对 1.6表现出效价的显著提升(图5))。这表明XPC化合物的稳态抑制作用足以在癫痫依赖性尖峰放电和去极化发生前抑制过度兴奋状态。事实上,即便是平衡速度更快的PHY化合物,在高频放电后抑制率仅提升 这与图4中四态模型的预测一致:从 电位转变为完全失活电位时,稳态表观效能仅能提升2倍,这将在非饱和浓度下带来约 的抑制率提升(图5)。这些数据表明,对于这些靶向Nav的抗癫痫药物而言,使用依赖性可能并非其发挥疗效的必要条件。
接下来,我们在更接近生理环境的脑切片中,测试了这些化合物抑制体感皮层神经元内在兴奋性的能力。如前所述, 和 主要在兴奋性神经元中表达,而 主要表达于抑制性GABA能神经元中。单独使用XPC-7224抑制 ,或联合使用XPC-5462同时抑制 与 ,均能降低皮层锥体细胞的内在兴奋性,同时不影响快速放电的抑制性神经元 (图6A,B)。这表明XPC化合物确实通过分子选择性实现了细胞选择性。我们认为这一特性极具价值,因为它能保持内源性抑制性神经元系统的完整,有助于维持兴奋-抑制平衡。相比之下,非选择性钠通道抗癫痫药物卡马西平同时抑制了兴奋性和抑制性神经元的兴奋性(图6C),这可能导致安全裕度降低。4此外,我们证明了CA1锥体神经元在去极化状态下动作电位抑制水平增强(图S4),这支持了我们体外状态依赖性实验(图4)的可转化性。这一特性对于抑制接受过度去极化兴奋性输入兴奋性神经元的超兴奋性具有积极意义。
为了进一步分析这些化合物的效果,我们在两种体外癫痫模型中评估了疗效,其中自发性癫痫样活动是通过从切片中去除细胞外 或添加4-AP来诱发的。在两种模型中,XPC-5462和CBZ都表现出类似的效果,对癫痫样活动和癫痫样放电的频率提供了强有力的抑制(图S5D-S5G)。令人惊讶的是,仅使用XPC-7224抑制 并未显著降低频率或放电,尽管在4-AP模型中放电有减少的趋势。XPC-7224和XPC-5462的差异特征表明,在这些体外模型中,可能需要抑制 通道来抑制癫痫样活动。我们先前已经表明,选择性抑制 在体内使用其他化合物(包括XPC-7224)时能有效预防癫痫发作。4,50XPC-7224在体外癫痫模型中缺乏效果的原因尚不清楚,需要进一步研究。我们推测,抑制体外癫痫样活动可能需要更大比例地抑制总兴奋性细胞N 电流,该电流由 和 组成,并且 具有较高的相对丰度。52
总之,本研究对一类新型选择性 通道抑制剂进行了详细的比较药理学表征。我们发现XPC-7224和XPC-5462具有不同的分子选择性特征:前者靶向 ,后者同时靶向 和 。这些化合物通过结合VSD-IV并稳定通道失活状态的相同机制发挥抑制作用,该状态在化合物解离前将持续保持。这导致其效能具有强烈的状态依赖性及膜电位依赖性。这些化合物的动力学特征与现有靶向 的抗癫痫药物(CBZ和PHY)存在显著差异,其平衡速率更慢,由缓慢解离驱动且在通道上的驻留时间更长。我们发现 电流在 电位下的抑制程度与完全失活通道相当,表明这些化合物可能通过稳态抑制而非使用依赖性阻断发挥作用。这一点通过抑制静息膜电位下脑切片中神经元固有兴奋性得到证实一一仅兴奋性神经元被XPC化合物抑制。在离体癫痫模型中,仅XPC-5462和CBZ表现出强效癫痫抑制效果,表明N 抑制在这些模型中具有重要作用。目前尚不清楚离体癫痫模型对临床转化的影响,但需要重点指出的是,选择性 抑制已被证实在啮齿类癫痫模型中有效4,甚至 抑制可能是体内功效的主要驱动因素5。最后我们提出,这类新型选择性 靶向化合物将提升临床疗效并提高不良反应阈值,因为 介导的抑制性神经元兴奋性不会受到干扰。
¶ 材料与方法
细胞系。稳定转染的FreeStyle 293F细胞(Thermo Fisher),用于电生理学实验,最多传代30次,在含有 胎牛血清和 Geneticin(G418)的DMEM(Gibco Invitrogen)中,于 和 的条件下维持。
动物。本研究使用雄性和雌性CF-1(查尔斯河)小鼠(年龄3-5周)。小鼠饲养在独立通风笼具中,采用12小时光照、12小时黑暗的光照周期。动物可自由获取食物和水ad libitum。所有动物操作及实验均遵循加拿大动物管理委员会指导方针的核准方案进行。
¶ 电生理学
细胞系转染。使用Lipofectamine(赛默飞)将包含特定人类钠通道 亚基全长cDNA的表达载体转染至稳定细胞系。所用 稳定细胞系及辅助载体对应的GenBank登录号为:人类 (NM_006920);人类 1.2(NM_021007);人类 (NM_198056);人类 (NM_014191);小鼠 (NM_001077499);人类 (NM_002977);人类 (NM_0069220)。所有细胞系均共表达人类 亚基(NM_199037)。另将人类 通道与人类FHF2B(NM_033642)共表达以增强功能性表达,人类 通道则与Contactin1(NM_001843)共表达以提升功能性。细胞在多西环素(西格玛奥德里奇)诱导24小时后用于自动化膜片钳实验。
钠v通道自动化Qube平面膜片钳检测。膜片钳检测使用Qube384(Sophion)自动化电压钳平台进行,采用单孔板。数据采集通过Qube 384(Sophion)自动化电压钳平台配合单孔板完成。为测量失活状态抑制,膜电位被维持在失活完全发生的电压值。各钠通道亚型用于量化化合物抑制的电压如下:钠 ( 、钠v1.1 ( )、钠v1.2( )、钠v1.3( )、钠 ( 及钠 ( 。通过短暂复极化至负电压( )持续20毫秒(针对钠 、钠v1.7、钠v1.3)或60毫秒(针对钠v1.1、钠v1.2、钠v1.6)使通道从快速失活中恢复,随后施加10毫秒测试脉冲至-20或 以量化化合物抑制。复极化步骤使未结合化合物的通道从快速失活恢复,而化合物结合通道在后续测试中仍保持抑制状态。Qube作为自动化电生理仪器,其细胞选择与实验过程采用盲法随机化操作。所有后续数据过滤与分析均通过自动过滤器处理,并应用于特定Qube运行的全数据集。应用了最小封接电阻的适当过滤器 (通常为 膜电阻与 电容),串联电阻补偿设置为 。脉冲协议运行频率为1赫兹(针对 、 、 、 )或0.04赫兹(针对钠v1.6、钠v1.1、钠v1.2)。
为构建浓度反应曲线,在 载体中处理20分钟后确立基线电流,并测定完全抑制反应幅度。实验结束时,向每个孔中加入河豚毒素(TTX, )或用于 通道的丁卡因( 。随后将化合物以单一浓度暴露20分钟。每个实验板预留六分之一的孔作为空白对照,用于校正每次实验中信号的非特异性漂移(即信号衰减)。对于所有通道亚型,化合物在20分钟的孵育时间内均能达到稳态抑制效果。
当前抑制值 根据公式1,分别归一化至载体 和由超最大TTX( 或丁卡因(针对
5)添加反应定义的完全反应:
随后,该标准化抑制值被进一步归一化至检测范围,以校正仅暴露于溶媒20分钟的细胞中出现的衰减效应,具体计算方法如下:
其中:
范数,跨度 当前响应在测定测量范围内归一化。
I归一化CPD 存在化合物时的归一化响应 无化合物时的归一化响应
该归一化处理确保数据范围在0到1之间,且曲线走势无下降。将同一浓度下所有细胞记录得到的归一化数据归为一组,通过GraphPadPrism8软件进行绘制,并采用以下希尔方程变体计算分组数据的IC50值:
,其中:Y 是在化合物存在下钠电流被阻断的比例。
[CPD] 化合物的浓度 和 浓度
表示单独载体组中钠电流的“减弱”,在这种情况下等于0,因为抑制作用已归一化至该范围。
希尔斜率固定为1。其他Qube方案的归一化均以相同方式执行。除非另有说明,我们报告了从拟合曲线到平均数据得出的 的 置信区间,并注明了用于拟合的细胞总数 N = _
从失活中恢复的情况通过一个去极化预脉冲至 持续10秒(保持电位为 )后,施加一个至 V的测试脉冲进行测量。该化合物在 保持电位下的平均归一化电流恢复曲线被绘制出来,并用双指数函数进行拟合。Qube 实验均在 下进行。
针对 、Nav1.2、Nav1.3和Nav1.6细胞系研究的记录溶液组成如下:胞内溶液(ICS):5mMNaCl、10 mMCsCl、120 mMCsF、0.1 mMCaCl、2 mMMgCl210mMHEPES(4-(2-羟乙基)-1-哌嗪乙磺酸缓冲液)、10mMEGTA(乙二醇四乙酸);采用CsOH调节至pH7.2。胞外溶液(ECS):140 mMNaCl、5mMKCl、2 mMCaCl、1mMMgCl、10 mMHEPES;调节至pH 7.4。使用 计算得到这些溶液的液接电位为 ,除非文本中另有说明,否则电压数据未作校正。在 .5和 研究中采用了反向 梯度溶液,因为该条件能提高技术成功率,并通过质量控制筛选与检测的细胞数量。这种改善源于密封电阻的提升以及对 和 细胞系中大电流的电压钳制优化,从而减少了串联电阻补偿可能引发的振铃现象。细胞内液: NaF、 、 、 MHEPES、 EGTA;用CsOH调节至 \mathrm { p H } 7 . 2 \AA 细胞外液: 胆碱氯化物、 、 、 HEPES;用NaOH调节至 。所有细胞内液与细胞外液的渗透压分别通过葡萄糖调节至300和 3 1 0 \mathrm { m O s m } / \mathrm { k g } _
脑片膜片钳电生理学-皮层记录。采用既往发表方法改进的标准流程,从3至5周龄CF-1小鼠制备矢状旁皮层脑切片。简要流程如下:通过异氟烷深度麻醉小鼠并实施断头术。取出脑组织后立即置于冰镇人工脑脊液(aCSF)中,该溶液成分包含(单位mM): 、 : 、 -葡萄糖,pH值调至7.3,采用蔗糖将渗透压调整至 。所有溶液均持续灌注 w/w 与 w/w 混合气体进行饱和处理,并维持 w/w 的气体环境。使用振动切片机(TedPella公司)制备 厚度的矢状旁切片。切片完成后,将脑片置于维持舱中,在 水浴内孵育15分钟。
在室温下孵育60分钟后,选择一个脑片并放置在直立显微镜(SliceScope Pro 20oo,Scientifica)的载物台上。脑片持续灌注室温aCSF,其中含有 DMSO作为载体对照,并用 充氧。使用明场显微镜观察脑片,并从新皮层第5层选择一个健康的神经元。使用含有内部溶液的移液管(浴槽电阻4-6MΩ)实现全细胞配置。在电流钳模式下施加刺激,包括一系列10 的方波脉冲,起始于 ,并以 pA的增量增加(脉冲间隔 )。内部溶液包含(单位 ): ,10 HEPES,4 0.3 Tris-GTP, 0.2 EGTA, ,使用KOH或HCI调节,渗透压为 。计算得出的这些溶液的LJP为 。实验在室温 下进行。
脑片膜片钳电生理记录-CA1区记录。海马区脑片取自3至5周龄C57BL/6雄性小鼠,采用振动切片机(莱卡VT1200)在 条件下制备。切片溶液成分为(单位mM):216蔗糖、 、 、 0: 、11葡萄糖、 (,pH值7.2-7.4;渗透压 ),持续通入碳合气。含海马区的冠状切片厚度为 ,制备时推进速度 ,振动幅度 。随后将切片转移至浴槽溶液(人工脑脊液aCSF),其成分为(单位mM): 、1 、10葡萄糖、 ;渗透压 ,pH值7.2-7.4。持续通入碳合气,并在 下恢复30分钟。
在电生理实验中,采用P-2000拉制仪(Sutter Instrument)控制玻璃电极,使尖端电阻达到 。电极内液成分包含(单位mM): -葡糖酸盐、9HEPES、0. 、 、0.1EGTA、14 Tris-磷酸肌酸、4 Na-ATP、0.3 tris-GTP;渗透压 ,pH值7.2-7.25。浴槽溶液(人工脑脊液)成分包含(单位mM):129NaCl、 PO、 、2 CaC1、10葡萄糖、26NaHCO;渗透压 ,pH值7.2-7.4,持续通入碳合气。电生理数据通过Multiclamp 700B放大器(MolecularDevices)在 条件下采集,采样频率 ,滤波频率 。在全细胞模式建立前,于吉欧封接电压钳状态下测量快电容并补偿90 电极电容。电流钳记录过程中,所有实验的串联电阻均控制在 以内,桥平衡补偿 液接电位在数据采集后进行校正。动作电位检测阈值为 。
在完成车辆内记录后,并保持对同一神经元的膜片钳位时,将浴液从含 DMSO的人工脑脊液更换为含测试化合物的人工脑脊液。脑切片在循环化合物溶液中孵育10分钟后,重复进行方波刺激序列。工作母液用DMSO配制,浓度为
所有数据分析均使用ClampFit10.7(MolecularDevices)离线完成。数据以均值±标准误表示。针对每次扫描,记录诱发动作电位的数量,并将其作为电流注入(从-20pA开始)的函数进行绘制,最后归一化至最大载体响应值。由此生成的"输入/输出"曲线 (即"I-O"曲线)清晰展示了刺激强度与动作电位频率之间的关联关系。
多电极阵列(MEA)记录。使用了4至8周龄的雄性和雌性CF-1小鼠。小鼠在用异氟烷麻醉后,通过颈椎脱位法处死。然后取出大脑并储存在冷切割液中(单位: :, ;1. ;10葡萄糖。使用莱卡VT1200振动切片机(德国Nussloch)制作了包含体感皮层的 水平切片。然后将切片转移到保持室中,在室温下于人工脑脊液(ACSF)中孵育1-2小时,人工脑脊液成分(单位:mM)为: ; : ;10 葡萄糖。所有溶液均持续通气以饱和碳氧气体( 和 )。
MEA记录在3BrainBioCAMDupleX系统(瑞士)上进行,使用具有4096个电极、间距为 微米的3BrainAccuraHD-MEA芯片。将脑片放置于电极上,并在顶部放置琴夹以轻柔地将脑片压向记录电极。脑片持续灌注人工脑脊液(aCSF),并采用无镁²+aCSF或 微米4-氨基吡啶诱导50分钟内的癫痫样活动。在移除镁2+或添加4-氨基吡啶前,脑片分别预先在含 DMSO的aCSF或含化合物溶液中灌注10分钟。记录信号来自整个脑片区域,实验在 条件下进行,溶液以最小5.0毫升/分钟的速率持续灌注。信号以 采样,高通滤波器设为 利用Xenon局部场电位分析平台54对癫痫样发作事件及痫样活动进行分析。电生理记录覆盖大脑切片的全新皮质区域,采样间隔为 微米。当高频节律性爆发放电伴随持续至少10秒的高频信号时,该痫样活动被判定为癫痫样发作事件。所有记录中观察到的病理性放电均被视为痫样放电纳入分析范畴。
数据的定量与统计分析。如所示,使用GraphPad Pris 或ClampFit10.7(MolecularDevices)进行数据定量分析。定量数据均以均值 标准误表示。所用细胞或脑切片数量已在相应图注或表格中注明。显著性检验采用双向方差分析后接邦费罗尼多重比较检验,或根据图注说明采用学生双向配对t检验。
安全性。所报告的工作未涉及任何新的或重大的危险源或风险。
¶ 相关内容
*s支持信息
支持信息可在 https://pubs.acs.org/doi/10.1021/acschemneuro.3c00757免费获取。
亚型稳态失活特性表、化合物效能膜电压依赖性表、XPC-5462与XPC6624对小鼠 的效能浓度反应曲线、 野生型与 (R1626A)点突变体的稳态失活曲线、化合物动力学评估浓度依赖关系图、海马CA1锥体细胞动作电位发放抑制的补充结果、体外癫痫发生模型中化合物作用的多电极阵列结果 (补充材料)
¶ 作者信息
-
通讯作者 塞缪尔·J·古德柴尔德(Samuel J. Goodchild)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
- ORCID:orcid.org/0000-0001-9805-1743
- 电子邮件:s.goodchild@xenon-pharma.com
-
诺亚·格雷戈里·舒亚特(Noah Gregory Shuart)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
-
亚伦·D·威廉姆斯(Aaron D. Williams)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
-
叶文磊(Wenlei Ye)
- 所属机构:神经分泌生物科学公司(Neurocrine Biosciences),美国加利福尼亚州圣地亚哥市92130
-
R·莱利·帕单什(R. Riley Panchish)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
-
梅根·索里亚诺(Megan Soriano)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
-
萨姆拉特·托塔(Samrat Tota)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
-
雅内特·梅泽约娃(Janet Mezeyova)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
-
马修·瓦尔德布鲁克(Matthew Waldbrook)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
-
理查德·迪安(Richard Dean)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
-
蒂洛·福肯(Tilman Focken)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
- ORCID:orcid.org/0000-0003-1993-2476
-
穆罕默德-礼萨·戈瓦努(Mohammad-Reza Ghavanloo)
- 所属机构1:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
- 所属机构2:生物医学生理学与运动机能学系,西蒙弗雷泽大学(Simon Fraser University),加拿大不列颠哥伦比亚省伯纳比市V5A 1S6
- 所属机构3:神经病学系,耶鲁大学(Yale University),美国康涅狄格州纽黑文市06519
- ORCID:orcid.org/0000-0002-2171-0744
-
彼得·C·鲁本(Peter C. Ruben)
- 所属机构:生物医学生理学与运动机能学系,西蒙弗雷泽大学(Simon Fraser University),加拿大不列颠哥伦比亚省伯纳比市V5A 1S6
-
菲奥娜·斯科特(Fiona Scott)
- 所属机构:神经分泌生物科学公司(Neurocrine Biosciences),美国加利福尼亚州圣地亚哥市92130
-
查尔斯·J·科恩(Charles J. Cohen)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
-
詹姆斯·恩普菲尔德(James Empfield)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
-
JP·约翰逊(JP Johnson)
- 所属机构:细胞与分子生物学系,氙气制药公司(Xenon Pharmaceuticals),加拿大不列颠哥伦比亚省伯纳比市V5G 4W8
完整联系信息见:https://pubs.acs.org/10.1021/acschemneuro.3c00757
¶ 资金
氙制药公司(Xenon Pharmaceuticals,Inc.)为本研究提供资金支持,并参与了研究设计、科研实施、数据分析、数据收集、结果解读、文献审阅及出版批准工作。MG获得MitacsAccelerate奖学金(IT10714)和加拿大自然科学与工程研究理事会(NSERC)研究生奖学金(535333-2019)的资助。PR获得加拿大自然科学与工程研究理事会(NSERC)科研基金(RGPIN03920)的支持。
¶ 参考文献
- Bean, B. P. 哺乳动物中枢神经元的动作电位。Nat. Rev. Neurosci. 2007, 8 (6), 451-465.
- Hodgkin, A. L.; Huxley, A. F. 膜电流的定量描述及其在神经传导与兴奋中的应用。J. Physiol. 1952, 117 (4), 500-544.
- Hille, B. Ion Channels of Excitable Membranes;牛津大学出版社,1992.
- Johnson, J. P.; Focken, T.; Khakh, K.; 等. NBI-921352-一种首创的选择性钠通道抑制剂,可预防Scn8a功能增益型小鼠、野生型小鼠和大鼠的癫痫发作。Elife 2022, 11, e72468.
- Trimmer, J. S.; Rhodes, K. J. 电压门控离子通道在哺乳动物大脑中的定位。Annu. Rev. Physiol. 2004, 66, 477-519.
- Yu, F. H.; Mantegazza, M.; Westenbroek, R. E.; 等. 婴儿严重肌阵挛性癫痫小鼠模型中GABA能中间神经元钠电流降低。Nat. Neurosci. 2006, 9 (9), 1142-1149.
- Sanders, S. J.; Campbell, A. J.; Cottrell, J. R.; 等. SCN2A介导疾病的认识与治疗进展。Trends Neurosci. 2018, 41 (7), 442-456.
- Catterall, W. A. 钠通道、遗传性癫痫与抗癫痫药物。Annu. Rev. Pharmacol. Toxicol. 2014, 54, 317-338.
- Gardella, E.; Moller, R. S. SCN8A相关疾病的表现遗传谱、治疗选择及预后。Epilepsia 2019, 60 (3), S77-S85.
- Hammer, M. F.; Wagnon, J. L.; Mefford, H. C.; Meisler, M. H. SCN8A相关脑病性癫痫。收录于GeneReviews(®), Adam;M., P; Ardinger, H. H.; 等编,1993.
- Johannesen, K. M.; Gardella, E.; Encinas, A. C.; 等. 中间型SCN8A相关癫痫的疾病谱系。Epilepsia 2019, 60 (5), 830-844.
- Kearney, J. A.; Plummer, N. W.; Smith, M. R.; 等. 钠通道基因Scn2a功能增益突变导致癫痫发作和行为异常。Neuroscience 2001, 102 (2), 307-317.
- Begemann, A.; Acuna, M. A.; Zweier, M.; Vincent, M.; Steindl, K.; Bachmann-Gagescu, R.; Hackenberg, A.; Abela, L.; Plecko, B.; Kroell-Seger, J.; 等人. SCN2A变异导致智力残疾或癫痫表型的独特功能特征再获确证。Mol. Med. 2019, 25 (1), 6.
- Sugawara, T.; Tsurubuchi, Y.; Agarwala, K. L.; Ito, M.; Fukuma, G.; Mazaki-Miyazaki, E.; Nagafuji, H.; Noda, M.; Imoto, K.; Wada, K.; 等人. 钠通道αII亚基基因Na(v)1.2的错义突变导致热性及无热性癫痫患者通道功能障碍。Proc. Natl. Acad. Sci. U. S. A. 2001, 98 (11), 6384-6389.
- Ben-Shalom, R.; Keeshen, C. M.; Berrios, K. N.; An, J. Y.; Sanders, S. J.; Bender, K. J. 对功能的拮抗效应揭示自闭症谱系障碍与婴儿癫痫患者SCN2A变异的差异机制。Biol. Psychiatry 2017, 82 (3), 224-232.
- Catterall, W. A. 电压门控钠通道60年:结构、功能与病理生理学。J. Physiol. 2012, 590 (11), 2577-2589.
- Chanda, B.; Bezanilla, F. 追踪骨骼肌钠通道激活过程中电压依赖性构象变化。J. Gen. Physiol. 2002, 120 (5), 629-645.
- Armstrong, C. M.; Bezanilla, F. 钠通道失活。II. 门控电流实验。J. Gen. Physiol. 1977, 70 (5), 567-590.
- Bezanilla, F.; Armstrong, C. M. 钠通道失活。I. 钠电流实验。J. Gen. Physiol. 1977, 70 (5), 549-566.
- Capes, D. L.; Goldschen-Ohm, M. P.; Arcisio-Miranda, M.; Bezanilla, F.; Chanda, B. 结构域IV电压传感器移动对钠通道快速失活具有充分性和速率限制性。J. Gen. Physiol. 2013, 142 (2), 101-112.
- Bean, B. P. 螯虾巨轴突钠通道失活:通道必须先开放后失活吗? Biophys. J. 1981, 35 (3), 595-614.
- Mickus, T.; Jung, H.; Spruston, N. 大鼠海马CA1锥体神经元慢累积性钠通道失活特性。Biophys. J. 1999, 76 (2), 846-860.
- West, J. W.; Patton, D. E.; Scheuer, T.; Wang, Y.; Goldin, A. L.; Caterall, W. A. 快速通道失活所需的疏水性氨基酸残基簇。Proc. Natl. Acad. Sci. U. S. A. 1992, 89 (22), 10910-10914.
- Pan, X.; Li, Z.; Zhou, Q.; Shen, H.; Wu, K.; Huang, X.; Chen, J.; Zhang, J.; Zhu, X.; Lei, J.; 等人人. 电压门控钠通道与β1复合物结构。Science 2018, 362, 6412.
- Shen, H.; Zhou, Q.; Pan, X.; Li, Z.; Wu, J.; Yan, N. 近原子分辨率真核电压门控钠通道结构。Science 2017, 355, 6328.
- Hu, W.; Tian, C.; Li, T.; Yang, M.; Hou, H.; Shu, Y. Na(v)1.6和Na(v)1.2在动作电位起始与反向传播中的独特贡献。Nat. Neurosci. 2009, 12 (8), 996-1002.
- Ragsdale, D. S.; McPhee, J. C.; Scheuer, T.; Catterall, W. A. 局部麻醉剂、抗心律失常药和抗惊厥药物阻断电压门控通道的共同分子决定簇。Proc. Natl. Acad. Sci. U. S. A. 1996, 93 (17), 9270-9275.
- Ragsdale, D. S.; Avoli, M. 钠通道作为抗癫痫药物的分子靶点。Brain Res. Brain Res. Rev. 1998, 26 (1), 16-28.
- Li, Z.; Jin, X.; Wu, T.; Huang, G.; Wu, K.; Lei, J.; Pan, X.; Yan, N. 抗心律失常药奎尼丁阻断人心脏钠通道的结构基础。Angew. Chem., Int. Ed. Engl. 2021, 60 (20), 11474-11480.
- Ragsdale, D. S.; McPhee, J. C.; Scheuer, T.; Catterall, W. A. 局部麻醉剂状态依赖性阻断通道的分子决定因素。Science 1994, 265 (5179), 1724-1728.
- Ghavanloo, M. R.; Choudhury, K.; Bandaru, T. S.; Fouda, M. A.; Rayani, K.; Rusinova, R.; Phaterpekar, T.; Nelkenbrecher, K.; Watkins, A. R.; Poburko, D.; 等人大. 大麻二酚通过阻断其孔道并改变膜弹性来抑制骨骼肌。J. Gen. Physiol. 2021, 153, 5.
- Dokken, K.; Fairley, P. 钠通道阻滞剂毒性。见StatPearls, 2022.
- Iorga, A.; Horowitz, B. Z. 苯妥英毒性。见StatPearls, 2022.
- Al Khalili, Y.; Sekhon, S.; Jain, S. 卡马西平毒性。见StatPearls, 2022.
- Hanck, D. A.; Nikitina, E.; McNulty, M. M.; Fozzard, H. A.; Lipkind, G. M.; Sheets, M. F. 利用利多卡因和苯佐卡因关联钠通道分子构象与状态依赖性抗心律失常药物亲和力。Circ. Res. 2009, 105 (5), 492-499.
- McCormack, K.; Santos, S.; Chapman, M. L.; Krafte, D. S.; Marron, B. E.; West, C. W.; Krambis, M. J.; Antonio, B. M.; Zellmer, S. G.; Printzenhoff, D.; 等. 电压门控钠通道选择性小分子抑制剂的电压传感器相互作用位点。Proc. Natl. Acad. Sci. U. S. A. 2013, 110 (29), E2724-2732.
- Ahuja, S.; Mukund, S.; Deng, L.; Khakh, K.; Chang, E.; Ho, H.; Shriver, S.; Young, C.; Lin, S.; Johnson, J. P., Jr; 等. 亚型选择性小分子拮抗剂抑制的结构基础。Science 2015, 350 (6267), aac5464.
- Li, X.; Xu, F.; Xu, H.; Zhang, S.; Gao, Y.; Zhang, H.; Dong, Y.; Zheng, Y.; Yang, B.; Sun, J.; 等. 临床药物及选择性拮抗剂调节人的结构基础。Nat. Commun. 2022, 13 (1), 1286.
- Focken, T.; Burford, K.; Grimwood, M. E.; Zenova, A.; Andrez, J. C.; Gong, W.; Wilson, M.; Taron, M.; Decker, S.; Lofstrand, V.; 等. 鉴定可穿透血脑屏障的芳基磺酰胺类化合物作为亚型选择性抑制剂并在小鼠癫痫模型中显示疗效。J. Med. Chem. 2019, 62 (21), 9618-9641.
- Bean, B. P.; Cohen, C. J.; Tsien, R. W. 利多卡因对心脏钠通道的阻断作用。J. Gen. Physiol. 1983, 81 (5), 613-642.
- Kuo, C. C.; Bean, B. P. 苯妥英与大鼠海马神经元失活钠通道的缓慢结合。Mol. Pharmacol. 1994, 46 (4), 716-725.
- Nau, C.; Wang, G. K. 局部麻醉药与电压门控通道的相互作用。J. Membr. Biol. 2004, 201 (1), 1-8.
- Kuo, C. C.; Bean, B. P. 通道必须去激活才能从失活中恢复。Neuron 1994, 12 (4), 819-829.
- Bankar, G.; Goodchild, S. J.; Howard, S.; Nelkenbrecher, K.; Waldbrook, M.; Dourado, M.; Shuart, N. G.; Lin, S.; Young, C.; Xie, Z.; 等. 具有长滞留时间的选择性拮抗剂在炎症性和神经性疼痛模型中显示改善的疗效。Cell Rep. 2018, 24 (12), 3133-3145.
- Neurocrine Biosciences. Study to Evaluate NBI-921352 as Adjunctive Therapy in Subjects With SCN8A Developmental and Epileptic Encephalopathy Syndrome (SCN8A-DEE); ClinicalTrials.gov, 2021.
- Neurocrine Biosciences. A Study to Investigate How Effective, Safe and Tolerable the Drug NBI-921352 is When Used With Antiseizure Medications in Adults With Focal Onset Seizures; ClinicalTrials.gov, 2021.
- Catterall, W. A.; Kalume, F.; Oakley, J. C. 通道与癫痫。J. Physiol. 2010, 588 (11), 1849-1859.
- Kuo, C. C.; Lu, L. 拉莫三嗪抑制大鼠海马神经元通道的特性。Br. J. Pharmacol. 1997, 121 (6), 1231-1238.
- Jo, S.; Bean, B. P. 拉科酰胺对电压门控钠通道的抑制:与快速失活状态的缓慢结合。Mol. Pharmacol. 2017, 91 (4), 277-286.
- Johnson, J.; Focken, T.; Tari, P. K.; Dube, C.; Goodchild, S. J.; Andrez, J. C.; Bankar, G.; Burford, K.; Chang, E.; Chowdhury, S.; 等. 抑制驱动电压门控钠通道抑制剂在野生型和Scn8aN1768D/+功能增益小鼠中预防电诱发癫痫发作的功效。BioRxIV 2023.
- Hu, W.; Bean, B. P. 皮层第5层锥体神经元中电压依赖性电导对轴突和胞体静息电位差异控制。Neuron 2018, 99 (6), 1355.
- 刘辉;王洪刚;皮特·G·S;刘志坚。电压门控钠通道区室特异性定位与动力学的直接观察。J. Neurosci. 2022年,42卷,第5482-5498页。
- 蔡淳;安倍优;韦斯滕布鲁克·R·E;肖尔·T;卡特罗尔·W·A。Dravet综合征小鼠模型中生长抑素与小白蛋白表达皮层中间神经元兴奋性受损。Proc. Natl. Acad. Sci. U. S. A. 2014年,111 (30)卷,第E3139-3148页。
- 马哈德万·A;科达杜·N·K;帕里什·R·R。Xenon LFP分析平台:面向大规模微电极阵列局部场电位数据分析的新型图形用户界面。Front. Neurosci. 2022年,16卷,第904931页。