¶ 联合小分子处理加快人类多能干细胞来源神经元的成熟进程
埃米利亚诺·赫尔根雷德1,2,3,8、亚娜·佐里娜4#、赵泽平5#、赫尔马尼·芒古巴6,7、伊丽莎白·L·卡尔德1,2、阿里安娜·巴贾利尼1,2、安德鲁·P·米诺蒂1,2,3、瑞安·M·沃尔什1,2、康纳·利斯顿7、约书亚·莱维茨6、拉尔夫·加里帕4、陈水冰5、加布里埃莱·奇切里1,2、洛伦兹·斯图德1,2
2美国纽约州纽约市斯隆-凯特琳癌症研究所干细胞生物学中心 3美国纽约州纽约市斯隆-凯特琳癌症研究所发育生物学项目 4美国纽约州纽约市康奈尔大学威尔医学院研究生院5美国纽约州纽约市斯隆-凯特琳癌症研究所基因编辑与筛选核心设施 6美国纽约州纽约市威尔康奈尔医学院外科 7美国纽约州纽约市威尔康奈尔医学院生物化学系 8美国纽约州纽约市威尔康奈尔医学院精神病学系 当前地址:美国加利福尼亚州南旧金山insitro公司
¶ 摘要
人多能干细胞(hPSC)来源神经元成熟的过程模拟了人类大脑发育的漫长时序,需要经历数月乃至数年才能获得类成体功能。这种漫长的invitro成熟周期对基于干细胞的神经系统疾病建模与治疗应用构成了重大挑战。我们设计了一种基于hPSC来源皮质神经元形态和功能表征的高内涵成像检测方法,旨在揭示其内在通路并筛选能够加速神经元成熟的化学物质。通过对包含2688种生物活性药物的化合物库进行筛选,我们发现了多种可促进神经元成熟的化合物,包括LSD1与DOT1L抑制剂以及钙依赖性转录激活剂。由GSK-2879552、EPZ-5676、NMDA和Bay K 8644这四种成分组成的鸡尾酒方案(我们统称为GENtoniK)在所有测试中均能触发成熟进程,包括突触密度、电生理学和转录组学的评估。值得注意的是,GENtoniK在3D皮质类器官和脊髓运动神经元中同样能有效促进神经元成熟,并能改善黑色素细胞和胰腺β细胞等非神经谱系细胞的成熟度。这些结果表明,通过简单的药理学干预即可促进多种hPSC来源细胞类型的成熟,并提示控制人类细胞成熟时序的某些机制在不同谱系间具有共通性。
¶ 介绍
人类多能干细胞(hPSC)分化的最新进展使得能够根据需要衍生出无数特定神经元亚型1–3。然而,由于人类细胞成熟速度缓慢导致疾病相关表型出现所需的培养周期延长,这项技术的应用仍然受到阻碍。事实上,大多数神经和精神疾病表现为突触连接4、树突分枝5及电生理功能6等出生后或成年神经元功能的损伤。因此,开发加速hPSC衍生神经元成熟的策略,对于实现其在模拟和治疗神经疾病方面的全部潜力至关重要。
多种细胞外在因素已被确认为神经元成熟的促进因素,包括胶质细胞7、网络活动8和神经营养因子9。然而在特定微环境中,细胞内在的成熟速率似乎占主导地位,且似乎由物种特异性的分子钟所决定——人类神经元的这种分子钟运行尤为缓慢10,11。例如,移植到发育中小鼠大脑的人多能干细胞源性皮层神经元,其成熟过程遵循人类特有的时间规律,需要9个月才能形成成熟的、类成体的树突形态与棘突功能12。类似地,将小鼠、猪与人类的中脑多巴胺神经元分别移植到帕金森病大鼠脑内,其移植物诱导功能恢复的时间点依次为4周、3个月和5个月,这表明移植细胞保留了其固有的物种特异性in vivo成熟节律,而非采纳宿主物种13的时间框架。
在此,我们的目标是识别神经元成熟效应因子,并开发一种化学策略以加速这一过程。我们设计了一种多表型、基于图像的检测方法,用以监测近乎纯化的人多能干细胞来源的深层皮质神经元培养群体的成熟过程,并运用该方法筛选了2688种生物活性化合物。在筛选结果中,我们针对染色质重塑和钙依赖性转录的化合物被组合成一种成熟诱导剂,该诱导剂对多种成熟表型均具有显著效果,且能驱动神经元与非神经元谱系中多个成熟维度的进展。
¶ 结果
¶ 高内涵神经元成熟度分析
神经元表型复杂性使得单一指标检测无法完整捕获成熟阶段。因此,我们采用多表型分析策略(通过高内涵筛选技术HCS)14,设计了可同步监测神经元成熟多维特征的检测方法(图1a)。树突生长作为神经元成熟的常用评估参数15,可通过微管相关蛋白2免疫染色进行自动化追踪监测(图1b、c)。细胞核尺寸与形态变化同样是神经元发育与成熟的特征指标16,可通过DAPI染色进行追踪。
复染色(图1b, c)。作为神经元功能和兴奋性的间接测量指标,我们在2小时KCl刺激后量化了即刻早期基因(IEG)产物FOS和EGR1的核表达(图1b, d)。IEG的定义特征在于其能在无需新生蛋白质合成的情况下,通过包括神经元持续膜电位去极化在内的刺激快速诱导表达17。相较于钙成像和电生理学等传统神经元活性检测方法,IEG免疫反应活性作为检测指标可轻松扩展至数千种处理条件。但需注意,除神经元活动外,IEG亦可被生长因子信号18和细胞应激反应19等其他刺激触发。为避免直接激活IEG,我们采用瞬时化合物处理(第7-14天),并在化合物冲洗后于无化合物培养基中继续培养7天(第14-21天)再进行检测(图1a)。此外,我们通过测定基础状态与KCl刺激状态下的IEG表达,以KCl诱导反应值减去基线值来特异性确定去极化诱导信号。仅在化合物撤除后检测成熟度读数,有助于识别那些即使移除后仍能触发成熟刺激持久“记忆”的化合物。
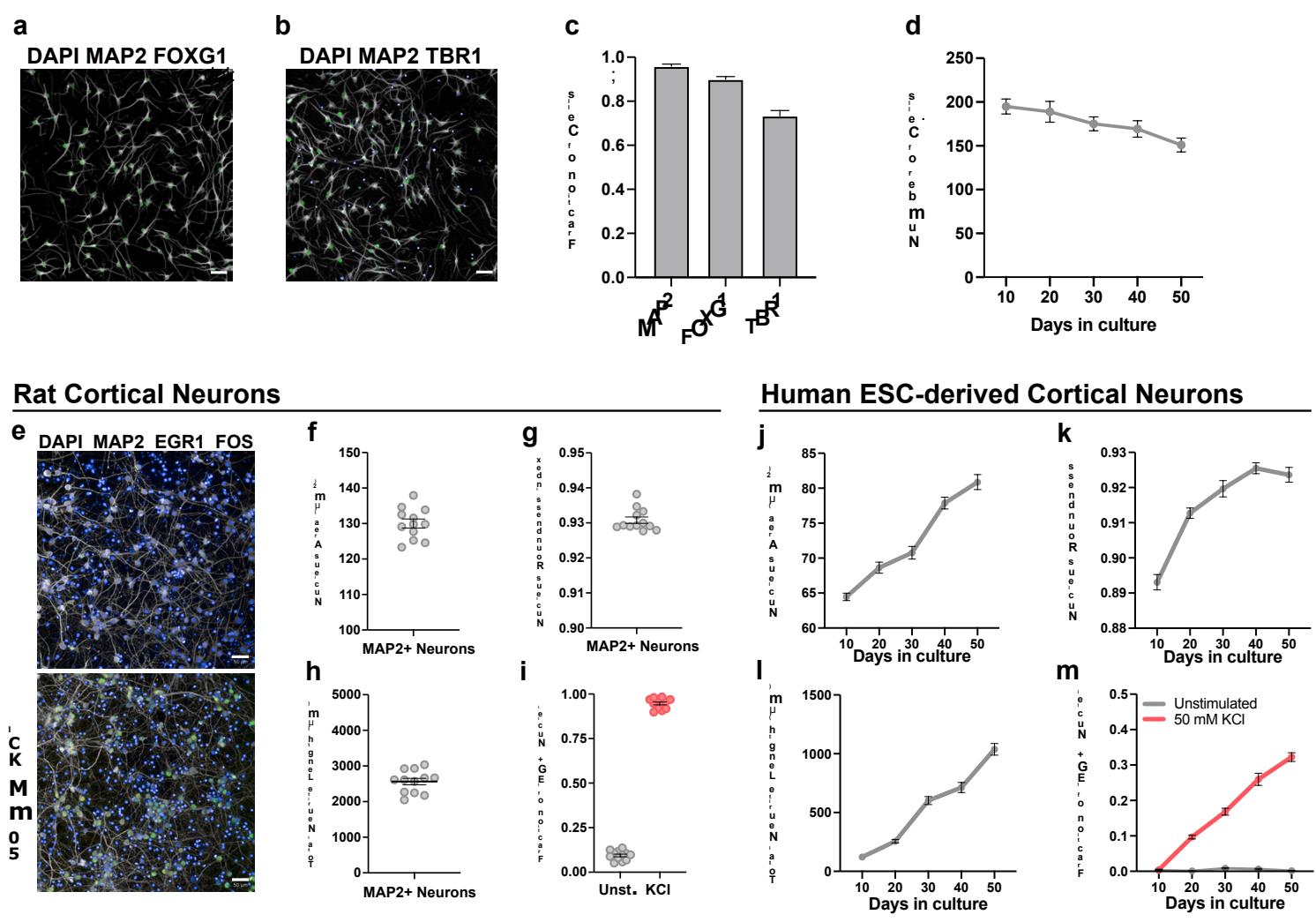
虽然这些检测结果是全神经元性的,因此适用于不同神经元谱系,但基于技术和生物学两方面的考量,我们选择皮质神经元进行筛选。皮质神经元无需昂贵重组蛋白即可高效获取,其均匀分布且不聚团的特性使其适用于高通量成像。该细胞类型所代表的大脑区域不仅发育周期特别漫长,更是人类神经系统疾病的重要关联区域。我们的皮质神经元分化方案可产生高度纯化的有丝分裂后深层TBR1 细胞群,这些细胞易于规模化培养、冷冻保存,并能直接解冻用于大规模检测(附图1a-d)。
为了对成熟细胞中的测定性能进行基准测试,我们采用了原代胚胎大鼠皮质神经元,它们能够快速可靠地发展出类似成熟的功能 invitro20。在培养14天后,大鼠神经元显示出大而圆的细胞核(1 ,圆度指数0.93)、广泛的神经突生长( 神经元),以及近 的神经元表现出KCl诱导的IEG反应(补充图1e-i)。相比之下,在人类PSC衍生的皮质神经元中,这些特性在50天的培养期内仅非常逐渐地增加,且从未达到其啮齿动物对应物的成熟度(补充图1j-m)。这些结果表明,我们的多表型测定可靠地捕捉了发育中大鼠和人类PSC衍生的人类皮质神经元的成熟过程。
¶ 成熟增强剂的化学筛选
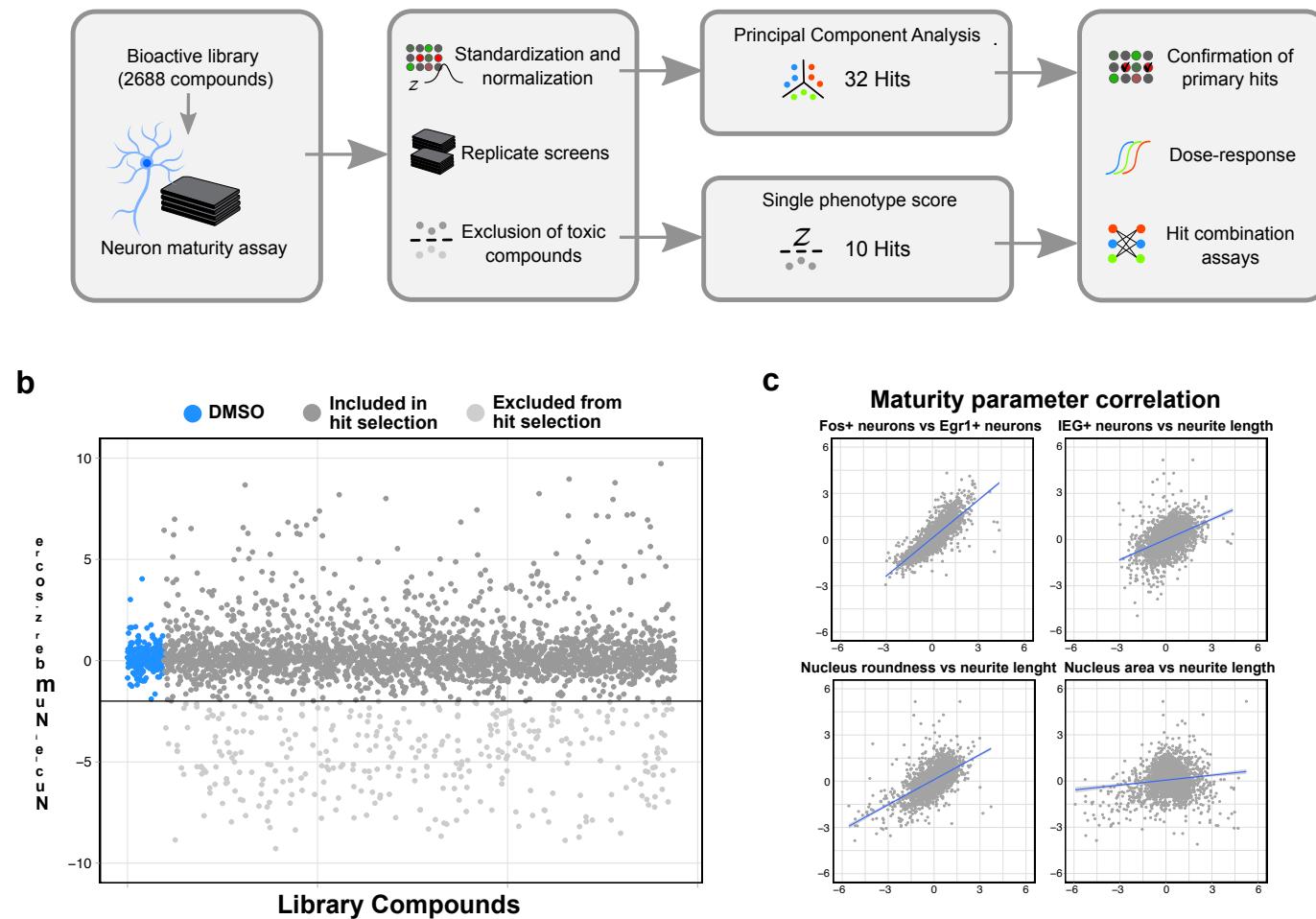
我们接下来应用我们的成熟度测定方法,筛选了一个包含2688种生物活性化合物的库,使用人源多能干细胞来源的皮质神经元(补充图2a)。该化合物库以5 的浓度应用,并将重复筛选运行的标准分数( -分数)取平均值进行分析。存活率通过量化完整细胞核来确定,325种 -分数低于-2的毒性化合物被从进一步分析中排除(补充图2b)。对于高内涵筛选命中选择,我们应用主成分分析(PCA)对6个成熟度 -分数进行分析,以识别化合物间的分布模式,避免单一阈值命中判别21(图1e,左图)。这6个参数是:细胞核大小和圆形度、总神经突长度和分支(每个细胞的段数)、以及KCl诱导的FOS 和EGR1 细胞的比例。我们通过PCA识别出3个化合物表型簇:成熟增强剂(命中);成熟抑制剂,主要由PI3K/AKT/mTOR轴抑制剂组成;以及非神经元污染物增殖诱导剂,这些高度富集于TGF- 信号通路抑制剂以及rho相关蛋白激酶(ROCK)和其他信号通路的抑制剂(图1e,右图)。
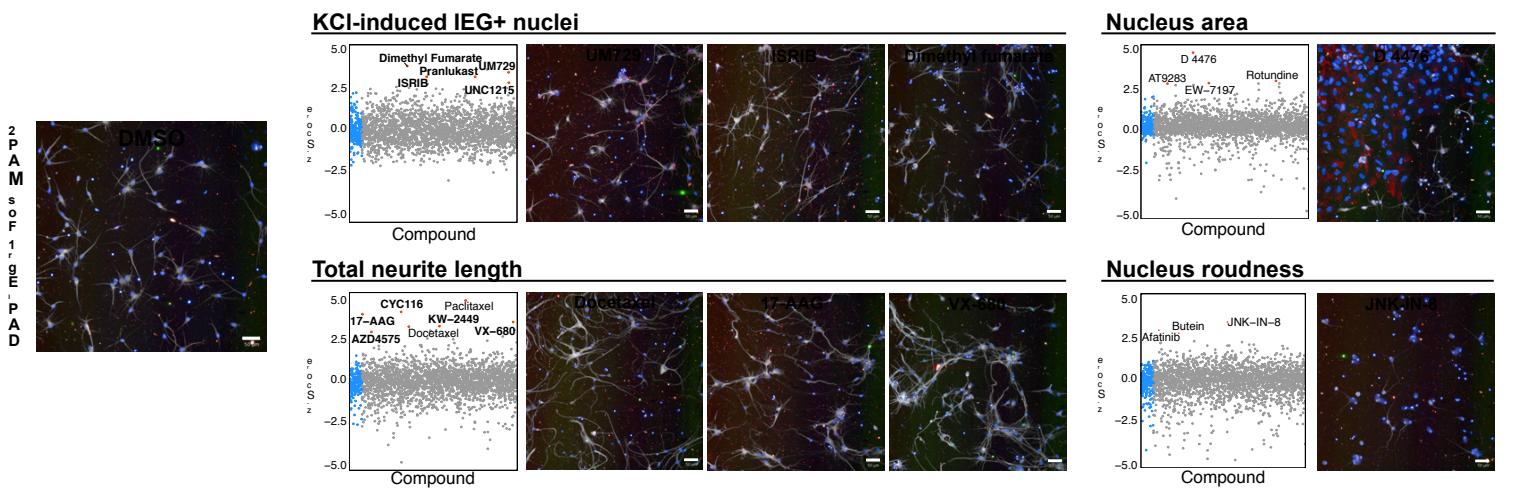
我们选取了成熟簇内的32种化合物进行验证。尽管PCA能够识别出具有最显著整体成熟效应的化合物,但我们推测那些对单一参数有强烈影响的化合物同样值得关注。因此,我们额外纳入了在总神经突长度和FOS/EGR1双阳性细胞这两个参数中分别评分最高的5种化合物(剔除已通过PCA选定的化合物,见补充图3a)。由于单参数读数易受假阳性影响,我们排除了具有已知非成熟依赖性效应的药物,例如微管稳定剂多西他赛和紫杉醇。值得注意的是,仅针对神经突的筛选结果中包含多种极光激酶抑制剂,这与近期针对该表型的表型筛选结果一致22,23。基于上述综合标准,我们最终筛选出42个初级阳性化合物(见补充表1)。
为了验证初步筛选结果,这42种化合物在筛选浓度( )下进行三次成熟度测定实验,并根据其对4个成熟度参数的影响进行排序:细胞核尺寸与圆形度、总神经突长度、以及双KCl诱导的FOS/EGR1细胞阳性率(附图3b)。选取在所有参数中相对于DMSO对照组具有最高标准化平均得分的22种化合物,开展后续剂量反应研究(图2a),最终鉴定出4种对平均成熟度评分具有最显著剂量依赖性效应的化合物(图2b)。
¶ 小分子鸡尾酒促进神经元成熟
已确认的4种促进成熟化合物包括两种赖氨酸特异性去甲基化酶1(LSD1/KDM1A)抑制剂、一种端粒酶破坏因子样1(DOT1L)抑制剂,以及一种L型钙通道(LTCC)激动剂。LSD1是组蛋白3在赖氨酸4和9位点的去甲基化酶,先前研究发现这两种底物间的特异性转换与神经元分化相关24,25。DOT1L是
唯一靶向组蛋白3球状结构域中赖氨酸79的甲基转移酶26。LTCCs参与钙依赖性转录过程,并在神经元发育中发挥重要作用27。我们推测LTCC激动剂诱导的转录作用可能增强表观遗传调控因子(如LSD1和DOT1L)介导的染色质重塑效应。因此,我们后续尝试确定联合使用先导化合物能否进一步促进神经元成熟。鉴于两个已验证的先导化合物均靶向LSD1,我们选择其中效果更强的GSK-2879552(图2b显示其协同作用优于OG-L002)进行组合实验。与单一化合物处理相比,三种先导化合物的联合使用显著提升了即早基因诱导、神经突生长和细胞核尺寸,但未改变细胞核圆形度(图2c,补充图4a)。这些效应似乎
该效应与细胞存活率无关,因为无论是单独处理还是联合处理,相对于DMSO均未显著改变细胞数量(补充图4b)。
除LTCCs外,钙依赖性转录还可通过激活NMDA谷氨酸受体28启动,该受体亦被证实参与神经元成熟过程29。有趣的是,化合物NMDA本身虽在初筛中脱颖而出,但未能通过单药治疗的验证(图2a)。我们随后检测了在以上三种命中组合物存在的情况下,添加NMDA是否能进一步促进成熟参数。结果发现所有成熟参数均显著提升,且细胞存活率依然未受影响(图2d,补充图4c),最终我们将由此得到的四药组合(GSK-2879552、EPZ-5676、NMDA及Bay K 8644)命名为GENtoniK,作为促进成熟的策略方案(图2e)。
¶ GENtoniK促进功能性神经元成熟
我们随后在筛选期间检测的成熟表型之外,另选取了正交的成熟表型对GENtoniK进行验证。建立独立的功能性读数尤为重要,因为鸡尾酒疗法靶向的三种蛋白质中有报道称可直接参与神经元中即刻早期基因的诱导30–32。化学突触的形成是神经元发育的关键步骤,在人脑皮层中同样以长期渐进的方式发生33。我们通过第35天皮层神经元的免疫荧光染色评估了GENtoniK对突触发生的影响。通过前突触标记物SYN1与后突触标记物PSD95相对于树突长度的标准化并置量化了突触组装密度(图3a)。经GENtoniK处理的神经元显示单位神经突长度上的前后突触标记物密度均有所增加,突触 punctae 的并置密度也有所提升(图3b-d)。 内在电生理特征(如被动膜特性与激发动作电位的能力)同样是功能性神经元成熟的重要指标34。为评估药物鸡尾酒疗法对膜特性与兴奋性的影响,我们在培养第28天的皮层神经元中进行了全细胞膜片钳记录。与即刻早期基因研究类似,此时已撤除药物处理。
在记录前7天进行处理,以确保差异是由成熟过程介导的,而非离子通道激活剂NMDA和Bay K 8644的直接作用。经GENtoniK处理的神经元中超过 可诱发动作电位,而对照组神经元中这一比例不足 (图3e)。在产生动作电位的神经元中,经GENtoniK处理的神经元表现出更高的放电频率(图3f)和更低的动作电位阈值(图3g)。尽管处理组神经元的静息膜电位值显著更接近成熟状态(图3h),其数值范围仍远低于皮层生理范围的-60至- in vivo35。这些结果表明GENtoniK能显著促进突触连接性和兴奋性,但可能需要其他外在因素才能实现更成熟的静息膜特性。
¶ GENtoniK诱导转录从幼稚向成熟转变
随后我们通过RNA测序评估了小分子处理引起的基因表达整体变化。与该复合制剂对染色质状态和钙内流的双重作用一致,我们分别使用两种表观遗传因子、两种钙通道激动剂或完整GENtoniK复合制剂处理hPSC来源的皮质神经元(附图5a)。GENtoniK中差异表达的基因在单独使用表观遗传药物时也呈现类似调控趋势,但变化幅度较小,这与钙内流可增强染色质重构介导的转录变化这一假说相符(附图5b-d)。虽然在基于蛋白质的筛选中两种钙通道激动剂均被鉴定为成熟促进剂,但在撤药7天后,它们对基因表达的联合影响较为有限(附图5b)。
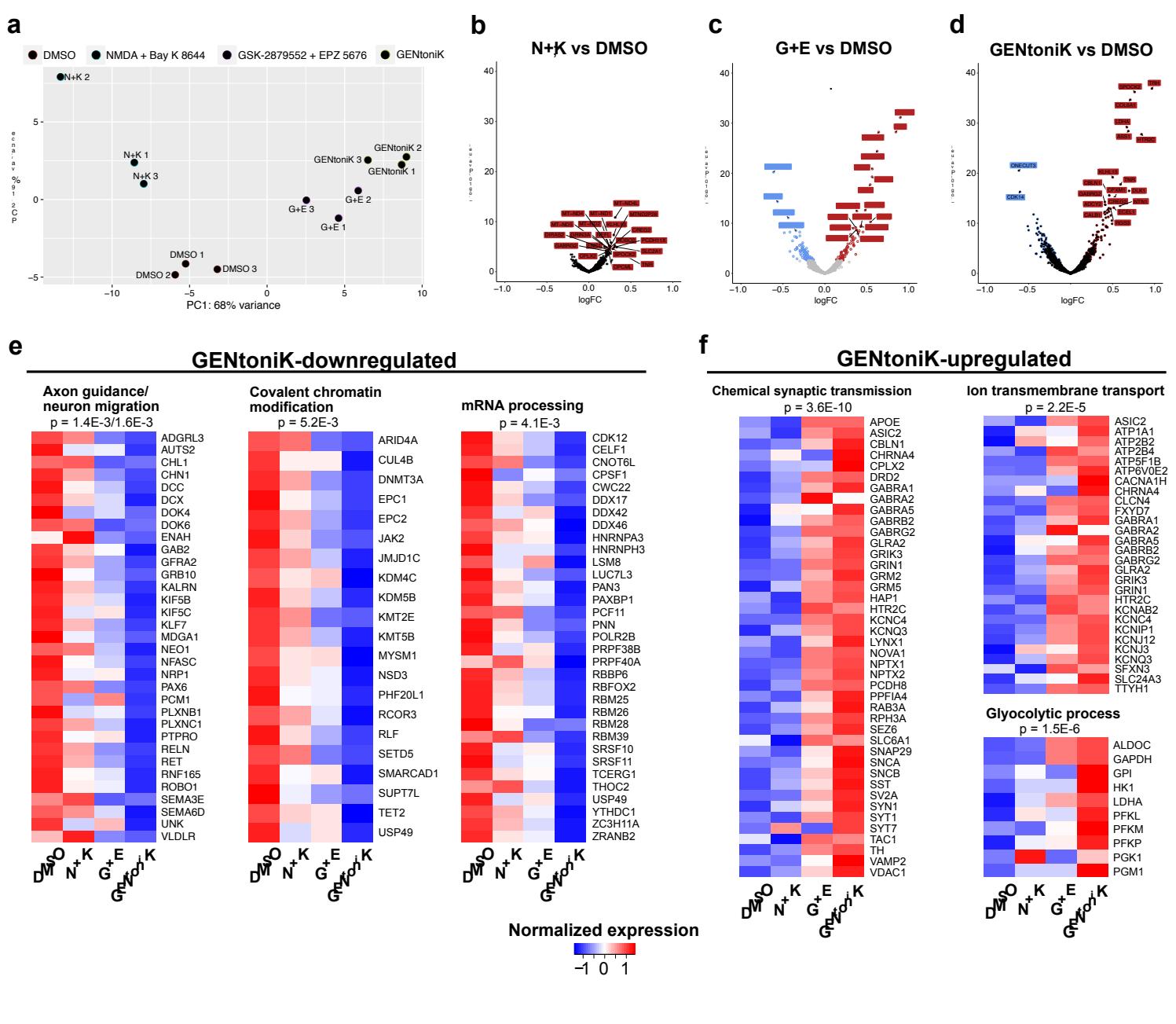
对GENtoniK下调转录本的基因本体分析显示,其在未成熟早期有丝分裂后神经元功能中呈现富集,包括细胞迁移和轴突导向,以及转录调控(图3i,补充图5e)。上调基因则在成熟神经元功能中富集,包括化学突触传递和跨膜离子运输(图3i,补充图5f)。虽然既往研究表明成熟神经元存在从糖酵解向氧化代谢的转变36,但我们观察到处理细胞中同时存在糖酵解、氧化磷酸化及脂肪酸代谢的富集(补充图6)。为将转录数据与基因表达的时间变化规律相匹配in vivo,我们将差异表达基因与人脑发育图谱BrainSpan数据库37进行比对。经GENtoniK下调的基因在胚胎早期高表达,并随出生进程逐渐下降(图3j左图)。相反,经处理上调的基因总体上呈现随妊娠进程表达量逐步升高的趋势(图3j右图)。
我们接下来对鸡尾酒疗法靶向的表观遗传因子下游的组蛋白标记进行了CUT&RUN染色质分析(图 )。虽然LSD1在成熟神经元中能够将其底物转换为H3K9——
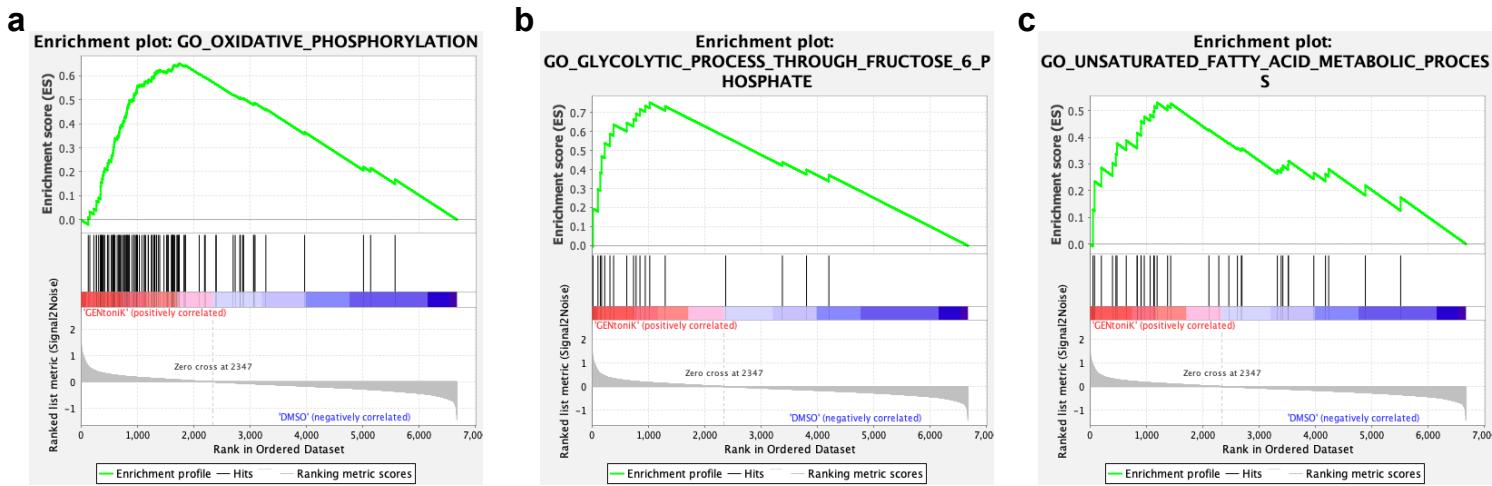
针对特定变体,我们聚焦于其典型靶标H3K4,基于"促成熟抑制作用很可能靶向未成熟形式"这一推论。在未处理的第7天皮层神经元中,H3K4和H3K79的二甲基化在GENtoniK下调基因中的富集程度均高于上调基因(图3l、m)。H3K4me2在基因组中广泛存在,其中启动子区域和转录起始位点附近富集度最高(附图7a)。相比之下,H3K79me2仅在少量基因中富集,并延伸至转录区域(附图7b)。值得注意的是,H3K79峰值区域内基因与RNA-seq测得的GENtoniK下调基因具有近乎相同的本体富集特征,在神经元迁移、染色质修饰和RNA加工等基因类别中过度呈现(图3i,附图7c-e)。H3K79me2峰值内的染色质调控基因包括GENtoniK靶标LSD1(附图7d),而具有H3K79me2峰值的mRNA加工基因(如NOVA2和CELF1)已被证明参与皮层神经元发育38,39(附图7e)。这些结果表明H3K79甲基化可能在维持未成熟基因表达程序中发挥作用,而该标记的缺失可能促进GENtoniK处理细胞的神经元成熟。
¶ GENtoniK促进多种神经元培养系统的成熟
接下来,我们在hPSC衍生的神经元系统中测试了GENtoniK的功效。由于我们的筛选依赖于女性hESC系H9(WA09),我们首先在男性皮质神经元中复现了结果,并采用诱导多能干细胞(iPSC)系进行验证,确认了GENtoniK在不同hPSC细胞系(hESC与hiPSC)及不同性别间对成熟度的促进作用(附图8)。
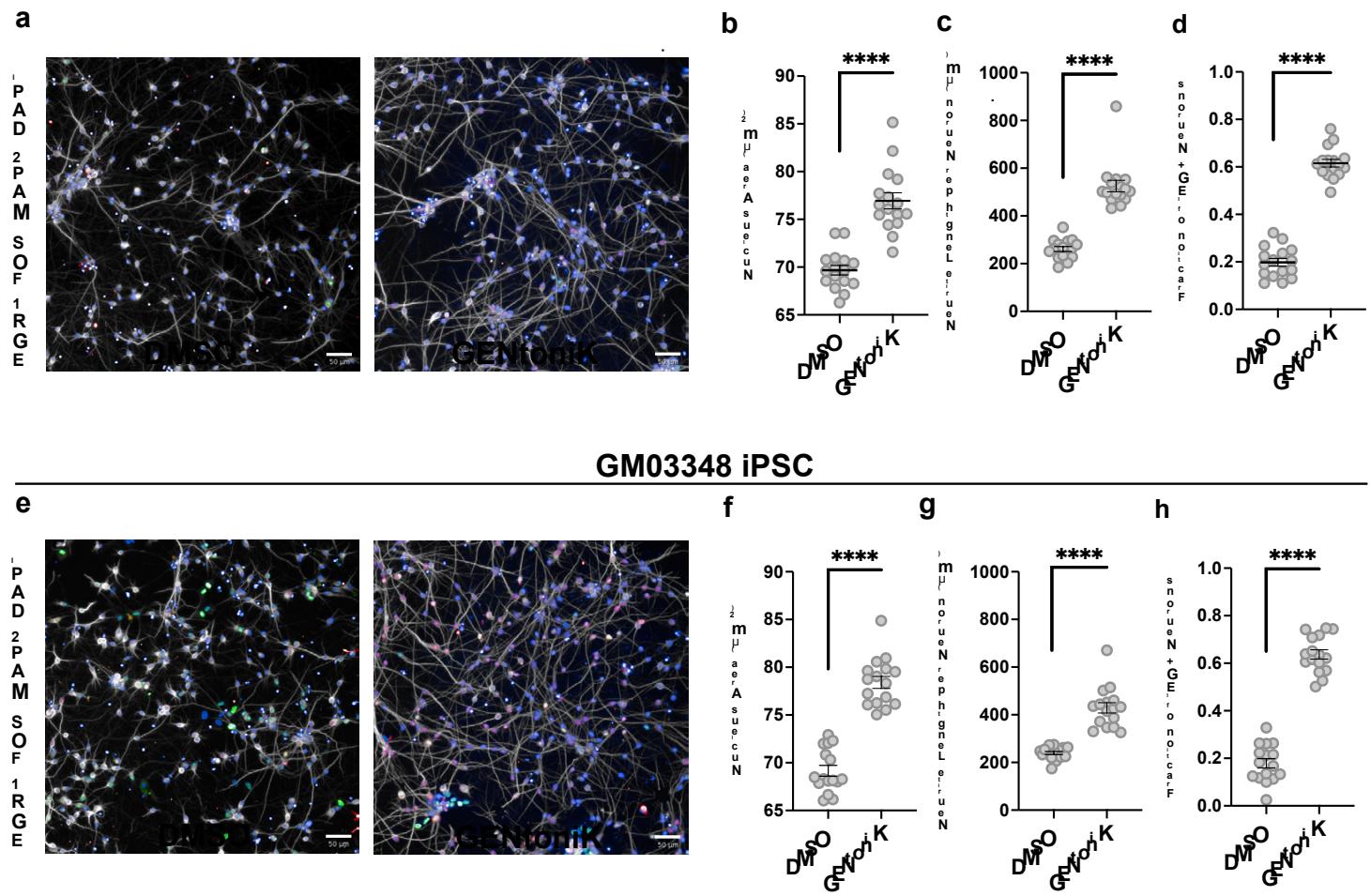
神经元培养中常规采用多种成熟策略,包括添加脑源性神经营养因子(BDNF)等营养因子,以及使用具有更生理化葡萄糖与离子浓度的培养基(BrainPhys)40。我们通过时序实验评估GENtoniK与现有成熟方案的兼容性及有效性。在标准Neurobasal培养基(不含神经营养因子)中,GENtoniK诱导神经元成熟参数的效果显著优于BrainPhys与BDNF联合方案;而当GENtoniK与BrainPhys及神经营养因子联用时,成熟度虽仅有小幅提升,但仍呈现增强趋势(附图9)。
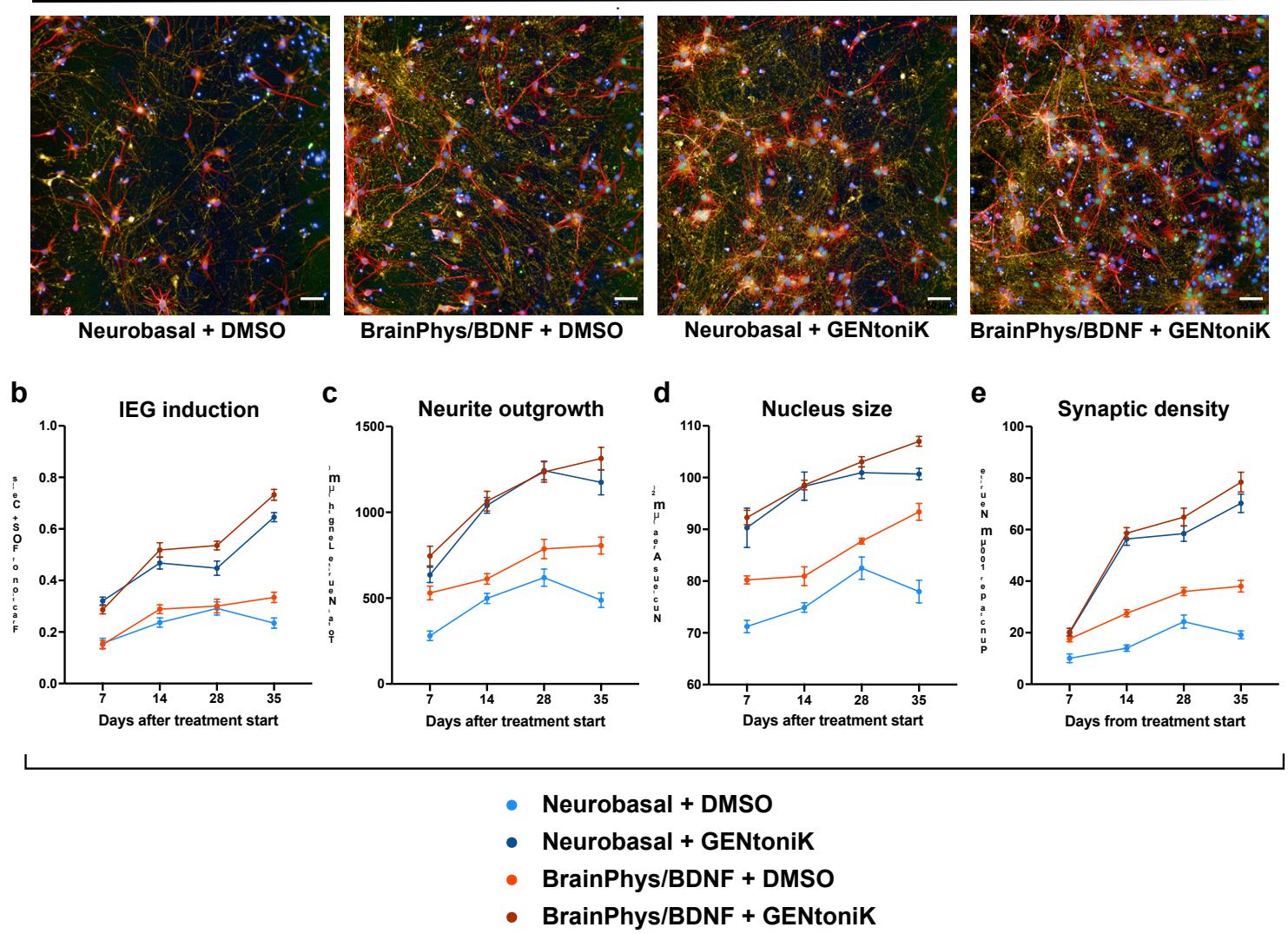
诸如脑类器官等自组织3D培养系统,已成为研究人类大脑发育与疾病的广泛应用模型系统41。然而,与2D培养系统类似,3D类器官存在成熟速率缓慢的问题42。我们观察到,在分化第15至50天期间接受GENtoniK处理的前脑类器官,在第60天时显示出SYN1斑点密度增加(图4a、b),以及细胞核表达EGR1和FOS的细胞数量增多(图4c、d,补充图10)。在这些研究中,类器官在即早基因免疫染色前未经过KCl刺激,这表明其具有更高水平的基线神经活动。
GENtoniK处理后自发性活动减少。经GENtoniK处理的类器官也显示出未成熟神经元标记物DCX的表达水平降低(附图10)。
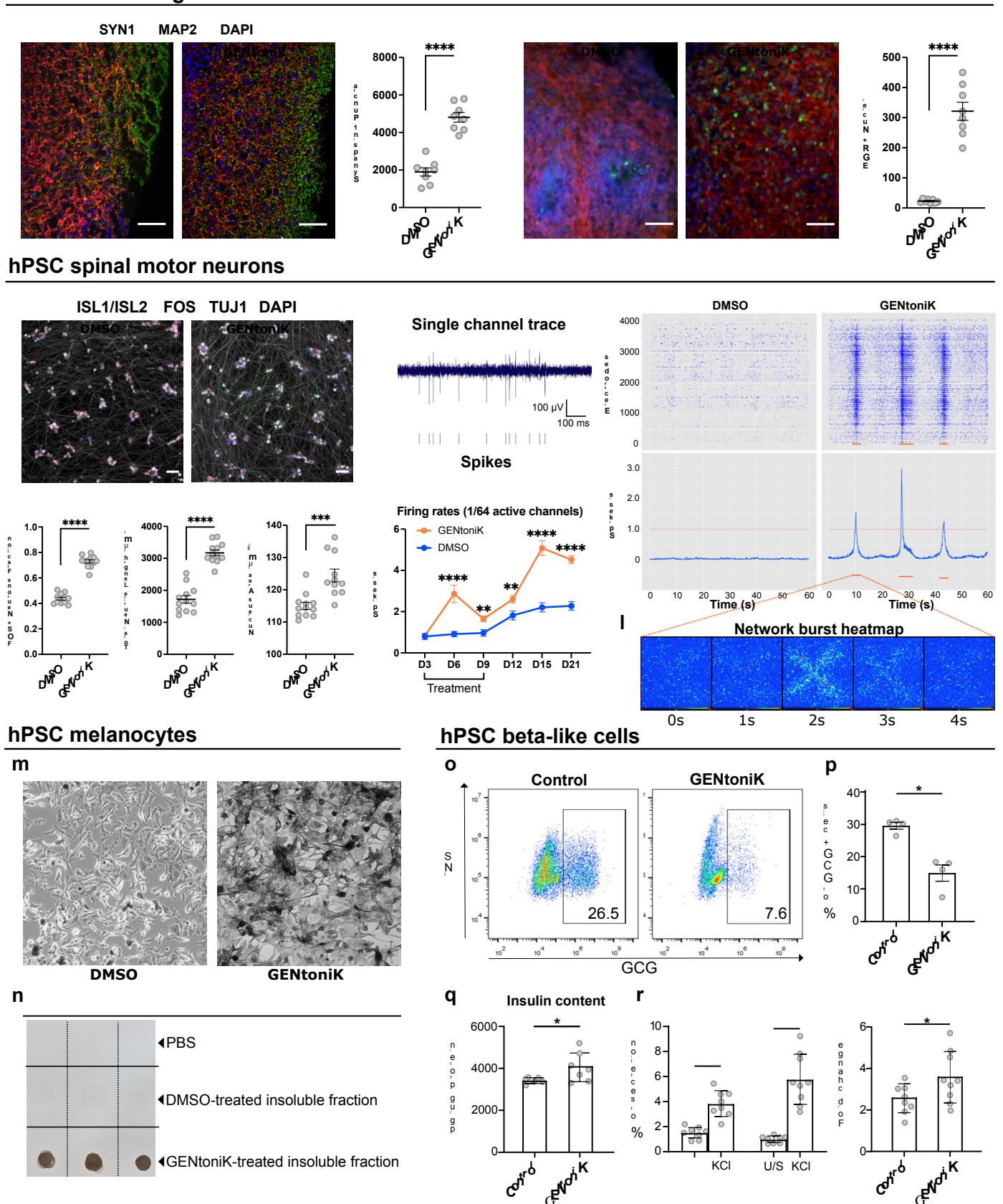
我们接下来探讨了该疗法是否能驱动hPSC衍生神经元在皮层或前脑之外的成熟。经GENtoniK处理的ISL1 脊髓运动神经元在所有测试的成熟度参数上均显示出高度显著的提升(图4e-h)。我们观察到,当在高密度多电极阵列上培养时,脊髓运动神经元表现出高水平的自发电活动(图4i)。在时序实验中,药物组合处理组的平均放电率略有增加(可能通过直接离子通道激活效应)。相比之下,在停止处理6天后开始观察到更显著的效果,表明该疗法引发了持久的成熟效应(图4j)。有趣的是,只有经GENtoniK预处理的脊髓运动神经元在 范围内表现出高度同步的爆发性活动(图4k,l),这与在胚胎脊髓43中观察到的自发性网络活动事件相似。
¶ GENtoniK 增强非神经元谱系的细胞功能
人类PSC衍生细胞成熟缓慢是神经元以外多种谱系面临的普遍问题。为评估GENtoniK在其他细胞类型中的潜力,我们随后研究了神经嵴来源的黑素细胞——这类细胞以成熟依赖性方式产生黑色素。黑素细胞生成并分泌黑色素决定了人类肤色和发色,hPSCs来源的黑素细胞已被用于模拟多种色素沉着障碍疾病44。采用我们既定的分化方案45,从第11天开始用GENtoniK处理hPSC衍生的黑素细胞,至分化第33天时,与未处理的黑素细胞相比,色素沉着现象出现显著增强(图 )。
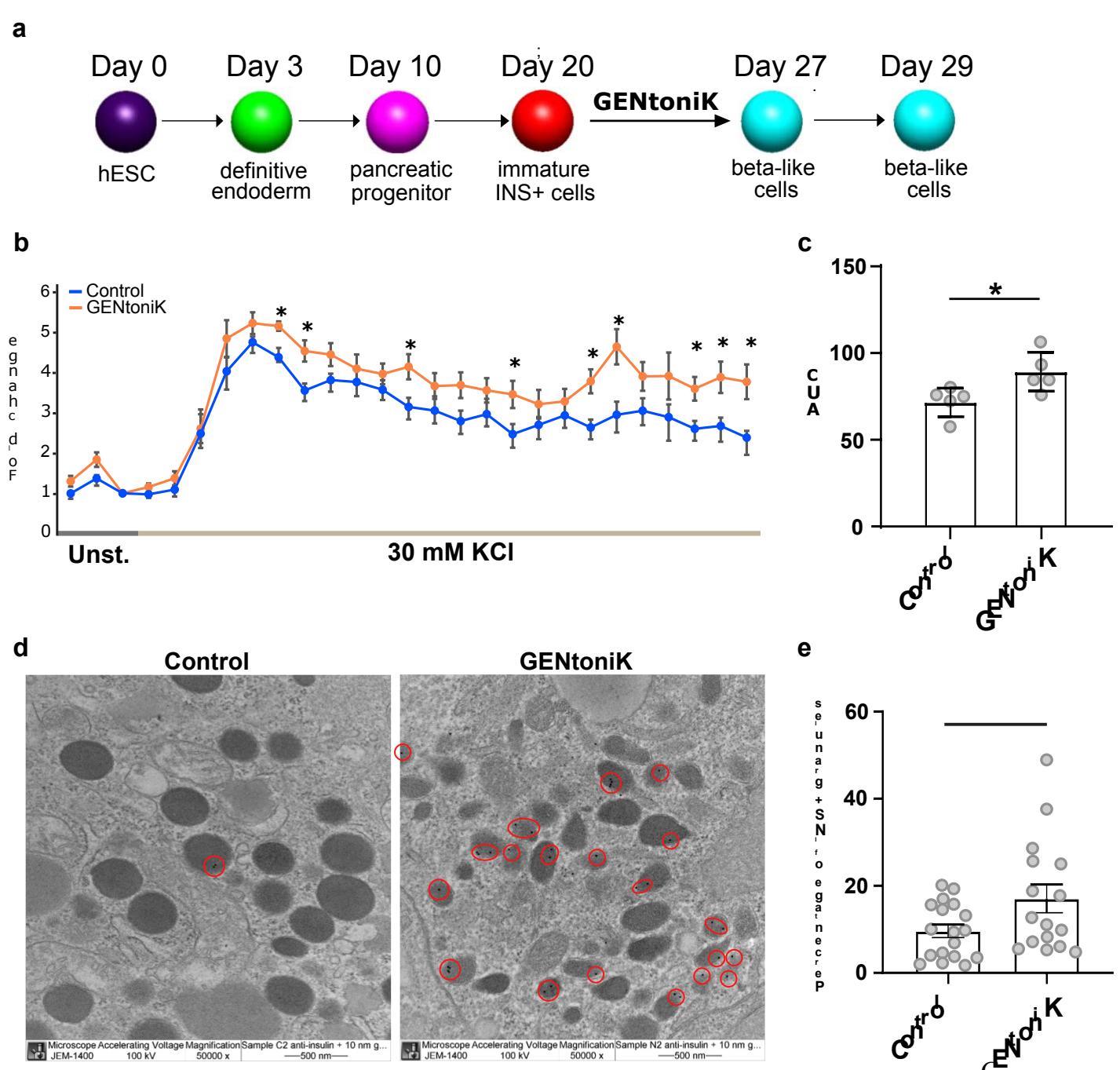
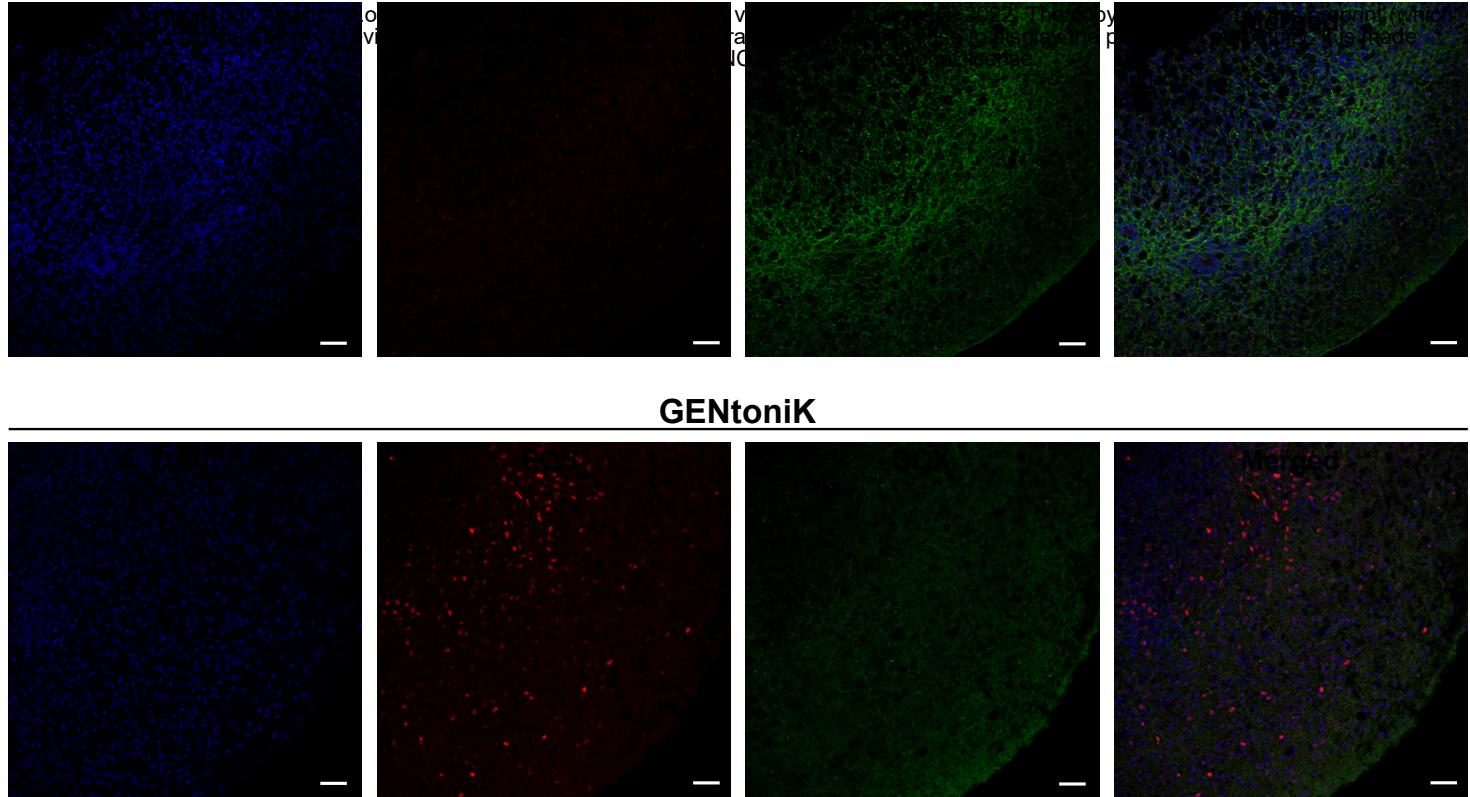
最后,我们在一种来源于不同胚层的细胞类型——hPSC来源的胰岛素分泌胰腺β细胞上测试了GENtoniK。这类细胞起源于定形内胚层46,在开发针对I型糖尿病47的细胞治疗方法方面具有重要意义。尽管已有多种诱导方案被报道,但主要局限在于会生成部分胰高血糖素 胰岛素 双激素细胞48。流式细胞术分析显示,GENtoniK处理降低了INS 细胞群中GCG+阳性细胞的数量(图4o,p)。重要的是,在分化第20至27天接受GENtoniK处理的β样细胞,在第29天显示出功能成熟度提升的证据,包括总胰岛素含量增加、胰岛素颗粒比例升高以及KCl诱导的胰岛素分泌增强(图4q-r;附图11)。这些结果表明,即使在非神经谱系中,GENtoniK也能激活细胞功能和成熟的某些方面。
¶ 讨论
我们提出了一种旨在促进人类干细胞源神经元成熟的联合化学策略,该策略通过整合高通量小分子筛选的活性化合物而获得。采用多参数读数分析使我们能够识别有效驱动神经元成熟的化合物,而非仅促进单一特征(如神经突生长)49,50。筛选结果的主成分分析生成了三个表型聚类:促进或抑制神经元成熟的化合物,以及促进非神经污染物生长的化合物。mTOR和PI3K调节剂在成熟抑制剂中的富集,与近期提出mTOR激活作为中间神经元成熟驱动力的研究结论一致51。意外发现是TGF-β和ROCK抑制剂被鉴定为促进“扁平细胞”非神经元命运的化合物,该细胞类型是神经分化的常见污染物,被认为代表神经嵴52或成纤维细胞来源53的间充质细胞谱系。TGF-β和ROCK抑制剂通常被广泛应用于多种神经分化方案,但我们的研究结果表明,若在分化后期阶段使用这些物质,可能会促进非目标细胞类型的生长。
我们研究的核心发现是,未成熟神经元中存在一种表观遗传程序,可阻止人类神经元的快速成熟。我们推测GENtoniK以双重方式发挥作用:表观遗传探针GSK2879552和EPZ-5676诱导染色质可及性从未成熟转录程序(迁移、轴突导向)向成熟转录程序(突触传递、离子通道亚基)转变。我们进一步推测,这些染色质状态的改变会促进NMDA和Bay K 8644介导的钙依赖性转录28激活,成为神经元成熟的额外驱动因素。
我们在初筛中鉴定出几种LSD1抑制剂。据文献报道,LSD1作为CoREST阻遏复合物的组成成分,能够特异性调控嗅觉25与皮质神经元54,55的分化及成熟进程。除发育调控功能外,LSD1还以高度环境依赖性和复合物特异性的方式参与众多生理过程56,这凸显了限制给药时长以避免脱靶效应的重要性。另一种策略是通过靶向特定复合物来实现功能特异性。虽然目前已开发出CoREST特异性探针57,但在我们的实验中发现该探针对神经元培养体系具有强烈毒性,导致无法评估其对成熟度的直接影响(数据未显示)。研究显示DOT1L可调控神经元分化过程中的细胞周期退出58,但其在调控有丝分裂后成熟阶段的作用尚未明确。我们在未成熟神经元中获得的染色质谱数据显示,DOT1L底物H3K79me2可能通过调控LSD1等转录调节因子的染色质可及性发挥作用,这使其成为发育过程中基因表达潜在主调控因子的重要候选者。与此观察结果一致的是,H3K79me2水平在神经元分化过程中会随着染色质凝聚而全局性升高59。
这表明它可能参与了从多能细胞向神经祖细胞和未成熟神经元转变过程中"表观遗传屏障"的建立;该屏障随后在人类神经元成熟过程中长期保留。由于该标记似乎缺乏对应的去甲基化酶,且其价态似乎取决于核小体周转速率60,这使其成为一种潜在的时间记录机制。
我们证明相同的化学策略能够促进非神经元细胞的功能成熟,但需要更深入的研究来确定最优配方以驱动其他细胞类型的成熟。例如,虽然NMDA受体和电压门控钙通道在黑色素细胞和胰腺β细胞中已证实具有功能61–64,但在其他细胞类型中,其激活作用或许并非驱动成熟所必需,可能需要激素等替代因子。同样,可能存在替代性表观遗传调节因子,在不同细胞类型和器官系统中调控成熟速率,以确保组织与物种特异性成熟时序的准确性。近期研究表明,包括蛋白质合成与降解在内的生化反应速率差异,与体节和脊髓发育的物种特异性差异相关联65,66。然而,仍需进一步研究证实其因果关系,并阐明这些机制是否适用于神经元成熟等后期发育阶段。GENtoniK为加速神经元及部分非神经细胞类型的成熟进程提供了一种简单、替代性且可能具有互补作用的策略。此外,GENtoniK的应用可促进人类多能干细胞技术在模拟人类发育与疾病过程中获得更成熟的类成人状态。
¶ 方法
¶ 细胞培养
人类多能干细胞 (hPSCs),包括胚胎和诱导的,在Vitronectin包被的板上使用Essential 8培养基(Thermo)进行维持,如前所述67。细胞每周传代两次,并在传代30至50次之间收集用于分化。支原体检测每两个月进行一次。
人胚胎干细胞来源的兴奋性皮层神经元采用基于既往报道的双SMAD抑制方案68进行诱导。简言之,将人胚胎干细胞用Accutase消化成单细胞后,以25万/平方厘米2的密度接种于基质胶包被的培养板,使用含 的Essential 8培养基。在分化方案第1-10天期间,采用含 SB431542(Tocris公司)和 LDN193189(Stemgent公司)的Essential 6培养基(Thermo公司)。为促进前端图式形成69,在第1-3天额外添加 Wnt抑制剂XAV-939。第11-20天使用添加N2补充剂的DMEM/F12培养基(Thermo公司)。整个分化过程中每日更换培养基。第20天用Accutase消化细胞30分钟,以每管1000万细胞的密度冻存于STEM-CELLBANKer冻存液(Amsbio公司)。神经元根据实验需要解冻后,接种于多聚赖氨酸/层粘连蛋白包被的培养板,使用含 B27与 GlutaMAX(Thermo公司)的低糖( )Neurobasal-A培养基。每周更换两次培养基。在铺板后前7天内,培养基中添加 Notch抑制剂DAPT,以促使残留前体细胞退出细胞周期70。
原代胚胎大鼠皮质神经元(Thermo)按照供应商说明进行解冻,并以与hPSC-皮质神经元相同的方式维持培养。
脊髓运动神经元的诱导流程基于既往报道的方案71,并调整为无饲养层单层培养体系。简言之,将Accutase解离的人胚胎干细胞以60万/平方厘米2的密度接种于Geltrex包被培养板,在CHIR99021和平滑激动剂存在条件下进行双重SMAD抑制。第11天收集脊髓祖细胞,将其铺置于多聚赖氨酸/层粘连蛋白/纤连蛋白(PDL/Lam/FN)包被板上,并在含有平滑激动剂、视黄酸、BDNF、GDNF、CTNF及DAPT的N2/B27培养基中维持培养。第24天将脊髓运动神经元重新接种于PDL/Lam/FN包被板,使用添加 B-27、抗坏血酸、视黄酸、BDNF、GDNF和CTNF的Neurobasal培养基维持培养。重铺板次日开始使用GENtoniK或DMSO进行处理。
背侧前脑类器官的生成方法基于先前报道的实验方案72。简言之,将10,000个经EDTA解离的人多能干细胞接种至96孔V型底板(S-bio)的每个孔中。细胞在人多能干细胞生长培养基中过夜自聚集。第1至8天期间,每两天更换一次添加了 SB431542、 LDN193189和 XAV-939的Essential 6培养基。第8天将培养基更换为由Neurobasal与DMEM/F12按50:50混合的类器官生长培养基,其中补充 NeuroBrew 21(Miltenyi)、 、 GlutaMAX、 MEM非必需氨基酸溶液、 2-巯基乙醇及1 重组人胰岛素(Sigma)。第14天从孔中收集类器官,以每皿约20个类器官的密度转移至 培养皿,并将培养皿置于设置为轻柔转动的轨道摇床上以防止类器官融合。
黑素细胞分化操作参照既往报道方法73进行。简言之,在分化前一天将hPSCs以20万细胞/平方厘米的密度接种于E8培养基包被的基质胶上,培养基中含 。在分化方案第0-11天期间,每日更换Essential 6培养基并添加以下因子: 、 SB431542及 CHIR99021(第0-2天); SB431542与 CHIR99021(第2-4天); CHIR99021(第4-6天);以及 CHIR99021、5ng/ml BMP4和 EDN3(第6-11天)。第11天时,在MSKCC流式核心设施使用BD-FACS Aria6流式细胞仪分选黑素母细胞。细胞经Accutase解离20分钟成单细胞悬液后,采用APC标记的cKIT抗体(Invitrogen)进行染色。APC(cKIT)阳性细胞经分选获取,并采用4,6-二脒基-2-苯基吲哚(DAPI)排除死细胞。流式分选后,将cKIT+黑素母细胞接种于干燥的PO/Lam/FN培养皿中。每2-3天更换黑素细胞培养基,每周使用Accutase以1:4比例传代。黑素细胞培养基由Neurobasal培养基添加以下成分组成: 、 cAMP、 FGF2、 HIR99021、 BMP4、 EDN3、 -谷氨酰胺、 MEM NEAA、 B27及 N2。
使用 MEL-1细胞进行胰腺β细胞分化实验。细胞培养于基质胶包被的6孔板中,采用StemFlex培养基(Thermo Fisher),并在 、 条件下维持培养。MEL-1细胞的分化采用既往报道的策略74:第0天,将细胞置于添加了 GlutaMAX(Thermo Fisher)、 Normocin、1 Activin A(R&D systems)及 CHIR99021(Cayman Chemical)的RPMI 1640基础培养基(Corning)中培养24小时。第2天更换为含 GlutaMAX、 Normocin、 FBS(Corning)及 Activin A的RPMI 1640基础培养基,持续培养2天。第4天,将获得的定型内胚层细胞置于添加 碳酸氢钠、 glutamax、 葡萄糖、 BSA、 FGF7和0.25 抗坏血酸的MCDB131培养基中培养2天。第6天,改用含 碳酸氢钠的MCDB131培养基进行细胞分化。
GlutaMAX、 葡萄糖、 BSA、 抗坏血酸、 视黄酸、 SANT1、50 FGF7、 TPB、 LDN193189 和 补充剂处理胰腺祖细胞阶段1细胞2天。在第8天,细胞在补充有 碳酸氢钠、 glutamax、 葡萄糖、 BSA、 抗坏血酸、 视黄酸、 SANT1、 FGF7、 TPB、 LDN193189 和 补充剂的 MCDB131 培养基中诱导分化为胰腺祖细胞阶段2细胞,持续3天。在第11天,细胞在补充有 碳酸氢钠、 glutamax、 葡萄糖、 、 视黄酸、 M SANT1、 LDN193189、 T3、 ALKi5、 硫酸锌、 肝素和 TS-X 的 MCDB131 培养基中诱导分化为胰岛素表达细胞,持续3天。在第14天,用于静态或动态KCl刺激胰岛素分泌(KSIS)分析的细胞从培养板上刮下,并重新放置到24毫米插入物和 微米聚碳酸酯膜、6孔组织培养trans-well板中的半球形集落中,而用于胰岛素含量分析和流式细胞术分析的细胞则保留在原始培养板上。所有细胞随后在补充有 碳酸氢钠、 glutamax、 葡萄糖、 BSA、 LDN193189、 、 硫酸锌、 肝素、 GS inXX 和 的 MCDB131 培养基中进一步成熟7天。然后细胞在补充有 碳酸氢钠、 glutamax、 葡萄糖、 BSA、 T3、 硫酸锌、 肝素、 乙酰半胱氨酸、 Trolox、 和 的 MCDB131 培养基中,使用 GENtoniK 或对照处理进一步成熟7天。
¶ 小分子处理
使用包含2688种化合物的生物活性化合物库进行筛选,浓度为 (Selleck生物活性化合物库,Selleck Chemicals)。库中包含的192个DMSO孔作为阴性对照。为验证初筛阳性化合物,使用安捷伦Bravo液体处理平台从库板中提取化合物,并以5 浓度进行三次重复的高内涵检测。从SelleckChemicals采购22种验证化合物,用适宜溶剂复溶后,以浓度对数梯度( 、 、 、 、 、 )进行剂量反应验证。GENtoniK复合剂定义为四种小分子混合物:GSK2879552、EPZ-5676、Bay K 8644和NMDA,每种工作浓度均为 。单个GENtoniK组分的储备液分别用DMSO复溶至 (GSK2879552、EPZ-5676、Bay K 8644)或用水复溶至 (NMDA),于- 保存至实验当日。除非特别说明,对照组均加入相应体积的DMSO(3:10,000)。
¶ 免疫染色
单层细胞培养——细胞在 多聚甲醛(PBS配制)中固定30分钟,用含 Triton X-100的PBS溶液透化5分钟,再用含 正常山羊血清(NGS)的PBS溶液封闭30分钟。一抗孵育在 条件下过夜进行,使用含 NGS的PBS溶液按指定稀释浓度配制。PBS清洗三次后,室温下用荧光标记二抗( )孵育30分钟。DAPI核染色( )与二抗孵育同步进行。在高内涵实验中,所有步骤均通过MSKCC基因编辑与筛选核心实验室的自动化液体处理系统完成。本研究使用的抗体列表见补充表2。
前脑类器官– 将类器官收集于1.5毫升离心管中,用PBS清洗后,在 条件下于PBS配制的 多聚甲醛溶液中固定过夜。固定后的类器官经PBS冲洗,置于PBS配制的 重量/体积蔗糖溶液中平衡24小时或沉降至管底。将类器官包埋于OCT化合物(Fisher)并置于冷冻模具中,经冷冻后使用冷冻切片机切割成 厚切片。切片收集于1毫升离心管(每管对应一种抗体),用含 Triton-X的TBS溶液清洗后,在含 正常山羊血清的相同溶液中进行封闭。一抗孵育在含 Tween-20的TBS中过夜完成,随后经洗涤,二抗在相同缓冲液中室温孵育2小时。切片用ProLong封片剂(Fisher)封固于载玻片,使用配备20倍高数值孔径物镜和Apotome光学切片系统(Zeiss)的蔡司显微镜成像。针对SYN1点状信号的量化,采用Synapse Counter ImageJ插件75进行批量图像分析。
¶ 高内涵成像
高内涵成熟度检测——将皮层神经元以每孔5000个的密度接种于PLO/Lam包被的384孔板,并按所述方法维持培养。在生物活性化合物筛选中,铺板7天后向复孔板中加入化合物,终浓度为 。处理7天后,细胞经两次冲洗并在基础培养基中继续培养7天。固定前,将一块复孔板用 l刺激2小时。按上述方法进行FOS、EGR1和MAP2的免疫染色及DAPI复染。通过INCell Analyzer 6000 HCA系统(GE Healthcare)采集图像(每孔4个视野,20倍放大)。
图像分析与筛选结果的量化——使用哥伦布软件(Perkin Elmer)对筛选图像进行表型分析。提取的参数包括:细胞核总数、核面积、核圆形指数(DAPI通道);每个细胞核的总神经突长度(MAP2通道);以及FOS-
阳性、EGR1阳性和双IEG阳性细胞核(FOS/EGR1)。在IEG定量分析中,通过设定DAPI阳性细胞核内荧光强度阈值计算阳性细胞核比率。随后将未刺激培养板的IEG细胞核比率从KCl刺激培养板中扣除,以分离出KCl去极化介导的响应。形态学变量(细胞核与神经突)在未刺激与KCl刺激培养板间取平均值。通过KNIME分析平台76搭载的高内涵筛查工具扩展模块,依次进行了b分数与z分数标准化处理及主成分分析。
突触标记物分析——将hPSC来源皮质神经元解冻后铺板于PLO/Lam 96孔板。药物处理于7天后启动并持续21天,随后在基础培养基中继续培养7天进行细胞固定。按前述方法进行Synapsin 1、PSD95与MAP2的免疫染色,使用IN Cell 6000高内涵系统的共聚焦模式每孔采集10张图像。在MAP2阳性突触周围区域设置掩膜,于划定区域内定量SYN1与PSD95斑点。针对突触前后标记物的毗邻定量,在含有SYN1斑点及其紧邻区域设置掩膜,统计该范围内的PSD95斑点。每个视野的突触斑点计数均标准化为总神经突长度。
¶ 电生理学
全细胞膜片钳记录——将人胚胎干细胞来源的皮质神经元以 的密度接种于PLO/Lam包被的 培养皿。从接种后第7天开始使用GENtoniK或DMSO处理并持续14天。在撤药后第7天(即接种后第28至33天)开始记录。全细胞记录在 条件下进行,实验过程中持续灌注新配制的ACSF溶液(单位 ): 、 、 、 、 、 和 -葡萄糖。溶液pH值校正至7.4,渗透压维持在 。采用3-7 MΩ电阻的电极记录神经元,电极内液包含(单位 ):130葡萄糖酸钾、 、0.3 EGTA、 -磷酸肌酸、10HEPES、 -ATP、 -GTP及13生物胞素,用KOH调节pH至7.3,渗透压调整至 Osmol/kg。记录通过计算机控制放大器(MultiClamp 700B,Axon Instruments,福斯特城)进行,使用AxoScope 1550B(Axon Instruments)以 采样率采集数据,并经过 低频滤波。
多电极阵列记录 - 将hPSC来源的脊髓运动神经元接种至聚赖氨酸包被的互补金属氧化物半导体多电极阵列(CMOS-MEA)探针(3Brain)77。在记录区域滴加100微升 含20万个神经元的培养基液滴。孵育1小时后,向探针补充1.5毫升培养基并每3天更换一次。细胞开始接受处理
在铺板后的第3至9天使用GENtoniK或DMSO处理。记录于培养基更换24小时后进行,每3天一次,持续18天。通过BioCAM系统从4096个电极中采集1分钟自发电活动,并运用BrainWave 4软件进行分析。采用滑动窗口算法对原始通道轨迹进行峰值检测,设定9倍标准差的检测阈值。通过在整个4096通道阵列上施加1次峰值/秒的硬阈值,检测网络爆发活动。
¶ 基因表达与染色质分析
RNA-seq - 使用Direct-zol RNA微量提取试剂盒(Zymo)提取RNA。将总RNA样本送至GENEWIZ进行双末端测序,测序深度为3000-4000万读长。在Galaxy平台78上进行分析,直接使用经过接头修剪的FASTQ文件,通过Salmon准映射工具79参考GENCODE Release 36(GRCh38.p13)转录本进行转录本定量。采用DESeq280对Salmon生成的每百万转录本数(TPM)值进行差异表达分析。将本杰米尼-霍赫伯格校正p值低于0.05且baseMean截断值为1000的差异表达基因,通过Goseq工具81进行基因集过表达分析。对于基因集富集分析,使用GSEA软件82对所有baseMean值高于1000的基因进行分析。
CUT&RUN——人源多能干细胞分化获得的皮层神经元在铺板7天后收集,采用标准方案83进行CUT&RUN染色质分析。使用针对H3K4me2(Upstate)、H3K79me2(Active Motif)及小鼠IgG(Abcam)的抗体,按每10万细胞1:100的比例进行实验。通过苯酚-氯仿萃取法收集DNA,并提交至MSKCC整合基因组学操作中心进行500万读长的双端测序。数据分析在Galaxy平台完成:先通过Bowtie 比对至ENSEMBL GRCh38基因组,再使用MACS85进行峰检测,最后通过ChIPSeeker86和deepTool287进行可视化分析,其中小鼠IgG作为标准化对照。
¶ 黑素细胞色素沉着的斑点印迹分析
hESC来源的黑素细胞在Accutase中解离,冲洗后收集于PBS中。将含100万细胞的沉淀用 RIPA缓冲液通过超声裂解,以10,000 RCF离心3分钟。弃去上清液后,将不溶性组分重悬于 PBS中。取 该溶液滴加至硝酸纤维素膜,空气干燥后使用标准办公扫描仪成像以评估色素沉着。
¶ 胰腺β细胞成熟测定
流式细胞术分析——使用Accutase酶解人胚胎干细胞衍生细胞,并依照制造商说明采用BD Biosciences的固定/透化试剂盒完成固定与透化操作。
简要步骤如下:首先将细胞在 黑暗条件下用固定/透化缓冲液处理30分钟,随后用洗涤缓冲液清洗两次,每次在室温下孵育10分钟。接着将固定后的细胞在 条件下与一抗共同孵育过夜,用洗涤缓冲液清洗两次,每次在室温下孵育10分钟。再于 条件下与荧光标记二抗孵育30分钟后,用洗涤缓冲液清洗两次(每次室温孵育10分钟),最后重悬于PBS缓冲液中待测。使用的一抗包括:胰岛素抗体(1:50,Dako)和胰高血糖素抗体(1:100,Abcam)。样品通过Accuri C6流式细胞仪进行分析,数据使用FlowJo v10软件处理。
静态与动态KSIS——在第30天,将细胞置于 无葡萄糖的胰腺β细胞成熟培养基中饥饿处理,随后用 无葡萄糖DMEM(含GlutaMAX)培养1小时,并在 培养箱中继续用KRBH缓冲液(含 、 、 、 、 、 Hepes( )、 和 BSA)孵育1小时。进行静态KSIS时,细胞依次暴露于10 含 葡萄糖的KRBH溶液,或含 葡萄糖与 的KRBH溶液;60分钟后收集上清液,离心去除细胞碎片。上清液用于化学发光ELISA检测(胰岛素化学发光ELISA Jumbo, Alpco)。为测定各样本细胞总胰岛素水平,细胞在含 蛋白酶抑制剂混合物(ThermoFisher Scientific)的RIPA裂解液中涡旋2分钟,液氮速冻后解冻以促进裂解释放胞内胰岛素。裂解液离心后取上清进行ELISA检测。各条件下细胞胰岛素分泌量均以KRBH处理组为基准进行标准化。进行动态KSIS时,将细胞按滤纸-Biogel P4微珠-细胞-Biogel P4微珠顺序夹心嵌入灌流室,安装于Biorep灌流系统(Biorep Technology),先以 流速灌注含 葡萄糖的Krebs缓冲液,随后灌注含 葡萄糖 KCl的溶液25分钟。KCl刺激下各组分细胞胰岛素分泌量均以KRBH处理为基准进行标准化。
胰岛素含量测定 - 使用Accutase酶解D30期hESC来源的β样细胞,重悬于含 FBS和 EDTA的DMEM培养基中。通过ARIA2流式细胞仪分选80,000个INS-GFP+DAPI−细胞,用PBS清洗一次后裂解于 补充了 蛋白酶抑制剂混合物(ThermoFisher Scientific)的RIPA缓冲液中。采用ELISA法检测胰岛素含量。
免疫电子显微镜技术 - 为分析颗粒超微结构,将对照组或化学处理的人多能干细胞源β样细胞团簇用无血清培养基清洗,并以 戊二醛、
多聚甲醛, 缓冲液中含 苦味酸。经过三次缓冲液清洗后,细胞团块在室温下用 OsO 与 铁氰化钾混合液再次固定60分钟,随后进行三次缓冲液清洗。经过 、 、 、95 、 、 、 乙醇的脱水步骤后,细胞团块依次经以下溶液渗透: 乙醇与乙腈1:1混合液、纯乙腈、乙腈与EMbed 812环氧树脂1:1混合液、纯树脂,最终包埋于新鲜树脂中,并在5 下聚合36小时。切片厚度为65纳米,收集于镍载网上。切片经高碘酸钠饱和溶液清洗,再用50 甘氨酸及封闭缓冲液处理。随后用原始稀释度的抗胰岛素抗体进行染色,再用10纳米金标羊抗豚鼠IgG(Aurion, 1:100)标记。样品使用JEOL JEM 1400透射电镜配接奥林巴斯-SIS 2K x 2K Veleta CCD相机进行成像。
统计分析
除非特别说明,数据均以算术平均值 SEM(平均值的标准误)形式呈现。统计学显著性以星号标注如下:(ns) 、( ) 、() 、() 、() 。除非另有说明,生物学重复定义为同一hPSC细胞系的独立分化实验。
¶ 数据可用性
本研究期间生成的数据已存入NCBI GEO数据库,登录号分别为GSE172544(RNA测序数据)和GSE172543(CUT&RUN数据)。
¶ 致谢
我们衷心感谢Studer实验室成员提供的持续支持与深刻见解。特别感激M. Fennell在筛选实验方案构思与设计阶段的指导。感谢MSK光学显微镜仪器中心的J. Muller和Vierbuchen实验室的Y. Lin在活细胞成像实验中的协助。同时,我们感谢3Brain AG的A. Maccione与M. Falappa在多重电极阵列结果解读方面提供的专业支持。此外,特别鸣谢Weill Cornell Medicine显微镜与影像分析核心设施的Lee Cohen-Gould博士及Juan Pablo Jimenez先生在免疫电镜技术中的专业协助。本研究部分经费由Starr基金会三机构干细胞计划资助、LS获得的R01AG054720、L.S与S.C获得的NYSTEM DOH01-STEM5-2016-00300-C32599GG,以及核心基金P30CA008748提供。A.B.受瑞士国家科学基金会博士后流动奖学金P400PB_180672支持;A.P.M.获F31AG067709-01奖学金资助;R.M.W.受Ruth L. Kirschstein博士后奖学金F32(MH116590)支持;JL获得Rohr家族研究学者奖及Irma T. Hirschl基金资助。
赫希爾和莫尼克·韋爾-凱利爾獎;G.C. 獲得了歐洲分子生物學組織長期博士後獎學金及紐約幹細胞基金博士後獎學金支持。
¶ 作者贡献
E.H.:概念构思、研究设计、数据分析与解读、高内涵筛选方案的开发与执行、人 pluripotent stemcells (hPSC) 维持与分化、生物信息学分析、多电极阵列记录、文稿撰写。Y.Z.:高内涵筛选方案的设计、优化与执行,数据解读。Z.Z.:β细胞分化、胰岛素含量与分泌测定、流式细胞术、数据分析、文稿撰写。H.M.:单细胞电生理记录及数据分析。E.L.C.:脊髓运动神经元诱导方案的开发与实施。A.B.:黑素细胞分化方案的优化与执行。A.P.M.:皮质类器官的生成与维持。R.M.W.:类器官生成方案的开发与督导。C.L & J.L.:单细胞电生理实验设计与督导。R.G.:高内涵筛选实验设计与督导。S.C.:数据分析与解读、文稿撰写。G.C.:概念构思、皮质分化方案开发。L.S.:概念构思、研究设计、数据分析与解读、文稿撰写。
¶ 图例
图1 |基于高内涵化学筛选的神经元成熟驱动因子研究。a,人类多能干细胞来源的兴奋性皮层神经元筛选方案流程图。2SMAD-i表示双SMAD抑制。b,输入免疫荧光图像示例。上图:铺板后第21天未受刺激的神经元。下图:固定前2小时接受 KCl处理的神经元。c,神经元形态的自动化分析。左图:DAPI通道的细胞核检测掩膜。右图:MAP2通道的自动化神经突追踪。d,通过在校正核掩膜区域内对FOS和EGR1通道施加强度阈值,量化神经元兴奋性。e,基于6项成熟度参数( 次独立筛选运行的z分数平均值)对筛选化合物库进行的主成分分析。左图:2343种无毒库化合物的PCA散点图(总计测试2688种化合物),显示促进成熟(橙色)、抑制成熟(蓝色)和增强非神经元增殖(灰色)化合物的表型聚类。右图:各聚类中具有代表性的筛选图像及10种典型活性化合物。比例尺为 微米。
图2 |筛选命中物的验证与组合鉴定出促成熟复合剂GENtoniK。a、通过4个成熟度参数(细胞核尺寸与圆形度、神经突长度、KCl诱导的双FOS/EGR1 阳性细胞)相对于DMSO标准化后的平均值( 个微孔板孔)对初筛命中物进行排序,最终筛选出22种排名靠前的化合物进行验证。b、22种筛选命中物的剂量反应验证,比较4个成熟度参数相对于DMSO标准化后的平均值( 个微孔板孔,来自3次独立分化实验)。c-f、已验证命中物GSK-2879552、EPZ-5676、Bay K 8644及三者的组合物( )在即刻早期基因诱导(c)、神经突生长(d)、细胞核尺寸(e)和细胞核面积(f)等成熟度参数上的比较( 个微孔板孔,来自2次独立实验)。g-j、三药组合( )与添加NMDA的相同组合在即刻早期基因诱导(g)、神经突生长(h)、细胞核尺寸(i)和细胞核圆形度(j)等成熟度参数上的比较( 个微孔板孔,来自2次独立分化实验)。k、上图:经DMSO或促成熟复合剂GENtoniK处理的皮质神经元代表性图像。下图:GENtoniK的配方组成。a-b采用Brown-Forsythe与Welch ANOVA检验,辅以Dunnett T3多重比较。c-j采用双尾Welch t检验;星号表示统计学显著性。平均值通过条形图(a)或折线(c-j)表示,误差线代表标准误。比例尺为 微米。
图3 |采用正交读数验证小分子成熟策略。a、在第7至21天期间接受DMSO与GENtoniK处理的人胚胎干细胞来源皮质神经元(培养第35天)中突触标记物检测的代表性图像。橙色圆点表示SYN1与PSD95并列定位的实例。插图为用于定量的输入免疫荧光图像,显示突触前与突触后结构的示例标记物并列由箭头突出显示。b-d,GENtoniK 增加 SYN1、PSD-95 的密度及其并列,表示为每神经突长度的点状结构( 孔来自 个独立实验)。e-h,GENtoniK 在第28天 hPSC-皮质神经元中促进兴奋性和成熟静息特性。e, 的处理神经元发放诱发动作电位,相比之下 DMSO对照组为 。轨迹显示每组的代表性响应。f-h,电生理参数 AP 频率 (f)、AP 阈值 (g) 和静息膜电位 (h) 的量化(每组 个神经元,来自 4-6 个培养皿和 3 个独立实验)。i-m,RNA-seq和 CUT&RUN(3 个生物学重复)显示 GENtoniK 诱导从不成熟到成熟转录程序的转变。i,基因本体分析显示,在由混合物上调的基因中,成熟神经元功能富集;而在由混合物下调的基因或被DOT1L 靶标 H3K79 2-甲基化占据的基因中,不成熟功能和转录调控富集。j,在发育中人类大脑的 BrainSpan 图谱 (https://www.brainspan.org) 中,被 GENtoniK 下调的基因在早期发育期间显示较高的平均表达,并随时间减少(左图),被 GENtoniK 上调的基因显示从早期发育到妊娠期及出生后平均表达增加(右图)。顶部面板显示带置信区间的平滑均值曲线,底部面板显示标准化表达的热图。 ,在不成熟、未处理的第7天 hPSC-皮质神经元中,LSD1 和 DOT1L 靶标 H3K4 和H3K79 2-甲基化的 CUT&RUN 峰谱,覆盖全基因组 (k) 以及在 RNA-seq 中被 GENtoniK 下调 (l) 或上调 的基因中。b-d 和 f-h,双尾 Welch -检验;星号表示统计学显著性。平均值由黑线 (b-d)或条形图 (f-h) 表示。误差条代表标准误。比例尺为 微米。
图4 | 在神经元和非神经元hPSC衍生细胞中验证成熟策略。a-d,GENtoniK处理可诱导皮质类器官发生突触生成并产生自发性活动。a,第60天类器官中SYN1与MAP2免疫荧光染色的代表性图像。b,每个视野中SYN1斑点总数量化( 个冷冻切片随机取自 个类器官)。c,未受刺激的第60天类器官中EGR1与MAP2免疫荧光染色的代表性图像。d,每个视野中EGR1 阳性细胞量化( 个冷冻切片随机取自 个类器官)。e-h,GENtoniK促进hPSC来源脊髓运动神经元的成熟。e, 阳性脊髓运动神经元的高内涵成熟检测代表性图像(hPSC分化第40天)。f-h,量化数据显示GENtoniK提升KCl诱导的FOS+阳性细胞数(f)、总神经突长度(g)及脊髓运动神经元核面积(h)( 个微孔板培养孔来自2次独立分化实验)。i-l,GENtoniK处理可提高高密度多电极阵列上脊髓运动神经元的放电频率并诱导自发性簇状放电活动。i,GENtoniK处理组脊髓运动神经元的单通道采样轨迹图示峰值检测。j,高密度多电极阵列上脊髓运动神经元平均放电频率的时序分析,数据计算基于
在1/64最活跃电极中60秒的活动( 来自2个MEA探针的128个电极)。k,铺板在HD-MEA上的SMNs代表性60秒锋电位点阵图(上图)和平均放电频率(下图)。仅GENtoniK处理的SMNs显示出自发爆发事件(橙色条)。l,4秒爆发事件的全阵列热图。m-n,GENtoniK处理诱导hPSC-黑色素细胞早期色素沉着。m,从第11天开始接受GENtoniK或DMSO的黑色素细胞(hPSC分化第33天)的明场图像。n,经GENtoniK或DMSO处理的黑色素细胞的PBS或细胞提取物的斑点印迹分析( 个生物学重复)。o-r,GENtoniK促进hESC衍生的β样细胞成熟。GENtoniK或对照处理7天随后无处理2天后,INS-GFP 细胞中GCG 细胞百分比的代表性流式细胞术分析(o)和定量(p)( 个生物学重复)。q,GENtoniK或对照处理7天随后无处理2天后,INS-GFP 细胞的总胰岛素含量( 个生物学重复)。r,GENtoniK或对照处理7天随后无处理2天后,β样细胞中静态KCl刺激的人胰岛素分泌及倍数变化。测定在 D-葡萄糖存在下进行( 个生物学重复)。b、d、f-h、j和p-r,双尾Welch’s t检验;星号表示统计学显著性。平均值由黑线(b、d、f-h)或条形图(p-r)表示。误差代表S.E.M.比例尺为 。
¶ 补充图图例
附图1 | 高通量成熟度检测方案的设计与优化。a-c,第10天hPSC皮质神经元免疫荧光染色显示全神经元标记物MAP2(a,b)、前脑标记物FOXG1(a)及深层皮质标记物TBR1(b)。c,免疫荧光染色定量分析( 个微孔板孔)。d,有丝分裂后hPSC皮质神经元细胞数量的时序定量(每视野DAP 阳性细胞数, 个微孔板孔)。e,使用高通量标记物对胚胎大鼠原代皮质神经元(E18)进行免疫荧光染色。f-i,原代大鼠神经元成熟度参数定量显示:细胞核尺寸(f)、细胞核圆度(g)、神经突长度(h)和KCl诱导即刻早期基因表达(i)均达到成熟值( 个微孔板孔)。j-m,hPSC源性皮质神经元成熟度参数的时序定量显示:细胞核尺寸(j)、细胞核圆度(k)、神经突长度(l)和KCl诱导即刻早期基因表达(m)均随时间递增( 个微孔板孔)。黑色线条表示平均值。误差棒代表标准误。比例尺为 微米。
附图2 | 高内涵筛选数据制备与分析流程。(a) 使用含2688种生物活性化合物库进行高内涵筛选的分析流程。两次独立筛选的标准化分数(z分数)经平均处理后,通过主成分分析或单参数评分进行候选化合物筛选。(b) 排除总细胞数平均z分数低于-2的毒性化合物。值得注意的是,仅诱导非神经细胞的化合物会观察到总细胞数增加(图1e)。© 两次筛选实验中非毒性化合物平均成熟度z分数的相关性分析。
补充图 3 | 单参数命中选择。a, 左, DMSO 对照孔的代表性高内涵筛选图像。右, 文库化合物(排除已选择的 PCA 命中)针对单个成熟参数进行绘图。选中的化合物以粗体突出显示,未突出显示的化合物未被纳入,原因是其表型和/或已知分子靶点与神经元成熟无关。筛选图像代表每个参数的高分化合物。b, 42 个初级命中(PCA 和单参数)在单个成熟参数中的排名( 微孔板孔)。平均值用条形图表示。误差条代表 S.E.M.。比例尺为 5 0 ~ { \mu \mathrm { m } } _
附图4 |促成熟小分子对神经元存活无显著影响。a、命中组合实验(图2c-e)的代表性染色图像,展示在第7-14天接受指定处理的第21天神经元。b、经筛选命中药物GSK-2879552、EPZ-5676、Bay K 8644及三者联合用药( )处理的神经元每孔细胞数量统计。c、经三药联用( )及联用基础上添加NMDA处理的神经元每孔细胞数量统计。 个微孔板样本,数据来源于2次独立实验。误差线表示标准误。标尺为 微米。
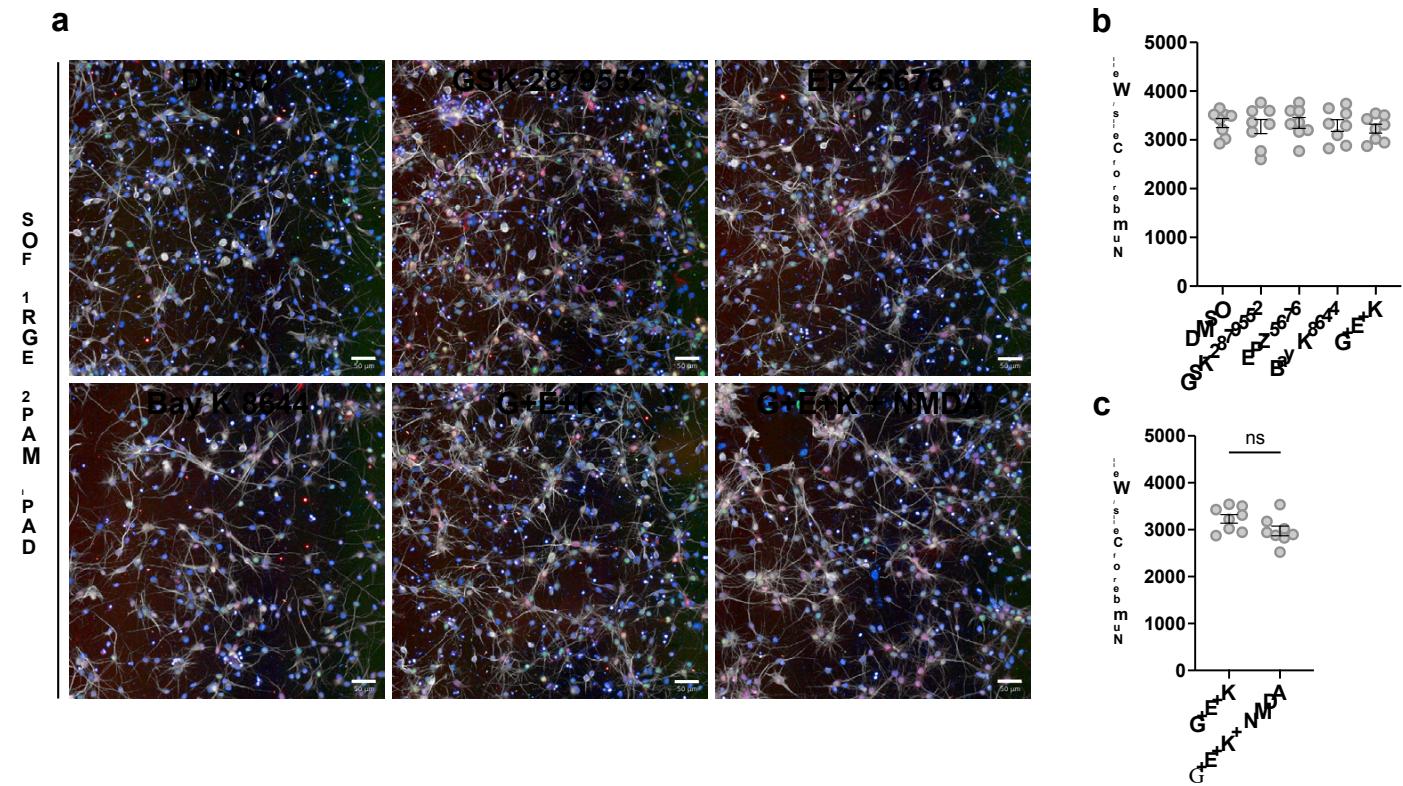
附图5 | 使用促成熟小分子化合物(d7-14期处理)的21天神经元RNA-seq结果。a、经DMSO、两种表观遗传药物( )、两种钙内流驱动化合物( )或完整GENtoniK处理的神经元RNA-seq主成分分析。b-d、钙内流激动剂NMDA与Bay K 8644(b)、表观遗传药物GSK-2879552与EPZ-5676(c)或完整GENtoniK(d)相较于DMSO的RNA-seq差异表达火山图。e-f、GENtoniK下调基因(e)与上调基因(f)中过表达生物过程本体类别的热图。RNA-seq结果包含3个生物学重复。热图显示按行标准化后的表达量,基于平均TPM值计算。标注的p值表示差异表达转录本中特定基因本体类别的富集显著性。
附图6 | GENtoniK诱导皮层神经元中多种代谢通路的转录激活。a-c、RNA测序结果的基因集富集分析显示,经GENtoniK处理的神经元在氧化磷酸化(a)、经典糖酵解(b)及脂肪酸代谢©等基因本体类别中呈现富集。样本量 \varprojlim 2 为3个生物学重复。
附图7 |未处理第10天未成熟神经元中LSD1与DOT1L靶向组蛋白修饰的CUT&RUN分析。a、左图:H3K4me2在转录起始位点周边12Kb区域内相对于IGG对照的标准化基因组富集谱。右图:H3K4me2峰在全基因组基因特征中的分布。b、左图:H3K79me2在转录起始位点周边24Kb区域内相对于IGG对照的标准化基因组富集谱。右图:H3K79me2峰在全基因组基因特征中的分布。c-e、H3K79me2峰中显著过度代表的基因本体类别相对于IGG对照的富集情况,并展示各类别中代表性基因的轨迹图:GO:0001764-神经元迁移与GO:0007411-轴突导向(c)、GO:0016569-染色质共价修饰(d)以及GO:0006397-mRNA加工(e)。所显示的p值表示H3K79me2峰内基因在指定本体类别中的富集显著性。
补充图8 | GENtoniK促进诱导多能干细胞(iPSC)分化的皮质神经元成熟。a-d 源自重编程的正常肺成纤维细胞系MRC5的神经元( 个微孔板培养孔):代表性高内涵成熟测定图像(a),及成熟参数量化:细胞核尺寸(b)、神经突长度(c)和KCl诱导的即刻早期基因表达(d)。e-h 源自10岁男性重编程皮肤成纤维细胞的神经元( 个微孔板培养孔):代表性高内涵成熟测定图像(e),及成熟参数量化:细胞核尺寸(f)、神经突长度(g)和KCl诱导的即刻早期基因表达(h)。双尾韦尔奇t检验;星号表示统计学显著性。黑色线条代表平均值。误差线表示标准误。比例尺为 微米。
补充图9 | GENtoniK优化并补充了其他神经元成熟策略。a、在基础Neurobasal培养基、BrainPhys培养基 BDNF、添加GENtoniK的Neurobasal培养基以及添加GENtoniK的BrainPhys+BDNF培养基中,培养35天的人多能干细胞来源皮质神经元的MAP2、FOS和SYN1免疫荧光染色。b-e、从铺板第7天起接受GENtoniK与DMSO处理的神经元成熟参数时序定量:KCl诱导的FOS表达(b)、神经突长度(c)、细胞核尺寸(d)及SYN1斑点密度(e)。每7天收取培养板进行分析。
在DMSO/GENtoniK处理开始后7天开始。 个微孔板孔。误差棒代表标准误。比例尺为 微米。
补充图10 | GENtoniK降低前脑类器官中迁移标志物表达并提升神经元活性标志物表达。a、在日龄60的前脑类器官中,于第15至50天期间接受DMSO(上图)或GENtoniK(下图)处理后,进行FOS、DCX及MAP2免疫荧光染色的代表性图像。比例尺为 微米。
附图11 | GENtoniK增强hPSC衍生β样细胞的动态胰岛素分泌及胰岛素 颗粒。a、逐步分化方案示意图。hESC来源的未成熟β样细胞于第20-27天接受GENtoniK或DMSO处理。b,c、hESC衍生细胞经GENtoniK或对照处理7天并停药培养2天后,在 D-葡萄糖环境下的动态KCl刺激人胰岛素分泌曲线(b)及曲线下面积©。倍数变化通过各时间点胰岛素分泌量与2 mM D-葡萄糖条件下平均分泌量的比值计算。 个生物学重复。d、显示β样细胞中胰岛素免疫金标记的代表性电镜图。圆圈标示胰岛素+颗粒( 金颗粒)。放大倍数 倍。e、对照组与GENtoniK处理组β样细胞中胰岛素+颗粒百分比 )。c和e采用双尾学生tt检验;星号表示统计学显著性。误差线代表标准误。
¶ 参考文献
Fig. 1
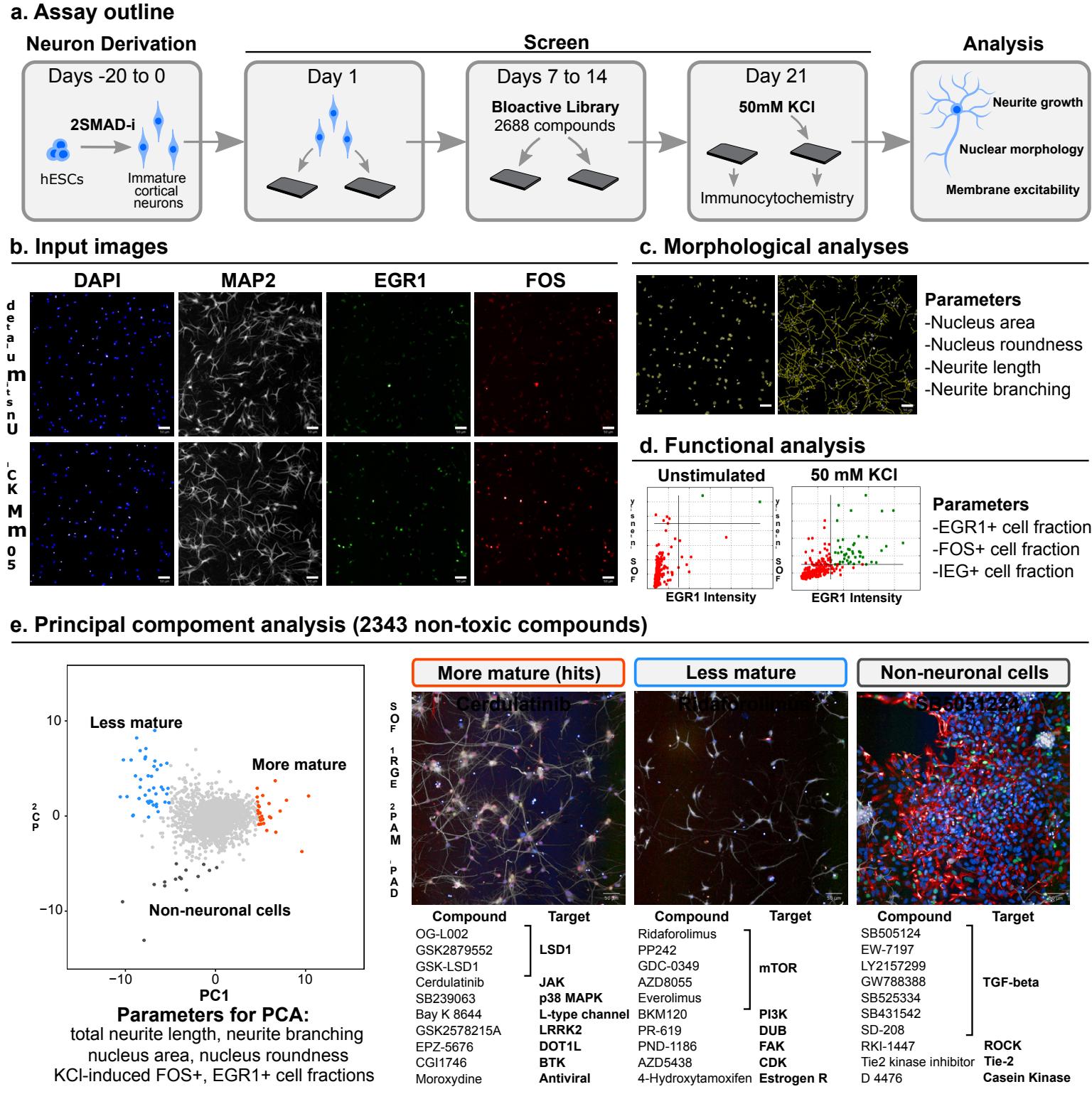
Fig. 2
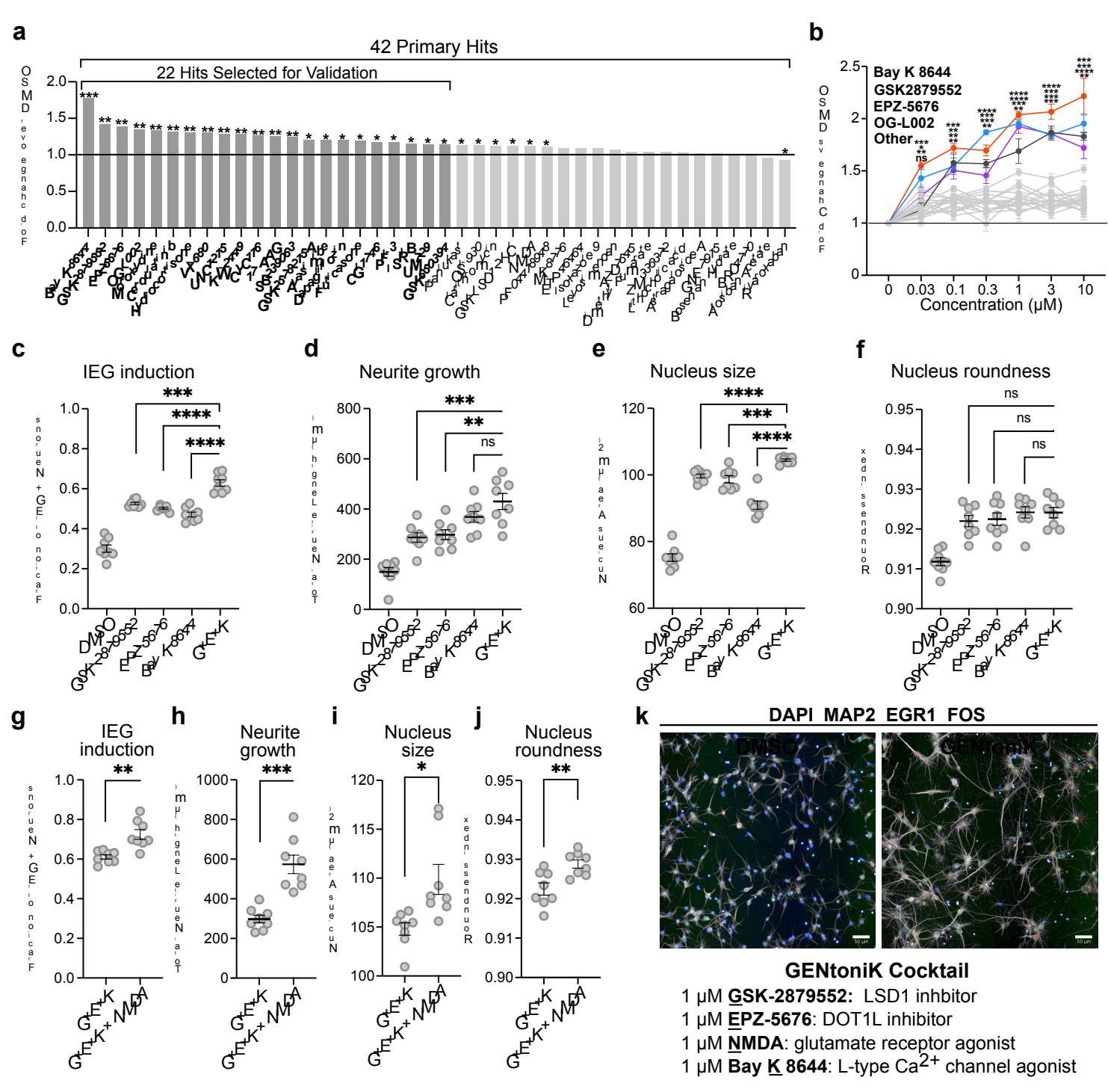
Fig.3
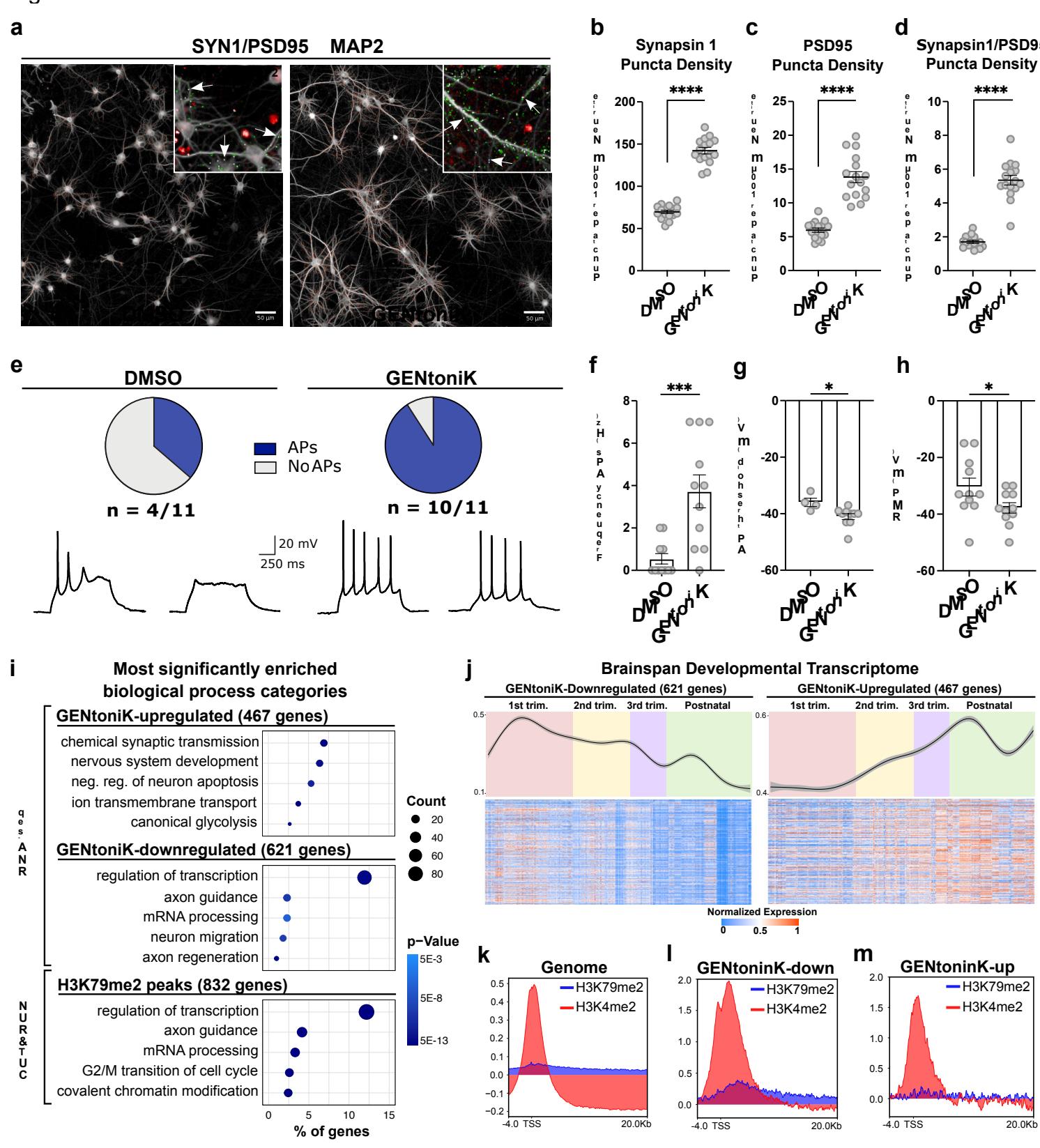
Fig. 4
hPSC cortical organoids
supp. Fig. 1
supp. Fig. 2
supp. Fig. 3
supp. Fig. 4
a. 单参数选择(不包括PCA命中)

b. 按成熟度参数排序的命中结果
Supp. Fig. 5
Supp. Fig. 6
Supp. Fig. 7
Supp. Fig. 8
Supp. Fig. 9
Supp. Fig. 10
Supp. Fig. 11