¶ 轴突形态和内在细胞特性决定重复性经颅磁刺激诱导可塑性的阈值
¶ Axon morphology and intrinsic cellular properties determine repetitive transcranial magnetic stimulation threshold for plasticity
克里斯托斯 加拉尼斯1, 莉娜 诺伊豪斯1, 尼古拉斯 哈纳内亚2, 若尔特 图里1, 彼得 耶德利奇卡2,安德烈亚斯 弗拉霍斯 1,3,4*
1 德国弗莱堡大学医学院解剖与细胞生物学研究所神经解剖学系
2 德国吉森贾斯图斯-李比希大学3R中心吉森分部
3 德国弗莱堡大学BrainLinks-BrainTools中心
4 德国弗莱堡大学医学院神经调控基础中心
关键词:突触可塑性,形态学,轴突,抑制,兴奋,全细胞膜片钳记录,类器官组织培养
引言:重复经颅磁刺激(rTMS)是神经病学和精神病学中广泛使用的治疗工具,但其细胞和分子机制尚未完全阐明。在实验和临床环境中,标准化刺激参数(特别是电场强度)至关重要。这有助于实现不同研究之间的有效比较,并推动研究成果向临床实践转化。然而,受刺激神经元及神经网络固有的生物物理学特性对rTMS方案效果的影响仍未得到充分认识。因此,在不同脑区和个体间实现生物学效应的标准化仍面临重大挑战。
方法:本研究比较了 重复磁刺激(rMS)对小鼠和大鼠内嗅-海马组织培养物的影响,从而揭示相同刺激方案在标准化条件下对类似神经元网络的作用。
结果:我们在小鼠和大鼠的组织培养中均观察到先前报道的CA1锥体神经元兴奋性和抑制性突触强度的可塑性变化,但诱导大鼠组织培养中rMS介导的突触可塑性需要更高的刺激强度。通过系统比较神经元结构与功能特性并结合计算建模,我们发现仅靠CA1锥体神经元的形态学参数不足以解释组间差异。尽管小鼠与大鼠CA1神经元形态未见显著差异,但模拟实验证实轴突形态会显著影响单个细胞的激活阈值。值得注意的是,内在细胞特性的差异足以解释大鼠组织培养中诱导突触可塑性所需强度增加 的现象。
结论:这些发现表明,轴突形态学和内在细胞特性在预测rTMS可塑性效应方面具有至关重要的作用,对于开发旨在预测和标准化rTMS生物效应的计算机模型具有重要意义。
¶ 引言
重复经颅磁刺激(rTMS)是一种非侵入性技术,能够在刺激周期结束后持续调节皮层兴奋性(Chen等 人,1997;Huang等 人,2005;Suppa等 人,2016)。尽管该技术日益广泛用于治疗神经精神疾病(如重度抑郁症)(Cocchi等人,2018;Garnaat等 人,2018;Rehn等 人,2018;Voigt等 人,2019;Somaa等人,2022),但其在人类皮层网络中的细胞与分子机制尚未被充分阐明(Müller-Dahlhaus与Vlachos,2013;Cirillo等人,2017)。通过体内外动物模型研究,学界对rTMS调节神经环路兴奋性与可塑性的机制获得了重要认知(Vlachos等人,2012;Tokay等 人,2014;Lenz等 人,2016;Hong等 人,2020;Romero等 人,2022;Eichler等 人,2023)。例如研究表明,rTMS可影响兴奋性与抑制性突触的功能和结构特性(Tokay等 人,2009;Vlachos等 人,2012;Lenz等 人,2016),并能促进异常皮层环路的重组(Tang等人,2021;Moretti等人,2022)。高频rTMS可增强初级运动皮层可塑性,改善老年小鼠的认知缺陷(Ma等 人,2019;Cambiaghi等 人,2021)。相反,低频rTMS能诱发海马齿状回可塑性,产生潜在抗抑郁样效应(Cambiaghi等 人,2020)。最新实验证据表明,大脑驻留免疫细胞——小胶质细胞参与了rTMS诱导的突触可塑性过程(Eichler等 人,2023)。
尽管rTMS在动物模型中展现出显著的神经生物学效应,但其在人类中的疗效存在显著差异(Goldsworthy等 人,2014;López-Alonso等 人,2014;Vallence等 人,2015;Guerra等 人,2020),这主要源于剂量标准化等挑战(Peterchev等 人,2012;Turi等人,2021)。为提升重复性并深入理解单脉冲与rTMS在不同脑区的效应,学界已投入大量努力以标准化跨脑区和受试者的电场强度(Opitz等 人,2011;Thielscher等 人,2011;Saturnino等人,2019)。与此同时,越来越明确的是,预测TMS感应电场强度与方向的计算模型必须延伸至生物效应层面,即电场必须与生物物理现实模型相耦合(Aberra等人,2018;Shirinpour等 人,2021)。这些计算方法确实为理解神经元形态(特别是轴突与髓鞘化)的作用提供了重要见解,它们对单脉冲TMS似乎具有关键影响(Aberra等人,2020)。然而,大多数模型依赖于急性脑切片或“人工轴突”的部分重建,这凸显了实现完整神经元形态学面临的挑战。尽管已有研究尝试通过模拟rTMS诱导的细胞内钙水平变化来预测可塑性结果(Shirinpour等 人,2021),但目前对于调控rTMS诱导突触可塑性的剂量-反应关系的认知仍十分有限。因此,现阶段还无法实现跨脑区与受试者的突触可塑性诱导计算与标准化
本研究采用跨物种分析方法,旨在阐明 重复磁刺激(rMS)对小鼠和大鼠内嗅-海马切片培养物中CA1锥体神经元的影响(参见Vlachos等 人,2012;Lenz等 人,2016;Eichler等人,2023),其理论基础在于CA1区域已被充分证实的神经连接性与可塑性。这一研究方法使得我们能够深入探索在高度标准化的重复磁刺激(rMS)条件下,两种相似但不同的神经元网络中突触可塑性诱导的研究发现:大鼠脑片培养物中的CA1锥体神经元诱导可塑性所需的刺激强度(以最大刺激器输出MSO测量)比小鼠高 。通过结合轴突形态重建的多尺度单细胞建模,我们的研究结果表明,仅凭神经元形态无法预测rTMS可塑性阈值。但轴突形态会显著影响跨物种单个细胞的激活阈值。内在细胞特性的差异足以解释大鼠组织培养中诱导突触可塑性所需强度增加 的现象。因此,内在细胞特性对决定rTMS对可塑性的影响至关重要。这些发现突显了在计算机预测激活阈值和标准化rTMS诱导突触可塑性时,综合考虑形态学与内在特性的重要意义。
¶ 材料与方法
¶ 伦理声明
小鼠和大鼠在12小时光照/黑暗循环条件下饲养,食物和水自由摄取。我们竭力减少动物的痛苦和疼痛。所有实验程序均遵循德国动物福利法规,并得到弗莱堡大学相关动物福利委员会及动物福利官的批准。
¶ 动物
本研究使用了C57BL/6J品系的小鼠和Wistar (Crl:WI)品系的大鼠,两种性别的个体均有采用。
¶ 实验设计
器官型组织培养取自出生后3-5天的雌雄小鼠和大鼠,在实验评估前于湿润环境中成熟培养3周。培养物在标准35毫米培养皿中接受rMS刺激(10赫兹,900个脉冲);假刺激组除不施加刺激外经历相同操作。全细胞电压钳与电流钳记录在刺激后2-4小时进行。同时对未刺激的切片培养组织进行高密度微电极阵列记录和电流钳记录,以确定物种特异性差异。对未刺激的组织培养中的CA1锥体神经元进行后期染色,并采用Neurolucida 360软件(版本2019.1.3;MBF Bioscience)进行三维重建,这些重建结果被用于多尺度单细胞建模。
¶ 器官型组织培养的制备
米厚的包含海马体和内嗅皮层的器官型组织培养在出生后第3-5天从雌雄不限的小鼠和大鼠中制备,如先前所述(Vlachos等人,2012;Galanis等人,2021。组织培养物在实验评估前需于 、 CO2的培养箱中维持至少18天。组织培养液每周更换3次,其成分为: (体积比)MEM、 (体积比)基础鹰氏培养基、 (体积比)热灭活正常马血清、25毫米HEPES、 (质量体积比)NaHCO3、 (质量体积比)葡萄糖、0.1毫克/毫升链霉素、100单位/毫升青霉素及2毫米谷氨酰胺增强剂(使用HCl或NaOH调节pH值至7.3)。
¶ 体外重复磁刺激
将组织培养物转移至标准的35毫米培养皿中,皿内充注标准细胞外溶液( 、 、 、2mM CaCl2、 葡萄糖、 HEPES、 链霉素、 青霉素, ,预热至 ;通过蔗糖调节渗透压至 )。将连接Magstim Super Rapid2 Plus1刺激器(Magstim公司)的70毫米八字形线圈(D70空气薄膜线圈,Magstim公司)置于培养皿盖上方1毫米处,采用900个脉冲、10赫兹的刺激方案对培养组织进行刺激。组织培养物的定向放置使组织内感应电场与CA1锥体神经元的树突结构大致平行。另设相同种属及时间匹配的未刺激培养组作为对照,该组除不施加刺激外其他处理条件完全相同。
¶ 全细胞电压钳记录
对CA1锥体神经元进行全细胞电压钳记录的方法如前人所述(Vlachos等人,2012;Lenz等人,2016;Galanis等人,2021)。记录在 条件下进行。浴液成分为 、 KCl、 NaHCO3、 NaH2PO4、 、2 和 葡萄糖,并用 CO2饱和。在浴液中加入 D-APV和 TTX的条件下记录微型 -氨基-3-羟基-5-甲基-4-异恶唑丙酸受体介导的兴奋性突触后电流(mEPSCs),此时电极内液包含 葡萄糖酸钾、 、 ATP-Mg、 GTP-Na2、 磷酸肌酸、 HEPES及 生物胞素(用KOH调节pH至7.25,用蔗糖调节渗透压至 )。在浴液中加入 TTX、 M D-APV和 CNQX的条件下记录微型抑制性突触后电流(mIPSCs),此时电极内液包含 、 、 、2 mM Mg-ATP、 Na2-GTP、 EGTA和 HEPES(用CsOH调节pH至 ,用蔗糖调节渗透压至 )。神经元保持电位设定为 。每2-4分钟监测串联电阻,当串联电阻达到 且漏电流发生显著变化时,相应记录数据即被弃用。
¶ 全细胞电流钳记录
在 环境下对CA1锥体细胞进行全细胞电流钳记录。浴液成分为: NaCl、2.5 mM KCl、 NaHCO3、1.25 mM NaH2PO4、2 mM CaCl2、2 mM MgCl2、 葡萄糖、 D-APV、 CNQX,以及溶液中含有 甲基碘化荷包牡丹碱,并用 O CO饱和。膜片钳电极内液包含 葡萄糖酸钾、 KCl、4 mM ATP-Mg、 GTP-Na2、 磷酸肌酸、 HEPES及 (w/v)生物胞素(用KOH调节pH至7.25,蔗糖调节渗透压至 )。通过1秒时长的10 pA电流阶跃注射,将神经元从−100 pA超极化去极化至 。当串联电阻达到≥15 MΩ时,记录数据予以废弃。
¶ 高密度微电极阵列记录
对小鼠和大鼠组织培养物进行的高密度微电极阵列记录在3 条件下进行。浴液成分与用于电压钳记录的溶液相似,未添加任何药物。将培养组织置于Accura HD-MEA芯片(3Brain,瑞士)上,记录前适应2分钟。使用BioCAM DupleX系统(3Brain,瑞士)对每个组织培养样本进行10分钟记录。
¶ 神经元填充、事后染色及成像
CA1锥体神经元采用含 葡萄糖酸钾、 氯化钾、 ATP-Mg、 GTP-Na2、 磷酸肌酸、 M HEPES及 生物胞素的电极进行膜片钳记录(用KOH调节pH至7.25,蔗糖调节渗透压至 )。神经元在全细胞模式下保持至少10分钟,期间以 频率通过100毫秒的2 电流注射使其去极化。组织培养物在含 多聚甲醛和 蔗糖的0.01 M PBS溶液中固定1小时,后续处理及成像方法参照先前研究(Galanis等 人,2021)。
¶ 神经元重建
CA1 锥体细胞使用 Neurolucida 360(版本 2019.1.3;MBFBioscience)进行了重建,如先前所述(Shirinpour et al., 2021)。胞体使用轮廓法在二维中重建,以避免由于用于填充细胞的体细胞全细胞记录方法以及这些区域的高信号强度导致的胞体体积高估。
¶ 电场建模
采用有限元方法构建了包含两个区域的三维网格模型,分别代表浴液和组织培养物。网格模型的物理尺寸基于体外实验设置的物理参数,线圈与培养皿距离为1毫米,线圈位于培养物上方。浴液和培养物的电导率分别设定为 和0.275 。线圈电流变化率在 MSO条件下设置为 ,并按更高刺激强度进行比例放大。宏观电场模拟通过SimNIBS(3.2.6)和MATLAB(2023a)实现,所有模拟均采用经验证的70毫米MagStim八字形线圈(Thielscher和Kammer,2004)。第99百分位电场的稳健最大值是从组织培养的体积区室中提取的。
¶ 单细胞建模
重建结果被导入NeMo-TMS流程系统,并配备Jarsky模型(Jarsky等人,2005)。当轴突进行"交换"时,原始轴突在胞体或树突交叉点被移除,替换为从相同位置截断的另一细胞轴突。所有细胞均以顶树突指向正y轴方向为标准取向,轴突相对方位在交换过程中保持不变。在单细胞模拟中,经颅磁刺激被模拟为强度可变的均匀电场,其阈值定义为能诱发胞体动作电位的最小TMS幅度。
¶ 实验设计与统计分析
数据分析由对实验条件不知情的人员进行。本项目对每只动物使用一到两个组织培养样本。电生理数据采用pClamp 11.2软件套件(Molecular Devices)、Easy Electrophysiology 2.5.0.2(Easy Electrophysiology Ltd.)及BrainWave(3Brain)软件进行分析。统计比较采用曼-惠特尼检验(用于两组比较)、双因素方差分析和克鲁斯卡尔-瓦利斯检验,具体方法见图注和正文说明(GraphPad Prism 7软件)。p值小于 视为具有显著差异。所有数据均表示为平均值±标准误。
¶ 数字绘图
共聚焦图像堆栈被导出为二维投影并存储为TIFF文件。图表使用Photoshop图形软件(Adobe)进行制作。调整了图像的亮度和对比度。
¶ 结果
¶ 重复磁刺激诱导小鼠CA1锥体神经元兴奋性与抑制性突触可塑性
采用10赫兹刺激方案(包含900个脉冲,强度为 最大刺激输出)评估重复磁刺激对小鼠脑组织培养突触可塑性的影响(图1A-C)。在刺激后2-4小时,对单个CA1区锥体神经元进行膜片钳记录,并检测AMPA受体介导的微小兴奋性突触后电流。与我们既往研究一致(参见Vlachos等人2012;Lenz等人2015、2020;Eichler 等人2023),相较于除未接受10赫兹重复磁刺激外其他处理完全相同的同期对照组培养物(对照组;图1D,E),实验组培养物中观察到平均微小兴奋性突触后电流幅值的显著增加。
在另一组文化实验中,我们 采用上述实验方法评估了 重复磁刺激对CA1锥体神经元GABA受体介导的微小抑制性突触后电流的影响。正如我们先前研究所述(图1F,G;参见Lenz等人2016年研究),这些实验观察到平均mIPSC振幅的降低。该结果证实了10Hz重复磁刺激对小鼠内嗅海马组织培养中CA1锥体神经元的mEPSC与mIPSC振幅具有显著影响,这一现象与兴奋性突触的增强及抑制性突触的抑制效应相吻合。
¶ 重复磁刺激在 最大刺激输出下不影响大鼠海马CA1区锥体神经元的突触强度
对取自大鼠脑部的组织培养物施加了相同的 方案(10Hz,900个脉冲, MSO)(图2),旨在评估rMS在两种相似但不同的神经元网络中的效应。与同龄小鼠组织培养物相比,匹配周龄的大鼠内嗅-海马培养物显示出更大的横截面积(图2A),而CA1锥体神经元未见明显形态学差异(图2B)。对CA1锥体神经元AMPA受体介导的mEPSCs记录显示,对照组与 rMS刺激组之间无统计学显著差异(图2C,D)。抑制性突触强度亦未受影响,刺激后2-4小时检测到的平均mIPSC振幅和频率均无显著差异(图2E,F)。
¶ 宏观电场模拟显示,小鼠和大鼠组织培养物中会产生不同的最大电场
通过计算建模描述了小鼠和大鼠切片培养物中感应的电场强度(Saturnino等人,2019)。采用有限元方法建立了包含两个分区(即浴液和切片培养物)的三维网格模型(图3A)。网格模型的物理尺寸根据小鼠和大鼠脑组织培养物获得的数据进行了调整(图3B)。宏观电场建模显示, MSO强度刺激下,小鼠组织培养物中产生的电场( )强于大鼠组织培养物( )。基于模型计算,我们确定对大鼠组织培养物施加 MSO刺激所产生的电场强度,与估算的小鼠组织培养物在 MSO刺激下的电场强度相当(图 3C)。据此,对另一组大鼠组织培养物施加 MSO( ,900个脉冲)刺激,并在刺激后2-4小时记录CA1锥体神经元的AMPA受体介导的mEPSCs。这些实验中未观察到平均mEPSC振幅和频率的显著差异(图3D)。我们得出结论:基于模拟的电场标准化可能不足以在小鼠和大鼠CA1锥体神经元(即嵌入具有相似结构和特性网络中的神经元)中实现可比拟的生物学效应。
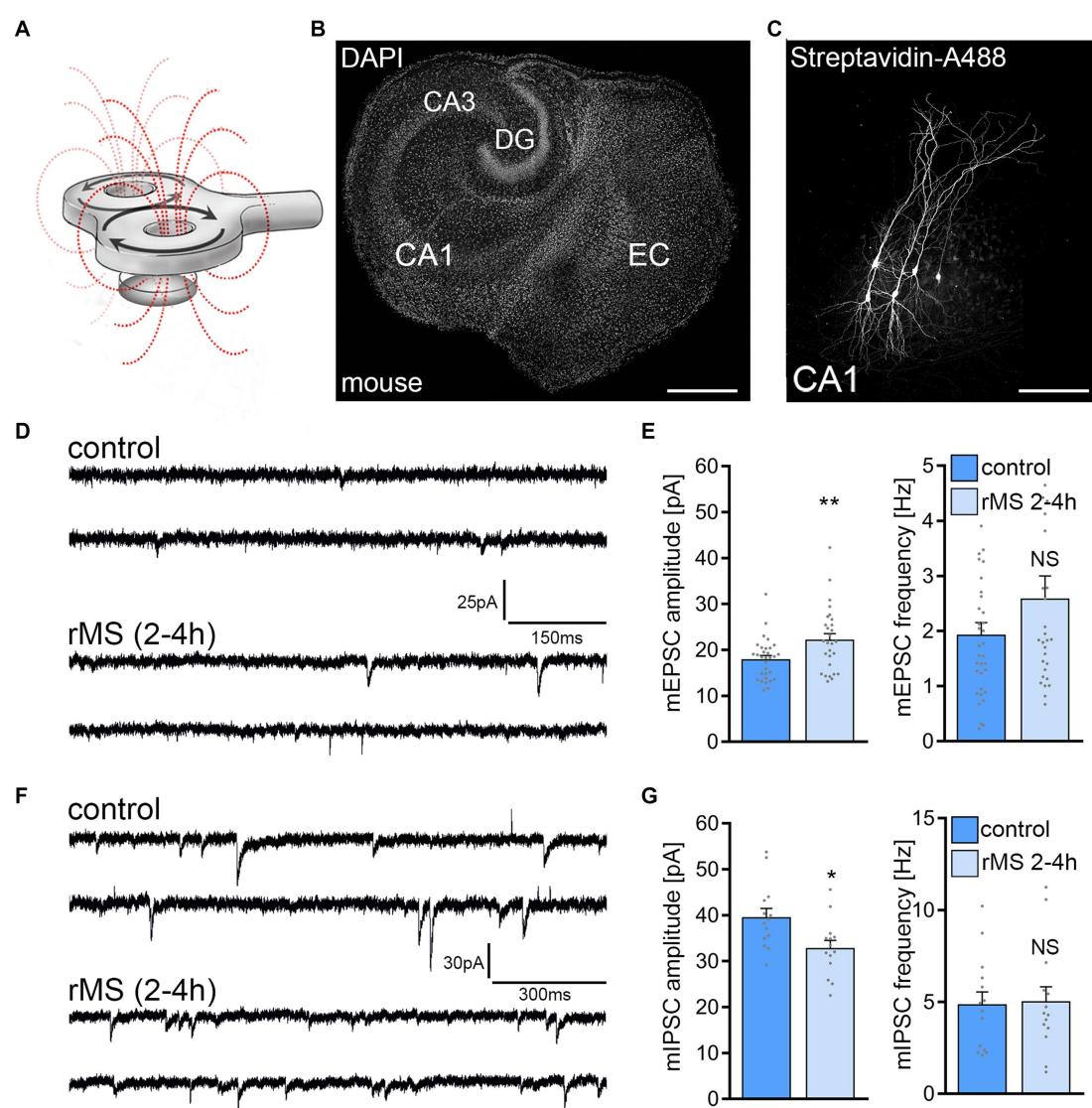
图1 10赫兹重复磁刺激(rMS)诱导小鼠CA1锥体神经元突触可塑性。(A)实验设置示意图。使用70毫米八字线圈在充满细胞外液的35毫米标准培养皿中对器官型组织培养物进行刺激(900个脉冲,10赫兹, 最大刺激输出)。(B)器官型组织培养物全景。DAPI显示的细胞结构:DG为齿状回;EC为内嗅皮层;CA1和CA3分别为Cornu Ammonis区域1和3。比例尺 微米。©灌录的CA1锥体神经元填充生物胞素并经链霉亲和素-A488post hoc标记。比例尺 微米。(D,E)刺激后2-4小时,假刺激组(对照)与rMS刺激组培养小鼠CA1锥体神经元记录的AMPA受体介导的微型兴奋性突触后电流(mEPSCs)样本轨迹与群体数据(对照组n 个细胞;rMS组n 个细胞;Mann-Whitney检验)。(F,G)刺激后2-4小时,假刺激组与rMS刺激组培养小鼠CA1锥体神经元记录的GABA受体介导的微型抑制性突触后电流(mIPSCs)样本轨迹与群体数据(对照组n 个细胞;rMS组n 个细胞;Mann-Whitney检验)。本图及后续图中灰色圆点代表独立数据点。数据以均值 标准误表示。NS无统计学意义。 , 。
¶ 小鼠和大鼠的组织培养中的基线网络活动无显著差异。
为检测小鼠与大鼠内嗅-海马切片培养物自发性网络活动的差异,我们采用高密度微电极阵列记录技术,在另一组3周龄小鼠和大鼠组织培养物中记录了基础放电率与场电位频率(图4A,B)。在这些实验中,小鼠与大鼠组织培养物在放电率和场电位频率方面均未观察到显著差异(图 4C-F)。我们认为基线网络活动并非导致rMS 无法在大鼠 CA1 锥体神经元中诱导可塑性。
¶ 培养的小鼠和大鼠CA1锥体神经元在结构特性上无显著差异
为探究CA1区锥体神经元尺寸与结构复杂性的差异能否解释重复磁刺激疗效的个体差异,我们重建了来自大鼠和小鼠海马组织的生物胞素填充及链霉亲和素-A488染色的CA1锥体神经元并对它们的树突和轴突进行了分析(图 5)。这一研究的动机是基于观察到小鼠和大鼠的脑部大小以及它们的组织培养物存在差异。
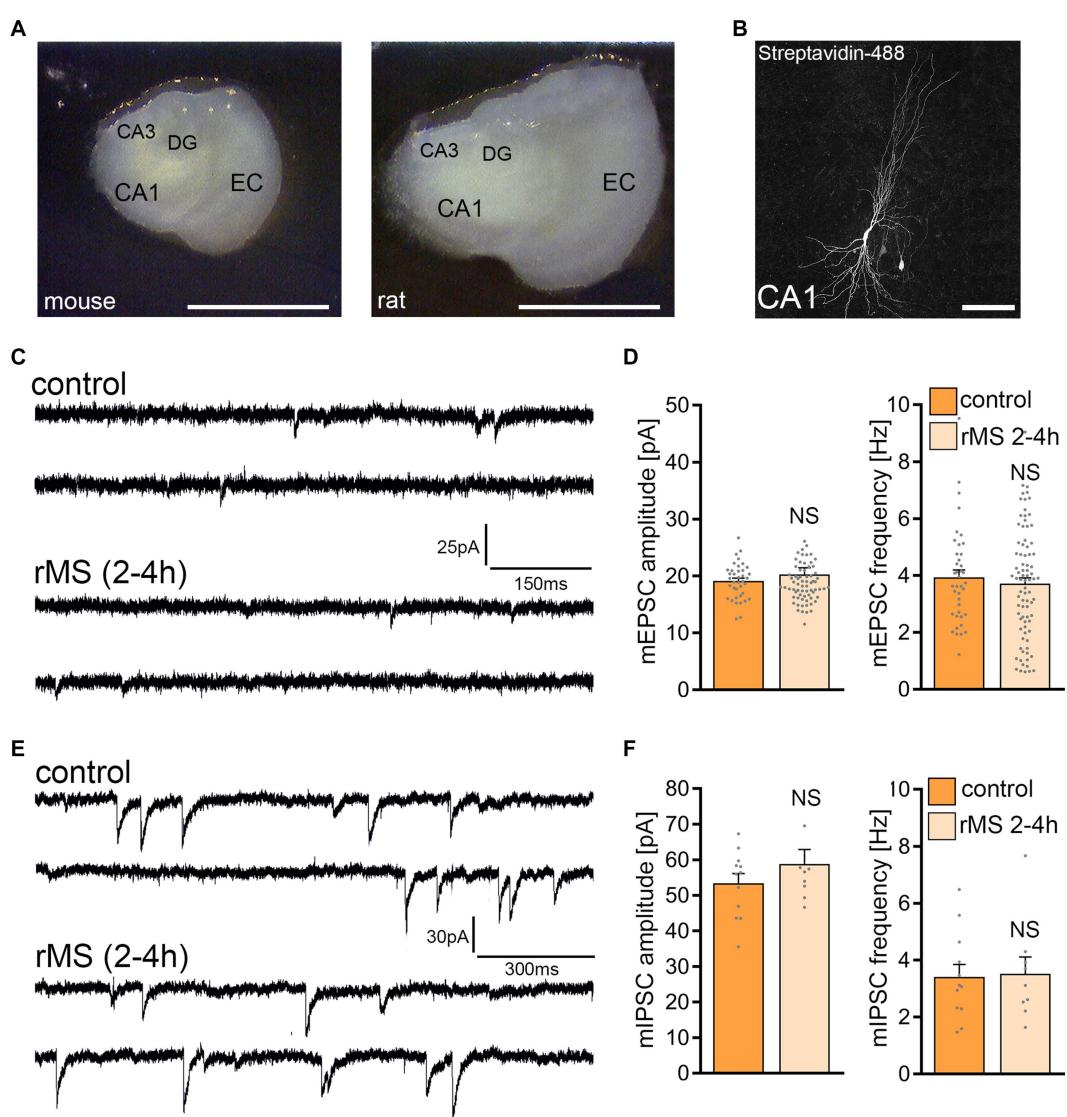
图2 10赫兹重复磁刺激(rMS)以 最大刺激器输出未能诱导大鼠CA1锥体神经元突触可塑性。(A)小鼠与大鼠器官型组织培养的概览图。DG,齿状回;EC,内嗅皮层;CA1与CA3,Cornu Ammonis1区和3区。比例尺1500μ微米。(B)填充生物胞素并经链霉亲和素-A488post hoc标识的大鼠CA1锥体神经元膜片。比例尺50μ微米。(C,D)假刺激(对照组)与rMS刺激培养组在刺激后2-4小时记录的大鼠CA1锥体神经元AMPA受体介导的微型兴奋性突触后电流(mEPSCs)样本轨迹及组数据(对照组n 个细胞;rMS组n 个细胞;曼-惠特尼检验)。(E,F)样本
在大鼠CA1锥体神经元上记录的GABA受体介导的微型抑制性突触后电流(mIPSCs)轨迹与群体数据,分别取自假手术(对照)组和经重复磁刺激(rMS)组在刺激后2–4小时培养的神经元(对照组: 个细胞;rMS组: 个细胞;Mann–Whitney检验)。数据以均值 标准误表示。NS表示无统计学差异。
两组在顶端和基部树突长度方面未观察到显著差异(图5C、D)。Sholl分析和直径/体积分析(图5E–G)显示,内嗅-海马组织培养物中大鼠与小鼠CA1锥体神经元的树突及其复杂度无统计学差异。同样,在小鼠和大鼠组织培养中重建并比较CA1轴突时也未发现显著差异(图5I–L)。我们得出结论:CA1锥体神经元的结构特性不存在统计学差异,且基于电场模拟的电场强度高度匹配时,仍无法解释为何大鼠组织培养对10 Hz重复磁刺激无响应。
¶ 现实多尺度单细胞建模预测小鼠与大鼠CA1锥体神经元在 诱导去极化方面无显著差异
我们通过一个多尺度计算模型评估了rMS对CA1锥体神经元的影响,该模型将rMS的物理输入参数与树突和轴突形态联系起来(图6)。采用这一方法是必要的,因为我们的形态学分析可能未能涵盖与rMS诱导神经元激活相关的关键差异。
在检查小鼠和大鼠CA1神经元的树突结构时,并采用标准化人工轴突于所有细胞中(参见 Aberra 等人,2018;Shirinpour 等人,2021;艾希勒等人(2023)的研究中,我们的模拟显示经颅磁刺激引发的去极化阈值未出现显著差异(图6A,B)。随后我们探究了轴突形态是否可能是实验结果中观察到变异性的潜在原因。通过额外一系列整合真实神经元轴突形态的模拟实验,我们再次发现两组间的去极化阈值并未呈现显著差异(图6C)。
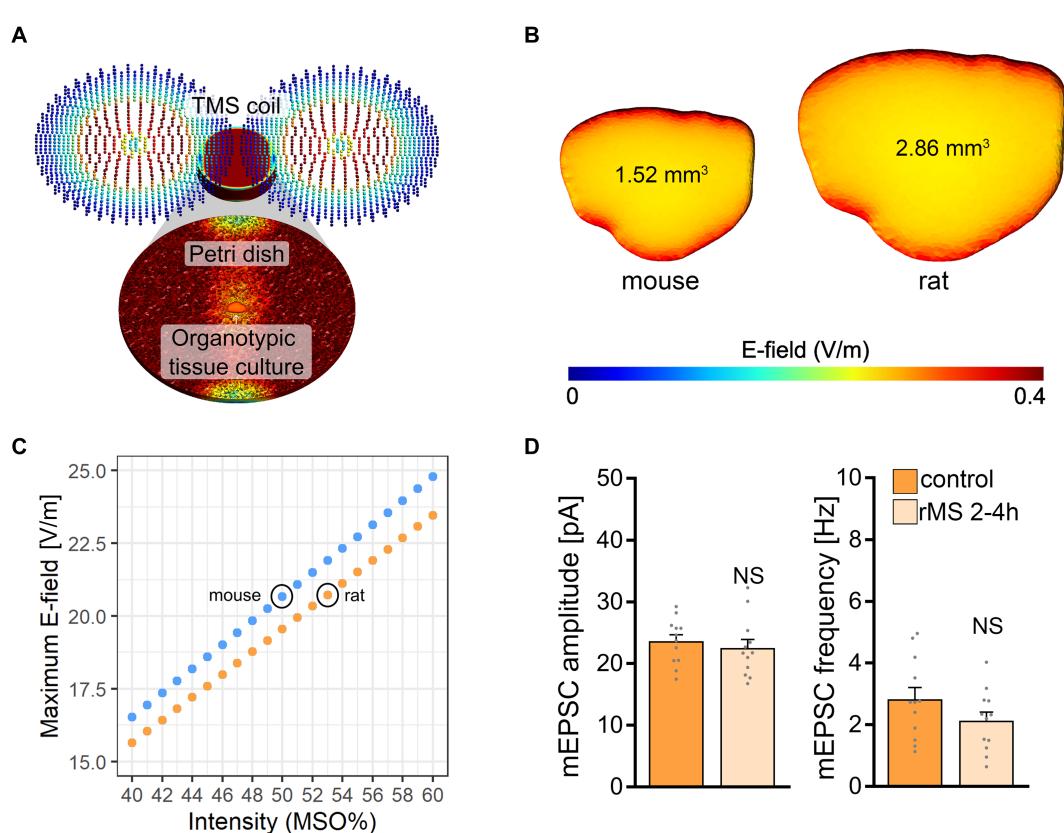
图3 小鼠与大鼠组织培养物中电场建模。(A) 经磁刺激产生的宏观电场仿真可视化图像in vitro。(B) 分别为小鼠与大鼠组织培养物的三维网格模型及单次磁脉冲生成的电场。© 不同刺激强度下小鼠与大鼠组织培养物中产生的最大电场对比。小鼠脑片培养物在 最大刺激器输出时产生的电场,在大鼠组织培养物中需达到 最大刺激器输出方能实现。(D) 假刺激组(对照组)与经rMS刺激的培养组中,刺激后2-4小时记录的大鼠CA1锥体神经元AMPA受体介导的mEPSCs群体数据;刺激强度为 最大刺激器输出(对照组: 个细胞;rMS组: 个细胞;Mann-Whitney检验)。数据表示为平均值 SEM。NS表示无显著性。
这些模拟中浮现出一个值得注意的见解,证实了先前的观测结果(例如Aberra等人,2018,2020):轴突在确立rMS诱导去极化阈值的过程中起着关键作用(表1)。我们通过建立所有小鼠和大鼠细胞中具有最低与最高rMS去极化阈值的轴突连接,对此现象进行了追踪研究。事实上,在所有重建神经元的模拟中观察到去极化阈值存在近两倍的差异(图6D)。然而尽管获得这些模拟结果,小鼠与大鼠组织培养物在rMS触发可塑性方面的差异仍未解决,仅凭树突与轴突形态的相互作用难以完全解释这一现象。
¶ 主动和被动膜特性揭示小鼠与大鼠CA1锥体神经元兴奋性差异
接下来,记录并分析了来自CA1锥体神经元的主动和被动膜特性。确实,这一系列实验发现了小鼠和大鼠CA1锥体神经元在被动和主动特性方面的显著差异(图 7)。
虽然两种物种之间的膜电容未发现显著差异(小鼠:90.7 ;大鼠: ;曼-惠特尼检验; ;数据未显示),但小鼠CA1锥体神经元的输入电阻显著高于大鼠CA1锥体神经元(小鼠: ;大鼠:67.25 ;曼-惠特尼检验; ; )。尽管两种小鼠和大鼠的细胞均处于相当的膜电位静息状态(图 7A-C),电流-电压(I/V)曲线一致表明:与大鼠切片培养中的神经元相比, depolarizing 小鼠CA1锥体神经元所需的电流更少。
观察活性膜特性(图 7D–F),观察到相似的趋势,并具有最显著的差异处于动作电位诱导阈值范围内(小鼠: ;大鼠: ;曼-惠特尼检验; ; 4)及首次峰电位潜伏期(小鼠: ;大鼠: ;曼-惠特尼检验; ; ;数据未显示)。图7F显示,电流注射在小鼠CA1锥体神经元中引发的反应强于大鼠神经元,表现为在较低注射电流下即可诱发更高的动作电位频率。这些结果表明小鼠CA1锥体神经元具有更强的兴奋性,暗示在大鼠组织培养中可能需要更高刺激强度才能诱导rMS介导的可塑性。
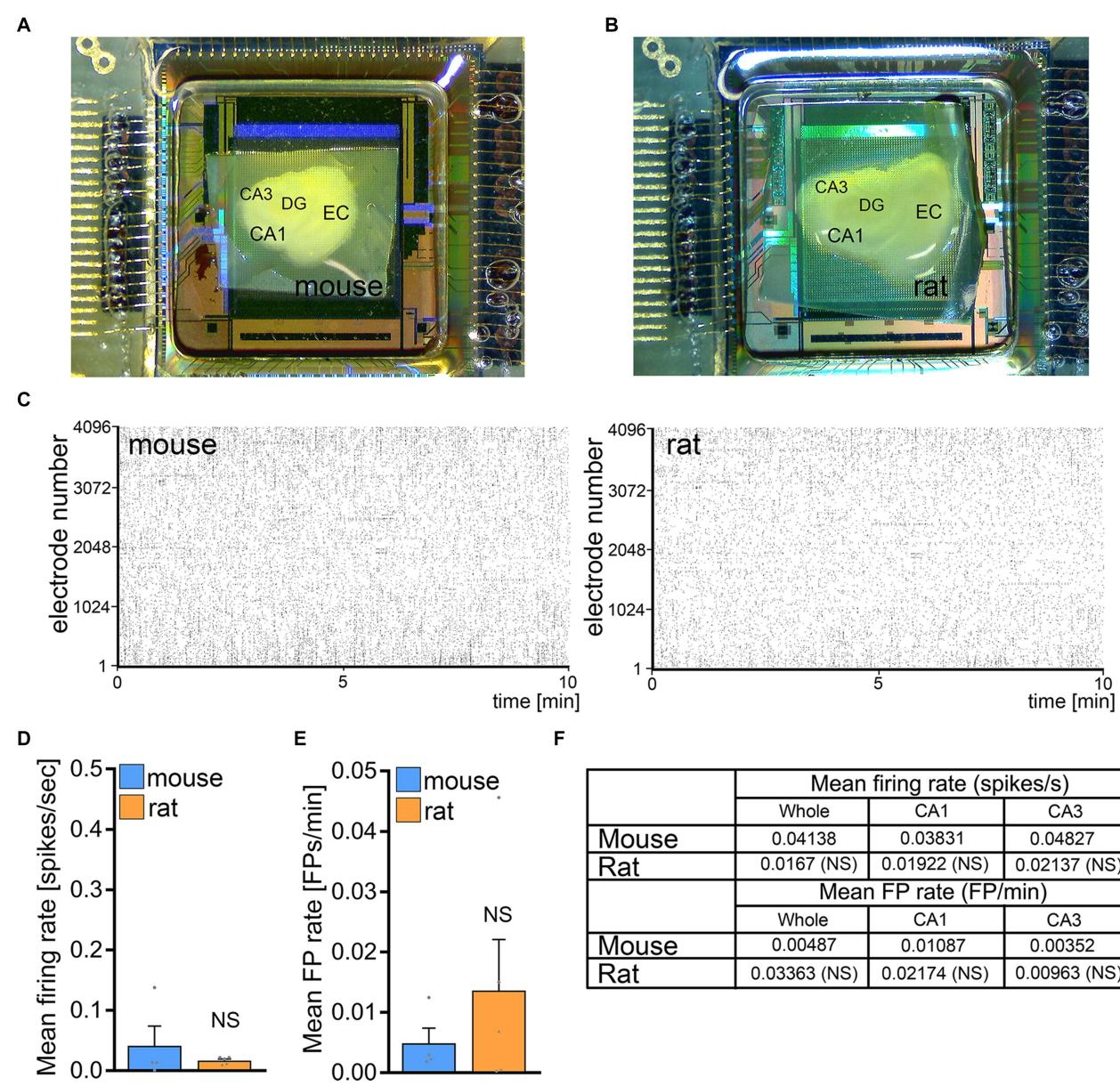
图 4 小鼠和大鼠组织培养物的基线网络活动无显著差异。(A,B) 高密度微电极阵列芯片上小鼠和大鼠组织培养物的概览图。DG,齿状回;EC,内嗅皮层;CA1与CA3,Cornu Ammonis区域1和区域3。© 小鼠和大鼠组织培养物在10分钟记录期间的动作电位点阵图。(D–F) 小鼠和大鼠组织培养物的平均放电频率与平均场电位频率的组间数据(小鼠: 个培养物;大鼠: 个培养物;Mann-Whitney检验)。数据以均值 标准误表示。NS,无显著性差异。
¶ MSO 在大鼠器官型组织培养中诱导 rMS 介导的可塑性
随后,我们 测试了在更高强度下施加10赫兹刺激方案是否会诱导大鼠CA1锥体神经元的可塑性。事实上,当用 MSO的10赫兹rMS刺激大鼠组织培养物时,检测到平均mEPSC幅度的强劲增加(图8A),类似于我们在 MSO刺激的小鼠培养物中观察到的现象(参见图1E)。此外,在另一组大鼠组织培养物中, MSO的rMS刺激后2-4小时,平均mIPSC幅度显著降低(图8B;参见图1G)。这些结果表明大鼠CA1锥体神经元确实表达rMS诱导的可塑性,但需要更高的刺激强度才能实现rMS诱导的兴奋性突触增强和抑制性突触抑制。
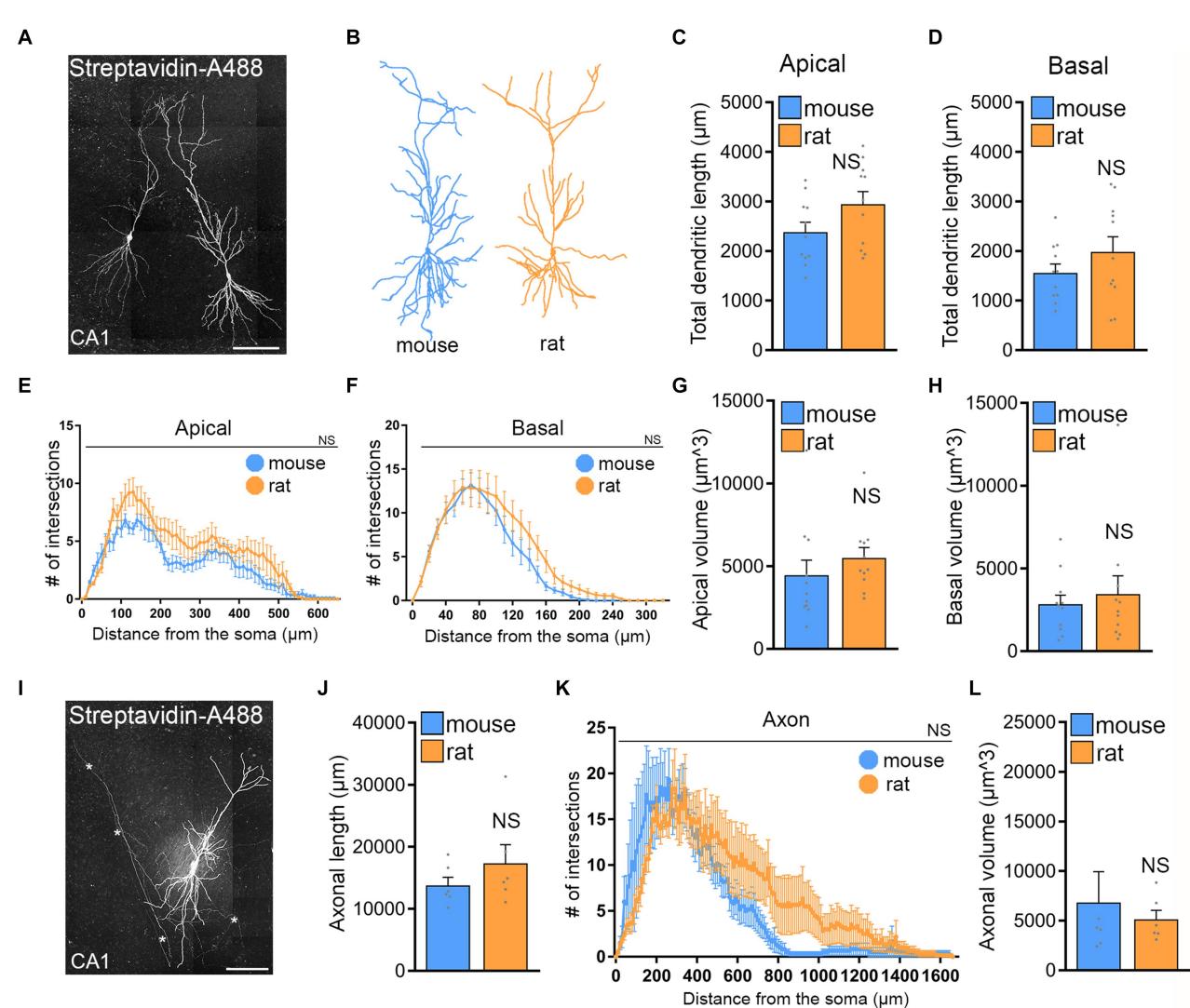
图 5 小鼠和大鼠组织培养中CA1锥体神经元未见显著形态差异。(A) 经膜片钳记录并填充生物胞素的大鼠CA1锥体神经元示例,通过链霉亲和素-A488进行post hoc鉴定,比例尺为100 μ微米。(B) 小鼠与大鼠CA1锥体神经元的三维重建示例。(C–H) 小鼠与大鼠顶树突和基树突的组间数据(小鼠n 个细胞;大鼠n 个细胞;图(C,D,G,H)采用曼-惠特尼检验;图(E,F)采用双因素方差分析)。(I) 经膜片钳记录并填充生物胞素的大鼠CA1锥体神经元,通过链霉亲和素-A488post hoc鉴定,用于包含树突与轴突结构的完整神经元重建,比例尺为 微米。(J–L) 小鼠与大鼠轴突的组间数据[小鼠n 个细胞;大鼠 个细胞;图(J,L)采用曼-惠特尼检验;图(K)采用双因素方差分析]。
¶ 讨论
本研究探讨了影响 rTMS诱导突触可塑性阈值的因素。通过使用小鼠和大鼠的内嗅-海马切片培养模型,我们研究了神经元结构、兴奋性和网络活动。在小鼠CA1锥体神经元中,我们证实了兴奋性突触的已知增强现象和抑制性突触的抑制现象,凸显了在受控条件下rTMS诱导的稳健突触可塑性。然而,尽管具有相似的神经元形态和网络活动在大鼠CA1锥体神经元中,通过前瞻性建模标准化电场并未产生相同的生物效应。通过调整刺激方案以补偿大鼠神经元较低的兴奋性,最终诱导出相似的突触变化。这些结果强调,仅靠电场标准化无法预测rTMS效应,必须建立不同脑区细胞特性的真实区室模型才能实现精准预测。
在过去十年中,重复经颅磁刺激(rTMS)在科研和临床领域的应用呈现显著增长态势(Dayan等人,2013;Paulus等人,2013;Suppa等人,2016;Blumberger等人,2018;Lefaucheur等人,2020;Lorentzen等人,2022)。为此,学界投入大量研究致力于识别影响rTMS对脑组织作用的关键参数(Deng等人,2013;Lefaucheur等人,2020;Zmeykina等人,2020;Turi等人,2021)。这些参数中,感应电场一直是被确定为直接影响rTMS对皮层组织作用效果的关键因素(Liu等,2018)。尽管计算工具的进步使得rTMS感应电场的计算成为可能(Thielscher等,2015),但这些模型主要依赖于目标刺激区域的介观结构参数,即头部和大脑的几何构型。近年来,越来越多研究采用多尺度建模方法来探究TMS对单个神经元的影响(Kamitani等 ,2001;Aberra等 ,2018,2020;Shirinpour等 ,2021)。值得注意的是,这些神经元模型正被整合到介观脑模型中,从而能够探索个体受试者中皮层褶皱及神经元精确定位(例如区分脑回冠与脑沟)的影响效应(Salvador等 ,2011Seo and Jun, 2019; Aberra 等 , 2020; Turi 等 , 2022)。虽然这些模型代表了该领域向标准化和精准医学的重大进展,但越来越明显的是,仅仅模拟电场及其与个体神经元形态(源自动物模型)的相互作用可能不足以预测和标准化rTMS在不同脑区域和个体中的生物效应(Turi 等, 2022)。这项跨物种研究的结果提供了实验证据,强调了细致的实验标准化和电场建模在保证rTMS稳健生物效应方面的不足。值得注意的是,计算模型显示,尽管大鼠组织培养物的大小与小鼠组织培养物存在差异,但其诱导的电场较弱。即使努力被在匹配电场时,大鼠培养物中的可塑性效应无法被重现。
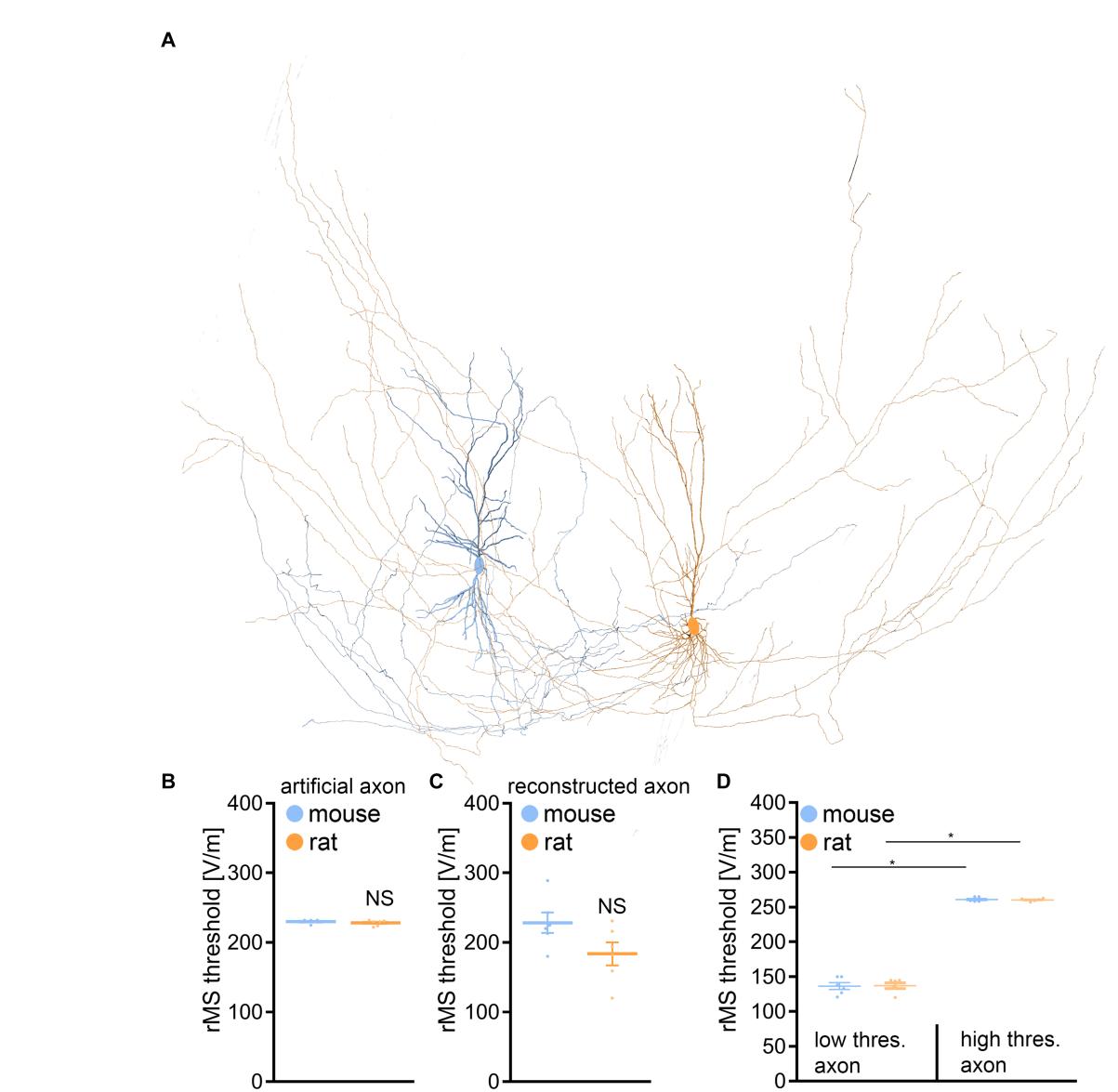
图 6 电磁刺激的多尺度单细胞建模。(A) 在重建的小鼠和大鼠CA1锥体神经元中,采用真实树突和轴突形态对电磁刺激引起的膜电压变化进行建模。(B) 采用标准化人工轴突的真实树突形态组数据(小鼠n 个细胞;大鼠n 个细胞;Mann-Whitney检验)。© 真实树突与轴突形态的模拟组数据(小鼠n 个细胞;大鼠n 个细胞;Mann-Whitney检验)。(D) 按轴突rMS去极化阈值最低(左)与最高(右)分类的小鼠及大鼠CA1锥体神经元组数据(小鼠n 个细胞;大鼠n 个细胞;Kruskal-Wallis检验)。数据表示为均值 标准误。NS无统计学意义。 。
表1 带有不同轴突的单个细胞的rMS去极化阈值。
| Axon 1 | Axon 2 | Axon 了 | Axon 4 | Axon 5 | Axon 6 | Axon 7 | Axon 8 | Axon 9 | Axon 10 | Axon 11 | Axon 12 | |
| Mouse cell 1 | 225 | 224 | 265 | 184 | 267 | 212 | 183 | 232 | 194 | 218 | 162 | 150 |
| Mouse cell 2 | 224 | 220 | 261 | 182 | 255 | 212 | 183 | 231 | 193 | 216 | 160 | 138 |
| Mouse cell 3 | 223 | 218 | 259 | 180 | 249 | 212 | 182 | 230 | 193 | 215 | 159 | 133 |
| Mouse cell4 | 222 | 216 | 258 | 180 | 244 | 212 | 182 | 229 | 192 | 214 | 159 | 127 |
| Mouse cell 5 | 222 | 217 | 258 | 180 | 242 | 212 | 182 | 229 | 191 | 214 | 157 | 121 |
| Mouse cell 6 | 226 | 226 | 265 | 186 | 271 | 213 | 184 | 233 | 194 | 219 | 161 | 150 |
| Rat cell 1 | 223 | 220 | 260 | 181 | 248 | 212 | 183 | 230 | 193 | 215 | 159 | 133 |
| Rat cell 2 | 224 | 222 | 263 | 183 | 260 | 212 | 183 | 231 | 194 | 217 | 161 | 145 |
| Rat cell 3 | 224 | 219 | 261 | 183 | 258 | 212 | 183 | 232 | 194 | 217 | 161 | 145 |
| Rat cell 4 | 224 | 221 | 262 | 183 | 257 | 212 | 183 | 231 | 194 | 217 | 161 | 144 |
| Rat cell 5 | 223 | 216 | 259 | 181 | 253 | 212 | 182 | 230 | 193 | 215 | 159 | 135 |
| Rat cell 6 | 220 | 215 | 257 | 179 | 236 | 212 | 182 | 229 | 192 | 213 | 158 | 120 |
数值表示以V/m为单位的rMS去极化阈值 \{ \mathbf { v } ^ { * } \} _
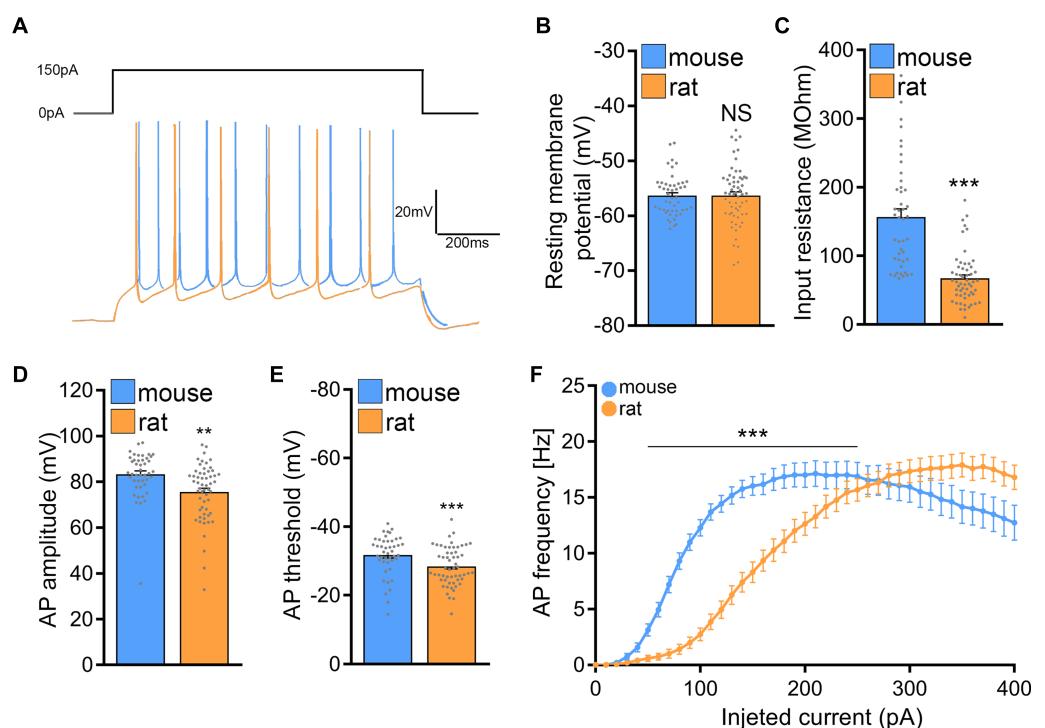
图 7 与大鼠相比,小鼠CA1锥体神经元兴奋性更低。(A) 小鼠和大鼠组织培养中CA1锥体神经元输入-输出记录的样本轨迹。(B,C) 小鼠与大鼠CA1锥体神经元静息膜电位和输入电阻的组间数据(小鼠n 个细胞;大鼠n 个细胞;Mann-Whitney检验)。(D,E) 小鼠与大鼠CA1锥体神经元动作电位幅度和阈值的组间数据(小鼠n 个细胞;大鼠n 个细胞;Mann-Whitney检验)。(F) 小鼠与大鼠组织培养中CA1锥体神经元的电流/频率曲线(小鼠n 个细胞;大鼠n 个细胞;双因素方差分析)。数据表示为均值 标准误。NS表示无显著性差异。 , 。
在此背景下,需要重点指出的是,我们的实验未显示出小鼠与大鼠培养的CA1锥体神经元存在统计学上显著的形态学差异。通过对顶树突和基树突的全面分析表明,两者的树突总长度、复杂程度及在器官组织培养的大鼠和小鼠锥体神经元中观察到的总体积。这些结果与先前发表的比较小鼠和大鼠海马CA1神经元在急性脑片制备中的数据一致(Routh等人,2009)。但值得注意的是,除观察到的形态特征外,这些细胞的总体积在大鼠脑片中更高。尽管急性脑片与组织培养之间存在差异
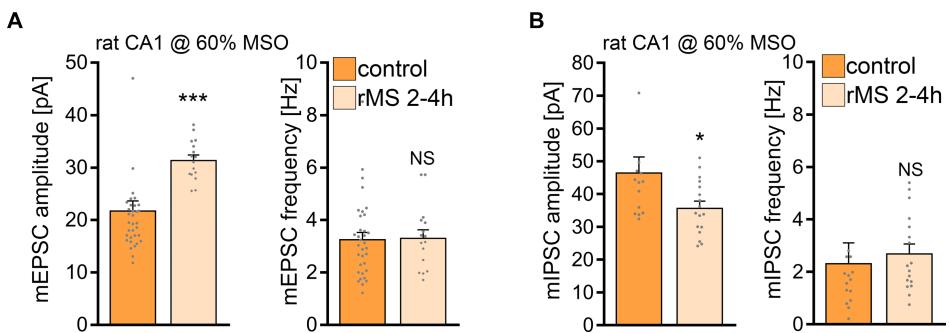
图8 频率为10赫兹的重复磁刺激(rMS)以 最大刺激输出强度诱导大鼠CA1锥体神经元突触可塑性。(A) 从假刺激组(对照组)和rMS刺激组培养的大鼠CA1锥体神经元记录的AMPA受体介导的微型兴奋性突触后电流(mEPSCs)的组数据(对照组: 个细胞;rMS组: 个细胞;Mann-Whitney检验)。(B) 从假刺激组(对照组)和rMS刺激组培养的大鼠CA1锥体神经元记录的微型抑制性突触后电流(mIPSCs)的样本轨迹和组数据(对照组: 个细胞;rMS组: 个细胞;Mann-Whitney检验。在mIPSC振幅和频率中各有一个数据点超出坐标轴范围)。数据以均值 标准误表示。NS表示无显著性差异。 ^ { * } p < 0 . 0 5 _
可能导致观察到的差异,而在我们的研究中无法实现可靠的斑片状胞体体积重建,但必须强调组织培养的关键优势。使用培养3周的组织使我们能够研究在实验评估前未经历急性切片处理的脑组织中的神经元。这使我们得以研究未受损的锥体神经元,并生成涵盖树突和轴突的详细形态学重建。特别重要的是,考虑到轴突与电场的显著相互作用(Siebner等人,2022),完整的轴突重建对于精确评估rTMS结果至关重要。先前研究(包括我们自己的工作)常依赖人工或简化的轴突形态(Aberra等 人,2018、2020;Shirinpour等 人,2021;Eichler等 人,2023)。值得注意的是,我们的研究显示培养的小鼠和大鼠CA1神经元轴突未见显著差异。这一发现表明,观察到大鼠CA1神经元无法展现突触可塑性的现象,不能简单地归因于轴突形态的差异。
然而,我们的模拟发现,无论胞体和树突形态如何,某些轴突对神经元去极化的效能可达到普通轴突的两倍。这强调需要在rTMS诱导突触可塑性的研究中系统评估各类轴突形态,同时考虑髓鞘化及少突胶质细胞作用等因素。我们提出在复杂皮层网络中可能存在“超响应细胞”——这类细胞在特定rTMS刺激强度下具有高度敏感性。该观点得到以下观察结果的支持:在当前及我们既往研究(参见Vlachos等人 ,2012;Lenz等人 ,2016、2020;Eichler等人 ,2023)中,并非所有神经元在刺激后2–4小时内都表现出mEPSC振幅升高或mIPSC减弱。
本研究结果表明,理解rTMS对小鼠和大鼠CA1锥体神经元的不同影响需要考虑其内在细胞特性。与先前对大鼠和小鼠脑切片的研究一致(Routh等,2009),我们的研究显示大鼠CA1锥体神经元相较于小鼠具有更高的动作电位阈值,这使得其兴奋性较低。尤其值得注意的是,我们发现大鼠CA1神经元比小鼠神经元具有更低的输入电阻,进一步印证了大鼠神经元兴奋性较低的特性神经元。然而,值得注意的是,Routh及其同事在2009年的一项研究报告了两种物种之间相似的输入电阻(Routh et al., 2009),这可能是由于来自成年动物的急性切片和器官型组织培养之间的差异。
仅凭形态学和生物物理学特性是否足以充分预测rTMS疗效?多巴胺、血清素、去甲肾上腺素等神经调节物质会通过影响皮层兴奋性,改变神经元对rTMS的反应方式,并调节可塑性阈值、强度及方向(Greenberg等 ,2000;Nitsche等 ,2006;Martorana等 ,2009;Nitsche等 ,2010;le Grand等 ,2011;Kuo等,2017)。值得注意的是,神经调节物质还能在不影响兴奋性及其他基线功能结构特性的前提下,调控神经元表达可塑性的能力——这一现象被称为元可塑性(Abraham与Bear,1996;Seol等,2007)。此外,非神经元细胞对突触可塑性的表达具有显著调控作用(Stellwagen等 ,2005;Henneberger等,2010;Allen,2014;Andoh与Koyama,2021;Sancho等 ,2021;Kleidonas等,2023)。我们前期研究证实小胶质细胞源细胞因子对rTMS诱导的可塑性起关键支撑作用(Eichler等,2023)。最后还需考量网络活动对rTMS疗效的影响。这些因素共同揭示了rTMS诱导可塑性过程的多元复杂性。器官型脑片培养模型为探究rTMS诱导可塑性的内在机制提供了重要研究平台,同时凸显了建立经严格验证的计算机模型的必要性——这些模型应能衔接感应电场与生物物理层面逼真的神经元网络,有望预测rTMS的生物学效应,为理解其作用机制、优化刺激方案以实现跨脑区与个体的一致性疗效提供重要见解。
¶ 参考文献
Aberra, A. S.、Peterchev, A. V. 与 Grill, W. M. (2018)。用于皮层刺激仿真的生物物理现实神经元模型。《神经工程杂志》15:066023。doi: 10.1088/1741-2552/aadbb1
阿贝拉 A. S., 王 B., 格里尔 W. M., 和 彼得切夫 A. V. (2020年). 在具有形态学真实皮层神经元的头部模型中模拟经颅磁刺激. 脑刺激 13, 175–189. doi: 10.1016/j.brs.2019.10.002
亚伯拉罕,W. C.和贝尔,M. F.(1996)。元可塑性:突触可塑性的可塑性。《神经科学趋势》19,126–130。doi: 10.1016/s0166-2236(96)80018-x
艾伦, N. J. (2014). 星形胶质细胞对突触行为的调控. 细胞与发育生物学年度评论 30, 439–463. doi: 10.1146/annurev-cellbio-100913-013053
安藤 M. 和小山 R. (2021). 小胶质细胞调节突触发育和可塑性。发育神经生物学 81, 568–590。doi: 10.1002/dneu.22814
Blumberger, D. M., Vila-Rodriguez, F., Thorpe, K. E., Feffer, K., Noda, Y., Giacobbe, P., 等人 (2018). θ脉冲刺激与高频重复经颅磁刺激治疗抑郁症患者的疗效比较(THREE-D):一项随机非劣效性试验。《柳叶刀》391, 1683–1692. doi: 10.1016/S0140-6736(18)30295-2
Cambiaghi, M., Cherchi, L., Masin, L., Infortuna, C., Briski, N., Caviasco, C., 等. (2021). 高频重复经颅磁刺激增强小鼠初级运动皮层II/III层树突形态可塑性. 行为大脑研究. 410:113352. doi: 10.1016/j.bbr.2021.113352
Cambiaghi, M.、Crupi, R.、Bautista, E. L.、Elsamadisi, A.、Malik, W.、Pozdniakova, H. 等人(2020)。1赫兹重复经颅磁刺激对雄性小鼠成熟与新生齿状回神经元情绪行为及树突复杂性的影响。《国际环境研究与公共健康杂志》17:4074。doi: 10.3390/ijerph17114074
陈荣、克拉斯森、格洛夫、塞尔尼克、瓦瑟曼、哈列特等(1997)。低频经颅磁刺激对运动皮层兴奋性的抑制作用。《神经病学》48卷,1398–1403页。doi: 10.1212/WNL.48.5.1398
Cirillo, G., Di Pino, G., Capone, F., Ranieri, F., Florio, L., Todisco, V., 等. (2017). 无创脑刺激的神经生物学后效. Brain Stimul. 10, 1–18. doi: 10.1016/j.brs.2016.11.009
科基,L.,扎列斯基,A.,诺特,Z.,怀伯德,G.,菲茨杰拉德,P. B. 和布雷克皮尔,M.(2018)。强迫症经颅磁刺激治疗:聚焦网络机制与状态依赖性。《神经影像:临床》19,661-674。doi:10.1016/j.nicl.2018.05.029
Dayan, E., Censor, N., Buch, E. R., Sandrini, M., and Cohen, L. G. (2013). 非侵入性脑刺激:从生理机制到网络动力学再回归. Nat. Neurosci. 16, 838–844. doi: 10.1038/nn.3422
邓,Z.-D.,Lisanby,S. H. 与 Peterchev,A. V.(2013)。经颅磁刺激中电场深度-聚焦性的权衡:50种线圈设计的仿真比较。《脑刺激》6,1–13。doi:10.1016/j.brs.2012.02.005
艾希勒,A.,克莱多纳斯,D.,图里,Z.,弗里高夫,M.,基尔施,M.,普法伊费尔,D.等(2023)。小胶质细胞因子介导10 Hz重复磁刺激诱导的可塑性。《神经科学杂志》43卷,3042–3060页。doi: 10.1523/JNEUROSCI.2226-22.2023
Galanis, C., Fellenz, M., Becker, D., Bold, C., Lichtenthaler, S. F., Müller, U. C. 等人 (2021). β-淀粉样蛋白介导稳态突触可塑性. 神经科学杂志 41, 5157–5172. doi:10.1523/JNEUROSCI.1820-20.2021
Garnaat, S. L.、袁, S.、王, H.、Philip, N. S. 与 Carpenter, L. L. (2018). 经颅磁刺激治疗重度抑郁症的最新进展。北美精神病学诊所 41, 419–431. doi: 10.1016/j.psc.2018.04.006
戈德斯沃西, M. R., 米勒-达尔豪斯, F., 里丁, M. C., 与齐曼, U. (2014). 人类运动皮层类LTD可塑性的个体间差异:先前运动激活的问题.《脑刺激》7, 864–870.doi: 10.1016/j.brs.2014.08.004
格林伯格,B. D.,齐曼,U.,科拉-洛卡泰利,G.,哈蒙,A.,墨菲,D. L.,基尔,J. C.等(2000)。强迫症患者皮质兴奋性的改变。《神经病学》54;142。doi: 10.1212/WNL.54.1.142
格拉,A.,洛佩斯-阿隆索,V.,奇兰,B.,和苏帕,A.(2020)。无创脑刺激研究中的变异性:原因与结果。《神经科学快报》719:133330。doi: 10.1016/j.neulet.2017.12.058
亨内伯格,C.,帕普安,T.,奥列特,S. H. R.,和鲁萨科夫,D. A.(2010)。长时程增强取决于星形胶质细胞释放D-丝氨酸。《自然》463, 232–236。doi: 10.1038/nature08673
洪,Y.,刘,Q.,彭,M.,白,M.,李,J.,孙,R.等(2020)。高频重复经颅磁刺激通过抑制缺血大鼠星形胶质细胞的神经毒性极化改善功能恢复。《神经炎症杂志》17:150。doi: 10.1186/s12974-020-01747-y
黄,Y.-Z.,爱德华兹,M. J.,鲁尼斯,E.,巴蒂亚,K. P.,和罗斯韦尔,J. C.(2005)。人运动皮层的θ波爆发刺激。《神经元》45, 201–206。doi: 10.1016/j.neuron.2004.12.033
贾尔斯基 T.、罗克辛 A.、凯斯 W. L. 和斯普拉斯顿 N. (2005). 海马CA1锥体神经元远端突触激活后的条件性树突尖峰传播. 《自然神经科学》 8, 1667–1676. doi: 10.1038/nn1599
上谷,Y.,巴拉迪亚,V. M.,库博塔,Y.,与下条,S.(2001)。新皮层神经元磁刺激模型。神经计算 38–40, 697–703. doi: 10.1016/ S0925-2312(01)00447-7
克莱多纳斯,D.,基尔施,M.,安德列厄,G.,普法伊弗,D.,博里耶斯,M.,弗拉霍斯,A.(2023)。小胶质细胞调控TNFα介导的突触可塑性。《胶质细胞》第71卷,2117–2136页。doi:10.1002/glia.24383
郭, H.-I., Paulus, W., Batsikadze, G., Jamil, A., 郭, M.-F., and Nitsche, M. A. (2017). 去甲肾上腺素能系统对健康人类皮质兴奋性的急性与慢性影响。《国际神经精神药理学杂志》20, 634–643. doi: 10.1093/ijnp/pyx026
le Grand, S. M., Supornsilpchai, W., Saengjaroentham, C., and Srikiatkhachorn, A. ( 2011). 血清素耗竭通过一氧化氮通路导致皮质过度兴奋及三叉神经伤害性易化 。Headache 51, 1152–1160. doi: 10.1111/j.1526-4610.2011.01931.x
Lefaucheur, J.-P.、Aleman, A.、Baeken, C.、Benninger, D. H.、Brunelin, J.、DiLazzaro, V. 等人 (2020)。重复经颅磁刺激(rTMS)治疗应用的循证指南:2014–2018年更新版。《临床神经生理学》131, 474–528。doi: 10.1016/j.clinph.2019.11.002
Lenz, M., Eichler, A., Kruse, P., Strehl, A., Rodriguez-Rozada, S., Goren, I. 等人 (2020). 白细胞介素10通过重复磁刺激技术修复脂多糖诱导的突触可塑性改变。免疫学前沿 11:614509. doi: 10.3389/fimmu.2020.614509
Lenz, M.、Galanis, C.、Müller-Dahlhaus, F.、Opitz, A.、Wierenga, C. J.、Szabó,G. 等人 (2016)。重复磁刺激诱导抑制性突触可塑性。《自然·通讯》7:10020。doi: 10.1038/ncomms10020
Lenz, M., Platschek, S., Priesemann, V., Becker, D., Willems, L. M., Ziemann, U.等 (2015). 重复磁刺激诱导培养小鼠CA1锥体神经元近端树突兴奋性突触后膜可塑性。《大脑结构与功能》220, 3323–3337. doi: 10.1007/s00429-014-0859-9
刘,A.,沃洛斯拉科斯,M.,克龙贝格,G.,亨宁,S.,克劳泽,M. R.,黄,Y.,等(2018)。经颅电刺激的即时神经生理效应。《自然·通讯》9:5092。doi: 10.1038/s41467-018-07233-7
洛佩兹-阿隆索 V., 奇兰 B., 里奥-罗德里格斯 D., 费尔南德斯-德尔-奥尔莫 M. (2014). 非侵入性脑刺激范式反应中的个体间差异性.《脑刺激》7, 372–380. doi: 10.1016/j.brs.2014.02.004
洛伦岑 R.、阮 T. D.、麦吉尔 A.、希罗尼穆斯 F. 和 奥斯特加德 S. D. (2022). 经颅磁刺激(TMS)对精神分裂症阴性症状的疗效:一项系统综述和荟萃分析. Schizophrenia (Heidelb) 8, 35. doi: 10.1038/s41537-022-00248-6
马琦、耿悦、王慧玲、韩冰、王莹莹、李小琳等(2019)。高频重复经颅磁刺激改善老年小鼠认知功能障碍并调节海马突触结构可塑性。《衰老神经科学前沿》11:235。doi: 10.3389/fnagi.2019.00235
Martorana, A., Mori, F., Esposito, Z., Kusayanagi, H., Monteleone, F., Codecà, C.,等人 (2009)。多巴胺调制阿尔茨海默病患者胆碱能皮质兴奋性。《神经精神药理学》34, 2323–2328. doi: 10.1038/npp.2009.60
莫雷蒂,J.,特斯特格,D. J.,波,E. Z.,埃普,J. R.,和罗杰,J.(2022)。低强度重复经颅磁刺激调控全脑功能连接以促进反相关c-Fos表达。科学报告。12:20571。doi: 10.1038/s41598-022-24934-8
Müller-Dahlhaus, F. 与 Vlachos, A. (2013). 揭示重复磁刺激的细胞与分子机制.前沿分子神经科学 6:50. doi: 10.3389/fnmol.2013.00050
Nitsche, M. A., Lampe, C., Antal, A., Liebetanz, D., Lang, N., Tergau, F., 等. (2006). 多巴胺能对长效直流电诱导的人类运动皮层兴奋性变化的调制. 欧洲神经科学杂志 23, 1651–1657. doi: 10.1111/j.1460-9568.2006.04676.x
Nitsche, M. A., Monte-Silva, K., Kuo, M.-F. 与 Paulus, W. (2010)。多巴胺能系统对人类皮质兴奋性的影响。《神经科学评论》21卷, 289–298页。doi: 10.1515/REVNEURO.2010.21.4.289
Opitz, A., Windhoff, M., Heidemann, R. M., Turner, R. 与 Thielscher, A. (2011). 脑组织如何塑造经颅磁刺激诱导的电场。 NeuroImage 58, 849–859. doi: 10.1016/ j.neuroimage.2011.06.069
保卢斯、彼得切夫、A. V. 和里丁, M. (2013)。经颅电与磁刺激技术及范式。《临床神经病学手册》116卷, 329–342页。 doi: 10.1016/B978-0-444-53497-2.00027-9
彼得切夫,A. V.,瓦格纳,T. A.,米兰达,P. C.,尼切,M. A.,保卢斯,W.,利桑比,S. H.,等(2012)。经颅电与磁刺激剂量的基本原理:定义、选择与报告实践。《脑刺激》5,435–453。doi: 10.1016/j.brs.2011.10.001
Rehn, S., Eslick, G. D. 与 Brakoulias, V. (2018)。重复经颅磁刺激(rTMS)治疗强迫症(OCD)时不同皮层靶点有效性的Meta分析。《精神病学季刊》第89卷,645–665页。doi: 10.1007/s11126-018-9566-7
Romero, M. C., Merken, L., Janssen, P. 与 Davare, M. (2022). 连续θ脉冲刺激对猕猴顶叶神经元的神经效应. eLife 11:e65536. doi: 10.7554/eLife.65536
Routh, B. N., Johnston, D., Harris, K., and Chitwood, R. A. (2009). 大鼠与小鼠CA1锥体神经元的解剖学及电生理学比较。《神经生理学杂志》第102卷,2288–2302页。doi: 10.1152/jn.00082.2009
Salvador, R., Silva, S., Basser, P. J. 与 Miranda, P. C. (2011). 确定运动皮层激活的主导机制:采用真实刺激波形与脑沟几何形态的经颅磁刺激模型研究。临床神经生理学 122, 748–758. doi: 10.1016/j.clinph.2010.09.022
桑乔 L., 孔特雷拉斯 M., 和 艾伦 N. J. (2021). 胶质细胞作为突触可塑性的雕塑家. 神经科学研究 167, 17–29. doi: 10.1016/j.neures.2020.11.005
Saturnino, G. B., Puonti, O., Nielsen, J. D., Antonenko, D., Madsen, K. H., 与 Thielscher, A. (2019). SimNIBS 2.1:用于经颅脑刺激个体化电场建模的综合工作流程,收录于《大脑与人体建模:EMBC 2018计算人体模型》(Makaro��v S, Horner M, Noetscher G 编)。瑞士:Springer出版社。
Seo, H. 与 Jun, S. C. (2019). 经颅电刺激中电场与皮层神经元激活的关系. 《脑刺激》12, 275–289. doi: 10.1016/j.brs.2018.11.004
Seol, G. H., Ziburkus, J., Huang, S., Song, L., Kim, I. T., Takamiya, K., 等。(2007)。神经调制剂控制尖峰时序依赖性突触可塑性的极性。Neuron 55, 919–929. doi:10.1016/j.neuron.2007.08.013
Shirinpour, S., Hananeia, N., Rosado, J., Tran, H., Galanis, C., Vlachos, A., 等。(2021)。经颅磁刺激下单个神经元及亚细胞活动的多尺度建模工具箱。《脑刺激》14, 1470–1482。doi: 10.1016/j.brs.2021.09.004
Siebner, H. R., Funke, K., Aberra, A. S., Antal, A., Bestmann, S., Chen, R., 等。(2022)。大脑经颅磁刺激:刺激了什么?——共识性立场论文与批判性述评。《临床神经生理学》140, 59–97。doi: 10.1016/j.clinph.2022.04.022
索马,F. A.,德格拉夫,T. A.,和萨克,A. T.(2022)。经颅磁刺激在神经系统疾病治疗中的应用。《神经病学前沿》13:793253。doi: 10.3389/fneur.2022.793253
Stellwagen, D.、Beattie, E. C.、Seo, J. Y. 与 Malenka, R. C. (2005)。肿瘤坏死因子-α对AMPA受体和GABA受体运输的差异性调控。《神经科学杂志》25卷,3219–3228页。doi: 10.1523/JNEUROSCI.4486-04.2005
Suppa, A.、Huang, Y.-Z.、Funke, K.、Ridding, M. C.、Cheeran, B.、Di Lazzaro,V. 等(2016)。Theta爆发式刺激在人类应用的十年:既定认知、未解之谜与未来展望。《脑刺激》9, 323–335. doi: 10.1016/j.brs.2016.01.006
唐,A. D.,贝内特,W.,宾多夫,A. D.,博兰,S.,柯林斯,J.,兰利,R. C.,等(2021)。阈下重复经颅磁驱动年轻与老年运动皮层的结构性突触可塑性。《脑刺激》14卷,1498–1507页。doi:10.1016/j.brs.2021.10.001
蒂尔舍, A., 安图内斯, A., 和 萨图尼诺, G. B. (2015). 经颅磁刺激的场建模:理解TMS生理效应的有用工具?, 在2015年第37届IEEE医学与生物工程学会年度国际会议(EMBC)上, 222–225.
蒂尔舍,A.与卡默,T.(2004)。两种商用8字形TMS线圈的电场特性:聚焦性与效率计算。《临床神经生理学》115卷,1697–1708页。doi: 10.1016/j.clinph.2004.02.019
蒂尔舍,A.,奥皮茨,A.,与温德霍夫,M.(2011). 脑回几何结构对经颅磁刺激诱发电场的影响. 神经影像 54, 234–243. doi: 10.1016/j.neuroimage.2010.07.061
托凯、霍尔、基尔施斯坦、茨乔利希与科林 (2009)。高频磁刺激诱导大鼠海马切片产生长时程增强效应。《神经科学快报》461: 150-154。doi: 10.1016/j.neulet.2009.06.032
Tokay, T., Kirschstein, T., Rohde, M., Zschorlich, V., and Köhling, R. (2014). 高频磁刺激诱导的NMDA受体依赖性元可塑性.《神经可塑性》2014:684238, 1–8. doi: 10.1155/2014/684238
图里·Z、哈纳尼亚·N、希林普尔·S、奥皮茨·A、耶德利奇卡·P、弗拉霍斯·A(2022)。基于多尺度建模调控初级运动皮层与背外侧前额叶皮层的经颅磁刺激剂量。《神经科学前沿》16:929814。doi: 10.3389/fnins.2022.929814
图里, Z., 伦茨, M., 保卢斯, W., 米特纳, M., 和弗拉霍斯, A. (2021). 1991至2020年间重复经颅磁刺激研究中刺激强度选择的系统性综述. 欧洲神经科学杂志 53, 3404–3415. doi: 10.1111/ejn.15195
瓦伦斯,A.-M.,戈尔兹沃西,M. R.,霍德尔,N. A.,塞姆勒,J. G.,皮彻,J. B.,和里丁,M. C.(2015)。连续θ脉冲刺激后运动皮层可塑性的个体间与个体内变异性。《神经科学》304卷,266-278页。doi: 10.1016/j.neuroscience.2015.07.043
弗拉霍斯、米勒-达尔豪斯、罗斯科普、伦茨、齐曼与德勒 (2012)。重复磁刺激能诱导神经功能与结构可塑性。小鼠海马器官型切片培养中的兴奋性突触后膜。《神经科学杂志》32卷,17514–17523页。doi: 10.1523/JNEUROSCI.0409-12.2012
Voigt, J.、Carpenter, L. 与 Leuchter, A. (2019). 关于重复经颅磁刺激(rTMS)对非难治性重度抑郁症患者临床疗效的系统性文献综述. BMC Psychiatry 19:13. doi: 10.1186/s12888-018-1989-z
兹梅金娜, E., 米特纳, M., 保卢斯, W., 与图里, Z. (2020). 弱重复经颅磁刺激诱导电场可引发人类神经夹带效应. 《科学报告》10:11994. doi: 10.1038/s41598-020-68687-8