最终编辑版发表于:《生物技术趋势》2025年7月;43(7): 1583–1598. doi:10.1016/j.tibtech.2025.02.009.
¶ 脑类器官:构建高阶复杂性和神经回路模型
古丽米赫兰姆·迈苏姆1,2、斯蒂芬妮·威勒思3,9、迈克尔·W·内斯特4,9、本·瓦尔道5,9、斯特凡·舒尔克6,7、弗朗切斯科·V·纳尔迪1,2、奥萨马·艾哈迈德1,2、周游1、马德尔·杜伦斯8、梁波2、阿布拉姆·M·雅库布1,*
1.哈佛医学院医学系及布莱根妇女医院,波士顿,马萨诸塞州,美国
2.第二生物力学系 医学工程, 北达科他大学, 大福克斯 rks, 北达科他州, 美国
-
生物医学工程系,维多利亚大学,加拿大不列颠哥伦比亚省维多利亚市
-
美国国家科学院、工程院和医学院,华盛顿特区,美国
5.神经外科系,加州大学戴维斯分校,美国加利福尼亚州萨克拉门托市
6.分子过敏学,保罗·埃尔利希研究所,德国朗根
7.变态反应研究(ALG 5),保罗-埃尔利希研究所变态反应学分部,德国朗根
8.神经科学系,西奈山伊坎医学院,美国纽约州纽约市
9.位并列第二作者。
¶ 摘要
脑类器官是由多能干细胞(PSCs)衍生而成的三维人脑组织模型。这一技术使得此前因人类脑组织难以获取、或某些脑疾病小鼠模型存在局限性而受阻的研究得以推进。尽管潜力巨大,脑类器官仍存在明显缺陷——既无法重现人脑的完整复杂性,也限制了其在疾病研究中的应用价值。我们重点阐述了针对这些缺陷的最新研究进展:特别是构建能模拟多个脑区相互作用的复杂类器官,以及在体外重构体内存在的神经回路。这些脑类器官技术的重大突破将显著推动脑疾病模型构建与神经科学研究的发展。
¶ 脑类器官——简洁驱动复杂
理解脑部疾病的分子机制需要在动物和人类模型中进行广泛研究。由于人类与啮齿类动物大脑发育存在显著差异,某些脑疾病小鼠模型的局限性,使得必须采用人类脑模型。。由于难以获取人类脑组织,且对死后组织的研究极为有限,这一领域迫切需要开发体外人类大脑模型。多能干细胞为在二维和三维培养体系中生物工程化人类脑细胞提供了前所未有的机遇。脑类器官是自组织的三维细胞系统,包含不同脑细胞类型,并能生成具有功能特征的结构,这些特征类似于不同大脑区域[1]。虽然二维培养体系实现了对特定人类脑细胞类型的分离研究,但类器官能更全面地重现人类大脑的结构复杂性——例如协同调控大脑发育与功能的细胞多样性、多种细胞类型及分层结构的呈现[2,3],并能再现人类大脑的基因表达谱[4]、表观遗传景观[5]以及部分突触功能[6]。
在成功构建出能重现多个混合脑区特征的简易“通用”类器官后,重要的问题(与愿景)随之产生:能否开发出重现特定脑区的类器官?能否在这一体外模型中重建体内观察到的脑区间回路连接?近年来,研究者们更投入大量精力以克服类器官模型的其他局限性,例如通过优化培养条件建立适用于衰老及衰老相关疾病研究的类器官体系。因此,本综述将聚焦于近期其他综述未深入探讨的关键方向:即能够重现神经回路与电活动记录的类器官模型及培养技术,以及如何突破类器官的主要局限以最大化其在脑疾病研究(包括衰老与神经退行性疾病相关研究)中的潜力与应用价值。
¶ 构建脑类器官中的高阶复杂性
¶ 大脑区域
在过去>10年中,已培育出多种简易形式的脑类器官;然而这些模型始终存在两大根本性局限。首先,由多能干细胞自发分化形成的脑/大脑类器官仅能重现包含若干混杂无序脑区的基础类脑组织,且各区域边界模糊不清[2]。随后科研人员着力开发能够特异性重现特定脑区特征的区域特异性脑类器官。这类器官通过体外模拟引导体内各脑区神经发育的模式形成信号与形态发生信号而构建(图1)[7,8]。例如:在诱导初期数日内采用双重SMAD抑制(BMP抑制 与TGF-β抑制)诱导神经外胚层命运[8-10];继而通过WNT与TGF-β抑制引导类器官向皮质命运分化[3];或采用WNT抑制、TGF-β激活、RXR与SHH刺激获得含有外侧神经节隆起(LGE,见术语表)细胞的纹状体类器官[11,12]。通过联合WNT抑制与FGF- 、EGF及SHH刺激,成功培育出具有内侧神经节隆起(MGE)特征的基底层类器官[13]。此外,采用双重SMAD抑制后接续BMP7、胰岛素及MEK抑制剂处理,可生成丘脑类器官[14]。而在激活WNT通路的基础上无论是BMP通路激活还是SHH通路抑制都导致了海马体类器官的生成[10,15],而WNT通路的调节结合BMP抑制、SHH激活和FGF-β则导致了丘脑下部的特化[7,10]。关于中脑类器官的特化,已经设计了多种方案,这些方案利用了BMP和TGF-β抑制剂以及WNT、SHH和FGF-8通路激活剂[7,9,16,17]。此外,通过使用视黄酸(RA)和/或FGF通路刺激剂进行尾部命运模式化,已经开发出再现后脑和脊髓的类器官[18–24]。除了这些模式化线索和信号通路调节剂外,神经营养因子如脑源性神经营养因子(BDNF)和胶质细胞源性神经营养因子(GDNF)通常被添加到培养基中以增强类器官的成熟[7,17,20]。除了直接向类器官培养中添加形态发生素外,一种最近开发的方法涉及在微流体装置中同时将PSCs或胚胎体暴露于多个正交形态发生素梯度。这使得化学梯度更可控,并同时生成了神经管或不同脑区的类器官[25,26]。总之,在类器官发育过程中适时控制命运决定线索和信号转导通路,使得能够生成大量区域特异性脑类器官。
¶ 神经回路
先前脑类器官模型的第二个局限是无法重现多个脑区域之间在体内发生的相互作用,包括信号转导级联和细胞间通讯、细胞迁移,以及更重要的是两个或多个脑区域之间发育形成的神经回路。针对这一问题的开创性解决方案是通过融合单独培育的脑区特异性类器官来生成"多区域组装体"(图2)[12,13,27]。这种组装体通过将单个类器官或球状体共同嵌入基质胶液滴中,或在微量离心管或培养板中共培养数天实现融合。例如,通过融合含有谷氨酸能神经元的背侧前脑/皮质类器官与含有 -氨基丁酸(GABA)能神经元的腹侧前脑/皮质下类器官,成功构建了前脑组装体[12,13,27]。这些前脑组装体重现了背腹轴和GABA能中间神经元迁移,并展现出轴突投射延伸及突触组装形成[13]。这为研究对皮质回路形成至关重要的中间神经元迁移提供了模型[12],也有助于理解蒂莫西综合征中皮质中间神经元迁移缺陷的分子机制[27]。另一项研究通过融合内侧神经节隆起(MGE)与皮质类器官开发了研究中间神经元迁移的组装体模型,其中间神经元从MGE类器官迁移至皮质类器官并形成兴奋性突触后致密区[28]。
重要的是,装配体能够实现长程神经元活动和回路形成,可通过钙成像或电生理记录技术进行分析。例如,通过观察MGE与皮层装配体中的钙瞬变和活性钙激增,研究人员发现了迁移中间神经元的正常活动模式[28]。能够重现皮质-丘脑-皮质回路的皮质丘脑装配体,则展现出与丘脑核团间互连结构相似的丘脑皮质双向投射网络以及在体内发生的皮层[14]。有趣的是, corticothalamic组装体中的丘脑神经元表现出比未融合丘脑类器官更高的放电频率, 提示组装体内存在功能性相互作用[14]。此外,为模拟基底 ganglia部分结构而融合的纹状体与中脑类器官中,黑质纹状体通路和纹状体黑质通路均表现出电生理活性。在这些纹状体-中脑组装体中过表达α-突触核蛋白( -syn)后, 观察到α-syn沿多巴胺能轴突从纹状体向中脑类器官运输, 并引发 reminiscent of帕金森病(PD)的黑质纹状体系统损伤[29]。网络分析显示,纹状体-中脑组装体的网络爆发频率和单次爆发峰值数量均高于单独的纹状体与中脑类器官,表明组装体具有更强的网络活性[29]。光遗传学技术可结合钙成像或电生理学方法,助力特定神经元细胞类型活动时空模式的分析[30]。例如通过融合皮层与纹状体类器官构建的皮层-纹状体组装体,不仅包含皮层-纹状体投射通路,皮层神经元还向纹状体类器官发出轴突投射,并与中型多棘神经元(MSNs)形成突触。对这些组装体中的皮层神经元进行光遗传刺激,可诱发纹状体MSNs的钙响应。结合电生理记录证实,光遗传刺激皮层神经元能诱导MSNs产生放电行为并激发兴奋性突触后电流与电位,进一步证明皮层神经元与纹状体类器官中的MSNs形成了功能性突触连接[11]。将含有功能性MSNs的纹状体类器官与中脑黑质类器官组装时, MSNs会从纹状体向黑质延伸投射,并与GABA能神经元建立突触连接。钙成像显示组装体的神经元活动强度高于单独培养的纹状体类器官。此外,光遗传刺激纹状体神经元可在黑质神经元中诱发抑制性突触后电流,证实两个类器官的神经元间形成了突触连接。这些结果表明该组装体可用于构建与运动障碍研究相关的纹状体-黑质神经回路模型[31]。此外,丘脑-皮层组装体已被用于研究钙电压门控通道亚基α1G(CACNA1G)基因变异对神经回路水平的影响[32]。对间脑类器官(丘脑谷氨酸能神经元的发育前体)进行光遗传刺激, 可提高皮层类器官中神经元的放电频率和钙响应强度[32]。
一个更为复杂的里程碑是将多个(即两个以上)大脑区域特异性类器官或神经结构融合,形成三向或四向组装体(图2)。例如,研究人员开发出包含皮质类器官、脊髓类器官和骨骼肌球体的皮质运动组装体——皮质类器官中的神经元与脊髓类器官连接,并激活肌球体产生收缩。狂犬病毒追踪、钙成像和膜片钳记录表明,皮质传出神经元会投射至脊髓类器官的运动神经元并与之建立连接,这些运动神经元继而与肌球体相连[33]。通过谷氨酸解笼锁进行皮质类器官光刺激可引发肌肉收缩,这提示存在皮质-脊髓-肌肉功能单元。类似地,大脑或中脑类器官与多个运动神经元球体组装,并与固体基底上的肌肉束连接。在该系统中,类器官的刺激可诱导肌肉束运动,而谷氨酸或左旋多巴处理大脑/中脑类器官后,电压、峰电位数量、平均放电率等相应电生理信号均增强。这些电生理信号传递至肌肉束并增强其运动,表明功能性脑-运动系统有望被构建[34]。此外,皮层与丘脑类器官已与视网膜类器官组装以重建视觉回路。在这些组装体中,视网膜节细胞轴突深入延伸至组装体内部,重现了视觉系统的投射路径;丘脑类器官中的星形胶质细胞也会迁移至视网膜类器官,模拟了这些脑区在体内的相互作用[35]。通过融合皮层、间脑、脊髓背侧和体感类器官,研究人员进一步开发出四脑区组装体,旨在重现人类上行脊髓丘脑通路。在这些组装体中,感觉神经元的光遗传学刺激通过脊髓和丘脑神经元传递至皮层神经元,且所有其他区域的钙离子水平均升高[36]。这些先进类器官模型重现了体内神经回路与脑区互作,对解构复杂动物行为(从运动感知到认知执行功能)的神经环路构成具有巨大潜力。例如涉及皮层[37]、皮质海马[38]、皮质丘脑皮层[39]、中脑皮层[40]、基底神经节[41]和Papez回路[42]的记忆形成过程,均可通过组装体模型进行研究。皮质丘脑与皮质丘脑皮层组装体还有助于研究感觉处理、意识与学习机制[39]。涉及中脑皮层通路[40]和基底神经节回路[43]的奖赏相关行为,可通过前脑-中脑及中脑-纹状体组装体进行研究。此外,脑-肿瘤组装体模型拓展了肿瘤-大脑相互作用的研究边界(框1)。尽管组装体潜力巨大,仍存在以下挑战:(i) 缺乏标准化类器官融合方法导致组装体间存在差异;(ii) 传统融合方法无法重现脑区间的白质结构,致使组装体模型难以用于研究轴突束这一脑区功能连接的重要特征[44]。近期技术进展正助力解决这些难题,如框2所示。
¶ 类器官中的突触功能与电活动
前文所述的改进类器官模型显示出成熟突触和电活性神经元网络的证据,这些是开展稳健神经科学研究的关键特征。例如,在标记了突触前后末端的中脑类器官中观察到了突触发生现象[45]。稀疏神经元标记技术同样揭示了大脑类器官中树突棘结构的存在[46]。此外,电子显微镜研究证实大脑类器官中存在充满囊泡的突触结构[47]。
自发电活动在发育中的大脑中独立于感觉输入而出现,并在神经回路形成、神经元迁移和成熟过程[48]。通过钙成像[24,28,45,49,50]和电生理学[7,45,46,51]技术,已在不同类器官模型中证实了神经元电活动的存在。钙成像与基因编码钙指标(GCaMPs)被用于标记类器官中的神经元,并证实类器官神经元表现出可被钠通道阻滞剂河豚毒素所阻断[28]。类似体内小脑回路模式的细胞内钙动力学表明小脑类器官具有功能成熟的网络活动,且类器官中的浦肯野细胞积极参与了功能性神经网络的形成[24]。为精确测量突触功能,类器官电生理记录方法发展迅速(图3)。全细胞膜片钳技术已被用于记录脑类器官中细胞膜的电生理特性及单个神经元的细胞内动作电位[46,51]。这种方法能以高时间分辨率记录单个神经元活动,但空间范围有限,难以获取复杂网络活动[51]。此外,多电极阵列可用于监测类器官内神经元网络的活动及其随时间演变的规律[6,45,46,52,53]。例如,多电极阵列记录显示,经疼痛诱发化学物质处理的脊髓类器官平均放电频率增加,证明了模拟痛觉回路可行性[53]。研究人员还通过多电极阵列记录了2个月至10个月大脑类器官的神经元电活动,除观察到网络事件或多电极同步放电外,还发现了从 个月开始出现、到~10个月转变为更强且可变振荡的嵌套振荡事件,这种模式类似于某些早产儿脑电图记录[6]。中脑类器官的神经元放电频率可通过多巴胺受体激动剂喹吡罗进行调节[45]。基于钙成像和多电极阵列的脑类器官功能活动记录方法,为在突触和网络层面记录神经元网络提供了宝贵的标准化方案[54]。
然而,使用微电极阵列(MEA)记录神经活动存在一个局限:MEA主要植入类器官底部并从中记录信号,因此无法覆盖所有类器官神经元。作为解决方案,传统二维MEA已被改进为三维MEA,能够稳健记录整个类器官的功能性神经网络[55]。但将3DMEA插入类器官难免会造成损伤。为此,研究人员开发了一种新型微加工三维框架——由三维微电极构成的三维多功能介观框架(3D MMF),可包裹类器官并通过电接口实现无损记录。通过将二维柔性电子器件折叠成预设三维结构,使其精准匹配即将整合进3D MMF的类器官形态,从而实现通过表面紧密接触监测类器官电生理活动[56]。该3D MMF已用于记录波传播、放电和爆发事件,且对类器官损伤更小[56]。类似地,采用可调聚合物薄片与导电聚合物涂层金属电极制成的三维壳状MEA可适配不同尺寸类器官,实现了不破坏内部结构的长期记录[57]。另一种高延展性三维双微电极阵列装置通过采用类似电极“口袋”的设计,实现了记录过程中的连续介质交换。该设计中,一对制备的可拉伸微电极阵列垂直排列于“口袋”周围[58]。。此外,为在类器官中实现单细胞电生理学的长期三维记录,研究人员设计了在网状结构中使用蛇形线路的弹性组织状纳米电子器件[59,60]。干细胞与弹性纳米电子器件共培养后,通过折叠纳米电子器件重建出脑类器官,这类结构被称为“赛博格类器官”[59]。这些弹性纳米电子器件可随组织生长延展,并能连接外部记录系统进行长期测量。由此,干细胞衍生的神经元细胞与纳米电子器件紧密接触,可在类器官发育过程中记录到单细胞电生理活动[60]。采用液态金属聚合物导体网状神经接口的进阶版赛博格类器官,在海马体类器官中观测到神经尖波、同步化及振荡活动[61]。尽管该技术为类器官电生理记录提供了长期稳定的解决方案,但赛博格类器官中的细胞必须从类器官诱导起始阶段就与纳米电子器件接触,这不可避免地会干扰类器官细胞架构与发育。因此,新开发的三维折叠电记录平台——剪纸术,由超薄电极组成,能几何适配悬浮状态的类器官,从而实现与脑类器官的长期整合及神经元活动的连续记录[62]。
¶ 增强脑类器官模型的能力
以往的大脑类器官模型存在明显缺陷,限制了其应用能力与发展潜力。近期研究通过创新策略显著缓解了这些局限,例如采用长期培养装置,以及构建包含血管细胞与类器官内小胶质细胞的多谱系组装体(图2)。下文将系统梳理早期类器官模型的主要局限,并阐述针对这些问题设计的解决方案——这些方法显著提升了类器官模型的功能维度。
¶ 脑类器官中的细胞死亡
培养类器官是一个漫长的过程,且存在诸多挑战,包括培养过程中类器官内部出现的细胞死亡现象——这很可能源于氧气和营养物质未能充分渗透至核心区域。因此,研究人员在类器官培养过程中引入了振荡培养法(详见框3和图4)。另一项提升营养物质渗透效率的策略是将类器官切片后在气液界面进行培养,该方案显著提升了神经元的存活率与成熟度(图4)[46,63]。为避免切片操作,研究者还通过微流控平台培养全脑类器官,该系统整合了可灌注培养腔室、气液界面及“一站式”操作流程(图4)。该微流控平台有效减少了低氧核心区的形成,并提升了类器官的均一性[64]。
此外,研究者尝试对类器官进行血管化处理,以增强营养物质向类器官核心的输送,减少细胞死亡,并重现血脑屏障(BBB)。将类器官与源自同一诱导多能干细胞(iPSC)系的内皮细胞共同嵌入基质胶后,类器官周围形成了类似脉管系统的管状结构[65]。
或者,从诱导开始就共培养PSC或PSC来源的神经祖细胞(NPC)与内皮细胞[66,67],或将PSC或脐静脉内皮细胞形成的血管球体与大脑类器官组装,均可诱导血管生成[68,69]。血管类器官与大脑类器官的组装不仅促进了体外血脑屏障特性的建模,还有助于模拟神经血管相互作用,尤其在脑海绵状血管畸形研究中成效显著[70]。此外,芯片类器官技术已被用于重建血脑屏障。该类芯片由包含类器官的微流体通道和小室构成,形似计算机芯片。这种设计使得培养基能在微流体系统中流经血管化类器官,不仅实现了血管细胞与类器官的时间同步化和空间定向[71],还增强了神经元分化能力并降低了细胞死亡率(图4)。基于芯片器官平台的人类血脑屏障建模技术进一步发展,有望通过iPSC来源的大脑类器官与内皮细胞在微流体芯片中的结合,实现对个体患者血脑屏障特性的精准医学检测。
¶ 漫长的胶质发生过程
除神经元外,类器官中也已证实星形胶质细胞[51]和少突胶质前体细胞[13]的自发性诱导现象,不过它们通常出现较晚——这与胚胎发生中神经发生向胶质发生转换较晚的特点相符[72]。通过添加血小板衍生生长因子AA、胰岛素样生长因子1、肝细胞生长因子等少突胶质细胞谱系生长因子,以及甲状腺激素、胰岛素等激素,已在很大程度上促进了少突胶质细胞的成熟与髓鞘形成[73,74]。但此类方案需要 个月的分化时间才能实现髓鞘形成。为突破这一局限,除外部生长因子和激素外,利用表达少突胶质细胞发育必需转录因子的人源OLIG2或SOX10多能干细胞报告系,已将形成带髓鞘层成熟少突胶质细胞所需时间缩短至最低42天[75,76]。
¶ 类器官中缺乏小胶质细胞
早期类器官模型存在缺乏小胶质细胞等免疫细胞类型的问题,而这些细胞对研究神经免疫和神经退行性疾病等脑部疾病的免疫反应至关重要。为解决这一问题,近期通过将小胶质细胞与类器官共培养实现了其整合[77]。研究将iPSCs来源的小胶质样细胞(MLCs)与类器官共培养,发现MLCs表现出差异化的迁移能力、细胞内 信号传导及对促炎刺激的反应[78]。除MLCs外,小胶质前体细胞(iPSCs来源的红髓系祖细胞)已与脑类器官整合,将其移植到小鼠大脑后可在体内实现稳态人源小胶质细胞的发育[79]。类似地,将巨噬细胞前体细胞与中脑类器官整合,可促使类器官释放细胞因子和趋化因子,并影响氧化应激、免疫反应及突触重塑相关基因表达[80]。髓系特异性转录因子PU.1的过表达也能诱导产生MLCs,当这些细胞融入脑类器官时,展现出完整的补体和趋化因子系统[81]。这些整合方法将小胶质细胞引入脑类器官后,增强了类器官模拟涉及重要免疫成分的脑部疾病的能力。
¶ 脑类器官生成方案效率低下和可重复性差
脑类器官生成涉及冗长的方案,这些方案会产生具有显著它们之间存在差异。因此,采用3D生物打印技术生成类器官已被用于减少传统方案的局限性。神经组织的3D生物打印需要能够支持细胞存活并分化为成熟神经细胞类型的专用生物墨水。基于纤维蛋白的生物墨水已被用于在微流体装置中支持iPSCs和iPSC来源的NPCs的神经组织生长[82,83]。另一种方法是,使用含有iPSC来源NPCs的海藻酸盐/基质胶生物墨水进行挤出式生物打印,以生成成熟的神经组织[84]。此外,通过强制过表达转录因子正交诱导iPSCs分化为神经元和内皮细胞谱系,可在数天内获得由神经干细胞、神经元和内皮细胞组成的可编程且图案化的血管化类器官[85]。在最近的一项研究中,生物打印的3D神经组织形成了神经元-星形胶质细胞网络和类似于功能性神经回路的皮质-纹状体投射[86]。先进的微制造胚胎体盘装置可用于扩大类器官生成过程并减少类器官变异性[87]。总之,这些利用生物打印生成类器官的进展促进了营养物质加速灌注到类器官中,并提高了类器官生成的速度和可重复性。
适用于模拟衰老相关和神经退行性疾病的建模先前所述的类器官模型改进——包括实现类器官的长期培养以及将小胶质细胞整合入类器官——可能提升类器官在模拟衰老相关脑部疾病方面的适用性。然而该领域仍面临另一挑战:类器官呈现的是早期发育阶段,并未表达神经退行性疾病(如阿尔茨海默病和帕金森病)中与衰老相关的分子和细胞特征。为模拟类器官的衰老过程,研究人员将中脑类器官在缺乏抗氧化剂的BDNF与GDNF培养液中持续培养长达60天。这些类器官呈现出人类中脑的衰老相关特征,例如衰老相关基因与DNA损伤标志物的表达上调[88]。球形培养模型中还使用了一种衰老诱导药物羟基脲来触发类衰老表型[89]。但该药物通过抑制核糖核苷酸还原酶及DNA合成/复制发挥作用,可能对细胞产生非特异性影响,这一潜在局限仍有待解决。小分子淀粉样蛋白β42(Aβ42)诱导剂Aftin-5也已被应用于类器官,用以加速Aβ42的生成并提高Aβ42/Aβ40的比例。[90]. 通过在类器官中添加人血清可模拟散发性阿尔茨海默病的发病机制,因为AD患者血脑屏障破坏导致的血清暴露是疾病关键风险因素[91]。帕金森病病理的标志——α-突触核蛋白聚集——通常出现在疾病后期。在类器官中,可通过光遗传学辅助诱导系统[92]或预成型 -突触核蛋白纤维接种[93]加速这一过程。常用于触发PD神经病理的多巴胺能神经毒素1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)能诱导多巴胺能神经元死亡[17]。总体而言,类器官模型已更适用于模拟衰老相关神经退行性病变。
¶ 脑类器官作为疾病模型
先进的类器官模型使得对多种脑部疾病和神经系统疾病的研究成为可能。作为示例,我们回顾了在两类神经退行性疾病(阿尔茨海默病/痴呆症和帕金森病)及一种感染性疾病[2019冠状病毒病(COVID-19)相关神经系统疾病]中的最新应用。
阿尔茨海默病与痴呆症携带阿尔茨海默病相关基因突变或变异的脑类器官已表现出细胞外Aβ沉积,包括Aβ斑块、胞体与神经突中高水平磷酸化tau蛋白,以及去垢剂不溶性纤维状tau蛋白[94]。携带载脂蛋白Eε 4(APOEε 4或简称APOE4)变异——散发性AD最强遗传风险因子——的脑类器官相较于APOE3类器官,显示出更严重的Aβ聚集和tau蛋白磷酸化。携带APOE4变异的神经元呈现突触数量增加,星形胶质细胞则表现出Aβ摄取功能受损和胆固醇蓄积加剧[95]。AD患者类器官边缘区域升高的Aβ40与Aβ42水平及部分细胞凋亡现象,与突触蛋白减少相关[96]。此外,脑类器官神经网络活性检测显示AD类器官钙信号传导紊乱,其特征为钙瞬变同步化缺失及自发钙瞬变幅度增强[50]。在模拟额颞叶痴呆(FTD)的突变Tau脑类器官中,自噬-溶酶体通路功能受损导致6月龄类器官中谷氨酸能神经元丢失[97]。多谱系组装体(图2)的构建进一步促进了AD神经炎症研究。当微胶质细胞与类器官组装时,完整的补体与趋化因子系统可保护实质免受Aβ引发的细胞与分子损伤,并降低Aβ诱导的凋亡、铁死亡及ADⅢ期相关基因表达[81]。在AD体外模型中,将APOE4纯合iPSC来源的微胶质细胞与APP重复基因类器官共培养时,相较于与健康APOE3微胶质细胞共培养组,这些组装体表现出更严重的Aβ沉积与磷酸化tau蛋白水平升高[95]。
¶ 帕金森病
中脑类器官是研究帕金森病相关多巴胺能神经元病理最常用的模型。该类器官包含能够产生和分泌多巴胺的多巴胺能神经元[98]。携带LRRK2 G2019S突变(帕金森病常见遗传病因)的中脑类器官可重现疾病相关表型[88,98],例如多巴胺能神经元数量减少及复杂性降低[98]。此外,携带SNCA基因(编码α-突触核蛋白)三重扩增的中脑类器官会促进路易体样包涵体的形成,这些包涵体具有球对称形态,其嗜酸性核心含有泛素化的α-突触核蛋白[99]。当SNCA过表达的中脑类器官与纹状体类器官组装时,与野生型类器官相比,它们表现出更短、更少且随机的轴突投射,同时电生理和网络活动减弱。研究观察到α-突触核蛋白通过多巴胺能神经元轴突投射进行逆行运动传播,并出现 -突触核蛋白积聚现象。
在中脑类器官中。这些组装体为研究“朊病毒样”传播假说提供了一个模型,该假说认为病理性α-突触核蛋白的细胞间传递促进了突触核蛋白病的发生[29]。
¶ 与COVID-19相关的神经系统疾病
COVID-19大流行引发了多种与严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)感染相关的神经系统疾病[100]。针对新冠肺炎患者尸检脑组织的研究表明,存在病毒RNA和蛋白质(包括亚基因组RNA),这提示大脑中存在活跃的病毒复制活动,并且已成功从人脑组织中分离出具有传染性的病毒[101–103]。此外,对急性COVID-19康复者的研究显示,他们可能长期存在大脑结构改变或认知/神经精神缺陷[104–106]。鉴于目前缺乏研究SARS-CoV-2中枢神经系统(CNS)趋向性的可靠动物模型,类器官已被广泛应用于探索该病毒在脑细胞中的潜在趋向性。例如,针对大脑特定区域(包括皮层、海马体、下丘脑、中脑和脉络丛)的类器官研究显示,SARS-CoV-2均存在不同程度的感染可能性,且研究报道该病毒可靶向神经元、星形胶质细胞等脑细胞。
以及神经血管细胞[10,107–109]。然而,不同细胞类型或类器官模型对感染易感性的差异,可能归因于SARS-CoV-2入侵因子(如血管紧张素转换酶2(ACE2))表达水平的不同。研究表明,成熟神经元中的ACE2表达水平高于未分化的神经祖细胞[110,111]。
脑类器官模型也被用于研究SARS-CoV-2感染对神经退行性疾病相关神经病理的影响[112]。例如,皮质类器官显示受感染神经元中tau蛋白从轴突错误定位至胞体,并出现苏氨酸-231位点磷酸化,这与tau蛋白病和痴呆症的病理特征一致[107]。血管类器官与皮质类器官的组装形成了具有血脑屏障样特征的结构,包括紧密连接和粘附连接,以及周细胞、星形胶质细胞和小胶质细胞/巨噬细胞。SARS-CoV-2感染后,皮质-血管类器官出现Aβ 聚集、tau蛋白错误定位与表达上调,以及促炎细胞因子引发的小胶质细胞和星形胶质细胞活化[113]。此外,星形胶质细胞会增强脑类器官中的SARS-CoV-2感染,当与携带APOE4等位基因的iPSC衍生神经元共培养时,相比APOE3等位基因的神经元,这些神经元表现出更严重的感染程度[114]。感染会减少神经元突触数量和长度并引发突触丧失,在APOE4神经元中尤为明显[114]。这些基于脑类器官模型的研究共同表明,COVID-19与神经系统或神经退行性疾病发病风险可能存在关联,但这一可能性仍需动物模型和临床研究提供更多证据支持。
¶ 结束语
类脑器官为在人类模型中研究大脑发育与疾病的分子和细胞机制开辟了新途径。人脑类器官建模技术的进步显著提升了该模型的功能,例如重建神经回路的能力以及生成可重复批次的类脑器官,这些能够长期培养或包含大脑基本要素(如小胶质细胞或血脑屏障)的类器官仍有待开发。然而,要在大脑类器官中重现人脑的更多特征,并充分发挥类器官在理解行为与疾病的分子和环路基础方面的潜力(参见“待解决的重要问题”),还需要开展更多研究工作。此外,类器官将有助于揭示疾病表型和测试新的治疗方法。例如,组合类器官与类器官移植技术的结合应用,已推动了对蒂莫西综合征反义寡核苷酸等新治疗策略的研究[115]。近期将人脑类器官整合到小鼠或大鼠额顶叶、体感和视觉皮层中的尝试,为脑损伤治疗提示了未来的潜在策略[116–118]。然而,伦理首先需要克服挑战 [119]。
¶ 术语表
¶ 声流体学方法
一种利用声波控制流体及流体中颗粒的技术。
¶ 阿尔茨海默病(AD)
一种神经退行性疾病,其特征是病理标志,如蛋白质聚集和大脑中的淀粉样斑块,由大脑中Aβ和过度磷酸化的tau蛋白积累引起。
¶ 淀粉样蛋白 β (Aβ)
在阿尔茨海默病中形成斑块的主要肽段。它是由淀粉样前体蛋白(APP)经 -分泌酶复合体选择性加工而产生。Aβ 清除功能受损与阿尔茨海默病高度相关。
¶ 钙成像
一种通过结合钙的荧光分子光学记录神经元细胞活动的显微技术——细胞内钙增加是衡量神经元活动的指标。
¶ 谷氨酸解笼
一种用于研究突触功能和神经回路的技术。它涉及使用笼状谷氨酸——一种与光敏保护基团结合的非活性谷氨酸形式。当暴露于特定波长的光时,保护基团被移除,‘解笼’。
¶ 谷氨酸并使其局部激活受体。
外侧神经节隆起 (LGE)生成纹状体投射神经元和中间神经元的祖域。
¶ 路易体
神经细胞中圆形、微红色的包涵体,由异常折叠和聚集的α-突触核蛋白(α-syn)构成。
¶ 内侧神经节隆起(MGE)
GABA能中间神经元前体细胞及皮质中间神经元的重要来源。
¶ 中型多棘神经元(MSNs)
纹状体中的一种投射神经元,向基底神经节核发出抑制性投射。
¶ 小胶质细胞
大脑的常驻先天免疫细胞通过吞噬作用以及产生细胞因子和趋化因子来应对病原体、毒素和细胞碎片。在神经退行性疾病中,小胶质细胞的活化是由神经元应激和退化引发的。
¶ 多电极阵列(MEA)
由紧密排列的微型金属电极组成的网格。它们用于测量神经元自发放电活动。
¶ 神经祖细胞(NPCs)
产生大部分不同类型神经胶质细胞和神经元细胞的中枢神经祖细胞。
¶ 光遗传学
一种通过表达称为视蛋白的光敏蛋白,能以高时间分辨率激活或抑制特定类型、亚型或亚群的神经元/细胞的技术。
¶ 帕金森病 (PD)
一种神经退行性疾病,主要表现为黑质致密部多巴胺能神经元的变性,以及α-syn以路易体和路易神经突形式的积累和聚集增加。
¶ 膜片钳记录
一种用于测量细胞膜电位及跨膜电流量的电生理技术。
¶ 狂犬病病毒追踪
一种利用经过改造的狂犬病病毒在细胞间移动作为标记,以确定神经元连接结构的技术。
¶ 严重急性呼吸综合征冠状病毒2(SARS-CoV-2)
一种高传播性和致病性的冠状病毒,引发了COVID-19大流行。感染会导致具有高度传染性的严重呼吸道疾病,可通过气溶胶传播,并可能影响身体不同器官,包括中枢神经系统。
¶ 球状体
一种“原始”形式的3维培养体系,由组织相关的单细胞或多细胞类型构成,呈现部分组织特征。根据近期命名共识,该术语现特指通过组合数个已模式化、自组织能力较弱的细胞所构建的细胞系统。
¶ 突触核蛋白病
一组在临床和病理上异质性的多样神经退行性疾病,其特征为在神经元和神经胶质中出现不溶性 -syn 的病理聚集。
¶ Tau蛋白
神经元中的一种微管相关蛋白,易于自我聚集形成β片层结构,进而积累为阿尔茨海默病及其他痴呆症中的神经纤维缠结。
¶ Tau蛋白病
一类在病理学上定义为大脑中异常tau蛋白沉积的神经退行性疾病。
¶ 蒂莫西综合征
一种影响心脏和神经系统的罕见疾病。该病由编码神经元细胞膜钙通道的CACNA1C基因突变引起。
¶ 向性
病原体(如病毒)之所以能够优先感染特定细胞类型而非其他细胞,是因为这些细胞类型中存在着促进感染的宿主细胞机制和/或调控病毒感染的免疫反应。
¶ 参考文献
- Pasca SP, et al. (2022). 神经系统类器官与组装体的命名共识. 《自然》 (Nature), 609, 907–910. [PubMed: 36171373]
- Lancaster MA, et al. (2013). 大脑类器官模拟人类大脑发育与小头畸形. 《自然》 (Nature), 501, 373–379. [PubMed: 23995685]
- Velasco S, et al. (2019). 个体大脑类器官可重复形成人类大脑皮层的细胞多样性. 《自然》 (Nature), 570, 523–527. [PubMed: 31168097]
- Camp JG, et al. (2015). 人类大脑类器官重演胎儿新皮质发育的基因表达程序. 《美国国家科学院院刊》 (PNAS), 112, 15672–15677. [PubMed: 26644564]
- Uzquiano A, et al. (2022). 类器官中细胞类别特性的正确获取有助于定义人类大脑皮层的命运特化程序. 《细胞》 (Cell), 185, 3770–3788. [PubMed: 36179669]
- Trujillo CA, et al. (2019). 皮质类器官产生的复杂振荡波模拟早期人类脑网络发育. 《细胞·干细胞》 (Cell Stem Cell), 25, 558–569. [PubMed: 31474560]
- Qian XY, et al. (2016). 利用微型生物反应器构建脑区特异性类器官模拟寨卡病毒暴露. 《细胞》 (Cell), 165, 1238–1254. [PubMed: 27118425]
- Sloan SA, et al. (2018). 人脑区域特异性三维培养物的生成与组装. 《自然·实验手册》 (Nature Protocols), 13, 2062–2085. [PubMed: 30202107]
- Jo J, et al. (2016). 人多能干细胞来源的中脑类器官包含功能性多巴胺能神经元和神经黑色素生成神经元. 《细胞·干细胞》 (Cell Stem Cell), 19, 248–257. [PubMed: 27476966]
- Jacob F, et al. (2020). 人多能干细胞衍生的神经细胞和脑类器官揭示SARS-CoV-2嗜神经性主要集中于脉络丛上皮. 《细胞·干细胞》 (Cell Stem Cell), 27, 937–950. [PubMed: 33010822]
- Miura Y, et al. (2020). 利用人多能干细胞生成人纹状体类器官与皮质-纹状体组装体. 《自然·生物技术》 (Nature Biotechnology), 38, 1421–1430. [PubMed: 33273741]
- Bagley JA, et al. (2017). 融合性脑类器官模拟脑区间相互作用. 《自然·方法》 (Nature Methods), 14, 743–751. [PubMed: 28504681]
- Birey F, et al. (2017). 功能整合型人前脑球状体的组装. 《自然》 (Nature), 545, 54–59. [PubMed: 28445465]
- Xiang YF, et al. (2019). hESC来源丘脑类器官与皮质类器官融合形成相互投射. 《细胞·干细胞》 (Cell Stem Cell), 24, 487–497. [PubMed: 30799279]
- Pomeshchik Y, et al. (2020). 人iPSC来源海马球状体:用于阿尔茨海默病患者特异性细胞表型分层及疗法开发的新型工具. 《干细胞报告》 (Stem Cell Reports), 15, 256–273.
- Fiorenzano A, et al. (2021). 单细胞转录组学捕捉人脑类器官中脑发育特征及多巴胺神经元多样性. 《自然·通讯》 (Nature Communications), 12, 7302. [PubMed: 34911939]
- Kwak TH, et al. (2020). 具有体内样细胞组成的均质中脑类器官促进基于神经毒素的帕金森病建模. 《干细胞》 (Stem Cells), 38, 727–740. [PubMed: 32083763]
- Valiulahi P, et al. (2021). 从hPSCs生成尾型血清素神经元及后脑命运类器官. 《干细胞报告》 (Stem Cell Reports), 16, 1938–1952.
- Lee JH, et al. (2022). 重现神经管形态发生的人脊髓类器官构建. 《自然·生物医学工程》 (Nature Biomedical Engineering), 6, 435–448. [PubMed: 35347276]
- Eura N, et al. (2020). 人多能干细胞来源的脑干类器官. 《神经科学前沿》 (Frontiers in Neuroscience), 14, 538. [PubMed: 32670003]
- Lui KN, et al. (2023). 呼吸障碍类器官模型揭示PHOX2B-PARMs致后脑神经元模式缺陷. 《干细胞报告》 (Stem Cell Reports), 18, 1500–1515.
- Ogura T, et al. (2018). 人多能干细胞三维诱导背侧、中间及腹侧脊髓组织. 《发育》 (Development), 145, dev162214. [PubMed: 30061169]
- Muguruma K, et al. (2015). 人多能干细胞3D培养中极化小脑组织的自组装. 《细胞报告》 (Cell Reports), 10, 537–550. [PubMed: 25640179]
- Atamian A, et al. (2024). 具有功能性浦肯野细胞的人小脑类器官. 《细胞·干细胞》 (Cell Stem Cell), 31, 39–51. [PubMed: 38181749]
- Xue X, et al. (2024). 利用微流体梯度构建模式化人神经管模型. 《自然》 (Nature), 628, 391–399. [PubMed: 38408487]
- Scuderi S, et al. (2024). 通过类器官中WNT与SHH正交梯度指定人脑区谱系. bioRxiv (预印本), 2024年5月19日在线发表. https://doi.org/10.1101/2024.05.18.594828
- Birey F, et al. (2022). 利用蒂莫西综合征前脑组装体解析人中间神经元迁移的分子基础. 《细胞·干细胞》 (Cell Stem Cell), 29, 248–264. [PubMed: 34990580]
- Xiang Y, et al. (2017). 区域特异性hPSC类器官融合模型模拟人脑发育与中间神经元迁移. 《细胞·干细胞》 (Cell Stem Cell), 21, 383–398. [PubMed: 28757360]
- Tran H-D, Shin M-K. (2022). 从人多能干细胞生成人纹状体-中脑组装体以模拟α-突触核蛋白传播. SSRN (预印本), 2022年12月5日在线发表. https://doi.org/10.2139/ssrn.4288935
- Shiri Z, et al. (2019). 脑类器官时代的光遗传学应用. 《生物技术趋势》 (Trends in Biotechnology), 37, 1282–1294. [PubMed: 31227305]
- Wu S, et al. (2024). 构建人3D纹状体-黑质组装体重现亨廷顿病中型多棘神经元投射缺陷. 《美国国家科学院院刊》 (PNAS), 121, e2316176121. [PubMed: 38771878]
- Kim J-I, et al. (2024). 人组装体揭示丘脑皮质通路中CACNA1G基因变异的后果. 《神经元》 (Neuron), 112, 4048–4059. [PubMed: 39419023]
- Andersen J, et al. (2020). 功能性人类三维皮质运动组装体的生成. 《细胞》 (Cell), 183, 1913–1929. [PubMed: 33333020]
- Shin M, et al. (2024). 基于人类运动系统的生物混合芯片机器人用于神经退行性疾病药物评估. 《先进科学》 (Advanced Science), 11, e2305371. [PubMed: 38036423]
- Fligor CM, et al. (2021). 人类多能干细胞衍生类器官组装模型中视网膜投射通路的延伸. 《干细胞报告》 (Stem Cell Reports), 16, 2228–2241.
- Kim JI, et al. (2024). 上行神经感觉通路的人类组装体模型. bioRxiv (预印本), 2024年3月12日在线发表. https://doi.org/10.1101/2024.03.11.584539
- Shang J. (2020). 局部皮层环路特征出现于优化联想记忆存储的网络中. 《神经科学杂志》 (The Journal of Neuroscience), 40, 2590–2592. [PubMed: 32213557]
- Basu J, Siegelbaum SA. (2015). 皮质-海马环路、突触可塑性与记忆. 《冷泉港生物学展望》 (Cold Spring Harbor Perspectives in Biology), 7, a021733. [PubMed: 26525152]
- Angulo Salavarria MM, et al. (2023). 皮质-丘脑发育与疾病:从细胞到环路再到精神分裂症. 《神经解剖学前沿》 (Frontiers in Neuroanatomy), 17, 1130797. [PubMed: 36935652]
- Hauser TU, et al. (2017). 中脑皮层与中脑边缘通路分别编码努力与奖赏学习信号. 《美国国家科学院院刊》 (PNAS), 114, E7395–E7404. [PubMed: 28808037]
- Guo Y, et al. (2018). 基底节在记忆与运动抑制中的超模态作用:元分析证据. 《神经心理学》 (Neuropsychologia), 108, 117–134. [PubMed: 29199109]
- Kamali A, et al. (2023). 皮质-边缘-丘脑-皮质环路:人类边缘系统原始Papez环路的更新. 《脑拓扑学》 (Brain Topography), 36, 371–389. [PubMed: 37148369]
- Hikosaka O, et al. (2014). 基于奖赏价值行为的基底节环路. 《神经科学年度评论》 (Annual Review of Neuroscience), 37, 289–306. [PubMed: 25032497]
- Osaki T, et al. (2024). 与轴突互连的人脑类器官的复杂活动与短期可塑性. 《自然·通讯》 (Nature Communications), 15, 2945. [PubMed: 38600094]
- Monzel AS, et al. (2017). 从神经上皮干细胞衍生人类中脑特异性类器官. 《干细胞报告》 (Stem Cell Reports), 8, 1144–1154.
- Giandomenico SL, et al. (2019). 气液界面培养的大脑类器官产生具有功能输出的多样化神经束. 《自然神经科学》 (Nature Neuroscience), 22, 669–679. [PubMed: 30886407]
- Quadrato G, et al. (2017). 光敏感人脑类器官中的细胞多样性与网络动态. 《自然》 (Nature), 545, 48–53. [PubMed: 28445462]
- Luhmann HJ, et al. (2016). 发育中新皮层网络的自发神经元活动:从单细胞到大规模相互作用. 《神经环路前沿》 (Frontiers in Neural Circuits), 10, 40. [PubMed: 27252626]
- Sakaguchi H, et al. (2019). 大脑类器官衍生的人类神经网络培养物中自组织同步钙瞬变. 《干细胞报告》 (Stem Cell Reports), 13, 458–473.
- Yin J, VanDongen AM. (2021). 阿尔茨海默病三维类器官模型中增强的神经元活动与异步钙瞬变. 《ACS生物材料科学与工程》 (ACS Biomaterials Science & Engineering), 7, 254–264. [PubMed: 33347288]
- Pasca AM, et al. (2015). 三维培养中人类多能干细胞来源的功能性皮层神经元与星形胶质细胞. 《自然方法》 (Nature Methods), 12, 671–678. [PubMed: 26005811]
- Sharf T, et al. (2022). 人脑类器官中的功能性神经元环路与振荡动力学. 《自然·通讯》 (Nature Communications), 13, 4403. [PubMed: 35906223]
- Ao Z, et al. (2022). 用于疼痛治疗药物发现的人类脊髓类器官芯片模拟伤害感受环路. 《分析化学》 (Analytical Chemistry), 94, 1365–1372. [PubMed: 34928595]
- Oliva MK, et al. (2024). 脑类器官神经网络功能评估方法的标准化. 《神经科学方法杂志》 (Journal of Neuroscience Methods), 110178. [PubMed: 38825241]
- Soscia DA, et al. (2020). 用于体外脑模型的柔性三维微电极阵列. 《芯片实验室》 (Lab on a Chip), 20, 901–911. [PubMed: 31976505]
- Park Y, et al. (2021). 用于皮层球体与工程组装体的三维多功能神经接口. 《科学进展》 (Science Advances), 7, eabf9153. [PubMed: 33731359]
- Huang Q, et al. (2022). 适用于脑类器官的壳式微电极阵列. 《科学进展》 (Science Advances), 8, eabq5031. [PubMed: 35977026]
- Shim C, et al. (2020). 用于自由形态3D神经组织的高度可拉伸微电极阵列. 《2020年IEEE第33届国际微机电系统大会(MEMS)论文集》 (Proceedings of the 2020 IEEE 33rd International Conference on Micro Electro Mechanical Systems, MEMS), pp. 380–383. IEEE.
- Li Q, et al. (2019). 电子人类器官:通过器官发生植入纳米电子器件实现全组织电生理学. 《纳米快报》 (Nano Letters), 19, 5781–5789.
- Le Floch P, et al. (2022). 用于发育中脑类器官3D单细胞长期电生理学的可拉伸网状纳米电子器件. 《先进材料》 (Advanced Materials), 34, e2106829.
- Wu Y, et al. (2024). 用于人海马类器官的三维液态金属神经接口. 《自然·通讯》 (Nature Communications), 15, 4047.
- Yang X, et al. (2024). 用于人类神经类器官和组装体长期电生理记录的剪纸电子技术. 《自然·生物技术》 (Nature Biotechnology), 42, 1836–1843.
- Giandomenico SL, et al. (2021). 用于研究神经发育后期阶段的高级脑类器官构建与长期培养. 《自然·实验手册》 (Nature Protocols), 16, 579–602.
- Ao Z, et al. (2020). 一站式微流控组装人类脑类器官模拟产前大麻暴露. 《分析化学》 (Analytical Chemistry), 92, 4630–4638.
- Pham MT, et al. (2018). 血管化人脑类器官的生成. 《神经报告》 (NeuroReport), 29, 588–593.
- Shi Y, et al. (2020). 血管化人类皮层类器官模拟体内皮层发育. 《公共科学图书馆·生物学》 (PLOS Biology), 18, e3000705.
- Chai YC, et al. (2024). 空间自组织三维神经凝聚体作为研究神经血管发育的新型简化人性化模型. 《先进科学》 (Advanced Science), 11, e2304421.
- Sun XY, et al. (2022). 血管化脑类器官的生成以研究神经血管相互作用. 《eLife》, 11, e76707.
- Kook MG, et al. (2022). 通过与血管球体组装生成具有血管化的皮层脑类器官. 《国际干细胞杂志》 (International Journal of Stem Cells), 15, 85–94.
- Dao L, et al. (2024). 在人PSC衍生类器官中模拟血脑屏障形成和脑海绵状血管畸形. 《细胞·干细胞》 (Cell Stem Cell), 31, 818–833.
- Salmon I, et al. (2022). 利用3D打印微流控芯片构建神经血管类器官. 《芯片实验室》 (Lab on a Chip), 22, 1615–1629.
- Iroegbu JD, et al. (2021). 发育中大脑的ERK/MAPK信号通路:扰动与后果. 《神经科学与生物行为评论》 (Neuroscience & Biobehavioral Reviews), 131, 792–805.
- Madhavan M, et al. (2018). 在人皮层球体中诱导髓鞘形成少突胶质细胞. 《自然·方法》 (Nature Methods), 15, 700–706.
- Marton RM, et al. (2019). 人三维神经培养中少突胶质细胞的分化与成熟. 《自然神经科学》 (Nature Neuroscience), 22, 484–491.
- Kim H, Jiang P. (2021). 生成含少突胶质细胞和髓鞘的人多能干细胞衍生融合类器官. 《STAR实验手册》 (STAR Protocols), 2, 100443.
- Shaker MR, et al. (2021). 在类器官中快速高效生成髓鞘化人少突胶质细胞. 《细胞神经科学前沿》 (Frontiers in Cellular Neuroscience), 15, 631548.
- Abud EM, et al. (2017). 利用iPSC衍生的人小胶质样细胞研究神经系统疾病. 《神经元》 (Neuron), 94, 278–293.
- Song L, et al. (2019). 用同源小胶质样细胞功能化特定脑区球体. 《科学报告》 (Scientific Reports), 9, 11055.
- Schafer ST, et al. (2023). 研究人类小胶质细胞表型的体内神经免疫类器官模型. 《细胞》 (Cell), 186, 2111–2126.
- Sabate-Soler S, et al. (2022). 小胶质细胞整合到人中脑类器官增强神经元成熟度和功能性. 《神经胶质》 (Glia), 70, 1267–1288.
- Cakir B, et al. (2022). 转录因子PU.1的表达诱导人皮层类器官生成小胶质样细胞. 《自然·通讯》 (Nature Communications), 13, 430.
- Abelseth E, et al. (2019). 使用纤维蛋白基生物墨水3D打印人诱导多能干细胞衍生的神经组织. 《ACS生物材料科学与工程》 (ACS Biomaterials Science & Engineering), 5, 234–243.
- Sharma R, et al. (2020). 使用含有药物释放微球的新型纤维蛋白生物墨水进行多能干细胞衍生神经组织的3D生物打印. 《生物工程与生物技术前沿》 (Frontiers in Bioengineering and Biotechnology), 8, 57. [PubMed: 32117936]
- Salaris F, et al. (2019). 源自诱导多能干细胞的人皮层神经构建体的3D生物打印. 《临床医学杂志》 (Journal of Clinical Medicine), 8, 1595. [PubMed: 31581732]
- Skylar-Scott MA, et al. (2022). 通过正交诱导干细胞分化实现血管化类器官和生物打印组织的程序化图案化. 《自然·生物医学工程》 (Nature Biomedical Engineering), 6, 449–462. [PubMed: 35332307]
- Yan Y, et al. (2024). 具有功能连接性的人神经组织3D生物打印. 《细胞·干细胞》 (Cell Stem Cell), 31, 260–274. [PubMed: 38306994]
- Mohamed NV, et al. (2022). 微加工圆盘技术:中脑类器官生成的快速扩增. 《方法》 (Methods), 203, 465–477. [PubMed: 34314827]
- Kim H, et al. (2019). 在3D中脑类器官中模拟G2019S-LRRK2散发性帕金森病. 《干细胞报告》 (Stem Cell Reports), 12, 518–531.
- Dong CM, et al. (2014). 利用产后神经干细胞构建应激诱导的细胞衰老模型. 《细胞死亡与疾病》 (Cell Death & Disease), 5, e1116. [PubMed: 24625975]
- Pavoni S, et al. (2018). 小分子诱导人脑类器官产生Aβ-42肽以模拟阿尔茨海默病相关表型. 《PLoS综合》 (PLOS ONE), 13, e0209150. [PubMed: 30557391]
- Chen X, et al. (2021). 在血清暴露条件下用人脑类器官模拟散发性阿尔茨海默病. 《先进科学》 (Advanced Science), 8, e2101462. [PubMed: 34337898]
- Kim MS, et al. (2023). 基于人iPSC的光遗传学α-突触核蛋白聚集帕金森病高级临床前模型. 《细胞·干细胞》 (Cell Stem Cell), 30, 973–986.e911. [PubMed: 37339636]
- Rodrigues PV, et al. (2022). 纤维状α-突触核蛋白从肠内分泌细胞到神经细胞的跨细胞传播需要细胞间接触并依赖Rab35. 《科学报告》 (Scientific Reports), 12, 4168. [PubMed: 35264710]
- Choi SH, et al. (2014). 三维人神经细胞培养阿尔茨海默病模型. 《自然》 (Nature), 515, 274–278. [PubMed: 25307057]
- Lin YT, et al. (2018). APOE4在人iPSC衍生脑细胞类型中引起与阿尔茨海默病表型相关的广泛分子和细胞改变. 《神经元》 (Neuron), 98, 1141–1154. [PubMed: 29861287]
- Zhao J, et al. (2020). APOE4加剧阿尔茨海默病患者iPSC来源脑类器官的突触丢失和神经退行性变. 《自然·通讯》 (Nature Communications), 11, 5540. [PubMed: 33139712]
- Bowles KR, et al. (2021). MAPT突变脑类器官中神经元丢失前的ELAVL4异常、剪接缺陷和谷氨酸能功能障碍. 《细胞》 (Cell), 184, 4547–4563. [PubMed: 34314701]
- Smits LM, et al. (2019). 中脑样类器官中的帕金森病建模. 《NPJ·帕金森病》 (NPJ Parkinson’s Disease), 5, 5. [PubMed: 30963107]
- Jo J, et al. (2021). 携带葡萄糖脑苷脂酶和α-突触核蛋白突变的人中脑类器官中的路易体样包涵体. 《神经病学年鉴》 (Annals of Neurology), 90, 490–505. [PubMed: 34288055]
- Shanley JE, et al. (2022). SARS-CoV-2感染神经性急性后遗症的纵向症状评估. 《临床与转化神经病学年鉴》 (Annals of Clinical and Translational Neurology), 9, 995–1010. [PubMed: 35702954]
- Crunfli F, et al. (2022). COVID-19患者脑部感染的形态学、细胞和分子基础. 《美国国家科学院院刊》 (PNAS), 119, e2200960119. [PubMed: 35951647]
- Meinhardt J, et al. (2021). 嗅觉黏膜SARS-CoV-2侵入作为COVID-19患者中枢神经系统入口. 《自然·神经科学》 (Nature Neuroscience), 24, 168–175. [PubMed: 33257876]
- Stein SR, et al. (2022). 尸检揭示SARS-CoV-2在人体和脑部的感染与持续存在. 《自然》 (Nature), 612, 758–763. [PubMed: 36517603]
- Liu EN, et al. (2023). COVID-19急性后遗症神经精神症状的纵向分析与治疗. 《神经病学杂志》 (Journal of Neurology), 270, 4661–4672. [PubMed: 37493802]
- Douaud G, et al. (2022). UK Biobank数据显示SARS-CoV-2与脑结构变化相关. 《自然》 (Nature), 604, 697–707. [PubMed: 35255491]
- Beghi E, et al. (2022). COVID-19的急性和急性后神经系统表现:现有发现、批判性评估与未来方向. 《神经病学杂志》 (Journal of Neurology), 269, 2265–2274. [PubMed: 34674005]
- Ramani A, et al. (2020). SARS-CoV-2靶向三维人脑类器官的神经元. 《EMBO杂志》 (The EMBO Journal), 39, e106230. [PubMed: 32876341]
- McMahon CL, et al. (2021). SARS-CoV-2靶向人皮质类器官中的胶质细胞. 《干细胞报告》 (Stem Cell Reports), 16, 1156–1164.
- Pellegrini L, et al. (2020). SARS-CoV-2感染脑脉络丛并破坏人脑类器官中的血-脑脊液屏障. 《细胞·干细胞》 (Cell Stem Cell), 27, 951–961. [PubMed: 33113348]
- Tiwari SK, et al. (2021). 利用人干细胞源肺与脑类器官揭示组织特异性SARS-CoV-2感染及宿主反应. 《干细胞报告》 (Stem Cell Reports), 16, 437–445.
- Yi SA, et al. (2020). SARS-CoV-2假病毒对脑类器官和二维皮质神经元的感染. 《病毒》 (Viruses), 12, 1004. [PubMed: 32911874]
- Ostermann PN, Schaal H. (2023). 用人脑类器官探索SARS-CoV-2对中枢神经系统的影响. 《医学病毒学评论》 (Reviews in Medical Virology), 33, e2430. [PubMed: 36790825]
- Kong D, et al. (2023). 皮质-血管组装体通过激活胶质细胞在SARS-CoV-2感染后呈现阿尔茨海默病表型. 《细胞死亡与疾病》 (Cell Death & Disease), 9, 32.
- Wang C, et al. (2021). ApoE异构体依赖的SARS-CoV-2神经嗜性及细胞反应. 《细胞·干细胞》 (Cell Stem Cell), 28, 331–342. [PubMed: 33450186]
- Chen X, et al. (2024). 蒂莫西综合征的反义寡核苷酸治疗策略. 《自然》 (Nature), 628, 818–825. [PubMed: 38658687]
- Daviaud N, et al. (2018). 移植人脑类器官在小鼠皮质中的血管化与定植. 《神经电子前沿》 (Frontiers in Neuroelectronics), 5, ENEURO.0219-0218.2018.
- Revah O, et al. (2022). 移植人皮质类器官的成熟与神经环路整合. 《自然》 (Nature), 610, 319–326. [PubMed: 36224417]
- Jgamadze D, et al. (2023). 人前脑类器官与受损成年大鼠视觉系统的结构和功能整合. 《细胞·干细胞》 (Cell Stem Cell), 30, 137–152. [PubMed: 36736289]
- Erler A. (2024). 人脑类器官移植:检验动物研究伦理的基础. 《神经伦理学》 (Neuroethics), 17, 20.
- Kim J, et al. (2024). 胶质母细胞瘤瘤体与脑类器官的组装:肿瘤细胞侵袭的3D体外模型. 《分子肿瘤学》 (Molecular Oncology), 2024年10月30日在线发表. https://doi.org/10.1002/1878-0261.13740.
- Fan Q, et al. (2024). 模拟胶质母细胞瘤与人脑区域特异性类器官的精确相互作用. 《iScience》, 27, 109111. [PubMed: 38390494]
- Sun Y, et al. (2024). 人胶质母细胞瘤的全脑神经元连接组. bioRxiv (预印本), 2024年3月4日在线发表. https://doi.org/10.1101/2024.03.01.583047.
- Qu F, et al. (2023). 小细胞肺癌细胞与星形胶质细胞的相互作用模拟脑发育促进脑转移. 《自然细胞生物学》 (Nature Cell Biology), 25, 1506–1519. [PubMed: 37783795]
- Reumann D, et al. (2023). 利用空间排布的腹侧中脑-纹状体-皮质组装体模拟人多巴胺能系统. 《自然·方法》 (Nature Methods), 20, 2034–2047. [PubMed: 38052989]
- Ao Z, et al. (2021). 声流控技术实现人脑类器官的可控融合. 《芯片实验室》 (Lab on a Chip), 21, 688–699. [PubMed: 33514983]
- Zhu Y, et al. (2023). 微流控技术构建人脑组装体. 《先进材料》 (Advanced Materials), 35, e2210083. [PubMed: 36634089]
- Kirihara T, et al. (2019). 人诱导多能干细胞衍生的脑白质束组织模型连接两个皮质区域. 《iScience》, 14, 301–311. [PubMed: 31006610]
- Phelan MA, et al. (2019). 用于改善球体/类器官形成的气泡隔离式旋转壁容器生物反应器. 《组织工程C部分:方法》 (Tissue Engineering Part C: Methods), 25, 479–488. [PubMed: 31328683]
- DiStefano T, et al. (2018). 旋转壁容器生物反应器中多能干细胞源视网膜类器官的加速改进分化. 《干细胞报告》 (Stem Cell Reports), 10, 300–313.
¶ 亮点
-
类器官模型能够特异性地再现多种脑区,从而实现体外神经回路的重建。
-
类器官技术可用于模拟多个脑区之间的相互作用。
-
脑类器官与类集合体模型可再现部分体内观察到的神经回路,并呈现具有电生理活性的神经元与突触。
-
类器官培养技术的进步已消除若干主要限制,显著提升了该模型在衰老及神经退行性疾病研究中的应用价值。
¶ 悬而未决的问题
-
类器官能否实现对动物行为的细胞与神经回路基础进行体外分解与解析?
-
类器官能否进一步促进中枢神经系统与外周神经系统(PNS)相互作用及脑-外周器官轴的建模研究?
-
类器官能否用于识别精准修复多种脑部疾病根源性缺陷回路的再生疗法?
-
类器官能否展现某种程度的"感知力"与学习行为?此前部分iPSC衍生的神经元模型曾被认为具备此类特性。
-
类器官技术结合人工智能能否推动人类智能神经科学的研究?
-
类器官能否更精准地重现人类阿尔茨海默病和帕金森病中渐进性、衰老相关的神经退行性疾病进展过程(超越单纯病理复现)?
-
混合物种(人类与非人灵长类)脑区类器官集合体能否帮助界定人类特有的神经回路?这些回路可能支撑着人类特有的脑发育特征及高级认知功能。
¶ 用于研究肿瘤-脑相互作用的组装体模型
通过将脑类器官与肿瘤类器官组装,研究人员对脑-肿瘤相互作用进行了探索。例如,利用胶质母细胞瘤-大脑组装体研究了胶质母细胞瘤细胞的侵袭特性。延时成像显示,在90小时内胶质母细胞瘤细胞能够以单细胞或细胞团形式侵入大脑类器官在组装体中观察到类似直接细胞间通讯通路的肿瘤微管网络,以及肿瘤细胞与正常细胞之间形成的突触样连接[120]。在与背侧/腹侧前脑类器官组装的胶质母细胞瘤模型中,发现肿瘤细胞特异性侵袭背侧前脑类器官并选择性抑制其轴突生长。背侧前脑类器官的神经元活性显著增强,这可能是由囊泡GABA转运体表达下调所引发[121]。通过将胶质母细胞瘤类器官移植至成年小鼠大脑,可研究其整合神经元环路的能力。单突触病毒追踪系统有助于建立胶质母细胞瘤细胞与多种神经递质网络的全脑连接图谱[122]。皮层类器官与小细胞肺癌聚集体形成的组装体表明,星形胶质细胞向肿瘤微环境的募集是由小细胞肺癌细胞分泌的脑发育因子Reelin驱动;而星形胶质细胞又会促进脑内癌细胞生长,这凸显了星形胶质细胞与癌细胞相互作用在脑转移状态中的重要性[123]。总之,肿瘤-脑组装体在探究肿瘤侵袭机制、肿瘤-脑连接及微环境互动变化等脑-肿瘤相互作用方面具有巨大潜力。
¶ 解决组装体模型局限性的方法
嵌入模具和微流控技术的应用极大地帮助了组装体发展的标准化,并减少了变异性。通过设计的嵌入模具进行融合的方法,有助于将腹侧中脑、纹状体和皮层类器官排列成线性阵列,模拟其在体内前-后轴定位[124]。为实现更精准的空间控制融合与类器官排布,研究人员开发了声流控技术——通过在六边形声流控装置内调控动态声场,以无接触、无标记且低影响的方式控制类器官的空间位置。这种空间控制能力使得组装体中的神经元投射参数、投射成熟度及神经祖细胞分裂过程得以精准调控。此外,借助自动控制微流控技术,研究人员以可控方式构建了双向组装体[125]。另有一种替代方案是采用电喷雾技术生成细胞微胶囊,通过灵活排布不同细胞微胶囊可生成具有区域特异性的大脑类器官与组装体[126]。
最近,通过在微装置两端腔室中培育大脑类器官,成功再现了脑区间的白质轴突束。两个类器官间狭窄通道中的双向连接轴突,使得轴突束重现及区域间皮层连接模拟成为可能[127]。当微装置配备多电极阵列层与聚二甲基硅氧烷微流体层时MEA记录显示这些具有区域间轴突束的类器官相较于融合脑类器官表现出更强劲的神经元活动。由此可见,在组装体中重现轴突连接有助于增强神经网络活性[44]。总体而言,这些改进技术促进了组装体模型的标准化与优化,使其更适用于未来研究。
¶ 长期培养类器官的振荡方法
旋转生物反应器和搅拌装置(见正文图4)已使类器官能够培养长达1年[2]。鉴于这些旋转生物反应器体积庞大,难以安装在标准组织培养箱中,研究人员开发了微型生物反应器(见正文图4)[7]。这些微型生物反应器使用更少量的培养基,从而降低了操作成本。另一种旋转生物反应器——旋转壁容器生物反应器,已被用于类器官的长期培养。该反应器沿轴轻柔牵引圆柱体内流体,其中的球体/类器官沿环形路径旋转[128,129]。它能提供低剪切力与低湍流的环境,既可减少对类器官的潜在损伤,又通过赋予细胞共定位与自组装的空间自由度促进3D类器官形成[130]。近期为探究机械力对脑类器官形成的影响,研究人员采用垂直混合生物反应器培养脑类器官[131]。垂直混合产生的高湍流能量与类器官周围搅拌力相关,并能维持类器官间距。有趣的是,垂直混合培养的脑类器官呈现出与轨道混合类器官相反的结构:神经祖细胞位于类器官外周边缘,而神经元产生于类器官中心。单细胞RNA测序分析表明,这种反向脑类器官中的神经元类似于腹侧前脑的GABA能神经元[131]。由此可见,培养液中的流体动力学不仅与类器官存活、分化和成熟相关,更与类器官结构及生成细胞类型密切相关。为避免上述方法中对特殊设备或生物反应器的依赖,使类器官制备更简便且适用于多数实验室,研究人员对轨道摇床(见正文图4)与生物反应器进行了对比测试[2,132]。值得注意的是,轨道摇床产生的剪切应力低于微型生物反应器——后者转速较低但剪切应力较高,可能对类器官发育产生不利影响[132]。这表明轨道摇床可作为旋转生物反应器的替代方案,实现更便捷、经济、稳定的脑类器官制备。
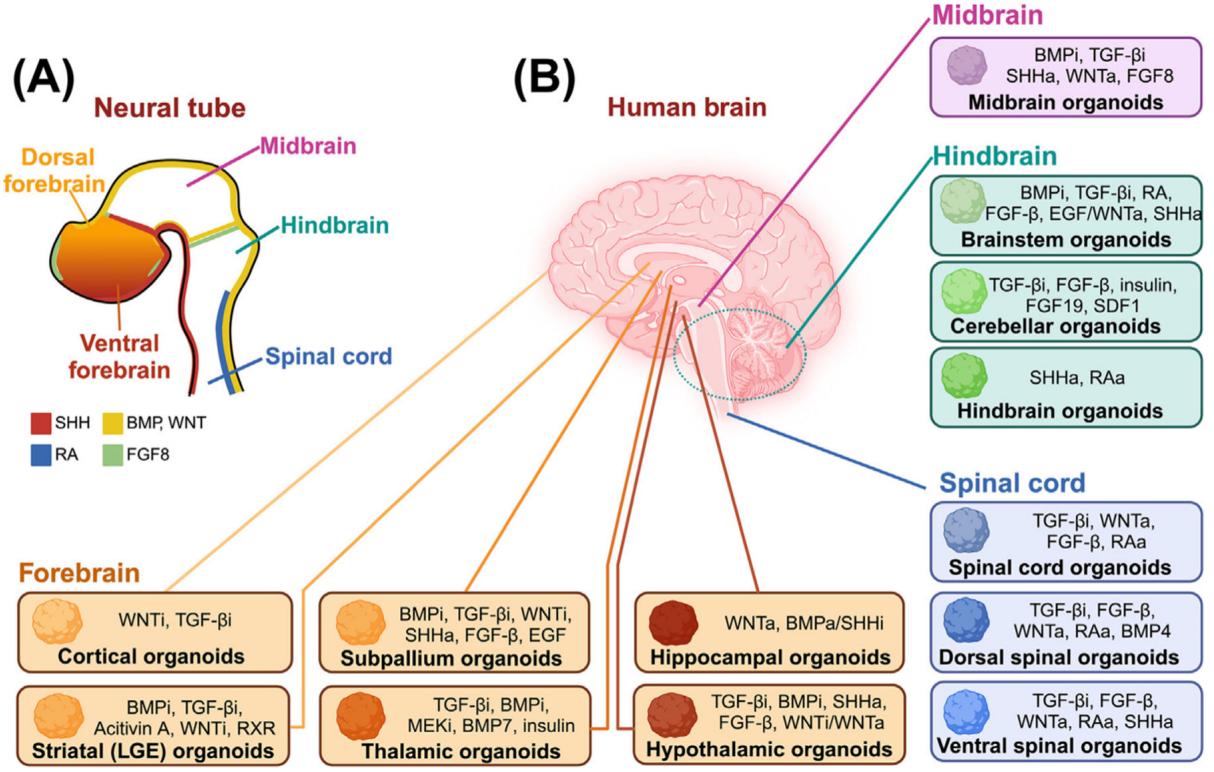
图1. 再现特定大脑区域的类器官。
(A) 神经管发育过程中的信号通路。沿背腹轴,SHH信号驱动腹侧命运,而WNT和BMP通路激活促进背侧化。沿前后轴,低WNT浓度促进前脑特化,较高WNT浓度则导致尾侧命运。FGFs和视黄酸(RA)也参与尾侧命运诱导。(B) 区域特异性脑类器官的生成及所需模式诱导信号。通过调控图示信号通路可诱导产生前脑、中脑、后脑与脊髓类器官。图示中“,”表示“和”,而“/”表示“或”。缩写:BMPi,骨形态发生蛋白抑制剂;FGF- ,成纤维细胞生长因子β;LGE,外侧神经节隆起;MEKi,丝裂原活化蛋白激酶抑制剂;RXR,维甲酸X受体;SDF1,基质细胞衍生因子1;SHHa,刺猬信号通路激活剂;TGF-βi,转化生长因子β抑制剂;WNTa,WNT通路激活剂;WNTi,WNT通路抑制剂。图由BioRender绘制。
这张图展示了从神经管发育到人类大脑不同脑区类器官构建的分子调控机制,分为两个部分(A和B)进行解析:
¶ 部分A:神经管的脑区分化与分子调控
图中左侧呈现了神经管的早期发育分区,包括背侧前脑(Dorsal forebrain)、腹侧前脑(Ventral forebrain)、中脑(Midbrain)、后脑(Hindbrain)和脊髓(Spinal cord)。不同颜色标注了调控这些区域分化的关键信号分子:
- 红色(SHH)、黄色(BMP、WNT)、蓝色(RA)、绿色(FGF8)分别代表 sonic hedgehog、骨形态发生蛋白/ Wingless 型等信号通路分子,它们通过浓度梯度或时空表达差异,引导神经管分化为不同脑区。
¶ 部分B:人类大脑不同脑区类器官的构建及分子诱导策略
右侧以人类大脑解剖结构为基础,详细列出了不同脑区类器官的构建方法,即通过添加特定的信号分子(如抑制剂或激动剂)来诱导多能干细胞分化为对应脑区的类器官,具体如下:
¶ 1. 前脑(Forebrain)相关类器官
- 皮层类器官(Cortical organoids):通过添加 WNT 抑制剂(WNTi)、TGF - β 抑制剂(TGF - βi)诱导。
- 纹状体(LGE)类器官(Striatal (LGE) organoids):通过 BMP 抑制剂(BMPi)、TGF - βi、Activin A、WNTi、RXR 诱导。
- 亚 pallium 类器官(Subpallium organoids):通过 BMPi、TGF - βi、WNTi、SHH 激动剂(SHHa)、FGF - β、EGF 诱导。
- 丘脑类器官(Thalamic organoids):通过 TGF - βi、BMPi、MEK 抑制剂(MEKi)、BMP7、胰岛素诱导。
- 海马类器官(Hippocampal organoids):通过 WNT 激动剂(WNTa)、BMP 激动剂/ SHH 抑制剂(BMPa/SHHi)诱导。
- 下丘脑类器官(Hypothalamic organoids):通过 TGF - βi、BMPi、SHHa、FGF - β、WNT 抑制剂/激动剂(WNTi/WNTa)诱导。
¶ 2. 中脑(Midbrain)类器官
通过 BMPi、TGF - βi、SHHa、WNT 激动剂(WNTa)、FGF8 诱导构建中脑类器官(Midbrain organoids)。
¶ 3. 后脑(Hindbrain)相关类器官
- 脑干类器官(Brainstem organoids):通过 BMPi、TGF - βi、视黄酸(RA)、FGF - β、EGF/WNTa、SHHa 诱导。
- 小脑类器官(Cerebellar organoids):通过 TGF - βi、FGF - β、胰岛素、FGF19、SDF1 诱导。
- 后脑类器官(Hindbrain organoids):通过 SHHa、视黄酸激动剂(RAa)诱导。
¶ 4. 脊髓(Spinal cord)相关类器官
- 脊髓类器官(Spinal cord organoids):通过 TGF - βi、WNTa、FGF - β、RAa 诱导。
- 背侧脊髓类器官(Dorsal spinal organoids):通过 TGF - βi、FGF - β、WNTa、RAa、BMP4 诱导。
- 腹侧脊髓类器官(Ventral spinal organoids):通过 TGF - βi、FGF - β、WNTa、RAa、SHHa 诱导。
¶ 整体意义
这张图系统展示了从胚胎神经管发育到体外构建脑区类器官的“分子调控 - 组织分化”对应关系,为利用多能干细胞体外模拟人脑发育、研究脑疾病机制或开展药物筛选提供了关键的方法学参考——通过精准调控 BMP、TGF - β、WNT、SHH、FGF、RA 等信号通路,可定向诱导出不同脑区的类器官,从而在体外重现脑区的发育过程与功能特性。
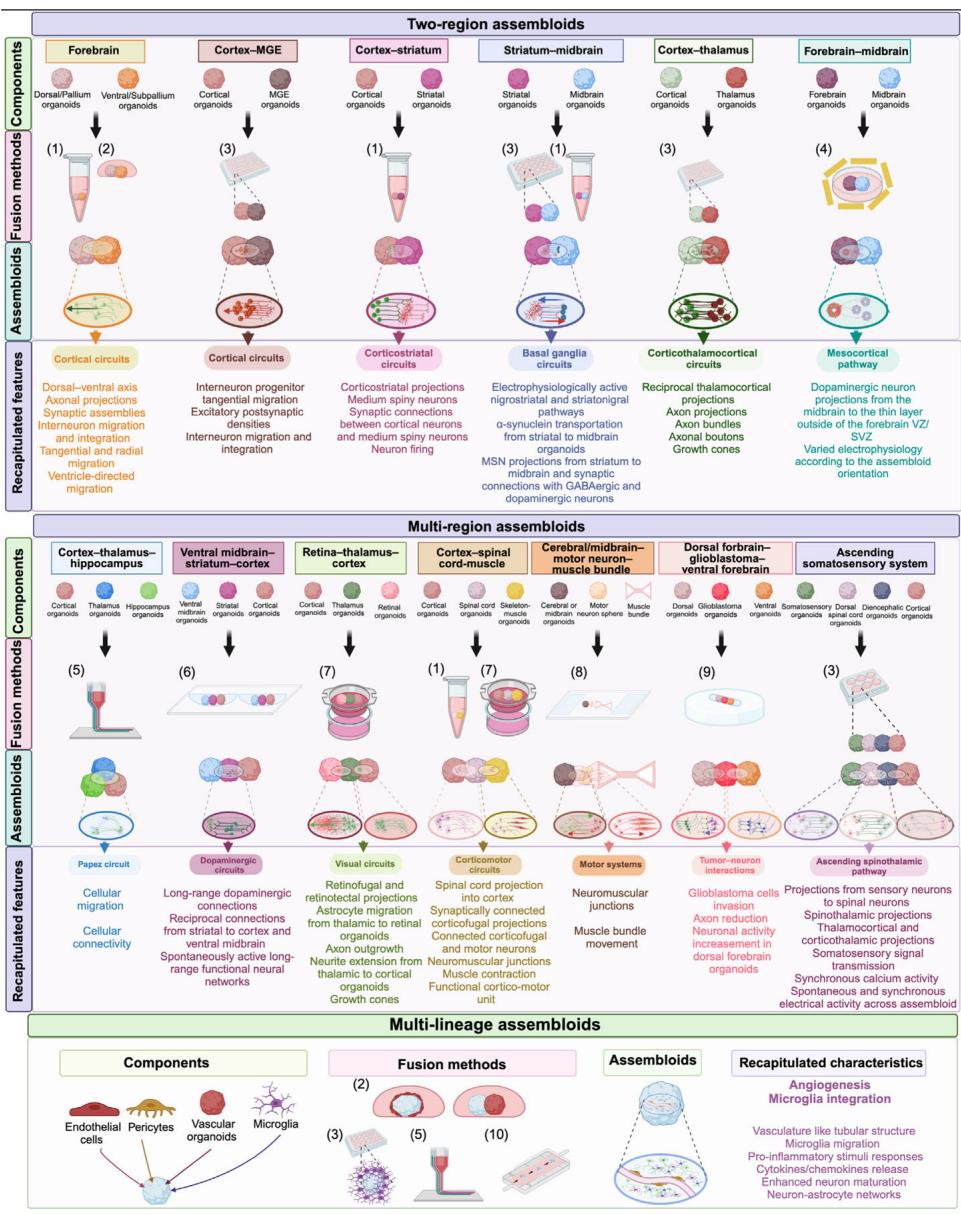
图2. 重现脑区间相互作用及神经环路功能的装配体生成方法。
脑类器官组装体包括多区域组装体和多谱系组装体。多区域组装体可用于重现不同脑区之间的体外相互作用,而多谱系组装体能够将血管结构和微胶质细胞整合到脑类器官中。多区域组装体通过融合单独形成的脑区特异性类器官构建而成,其方法包括:(1) 试管共培养,(2) 基质胶共包埋,(3) 多孔板共培养,(4) 声学装置,(5) 3D生物打印,(6,9) 3D打印包埋模具,(7) Transwell插板,以及(8) 芯片生物混合机器人。多谱系组装体指包含内皮细胞、周细胞和微胶质细胞的脑类器官。这些非神经元谱系来源细胞通过以下方式被整合到脑类器官中:(2) 基质胶共包埋,(3) 多孔板共培养,(5) 3D生物打印,或(10) 微流控装置。缩写:MGE,内侧神经节隆起;MSN,中型多棘神经元;SVZ,脑室下区;VZ,脑室区。图使用BioRender绘制。
¶ 双区域类组装体(Two-region assembloids)
- 组件(Components)
- 前脑(Forebrain):背侧 pallium 类器官、腹侧 subpallium 类器官
- 皮层 - 内侧神经节隆起(Cortex-MGE):皮层类器官、MGE 类器官
- 皮层 - 纹状体(Cortex-striatum):皮层类器官、纹状体类器官
- 纹状体 - 中脑(Striatum-midbrain):纹状体类器官、中脑类器官
- 皮层 - 丘脑(Cortex-thalamus):皮层类器官、丘脑类器官
- 前脑 - 中脑(Forebrain-midbrain):前脑类器官、中脑类器官
- 融合方法(Fusion methods)
- (1)离心管融合
- (2)类器官拼接
- (3)基质胶上共培养
- (4)微流控装置共培养
- 类组装体(Assembloids):各双区域组合形成的融合类器官结构
- 重现特征(Recapitulated features)
- 皮层环路(Cortical circuits):背 - 腹轴形成、轴突投射、突触组装体、中间神经元迁移与整合、靶向视网膜投射、脑室区引导迁移
- 皮层环路(Cortical circuits):中间神经元前体细胞切线迁移、兴奋性突触后致密体、中间神经元迁移与整合
- 皮层 - 纹状体环路(Corticostriatal circuits):皮层 - 纹状体投射、中等多棘神经元与皮层神经元间的突触连接、神经元放电
- 基底节环路(Basal ganglia circuits):电生理活性的黑质 - 纹状体和纹状体 - 黑质通路、α - 突触核蛋白在纹状体类器官中的转运、纹状体到中脑的 MSN 投射以及与 GABA 能和多巴胺能神经元的突触连接
- 皮层 - 丘脑 - 皮层环路(Corticothalamocortical circuits): reciprocal 丘脑 - 皮层投射、轴突束、生长锥、自发活动
- 中皮层通路(Mesocortical pathway):多巴胺能神经元向端脑 VZ 外薄层的投射、根据类组装体方向变化的多样电生理特性
¶ 多区域类组装体(Multi-region assembloids)
- 组件(Components)
- 皮层 - 丘脑 - 海马(Cortex-thalamus-hippocampus):皮层类器官、丘脑类器官、海马类器官
- 腹侧中脑 - 纹状体 - 皮层(Ventral midbrain-striatum-cortex):腹侧中脑类器官、纹状体类器官、皮层类器官
- 视网膜 - 丘脑 - 皮层(Retina-thalamus-cortex):皮层类器官、丘脑类器官、视网膜类器官
- 皮层 - 脊髓 - 肌肉(Cortex-spinal cord-muscle):皮层类器官、脊髓类器官、肌肉类器官
- 大脑 / 中脑 - 运动神经元 - 肌肉束(Cerebral midbrain–motor neuron–muscle bundle):中脑或大脑类器官、运动神经元类器官、肌肉束
- 背侧前脑 - 胶质母细胞瘤 - 腹侧前脑(Dorsal forebrain–glioblastoma–ventral forebrain):背侧类器官、胶质母细胞瘤类器官、腹侧类器官
- 上行躯体感觉系统(Ascending somatosensory system):体感类器官、脊髓类器官、背根神经节类器官、丘脑类器官、皮层类器官
- 融合方法(Fusion methods)
- (1)离心管融合
- (3)基质胶上共培养
- (5)微流控装置共培养
- (6)类器官线性排列共培养
- (7)Transwell 共培养
- (8)肌肉束整合培养
- (9)肿瘤类器官与脑类器官共培养
- 类组装体(Assembloids):各多区域组合形成的融合类器官结构
- 重现特征(Recapitulated features)
- Papez 环路(Papez circuit):细胞迁移、细胞连接性
- 多巴胺能环路(Dopaminergic circuits):长程多巴胺能连接、腹侧中脑与皮层间的 reciprocal 连接、自发的长程功能性神经网络
- 视觉环路(Visual circuits):视网膜 - 丘脑和丘脑 - 视网膜投射、星形胶质细胞从丘脑类器官向视网膜类器官迁移、轴突生长、神经元从丘脑类器官向皮层类器官的神经延伸、生长锥
- 皮层 - 运动环路(Corticomotor circuits):脊髓 - 皮层投射、突触连接的运动神经元、皮层 - 丘脑连接的运动神经元、神经肌肉接头、肌肉束运动、功能性类运动单元
- 运动系统(Motor systems):神经肌肉接头、肌肉束运动
- 肿瘤 - 神经元相互作用(Tumor-neuron interactions):胶质母细胞瘤细胞侵袭、轴突减少、背侧前脑类器官中神经元活性降低
- 上行躯体感觉通路(Ascending somatosensory pathway):感觉神经元到脊髓神经元的投射、脊髓 - 丘脑和皮层 - 丘脑投射、躯体感觉信号传递、类组装体间的同步钙活性、类组装体间自发且同步的电活性
¶ 多谱系类组装体(Multi-lineage assembloids)
- 组件(Components):内皮细胞、周细胞、血管类器官、小胶质细胞
- 融合方法(Fusion methods):
- (2)类器官拼接
- (3)基质胶上共培养
- (5)微流控装置共培养
- (10)其他培养体系
- 类组装体(Assembloids):包含多种谱系细胞的融合类器官结构
- 重现特征(Recapitulated characteristics)
- 血管生成(Angiogenesis)、小胶质细胞整合(Microglia integration)
- 类似管状结构的脉管系统(Vasculature like tubular structure)
- 小胶质细胞迁移(Microglia migration)
- 炎症和病原体反应(Pro-inflammatory and responses to pathogens)
- 细胞因子 / 趋化因子释放(Cytokines/chemokines release)
- 增强的神经元成熟度(Enhanced neuron maturation)
- 神经元 - 星形胶质细胞网络(Neuron-astrocyte networks)
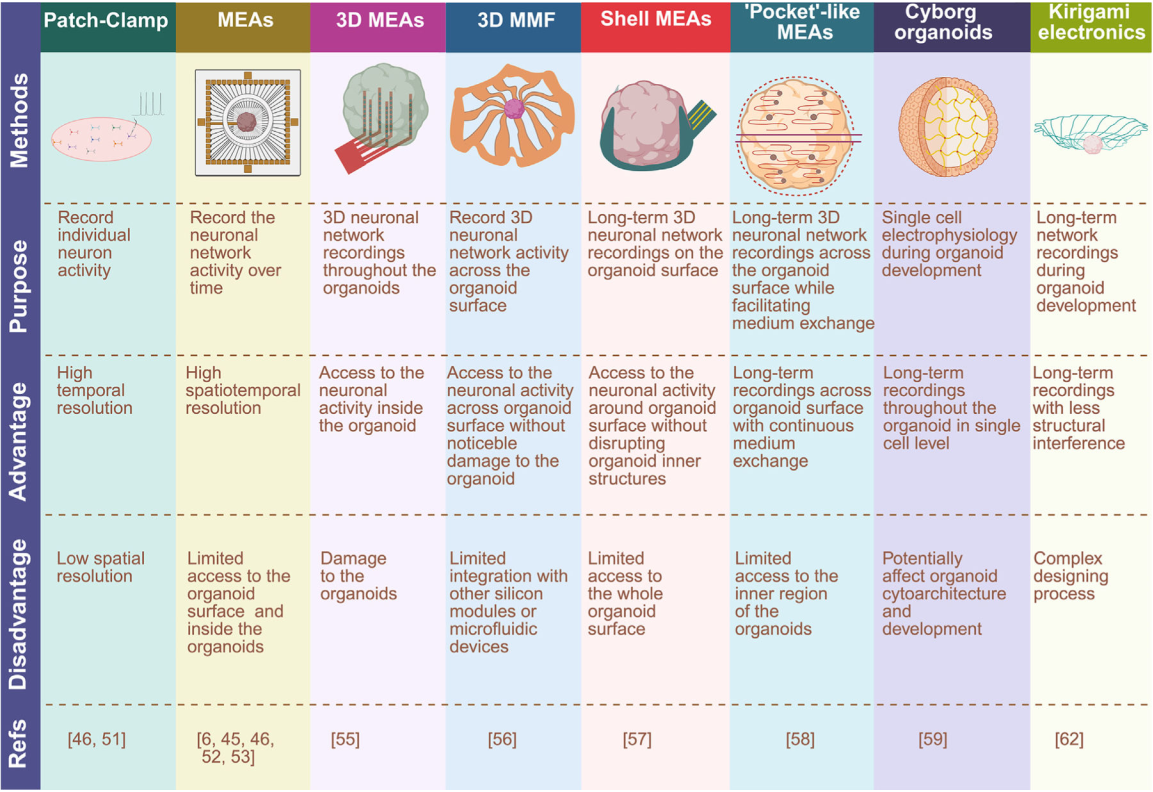
图3. 脑类器官电生理活动测量方法。
从脑类器官获取电生理记录的技术已得到改进,可在不干扰类器官结构的情况下实现长期记录。这些方法包括膜片钳、多电极阵列(MEA)、三维MEA、三维多功能中尺度框架(MMF)、壳式MEA、“口袋”式MEA、赛博格类器官以及剪纸电子技术。本图基于文献[6,45,46,51–53,55–59,62]数据绘制,图使用BioRender制作。
详细分析图片内容
这张图是关于类器官(尤其是神经类器官)电生理记录方法的对比分析,从方法(Methods)、用途(Purpose)、优势(Advantage)、劣势(Disadvantage)和参考文献(Refs)五个维度,对 8 种技术进行了系统梳理:
- 膜片钳(Patch-Clamp)
方法:通过微电极与单个神经元膜形成高阻封接,记录单个神经元的电活动。
用途:记录单个神经元的电活动。
优势:时间分辨率高。
劣势:空间分辨率低。
参考文献:[46, 51] - 微电极阵列(MEAs)
方法:在平面阵列上集成多个微电极,记录神经元网络的电活动。
用途:长时间记录神经元网络的电活动。
优势:时空分辨率高。
劣势:对类器官表面和内部的访问有限。
参考文献:[6, 45, 46, 52, 53] - 三维微电极阵列(3D MEAs)
方法:将微电极集成到三维结构中,用于类器官内部的电活动记录。
用途:在类器官内部进行全维度的神经元网络电活动记录。
优势:可访问类器官内部的神经元电活动。
劣势:会对类器官造成损伤。
参考文献:[55] - 三维微流控纤维(3D MMF)
方法:基于三维微流控纤维结构,记录类器官表面的三维神经元网络电活动。
用途:记录类器官表面的三维神经元网络电活动。
优势:可在不明显破坏类器官内部结构的前提下,访问类器官表面的神经元电活动。
劣势:与其他硅基模块或微流控装置的整合有限。
参考文献:[56] - 壳状微电极阵列(Shell MEAs)
方法:采用壳状结构的微电极阵列,在类器官表面进行长期三维记录,同时便于换液。
用途:在类器官表面进行长期三维神经元网络记录,且便于换液。
优势:可访问类器官表面的神经元电活动,且能持续换液。
劣势:对类器官整个表面的访问有限。
参考文献:[57] - 口袋状微电极阵列(Pocket-like MEAs)
方法:设计成口袋状的微电极阵列,在类器官表面进行长期三维记录。
用途:在类器官表面进行长期三维神经元网络记录。
优势:可在单细胞水平上对类器官表面进行长期记录。
劣势:对类器官内部区域的访问有限。
参考文献:[58] - 半机械人器官(Cyborg organoids)
方法:将类器官与电子元件整合,实现单细胞水平的电生理记录。
用途:在类器官发育过程中进行单细胞电生理记录。
优势:可在单细胞水平上对类器官进行长期全维度记录。
劣势:可能影响类器官的细胞结构和发育。
参考文献:[59] - 剪纸电子学(Kirigami electronics)
方法:基于剪纸工艺的柔性电子结构,用于类器官发育过程中的长期网络记录。
用途:在类器官发育过程中进行长期网络记录。
优势:长期记录时对类器官的结构干扰较小。
劣势:设计过程复杂。
参考文献:[62]
整体意义
这张图系统对比了不同电生理技术在类器官研究中的应用场景、优劣特性,为研究人员根据实验需求(如单神经元 / 网络水平、短期 / 长期记录、类器官内部 / 表面监测等)选择合适的技术提供了清晰的参考框架,也体现了类器官电生理研究中 “技术适配性” 与 “生物学问题针对性” 的紧密关联。
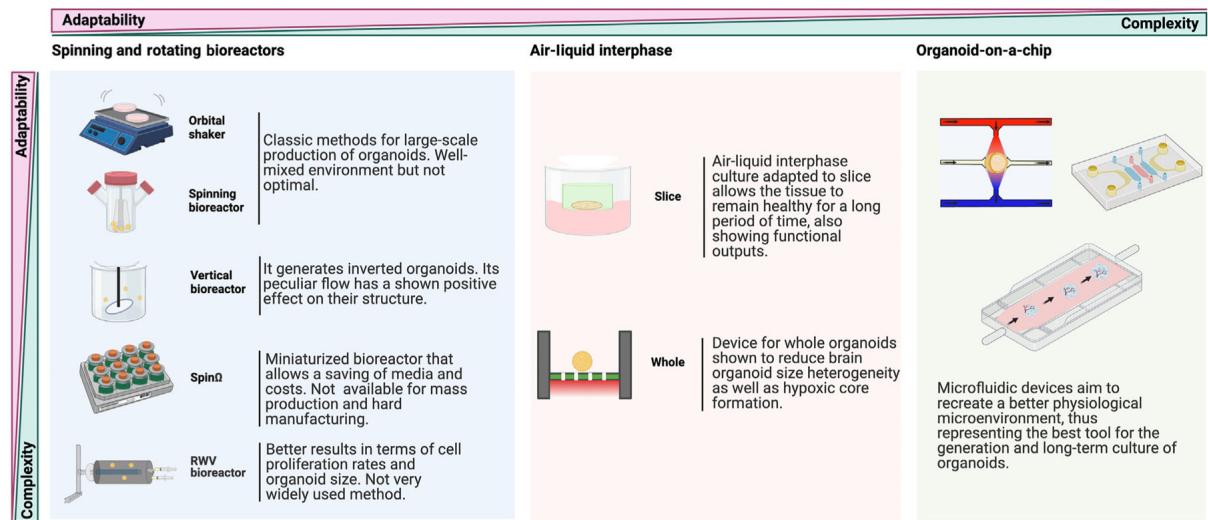
图4. 大脑类器官长期培养方法。
目前已开发出多种培养方法,包括轨道摇床、旋转生物反应器、spinΩ 微型生物反应器、立式生物反应器、旋转壁容器生物反应器,以及应用于切片类器官/完整类器官/芯片类器官模型的气液界面培养技术,以提升脑类器官的长期培养效果。缩写说明:RWV指旋转壁容器。图源BioRender。
这张图从**适应性(Adaptability)和复杂性(Complexity)**两个维度,对类器官的三种培养技术(旋转生物反应器、气液界面培养、类器官芯片)进行了详细对比分析:
¶ 一、旋转和旋转生物反应器(Spinning and rotating bioreactors)
该类技术聚焦于通过机械旋转营造培养环境,涵盖多种设备:
- 轨道摇床(Orbital shaker):是大规模生产类器官的经典方法,能形成混合良好的环境,但并非最优选择。
- 旋转生物反应器(Spinning bioreactor):无额外说明。
- 垂直生物反应器(Vertical bioreactor):可生成倒置类器官,其独特的流体流动对类器官结构有积极影响。
- SpinΩ:是微型化的生物反应器,可节省培养基和成本,但无法用于大规模生产,也难以进行硬质制造。
- 旋转壁式生物反应器(RWV bioreactor):在细胞增殖率和类器官大小方面效果较好,但并非广泛使用的方法。
¶ 二、气液界面培养(Air-liquid interphase)
该技术通过营造气液界面模拟组织微环境,分为两种应用场景:
- 切片(Slice):气液界面培养适配组织切片,可使组织在长时间内保持健康,且能展现功能性输出。
- 整体(Whole):适用于完整类器官的装置,可减少脑类器官大小的异质性以及缺氧核心的形成。
¶ 三、类器官芯片(Organoid-on-a-chip)
基于微流控技术构建,旨在重现更接近生理的微环境:
微流控装置可模拟生理微环境,是类器官生成和长期培养的最佳工具之一。
¶ 维度总结
- 适应性(Adaptability):体现技术对不同实验需求(如规模、培养对象形态)的适配程度,旋转生物反应器在大规模生产上有一定适应性,气液界面适合组织切片和完整类器官的特定维持,类器官芯片则在生理微环境模拟上具优势。
- 复杂性(Complexity):反映技术的操作难度、设备复杂度等,旋转生物反应器相对多样但部分设备操作不简便,气液界面原理相对清晰但装置设计有要求,类器官芯片依赖微流控技术,设计和操作复杂度较高。
整体而言,这张图为研究人员根据类器官培养的规模、功能需求、操作可行性等因素选择合适技术提供了清晰的参考框架。